制备外泌体方法及其药物组合物在组织修复中的应用与流程
1.本发明涉及生物领域,更具体的,涉及制备外泌体方法及其药物组合物在组织修复中的应用。
背景技术:
2.外泌体于1983年首先由harding等在大鼠的网织红细胞中发现,随后在1985年pan等用电镜观察羊网织红细胞向成熟红细胞发育过程中同样发现了这种由细胞分泌的小囊泡,1987年johnstone等将这种小囊泡正式定义为“exosomes”,即外泌体。起初外泌体被认为仅仅是细胞清除的一些不需要的细胞组分,直到2007年valadi等人在外泌体中首次发现microrna和mrna等遗传物质,使得人们对外泌体的组成有了进一步的认识,同时人们也意识到外泌体可能是介导细胞间通讯的一种新机制,因此人们对外泌体的成分、形成机制、作用机制和功能进行了更深入的探索。
3.外泌体是早期内涵体向晚期内涵体/多泡体(multivesicularbody,mvbs)变化过程中由内涵体内陷形成的内囊泡(intraluminalvesicle,ilvs),内囊泡为亚细胞双层膜结构,其膜结构中富含鞘磷脂、胆固醇以及神经酰胺等成分,同时含有少量脂筏等,在外泌体的有些膜结构中还发现了磷脂酰丝氨酸等,而内囊泡形成时将一些特定的胞浆蛋白质、microrna及mrna,甚至包括一些小的可溶性生物因子,如趋化因子、生长因子、转录因子、细胞因子等纳入其中形成直径40
‑
100nm的封闭空间,当晚期内涵体/多泡体与细胞膜融合时,将内嚢泡即外泌体释放到细胞外基质中。因此,外泌体进入靶细胞的途径可以有两种:
①
通过细胞胞呑作用被撮入到细胞内;
②
通过膜融合的方式与靶细胞膜融合,进而直接释放其中含有的物质及信息到目的细胞。由于不同细胞分泌的外泌体所含的蛋白质和遗传物质不同,所以他们行使的生物学功能也有所不同。
4.多种疾病导致组织损伤,如心肌缺血再灌注损伤、脊髓损伤、神经元损伤、急性肾损伤、脑损伤、皮肤黏膜及血管内皮损伤、烧伤导致的皮肤损伤等,一直是高发病率、高死亡率最主要的原因。而治疗效果则不十分满意。如最常规的治疗烧伤的疗法—皮肤移植,其皮肤来源不仅有限,而且容易发生免疫排斥反应。尤其对于面部创伤所导致的一定面积瘢痕组织造成器官移位畸形,会给患者带来巨大的心理伤害。大量的证据表明外泌体外泌体是直径为30~100nm由各种组织细胞分泌的囊泡,来源广泛,基本上存在于所有生物体内。此外,其内含有丰富的mrna、microrna及蛋白质等成分,可以与靶细胞进行信息交流,促进细胞的增殖、迁移或抑制细胞的凋亡,进而达到促进组织损伤修复的目的。
5.脊髓损伤的病理生理学机制是很复杂的,包括细胞凋亡炎性反应、血管损伤、兴奋毒性、流体
‑
解质紊乱、线粒体功能障碍、钙和其他一些过程。其中凋亡和炎性反应是脊髓损伤继发性损伤的主要事件。细胞凋亡主要受上游bcl
‑
2家族和下游caspase家族的调控,其中抗凋亡蛋白bcl
‑
2和促凋亡蛋白bax是细胞凋亡最常见的凋亡标志物。采用尾静脉注射的方式将100μg外泌体总蛋白植入到t10打击模型的脊髓损伤大鼠内,发现mscs
‑
exosomes处理减少了脊髓损伤后大鼠脊髓中tunel阳性细胞的数量。同时,显著抑制促凋亡bax水平,而
抗凋亡bcl
‑
2水平上调。结果表明,mscs
‑
exosomes在脊髓损伤中起着抗细胞凋亡的作用。
6.脊髓损伤后,血脑屏障受到损坏,受伤的脊髓可以迅速被来自血液的嗜中性粒细胞渗透。tnf
‑
α阳性和il
‑
1β阳性细胞在脊髓损伤后脊髓周围区域强烈上调。tnf
‑
α和il
‑
1β是重要的炎性介质,可加强脊髓中的神经细胞死亡。尾静脉注射mscs
‑
exosomes可显著下调促炎性细胞因子(tnf
‑
α和il
‑
1β)蛋白质水平和上调抗炎细胞因子(il
‑
10)蛋白质水平,在脊髓损伤后发挥抗炎作用。天冬氨酸内肽酶抑制剂处理的脊髓损伤小鼠能够改善脊髓损伤的修复。
7.外泌体作为一种新的治疗策略,对于脊髓损伤的治疗展现出了一定的疗效。与移植mscs相比,mscs
‑
exosomes具有体内存活期更长、低致癌性、高传递效率的优势。外泌体不仅可以通过血脑屏障进入中枢神经系统,还可以通过基因修饰,提高治疗效率。虽然目前外泌体对于脊髓损伤治疗的直接报道还比较少,但是种种特征显示外泌体对于脊髓损伤的治疗研究前景很大。因此,研究外泌体用于组织损伤例如脊髓损伤变得尤为迫切。
技术实现要素:
8.本发明的目的在于促进脊髓损伤修复的药物组合物,提供了一种血清提取外泌体的的制备方法,最终实现脊髓损伤功能的恢复。
9.本发明一方面,提供一种血清提取外泌体的方法,所述方法包括如下步骤:
10.取1ml血清,加入19mlpbs,300g,4℃离心10min。取上清转移到新的离心管中,2000g,4℃离心10min;取上清转移至新的离心管,在血清中加入8%peg6000(2x),具体配方为16gpeg6000+5.844gnacl+100ml超纯水配制成8%peg6000(2x)溶液;4℃静置孵育30min后,10000g,4℃离心1h,去除上清,用20mlpbs重悬,100000g,4℃离心70min,底部沉淀即外泌体。
11.本发明另外一方面,提供一种特异性针对天冬氨酸内肽酶的单克隆抗体,所述单克隆抗体为3c7单克隆抗体的序列如下所示。
12.轻链可变区(seq id no:1):
13.divitqrpammaaspgekvtitcrqfnmdkgffwkwyqqksgispkpwiymqcnqeqgvparfsgsgsgtsysltitsmeaedaatyyccrgipwqtcfgagtklelk
14.重链可变区(seq id no:2):
15.evqleesatelsrpgasvklsckasgyifswdkqcwikqrpgqglewigwtrihrflrpknhhlhgkatltadkssstaymqlsslasedsavyycagdkhdqtqwglgttlavss。
16.本发明一方面,提供一种药盒,所述药盒由外泌体、bfgf和单克隆抗体组成;所述药盒能够用于治疗脊髓损伤。其中,所述外泌体是采用如下方法制备获得:取1ml血清,加入19mlpbs,300g,4℃离心10min。取上清转移到新的离心管中,2000g,4℃离心10min;取上清转移至新的离心管,在血清中加入8%peg6000(2x),具体配方为16gpeg6000+5.844gnacl+100ml超纯水配制成8%peg6000(2x)溶液;4℃静置孵育30min后,10000g,4℃离心1h,去除上清,用20mlpbs重悬,100000g,4℃离心70min,底部沉淀即外泌体;
17.所述单克隆抗体是序列如下所示的抗体:
18.轻链可变区(seq id no:1):
19.divitqrpammaaspgekvtitcrqfnmdkgffwkwyqqksgispkpwiymqcnqeqgvparfsgsgsg
tsysltitsmeaedaatyyccrgipwqtcfgagtklelk
20.重链可变区(seq id no:2):
21.evqleesatelsrpgasvklsckasgyifswdkqcwikqrpgqglewigwtrihrflrpknhhlhgkatltadkssstaymqlsslasedsavyycagdkhdqtqwglgttlavss。
22.另外一方面,所述药盒还含有药学上可接受的载体。
23.进一步的,本发明所述的药盒可根据本领域公知的方法制备。用于此目的时,如果需要,可将本发明二种药物成分与一种或多种固体或液体药物赋形剂和/或辅剂结合,制成可作为人药或兽药使用的适当的施用形式或剂量形式。
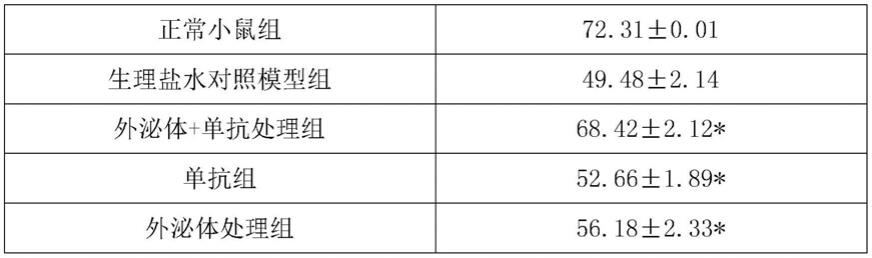
24.本发明的药盒可以单位剂量形式给药,给药途径可为肠道或非肠道,如口服、肌肉、皮下、鼻腔、口腔粘膜、眼、肺、皮肤、阴道、腹膜、直肠等,优选腹腔注射给药。
25.为了将单位给药剂型制成片剂,可以广泛使用本领域公知的各种赋形剂,包括稀释剂、黏合剂、润湿剂、崩解剂、润滑剂、助流剂。稀释剂可以是淀粉、糊精、蔗糖、葡萄糖、乳糖、甘露醇、山梨醇、木糖醇、微晶纤维素、硫酸钙、磷酸氢钙、碳酸钙等;湿润剂可以是水、乙醇、异丙醇等;粘合剂可以是淀粉浆、糊精、糖浆、蜂蜜、葡萄糖溶液、微晶纤维素、阿拉伯胶浆、明胶浆、羧甲基纤维素钠、甲基纤维素、羟丙基甲基纤维素、乙基纤维素、丙烯酸树脂、卡波姆、聚乙烯吡咯烷酮、聚乙二丙醇等;崩解剂可以是干淀粉、微晶纤维素、低取代羟丙基纤维素、交联聚乙烯吡咯烷酮、交联羧甲基纤维素钠、羧甲基淀粉钠、碳酸氢钠与构椽酸、碳酸钙、聚氧乙烯山梨糖醇脂肪酸酯、十二烷基磺酸钠;润滑剂和助流剂可以是滑石粉、二氧化硅、硬脂酸盐、酒石酸、液体石蜡、聚乙二醇等。
26.还可以将片剂进一步制成包衣片,例如糖包衣片、薄膜包衣片、肠溶包衣片,或双层片和多层片。
27.为了将给药单元制成丸剂,可以广泛使用本领域公知的各种载体。关于载体的例子是,例如稀释剂与吸收剂,如葡萄糖、乳糖、淀粉、可可脂、氢化植物油、聚乙烯吡咯烷酮、月桂酸聚乙二醇甘油酯、高岭土、滑石粉等;粘合剂,如阿拉伯胶、黄菩胶、明胶、乙醇、蜂蜜、液糖、米糊或面糊等;崩解剂,如琼脂粉、干燥淀粉、海藻酸盐、十二烷基磺酸钠、甲基纤维素、乙基纤维素等。
28.另外一方面,提供了外泌体、bfgf和单克隆抗体在制备用于脊髓损伤治疗的药盒中的用途。
29.同现有技术相比,本发明的有益效果体现在:
30.本发明提供了制备外泌体的方法以及获得了针对天冬氨酸内肽酶的单克隆抗体,将外泌体、bfgf和抗体联合使用之后,可以有效的用于脊髓损伤的治疗中去,并且效果良好,比单独使用外泌体或者单抗的效果都要显著。具有很好的市场应用价值。
附图说明
31.图1抗体特异性的鉴定结果图
32.图2bbb评分结果图
33.图3联合使用的bbb评分结果图
34.图4caspase
‑
3活性测定结果图
具体实施方式
35.下面结合具体实施例对本发明进行进一步描述,但本发明的保护范围并不仅限于此:下述实施例中所用材料、试剂等,如无特别说明,均可从商业途径获得。
36.实施例1血清外泌体的制备及鉴定
37.取1ml大鼠血清,加入19mlpbs,300g,4℃离心10min。取上清转移到新的离心管中,2000g,4℃离心10min。取上清转移至新的离心管,在血清中加入8%peg6000(2x),具体配方为16gpeg6000+5.844gnacl+100ml超纯水配制成8%peg6000(2x)溶液;,4℃静置孵育30min后,10000g,4℃离心1h。去除上清,用20mlpbs重悬,100000g,4℃离心70min,底部沉淀即外泌体。
38.取少量外泌体裂解并提取其总蛋白,以等样蛋白浓度跑10%丙烯酰胺凝胶电泳,电泳结束后转移至pvdf膜,5%脱脂奶粉封闭2h,4℃孵育hsp70、cd63和tsg101一抗过夜,加入相应二抗室温孵育1h后,于蛋白成像系统中进行曝光成像,拍摄图片。同时取上述外泌体于铜网上,负染后在透射电镜下观察其形态。
39.结果显示,提取到的外泌体中检测到外泌体标记蛋白hsp70、cd63和tsg101的表达,在电镜下可见茶托形结构,粒径在90
±
10nm左右,纯度较高。
40.实施例2天冬氨酸内肽酶单克隆抗体的制备及性能鉴定
41.以重组鼠天冬氨酸内肽酶作为免疫原(货号:jn1806,北京百奥莱博科技有限公司),取80μg/l溶于250μl生理盐水并与等体积弗氏完全佐剂充分乳化,取6周龄的balb/c雌鼠,皮下多点免疫方法,免疫剂量为50μg/只。首次免疫4周后进行第二次免疫,免疫原剂量减半,并用弗氏不完全佐剂乳化。第2次免疫7d,从尾静脉才学,用elisa方法检测血清抗体效价。选择效价最高的小鼠,采用常规细胞融合及筛选方法,最终筛选出1株阳性最强细胞株3c7,采用小鼠体内诱生法制备腹水型抗体;proteing亲和层析柱进行纯化后备用。
42.mab ig类及亚类的鉴定采用sba clonotyping system
‑
hrp试剂盒对筛选的抗体ig类及亚类进行测定,所有操作严格依照试剂盒说明书操作。
43.mab抗体亲和常数的测定非竞争酶免疫实验测定其亲和常数(affinity constant),ka值。参考raghava等的方法,按照公式ka=(n-1)/
44.2(n[ab']t-[ab]t)计算亲和常数ka值。结果如表1所示。
[0045]
表1抗体鉴定结果
[0046]
mab亚型滴度亲和力(l/mol)3c7igg11:2.56
×
1061.07
×
109[0047]
从表1的结果可以看出,3c7单克隆抗体的亚型是igg1,其滴度达到了1:2.56
×
106,亲和力达到1.07
×
109l/mol具有较好的效果。
[0048]
3c7 mab抗体特异性的鉴定:
[0049]
将鼠天冬氨酸内肽酶蛋白、bsa和稀释为1μg/ml,每孔100μl加入酶标板中,4℃孵育过夜。用含0.05%吐温的pbst洗涤3次,每次3min,再用5%的脱脂奶粉于37℃封闭1h,pbst洗涤3次,每次3min。将纯化后抗体从1∶1000开始进行倍比稀释。每孔加入100μl,37℃孵育1h。pbst洗涤3次,每次3min,再加入8000倍稀释的hrp标记的羊抗鼠酶标二抗100μl,37℃孵育40min。pbst洗涤5次,加入tmb单组分显色液,室温避光反应10min后加入50μl浓硫酸终止液终止反应,酶标仪读取od450值,进行结果分析。
[0050]
结果如图1所示。从图1可以看出,3c7 mab抗体特异性好,只与天冬氨酸内肽酶结合,而不与bsa结合。
[0051]
采用本领域通用的抗体序列鉴定方法,获得3c7单克隆抗体的序列如下所示。
[0052]
轻链可变区(seq id no:1):
[0053]
divitqrpammaaspgekvtitcrqfnmdkgffwkwyqqksgispkpwiymqcnqeqgvparfsgsgsgtsysltitsmeaedaatyyccrgipwqtcfgagtklelk
[0054]
重链可变区(seq id no:2):
[0055]
evqleesatelsrpgasvklsckasgyifswdkqcwikqrpgqglewigwtrihrflrpknhhlhgkatltadkssstaymqlsslasedsavyycagdkhdqtqwglgttlavss
[0056]
实施例3动物模型试验
[0057]
(1)动物分组。将c57bl/6小鼠随机分为外泌体处理组、单抗处理组、外泌体+单抗处理组、生理盐水对照组、正常小鼠组,每组10只。(2)小鼠脊髓损伤模型的构建。采用腹腔注射5%戊巴比妥钠麻醉小鼠,背部去毛,将小鼠固定于手术台上。除正常小鼠组以外的小鼠,在外科显微镜下,纵行切开皮肤去除t9椎板,充分暴露t9脊髓节段后采用改造后的动脉夹钳夹脊髓3s造成急性脊髓损伤模型。正常小鼠组只行椎板切除术,未进行脊髓钳夹。逐层缝合肌肉、皮肤,将术后小鼠安置于体温维持垫上苏醒;术后辅助小鼠排尿每日2次,每次排尿后使用碘伏消毒尿道。(3)给药方法。术后苏醒30min给药。
[0058]
外泌体处理组:实施例1制备的外泌体尾静脉注射500μl外泌体(外泌体蛋白浓度为200μg/ml,即外泌体尾静脉移植量为100μg);
[0059]
单抗处理组:3c7单抗10mg/kg腹腔注射给药;
[0060]
外泌体+单抗处理组:实施例1制备的外泌体尾静脉注射500μl外泌体(外泌体蛋白浓度为200μg/ml,即外泌体尾静脉移植量为100μg);同时与3c7单抗10mg/kg一起腹腔注射给药;
[0061]
生理盐水对照模型组:生理盐水10mg/kg腹腔注射给药;
[0062]
正常小鼠组:生理盐水10mg/kg腹腔注射给药;
[0063]
给药均为每日1次,连续7d;生理盐水对照组在每日相同时间点,腹腔注射,连续14d。
[0064]
大鼠的运动能力评估:斜板试验标准按照改良rivlin法进行斜板试验,将不同处理组大鼠身体轴线与斜板纵轴垂直位放置,斜板每次升高5
°
,以大鼠能够停留5s的最大角度为其功能值。结果如表2所示。
[0065][0066]
[0067]
从表2的结果可以看出,2周后,外泌体和单抗协同治疗组的脊髓损伤大鼠保持在斜板上的角度逐渐增大,与损伤组相比差异显著(*p<0.01)、接近正常小鼠组的水平,充分的说明外泌体和单抗联合治疗对脊髓损伤大鼠更具有保护作用。。
[0068]
同时,采用bbb评分标准按照bbb评分法记录不同处理组大鼠的行为。结果如图2所示。
[0069]
从图2的结果显示,bbb运动功能评分与生理盐水对照模型组动物相比,采用单抗和外泌体处理组治疗后的小鼠运动能力明显恢复。此外,此研究发现外泌体联合单抗联合治疗比单独使用外泌体或单抗的效果显著。
[0070]
实施例4协同治疗实验
[0071]
(1)动物分组。将c57bl/6小鼠随机分为外泌体+单抗处理组、生理盐水对照组、正常小鼠组,每组10只。(2)小鼠脊髓损伤模型的构建。采用腹腔注射5%戊巴比妥钠麻醉小鼠,背部去毛,将小鼠固定于手术台上。除正常小鼠组以外的小鼠,在外科显微镜下,纵行切开皮肤去除t9椎板,充分暴露t9脊髓节段后采用改造后的动脉夹钳夹脊髓3s造成急性脊髓损伤模型。正常小鼠组只行椎板切除术,未进行脊髓钳夹。逐层缝合肌肉、皮肤,将术后小鼠安置于体温维持垫上苏醒;术后辅助小鼠排尿每日2次,每次排尿后使用碘伏消毒尿道。(3)给药方法。术后苏醒30min给药。
[0072]
外泌体+单抗+bfgf处理组:实施例1制备的外泌体尾静脉注射500μl外泌体(外泌体蛋白浓度为200μg/ml,即外泌体尾静脉移植量为100μg);同时与3c7单抗10mg/kg、bfgf 80μg/kg一起腹腔注射给药;
[0073]
bfgf组:bfgf 80μg/kg腹腔注射给药;
[0074]
外泌体+单抗处理组:实施例1制备的外泌体尾静脉注射500μl外泌体(外泌体蛋白浓度为200μg/ml,即外泌体尾静脉移植量为100μg);同时与3c7单抗10mg/kg一起腹腔注射给药;
[0075]
生理盐水对照模型组:生理盐水10mg/kg腹腔注射给药;
[0076]
正常小鼠组:生理盐水10mg/kg腹腔注射给药;
[0077]
给药均为每日1次,连续7d;生理盐水对照组在每日相同时间点,腹腔注射,连续14d。
[0078]
大鼠的运动能力评估:斜板试验标准按照改良rivlin法进行斜板试验,将不同处理组大鼠身体轴线与斜板纵轴垂直位放置,斜板每次升高5
°
,以大鼠能够停留5s的最大角度为其功能值。结果如表3所示。
[0079]
各组评分正常小鼠组72.29
±
0.02生理盐水对照模型组49.51
±
2.10外泌体+单抗处理组68.49
±
2.17*bfgf组57.81
±
2.08*外泌体+单抗+bfgf组71.30
±
1.59*
[0080]
从表3的结果可以看出,2周后,bfgf+外泌体和单抗协同治疗组的脊髓损伤大鼠保持在斜板上的角度逐渐增大,与损伤组相比差异显著(*p<0.01),比外泌体和单抗协同治疗组接近正常小鼠组的水平,充分的说明bfgf和外泌体以及单抗联合治疗对脊髓损伤大鼠
更具有保护作用。
[0081]
同时,采用bbb评分标准按照bbb评分法记录不同处理组大鼠的行为。结果如图3所示。
[0082]
从图3的结果显示,bbb运动功能评分与生理盐水对照模型组动物相比,采用bfgf与单抗和外泌体处理组治疗后的小鼠运动能力明显恢复。此外,此研究发现外泌体联合单抗和bfgf联合治疗比单独使用外泌体和单抗的效果显著。
[0083]
评分后,取损伤区的脊髓组织。按照caspase
‑
3活性测定试剂盒说明书进行操作,即每5mg组织加入100μl微升裂解液的比例加入裂解液,在冰浴上用玻璃匀浆器匀浆。然后把匀浆液转移到离心管中,冰浴裂解5min。4℃20000g离心15min。把上清转移到冰浴预冷的离心管中。测定caspase 3的酶活性,结果如图4所示。
[0084]
从图4的caspase 3的活性检测结果显示治疗组与对照模型组相比明显降低。
[0085]
这充分说明,采用bfgf与单抗和外泌体处理对脊髓的神经元损伤有显著的保护作用。
[0086]
应当理解,以上所述的仅是本发明的一些实施方式,应当指出,对于本领域的普通技术人员来说,在不脱离本发明的创造构思的前提下,还可以做出其它变形和改进,这些都属于本发明的保护范围。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1