一种磷脂壳聚糖药物递送系统及其制备方法和用途
1.本发明涉及一种新型磷脂/壳聚糖药物递送系统及其制备方法和用途。
背景技术:
2.磷脂/壳聚糖纳米粒(lecithin/chitosannanoparticles,lcns)是意大利学者f.sonvico等[sonvico f.et al.,int j pharm,2006,324:67
‑
73]在2006年研究发现的一种纳米载体,它是由带负电荷的磷脂和带正电荷的壳聚糖在一定条件下通过电荷相互作用自组装形成的。
[0003]
磷脂/壳聚糖纳米粒凭借其良好的生物相容性、生物可降解性、生物黏附性等优势,近年来受到国内外学者的广泛关注,在医药领域如口服、经皮、黏膜给药系统等以及在食品领域的应用得到深入研究。
[0004]
据sonvico f.et al.报道,磷脂/壳聚糖纳米粒适宜包载亲脂性药物。然而,药物是否适合制成磷脂/壳聚糖纳米粒,与药物的脂溶性并没有必然的联系。某些脂溶性低的药物,也可以制成包封率较高的磷脂/壳聚糖纳米粒,例如,renu chadha等[renu chadha,et al.,journal of microencapsulation,2012,29(8):805
‑
812]制备的氢氯噻嗪的磷脂/壳聚糖纳米粒,包封率达81.8
±
1.7%;marthyna p.souza等[marthyna p.souza,et al.,food&bioprocess technology,2014,7(4):1149
‑
1159]制备的槲皮素的磷脂/壳聚糖纳米粒,包封率达96.13
±
0.44%;而某些脂溶性高的药物,无法获得包封率高的磷脂/壳聚糖纳米粒,例如,esther moreno等[esther moreno,et al.,nanomedicine nanotechnology biology&medicine,2015,11(8):2003
‑
2012]制备的β
‑
拉帕醌的磷脂/壳聚糖纳米粒,包封率仅52.4
±
2.4%。特别是一些带有氨基、羟基、羰基、羧基、酰胺基、酯基等极性基团的药物,可能出现包封率低,药物泄露、粒径、zeta电位等方面的变化而不稳定的现象,例如,r.s.bhatta等[r.s.bhatta,et al.,international journal of pharmaceutics,2012,432(1
–
2):105
‑
112]制备了那他霉素(带羟基、氨基、羧基、酯基)的磷脂/壳聚糖纳米粒,包封率为73.57
±
0.62%,在4℃条件下储存60天时,包封率显著降低,那他霉素泄露严重。
[0005]
纳米粒制剂的包封率和稳定性对于药物的安全性、有效性和质量控制十分重要,尤其对安全窗窄、不良反应多的药物更需严格控制。
技术实现要素:
[0006]
本发明的第一个方面是提供一种磷脂/壳聚糖药物递送系统,其特征在于,所述磷脂/壳聚糖药物递送系统包括药物脂质复合物、磷脂和壳聚糖;所述药物脂质复合物由药物与脂质材料复合而成;其中,当所述药物脂质复合物的脂质材料包括磷脂时,所述磷脂/壳聚糖药物递送系统所包括的磷脂为来自药物脂质复合物中的磷脂和/或来自药物脂质复合物以外的磷脂;所述药物脂质复合物中的药物不包括胰岛素。
[0007]
所述药物为能够形成药物脂质复合物的任何药物;可选地,所述药物为具有极性基团的药物;可选地,所述药物包括含有氨基、羟基、羰基、羧基、酰胺基、酯基等中至少一种
极性基团的药物;可选地,所述药物包括黄酮多酚类、萜类、生物碱类、蛋白多肽类、白藜芦醇、靛玉红、他莫昔芬、黄体酮中的至少一种;可选地,所述黄酮多酚类包括黄酮类、黄烷类、黄酮醇类、花色素类、双苯吡酮类、酚酸类、苯丙烷类、酚酮类、木质素类、香豆素类、黑色素类及单宁类中的至少一种;可选地,所述药物包括黄芩苷、黄芩素、汉黄芩素、紫杉醇、三七总皂苷、人参总皂苷、姜黄素、葛根素、阿魏酸、绿原酸、花青素、槲皮素、水飞蓟素、儿茶素、厚扑酚、和厚扑酚、丹酚酸、粉防己碱、胡椒碱、小白菊内酯、芹菜素、大黄素、苦参碱、补骨脂素、千金藤素、盐酸小檗碱、喜树碱、白藜芦醇、靛玉红、他莫昔芬、黄体酮中的至少一种;可选地,所述药物包括黄芩素、汉黄芩素、紫杉醇、姜黄素、槲皮素、葛根素、绿原酸、花青素、厚扑酚、和厚扑酚、丹酚酸、芹菜素、大黄素、苦参碱、补骨脂素、黄体酮中的至少一种。
[0008]
所述脂质材料包括天然脂质材料、合成脂质材料中的至少一种;可选地,所述脂质材料为选自磷脂类、类固醇类、胆酸类及其盐类、甘油酯类及脂肪酸类中的至少一种;可选地,所述脂质材料为磷脂类或类固醇类中的至少一种;可选地,所述脂质材料为选自卵磷脂、豆磷脂、胆甾醇中的至少一种;可选地,所述脂质材料为选自大豆磷脂、蛋黄磷脂、胆固醇中的至少一种;可选地,所述脂质材料为选自磷脂酰甘油酯、二硬脂酰磷脂酰胆碱、二棕榈酰磷脂酰胆碱、二棕榈酰磷脂酰乙醇胺、二肉蔻酰磷脂酰胆碱、神经酰胺中的至少一种。
[0009]
所述的磷脂为选自天然磷脂、合成磷脂中的至少一种;可选地,所述天然磷脂为卵磷脂和/或豆磷脂;可选地,所述合成磷脂为磷脂酰甘油酯、二硬脂酰磷脂酰胆碱、二棕榈酰磷脂酰胆碱、二棕榈酰磷脂酰乙醇胺、二肉蔻酰磷脂酰胆碱、神经酰胺的至少一种;可选地,所述的磷脂选自大豆磷脂、蛋黄磷脂、二棕榈酰磷脂酰胆碱、磷脂酰甘油酯、二肉蔻酰磷脂酰胆碱中的至少一种。
[0010]
可选地,所述磷脂/壳聚糖药物递送系统中壳聚糖类材料为具有壳聚糖主体结构的材料;可选地为壳聚糖;可选地,所述的壳聚糖为选自高粘度壳聚糖(粘度为800~2000cp)、中粘度壳聚糖(粘度为200~800cp)、低粘度壳聚糖(粘度为20~200cp)中的至少一种;可选地,所述壳聚糖为中粘度壳聚糖和/或低粘度壳聚糖。
[0011]
所述壳聚糖的粘度的测试条件是:在25℃条件下,浓度为1wt.%壳聚糖的1%醋酸水溶液,brookfield粘度计测得。
[0012]
可选地,所述药物脂质复合物中药物和脂质的摩尔比为4:1~1:20,可选为4:1~1:10。
[0013]
可选地,壳聚糖和磷脂的质量比为1:5~1:50,可选为1:5~1:40。
[0014]
可选地,所述磷脂/壳聚糖药物递送系统的粒径为20~5000nm,可选地,所述粒径为20~3000nm。
[0015]
可选地,所述药物脂质复合物的复合率在50%以上,可选地,在70%以上,或可选地,在80%以上。
[0016]
可选地,所述磷脂/壳聚糖药物递送系统包含表面活性剂;可选地,所述表面活性剂为选自阴离子型表面活性剂、两性离子型表面活性剂和非离子型表面活性剂中的至少一种;可选地,所述非离子型表面活性剂为选自脂肪酸山梨坦、聚山梨酯、聚氧乙烯脂肪酸酯、聚氧乙烯脂肪醇醚、聚氧乙烯
‑
聚氧丙烯共聚物、聚乙二醇甘油酯类、水溶性维生素e类中的至少一种;可选地,所述表面活性剂选自聚山梨酯
‑
80(吐温
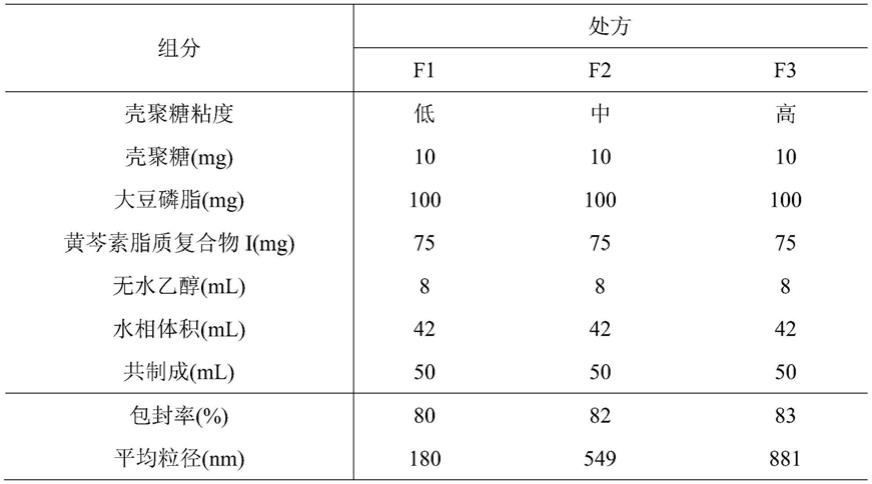
‑
80)、泊洛沙姆、聚氧乙烯蓖麻油、维生素e聚乙二醇琥珀酸酯中的至少一种。
[0017]
本发明的第二个方面提供制备上述的磷脂/壳聚糖药物递送系统的方法,其特征在于,包括如下步骤:将壳聚糖溶于水溶液中制得水相,将药物脂质复合物和任选的磷脂溶于有机溶剂中制得有机相,将有机相注入到水相中制得所述磷脂/壳聚糖药物递送系统。
[0018]
可选地,所述水溶液为任何药学上可接受的酸的水溶液;可选地,所述水溶液为选自醋酸、盐酸、乳酸中的至少一种的水溶液;可选地,所述水溶液中酸的浓度为0.5~2.5%(v/v)。
[0019]
可选地,所述有机溶剂为选自醇类、醚类、酮类、酯类、烷烃类、卤代烷烃类、酰胺类、四氢呋喃、dmso中的至少一种。
[0020]
可选地,所述有机溶剂为选自甲醇、乙醇、正丙醇、异丙醇、正丁醇、异丁醇、叔丁醇、乙醚、甲基乙基醚、二氧六环、丙酮、丁酮、乙酸乙酯、石油醚、己烷、环己烷、二氯甲烷、氯仿、四氯化碳、四氢呋喃、dmso、dmf中的至少一种。
[0021]
可选地,所述有机溶剂为选自无水甲醇、无水乙醇、乙醚、四氢呋喃、dmso中的至少一种。
[0022]
可选地,所述水相中壳聚糖的浓度为0.05~5.0mg/ml。
[0023]
可选地,将有机相在搅拌条件下注入到水相中进行搅拌,所述搅拌的时间为10~300min,搅拌速率为300~5000rpm/min;或者为500~2000rpm/min。
[0024]
可选地,所述注入时的水相和有机相的温度各自独立地为0~50℃。
[0025]
可选地,所述方法还包括将所述磷脂/壳聚糖药物递送系统中的有机溶剂和/或水除去的步骤。
[0026]
可选地,所述药物脂质复合物的制备方法包括:将药物、脂质材料、制备药物脂质复合物用有机溶剂混合,去除有机溶剂,制得药物脂质复合物。
[0027]
可选地,所述的制备药物脂质复合物所采用的有机溶剂选自醇类、醚类、酮类、酯类、烷烃类、卤代烷烃类、芳香烃类、酰胺类、四氢呋喃、dmso中的至少一种。
[0028]
可选地,所述的制备药物脂质复合物所采用的有机溶剂为选自甲醇、乙醇、正丙醇、异丙醇、正丁醇、异丁醇、叔丁醇、乙醚、甲基乙基醚、二氧六环、丙酮、丁酮、乙酸乙酯、石油醚、己烷、环己烷、二氯甲烷、氯仿、四氯化碳、四氢呋喃、dmso、dmf中的至少一种。
[0029]
可选地,所述的磷脂/壳聚糖药物递送系统的zeta电位绝对值在15mv以上,可选为20mv以上。
[0030]
本发明的第三个方面提供一种药物组合物,包括所述的磷脂/壳聚糖药物递送系统以及任选的药学上可接受的辅料。
[0031]
可选地,所述药物组合物的剂型为注射剂、口服制剂、经皮给药制剂、粘膜给药制剂、肺部吸入制剂、眼部给药制剂、鼻腔给药制剂;可选的,所述药物组合物的剂型为片剂、胶囊剂、颗粒剂、膜剂、凝胶剂、散剂、乳剂、滴丸剂、栓剂、气雾剂、喷雾剂、粉雾剂、贴剂、贴膏剂、溶液剂、混悬剂、软膏剂、乳膏剂。
[0032]
可选的,所述药物组合物用于抗菌、抗病毒、抗炎、抑制变态反应、调节免疫、抗氧化、抗衰老、抗紫外辐射、抗肿瘤、治疗激素缺乏、抗高血压、降血脂、抗动脉粥样硬化、治疗手足口病、抗骨质疏松、保护肝脏等。
[0033]
本发明的第四个方面提供上述的磷脂/壳聚糖药物递送系统在制备抗菌、抗病毒、抗炎、抑制变态反应、调节免疫、抗氧化、抗衰老、抗紫外辐射、抗肿瘤、治疗激素缺乏、抗高
血压、降血脂、抗动脉粥样硬化、治疗手足口病、抗骨质疏松、保护肝脏的药物中的用途。
[0034]
本发明的第五个方面是提供上述磷脂/壳聚糖药物递送系统在抗菌、抗病毒、抗炎、抑制变态反应、调节免疫、抗氧化、抗衰老、抗紫外辐射、抗肿瘤、治疗激素缺乏、抗高血压、降血脂、抗动脉粥样硬化、治疗手足口病、抗骨质疏松、保护肝脏等中的用途。
[0035]
根据一方面的具体实施方式,通过以药物脂质复合物为中间载体,所得磷脂/壳聚糖递送系统提高了药物的包封率。根据另一方面的具体实施方式,所得磷脂/壳聚糖递送系统提高了磷脂/壳聚糖药物递送系统的稳定性,减少了药物渗漏。不受约束于该理论,发明人认为,药物与脂质材料形成复合物后,药物所含有的极性基团被掩蔽,有利于制备得到包封率高且稳定的磷脂/壳聚糖药物递送系统。
具体实施例
[0036]
以下对本发明的具体实施方式进行详细说明。应当理解的是,此处所描述的具体实施方式仅用于示例性地对本发明进行说明,并不用于限制本发明。
[0037]
以下实施例和对比例制备的磷脂/壳聚糖药物递送系统的包封率的测定方法:
[0038]
一、微柱离心法
[0039]
1)总药量的测定:
[0040]
精密称取药物对照品25mg,用无水乙醇溶解并稀释至100μg
·
ml
‑1,作为对照品溶液;精密量取1ml药物递送系统至10ml容量瓶中,加入8ml无水乙醇,超声,冷却至室温,再定容至刻度,摇匀,作为供试品溶液1。
[0041]
采用高效液相色谱法分别测定对照品溶液和供试品溶液1,记录色谱图和峰面积,按照外标法计算药物递送系统的总药量。
[0042]
2)包载药量的测定:
[0043]
将葡聚糖凝胶g50填入5ml注射器,制成柱高与5ml刻度线相平的凝胶微柱。
[0044]
精密量取0.2ml药物递送系统并加至微柱顶端,500rpm离心1min,使药物递送系统进入柱内。加入0.5ml蒸馏水洗脱,1000rpm离心1min,收集洗脱液;反复洗脱2次,使游离药物与药物递送系统充分分离;合并收集前三份洗脱液,转移至10ml容量瓶中,加入8ml无水乙醇,超声,冷却至室温,再定容至刻度,摇匀,作为供试品溶液2。按照上述高效液相色谱法测定供试品溶液2,计算药物递送系统的包载药量。
[0045]
以公式计算包封率
[0046]
二、超滤离心法
[0047]
1)总药量的测定:
[0048]
精密称取药物对照品25mg,用无水乙醇溶解并稀释至100μg
·
ml
‑1,作为对照品溶液;精密量取1ml药物递送系统至10ml容量瓶中,加入8ml无水乙醇,超声,冷却至室温,再定容至刻度,摇匀,作为供试品溶液1。
[0049]
采用高效液相色谱法分别测定对照品溶液和供试品溶液1,记录色谱图和峰面积,按照外标法计算药物递送系统的总药量。
[0050]
2)游离药物量的测定:
[0051]
精密量取2ml药物递送系统,置于超滤离心管中,以14000rpm离心30min,将游离药
物与药物递送系统充分分离。取超滤液10μl,直接注入高效液相色谱仪进样分析,按照上述高效液相色谱法测定,计算游离药物量。
[0052]
以公式计算包封率
[0053]
实施例1
[0054]
1、黄芩素脂质复合物的制备
[0055]
(1)制备黄芩素脂质复合物i(黄芩素:大豆磷脂(w/w)=1:3.5)
[0056]
取黄芩素1g,大豆磷脂3.5g,加入四氢呋喃40ml,40℃复合1小时后,旋转蒸发去除溶剂,经真空干燥12小时以上(20
‑
30℃),即得黄芩素脂质复合物i,密闭包装,放入冰箱冷藏保存。
[0057]
(2)制备黄芩素脂质复合物ii(黄芩素:大豆磷脂(w/w)=1:6)
[0058]
取黄芩素0.5g,大豆磷脂3.0g,加入乙酸乙酯40ml,40℃复合1小时后,旋转蒸发去除溶剂,经真空干燥12小时以上(20
‑
30℃),即得黄芩素脂质复合物ii,密闭包装,放入冰箱冷藏保存。
[0059]
2、黄芩素脂质复合物i
‑
磷脂/壳聚糖药物递送系统的制备
[0060]
(1)分别将低、中、高粘度壳聚糖溶解于1%(v/v)醋酸水溶液,配制10mg/ml的壳聚糖溶液,按照表1的处方,取该壳聚糖溶液与2g泊洛沙姆
‑
407,加入蒸馏水溶解稀释,得到水相,称取大豆磷脂和上述黄芩素脂质复合物i,溶于无水乙醇中,得到有机相。在搅拌条件下将有机相注入水相中,继续搅拌0.5小时,得到黄芩素脂质复合物i
‑
磷脂/壳聚糖药物递送系统。采用微柱离心法测定药物递送系统包封率。
[0061]
表1
[0062][0063]
(2)将低粘度壳聚糖溶解于1%(v/v)醋酸水溶液,配制10mg/ml的壳聚糖溶液,按照表2的处方,取该壳聚糖溶液与2g吐温
‑
80,加入蒸馏水溶解稀释,得到水相,称取大豆磷脂和上述黄芩素脂质复合物i,溶于无水乙醇中,得到有机相。在搅拌条件下将有机相注入水相中,继续搅拌0.5小时,得到黄芩素脂质复合物i
‑
磷脂/壳聚糖药物递送系统。采用微柱离心法测定药物递送系统包封率。
[0064]
表2
[0065][0066]
3、黄芩素脂质复合物ii
‑
磷脂/壳聚糖药物递送系统的制备
[0067]
采用与上述2中(2)相同的方法,采用黄芩素脂质复合物ii,以按表3处方,制备得到黄芩素脂质复合物ii
‑
磷脂/壳聚糖药物递送系统。采用微柱离心法测定药物递送系统包封率。
[0068]
表3
[0069][0070]
以上结果表明,本发明实施例的黄芩素脂质复合物
‑
磷脂/壳聚糖药物递送系统的包封率高。
[0071]
实施例2
[0072]
1、紫杉醇脂质复合物的制备
[0073]
(1)制备紫杉醇脂质复合物i(紫杉醇:蛋黄磷脂(w/w)=1:6)
[0074]
取紫杉醇0.5g,蛋黄磷脂3.0g,加入四氢呋喃100ml,40℃复合1小时后,旋转蒸发去除溶剂,经真空干燥12小时以上(20
‑
30℃),即得紫杉醇脂质复合物i,密闭包装,放入冰箱冷藏保存。
[0075]
(2)制备紫杉醇脂质复合物ii(紫杉醇:胆固醇(w/w)=1:2)
[0076]
取紫杉醇0.5g,胆固醇1.0g,加入预热至40℃的丙酮200ml,40℃复合2小时后,旋转蒸发去除溶剂,经真空干燥12小时以上(20
‑
30℃),即得紫杉醇脂质复合物ii,密闭包装,
放入冰箱冷藏保存。
[0077]
2、紫杉醇脂质复合物ii
‑
磷脂/壳聚糖药物递送系统的制备
[0078]
(1)将低粘度壳聚糖溶解于1%(v/v)醋酸水溶液,配制10mg/ml的壳聚糖溶液,按照表4的处方,取该壳聚糖溶液和2g聚氧乙烯蓖麻油,加入蒸馏水溶解并稀释,得到水相,称取大豆磷脂和上述紫杉醇脂质复合物ⅱ,溶于无水乙醇中,得到有机相。在搅拌条件下将有机相注入水相中,继续搅拌0.5小时,得到紫杉醇脂质复合物ii
‑
磷脂/壳聚糖药物递送系统。采用微柱离心法测定药物递送系统包封率。
[0079]
表4
[0080][0081]
(2)采用与上述2中(1)相同的方法,按表5处方,制备得到紫杉醇脂质复合物ii
‑
磷脂/壳聚糖药物递送系统。采用微柱离心法测定药物递送系统包封率。
[0082]
表5
[0083][0084]
3、紫杉醇脂质复合物i
‑
磷脂/壳聚糖药物递送系统的制备
[0085]
采用与上述2中(1)相同的方法,采用紫杉醇脂质复合物i,按表6处方,制备得到紫杉醇脂质复合物i
‑
磷脂/壳聚糖药物递送系统。采用微柱离心法测定药物递送系统包封率。
[0086]
表6
[0087][0088]
以上结果表明,本发明实施例的紫杉醇脂质复合物
‑
磷脂/壳聚糖药物递送系统的包封率高。
[0089]
实施例3
[0090]
1、绿原酸脂质复合物的制备
[0091]
(1)制备绿原酸脂质复合物i(绿原酸:大豆磷脂(w/w)=1:2.5)
[0092]
取绿原酸0.5g,大豆磷脂1.25g,加入无水乙醇50ml,40℃复合30min后,旋转蒸发去除溶剂,经真空干燥12小时以上(20
‑
30℃),即得绿原酸脂质复合物i,密闭包装,放入冰箱冷藏保存。
[0093]
(2)制备绿原酸脂质复合物ii(绿原酸:二硬脂酰磷脂酰胆碱(w/w)=1:2.2)
[0094]
取绿原酸1g,二硬脂酰磷脂酰胆碱2.2g,加入无水乙醇50ml,40℃复合30min后,旋转蒸发去除溶剂,经真空干燥12小时以上(20
‑
30℃),即得绿原酸脂质复合物ii,密闭包装,放入冰箱冷藏保存。
[0095]
2、绿原酸脂质复合物i
‑
磷脂/壳聚糖药物递送系统的制备
[0096]
(1)将低粘度壳聚糖溶解于1%(v/v)醋酸水溶液,配制10mg/ml的壳聚糖溶液,按照下表7,取该壳聚糖溶液,加入蒸馏水溶解并稀释,得到水相,称取蛋黄磷脂和上述绿原酸脂质复合物i适量,溶于无水乙醇中,得到有机相。在搅拌条件下将有机相注入水相中,继续搅拌0.5小时,得到绿原酸脂质复合物i
‑
磷脂/壳聚糖药物递送系统。采用超滤离心法测定药物递送系统包封率。
[0097]
表7
[0098][0099]
(2)采用与上述2中(1)相同的方法,按表8处方,制备得到绿原酸脂质复合物i
‑
磷脂/壳聚糖药物递送系统。采用超滤离心法测定药物递送系统包封率。
[0100]
表8
[0101][0102]
3、绿原酸脂质复合物ii
‑
磷脂/壳聚糖药物递送系统的制备
[0103]
将低粘度壳聚糖溶解于1%(v/v)醋酸水溶液,配制10mg/ml的壳聚糖溶液,按照下表9,取该壳聚糖溶液,加入0.5g维生素e琥珀酸酯并加蒸馏水溶解并稀释,得到水相,称取二肉蔻酰磷脂酰胆碱和上述绿原酸脂质复合物ii适量,溶于无水乙醇中,得到有机相。在搅拌条件下将有机相注入水相中,继续搅拌0.5小时,得到绿原酸脂质复合物ii
‑
磷脂/壳聚糖药物递送系统。采用超滤离心法测定药物递送系统包封率。
[0104]
表9
[0105][0106]
以上结果表明,本发明实施例的绿原酸脂质复合物
‑
磷脂/壳聚糖药物递送系统的包封率高。
[0107]
实施例4
[0108]
1、黄体酮脂质复合物的制备(黄体酮:大豆磷脂(w/w)=1:9)
[0109]
取黄体酮0.5g,大豆磷脂4.5g,加入乙醚100ml,40℃复合1小时后,旋转蒸发去除溶剂,经真空干燥12小时以上(20
‑
30℃),即得黄体酮脂质复合物,密闭包装,放入冰箱冷藏保存。
[0110]
2、黄体酮脂质复合物
‑
磷脂/壳聚糖药物递送系统的制备
[0111]
(1)将低粘度壳聚糖溶解于1%(v/v)醋酸水溶液,配制10mg/ml的壳聚糖溶液,按照下表10,取该壳聚糖溶液,加入蒸馏水溶解稀释,得到水相,称取大豆磷脂和上述黄体酮脂质复合物,溶于无水乙醇中,得到有机相。在搅拌条件下将有机相注入水相中,继续搅拌0.5小时,得到黄体酮脂质复合物
‑
磷脂/壳聚糖药物递送系统。采用微柱离心法测定药物递送系统包封率。
[0112]
表10
[0113][0114][0115]
以上结果表明,本发明实施例的黄体酮脂质复合物
‑
磷脂/壳聚糖药物递送系统的包封率高。
[0116]
对比例1
[0117]
黄芩素
‑
磷脂/壳聚糖药物递送系统的制备
[0118]
将低粘度壳聚糖溶解于1%(v/v)醋酸水溶液,配制10mg/ml的壳聚糖溶液,按照下表11的处方,取1ml该壳聚糖溶液与2g吐温
‑
80,加入蒸馏水溶解稀释,得到水相,称取大豆磷脂和黄芩素,溶于无水乙醇中,得到有机相。在搅拌条件下将有机相注入水相中,继续搅拌0.5小时,得到黄芩素
‑
磷脂/壳聚糖药物递送系统。采用微柱离心法测定药物递送系统包封率。
[0119]
表11
[0120][0121]
结果发现,黄芩素
‑
磷脂/壳聚糖药物递送系统中药物迅速析出,药物无法包进载体,故未测定包封率。
[0122]
对比例2
[0123]
紫杉醇
‑
磷脂/壳聚糖药物递送系统的制备
[0124]
将低粘度壳聚糖溶解于1%(v/v)醋酸水溶液,配制10mg/ml的壳聚糖溶液,按照下表12的处方,取该壳聚糖溶液和2g聚氧乙烯蓖麻油,加入蒸馏水溶解并稀释,得到水相,称取大豆磷脂和紫杉醇,溶于无水乙醇中,得到有机相,在搅拌条件下将有机相注入水相中,继续搅拌0.5小时,得到紫杉醇
‑
磷脂/壳聚糖药物递送系统。采用微柱离心法测定药物递送系统包封率。
[0125]
表12
[0126][0127]
结果发现,紫杉醇
‑
磷脂/壳聚糖药物递送系统中药物迅速析出,药物无法包进载体,故未测定包封率
[0128]
对比例3
[0129]
绿原酸
‑
磷脂/壳聚糖药物递送系统的制备
[0130]
将低粘度壳聚糖溶解于1%(v/v)醋酸水溶液,配制10mg/ml的壳聚糖溶液,按照下表13的处方,取该壳聚糖溶液,加入蒸馏水溶解并稀释,得到水相,称取蛋黄磷脂和绿原酸,溶于无水乙醇中,得到有机相,在搅拌条件下将有机相注入水相中,继续搅拌0.5小时,得到绿原酸
‑
磷脂/壳聚糖药物递送系统。采用超滤离心法测定药物递送系统包封率。
[0131]
表13
[0132][0133][0134]
对比例4
[0135]
黄体酮
‑
磷脂/壳聚糖药物递送系统的制备
[0136]
将低粘度壳聚糖溶解于1%(v/v)醋酸水溶液,配制10mg/ml的壳聚糖溶液,按照下表14的处方,取该壳聚糖溶液,加入蒸馏水溶解稀释,得到水相,称取大豆磷脂和黄体酮,溶于无水乙醇中,得到有机相,在搅拌条件下将有机相注入水相中,继续搅拌0.5小时,得到黄体酮
‑
磷脂/壳聚糖药物递送系统。采用微柱离心法测定药物递送系统包封率。
[0137]
表14
[0138][0139]
综上,由实施例1和对比例1、实施例2和对比例2、实施例3和对比例3、实施例4和对比例4结果可知,本发明实施例中通过将药物制备成药物脂质复合物,采用药物脂质复合物制备磷脂/壳聚糖药物递送系统,显著提高了药物的包封率。
[0140]
实验例5
[0141]
磷脂/壳聚糖药物递送系统稳定性的考察
[0142]
1、黄芩素脂质复合物
‑
磷脂/壳聚糖药物递送系统的稳定性
[0143]
将实施例1处方f5制备的黄芩素脂质复合物i
‑
磷脂/壳聚糖药物递送系统溶液储存于冷藏条件(4℃),分别于0个月、1个月、3个月考察药物递送系统的外观、粒径、zeta电位、含量及包封率,结果见表15。
[0144]
表15
[0145]
指标0个月1个月3个月外观淡黄色澄明溶液淡黄色澄明溶液淡黄色澄明溶液平均粒径(nm)170~185nm170~185nm170~185nmzeta电位(mv)33~3633~3633~36含量(%)100%102%100%包封率(%)83%82%82%
[0146]
2、紫杉醇脂质复合物
‑
磷脂/壳聚糖药物递送系统的稳定性
[0147]
将实施例2处方f18制备的紫杉醇脂质复合物i
‑
磷脂/壳聚糖药物递送系统溶液储存于冷藏条件(4℃),分别于0个月、1个月、3个月考察递送系统的外观、粒径、zeta电位、含量及包封率,结果见表16。
[0148]
表16
[0149]
指标0个月1个月3个月外观澄明溶液澄明溶液澄明溶液平均粒径(nm)200~215nm200~215nm200~215nmzeta电位(mv)40~4540~4540~45含量(%)100%100%103%包封率(%)92%91%92%
[0150]
3、绿原酸脂质复合物
‑
磷脂/壳聚糖药物递送系统的稳定性
[0151]
将实施例3处方f34制备的绿原酸脂质复合物i
‑
磷脂/壳聚糖药物递送系统溶液储存于冷藏条件(4℃),分别于0个月、1个月、3个月考察递送系统的外观、粒径、zeta电位、含量及包封率,结果见表17。
[0152]
表17
[0153]
指标0个月1个月3个月外观澄明溶液澄明溶液澄明溶液平均粒径(nm)150~180nm150~180nm150~180nmzeta电位(mv)39~4339~4339~43含量(%)100%98%102%包封率(%)93%94%94%
[0154]
4、黄体酮脂质复合物
‑
磷脂/壳聚糖药物递送系统的稳定性
[0155]
将实施例4处方f37制备的黄体酮脂质复合物i
‑
磷脂/壳聚糖药物递送系统溶液储存于冷藏条件(4℃),分别于0个月、1个月、3个月考察递送系统的外观、粒径、zeta电位、含量及包封率,结果见表18。
[0156]
表18
[0157]
指标0个月1个月3个月外观澄明溶液澄明溶液澄明溶液平均粒径(nm)170~185nm170~185nm170~185nmzeta电位(mv)32~3532~3632~36含量(%)100%101%99%包封率(%)90%89%92%
[0158]
结果表明,上述药物脂质复合物
‑
磷脂/壳聚糖药物递送系统,在4℃条件下可稳定储存3个月以上,粒径、zeta电位、药物含量及包封率均无显著差异;该递送系统在4℃储存10个月时,外观几乎无变化,无药物析出或沉淀产生。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1