一种治疗耐药性肿瘤药物的增效组合物
1.本发明属于生物医药技术领域,涉及一种治疗耐药性肿瘤药物的增效组合物,具体涉及一种增强化疗药物治疗耐药性肿瘤并抑制其肺转移的组合物及其联合制剂的构建和应用。
背景技术:
2.现有技术公开了在癌症化疗中,多药耐药(multidrug resistance,mdr)的产生是化疗失败的主要原因。mdr是指恶性细胞对多种分子结构不相关的药物产生耐药的现象,经典的mdr机制是三磷酸腺苷结合盒(abc)跨膜转运蛋白的过表达,如p-糖蛋白(p-glycoprotein)和多药耐药相关蛋白(multidrug resistance-associated protein,mrp),过表达的p-gp导致一种抗癌药物在癌细胞内的积累减少,因此需要增加剂量才能产生同等的毒性。第三代p-gp抑制剂,如tariquidar,在克服mdr方面表现出了很高的疗效。然而,因为p-gp在体内内源性和外源性化合物的生理调节中都发挥着重要作用,所以全身使用p-gp抑制剂具有明显的副作用。因此,限制正常细胞和组织暴露于外排抑制剂是很重要的。有研究报道一种抗癌药物与一种外排抑制剂共给药,可以实现该药物与抑制剂在同一肿瘤细胞群中的共域化,使治疗效果最大化,全身毒性最小化。
3.大量研究表明,自噬在肿瘤的发生、发展以及耐药中具有重要作用。相关临床数据表明,在肿瘤治疗过程中,自噬可作为介导mdr的保护机制被激活。因此,抑制肿瘤细胞的自噬可以使耐药癌细胞重新敏感,诱导肿瘤细胞的凋亡,增强化疗药物的细胞毒作用。氨溴索作为一种祛痰剂、肺表面活性物质合成诱导剂,同时还具有抗氧化、抗炎等作用,主要用于呼吸系统疾病。根据文献调研和本技术研究团队实验室的前期研究发现,氨溴索可以调节细胞自噬,例如可以提高神经元和肿瘤细胞中自噬相关蛋白lc3b-ii、p62/sqstm1的表达水平。目前认为其调节自噬的机制,主要是通过抑制溶酶体和自噬体之间的融合,增加溶酶体的ph,从而阻断自噬通量。
4.临床实践显示,多数患者在就医时可能发生不同程度的肿瘤转移,数据显示,原发肿瘤的转移性扩散占实体瘤患者死亡率的90%以上。因此,抑制肿瘤的转移是癌症治疗中十分重要的一部分。基质金属蛋白酶(matrix metalloproteinases,mmps)是一类高度保守的含锌原子的内切蛋白水解酶,根据作用底物不同,可分为胶原酶、明胶酶、基质溶解酶、巨噬细胞弹性蛋白酶、膜型mmps,这些酶主要降解各型胶原、明胶蛋白、纤维连接蛋白、层黏连蛋白以及其它细胞外基质。mmps通过降解肿瘤周围的细胞外基质(ecm)和基底膜,从而促进了肿瘤的侵袭和转移。研究表明,基质金属蛋白酶抑制剂具有明显的抗肿瘤转移的作用。由聚氧乙烯(polyethyleneglycol,peo)和聚氧丙烯醚(polypropylene oxide,ppo)嵌段组成的三嵌段共聚物普朗尼克是一类常用的两亲性高分子材料,其特殊的嵌段比类型,如p123、p85、p105具有下调mmp-9表达的生物功能,对肿瘤细胞的转移具有很好的防治作用。
5.基于现有技术的研究背景和现状,本技术针对耐药性肿瘤的特点:耐药相关蛋白的高表达和高转移性,利用普朗尼克对耐药性肿瘤外排蛋白和基质金属酶的抑制作用、氨
溴索对耐药性肿瘤细胞的自噬调控作用以及磷脂的细胞和肺组织亲和能力,拟提供一种治疗耐药性肿瘤药物的增效组合物,通过一定比例组成的组合物及其制剂,进行多策略多手段的增强化疗药物对耐药性肿瘤的杀伤力,同时抑制耐药性肿瘤向肺部的侵袭和转移,进一步提高抗肿瘤效果。
技术实现要素:
6.本发明的目的在于基于现有技术的研究背景,针对耐药性肿瘤的特点:耐药相关蛋白的高表达和高转移性,利用普朗尼克对耐药性肿瘤外排蛋白和基质金属酶的抑制作用、氨溴索对耐药性肿瘤细胞的自噬调控作用以及磷脂的细胞和肺组织亲和能力,提供一种治疗耐药性肿瘤药物的增效组合物,以增强化疗药物对耐药性肿瘤的杀伤力,同时抑制耐药性肿瘤向肺部的侵袭和转移,提高抗肿瘤效果。
7.本发明所述的组合物由氨溴索、普朗尼克和磷脂类材料组成,进一步制成为含有氨溴索的普朗尼克脂质体或胶束制剂,所述药物制剂可增强化疗药物治疗耐药性肿瘤并抑制其肺转移。
8.更具体的,
9.本发明提供了一种治疗耐药性肿瘤药物的增效组合物,其由氨溴索、普朗尼克与磷脂类材料组成,其中,所述的氨溴索为盐酸氨溴索,英文名为ambroxol(ax),其化学式为反式-4-[(2-氨基-3,5-二溴苄基)氨基]环己醇,分子量为378.1,所述的普朗尼克(pluronic)包括普朗尼克p105、普朗尼克p85、普朗尼克p123,通用名为泊洛沙姆,是一种由聚氧乙烯(peo)、聚氧丙烯(ppo)组成的peo-ppo非离子型三嵌段共聚物,所述的磷脂类材料选自二棕榈酰磷脂酰胆碱(dppc)、二硬脂酰磷脂酰胆碱(dspc)、卵磷脂、大豆磷脂。
[0010]
本发明的增效组合物,进一步制成含氨溴索、普朗尼克、磷脂组合物的溶液、脂质体或胶束制剂;
[0011]
其中,氨溴索的剂量浓度范围为5-100mg/ml;普朗尼克的剂量浓度范围为0.005-5mg/ml;磷脂与普郎尼克的摩尔比为100:1-1:2。
[0012]
本发明中,所述的溶液制剂通过下述方法制备:
[0013]
将氨溴索、普朗尼克与磷脂材料溶于去离子水或pbs中后,进行超声分散制备成组合物溶液。
[0014]
本发明中,所述的组合物脂质体或胶束制剂采用薄膜分散法制备:
[0015]
将磷脂、普郎尼克溶于有机溶剂中,旋蒸除去有机溶剂,随后加入含有氨溴索的去离子水或pbs缓冲液进行水化,超声后通过聚碳酸酯膜进行挤出,最终制得组合物脂质体或胶束制剂。
[0016]
本发明所述的制备方法中的有机溶剂为三氯甲烷、甲醇、二氯甲烷、乙醇。
[0017]
本发明进一步提供了所述的治疗耐药性肿瘤药物的增效组合物在制备增强化疗药物治疗耐药性肿瘤并抑制其肺转移的药物制剂中的用途,
[0018]
所述的药物制剂抑制肿瘤细胞的生长和增殖并抑制肿瘤细胞的肺转移;
[0019]
所述的化疗药物为紫杉醇、多西紫杉醇、卡巴他赛紫杉烷类药物或多柔比星、阿柔比星、表柔比星蒽环类化疗药物。
[0020]
本发明所述的组合物制剂通过静脉注射或吸入途径给药方式给药。
[0021]
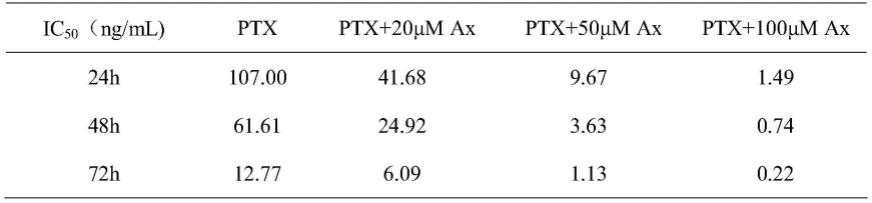
表1为不同浓度的氨溴索、普朗尼克和磷脂材料组合物和紫杉醇共同孵育a549/t细胞24h、48h和72h后的ic
50
值。
[0022]
表2为普朗尼克p105、普郎尼克p85、普郎尼克p123与不同浓度的氨溴索、磷脂材料组合物与紫杉醇共同孵育a549/t细胞24h后的ic
50
值。
[0023]
表3为普朗尼克、不同浓度的氨溴索与dppc、dspc、卵磷脂、大豆磷脂组合物与紫杉醇共同孵育a549/t细胞24h后的ic
50
值。
[0024]
表4为普朗尼克、氨溴索与磷脂组合物与多西紫杉醇、卡巴他赛、多柔比星、阿柔比星、表柔比星共同孵育a549/t细胞24h后的ic
50
值。
[0025]
表1
[0026][0027]
表2
[0028][0029]
表3
[0030][0031]
表4
[0032][0033]
本发明提供了一种组合物,可用于制备增强化疗药物治疗耐药性肿瘤并抑制其肺转移的药物制剂。
[0034]
本发明取得了以下有益结果:
[0035]
(1)本发明联合使用了氨溴索、普朗尼克和磷脂类材料,增强了化疗药物对耐药性肿瘤的治疗并抑制其肺转移。
[0036]
(2)本发明制备了含氨溴索的普朗尼克脂质体或胶束的组合物制剂,用于增强化疗药物对耐药性肿瘤的治疗并抑制其肺部侵袭和转移,易于制备,可大量生产。
附图说明
[0037]
图1不同组合物抑制肿瘤细胞的侵袭和转移
[0038]
(a)a549/t细胞划痕实验结果。a.对照组0h的细胞划痕;b.对照组24h的细胞划痕,完全愈合;c.加入磷脂脂质体(bl)24h后的细胞划痕;d.加入普朗尼克-磷脂脂质体(pl)24h后的细胞划痕;e.加入普朗尼克-磷脂胶束(pm)24h后的细胞划痕;
[0039]
(b)transwell实验结果。对照组(control)、磷脂脂质体(bl)、普朗尼克-磷脂脂质体(pl);
[0040]
(c)组合物制剂对肿瘤细胞mmp-9表达的影响。磷脂脂质体(bl)、普朗尼克-磷脂脂质体(pl)和普朗尼克-磷脂胶束(pm)。
[0041]
图2组合物制剂的理化性质表征
[0042]
(a)组合物制剂的透射电镜照片。(a)磷脂脂质体(b)组合物脂质体。标尺:
[0043]
100nm;
[0044]
(b)红外光谱对组合物制剂中普朗尼克和磷脂成份的表征结果。pluronic(a),
[0045]
bl(b)and pl(c)。
[0046]
图3不同组合物制剂对细胞摄取能力和sp-a表达水平的影响
[0047]
(a)a549/t细胞对负载rh123的磷脂脂质体制剂(brl)、不含氨溴索的普朗尼克-磷脂脂质体制剂(prl)与组合物脂质体制剂(prl+ax)的耐药性肿瘤细胞摄取;
[0048]
(b)a549/t细胞摄取负载rh123的brl和prl、prl+ax或游离rh123的流式定量结果;
[0049]
(c)不同浓度的氨溴索、普朗尼克、磷脂材料组合物和对a549/t细胞表达sp-a蛋白的影响;
[0050]
(d)不同组合物制剂对a549/t细胞表达sp-a蛋白的影响。
[0051]
图4不同组合物制剂的细胞水平逆转耐药机制探究
[0052]
(a)不同组合物制剂对a549和a549/t细胞表达p-gp蛋白的影响;
[0053]
(b)不同组合物制剂对a549和a549/t细胞自噬通量的影响。
[0054]
图5不同组合物制剂的体内分布情况和对肺肿瘤组织微环境的影响
[0055]
(a)24h内不同组合物制剂在肺肿瘤及其他脏器中的分布情况;
[0056]
(b)24h内不同组合物制剂在肺肿瘤中分布的定量结果;
[0057]
(c)给予不同组合物制剂24h后荷瘤裸鼠肺表面活性物质相关蛋白sp-a的表达情况;
[0058]
(d)多次给药治疗后每组荷瘤裸鼠肺部肿瘤微环境中il-6、tnf-α、fn和α-sma的表达情况。
[0059]
图6不同组合物制剂的体内药效学评价。
[0060]
(a)a549/t-luciferase肺部肿瘤模型中,不同给药组治疗后肺部肿瘤大小变化;
[0061]
(b)a549/t-luciferase肺部肿瘤模型中,不同给药组的裸鼠的体重变化;
[0062]
(c)a549/t-luciferase肺部肿瘤模型中,不同给药组治疗后裸鼠的生存时间比较。
具体实施方式
[0063]
下面结合具体实例对本发明作进一步的说明,以下实例仅是为了解释本发明,并不对其内容进行限定。如果实例中未注明的实验具体条件,通常按照常规条件,或按照试剂公司所推荐的条件;下述实施例中所用的试剂、耗材等,如无特殊说明,均可从商业途径得到。
[0064]
实施例1:不同组合物增强化疗药物对耐药性肿瘤的细胞毒作用
[0065]
方法:(1)通过mtt法检测普朗尼克、氨溴索和磷脂材料组合物与不同浓度紫杉醇联用后对a549及其耐药株a549/t,mcf7及其耐药株mcf7/adr细胞的生长抑制作用。
[0066]
(2)检测普朗尼克、氨溴索和磷脂材料组合物与多西紫杉醇、卡巴他赛、多柔比星、阿柔比星、表柔比星联用后共同孵育a549/t细胞24h后的ic50值。
[0067]
结果:(1)如表1所示,相比于单纯ptx组,ax和plu的加入,均可以增加ptx对细胞的毒性,但是相比于两两联合,氨溴索、普郎尼克和磷脂三者的组合物对于ptx增敏效果更加显著,而这种增敏效果在耐药株细胞a549/t和mcf-7/adr中更为显著。
[0068]
(2)如表2-表4所示,普朗尼克、氨溴索与磷脂三者组合物显著性增强多西紫杉醇、卡巴他赛、多柔比星、阿柔比星、表柔比星等化疗药物对耐药性肿瘤的细胞毒作用。
[0069]
实施例2:不同组合物抑制耐药性肿瘤细胞的侵袭和转移
[0070]
方法:(1)细胞划痕实验:a549/t细胞接种于12孔板,待孔内细胞密度长至90%左右用枪头在培养孔中间划出垂直的划痕。随后用pbs洗去漂浮的细胞碎片,并加入含有0.2mg/ml的bl、pl和pm的无血清培养基,共孵育24h。在孵育0h和24h后进行拍照,比较划痕的宽度。
[0071]
(2)transwell实验:a549/t细胞预先用含有0.2mg/ml bl和pl的完全培养基培养24h,随后接种于transwell小室上部。接种24h后,小室上部的细胞用棉签擦去,下部细胞用pbs冲洗后固定。随后用0.5%的结晶紫溶液对下室细胞染色,30min后洗净残留的结晶紫溶液并拍照。
[0072]
(3)联合制剂对肿瘤细胞mmp-9表达的影响:a549/t细胞接种于6孔板并加入含有0.2mg/ml的bl、pl或pm的完全培养基。孵育24h后,每孔细胞用pbs洗净并用含有蛋白酶抑制剂的ripa裂解液进行裂解,并对裂解后细胞样品的蛋白量进行测定。采用western blot对bl、pl和pm处理后的a549/t细胞中的mmp-9表达水平进行分析。
[0073]
结果:(1)如图1a所示,通过比较0h和24h的划痕宽度,显示对照组在24h划痕已经完全愈合,表明a549/t细胞具有强烈的愈合能力。而对于实验组,用0.2mg/ml bl处理24小时后,a549/t细胞的划痕几乎完全愈合,表明bl对a549/t细胞的划痕愈合没有抑制作用;在用pl和pm处理后的a549/t细胞中发现有明显的划痕,表明组合物可以抑制a549/t细胞的侵袭。
[0074]
(2)将用bl和pl预处理后的细胞接种到transwell小室中,迁移到下侧的细胞用结晶紫染色,结果如图1b所示。用bl处理后的a549/t细胞迁移到下室的数量和对照组相比没有显著的差异,而用pl处理的a549/t细胞迁移到下室的数量更少,并且明显少于bl组,表明组合物可以抑制a549/t细胞的迁移。
[0075]
(3)采用western blot对bl、pl和pm处理后的a549/t细胞中的mmp-9表达水平进行分析。如图1c所示,pl和pm均显示出对mmp-9表达的显著抑制作用,表明组合物通过抑制mmp9的表达来抑制a549/t细胞的迁移。
[0076]
实施例3:组合组脂质体(pl)和胶束(pm)制剂制备与理化表征
[0077]
方法:(1)采用薄膜水化法制备组合物脂质体或胶束制剂,按照普朗尼克与磷脂的摩尔比为1:100至1:2的摩尔比称取,用有机溶剂(三氯甲烷、甲醇、二氯甲烷、乙醇等)溶解后,于65℃进行减压旋转蒸发15min,去除有机溶剂。随后采用含有5-100mg/ml氨溴索的去离子水溶液进行水化,并迅速进行振荡、超声,水化,最后通过聚碳酸酯膜挤出得到含有组合物脂质体或胶束。结果表明普朗尼克与磷脂的摩尔比在1:100至1:2的摩尔比范围内,组合物能够制备形成稳定的脂质体或胶束溶液。
[0078]
(2)采用马尔文粒径测定仪测定纳米粒的粒径及zeta电位,透射电子显微镜观察其形态,并通过红外光谱证明磷脂材料和普朗尼克p105的成分特征。如图2所示,空白磷脂脂质体与组合物脂质体的粒径分别为:103.3
±
3.0,107.9
±
3.4nm,形态呈现为圆球形,相应粒径尺寸与前述动态光散射法测得的结果基本一致。傅里叶红外光谱(fir)对组合物中普朗尼克与磷脂的结构官能团进行了分析,结果证实组合物脂质体制剂中存在pluronic的c-o-c特征峰1102cm-1,也有来自磷脂材料的c=o特征峰1736cm-1,表明普朗尼克与磷脂材料可以形成稳定的脂质体或胶束溶液。
[0079]
实施例4:不同组合物对细胞摄取能力和sp-a表达水平的影响
[0080]
方法:(1)将a549/t细胞接种于24孔板中,培养24h。分别加入适量rpmi 1640无血清培养基配制的载有rh123的制剂溶液brl、prl或prl+100μm ax溶液,使得样品孔中rh123的终浓度为5μm,置于培养箱中37℃避光孵育0.5h、1h和2h后清洗,每组平行操作3份。通过倒置荧光显微镜对细胞摄取情况进行定性观察并拍照。另取一组分别给与brl、prl、prl+100μm ax溶液或free rh123溶液,使得样品孔中rh123的终浓度均为5μm,避光孵育2h后,清洗、消化、收集细胞,并通过流式细胞仪进行定量分析检测。
[0081]
(2)将a549/t细胞接种于6孔板中,培养24h后,加入不同浓度的ax溶液(50μm、100μm、200μm),不同浓度的pluronic 105溶液(0.025mg/ml,0.05mg/ml和0.1mg/ml),以及磷脂
浓度为0.2mg/ml的不同制剂和制剂与ax的组合溶液共同孵育24h。孵育结束后,清洗、收集细胞,通过western blot方法来测定不同处理方式对细胞sp-a表达的影响。
[0082]
结果:(1)如图3(a、b)所示,相比于brl组,a549/t细胞对prl和ax与prl联合孵育组的制剂摄取能力相对更强。流式定量得到了同样的结果。因此,氨溴索、普朗尼克和磷脂材料组合物可以明显增加耐药株细胞对化疗药物的摄取水平,进一步证明了组合物及其制剂在增强化疗药物对耐药性肿瘤的治疗的独特性和必要性。
[0083]
(2)如图3(c、d)所示,氨溴索、普朗尼克和磷脂材料均可以促进sp-a的分泌,并且其促进作用皆与用量成正比。并且,氨溴索、普朗尼克和磷脂材料的组合物及其制剂对于sp-a分泌的促进作用效果最好。
[0084]
实施例5:组合组逆转耐药性肿瘤对化疗药物耐药的机制
[0085]
方法:细胞处理方法同实例4所示,通过western blot方法来测定不同处理方式耐药相关蛋白p-gp以及细胞自噬标志物lc3-ii的影响。
[0086]
结果如图4所示,普郎尼克对细胞自噬、ax对p-gp的表达均无影响,但氨溴索、普郎尼克与磷脂材料组合物具有抑制肿瘤细胞自噬以及降低耐药相关蛋白p-gp表达的能力,表明组合物在逆转耐药性肿瘤耐药方面具有独特的增加作用。
[0087]
实施例6:不同组合物制剂的体内药效学评价
[0088]
方法:(1)体内分布实验:将用dir标记的空白磷脂脂质体(bl)和空白普朗尼克-磷脂脂质体制剂(pl)通过静脉注射到荷瘤小鼠体内(dir 0.2mg/kg),对于不同组合物脂质体制剂(bl+ax组、pl+ax组),采用100μm ax溶液水化脂质体。各组分别在给药后的6、12和24h对小鼠进行处死,心脏灌流后解剖取得主要的脏器进行扫描拍照,并对荧光强度进行半定量。然后肺部肿瘤组织固定、脱水后,进行石蜡包埋。通过免疫组化法,对荷肺部转移瘤的小鼠肺组织的看肺表面活性物质sp-a的表达情况进行分析。
[0089]
(2)体内药效试验:利用ivis活体呈像观察肺部a549/t-luciferase肿瘤的生长情况,待肺部肿瘤生长至合适大小时,将荷瘤裸鼠随机分为6组,每组6只,分别为saline组(生理盐水组)、ptx组、bpl组、bpl+100mg/kg ax组、ppl组、ppl+100mg/kg ax组。分别于第0、4、8、12和16天以尾静脉注射方式给与各制剂,各组化疗药物紫杉醇(ptx)的给药剂量为5mg/kg。各组给药后通过如下指标进行体内药效结果监测:
[0090]
①
耐药肿瘤的生长情况:采用ivis活体成像法监测荷瘤小鼠肺部肿瘤的生长,于第0,5,10,15,20天进行小动物活体成像拍摄。
[0091]
②
每隔3天对荷瘤小鼠体重情况进行测定。
[0092]
③
实验结束后,处死各组荷瘤小鼠,并收集荷瘤肺组织和其他主要组织器官,固定、脱水后,进行石蜡包埋并进行h&e染色。
[0093]
④
通过免疫组化法测定肺部微环境中免疫因子il-6、tnf-α和肿瘤相关成纤维相关蛋白fn和α-sma表达水平。
[0094]
结果:(1)如图5所示,在a549/t-luciferase细胞建立的耐药性肺转移瘤模型中,氨溴索、普郎尼克、磷脂材料组合物制剂(ax+pl组)在肺部的相对蓄积最多,证明了组合物的肿瘤组织响应性,从而可以增强化疗药物在肿瘤部位的蓄积。sp-a蛋白的免疫组化结果显示,相比其他组,氨溴索、普郎尼克、磷脂材料组合物制剂(ax+pl组),sp-a的分泌明显增加,与体内分布实验相呼应。
[0095]
(2)观察肿瘤的生长情况并以中位生存期的变化来考察不同实验组别的体内药效情况,如图6所示,氨溴索、普郎尼克、磷脂材料的组合物制剂在增强化疗药物抑制耐药性肿瘤生长的作用最佳(ax+ppl组),可以延长生存期至63.5天。采用he染色和免疫组化法,对各实验组肺部肿瘤微环境的相关炎症因子和cafs相关的标志性蛋白的表达水平的考察结果发现,ax可以显著减少肺部组织及肺部肿瘤组织对炎症因子il-6,tnf-α、fn、α-sma分泌,并且在氨溴索、普朗尼克与磷脂组合物的协同作用下,炎症因子的下调作用更为显著。
[0096]
综上所述,本发明采用氨溴索、普朗尼克与磷脂材料并制备了该组合物制剂,将该组合物或其制剂与化疗药物联用,能增强化疗药物对耐药性肿瘤细胞的杀伤作用,在逆转耐药性肿瘤耐药性的同时抑制其肺转移。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1