磷酸西格列汀组合物、磷酸西格列汀片及其制备方法和用途与流程
1.本发明属于药物领域,具体涉及一种磷酸西格列汀组合物、磷酸西格列汀片及其制备方法和用途。
背景技术:
2.糖尿病是一种以高血糖为特征的代谢性疾病。高血糖则是由于胰岛素分泌缺陷或其生物作用受损,或两者兼有引起。长期存在的高血糖,导致各种组织,特别是眼、肾、心脏、血管、神经的慢性损伤,功能障碍。有研究显示,在2015年,我国成人糖尿病的病人数量已高达1.096亿,位居世界第一位,在全世界的范围内,糖尿病的患病率、发病率正逐渐的升高。
3.磷酸西格列汀是一种有效和高度选择性的二肽基肽酶ⅳ(dpp
‑ⅳ
)抑制剂,在2型糖尿病患者中可通过增加活性肠促胰岛激素胰高糖素样多肽
‑
1(glp
‑
l)和葡萄糖依赖性促胰岛素分泌多肽(gip)的水平而改善血糖控制。2006年默克公司开发了一种磷酸西格列汀片。2009年9月进口到中国,商品名为捷诺维,规格为25mg、50mg和100mg。临床上可以单独应用也可以与其他口服降糖药组成复方药物(如二甲双胍或噻唑烷二酮)来治疗2型糖尿病。
4.药物一致性评价,要求仿制药品要与原研药品质量和疗效一致。具体来讲,要求杂质谱一致、稳定性一致、体内外溶出规律一致。开展仿制药质量和疗效一致性评价工作,对提升我国制药行业整体水平,保障药品安全性和有效性,促进医药产业升级和结构调整,增强国际竞争能力,都具有十分重要的意义。
5.现有技术中,在对磷酸西格列汀的仿制药进行体外溶出行为考察时,发现仿制药的释放行为与原研制剂存在着明显差距,很难与原研制剂的体外溶出相一致,致使仿制药的安全性和有效性没有保障。
技术实现要素:
6.针对现有技术中存在的上述不足,本发明的目的在于提供磷酸西格列汀组合物、磷酸西格列汀片及其制备方法和用途,所述磷酸西格列汀片的体外溶出曲线与默克公司生产的进口原研制剂相似,解决了现有技术中磷酸西格列汀仿制药与原研制剂的体外溶出不一致的问题。
7.为实现上述发明目的,本发明采用的技术方案如下:
8.第一方面,本发明提供了一种磷酸西格列汀组合物,所述磷酸西格列汀组合物包括如下质量百分含量的组分:
[0009][0010]
所述磷酸西格列汀一水合物的d90粒径为30~90μm;
[0011]
所述微晶纤维素的d90粒径≥260μm。
[0012]
优选的是,所述磷酸西格列汀组合物包括如下质量百分含量的组分:
[0013][0014]
所述磷酸西格列汀一水合物的d90粒径为40~80μm;
[0015]
所述微晶纤维素的d90粒径≥280μm。
[0016]
本发明通过控制所述磷酸西格列汀一水合物和所述微晶纤维素的d90粒径,使得由所述磷酸西格列汀组合物制得的制剂的体外溶出曲线与默克公司生产的进口原研制剂相似,提高了与原研制剂生物等效的可能性,符合药物一致性评价要求。
[0017]
第二方面,本发明提供了一种磷酸西格列汀片,所述磷酸西格列汀片包括片芯,所述片芯包括如第一方面所述的磷酸西格列汀组合物。
[0018]
优选的是,所述磷酸西格列汀片还包括包衣层,所述包衣层包括欧巴代胃溶型薄膜包衣预混剂,所述包衣层质量为所述片芯质量的1%~3%。
[0019]
上述任一方案中优选的是,每1000片所述磷酸西格列汀片中包括如下组分:
[0020][0021]
所述磷酸西格列汀一水合物的d90粒径为30~90μm;
[0022]
所述微晶纤维素的d90粒径≥260μm。
[0023]
本发明提供的磷酸西格列汀片的体外溶出曲线与默克公司生产的进口原研制剂相似,提高了与原研制剂生物等效的可能性,符合一致性评价要求。
[0024]
第三方面,本发明提供了一种根据第二方面所述的磷酸西格列汀片的制备方法,所述制备方法包括如下步骤:对第一方面所述的磷酸西格列汀组合物直接压片即可。
[0025]
优选的是,所述制备方法包括如下步骤:
[0026]
按配方量称取磷酸西格列汀一水合物、无水磷酸氢钙、微晶纤维素、交联羧甲基纤维素钠、硬脂酸镁和硬脂富马酸钠;
[0027]
将所述磷酸西格列汀一水合物、无水磷酸氢钙、微晶纤维素和交联羧甲基纤维素钠混合,得到第一混合物;
[0028]
向所述第一混合物中加入硬脂酸镁和硬脂富马酸钠,混合,得到第二混合物;
[0029]
采用压片机将所述第二混合物压制成片,得到所述磷酸西格列汀片。
[0030]
上述任一方案中优选的是,在所述得到第一混合物的步骤中,在三维混合机中进行混合,混合时间为10min~30min。
[0031]
上述任一方案中优选的是,在所述得到第二混合物的步骤中,在三维混合机中进行混合,混合时间为1min~10min。
[0032]
上述任一方案中优选的是,所述压片机为旋转压片机。
[0033]
上述任一方案中优选的是,在所述采用压片机将所述第二混合物压制成片,得到所述磷酸西格列汀片步骤后,还包括:
[0034]
对所述磷酸西格列汀片进行包衣,控制包衣层增重1%~3%。
[0035]
本发明提供的磷酸西格列汀片的制备方法,采用粉末直接压片技术减少了制粒、干燥等工序,制备过程简单、安全性高、成本低,节约了人力物力,更适合规模化生产。
[0036]
第四方面,本发明提供了一种根据第一方面所述的磷酸西格列汀组合物在制备预防或治疗2型糖尿病的药物中的用途。
附图说明
[0037]
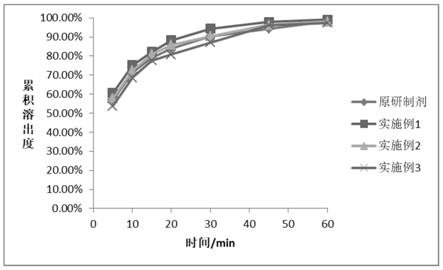
图1为实施例1~3与原研制剂在水中的溶出曲线对比图;
[0038]
图2为实施例4~6与原研制剂在水中的溶出曲线对比图;
[0039]
图3为对比例2和对比例4与原研制剂在水中的溶出曲线对比图。
具体实施方式
[0040]
为了使本发明要解决的技术问题、技术方案及有益效果更加清楚明白,以下结合具体实施例,对本发明进行进一步详细说明。应当理解,此处所描述的具体实施例仅仅用以解释本发明,并不用于限定本发明。
[0041]
除有定义外,以下实施例中所用的技术术语具有与本发明所属领域技术人员普遍理解的相同含义。以下实施例中所用的实验试剂,如无特殊说明,均为常规生化试剂;以下实施例中所用的原材料、仪器和设备等,均可通过市场购买获得或者可通过现有方法获得,如没有特殊说明,均指通过市场购买获得或者可通过现有方法获得的常规原材料、仪器和设备等,没有特殊限制;所述实验试剂用量,如无特殊说明,均为常规实验操作中试剂用量;所述实验方法,如无特殊说明,均为常规方法。
[0042]
第一方面,本发明实施例提供了一种磷酸西格列汀组合物,所述磷酸西格列汀组合物包括如下质量百分含量的组分:
[0043][0044]
所述磷酸西格列汀一水合物的d90粒径为30~90μm;
[0045]
所述微晶纤维素的d90粒径≥260μm。
[0046]
本发明实施例中,所述d90粒径指的是样品的累计粒度分布百分数达到90%时所对应的粒径,例如:样品的d90粒径为60μm,指的是所测样品90%的颗粒粒径小于60μm。
[0047]
可以通过气流粉碎或机械粉碎,控制所述磷酸西格列汀一水合物的d90粒径为30~90μm,例如d90粒径可以为30μm、40μm、50μm、60μm、80μm或90μm等,如果d90粒径太小,则由所述磷酸西格列汀组合物制成的制剂的体外溶出速度过快,与参比制剂的溶出曲线差距较大,且粉碎所需要的能耗较大,易粘冲,如果d90粒径太大,则由所述磷酸西格列汀组合物制成的制剂的体外溶出速度过慢,与参比制剂的溶出曲线差距较大,优选地,d90粒径为40~80μm。
[0048]
所述微晶纤维素的d90粒径≥260μm,例如d90粒径可以为260μm、280μm或300μm等,可以选自商购可得且符合d90粒径≥260μm的所述微晶纤维素。如果微晶纤维素的d90粒径太小,则由所述磷酸西格列汀组合物制成的制剂的体外溶出速度过慢且片重差异较大,与参比制剂的溶出曲线差距较大。优选地,d90粒径≥280μm。
[0049]
本发明实施例通过控制所述磷酸西格列汀一水合物和所述微晶纤维素的d90粒径,使得由所述磷酸西格列汀组合物制得的制剂的体外溶出曲线与默克公司生产的进口原研制剂相似,提高了与原研制剂生物等效的可能性,符合一致性评价要求。
[0050]
进一步地,所述磷酸西格列汀组合物包括如下质量百分含量的组分:
[0051][0052]
所述磷酸西格列汀一水合物的d90粒径为40~80μm;
[0053]
所述微晶纤维素的d90粒径≥280μm。
[0054]
第二方面,本发明实施例提供了一种磷酸西格列汀片,所述磷酸西格列汀片包括片芯,所述片芯包括如第一方面所述的磷酸西格列汀组合物。
[0055]
因原研制剂处方和制备工艺可查询,国内磷酸西格列汀制剂大都使用和原研制剂一样的处方和工艺(粉末直接压片工艺)。
[0056]
原研制剂的辅料和包衣处方如下:
[0057]
微晶纤维素123.8mg,未压碎的磷酸氢钙123.8mg,交联羧甲基纤维素钠8mg,硬脂酸镁4mg,硬脂富马酸钠12mg;
[0058]
包衣组成为欧巴代ii米色85f17438,16mg,包括如下质量百分含量的组分:聚乙烯醇40%,二氧化钛(e171)21.56%,聚乙二醇3350(聚乙二醇)20.2%,滑石粉14.8%,氧化铁黄(e172)3.07%,氧化铁红(e172)0.37%。
[0059]
本技术发明人在研究过程中意外地发现,在原研制剂处方中,并不是使用任何不同d90粒径的微晶纤维素或者不同d90粒径的磷酸西格列汀一水合物均可以制备出与原研制剂相似的样品。不同d90粒径的微晶纤维素或不同d90粒径的磷酸西格列汀一水合物体现出不同的性质,相应的,在制剂中体现出不同的溶出行为,对制剂的溶出行为具有明显的影响。
[0060]
本发明实施例提供的磷酸西格列汀片的体外溶出曲线与默克公司生产的进口原研制剂相似,提高了与原研制剂生物等效的可能性,符合一致性评价要求,处方粉末流动性和可压性良好,所得片面光洁,片重差异在
±
3.0%以下,更适合规模化生产。
[0061]
进一步地,所述磷酸西格列汀片还包括包衣层,所述包衣层包括欧巴代胃溶型薄膜包衣预混剂,所述包衣层质量为所述片芯质量的1%~3%,例如所述包衣层质量可以为所述片芯质量的1%、2%或3%等。
[0062]
进一步地,每1000片所述磷酸西格列汀片中包括如下组分:
[0063][0064]
所述磷酸西格列汀一水合物的d90粒径为30~90μm;
[0065]
所述微晶纤维素的d90粒径≥260μm。
[0066]
第三方面,本发明实施例提供了一种根据第二方面所述的磷酸西格列汀片的制备方法,所述制备方法包括如下步骤:对第一方面所述的磷酸西格列汀组合物直接压片即可。
[0067]
本发明实施例提供的磷酸西格列汀片的制备方法,采用粉末直接压片技术减少了制粒、干燥等工序,制备过程简单、安全性高、成本低,节约了人力物力,更适合规模化生产。
[0068]
进一步地,所述制备方法包括如下步骤:
[0069]
s1、按配方量称取磷酸西格列汀一水合物、无水磷酸氢钙、微晶纤维素、交联羧甲基纤维素钠、硬脂酸镁和硬脂富马酸钠;
[0070]
s2、将所述磷酸西格列汀一水合物、无水磷酸氢钙、微晶纤维素和交联羧甲基纤维素钠混合,得到第一混合物;
[0071]
s3、向所述第一混合物中加入硬脂酸镁和硬脂富马酸钠,混合,得到第二混合物;
[0072]
s4、采用压片机将所述第二混合物压制成片,得到所述磷酸西格列汀片。
[0073]
进一步地,在步骤s2中,在三维混合机中进行混合,混合时间为10min~30min,例如混合时间可以为10min、20min或30min等。
[0074]
进一步地,在步骤s3中,在三维混合机中进行混合,混合时间为1min~10min,例如混合时间可以为1min、2min、5min、7min或10min等。
[0075]
进一步地,所述压片机为旋转压片机。
[0076]
进一步地,在步骤s4后,还包括:
[0077]
对磷酸西格列汀片进行包衣,控制包衣层增重1%~3%,例如包衣层增重可以为1%、2%或3%等。
[0078]
第四方面,本发明实施例提供了一种根据第一方面所述的磷酸西格列汀组合物在制备预防或治疗2型糖尿病的药物中的用途。
[0079]
本发明先后进行过多次试验,现举一部分试验结果作为参考对发明进行进一步详细描述,下面结合具体实施例进行详细说明。
[0080]
下述各实施例和对比例中,d90粒径在马尔文激光粒度分析仪上检测获得,设备型号为mastersizer 3000,光源为633nm高稳定氦
‑
氖激光器,检测方法为干法。
[0081]
下述实施例和对比例中,与原研制剂进行溶出曲线比较,按照下述规定进行结果判定:根据《普通口服固体制剂溶出曲线比较指导原则》中对于溶出曲线比较的判定,采用非模型依赖法中的相似因子(f2)法,即两条溶出曲线相似因子(f2)数值不小于50时,可认
为两条溶出曲线相似。
[0082]
原研制剂:磷酸西格列汀片,商品名为捷诺维(由英国进口到中国),规格为100mg。
[0083]
下述各实施例和对比例中包衣层为欧巴代胃溶型薄膜包衣预混剂:欧巴代ii米色85f17438,包括如下质量百分含量的组分:聚乙烯醇40%,二氧化钛(e171)21.56%,聚乙二醇3350(聚乙二醇)20.2%,滑石粉14.8%,氧化铁黄(e172)3.07%,氧化铁红(e172)0.37%。
[0084]
实施例1~实施例6提供的磷酸西格列汀片包括如表1所示质量的组分(按1000片计),对比例1~对比例4提供的磷酸西格列汀片包括如表2所示质量的组分(按1000片计)。
[0085]
表1
[0086][0087]
表2
[0088]
[0089][0090]
实施例1
[0091]
本实施例提供的磷酸西格列汀片组分含量如表1所示。
[0092]
制备方法:
[0093]
s1、将无水磷酸氢钙、交联羧甲基纤维素钠、硬脂酸镁和硬脂富马酸钠均过40目筛备用。依次按处方量称取磷酸西格列汀一水合物(d90粒径为30μm)、无水磷酸氢钙、微晶纤维素(d90粒径为260μm)、交联羧甲基纤维素钠、硬脂酸镁和硬脂富马酸钠;
[0094]
s2、将所述磷酸西格列汀一水合物、无水磷酸氢钙、微晶纤维素和交联羧甲基纤维素钠于三维混合机中混合,混合时间为20min,得到第一混合物;
[0095]
s3、向所述第一混合物中加入硬脂酸镁和硬脂富马酸钠,于三维混合机中继续混合,混合时间为5min,得到第二混合物;
[0096]
s4、采用旋转压片机将所述第二混合物压制成片,制1000片,得到素片,之后对所述素片包薄膜衣,包衣层增重2%,得到所述磷酸西格列汀片。
[0097]
实施例2
[0098]
本实施例提供的磷酸西格列汀片组分含量如表1所示。
[0099]
制备方法:
[0100]
s1、将无水磷酸氢钙、交联羧甲基纤维素钠、硬脂酸镁和硬脂富马酸钠均过40目筛备用。依次按处方量称取磷酸西格列汀一水合物(d90粒径为40μm)、无水磷酸氢钙、微晶纤维素(d90粒径为260μm)、交联羧甲基纤维素钠、硬脂酸镁和硬脂富马酸钠;
[0101]
s2~s4与实施例1中s2~s4完全相同。
[0102]
实施例3
[0103]
本实施例提供的磷酸西格列汀片组分含量如表1所示。
[0104]
制备方法:
[0105]
s1、将无水磷酸氢钙、交联羧甲基纤维素钠、硬脂酸镁和硬脂富马酸钠均过40目筛备用。依次按处方量称取磷酸西格列汀一水合物(d90粒径为80μm)、无水磷酸氢钙、微晶纤维素(d90粒径为260μm)、交联羧甲基纤维素钠、硬脂酸镁和硬脂富马酸钠;
[0106]
s2~s4与实施例1中s2~s4完全相同。
[0107]
实施例4
[0108]
本实施例提供的磷酸西格列汀片组分含量如表1所示。
[0109]
制备方法:
[0110]
s1、将无水磷酸氢钙、交联羧甲基纤维素钠、硬脂酸镁和硬脂富马酸钠均过40目筛备用。依次按处方量称取磷酸西格列汀一水合物(d90粒径为90μm)、无水磷酸氢钙、微晶纤维素(d90粒径为260μm)、交联羧甲基纤维素钠、硬脂酸镁和硬脂富马酸钠;
[0111]
s2~s4与实施例1中s2~s4完全相同。
[0112]
实施例5
[0113]
本实施例提供的磷酸西格列汀片组分含量如表1所示。
[0114]
制备方法:
[0115]
s1、将无水磷酸氢钙、交联羧甲基纤维素钠、硬脂酸镁和硬脂富马酸钠均过40目筛备用。依次按处方量称取磷酸西格列汀一水合物(d90粒径为30μm)、无水磷酸氢钙、微晶纤维素(d90粒径为280μm)、交联羧甲基纤维素钠、硬脂酸镁和硬脂富马酸钠;
[0116]
s2~s4与实施例1中s2~s4完全相同。
[0117]
实施例6
[0118]
本实施例提供的磷酸西格列汀片组分含量如表1所示。
[0119]
制备方法:
[0120]
s1、将无水磷酸氢钙、交联羧甲基纤维素钠、硬脂酸镁和硬脂富马酸钠均过40目筛备用。依次按处方量称取磷酸西格列汀一水合物(d90粒径为40μm)、无水磷酸氢钙、微晶纤维素(d90粒径为280μm)、交联羧甲基纤维素钠、硬脂酸镁和硬脂富马酸钠;
[0121]
s2~s4与实施例1中s2~s4完全相同。
[0122]
对比例1
[0123]
本对比例提供的磷酸西格列汀片组分含量如表2所示。
[0124]
制备方法:
[0125]
s1、将无水磷酸氢钙、交联羧甲基纤维素钠、硬脂酸镁和硬脂富马酸钠均过40目筛备用。依次按处方量称取磷酸西格列汀一水合物(d90粒径为30μm)、无水磷酸氢钙、微晶纤维素(d90粒径为150μm)、交联羧甲基纤维素钠、硬脂酸镁和硬脂富马酸钠;
[0126]
s2~s4与实施例1中s2~s4完全相同。
[0127]
对比例2
[0128]
本对比例提供的磷酸西格列汀片组分含量如表2所示。
[0129]
制备方法:
[0130]
s1、将无水磷酸氢钙、交联羧甲基纤维素钠、硬脂酸镁和硬脂富马酸钠均过40目筛备用。依次按处方量称取磷酸西格列汀一水合物(d90粒径为30μm)、无水磷酸氢钙、微晶纤维素(d90粒径为200μm)、交联羧甲基纤维素钠、硬脂酸镁和硬脂富马酸钠;
[0131]
s2~s4与实施例1中s2~s4完全相同。
[0132]
对比例3
[0133]
本对比例提供的磷酸西格列汀片组分含量如表2所示。
[0134]
制备方法:
[0135]
s1、将无水磷酸氢钙、交联羧甲基纤维素钠、硬脂酸镁和硬脂富马酸钠均过40目筛备用。依次按处方量称取磷酸西格列汀一水合物(d90粒径为15μm)、无水磷酸氢钙、微晶纤
维素(d90粒径为260μm)、交联羧甲基纤维素钠、硬脂酸镁和硬脂富马酸钠;
[0136]
s2~s4与实施例1中s2~s4完全相同。
[0137]
对比例4
[0138]
本对比例提供的磷酸西格列汀片组分含量如表2所示。
[0139]
制备方法:
[0140]
s1、将无水磷酸氢钙、交联羧甲基纤维素钠、硬脂酸镁和硬脂富马酸钠均过40目筛备用。依次按处方量称取磷酸西格列汀一水合物(d90粒径为120μm)、无水磷酸氢钙、微晶纤维素(d90粒径为260μm)、交联羧甲基纤维素钠、硬脂酸镁和硬脂富马酸钠;
[0141]
s2~s4与实施例1中s2~s4完全相同。
[0142]
效果实施例1
[0143]
效果实施例1为测定实施例1~6和对比例1~4压片前混合后物料的休止角,观察制备得到的素片的外观,检查素片的片重差异。
[0144]
片重差异检查法:取所述磷酸西格列汀片20片,精密称定总重量,求得平均片重后,再分别精密称定每片的重量,按(每片重量
‑
平均片量)/平均片重
×
100%计算每片的重量差异,并求得20片的片重差异范围。
[0145]
测定结果如表3和表4所示。
[0146]
表3
[0147][0148][0149]
表4
[0150][0151]
实施例1~6制备得到的磷酸西格列汀片片重差异均在3%以下,表面光滑,符合相关规定,对比例1~2制备得到的磷酸西格列汀片片重差异较大,均在3%以上,甚至超过了5%,对比3制备得到的磷酸西格列汀片表面不平整,粘冲
[0152]
效果实施例2
[0153]
效果实施例2为实施例1~6、对比例2和4制备的磷酸西格列汀片和原研制剂的溶出曲线的考察。
[0154]
一、实验样品:
[0155]
供试制剂:实施例1~6、对比例2和4制备的磷酸西格列汀片和原研制剂。
[0156]
二、实验内容:
[0157]
以水作为溶出介质,测定供试制剂在水中的溶出度。
[0158]
三、实验方法
[0159]
1.溶出度测定
[0160]
分别取供试制剂,照中国药典2020年版第一法,采用溶出度测定法(附录
ⅹ
c第一法(篮法))的装置以水为溶出介质,溶出介质体积为900ml,转速50r/min,依法操作,分别于5min、10min、15min、20min、30min、45min、60min取样1.5ml作为供试品溶液,同时补加等量同温释放介质。各时间点的供试品溶液均采用高效液相色谱法检测。分别比较实施例1~6、对比例2和4制备的磷酸西格列汀片和原研制剂中磷酸西格列汀在水中的溶出度,结果如表5和表6所示。实施例1~6与原研制剂在水中的溶出曲线对比图如图1和图2所示,对比例2和4与原研制剂在水中的溶出曲线对比图如图3所示。
[0161]
表5(溶出介质为水)
[0162][0163]
表6(溶出介质为水)
[0164][0165]
因对比例1片重差异较大,不符合相关规定,对比例3有粘冲现象,因此不对对比例1和对比例3进行溶出曲线考察。实施例1~6制备的磷酸西格列汀片和原研制剂的溶出曲线的相似因子均大于50,溶出行为均相似,符合一致性评价要求,实施例2制备得到的磷酸西格列汀片与原研制剂的相似度明显高于实施例1和实施例3~6制备得到的磷酸西格列汀片。
[0166]
效果实施例3
[0167]
效果实施例3为以ph=1.2盐酸溶液、ph=4.5醋酸盐缓冲液和ph=6.8磷酸盐缓冲液作为溶出介质,实施例1~6、对比例2和4制备的磷酸西格列汀片和原研制剂的溶出曲线的考察。
[0168]
考察方法与效果实施例2基本相同,不同的是改变溶出介质,分别替换为ph=1.2盐酸溶液、ph=4.5醋酸盐缓冲液和ph=6.8磷酸盐缓冲液。分别比较实施例1~6、对比例2和4制备的磷酸西格列汀片和原研制剂中磷酸西格列汀在不同ph介质中的溶出曲线。实施例1~6与原研制剂在该三种溶出介质下的溶出曲线对比图与图1和图2类似,对比例2和4与原研制剂在该三种溶出介质下的溶出曲线对比图与图3类似。
[0169]
实施例1~6制备的磷酸西格列汀片和原研制剂在三种不同溶出介质中的溶出曲线的相似因子均大于50,溶出行为均相似,对比例2和对比例4制备的磷酸西格列汀片和原研制剂在三种不同溶出介质中的溶出曲线的相似因子均小于50,溶出行为差距较大。
[0170]
以上所述仅为本发明的较佳实施例而已,并不用以限制本发明,凡在本发明的精神和原则之内所作的任何修改、等同替换和改进等,均应包含在本发明的保护范围之内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1