替度鲁肽用于制备治疗心肌缺血再灌注损伤药物中的应用的制作方法
1.本发明属于医药领域,具体涉及一种替度鲁肽用于制备治疗心肌缺血再灌注损伤药物中的应用。
背景技术:
2.随着经济发展和人民生活水平的提高,急性心肌梗死(ami)的患病人数逐年增加,已经成为我国致死,致残的首要病因。急性心肌梗死是冠状动脉急性闭塞引起的心肌坏死性疾病,快速完全地开通闭塞血管是其主要治疗手段。进入21世纪以来,随着急诊冠脉介入治疗的普及,越来越多的ami患者得到了及时的血运重建治疗,ami的死亡率有了明显下降。但是再灌注损伤导致了大量的心肌细胞进一步死亡,使心梗患者晚期出现严重的心功能减退,影响了远期预后。大量证据表明,心肌缺血再灌注后过度激活的免疫炎症反应在其发生发展中发挥重要作用。心肌缺血再灌注后,适度的炎症反应有利于清除梗死区的坏死细胞及细胞外基质,为接下来的增殖修复扫清障碍。而如果心肌炎症反应过于剧烈或持续存在,则会造成心肌细胞的进一步损伤。
3.近年来人类肠道微生物在心血管疾病和代谢紊乱中的作用逐渐引起关注。相继有研究指出心肌梗死后存在肠道菌群结构的紊乱及比例失衡。蔡军教授团队发文首次报道急性心肌梗死后存在肠道菌群移位及循环中脂多糖(lipopolysaccharide,lps)升高现象,且急性st段抬高型心梗患者循环中lps的增幅与循环中促炎型单核细胞的增幅呈正相关。国外学者的研究进一步证实急性st段抬高型心梗患者循环中lps的水平与循环中肠道通透性的标志物zonulin的水平独立相关。申请者前期工作也发现小鼠心肌缺血再灌注后存在肠道形态、通透性和屏障功能的破坏及肠道菌群向循环中迁移以及循环中lps的升高,且肠道菌群异位的变化趋势与受损心肌中促炎型巨噬细胞的变化趋势相同,均在术后第三天达到高峰。而缺乏肠道菌群的无菌鼠,心肌缺血再灌注后组织损伤较野生型鼠显著减弱。这些均提示肠道菌群移位与心肌缺血后炎症反应的激活和持续存在联系密切,对于心肌缺血再灌注后炎症反应具有重要意义。故寻找心肌缺血再灌注后减少肠道菌群异位和失调的方法,对于临床缓解心肌缺血再灌注损伤有着重要的作用。
4.抗生物治疗理论上可以清除肠道菌群以切断肠道菌群与心血管疾病之间的联系。但广谱抗生素的应用会增加心梗后心脏破裂的风险,再结合广谱抗生素治疗会增加耐药菌和真菌感染的风险,这种“简单粗暴”的抗生素疗法势必难以应用于临床。
5.饮食干预或益生菌疗法可以通过改变肠道微生态发挥保护肠道免疫屏障的作用,在糖尿病、肥胖症及动脉粥样硬化等慢性疾病的治疗中拥有不错的应用前景。但显然这种长周期的治疗模式及需要提前干预的特点极大程度地限制了其在急性心梗患者中的应用。近年来,粪菌移植作为一种新兴的改善肠道菌群紊乱,保护肠道屏障的疗法受到了越来越多的关注,曾一度广泛应用于肠道疾病及部分肠外疾病的治疗。但由于其成分复杂,具有导致内毒素或感染性物质转移及诱发新的胃肠道并发症的潜在风险,治疗效果和安全性难以得到有效保证。因此迫切地需要寻找新的安全有效的治疗手段以阻止心肌缺血再灌注后肠
道菌群的移位。
6.胰高血糖素样肽2(glucagon
‑
like peptide
‑
2,glp
‑
2)是一种由33个氨基酸组成的多肽,由末端回肠及结肠的l细胞分泌,起初作为一种可以促进肠粘膜增生的肠道营养因子被发现。近几年的突破性研究发现glp
‑
2的作用不仅仅拘泥于肠道,已被证明能减轻肝脏、神经系统等的炎症损伤,其具体机制有待深入研究。glp
‑
2在体内的半衰期极短,极易被体内的二肽基肽酶ⅳ(dipeptidyl peptidase
‑
4,dpp4)降解。因此,一种被称为替度鲁肽(teduglutide)的耐dpp4酶降解的glp
‑
2类似物被研制出来,替度鲁肽是在glp
‑
2序列的基础上将其第二位的“a(丙氨酸
‑
alanine)”用“g(甘氨酸
‑
glycine)”替换,所产生的(gly2)
‑
glp
‑
2既保有功效,又能抵抗降解,其半衰期相比于天然的glp
‑
2显著延长。目前替度鲁肽已于2012年由美国fda批准上市,用于肠功能衰竭的治疗。
7.本发明于首次通过动物实验证实替度鲁肽可以保护心肌缺血后肠屏障的完整性,阻止肠道菌群移位和肠道菌群失调,抑制心肌组织中中性粒细胞和促炎型单核细胞的浸润,减轻心肌缺血再灌注后的心肌炎症反应。本发明为防治心肌缺血再灌注后炎症反应过度激活提供新思路,具有较高的临床转化价值和临床应用可实现性。
技术实现要素:
8.为了克服现有技术中存在的不足,本发明公开了替度鲁肽的一种新用途,具体地,替度鲁肽在制备治疗急性心肌梗死血管再通后心肌缺血再灌注的药物中的应用。
9.本发明一方面提供了一种替度鲁肽用于制备治疗心肌缺血再灌注损伤药物中的应用,具体为:在制备治疗急性心肌梗死血管再通后心肌缺血再灌注引起肠道菌群移位和肠道菌群失调导致炎症风暴的药物中的应用;
10.其中,所述的心肌缺血再灌注损伤为冠状动脉急性闭塞后行血运重建治疗后导致的心肌进一步损伤,包含氧化应激损伤、炎症反应损伤等;
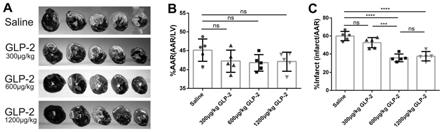
11.其中,所述的炎症风暴为心肌缺血再灌注后导致肠道通透性和屏障功能的破坏肠道菌群失调,引发肠道菌群向循环中迁移以及lps入血,促进炎症细胞如中性粒细胞、单核巨噬细胞的活化和动员,产生和分泌大量炎症因子和趋化因子,促进促炎型细胞向受损心肌浸润,导致心肌缺血再灌注后炎症反应的激活和持续存在;
12.其中,所述的替度鲁肽可以是其原料药、溶剂合物、盐的形式,及其它氨基酸序列类似的胰高血糖素样肽
‑
2类似物,如apraglutide;
13.其中,apraglutide的氨基酸序列为:
14.his
‑
gly
‑
asp
‑
gly
‑
ser
‑
phe
‑
ser
‑
asp
‑
glu
‑
norleucine
‑
d
‑
phenylalanine
‑
thr
‑
ile
‑
leu
‑
asp
‑
leu
‑
leu
‑
ala
‑
ala
‑
arg
‑
asp
‑
phe
‑
ile
‑
asn
‑
trp
‑
leu
‑
ile
‑
gln
‑
thr
‑
lys
‑
ile
‑
thr
‑
asp
‑
nh215.本发明中替度鲁肽的氨基酸序列具体如下:
16.h
‑
his
‑
gly
‑
asp
‑
gly
‑
ser
‑
phe
‑
ser
‑
asp
‑
glu
‑
met
‑
asn
‑
thr
‑
ile
‑
leu
‑
asp
‑
asn
‑
leu
‑
ala
‑
ala
‑
arg
‑
asp
‑
phe
‑
ile
‑
asn
‑
trp
‑
leu
‑
ile
‑
gln
‑
thr
‑
lys
‑
ile
‑
thr
‑
asp
‑
oh。
17.另一方面,本发明提供了替度鲁肽小鼠用药剂量为每天两次,每次600
‑
1200μg/kg,优选地,每次600μg/kg;
18.根据徐叔云教授主编的《药理实验方法学》中人和动物体表面积比值剂量表,根据
人与小鼠按体表面积折算的等效剂量比值:小鼠的用药剂量(mg/kg)=人的用药剂量(mg/kg)
×
70kg
×
0.0026/0.02kg,因此替度鲁肽的人类用药剂量为每天两次,每次66
‑
132μg/kg,优选地,每次66μg/kg。
19.最后,本发明中的替度鲁肽可以和药剂学上的常规药用辅料制成药物制剂;
20.其中,所述的药物制剂可以通过肠胃外给药;
21.其中,所述的药物制剂是注射液剂型或粉针剂。
22.有益效果:
23.本发明发现在结扎小鼠前降支缺血60分钟后恢复冠脉血流构建的小鼠心肌缺血再灌注模型中,于建模后连续3天皮下注射600μg/kg替度鲁肽每天两次,可以保护心肌缺血后肠屏障的完整性,阻止肠道菌群移位和肠道菌群失调,减轻心肌缺血再灌注后的心肌炎症反应,从而减轻心肌缺血再灌注损伤,改善心功能和远期心室重构,提高小鼠远期生存率,改善预后。本发明发现替度鲁肽具有阻止心肌缺血再灌注后肠道菌群移位和肠道菌群失调,减轻心肌缺血再灌注后的心肌炎症反应,保护心功能的作用,可用于制备心肌缺血再灌注的治疗药物,为临床治疗提供新的治疗方案。
附图说明
24.附图1为实施例1中不同剂量替度鲁肽治疗心肌缺血再灌注损伤的效果。
25.附图2为实施例2中替度鲁肽治疗显著改善心肌缺血再灌注后的心功能。
26.附图3为实施例2中替度鲁肽治疗显著提高心肌缺血再灌注小鼠的生存率。
27.附图4为实施例3中替度鲁肽治疗显著减少心肌缺血再灌注后微循环障碍的形成。
28.附图5为实施例4中替度鲁肽治疗显著减少心肌缺血再灌注后受损心肌中及循环中il
‑
6及il
‑
1β促炎因子的水平。
29.附图6为实施例5中替度鲁肽治疗显著减少心肌缺血再灌注后受损心肌中中性粒细胞及巨噬细胞的浸润。
30.附图7为实施例6中替度鲁肽治疗显著改善心肌缺血再灌注后肠道菌群的紊乱。
31.附图8为实施例7中替度鲁肽治疗可显著抑制心肌缺血再灌注后的肠道菌群移位。
具体实施方式
32.下面结合附图对本发明作更进一步的说明。
33.以上所述仅是本发明的优选实施方式,应当指出:对于本技术领域的普通技术人员来说,在不脱离本发明原理的前提下,还可以做出若干改进和润饰,这些改进和润饰也应视为本发明的保护范围。
34.以下实施例中使用的替度鲁肽(teduglutide)均为如下所示的结构,纯度为>98%。
35.h
‑
his
‑
gly
‑
asp
‑
gly
‑
ser
‑
phe
‑
ser
‑
asp
‑
glu
‑
met
‑
asn
‑
thr
‑
ile
‑
leu
‑
asp
‑
asn
‑
leu
‑
ala
‑
ala
‑
arg
‑
asp
‑
phe
‑
ile
‑
asn
‑
trp
‑
leu
‑
ile
‑
gln
‑
thr
‑
lys
‑
ile
‑
thr
‑
asp
‑
oh
36.本发明实施例中所用替度鲁肽购自creative peptide有限公司,货号:10
‑
101
‑
285。本发明实施例中所用动物均为c57bl/6小鼠(spf级,8周龄,雄性),购买于南京大学模式动物研究所。
37.实施例1不同剂量替度鲁肽治疗心肌缺血再灌注损伤的效果
38.材料:小动物呼吸机、动物手术照明灯、气体麻醉系统购自上海玉研科学仪器有限公司;手术用显微器械购自臻美医疗器械有限公司;4
‑
0/7
‑
0缝合线购自宁波医用缝针有限公司;2,3,5—氯化三苯基四氮唑(ttc)、伊文思蓝(evan&blue)购自美国sigma公司。
39.构建小鼠心肌缺血再灌注模型:将8周龄雄性c57bl/6小鼠随机分为假手术组(sham组)、生理盐水组(saline组)、替度鲁肽300μg/kg组(300μg/kg glp
‑
2组)、替度鲁肽600μg/kg组(600μg/kg glp
‑
2组)和替度鲁肽1200μg/kg组(1200μg/kg glp
‑
2组),每组各5只。建模方法:异氟烷麻醉小鼠,气管插管后连接呼吸机辅助呼吸,胸前除毛,碘伏表皮消毒后,于第三四肋间处切开,暴露心脏,使用7
‑
0的线于结扎前降支60min后解开结扎线恢复灌注,用4
‑
0缝线缝合切口,待小鼠自主呼吸恢复后撤除呼吸机,假手术组仅用线穿过,不进行结扎,不同剂量替度鲁肽组于再灌注后即刻皮下注射相应剂量等体积的耐dpp4降解的替度鲁肽,每天两次,连续注射3天,生理盐水组于相同的时间给予等体积的生理盐水。
40.运用evan blue和ttc染色计算心梗面积:心肌缺血再灌注术后3天,利用异氟烷将小鼠充分麻醉后仰卧位将四肢固定于动物手术平板上,行气管插管,连接呼吸机,沿原切口开胸,逐层分离,暴露心脏。在左心耳中下处1
‑
2mm原结扎部位再次用7
‑
0缝线结扎冠状动脉,分离暴露出小鼠主动脉,颈椎脱臼法处死小鼠,迅速从主动脉根部剪断取出心脏,置于盛有pbs的10ml培养皿中,找到小鼠主动脉开口,用1ml注射器从主动脉注入pbs灌洗心脏,洗去心脏中残留血液,灌注pbs后可见心脏跳动。接着用1ml注射器从主动脉注入1%evan blue染液5个单位,期间用血管夹夹住主动脉开口,防止染液漏出,注入evan blue后可见前降支供血以外区域迅速蓝染。将小鼠心脏,放于保鲜膜上,
‑
80℃冰箱冰冻15分钟,用刀片及模具按长轴方向切成厚度约1mm的心肌切片5
‑
6片,将心肌切片放入培养皿中,生理盐水冲洗去浮色,将其泡入1.5%的ttc染液中,室温避光孵育15分钟。ttc可以与存活心肌细胞线粒体内的琥珀酸脱氢酶反应,生成砖红色的甲月赞,而死亡的心肌细胞不能与ttc发生反应,呈苍白色。将心肌切片取出放入含有少量生理盐水的干净培养皿中。观察效果并拍照,采集心肌两侧切面图像。蓝染区域为存活心肌,未被蓝色染料覆盖的部分为缺血心肌,其范围内的砖红色区域为缺血区域内因再灌注而挽救的心肌,而白色区域为坏死心肌。采用image pro plus软件分析心肌梗死范围,打开图像后手动描记每片心肌总面积(total area of myocardium,ta),心肌缺血区域(砖红色+白色区域,area at risk,aar),心肌梗死区域(infarct area,ia),将同一片心肌正反两面测得的数据取平均值,后将同一只小鼠所有心肌切片测得的ta、aar、ia分别进行累加。得到t
ta
,t
aar
,t
ia
,计算公式如下:aar%=t
aar
/t
ta
;infarct size%=t
ia
/t
aar
。
41.如图1所示,600μg/kg和1200μg/kg替度鲁肽组心梗面积明显小于saline组,两剂量组间心梗面积无显著差异,说明替度鲁肽的剂量范围为600
‑
1200μg/kg,后续实验中替度鲁肽的给药剂量为600μg/kg。
42.实施例2替度鲁肽治疗显著改善心肌缺血再灌注后的心功能,提高生存率。
43.材料:小动物呼吸机、动物手术照明灯、气体麻醉系统购自上海玉研科学仪器有限公司,手术用显微器械购自臻美医疗器械有限公司,4
‑
0/7
‑
0缝合线购自宁波医用缝针有限公司,小动物心脏超声仪购自加拿大visualsonics公司。
44.运用心超测量心功能:将8周龄雄性c57bl/6小鼠随机分为假手术组(sham组)、生
理盐水组(saline组)、替度鲁肽组(600μg/kg glp
‑
2组),每组各9只,如上所述构建小鼠心肌缺血再灌注模型,假手术组仅用线穿过,不进行结扎,替度鲁肽组于再灌注后即刻皮下注射600μg/kg的耐dpp4降解的替度鲁肽,每天两次,连续注射3天。生理盐水组于相同的时间给予等体积的生理盐水,小鼠术前及心肌缺血再灌注术后3天、3周均进行心脏超声检测。异氟烷麻醉后,将小鼠固定在带有心电检测的固定板上,轻轻剔除左胸毛发后,应用加拿大visualsonics vevo 2100型号小动物高频彩色超声仪,取小鼠左室(left ventricle,lv)长轴及短轴切面,由二维图像引导取m超进行测量,每个切面选取不同心动周期重复测量三次,分别测量左室收缩末期内径(lv end
‑
systolic diameter,lvid;d)、左室舒张末期内径(lv end
‑
diastolic diameter,lvid;s)、收缩和舒张末期的室间隔厚度(interventricular septal thickness,ivs)和收缩和舒张末期的左室后壁厚度(lvposterior wall thickness,lvpw)。左室短轴缩短率(fractional shortening,fs%)=(lvid;d
–
lvid;s)/lvid;d
×
100(%);左心室射血分数(ejection fraction,ef%)=(lv vol;d
‑
lv vol;s)/lv vol;d
×
100(%);lv vol;d=((7.0/(2.4+lvid;d))
×
lvid;d3);lv vol;s=((7.0/(2.4+lvid;s))
×
lvid;s3)。
45.生存率统计:将8周龄雄性c57bl/6小鼠随机分为假手术组(sham组)、生理盐水组(saline组)、替度鲁肽组(600μg/kg glp
‑
2组),每组各10只,如上所述构建小鼠心肌缺血再灌注模型,假手术组仅用线穿过,不进行结扎。替度鲁肽组于再灌注后即刻皮下注射600μg/kg的耐dpp4降解的替度鲁肽,每天两次,连续注射3天。生理盐水组于相同的时间给予等体积的生理盐水。在同样的生存环境下观察各组小鼠生存率,并绘制生存曲线。
46.如图2所示,替度鲁肽可显著提高心肌缺血再灌注后的左室射血分数(ejection fraction,ef%)和左室短轴缩短率(fractional shortening,fs%),改善心功能。如图3所示,替度鲁肽组较生理盐水组有更高的生存率。
47.实施例3替度鲁肽治疗显著减少心肌缺血再灌注后微循环障碍(microvascular obstruction,mvo)的形成
48.材料:小动物呼吸机、动物手术照明灯、气体麻醉系统购自上海玉研科学仪器有限公司。手术用显微器械购自臻美医疗器械有限公司。4
‑
0/7
‑
0缝合线购自宁波医用缝针有限公司。硫黄素s染料购自biosharp公司。
49.运用硫黄素s染色计算mvo面积:将8周龄雄性c57bl/6小鼠随机分为假手术组(sham组)、生理盐水组(saline组)、替度鲁肽组(600μg/kg glp
‑
2组),每组各5只。如上所述构建小鼠心肌缺血再灌注模型,假手术组仅用线穿过,不进行结扎。替度鲁肽组于再灌注后即刻皮下注射600μg/kg的耐dpp4降解的替度鲁肽,每天两次,连续注射3天,生理盐水组于相同的时间给予等体积的生理盐水。心肌缺血再灌注术后3天,利用异氟烷将小鼠充分麻醉后仰卧位将四肢固定于动物手术平板上。行气管插管,连接呼吸机。沿原切口开胸,逐层分离,分离暴露出小鼠主动脉,颈椎脱臼法处死小鼠,迅速从主动脉根部剪断取出心脏,置于盛有pbs的10ml培养皿中,找到小鼠主动脉开口,用1ml注射器从主动脉注入pbs灌洗心脏,洗去心脏中残留血液,灌注pbs后可见心脏跳动,接着用1ml注射器从主动脉注入4%的硫黄素s染液5个单位,期间用血管夹夹住主动脉开口,防止染液漏出,可见部分心脏被淡黄色染料覆盖,将小鼠心脏,放于保鲜膜上,
‑
80℃冰箱冰冻15分钟,用刀片及模具按长轴方向切成厚度约1mm的心肌切片5
‑
6片,在紫外灯下观察效果并拍照,采集心肌两侧切面图像,荧光蓝
色区域为硫磺素s与内皮细胞结合区域,此处为再灌注后血液复流区域,黑色区域为再灌注后血流未恢复区域,即微循环障碍(microvascular obstruction,mvo)区域,采用image pro plus软件分析心肌梗死范围,打开图像后手动描记每片心肌左室总面积(荧光蓝色左室区域,total area ofleft ventricular myocardium,tla),mvo区域(黑色区域,mvo area,ma)。将同一片心肌正反两面测得的数据取平均值,后将同一只小鼠所有心肌切片测得的tla、ma分别进行累加,得到t
tla
,t
ma
,计算公式如下:mvo%=t
ma
/t
tla
。
50.如图4所示,替度鲁肽可显著减少心肌缺血再灌注后微循环障碍的形成。
51.实施例4替度鲁肽治疗显著减少心肌缺血再灌注后受损心肌中及循环中il
‑
6及il
‑
1β促炎因子的水平
52.材料:小动物呼吸机、动物手术照明灯、气体麻醉系统购自上海玉研科学仪器有限公司,手术用显微器械购自臻美医疗器械有限公司,4
‑
0/7
‑
0缝合线购自宁波医用缝针有限公司,小鼠il
‑
6、il
‑
1βelisakit购自联科生物技术有限公司。
53.留取血液及心脏标本:将8周龄雄性c57bl/6小鼠随机分为假手术组(sham组)、生理盐水组(saline组)、替度鲁肽组(600μg/kg glp
‑
2组),每组各8只。如上所述构建小鼠心肌缺血再灌注模型,假手术组仅用线穿过,不进行结扎。替度鲁肽组于再灌注后即刻皮下注射600μg/kg的耐dpp4降解的替度鲁肽,每天两次,连续注射3天。生理盐水组于相同的时间给予等体积的生理盐水。术后3天处死小鼠留取心脏及血液标本。用异氟烷麻醉小鼠后,予摘眼球取血,留至事先标记好1.5ml ep管中,静置2小时后,3000rpm离心5分钟,留取上层血清,
‑
80℃保存,用于后续实验。小鼠摘除眼球取血后,颈椎脱臼法处死小鼠,之后将小鼠固定于鼠板上,迅速开胸后心腔内注射kcl(2mol/l)1ml,使小鼠心脏停跳于舒张期,在右心房剪一小口,从左心室注射生理盐水进行全身灌流,随后小心从主动脉根部剪断取出心脏,用生理盐水冲洗小鼠心脏表面的血迹,纱布擦拭干净。减去心房与右心室部分,将左心室组织迅速装入冻存管中置于液氮中,并转移到
‑
80℃冰箱保存。
54.酶联免疫吸附实验:使用elisa试剂盒检测il
‑
6,il
‑
1β的含量,如检测样本为血清检测前将其从
‑
80℃冰箱拿出,冰上融化,如为心脏组织样本则称取50mg组织,加9倍匀浆介质用组织匀浆机进行匀浆(匀浆时间10秒/次,间隙30秒,连续3~5次,在冰水中进行),然后将研磨液5000rpm离心10分钟,取上清制备成10%的组织匀浆,取少量匀浆液提蛋白,bca法测定各组匀浆样本蛋白浓度,便于后续统计分析数据,elisa检测具体操作步骤如下:(1)标准品配制:将试剂盒中的标准品冻干粉加入一定体积的“standard/sample diluent”,轻轻摇晃使其充分溶解。按照说明书中的比例依次稀释标准品,配置不同浓度梯度的标准品;(2)在96孔板中每孔加入50μl“elisadiluent”。(3)加样:在标准品孔中加入100μl不同浓度的标准品,在样本孔中加入“standard/sample diluent”稀释2倍后的样品(血清样本可不稀释),贴上封板膜,37℃恒温箱孵育2小时;(4)wash buffer配制:100ml 20
×
wash buffer+1900ml ddh2o,充分颠倒混匀,工作液配制:使用前15分钟配制,8mldetectionantibody+32μl enzyme concentrate,充分颠倒混匀;(5)洗板:每孔中加入wash buffer 300μl,浸泡1分钟后,将96孔板中液体倒掉,在吸水纸上适度拍打,将水拍干,重复洗板5次,也可用洗板机洗板;(6)每孔中加入100μl配制好的工作液,贴上封板膜,37℃恒温箱孵育1小时;(7)按第5步方法洗板,此次洗板7次;(8)每孔中加入100μl“tmb one
‑
step substrate reagent”,室温避光孵育30分钟;(9)当孔内液体变为深蓝色时,每孔中加入50μl“stop solution”,此
时液体由蓝色转为黄色;(10)5分钟内使用酶标仪上在450nm测定od值;(11)根据标准品的浓度和od值做标准曲线,然后根据标准曲线方程计算出样本浓度,心肌组织样本根据之前测得的蛋白浓度将单位换算为pg/mg。
55.如图5所示,小鼠血清及心肌组织中,术后第3天,saline组和glp
‑
2组小鼠血清及心肌组织中il
‑
6及il
‑
1β的含量明显高于sham组,glp
‑
2组小鼠血清及心肌组织中il
‑
6及il
‑
1β的含量明显低于saline组,提示替度鲁肽可明显减少心肌缺血再灌注后循环和心肌组织中il
‑
6及il
‑
1β促炎因子的水平。
56.实施例5替度鲁肽治疗显著减少心肌缺血再灌注后受损心肌中中性粒细胞及巨噬细胞的浸润
57.材料:小动物呼吸机、动物手术照明灯、气体麻醉系统购自上海玉研科学仪器有限公司,手术用显微器械购自臻美医疗器械有限公司,4
‑
0/7
‑
0缝合线购自宁波医用缝针有限公司。流式染色缓冲液、小鼠cd11b
‑
fitc单克隆抗体购自美国bd biosciences公司。小鼠ly6g
‑
pe,ly6c
‑
apc、f4/80
‑
percy5.5单克隆抗体购自ebioscience公司。gentlemacs购自dissociator miltenyi公司。bd facs ariaⅱ流式细胞仪购自bd biosciences公司。
58.留取心脏标本:将8周龄雄性c57bl/6小鼠随机分为假手术组(sham组)、生理盐水组(saline组)、替度鲁肽组(600μg/kg glp
‑
2组),每组各5只。如上所述构建小鼠心肌缺血再灌注模型,假手术组仅用线穿过,不进行结扎。替度鲁肽组于再灌注后即刻皮下注射600μg/kg的耐dpp4降解的替度鲁肽,每天两次,连续注射3天,生理盐水组于相同的时间给予等体积的生理盐水,术后3天处死小鼠留取心脏及血液标本。用异氟烷麻醉小鼠后,颈椎脱臼法处死小鼠,之后将小鼠固定于鼠板上,迅速开胸后心腔内注射kcl(2mol/l)1ml,使小鼠心脏停跳于舒张期,在右心房剪一小口,从左心室注射生理盐水进行全身灌流,随后小心从主动脉根部剪断取出心脏,用生理盐水冲洗小鼠心脏表面的血迹,纱布擦拭干净。减去心房与右心室部分,取缺血的心尖区置于装有冰pbs的1.5ml ep管中。
59.心肌组织流式细胞检测:(1)取缺血的心尖区置于装有冰pbs的1.5ml ep管中,用剪刀将组织剪成碎块;(2)运用gentlemacs
tm
dissociator机器将组织匀至单细胞悬液(基本看不到大块组织);(3)用尼龙布过滤,滤去大的组织团块。300g 4℃离心5分钟,弃上清,用100μl染色缓冲液重悬细胞;(4)根据抗体说明书加入适量体积的细胞表面标记物偶联抗体(cd11b
‑
fitc、ly6g
‑
pe,ly6c
‑
apc、f4/80
‑
percy5.5)或同型对照,4℃避光孵育30分钟,可放置于旋转仪上旋转以充分孵育;(5)加入1ml染色缓冲液清洗细胞,300g 4℃离心5分钟,弃上清;(6)洗去多余的流式抗体后,每管用200μl染色缓冲液重悬后立即上机,流式细胞仪检测表面标记的表达情况;(7)cd11b
+
ly6g
+
标记中性粒细胞,cd11b
+
f4/80
+
标记巨噬细胞,cd11b
+
f4/80
+
ly6c
high
标记促炎型巨噬细胞,cd11b
+
f4/80
+
ly6clow标记抑炎型巨噬细胞。
60.如图6所示,术后第3天,saline组和glp
‑
2组小鼠心肌组织中中性粒细胞和巨噬细胞的比例均明显高于sham组,且glp
‑
2组小鼠心脏中中性粒细胞和巨噬细胞的比例明显低于saline组,提示替度鲁肽可显著减少中性粒细胞和巨噬细胞浸润的数量,进一步分析促炎型及抑炎型巨噬细胞的比例,结果发现:glp
‑
2组小鼠促炎型及抑炎型巨噬细胞的比例明显低于saline组。
61.实施例6替度鲁肽治疗显著改善心肌缺血再灌注后肠道菌群的紊乱
62.材料:小动物呼吸机、动物手术照明灯、气体麻醉系统购自上海玉研科学仪器有限
公司。手术用显微器械购自臻美医疗器械有限公司。4
‑
0/7
‑
0缝合线购自宁波医用缝针有限公司。qiaamp dna stool mini kit购自qiagen公司。
63.粪便标本收集:将8周龄雄性c57bl/6小鼠随机分为假手术组(sham组)、生理盐水组(saline组)、替度鲁肽组(600μg/kg glp
‑
2组),sham组5只,saline组、glp
‑
2各6只。如上所述构建小鼠心肌缺血再灌注模型,假手术组仅用线穿过,不进行结扎。替度鲁肽组于再灌注后即刻皮下注射600μg/kg的耐dpp4降解的替度鲁肽,每天两次,连续注射3天。生理盐水组于相同的时间给予等体积的生理盐水。术后3天处死小鼠进行小鼠粪便标本取样。断颈处死小鼠,打开腹腔,无菌剪刀剪开小鼠末端回肠和盲肠,用无菌剪刀将已高温高压灭菌的1ml移液枪的蓝色枪头尖减掉,用1ml移液枪将末端回肠和盲肠的粪便吸入1.5ml无酶无菌冻存管,每份约200mg;随后立即将冻存管置于液氮中速冻,后置于
‑
80℃冰箱中保存备用。
64.粪便dna提取:采用商品化的试剂盒qiaamp dna stool mini kit提取小鼠粪便标本中的基因组dna,具体实验流程如下:(1)从
‑
80℃冰箱中取出备用的粪便标本,置于冰上,转移至实验台,将小鼠粪便标本从冻存管中转移至2ml的无菌无酶离心管中;(2)向离心管中加入1.6ml bufferasl;充分斡旋离心管直至样品完全混匀后离心,20000g/min,4℃,2min;(3)吸取1.2ml上清液,转移至另一2ml离心管,丢弃粪便沉渣。(4)向离心管中加入1片inhibitex药片,充分斡旋直至inhibitex药片完全溶解;将离心管于室温下静置孵育2分钟后于离心,20000g/min,4℃,5min;(5)将所有的上清液转移至新的1.5ml离心管中并离心,20000g/min,4℃,5min;(6)向一个新的2ml离心管中加入25μl proteinase k,并吸取步骤5中的样品上清液600μl至该离心管中;(7)向样品上清液与proteinase k的混合液中加入600μl bufferal,充分斡旋混匀后,将离心管于70℃水浴中孵育1小时;(8)再向离心管内加入600μl无水乙醇,充分斡旋混匀。(9)将600μl上述混合液加入到试剂盒中提供的旋转柱中离心,20000g/min,4℃,1min;将旋转柱放置于新的2ml收集管中,弃去含有滤液的管子。(10)再次向旋转柱中加入600μl无水乙醇,重复步骤9;(11)第二次洗涤结束后,重复步骤10共洗涤第三次;(12)三次洗涤结束后,向旋转柱中加入500μl预混好的buffer aw1;20000g/min 4度离心1分钟。将旋转柱置于新的收集管中,弃去含有滤液的管子。(13)向旋转柱中加入500μl预混好的bufferaw2中离心,20000g/min,4℃,4min;弃去含有滤液的管子;(14)将旋转柱放置于新的1.5ml离心管中;打开旋转柱盖子,吸取200μl bufferae直接滴加到膜上;关紧盖子并在室温下孵育1分钟;20000g/min 4度离心1分钟即可获得纯化的dna;(15)用qubit荧光仪及qubit fluorometer对样品浓度进行精准定量;illumuna miseq测序平台对于基因组dna的要求是:浓度≥5ng/μl,dna量≥30ng。
65.文库构建及测序:根据illumina高通量测序要求,进行双向测序,设计目标区域和带有“5’接头
‑
barcode
‑
测序引物
‑
特异引物
‑3’”
的融合引物。并采用两步pcr扩增的方法构建文库。本研究使用的测序平台为illumina miseq2500,测序类型为pe250引物序列如下:
66.f 5'
‑
aatgatacggcgaccaccgagatctacac
‑
67.tctttccctacacgacgctcttccgatct
‑
barcodef1
‑
特异引物
‑
3'
68.r 5'
‑
caagcagaagacggcatacgagat
‑
barcode r2
‑
69.gtgactggagttccttggcacccgagaattcca
‑
barcode r1
‑
特异引物
‑
3'
70.如图7所示saline组小鼠较sham组小鼠肠道中致病菌proteobacteria(变形杆菌门)
‑
gammaproteobacteria(变形杆菌纲)均显著增加,并伴随着肠道常驻菌bacilli(芽孢
杆菌纲)相对丰度显著减少,而glp
‑
2组proteobacteria(变形杆菌门)
‑
gammaproteobacteria(变形杆菌纲)均限制减少,提示菌群紊乱改善。
71.实施例7替度鲁肽治疗可显著抑制心肌缺血再灌注后的肠道菌群移位
72.材料:小动物呼吸机、动物手术照明灯、气体麻醉系统购自上海玉研科学仪器有限公司。手术用显微器械购自臻美医疗器械有限公司。4
‑
0/7
‑
0缝合线购自宁波医用缝针有限公司。
73.菌群移位检测:将8周龄雄性c57bl/6小鼠随机分为假手术组(sham组)、生理盐水组(saline组)、替度鲁肽组(600μg/kg glp
‑
2组),每组各4只。如上所述构建小鼠心肌缺血再灌注模型,假手术组仅用线穿过,不进行结扎。替度鲁肽组于再灌注后即刻皮下注射600μg/kg的耐dpp4降解的替度鲁肽,每天两次,连续注射3天。生理盐水组于相同的时间给予等体积的生理盐水。术后第三天,用5
×
109菌落形成单位的生物荧光素标记的柠檬酸杆菌灌胃,6h后分别处死小鼠,无菌状况下取血液、肠系膜淋巴结、脾脏、心脏匀浆上清液进行铺板培养24小时后,利用ivis活体成像仪检测计数带荧光的菌落数以评估有无肠道菌群移位现象以及移位的菌群进入哪些脏器。
74.如图8所示,saline组小鼠血液、肠系膜淋巴结、脾脏、心脏组织中均可见到细菌菌落,glp
‑
2组小鼠血液、肠系膜淋巴结、脾脏、心脏组织中的菌落数较saline组明显减少,提示替度鲁肽治疗可有效减轻心肌缺血再灌注后肠道菌群移位。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1