蜂王浆分离液发酵物、含其皮肤外用剂及制备方法和应用与流程
1.本发明属于发酵技术领域,尤其涉及一种蜂王浆分离液发酵物、含其皮肤外用剂及制备方法和应用。
背景技术:
2.蜂王浆是工蜂食用蜂蜜和蜂花粉之后由喉咙分泌的乳状物质,是完全由蜜蜂自身分泌的。蜂王浆中含有丰富的蛋白质,例如,蜂王浆中含有大量的王浆主蛋白,因其具有可促进细胞生长、抗肿瘤和抗菌等多重功效,使其备受关注,成为研究热点。目前,我国已利用蜂王浆中的王浆主蛋白开发生产功能饮料。从蜂王浆中提取出王浆主蛋白后,会产生大量的蜂王浆分离液。蜂王浆分离液呈透明的绿色或者黄绿色,其中含有大量的有机酸、维生素、氨基酸和多肽等多种丰富的营养物质和活性成分,但其一般会被当作废弃物而遗弃,利用率低,导致资源浪费。
3.目前,皮肤外用剂领域常用的活性物质提取方法有水提取法、有机溶剂提取法、超声波提取法、微波提取法、超临界流体萃取法和微生物发酵法等。面对如此众多的提取方法,如何筛选出更利于从蜂王浆分离液中提取可用于皮肤外用剂领域的活性物质的方法,实现资源的最大利用度,仍是本领域研发人员面临的技术难题。
4.因此,本领域亟需开发一种适用于从蜂王浆分离液中提取可用于皮肤外用剂领域的活性成分的提取方法,实现变肥为宝,提高蜂王浆分离液的利用度。
技术实现要素:
5.本发明所要解决的技术问题是克服现有技术中蜂王浆分离液常被当作废弃物而遗弃,利用度低,且现有提取工艺众多,很难筛选出更利于从蜂王浆分离液中提取可用于皮肤外用剂领域的活性成分的方法等缺陷,而提供一种蜂王浆分离液发酵物、含其皮肤外用剂及制备方法和应用。本发明制得的蜂王浆分离液发酵物具有良好的抗氧化和抗炎功效,对人体皮肤成纤维细胞具有促进生长的作用,安全性高,不刺激皮肤,制备工艺简单,制备成本低,可被广泛应用于皮肤外用剂领域。
6.本发明采用以下技术方案解决上述技术问题:
7.本发明提供一种蜂王浆分离液发酵物的制备方法,具体包括如下步骤:乳酸菌接种到发酵底物中,经发酵培养,灭菌,即可;其中,所述发酵底物中包括蜂王浆分离液,所述蜂王浆分离液为新鲜蜂王浆去除蛋白质成分后制得的物料。
8.一些实施例中,所述乳酸菌可包括嗜热链球菌和/或乳杆菌。
9.其中,所述乳杆菌可包括鼠李糖乳杆菌(lactobacillus rhamnosus)、保加利亚乳杆菌(lactobacillus bulgaricus)和约氏乳杆菌(lactobacillus johnsonii)中的任意一种或多种。
10.其中,所述鼠李糖乳杆菌可包括郑州和合生物工程技术有限公司生产的菌株编号为pb
‑
lr76的鼠李糖乳杆菌。
11.其中,所述约氏乳杆菌可包括郑州和合生物工程技术有限公司生产的菌株编号为lbj 456的约氏乳杆菌。
12.其中,保加利亚乳杆菌可包括宁波明舟生物科技有限公司生产的产品编号为bmz124644的保加利亚乳杆菌。
13.其中,所述嗜热链球菌可包括宁波明舟生物科技有限公司生产的产品编号为bmz132094的嗜热链球菌。
14.一较佳实施方案中,所述乳酸菌为所述嗜热链球菌和所述保加利亚乳杆菌的混合菌株、所述鼠李糖乳杆菌或所述约氏乳杆菌。
15.当所述乳酸菌为所述嗜热链球菌和所述保加利亚乳杆菌的混合菌株时,所述嗜热链球菌和所述保加利亚乳杆菌的个数比可为(1~3):1。
16.一些实施例中,所述乳酸菌可按照本领域常规以乳酸菌菌液的形式添加,所述乳酸菌菌液中所述乳酸菌的浓度可为106~108cfu/ml,较佳地为106~107cfu/ml。
17.其中,所述乳酸菌菌液与所述发酵底物的质量比可为本领域常规,较佳地为(1~5):100。
18.其中,所述乳酸菌菌液的制备方法可为本领域常规,具体包括如下步骤:所述乳酸菌接种于ph值为6.8~7.2的mrs肉汤培养基中,在温度为37~50℃条件下经发酵培养,即可。
19.一些实施例中,所述发酵底物在使用前还可进一步包括灭菌的操作。所述灭菌的条件和方法可为本领域常规,一般可为高压蒸汽灭菌法。
20.其中,当采用所述高压蒸汽灭菌法进行所述灭菌时,所述灭菌的温度可为本领域该类操作常规的温度,较佳地为90~100℃,更佳地为95~100℃。
21.其中,当采用所述高压蒸汽灭菌法进行所述灭菌时,所述灭菌的时间可为本领域该类操作常规的时间,较佳地为20~30min。
22.其中,当采用所述高压蒸汽灭菌法进行所述灭菌时,所述灭菌的压力可为本领域该类操作常规的压力,较佳地为0.09
‑
0.15mpa。
23.一些实施例中,所述蜂王浆分离液较佳地为艾蜂健康科技公司的蜂王浆小分子水液。
24.一些实施例中,所述蜂王浆分离液的制备方法可包括如下步骤:新鲜蜂王浆经水浸提,膜分离去除蛋白质,即可。
25.一些实施例中,所述蜂王浆分离液占所述发酵底物的质量百分数可为1%~3%,例如1.50%。
26.一些实施例中,所述发酵底物中还可进一步包括水。
27.一较佳实施例中,所述发酵底物由1wt%~3wt%的所述蜂王浆分离液和余量的水组成。
28.一些实施例中,所述发酵培养的时间可为本领域该类操作常规的时间,较佳地为10~15h,更佳地为13~15h。
29.一些实施例中,所述发酵培养的温度可为本领域该类操作常规的温度,较佳地为37~45℃,更佳地为37~43℃。
30.一些实施例中,所述灭菌的条件和方法可为本领域该类操作常规的条件和方法,
一般可为高压蒸汽灭菌法。
31.其中,当采用所述高压蒸汽灭菌法进行所述灭菌时,所述灭菌的温度可为本领域该类操作常规的温度,较佳地为90~100℃,更佳地为95~100℃。
32.其中,当采用所述高压蒸汽灭菌法进行所述灭菌时,所述灭菌的时间可为本领域该类操作常规的时间,较佳地为20~30min。
33.其中,当采用所述高压蒸汽灭菌法进行所述灭菌时,所述灭菌的压力可为本领域该类操作常规的压力,较佳地为0.09~0.15mpa。
34.一些实施例中,所述灭菌的操作后,还可进一步包括过滤、二次灭菌和与防腐剂混合中任意一种或多种的操作。
35.其中,所述过滤可按照本领域常规在过滤器中进行。所述过滤器的孔径大小可为本领域常规,一般可为0.4~0.6μm,较佳地为0.45μm。
36.其中,所述二次灭菌的条件和方法可为本领域该类操作常规的条件和方法,一般可为高压蒸汽灭菌法。
37.其中,当采用所述高压蒸汽灭菌法进行所述二次灭菌时,所述二次灭菌的温度可为本领域该类操作常规的温度,较佳地为90~100℃,更佳地为95~100℃。
38.其中,当采用所述高压蒸汽灭菌法进行所述二次灭菌时,所述二次灭菌的时间可为本领域该类操作常规的时间,较佳地为20~30min。
39.其中,当采用所述高压蒸汽灭菌法进行所述二次灭菌时,所述二次灭菌的压力可为本领域该类操作常规的压力,较佳地为0.09~0.15mpa。
40.其中,与所述防腐剂混合的过程中,所述混合的温度可为本领域该类操作常规的温度,较佳地为65~80℃,更佳地为75~80℃。
41.其中,所述防腐剂的种类可为本领域常规,较佳地包括1,2
‑
己二醇和/或对羟基苯乙酮。
42.当所述防腐剂包括对羟基苯乙酮和1,2
‑
己二醇时,所述对羟基苯乙酮占所述灭菌后制得物料的质量百分数可为0.3%
‑
0.5%,所述1,2
‑
己二醇占所述灭菌后制得物料的质量百分数可为0.5%
‑
1%;较佳地,所述对羟基苯乙酮占所述灭菌后制得物料的质量百分数为0.5%,所述1,2
‑
己二醇占所述灭菌后制得物料的质量百分数为0.5%。
43.本发明还提供一种蜂王浆分离液发酵物,其由如上所述的蜂王浆分离液发酵物的制备方法制得。
44.本发明还提供一种如上所述的蜂王浆分离液发酵物作为产品、产品添加剂或产品基底在制备皮肤外用剂中的应用。
45.一些实施例中,所述蜂王浆分离液发酵物可作为所述皮肤外用剂中的抗氧化活性成分和/或抗炎活性成分。
46.其中,所述抗氧化活性成分可为具有dpph自由基清除能力的抗氧化活性成分。
47.其中,所述抗炎活性成分可为具有抑制klk7炎症因子和/或il
‑
1炎症因子表达的抗炎活性成分。
48.本发明还提供一种皮肤外用剂,其包括如上所述的蜂王浆分离液发酵物。
49.一些实施例中,所述皮肤外用剂可按照本领域常规包括且不限于面膜、精华或爽肤水。
50.一些实施例中,所述蜂王浆分离液发酵物占所述皮肤外用剂的质量百分比可为5%~100%,较佳地为50%~100%。
51.一些实施例中,所述皮肤外用剂中还可进一步包括保湿活性成分、美白活性成分、抗炎活性成分、抗敏活性成分和抗氧化活性成分中的任意一种或多种。
52.在符合本领域常识的基础上,上述各优选条件,可任意组合,即得本发明各较佳实例。
53.本发明所用试剂和原料均市售可得。
54.本发明的积极进步效果在于:本发明制得的蜂王浆分离液发酵物具有良好的抗氧化功效和抗炎功效,蜂王浆分离液发酵物对人体皮肤成纤维细胞具有促进生长的作用,安全性高,不刺激皮肤,制备工艺简单,制备成本低,可以作为皮肤外用剂的优良原料或直接用作皮肤外用剂。
附图说明
55.本公开可以通过参考下文中结合附图所给出的描述而得到更好的理解。所述附图连同下面的详细说明一起包含在本说明书中并且形成本说明书的一部分,而且用来进一步举例说明本公开的优选实施例和解释本公开的原理和优点。其中:
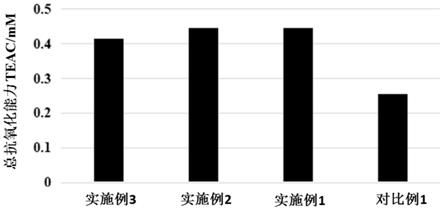
56.图1为实施例1~3和对比例1制得产品的总抗氧化能力对比图;
57.图2为实施例1~3和对比例1制得产品的dpph自由基清除能力对比图;
58.图3为实施例3制得的产品、空白对照组和模型组分别处理hacat细胞后,hacat细胞中klk7炎症因子释放水平对比图;
59.图4为实施例3制得产品、空白对照组和模型组分别处理hacat细胞后,hacat细胞中il
‑
1炎症因子释放水平对比图;
60.图5为采用不同浓度实施例3制得产品处理人体皮肤成纤维细胞后,细胞存活率结果图。
具体实施方式
61.下面通过实施例的方式进一步说明本发明,但并不因此将本发明限制在所述的实施例范围之中。下列实施例中未注明具体条件的实验方法,按照常规方法和条件,或按照商品说明书选择。
62.在下文中将结合附图对本公开的示范性实施例进行描述。
63.下述实施例中所使用的实验方法如无特殊说明,均为常规方法。
64.下述实施例中,乳酸菌1为郑州和合生物工程技术有限公司生产的鼠李糖乳杆菌(lactobacillus rhamnosus),菌株编号pb
‑
lr76;
65.下述实施例中,乳酸菌2为郑州和合生物工程技术有限公司生产的约氏乳杆菌(lactobacillus johnsonii),菌株编号lbj 456;
66.下述实施例中,乳酸菌3为宁波明舟生物科技有限公司生产的产品编号为bmz132094的嗜热链球菌(streptococcus thermophilus)和产品编号为bmz124644的保加利亚乳杆菌(lactobacillus bulgaricus)的混合菌株,嗜热链球菌和保加利亚乳杆菌的个数比为1:1;
67.下述实施例中,蜂王浆分离液可为艾蜂健康科技公司的蜂王浆小分子水液,其制备工艺为新鲜蜂王浆经水浸提,三次膜分离,去除蛋白质,即可。
68.下述实施例中,mrs肉汤培养基配方为:肉汁10g,蛋白胨5g,酵母粉3g,d(+)
‑
葡萄糖5g,淀粉1g,nacl 5g,naac 3g,l
‑
半胱氨酸盐酸盐0.5g,蒸馏水1.0l;mrs肉汤固体培养基为mrs肉汤液体培养基中添加琼脂粉,琼脂粉占mrs肉汤液体培养基的质量百分比为1%。
69.下述实施例中乳酸菌1菌液的制备方法包括如下步骤:
70.(1)菌种的活化:将乳酸菌1接种于mrs肉汤固体培养基中进行划线活化,于43℃培养箱中培养48h,获得单菌落;
71.(2)菌种的扩大培养:将步骤(1)获得的单菌落接种至100ml,ph值为7的mrs肉汤液体培养基中,在43℃培养箱中培养48h,得到乳酸菌1菌液,浓度为107cfu/ml。
72.乳酸菌2菌液的制备方法同乳酸菌1菌液,区别仅在于接种的菌种分别为乳酸菌2。
73.乳酸菌3菌液的制备方法同乳酸菌1菌液,区别仅在于接种的菌种分别为乳酸菌3,培养温度为37℃。
74.实施例1
75.发酵底物的制备方法包括如下步骤:取适量蜂王浆分离液加入水中,在温度为95℃,压力为0.09mpa的条件下灭菌30min,得到蜂王浆分离液发酵底物;蜂王浆分离液发酵底物中蜂王浆分离液和水的质量比为1:100;
76.以上述方法制得的浓度为107cfu/ml的鼠李糖乳杆菌菌液和蜂王浆分离液发酵底物为原料,制备蜂王浆分离液发酵物,具体包括如下步骤:将3g乳酸菌菌液接种到300g蜂王浆分离液发酵底物中,在温度为43℃,且搅拌的条件下发酵培养15h;对制得的物料进行灭菌处理,灭菌的温度为95℃,压力为0.09mpa,时间为30min;灭菌后转移到孔径为0.45μm的过滤器中进行过滤,再于95℃,压力为0.09mpa的条件下进行二次灭菌30min;二次灭菌后,降温,在75℃条件下与防腐剂混合,防腐剂中包括1,2
‑
己二醇和对羟基苯乙酮,对羟基苯乙酮占灭菌后制得物料的质量百分数为0.5%,1,2
‑
己二醇占灭菌后制得物料的质量百分数为0.5%,制得蜂王浆分离液发酵物。
77.实施例2
78.与实施例1相比,区别仅在于将乳酸菌1菌液替换为乳酸菌2菌液,其他条件参数同实施例1,制得蜂王浆分离液发酵物。
79.实施例3
80.与实施例1相比,区别仅在于将乳酸菌1菌液替换为等量的乳酸菌3菌液,发酵培养温度为37℃,其他条件参数同实施例1,制得蜂王浆分离液发酵物。
81.对比例1
82.取适量蜂王浆分离液加入水中,在95℃,压力为0.09mpa条件下灭菌30min,灭菌后转移到孔径为0.45μm的过滤器中进行过滤,再于温度为95℃,压力为0.09mpa的条件下进行二次灭菌30min;二次灭菌后,降温,得到蜂王浆分离液发酵底物;蜂王浆分离液发酵底物中蜂王浆分离液和水的质量比为1:100。
83.效果实施例1总抗氧化能力
84.将对比例1制得的产品及上述实施例1~3制得的蜂王浆分离液发酵物分别稀释成体积百分比为50%的待测液。
85.以实施例1待测液为例,其配置方法包括如下:取150μl蜂王浆分离液发酵物,加pbs,配置成体积为300μl的实施例1待测液,即可。
86.先将200ul的abts与200ul氧化剂溶液制备abts工作母液,室温避光存放14小时后以pbs稀释40倍得到abts工作液。
87.标准曲线测定的准备:pbs稀释标准品,把10mm trolox标准溶液稀释成0.15、0.3、0.6、0.9、1.2和1.5mm。
88.96孔板的每个检测孔中加入200ul的abts工作液,空白对照孔中加入10ul的pbs溶液;标准曲线检测孔内加入10ul各种浓度的trolox标准溶液;样品检测孔内加入10ul实施例待测液,对照组加入10ul对比例1待测液,轻轻混匀。室温孵育4分钟后测定a734。根据标准曲线计算出样品的总抗氧化能力,结果见表1和图1。
89.所得的标准曲线为:y=
‑
0.6923x+0.456,r2=0.9993。
90.表1总抗氧化能力
[0091][0092]
结果显示,实施例1~3制得的蜂王浆分离液发酵物的总抗氧化能力显著强于对比例1。实施例1~3制得的蜂王浆分离液发酵物的总抗氧化能力相差不大。
[0093]
效果实施例2dpph自由基清除能力
[0094]
将对比例1制得的产品及上述实施例1、实施例2、实施例3制得的蜂王浆分离液发酵物分别稀释成体积百分比为50%的待测液。
[0095]
以实施例1待测液为例,其配置方法包括如下:取1.5ml蜂王浆分离液发酵物,加水,配置成体积为3ml的实施例1待测液,即可。
[0096]
先将20mg dpph溶解于250ml无水乙醇中,0
‑
4℃下避光保存。
[0097]
每个管中加入dpph乙醇溶液3ml,对照管中加入等体积的水(a1),样品管中加入等体积的实施例待测液(a2),空白对照中加入3ml的水与等体积的实施例待测液(a3)。
[0098]
反应30min后,于517nm波长下测定各管吸光值,并计算dpph自由基清除率。dpph自由基清除率计算公式如下:dpph自由基清除率=[(a1+a3)
‑
a2]/a1
×
100%
×
稀释倍数,本效果实施例中,稀释倍数为2。结果见表2和图2。
[0099]
表2 dpph自由基清除能力
[0100][0101]
从表2和图2结果可以看出,实施例1~3制得的蜂王浆分离液发酵物的dpph自由基
清除能力明显强于对比例1。其中,实施例3制得的蜂王浆分离液发酵物的dpph自由基清除率(70.13%)是对比例1制得产品的dpph自由基清除率的2.3倍。与实施例1和实施例2相比,实施例3制得的蜂王浆分离液发酵物的dpph自由基清除效果更佳。
[0102]
效果实施例3多肽含量测定
[0103]
对实施例1~3和对比例1制得的产品中多肽含量进行测定,测试方法参见文献“王倩,张佳婵,王昌涛,等;碳氮比对真菌发酵桑枝
‑
黃豆的活性成分和抗氧化能力的影响[j].食品工业科技,2019,40(02):93
‑
99”,结果见表3。
[0104]
表3
[0105][0106]
效果实施例4人体斑贴试验
[0107]
人体斑贴试验主要是用于检测化妆品终产品或原料的刺激性。根据《化妆品卫生规范》(2015)对实施例1
‑
3制得的蜂王浆分离液发酵物进行人体封闭式斑贴试验,旨在对其皮肤刺激性进行评估。
[0108]
1、试验对象:
[0109]
严格按照《化妆品接触性皮炎诊断标准及处理原则》要求,选择受试对象,皮肤的待测部位出现瘢痕、鲜红斑痣等影响结果判定的受试者、体质高度敏感者均不能参与试验。本试验选择合适的志愿者30人,年龄范围在18
‑
60岁随机选择。
[0110]
2、实验方法
[0111]
分别将0.02ml上述实施例1
‑
3制得的产品滴加在滤纸片上,再将滤纸片置于斑试器内。测试周期持续24h。为了试验结果的准确、可信和科学,在测试期间志愿者按照要求,不能摘掉斑试器,亦不可使受试部位接触水。24h后去除斑试器,静置30min后,等待压痕消失,观察皮肤的反应,接着于24h后观察皮肤的反应。体斑贴试验皮肤不良反应分级标准参见表4。
[0112]
表4皮肤不良反应分级标准
[0113][0114]
3、试验结果
[0115]
结果参见表5,从表中可以看出;实施例1
‑
3得到的蜂王浆分离液发酵物试敏结果都是阴性反应,说明实施例1
‑
3制得的蜂王浆分离液发酵物具有安全性,不会给人体带来不良反应。
[0116]
表5
[0117][0118][0119]
效果实施例5
[0120]
取对数期hacat细胞(人类永生化表皮细胞),以2
×
106个/ml的密度将细胞悬浊液接种于6孔细胞培养板上,每孔加入1ml细胞悬液,孵箱培养24h,小心吸去上清;
[0121]
空白组和模型组分别加入1ml dmem溶液;实施例组加入1ml实施例3制得的蜂王浆分离液发酵物稀释1000倍的待测液;
[0122]
加入后,继续培养6h,模型组和实施例组均采用紫外光(uva)照射,光照功率为9j/cm2,照射时间1.5h,空白对照组不光照。光照后继续培养24h,每组样品重复3个平行,每个
平行样品检测3次。处理细胞,收集细胞裂解液,具体为破碎细胞,在10000r/min,4℃条件下离心10min,取上清,得到细胞裂解上清液。取20μl细胞裂解液用bca试剂盒检测样品中的总蛋白含量;
[0123]
测试空白对照组、模型组和实施例组中klk1炎症因子和il
‑
1炎症因子的释放水平;
[0124]
测试方法:klk1炎症因子的测定按照elisa试剂盒说明书进行实验操作后,于450nm处测定各od值,根据od值,计算klk1炎症因子释放水平,klk1炎症因子的释放量需要bca含量校正,通过下述公式计算得到klk1炎症因子的相对表达量,结果见表6和图3;il
‑
1炎症因子采用elisa试剂盒进行测定,方法同klk1炎症因子,结果见表6和图4;
[0125]
炎症因子相对表达量=实验组炎症因子的表达量/空白对照组炎症因子的表达量。
[0126]
表6
[0127][0128]
结果表明,实施例3制得的蜂王浆分离液发酵物可有效抑制klk7炎症因子和il
‑
1炎症因子的表达量,具有理想的抗菌性能。
[0129]
效果实施例6
[0130]
本实验采用人体皮肤成纤维细胞,来自中国科学细胞库,验证上述实施例3制得蜂王浆分离液发酵物的细胞毒性。
[0131]
1、实验步骤:
[0132]
将上述实施例3制得的蜂王浆分离液发酵物用无血清的dmem培养基配置成体积百分数为40%、20%、10%、5%、2.5%、1.25%、0.625%和0.3125%的实验组待测液。
[0133]
人体皮肤成纤维细胞养于含10%胎牛血清以及1%双抗(1
×
105u/l青霉素、100mg/l链霉素)的dmem培养基中。细胞生长于37℃、5%co2饱和湿度的培养箱中,当细胞融合达到85%以上时,以0.05%胰酶消化对数生长期细胞,用含血清的dmem终止消化反应。细胞计数板计数,将细胞悬液浓度调整到7
×
104个/ml,将细胞悬液按照每孔100μl的比例接种到96孔板上,37℃、5%co2条件下孵育12h。
[0134]
去除旧培养液,用磷酸盐缓冲液清洗细胞两遍。实验组中每孔加入100μl上述配置的已过滤除菌的不同浓度的实验组待测液,每个待测液做6个复孔;对照组含有细胞,加入无血清的dmem培养基;空白对照组无细胞,加入100μl的pbs。再于37℃、5%co2条件下孵育24h。然后每孔加入10μl的cck
‑
8溶液,再孵育3h,在450nm波长下测定吸光度值。
[0135]
细胞存活率的计算公式如下:
[0136]
细胞存活率(%)=(a
实验组
‑
a
空白对照组
)/(a
对照组
‑
a
空白对照组
)
×
100%;
[0137]
实验结果见表7和图5,结果表明,实施例3制得的蜂王浆分离液发酵物不仅对人成
纤维细胞无明显毒性,而且对人体皮肤成纤维细胞的生长有促进作用。
[0138]
表7
[0139][0140][0141]
最后,还需要说明的是,在本发明中术语“包括”、“包含”或者其任何其他变体意在涵盖非排他性的包含,从而使得包括一系列要素的过程、方法、物品或者设备不仅包括那些要素,而且还包括没有明确列出的其他要素,或者是还包括为这种过程、方法、物品或者设备所固有的要素。
[0142]
尽管上面已经通过本公开的具体实施例的描述对本公开进行了披露,但是,应该理解,本领域技术人员可在所附方案的精神和范围内设计对本公开的各种修改、改进或者等同物。这些修改、改进或者等同物也应当被认为包括在本公开所要求保护的范围内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1