一种休眠检测调控集成化植入式柔性神经电极及测试系统
1.本发明涉及生物传感器的微加工领域,纳米材料修饰的电化学领域和神经信息检测领 域,具体涉及一种休眠检测调控集成化植入式柔性神经电极及测试系统。
背景技术:
2.据已有的研究表明gaba能、谷氨酸能神经元在休眠中起到了重要作用。目前神经元 常用的调控手段有药物调控,但限制在实验鼠麻醉状态下使用,并且硬性的注射针管对脑损 伤较大。另外,在长期植入情况下,常规的硅基微纳电极阵列因与脑组织杨氏模量即刚度不 匹配,易引发脑内炎症反应,进而会带来电极的检测性能下降或电极脱落等不利影响。相较 于此,植入式柔性神经电极阵列更为优选,但是植入式柔性电极阵列由于其自身的柔软性, 导致其植入时需要辅助工具,而常规的方式容易造成植入移位,无法保证准确的植入位置; 或因辅助工具过大对脑组织损伤过大,反而不易进行信号检测等等。除此之外,研究休眠的 实验鼠行动敏捷,活动过程中易于产生信号干扰,对实验结果影响极大,所以非常需要针对 其制定特殊的测试系统便于长期调控和检测。
3.综上存在的问题,研制一种针对休眠的集成化植入式柔性神经电极阵列及其测试系统用 于神经电生理和神经电化学检测和调控,它所具备的高密度、灵活性、小损伤等特点,都对 休眠机制的探索研究具有重要意义。
技术实现要素:
4.有鉴于此,本发明的目的在于提出一种休眠检测调控集成化植入式柔性神经电极,即使 用模具结合peg进行在体植入,使用fpc接口与柔性药管进行集成化封装,再通过搭建适 合实验鼠长期在体的休眠调控与测试系统,以期至少部分地解决上述提及的技术问题的至少 之一。
5.为实现上述目的,本发明的技术方案为:一种休眠检测调控集成化植入式柔性神经电极, 包括微电极阵列,引线,焊盘;
6.所述微电极阵列通过引线与长方形的焊盘连接,每根引线对应一个焊盘;所述的神经电 极的焊盘由fpc接口引出;
7.微电极阵列的每个电极的针头上分布有多个检测位点,且每两个相邻检测位点的位点间 直线距离d,满足神经元在脑中的排布方式又满足检测位点的2倍宽电学要求;
8.所述的检测位点包括神经电生理检测位点和神经电化学检测位点。
9.进一步的,所述微电极阵列上包含2
×
8个圆形的神经电生理检测位点,2个矩形的神经 电化学检测位点;所有神经电生理检测位点构成2
×
8微电极阵列,分布在2根探针的针头上, 每根探针的针头上有8个神经电生理检测位点和1个神经电化学检测位点,检测位点间的直 线距离为70μm。
10.进一步的,所述柔性神经电极的微电极阵列的每个电极依次包括:
11.绝缘层,覆盖引线,暴露微电极阵列和焊盘;
12.微电极阵列导电层,所述微电极阵列包括18个检测位点;其中18个检测位点分2组以 针形状分布于休眠相关的双脑区,用于检测下丘脑(背侧核与弓状核)的神经电生理和电化 学信号;
13.柔性基底层,作为植入式柔性神经电极阵列的载体;
14.可溶性增强层,由peg蔗糖组成,与植入式柔性神经阵列背面粘合;
15.采用绝缘硅胶,将fpc板电极的位置与柔性药管封装在一起;
16.进一步的,所述的柔性基底层,包括聚二甲苯(parylene)材料,优选厚度为19μm;所 述的可溶性增强层,其特征在于,包括聚乙二醇(peg),蔗糖。
17.进一步的,所述的微电极阵列导电层,包括检测位点,所述电生理检测位点直径包括 4
‑
20μm;所述电化学检测位点大小为16
×
28μm;所述焊盘为2950
×
300μm;所述引线为4μm, 相邻两根引线间距8μm及以上;所述分布特点包含检测位点的尖端分布范围形似针状,宽 度为51
‑
120μm,长度为134
‑
314μm,相邻两个检测位点之间的直线间隔为30
‑
70μm,满足不 相互干扰的2倍间距排布要求;所述电生理检测位点和电化学检测位点分布在两根检测探针 上,且两根检测探针水平间隔为200
‑
250μm。
18.进一步的,所述的绝缘层,覆盖所述引线,暴露所述电生理检测位点、电化学检测位点、 焊盘。
19.进一步的,所述的电生理检测位点和电化学检测位点,均采用铂黑纳米粒子和/或碳纳米 管纳米粒子等纳米材料修饰;电化学检测位点在纳米材料修饰的基础上用与神经递质对应的 氧化酶进行修饰。
20.根据本发明的另一方面,提出一种集成有前述的植入式柔性神经电极的休眠检测调控装 置,包括:柔性药管、fcb板,绝缘硅胶,以及柔性神经电极;
21.所述柔性药管的材质为弹性熔融毛细石英套管;
22.所述fcb板上安装有柔性神经电极,柔性神经电极上有柔性药管;柔性药管与柔性神 经电极上下间距小于预定间距,柔性药管与柔性神经电极之间由绝缘硅胶固定。
23.进一步的,所述植入式柔性神经电极通过fpc接口引出;所述弹性熔融毛细石英套管包 括内外直径为250
×
350μm的外管和内外直径为100
×
200μm的内管;所述弹性熔融毛细石英 套管通过绝缘硅胶与所述植入式柔性神经电极阵列粘合。
24.根据本发明的又一个方面,提出一种集成化植入式柔性神经电极的制备方法,包括以下 步骤:
25.采用气相沉积法,在硅片上蒸镀柔性基底层;
26.通过负胶光刻、电子束蒸发、剥离技术,在柔性基底层上制备金属导电层,金属导电层 材料优选金,并以铬作为粘附层;
27.在导电层上蒸镀柔性材料为绝缘层,通过正胶、等氧离子刻蚀,去除微电极阵列和焊盘 表面的绝缘层,仅保留覆盖引线的绝缘层;
28.使用su
‑
8光刻胶进行光刻显影,形成柔性基底刻蚀所需掩模,经氧离子刻蚀后形成柔 性基底探针轮廓;
29.去除光刻胶,使柔性微纳电极脱离硅片,得到完整的植入式柔性神经电极阵列;
30.采用模具浇铸法制备可溶性增强层,并将植入式柔性神经阵列与可溶性增强层粘贴。
31.根据本发明的另一方面,提出一种集成化植入式柔性神经电极的可溶性增强层制备方 法,包括以下步骤:
32.采用气相沉积法,在硅片上蒸镀柔性基底层;
33.通过光刻技术与氧等离子刻蚀技术,制作出与植入式柔性神经阵列轮廓大小一致的模具 凹槽;
34.将加热配置好的液体peg倒入模具凹槽中,静置降温硬化获得peg模具;
35.将植入式柔性神经阵列的背面(没有裸露位点的一面)通过蔗糖粘上模具peg。
36.根据本发明的另一方面,提出一种应用集成化植入式柔性神经电极的测试系统,包括:
37.集成化植入式柔性神经电极,用于长期在体检测和调控;
38.透明柱状休眠舱,直径30cm,高度40cm,在距离底部10cm高处设置水瓶;
39.休眠舱网盖,直径30cm,保证实验鼠活动及休眠空间的同时,其处于限定测试区域;
40.噪声屏蔽箱,长宽高分别为50
×
50
×
60cm,降低外界噪声干扰;
41.弹性牵引绳,长度60cm,用于悬吊数据线;
42.三脚支架,高度伸缩可调,用于控制弹性牵引绳。
43.进一步的,本发明使用微纳电极加工技术,由下至上依次形成柔性基底层、微电极阵列 导电层,绝缘层以及可溶性增强层;
44.每一层的形成均充分考虑植入式柔性神经电极阵列的设计情况,改进已有的工艺制备方 法,选用合适的光刻胶和mems工艺,直至获得实际可用、神经信号检测性能优选的植入 式柔性神经电极阵列;
45.采用模具浇铸法制备可溶性增强层,并将植入式柔性神经阵列与可溶性增强层粘合。
46.有益效果:
47.从上述技术方案可以看出,本发明相较于现有技术至少具有以下有益效果:
48.(1)本发明提供的植入式柔性神经电极阵列,parylene生物相容性好,并且采用较薄的 parylene作为基底,更加减少了电极对脑组织的损伤,满足实验鼠长期检测的需求;并且, 微电极阵列包括多个检测位点,且检测位点以针形形式排布,贴合待测脑区大小;
49.(2)微电极阵列具有包括直径4
‑
20μm在内的16个电生理检测位点和2个16
×
28μm的 电化学检测位点的微米级电极位点的阵列式排布,相邻两个检测位点之间的直线间隔可为 30
‑
70μm;较小的位点尺寸极大的提高了该脑区的神经信号检测能力,同时可做到高密度分 布,极大的提升了信噪比;
50.(3)微电极阵列直接植入下丘脑的背侧核和弓状核,同时记录神经信号的电生理活动 和神经递质变换的电化学信息,排除了中间组织对脑电活动记录的影响,提升灵敏度;
51.(4)柔性fcb与集成柔性药管封装的设计,可将注射药物调控与神经信号检测相结合, 可极大的提高实验效率;并且相较于传统的药物注射调控方式,该方法不受实验鼠状态的局 限,可根据实验情况需求,在实验鼠清醒状态下进行药物调控与同步检测,为神经实验研究 提供一种便利的方法;同时柔性电路板的采用,使得电极可以弯折成特定角度方
便当实验鼠 进入休眠后身体蜷缩时插拔;而且由于柔性材质,不易被实验鼠拔下电极,有利于长期监测;
52.(5)针对实验鼠行动敏捷不受控制设计的测试系统,既为实验鼠提供舒适的环境有利 于其进入休眠,又尽可能的不影响长期信号调控与检测;
53.(6)以上所有设计为研究休眠这一行为模式下的神经机制研究提供了新方法。
附图说明
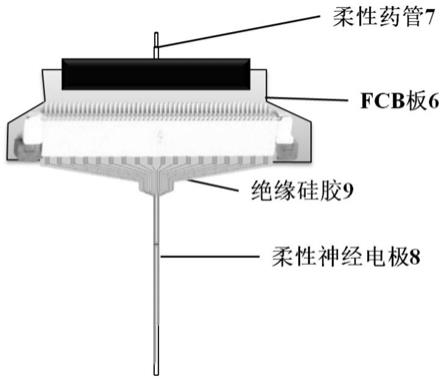
54.图1为本发明实施例的植入式柔性神经电极阵列结构示意图;
55.图2为本发明实施例的微电极阵列的局部放大示意图;
56.图3为本发明实施例的植入式柔性神经电极阵列制备方法的工艺流程图;
57.图4为本发明实施例的植入式柔性神经电极可溶性增强层的制作流程;
58.图5(a)为本发明实施例的集成柔性药管的神经电极阵列封装图的正面示意图,图5(b) 所示为集成柔性药管的神经电极阵列封装图的结构示意图。
59.图6为本发明实施例的实验鼠整体测试系统搭建示意图。
60.以上附图中,附图标记含义如下:
61.1、微电极阵列;2、引线;3、焊盘;4、神经电生理检测位点;5、神经电化学检测位 点;6、fpc板;7、药管;8、柔性神经电极;9、绝缘硅胶;10、噪声屏蔽箱;11、透明 柱状休眠舱;12、休眠舱网盖;13、三脚支架;14、弹性牵引绳。
具体实施方式
62.为使本发明的目的、技术方案和优点更加清楚明白,下面结合具体实施例,并参照附图, 对本发明作进一步的详细说明,但需要注意的是,下述的实施例仅用于说明本发明的技术方 案,但本发明并不限于此。
63.根据本发明的一个实施例,设计了一种休眠检测调控集成化植入式柔性神经电极及其测 试系统,能够用于航天员休眠旅行和“冷冻医疗”。多通道的位点设计,以实现精确检测下丘 脑背侧核和弓状核的实时电生理和电化学信号检测。由于parylene柔性材料的杨氏模量与大 脑的接近,柔韧性可提高电极的生物相容性,进而实现对实验鼠在体长期休眠态2
‑
3个月下 的神经状态监控。另一方面,通过微纳电极阵列获取到的神经信号可对其进行数据分析,获 取特征,从而研究休眠态下的实验鼠脑神经机制。除此之外,还可对某一核团进行电刺激或 药物调控,检测另一核团的神经信号变化,进而实现对实验鼠休眠态下的神经调控,本发明 可将调控与检测同步进行,有利于进一步研究该物种的休眠神经机制。
64.如图1、图2所示,图1所示为本发明提出的一种集成化植入式柔性神经电极结构示意 图,包括微电极阵列1,引线2,焊盘3;
65.所述微电极阵列1指针头处的阵列结构;所述微电极阵列1通过引线2与长方形的焊盘 3连接,每根引线对应一个焊盘。单个焊盘3尺寸为2950
×
300μm,焊盘间距为1mm,符合 fpc接口的标准尺寸。所述的神经电极的焊盘3可由fpc接口引出,再由设计好的接口电 路板与后端信号数据采集仪相连接。
66.神经电极的整体结构的宽度为13.0mm,两根探针长分别为10.0mm和13.0mm,探针
的 探测区域包括了实验鼠的关键脑区下丘脑背侧核和下丘脑弓状核,前端微电极阵列1部分的 宽度为126μm,长为313.5μm;针头上分布有多个检测位点,且每两个相邻检测位点的位点间 直线距离70μm,考虑到神经元在脑中的排布方式又满足位点的2倍宽电学要求。
67.所述的检测位点包括神经电生理检测位点4和神经电化学检测位点5;
68.如图1、图2所示,图2所示为微电极阵列的局部放大示意图。微电极阵列1上包含2
×
8 个圆形的神经电生理检测位点4,2个矩形的神经电化学检测位点5。所有神经电生理检测位 点4构成2
×
8微电极阵列,分布在2根探针的针头上,每根探针的针头上有8个神经电生理 检测位点4和1个神经电化学检测位点5,检测位点间的直线距离为70μm,此间隔选取既 可避免了检测位点及引线2中的导线间的相互串扰又可满足神经元胞体的分布间距大小。
69.图2的微电极阵列的局部放大示意图,其中示意了微电极阵列的检测位点排布方式及检 测位点的尺寸,包含了直径为4
‑
20μm的神经电生理检测位点4和1个16
×
28μm神经电化学 检测位点5。
70.神经元电化学检测位点5大小设计是为了方便区域性神经电化学检测;
71.神经电生理检测位点的位点4的直径相较以往工艺位点较小,工艺难度较大,但可提高 检测动作电位的灵敏性以及提高电极的分布密度,并且位点的排布范围涵盖重要脑区,能尽 可能多的探测到该脑区的神经电生理信号变化,极大的提高了植入式柔性神经电极阵列的性 能;联合神经电生理和神经电化学情况对休眠态下的神经元信号,采用聚类、ica、gan等 算法,对其作处理分析,以期推测休眠态下的神经机制。
72.本实施例中,植入式柔性神经电极阵列的具体制备过程参考图3,具体包括如下步骤:
73.1、在经表面清洁处理的硅片表面蒸镀parylene,获得一层19μm基底层(如图3中的(a) 所示);
74.2、在经氧等离子体清洁的热氧化层的硅片上旋涂反转光刻胶az5214,厚度为3μm;光 刻、显影后得到微电极阵列、引线及焊盘的结构图案。然后蒸发厚度为的cr(铬)种 子层,以增加au(金)导电薄膜层与parylene基底的粘附性,接着溅射的金薄膜层 (如图3中的(b)所示);
75.3、使用剥离工艺构建导电层将蒸发好金属层的硅片置于丙酮溶液中,在丙酮中溶解掉 光刻胶,进而可去除多余的cr/au薄膜层,留下所需微电极阵列、引线及焊盘(如图3中的 (c)所示);
76.4、在具备了导电层金属薄膜表面,蒸镀parylene,厚度2μm,作为电极的绝缘层(如 图3中的(d)所示);
77.5、在绝缘层表面旋涂正性光刻胶az4620进行第二次光刻,显影后暴露出电极位点(包 括检测位点和接地位点)和焊盘部分,保留引线部分的光刻胶(如图3中的(e)所示);
78.6、通过氧等离子体刻蚀工艺对暴露的电极位点和焊盘表面的parylene进行刻蚀,刻蚀 至在电极位点和焊盘部分可暴露出金属层,同时保留引线表面的parylene绝缘层(如图3中 的(f)所示);
79.7、在绝缘层表面旋涂负性光刻胶su
‑
8进行第三次光刻,显影后在电极表面留下光刻胶, 作为保护层(如图3中的(g)所示);
80.8、通过多次长时间的氧等离子体刻蚀工艺将基底层刻下来,露出电极的形状(如图3 中的(h)所示);
81.9、清洗掉硅片表面的su
‑
8光刻胶,并泡于水中,将植入式柔性神经微电极阵列彻底释 放下来(如图3中的(i)所示);
82.10、将电极连接至电化学工作站,通过电化学沉积的方式,将具有提高电极检测能力的 纳米粒子沉积到电极位点表面,得到高灵敏度的微电极阵列(如图3中的(j)所示)。
83.11、用电化学修饰的方式,将谷氨酸氧化酶修饰到用于神经电化学检测的位点上,获得 可检测谷氨酸浓度的柔性神经阵列电极(如图3中的(k))。
84.图4为本发明一个实施例的植入式柔性神经电极可溶性增强层的制作流程,包括如下步 骤。
85.1、在经表面清洁处理的硅片表面蒸镀parylene,获得一层25μm基底层(如图4中的(a) 所示);
86.2、在经氧等离子体清洁的热氧化层的硅片上旋涂正性光刻胶az4903,厚度为30μm; 经过光刻、显影后得到微纳电极的整体形状。(如图4中的(b)所示);
87.3、通过多次长时间的等氧离子体刻蚀工艺刻蚀掉15μm厚的电极形状,形成深度为15μm 的电极形状的凹糟(如图4中的(c)所示);
88.4、清洗掉光刻胶,烘干,将稀释加热后的peg倒入凹槽中(如图4(d)所示);
89.5、用美工刀划对着模具的形状划刻出电极轮廓,将做好的硅片泡入水中,静待模具脱 落,即可获得peg材料的可溶性增强层(如图4中的(e)所示);
90.6、将模具peg也就是可溶性增强层的一面涂抹上蔗糖(如图4中的(f)所示);
91.7、将柔性神经电极与peg模具对其粘和好,即可获得满足硬性植入的柔性神经电极。
92.图5(a)所示为集成柔性药管的神经电极阵列封装图的正面示意图,图5(b)所示为 集成柔性药管的神经电极阵列封装图的结构示意图。fcb板6上有柔性神经电极8,柔性神 经电极8上有柔性药管7。柔性药管7与柔性神经电极8的深度位置可根据实验需求确定, 柔性药管7与柔性神经电极8上下间距小于100μm,柔性药管7与柔性神经电极8之间由绝 缘硅胶9固定。
93.图6所示为本发明提出的适配实验鼠整体测试系统示意图,包括噪声屏蔽箱10、透明柱 状休眠舱11、休眠舱网盖12、三脚支架13、弹性牵引绳14。实验鼠埋植电极后置于透明柱 状休眠舱11中,与电极相连的数据线穿过休眠舱网盖12被弹性牵引绳14悬吊,弹性牵引 绳14于三脚支架13处固定,数据线与后端的数据检测仪器相连。透明柱状休眠舱11放置 在噪声屏蔽箱10中,透明柱状休眠舱11的下方有一个直径1cm的圆洞,用于放置饮水瓶。 休眠舱网盖12的设计既可给实验鼠提供活动空间,又可确保其处于限定测试区域。数据线 经过弹性牵引绳14和三脚支架13的悬吊后可避免实验鼠把数据线咬断,同时由于弹性牵引 绳14的可伸缩作用,也给实验鼠提供了舒适的活动空间。
94.本发明的神经电极可长期植入实验动物脑内休眠相关脑区,利用集成柔性药管设计可对 休眠态下的实验鼠在任意时刻场景下进行药物调控,且脑损伤较小,利用植入式柔性神经电 极可实时检测双脑区调控前后神经元电生理与神经递质电化学信号,与宏观休眠行为反应相 结合。
95.另外,在充分考虑实验鼠习性的前提下搭建测试系统并合理优化,旨在通过此技术手段 实现长期在体神经调控与检测,进而可推测在休眠状态下神经元的活动情况以及是否存在神 经触发等神经机制。
96.以上所述的具体实施例,对本发明的目的、技术方案和有益效果进行了进一步详细说明, 应理解的是,以上所述仅为本发明的具体实施例而已,并不用于限制本发明,凡在本发明的 精神和原则之内,所做的任何修改、等同替换、改进等,均应包含在本发明的保护范围之内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1