一种治疗嗜酸性哮喘的纳米给药系统及其制备方法与应用
1.本发明涉及纳米药物领域,尤其涉及一种治疗嗜酸性哮喘的纳米给药系统及其制备方法与应用。
背景技术:
2.嗜酸性哮喘是过敏性哮喘中多见的一类,在外周血和肺部甚至其他组织中嗜酸性粒细胞不仅数量增加,而且活性增强,细胞存活时间延长,其极端类型为嗜酸性肉芽肿性血管炎,简称egpa,严重威胁生命健康。哮喘病人肺组织中嗜酸性粒细胞和其他固有免疫细胞和适应性免疫细胞与上皮细胞的相互作用,通过自分泌或旁分泌的方式分泌大量的炎性细胞因子,比如il
‑
3、il
‑
4、il
‑
5、il
‑
9、il
‑
13、il
‑
25、il
‑
33粒
‑
巨噬细胞集落刺激因子(gm
‑
csf)和胸腺基质淋巴细胞生成素(tslp)等。而这些炎症因子又通过jak/stat的途径调节哮喘疾病中肺组织中嗜酸性粒细胞募集和存活、气道高反应性、粘液产生、免疫球蛋白类转换等病理效应的改变。
3.目前哮喘临床治疗主要采用糖皮质激素治疗或与长效β2受体激动剂和支气管扩张药联合应用。另一方面,基于炎症因子jak/stat信号通路产生了抗体和小分子抑制剂两种重要的靶向治疗策略,抗il
‑
4/
‑
5/
‑
13、抗il5r和抗tslp等生物制剂已被用于传统常用抗炎的糖皮质激素的补偿治疗。临床治疗时给药途径主要包括口服、雾化吸入和静脉注射。所有这些治疗方法都面临着胃部苛刻的酸性ph值、酶消化、跨越人体自然屏障比如血脑屏障、肠道屏障和气道屏障等挑战,导致许多药物的生物利用度被削弱降低。肺部给药有着居多的优势,比如肺部给药吸收表面积大、吸收部位血流丰富、可避免肝脏首过效应以及上皮屏障薄、膜通透性高等优点,治疗范围正在扩大。但呼吸道结构复杂,它既有由黏液层、纤毛细胞和紧密连接的气道上皮形成的机械屏障,又有不同免疫细胞参与应答的免疫屏障,药物的吸收仍受到大量因素影响。因此在采用肺部给药治疗肺部疾病的过程中,寻找一种克服气道屏障的合适药物投送方式显得尤为迫切。bio
‑
peg
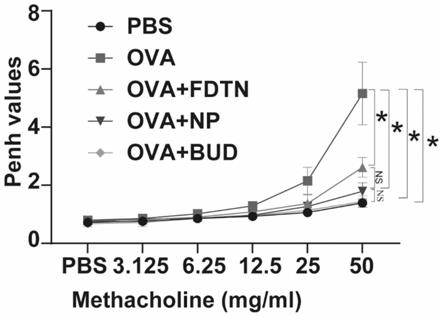
‑
tk
‑
plga是一种由亲水生物素化聚乙二醇(bio
‑
peg)、易被活性氧(ros)氧化断裂酮缩硫醇(tk)和聚乳酸(plga)聚合形成的高分子化合物,能够自组装成低毒性、稳定的和ros响应的纳米胶束,已被用于药物缓释载体。另外,纳米颗粒上修饰免疫球蛋白igg的fc片段,可靶向新生儿受体(fcrn),经fc/fcrn介导的细胞转运途径,在临床中开发用于药物的跨屏障递送。
4.长期吸入激素,可抑制肾上腺皮质和延缓儿童生长,易于产生依赖性,骨折、白内障风险增加,产生激素耐受。生物制剂成本高、给药周期长,而且哮喘发病机制中存在不同炎性通路的交叉和重叠,单一的抗体生物疗法完全成功仍存在疑问。一些脂溶的小分子抑制剂,在气道给药后存在小分子的自由扩散,且面临气道上皮形成的屏障等原因导致生物利用度降低。
技术实现要素:
5.本发明的目的在于克服现有技术的不足,提供一种治疗嗜酸性哮喘的纳米给药系
统及其制备方法与应用。本发明的纳米给药系统为内部核心装载疏水的fedratinib,外部修饰fc的纳米给药系统。该系统实现肺部跨气道屏障给药,延长药物在肺部的驻留时间,在肺部进行响应性缓慢释放,提高药物利用和疗效。
6.为实现上述目的,本发明采取的技术方案为:提供一种纳米给药系统,所述纳米给药系统为利用生物素化聚乙二醇
‑
酮缩硫醇
‑
聚乳酸
‑
羟基乙酸共聚物为基础材料,采用乳化法自组装合成载jak2抑制剂fedratinib的载药纳米颗粒,然后在纳米颗粒上修饰免疫球蛋白的fc片段得到。
7.本发明基于生物素化聚乙二醇(bio
‑
peg)
‑
酮缩硫醇(tk)
‑
聚乳酸
‑
羟基乙酸共聚物(plga)的共聚物(bio
‑
peg
‑
tk
‑
plga),采用乳化法自组装合成载jak2抑制剂fedratinib(fdtn)的纳米颗粒,通过生物素
‑
亲和素系统修饰免疫球蛋白g的fc片段,最终通过超滤、冷冻干燥得到ros响应
‑
fcrn靶向的微纳米给药系统。该系统实现肺部跨气道屏障给药,延长药物在肺部的驻留时间,在肺部进行响应性缓慢释放,提高药物利用和疗效。为嗜酸性哮喘及与之类似的肺部疾病治疗提供了一种新的载体及其制备方法。
8.作为本发明所述纳米给药系统的优选实施方式,所述免疫球蛋白为免疫球蛋白igg。
9.作为本发明所述纳米给药系统的优选实施方式,所述修饰为通过生物素
‑
亲和素系统进行修饰。
10.作为本发明所述纳米给药系统的优选实施方式,所述纳米给药系统最终通过超滤、冷冻干燥得到。
11.本发明同时提供所述纳米给药系统的制备方法,所述制备方法包括以下步骤:
12.s1.利用生物素化聚乙二醇
‑
酮缩硫醇
‑
聚乳酸
‑
羟基乙酸共聚物为基础材料,采用乳化法自组装合成载jak2抑制剂fedratinib的载药纳米颗粒;
13.s2.然后在纳米颗粒上修饰免疫球蛋白igg的fc片段;
14.s3.将纳米颗粒进行超滤、冷冻干燥得到所述纳米给药系统。
15.作为本发明所述制备方法的优选实施方式,步骤s1具体为:
16.s11.将生物素化聚乙二醇
‑
酮缩硫醇
‑
聚乳酸
‑
羟基乙酸共聚物和fedratinib溶于二氯甲烷中,溶解后超声处理制得初乳;
17.s12.将制得的初乳逐滴加入1%聚乙烯醇溶液中,同时搅拌溶液,待初乳滴完后,在搅拌下加入0.5%pva,继续搅拌挥发掉有机溶剂;
18.s13.将溶液离心收集上清,超滤收集超滤液,真空冷冻干燥得到载药纳米颗粒。
19.本发明还提供所述纳米给药系统在制备治疗肺部疾病药物中的应用。
20.作为本发明所述应用的优选实施方式,所述肺部疾病为嗜酸性哮喘。
21.本发明纳米给药系统具有以下特点:
22.(1)具有ros响应性。共聚物中嵌入的酮缩硫醇作为响应性片段,易被活性氧剪切断裂。当遇到环境中的活性氧ros,酮缩硫醇被ros剪切断裂,导致纳米颗粒的破裂,载于纳米颗粒疏水核心的药物则释放到微环境中,发挥药物的药理作用。
23.(2)溶酶体逃逸,fcrn靶向性。合成的纳米颗粒修饰上fc后,能靶向肺部气道上皮上的新生儿受体fcrn,通过fc/fcrn介导细胞内转导将纳米颗粒转运入肺。纳米给药系统借fc与肺部气道上皮膜上fcrn结合,形成内吞小泡,且被细胞内溶酶体识别为“自我”而忽略,
不发生溶解作用,从而实现胞内转运的溶酶体逃逸,提高药物的递送效率。
24.(3)药物被递送到肺部后,ros响应性缓慢释放。纳米颗粒修饰有fc,避免当作异物被降解和清楚,在炎症微环境驻留时间延长,提高生物利用度。
25.(4)纳米给药系统经气道给药,无需全身性途径给药,有效剂量大大降低,这不仅节约了药物成本,而且避免了全身性途径过量使用fdtn可能造成的各种不良反应等问题。
26.(5)本发明制备所需材料容易获得,均为fda批准可用于人体的生物材料,生物安全性良好。制备方法简单,不需特殊设备,易于生产。
附图说明
27.图1:载药纳米颗粒活性氧响应性释放。(a)和(b)透射电镜检测纳米颗粒在50mm h2o2在0小时和12小时的形态变化。(c)游离fdtn、空载纳米颗粒(nps)和载药fdtn(nps
‑
fdtn)纳米颗粒在50mm h2o2、100mm h2o2、2000mm h2o2在0
‑
108小时的累积释放率。(d)图为(c)图0
‑
12小时之间的变化图。
28.图2:共聚焦荧光显微镜z轴扫描结果。修饰fc的包载香豆素6纳米颗粒在16hbe细胞内从上到下未见红色荧光与绿色荧光共定位的橙色荧光,而绿色未修饰fc的包载香豆素6纳米颗粒与红色溶酶体发生共定位,有橙色荧光区域。
29.图3:纳米颗粒靶向气道上皮经皮转运动物示踪实验。(a)小鼠经ova和al(oh)3致敏与激发建立嗜酸性哮喘模型,行气道给药的方式分组给药载有绿色荧光香豆素6(coumarin6,cou6)的纳米颗粒(np(c6))和修饰fc的包载香豆素6纳米颗粒(np(c6)
‑
fc),各时间点取材检测示意图。(b)(np(c6))和(np(c6)
‑
fc)处理组肺组织切片0、2和4h荧光强度比较(n=3);(c)(np(c6)
‑
fc)处理组肺组织切片0
‑
48h荧光强度变化(n=3);(d)(np(c6))和(np(c6)
‑
fc)处理组肺组织切片0、2和4h荧光显微镜检测(*200倍);(e)(np(c6)
‑
fc)处理组肺组织切片0
‑
48h荧光显微镜检测(*200倍)。(注:n=3,***表示p<0.001)。
30.图4:肺组织病理结果。(a,c)各组非组织切片he染色和糖原染色(scale bar=100μm),(b)各组气道周围浸润炎症细胞分数(n=5);(d)各组气道糖原染色阳性细胞百分数(n=5)。(注:*表示p<0.05,**表示p<0.01,***表示p<0.001,ns表示无显著性差异)
31.图5:三组药物治疗后气道高反应明显降低。检测梯度浓度乙酰
‑
β
‑
甲基氯化胆碱激发小鼠呼吸间歇收缩指数(penh)来评估各处理组气道高反应性
32.图6:各组小鼠balf炎症细胞和肺组织炎症细胞及炎症因子水平变化。(a)各处理组肺泡灌洗液bal液细胞的嗜酸性粒细胞和嗜中性粒细胞流式分析(来自cd45
+
/cd11b
+
/cd11c
low
门);(b)肺泡灌洗液总细胞浓度;(c)肺泡灌洗液中性粒细胞浓度;(d)肺泡灌洗液嗜酸性粒细胞浓度;(e)肺组织嗜酸性粒细胞;(f)肺组织cd4
+
t细胞;(g)肺组织匀浆单细胞悬液t细胞胞内炎症因子(il
‑
4、il
‑
5、il10、il
‑
13、il
‑
17a和ifn
‑
γ)流式检测结果。(注:n=5,*表示p<0.05,**表示p<0.01,***表示p<0.001,ns表示无显著性差异)。
具体实施方式
33.为更清楚地表述本发明的技术方案,下面结合具体实施例进一步说明,但不能用于限制本发明,此仅是本发明的部分实施例。
34.本发明提供一种ros响应性
‑
fcrn靶向的纳米给药系统的制备方法及其应用。采用
双亲性聚乙二醇(peg)
‑
酮缩硫醇(tk)
‑
聚乳酸
‑
羟基乙酸(plga)共聚物为基础材料,和jak2抑制剂fedratinib通过“水包油”乳化法合成纳米载药颗粒,通过生物素
‑
亲和素系统修饰后免疫球蛋白fc片段,最终得到内部核心装载疏水的fdtn,外部修饰fc的纳米给药系统。制备的纳米颗粒粒径为98nm,包封率达84%。该给药系统是针对嗜酸性炎症环境ros响应的纳米颗粒,并在纳米颗粒上修饰fc,使其靶向气道上皮的fcrn,通过fc/fcrn介导的受体转运实现跨气道转运,将脂溶性fdtn递送到肺组织,在肺内炎症微环境ros存在下纳米胶束断裂,将fdtn释放出来发挥其生物效能。
35.通过动物实验证实本发明的生物活性纳米颗粒能有效地提高游离fdtn的生物利用度,使气道高反应性、balf炎症细胞总数、嗜酸性粒细胞数、气道周围炎症浸润、气道黏液的产生、肺组织炎症细胞因子水平以及血清ige水平更进一步降低,明显提高其缓解嗜酸性哮喘的能力,而且具备很好的生物安全性。本发明提供的纳米给药系统可有效实现肺部跨气道屏障给药,延长药物在肺部的驻留时间,在肺部进行响应性缓慢释放,提高药物利用和疗效。为嗜酸性哮喘及与之类似的肺部疾病治疗提供了一种新的载体及其制备方法。
36.实施例1:ros响应性载fdtn纳米颗粒的合成
37.①
修饰有生物素的聚乙二醇(peg)
‑
酮缩硫醇(tk)
‑
聚乳酸
‑
羟基乙酸(plga)共聚物(bio
‑
peg
‑
tk
‑
plga)(市售产品,购于西安瑞喜公司)与fedratinib(fdtn)(市售产品,购于medchemexpress,mce)采用“水包油”乳化法自组装合成纳米颗粒。准确称取10mg的bio
‑
peg
‑
tk
‑
plga共聚物和2mg的fdtn溶于1ml的二氯甲烷(dcm)中,溶解后使用细胞破碎仪在冰水环境下180w超声处理1min制得乳白色初乳。
38.②
将制得的初乳吸入2.5ml注射器中,取下针头,连上软管,安装到蠕动注射泵上,设置滴速为15ml/h,逐滴加入装有10ml的1%聚乙烯醇(pva)溶液的小烧杯中,烧杯中置小转子,设磁力搅拌转速为300r/min。待注射器初乳滴完后,于通风橱中在500r/min磁力搅拌作用下,加入10ml的0.5%pva,搅拌30min。降低转速至100r/min通风橱过夜挥发掉有机溶剂。
39.③
将溶液4℃,1200rpm离心10min,除去悬浮物等杂质,再4℃,10000rpm离心30分钟,收集上清,并记录体积待后续实验。加10ml去离子水重悬。
40.④
重悬后的乳液用10kd超滤管,4℃,4000rpm超滤15min,3次。收集超滤下液,记录体积。同时收集超滤液,重悬定容到4ml。
41.⑤
4ml超滤液于5ml试管内加盖先置于
‑
70℃低温冰箱冷冻2h后,去盖用薄膜封住管口,用针扎些小孔透气,置于冷冻真空干燥机内冷冻真空干燥过夜,次日观察为白色粉末,称量至恒重则为干燥完全,记录质量冷冻保存,所得粉末即为ros响应性载fdtn纳米颗粒。
42.⑥
考虑到后续评估纳米粒的生物学功能,需荧光示踪,按以上方法将香豆素6(coumarin6,cou6)载于胶束内制得绿色荧光纳米颗粒(np(c6))。
43.实施例2:合成fc修饰的载药纳米颗粒
44.①
用pbs配制2mg/ml亲和素和2mg/ml人源/鼠源生物素连接的免疫球蛋白igg的fc片段备用。
45.②
称2mg冻干载药(或载荧光)纳米材料,溶于200μl pbs,分别加200μl以上配制的亲和素和人源/鼠源生物素连接的免疫球蛋白fc片段,置于小平底试管,加小号磁力搅拌,
低速(100r/min)室温混匀30min(若合成载荧光纳米颗粒则避光)。
46.③
混悬溶液转移至离心管,4℃,12000rpm离心30min,去游离亲和素和fc的上清后加去离子水重悬到5ml,用10kd超滤管4℃,4000rpm超滤15min,收集超滤上液,重悬至500μl,即获得fc修饰的载药纳米颗粒。
47.实验1:体外ros响应释药实验
48.(1)取100μl载药纳米超滤乳液(nps
‑
fdtn)分散于50mm的h2o2中,于0h和12h,制样透射电镜检测形态变化。
49.(2)分别取原药fdtn(0.15mg/ml)、载药纳米超滤乳液(nps
‑
fdtn)和空载纳米超滤乳液(nps)2mg,分别分散在1ml用含15%无水乙醇ph=7.24的pbs配制的不同浓度h2o2溶液(0mm、50mm、100mm和200mm)中,置于截留量为8k的透析袋。将透析袋分别置于装有4ml含有15%无水乙醇的pbs的离心管中。将离心管置于温度为37℃,转速为100r/min恒温培养箱。分别在不同时间点取样1ml后,补充加入1ml相同的含有15%无水乙醇的pbs,继续恒温震荡。取样完成后对样品进行吸光度检测,测定各组释放出的fdtn的浓度,计算药物累积释放率。
50.透射电镜检测结果显示孵育前纳米颗粒呈独立单个的小球状,与50mm h2o2共孵育12h后,纳米颗粒出现明显断裂情况,部分形成融合的长链状(图1
‑
a、b)。另外,随着时间的延长,fdtn的释放增加,在前12小时释放迅速,后期相对平缓,而且h2o2浓度越大,释放的效率越高。单独的np在没有h2o2的情况下,也存在一定的自我释放,但释放效率较低,最大累计约30%,这也与纳米合成材料的来源时可降解的pea和plga相符合(图1
‑
c、d)。因此实验结果证明合成的载药纳米颗粒在活性氧环境下能响应性释放出所载的药物。
51.实验2:fc修饰的载药纳米颗粒细胞摄取与溶酶体逃逸
52.采用16hbe细胞与载有绿色荧光香豆素6(coumarin6,cou6)的纳米颗粒(np(c6))和修饰fc的包载香豆素6纳米颗粒(np(c6)
‑
fc)共培养,用共聚焦显微镜观察细胞内荧光纳米颗粒的内吞情况。蓝色染料dapi染细胞核,红色荧光溶酶体探针染胞质中的溶酶体。可清楚的发现np(c6)
‑
fc分布于胞质内,即说明纳米粒子被细胞摄取入内。共聚焦显微镜的z轴扫描发现np(c6)
‑
fc处理的16hbe细胞,绿色的纳米粒子分布在胞质内,红色荧光代表溶酶体在胞质中的分布,整个图片内未发现红色与绿色共定位的橙红色信号出现,证明np(c6)
‑
fc被摄取入16hbe内,但没有被溶酶体所溶解。相反,未修饰fc的包载香豆素6纳米颗粒(np(c6))在共聚焦z轴扫描中从顶层到细胞底部出现大量红色与绿色共定位的橙红色信号,即是说明未修饰fc的纳米颗粒(np(c6))可以被细胞内吞摄取,但会被胞质内溶酶体捕捉。提示单纯的纳米给药或直接游离给药入细胞后生物利用度会降低。证实本发明设计的修饰fc纳米颗粒具备溶酶体逃逸的优势。
53.实验3:纳米颗粒靶向气道上皮经皮转运动物示踪实验
54.为评估经fc修饰的纳米颗粒靶向肺部并经受体介导转运入肺后在肺部的分布情况及其在肺组织的驻留时间。建立动物模型,将纳米颗粒载入荧光作示踪,通过气道给药,在不同时间段取肺组织作冰冻切片,用荧光显微镜观察气道周围纳米颗粒的荧光分布状态。
55.建立嗜酸性哮喘小鼠模型:雌性c57bl/6小鼠,8周龄,在第0、14天行腹腔注射致敏剂(按20μg的ova和2.25mg的al(oh)3溶于100μl pbs配制)100μl;第24、25、26天经1%ova的
生理盐水超声雾化40min;第27天后在不同时间段(0、2、4、8、12、24和48h)将相同荧光强度的载有绿色荧光香豆素6(coumarin6,cou6)的纳米颗粒(np(c6))和修饰fc的包载香豆素6纳米颗粒(np(c6)
‑
fc)经气道给药,荧光显微镜观察冷冻肺组织切片,以绿色荧光示踪纳米颗粒在气道的分布状态。
56.结果显示在0h时,np(c6)组和np(c6)
‑
fc组荧光主要集中在气道内测,提示经口咽气道给药,药物成功到达肺内大气道。随着时间推移,在2h时切片发现气道周围np(c6)组荧光明显减弱,而np(c6)
‑
fc组荧光强度高,呈向气道周围扩散趋势,在肺实质部位发现较强荧光。到4h时,np(c6)组在气道周围几乎不见,而np(c6)
‑
fc组在气道周围依然有较强荧光,肺实质部分分布有不同亮度的荧光区域。结果说明修饰有fc的纳米颗粒靶向结合气道上皮,并跨气道上皮屏障被转运到肺实质区域。继续观察np(c6)
‑
fc组到48h,np(c6)
‑
fc组在肺组织随着时间的推移,虽荧光强度减弱,但一直持续有较亮的荧光,且不再限于气道附近,而是浸润到肺组织的实质部分(图3)。故此结果充分说明修饰fc的纳米颗粒靶向到肺组织气道上皮并被转运入肺实质区域,在肺组织的驻留时间延长,延长药物在肺组织的作用时间,将有利于提高药物的生物利用度。
57.实验4:纳米给药系统改善哮喘模型小鼠病理学损伤
58.(1)建立嗜酸性哮喘小鼠模型:雌性c57bl/6小鼠,8周龄,在第0、14天行腹腔注射致敏剂(按20μg的ova和2.25mg的al(oh)3溶于100μl pbs配制)100μl;第24、25、26天经1%ova的生理盐水超声雾化40min;在第24、25、26天连续3天在雾化激发后2小时以pbs、fdtn、载药纳米颗粒(np)和bud行气道给药治疗。pbs:50μl/只,fdtn工作液(1.2mg/ml):50μl/只,载药纳米颗粒工作液(np):50μl/只,bud工作液(0.24mg/ml):50μl/只。
59.(2)共5组,每组5只。
60.①
对照组(pbs),致敏、激发和治疗均为pbs;
61.②
模型组(ova),ova致敏和激发;
62.③
fdtn组,ova致敏,激发2h后气道给药fdtn;
63.④
np组,ova致敏,激发2h后气道给药np;
64.⑤
bud组,ova致敏,激发2h后气道给药bud。
65.取研究小鼠右肺横切,行he染色和pas染色,观察肺气道周围炎症浸润和粘液分泌情况。he染色结果显示ova模型组气道周围有大量浸润炎症细胞,3个治疗组气道炎症浸润均减少。统计炎症浸润分数发现游离给药组减低程度相对较低,np组则相对ova组有显著性降低,整体水平表现比游离给药组治疗效果好(图4
‑
a、b)。肺组织切片糖原染色显示ova组气道环绕的几乎全是pas阳性细胞,而三个治疗组则显著性降低。pas阳性细胞率统计显示三个治疗组显著性降低。该结果说明ova组小鼠气道产生大量粘蛋白,fdtn和np治疗均能显著性降低气道上皮粘蛋白的产生,改善炎症环境,利于哮喘的控制与转归(图4
‑
c、d)。
66.实验5:纳米给药系统改善哮喘模型小鼠气道高反应性
67.按实验3建立嗜酸性哮喘小鼠模型。检测梯度浓度乙酰
‑
β
‑
甲基氯化胆碱激发小鼠呼吸间歇收缩指数(penh)来评估各处理组气道高反应性;结果如图5所示,模型ova组显著性升高,三治疗组气道高反应性得到明显抑制。游离fdtn给药显著降低气道高反应,纳米给药组np组相对fdtn组进一步下降(图5)。
68.实验6:纳米给药系统明显降低哮喘模型小鼠balf和肺组炎症细胞数和炎症因子
水平
69.按实验4建立嗜酸性哮喘小鼠模型。收集balf并行细胞总数和分类计数。分类计数采用流式分选法,具体圈门策略按路径:总细胞
‑
去粘连单个细胞
‑
活细胞
‑
cd45
+
炎性细胞
‑
cd11b
+
cd11c
low
‑
ly6g
+
(中性粒细胞)
‑
siglecf
+
(嗜酸性粒细胞)。实验各组小鼠balf细胞cd45
+
cd11b
+
cd11c
low
中嗜酸性粒细胞占比都在90%以上(图6
‑
a),说明balf里主要以嗜酸性粒细胞浸润为主,进一步说明本次建立的嗜酸性哮喘模型成功。经治疗后,三组治疗均显著降低balf炎症细胞,同样临床常用药布地奈德显示出经典药物的优势,炎症细胞降到很低,仅略高于对照组,且各组间的变异系数较小。有意义的是np组相对游离fdtn组炎症细胞进一步明显降低,且有统计学意义(图6
‑
b)。在balf中性粒细胞变化显示,np组降低的程度也比fdtn组更大(图6
‑
c)。特别是三组治疗后balf里嗜酸性粒细胞(eos)显著降低,np组相较于fdtn组进一步显著降低,且与bud的水平一致(图6
‑
d)。np组在降低balf炎症细胞数的现象同样出现在肺组织匀浆后的单细胞悬液里。图6
‑
e显示肺组织eos在三种策略治疗后也呈下降趋势,fdtn组相对ova组没有显著差异主要还是fdtn组5只小鼠间的变异较大,而np组则表现出很好的效果,组间差异较小,相对ova组显著降低。图6
‑
f显示肺组织cd4
+
细胞也存在相同的下降趋势。即可推断出np在降低炎症细胞相较游离给药有明显优势。
70.三种治疗措施在降低炎症效应细胞表现出差异性功效,为进一步探讨np的优势,各组小鼠肺组织通过匀浆制成单细胞悬液后经胞外刺激,采用流式抗体分选的方法评估各组小鼠肺组织单细胞悬液细胞胞内炎症因子的变化情况。各细胞因子的圈门策略按路径:总细胞
‑
去粘连单个细胞
‑
活细胞
‑
cd45
+
炎性细胞
‑
cd3
+
/cd4
+
‑
cd4
+
/cytokines
+
,具体结果展示如图6
‑
g。首先考察的6个细胞因子(il
‑
4、il
‑
5、il
‑
13、il
‑
10、il
‑
17a和ifn
‑
γ)在三治疗组均呈显著性下降。其中il
‑
4、il
‑
5和ifn
‑
γ水平在np组相较于fdtn组降低程度更大,且统计学差异显著,这也进一步证实np给药比游离fdtn给药有优势。
71.最后所应当说明的是,以上实施例仅用以说明本发明的技术方案而非对本发明保护范围的限制,尽管参照较佳实施例对本发明作了详细说明,本领域的普通技术人员应当理解,可以对本发明的技术方案进行修改或者等同替换,而不脱离本发明技术方案的实质和范围。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1