半胱氨酸改造的抗体和偶联物的制作方法
半胱氨酸改造的抗体和偶联物
1.本技术是申请日为2011年6月7日、中国申请号为 201180039258.7、发明名称为“半胱氨酸改造的抗体和偶联物”的分案申 请的再分案申请(原申请号为201180039258.7)。
2.对相关申请的引用
3.本技术是在37 cfr
§
1.53(b)规定下提交的非临时申请,依照35 usc
ꢀ§
119(e)的规定要求2010年6月8日提交的流水号为61/352,728的美国临时 申请的权益,将其引入本文作为参考。
发明领域
4.本发明一般涉及用反应性半胱氨酸残基改造的抗体,且更具体地说, 本发明涉及具有治疗或诊断应用的抗体。可以使半胱氨酸改造的抗体与化 疗药;毒素;亲和配体,诸如生物素和检测标记,诸如荧光团偶联。本发 明还涉及使用抗体和抗体-药物偶联物化合物在体外、原位和体内诊断或治 疗哺乳动物细胞或相关病理性情况的方法。
5.发明背景
6.抗体药物偶联物(adc)是有吸引力的靶向化疗分子,因为它们组合抗体 和细胞毒性药物二者的理想特性,即通过将有力的细胞毒性药物靶向表达 抗原的肿瘤细胞,由此增强它们的抗肿瘤活性。针对给定靶抗原的成功adc 开发取决于抗体选择、接头稳定性、细胞毒性药物效力和接头-药物偶联抗 体的方式的优化。
7.常规附着方式,即通过共价键连接,药物部分与抗体一般产生不均一 的(heterogeneous)分子混合物,其中药物部分结合在抗体上的许多位点上。 例如,细胞毒性药物一般与抗体通过抗体的通常大量的赖氨酸残基偶联, 从而产生不均一的抗体-药物偶联物混合物。根据反应条件的不同,所述的 不均一混合物一般含有抗体和0-约8或8以上附着的药物部分的分布。此 外,在具有特定整数比的药物部分与抗体的偶联物各亚组内可能是不均一 的混合物,其中药物部分结合在抗体上的不同位点上。分析和制备方法不 足以分离和表征由偶联反应产生的不均一混合物中的抗体-药物偶联物类分 子。抗体为较大的复杂的并且结构多样的生物分子,通常带有许多反应性 官能基。其与接头试剂和药物-接头中间体的反应性取决于如下因素:诸如 ph、浓度、盐浓度和共溶剂。此外,多步骤偶联过程因控制反应条件和表 征反应剂和中间体方面的困难而可能不可再现。
8.半胱氨酸硫醇在中性ph具有反应性,这与在接近ph 7时质子化和亲 核性降低的大部分胺类不同。由于游离硫醇(rsh,硫氢基)具有相对的反应 性,所以带有半胱氨酸残基的蛋白质通常以其作为二硫化物-连接的寡聚体 的氧化形式存在或具有内部桥连的二硫化物基团。抗体半胱氨酸硫醇一般 对亲电子偶联反应剂比对抗体胺或羟基更具反应性,即更具亲核性。通过 使蛋白质的不同氨基酸残基突变成半胱氨酸氨基酸的在半胱氨酸硫醇上的 设计可能存在问题,特别是就未配对的(游离cys)残基或那些相对易于进行 反应或氧化的残基而言。在蛋白质的浓溶液中,无论是在大肠杆菌(e.coli) 的周质中,还是在培养物上清液或部分或完全纯化的蛋白质中,蛋白质表 面上的未配对的cys残基可以配对并
且氧化成分子内二硫化物和由此的蛋 白质二聚体或多聚体。二硫化物二聚体的形成使得新的cys无法与药物、 配体或其它标记发生偶联反应。此外,如果蛋白质以氧化方式在新改造的 cys和已存在的cys残基之间形成分子内二硫键,那么两种cys基团对活性 位点的参与和相互作用而言均无法利用。此外,可以通过错误折叠或丧失 三级结构使蛋白质失活或赋予其非特异性(zhang等(2002)anal.biochem. 311:1-9)。
9.在改造的半胱氨酸可供偶联但不扰乱免疫球蛋白折叠和装配或改变抗 原结合和效应器功能的位点处具有半胱氨酸替代的抗体(thiomab)(junutula, et al.,2008b nature biotech.,26(8):925-932;dornan et al(2009)blood 114(13):2721-2729;us 7521541;us 7723485;wo2009/052249)。然后, 这些thiomab可以经由改造的半胱氨酸硫醇基偶联细胞毒性药物以获得具 有统一化学计量(约2个药物每个抗体)的thiomab药物偶联物(tdc)。针对 不同抗原的多种抗体的研究显示了tdc在异种移植物模型中像常规adc 一样有效,而且在有关临床前模型中在更高的剂量得到耐受。thiomab药 物偶联物改造成在抗体的不同部分(轻链-fab、重链-fab和重链-fc)附着药 物。由于它们的同质性和位点特异性偶联细胞毒性药物,tdc的体外和体 内稳定性、功效和pk特性提供胜过常规adc的独特优势。
10.概述
11.本发明包括分离的半胱氨酸改造的抗体,其在重链或轻链中包含游离 半胱氨酸氨基酸。
12.本发明的一个方面是制备分离的半胱氨酸改造的抗体的方法,即通过 将一个或多个氨基酸残基用半胱氨酸替换来诱变亲本抗体的核酸序列,以 便编码半胱氨酸改造的抗体;表达半胱氨酸改造的抗体;并分离半胱氨酸 改造的抗体。
13.本发明的另一个方面是分离的半胱氨酸改造的抗体的偶联物,其中抗 体共价附着于捕捉标记、检测标记、药物部分、或固相支持物。
14.本公开涉及下述实施方案。
15.1.一种分离的半胱氨酸改造的抗体,其包含游离半胱氨酸氨基酸 和重链中选自seq id no:50-98的序列或轻链中选自seq id no:99-147 的序列,其中所述序列中的半胱氨酸是游离半胱氨酸氨基酸。
16.2.实施方案1的分离的半胱氨酸改造的抗体,其通过包括以下步 骤的方法制备:
17.(i)通过将一个或多个氨基酸残基用半胱氨酸替换来诱变亲本抗体 的核酸序列,以便编码半胱氨酸改造的抗体;
18.(ii)表达半胱氨酸改造的抗体;并
19.(iii)分离半胱氨酸改造的抗体。
20.3.实施方案2的半胱氨酸改造的抗体,其中诱变包括位点定向诱 变。
21.4.实施方案2的半胱氨酸改造的抗体,其中在选自噬菌体或噬菌 粒颗粒的病毒颗粒上表达半胱氨酸改造的抗体。
22.5.实施方案2的半胱氨酸改造的抗体,进一步包括:
23.(i)使半胱氨酸改造的抗体与硫醇-反应性亲和试剂反应而生成亲和 标记的半胱氨酸改造的抗体;并
24.(ii)测量亲和标记的半胱氨酸改造的抗体与捕捉介质的结合。
25.6.实施方案5的半胱氨酸改造的抗体,其中所述硫醇-反应性亲和 试剂包含生物素部分。
26.7.实施方案5的半胱氨酸改造的抗体,其中所述硫醇-反应试剂包 含马来酰亚胺部分。
27.8.实施方案5的半胱氨酸改造的抗体,其中所述捕捉介质包含链 霉抗生物素。
28.9.实施方案1的半胱氨酸改造的抗体,其中所述半胱氨酸改造的 抗体为包含清蛋白结合肽(abp)的融合蛋白。
29.10.实施方案9的半胱氨酸改造的抗体,其中所述abp包含选自 seq id no:1、seq id no:2、seq id no:3、seq id no:4、和seq id no: 5的序列。
30.11.实施方案1的半胱氨酸改造的抗体,其中所述半胱氨酸改造的 抗体选自单克隆抗体、抗体片段、双特异性抗体、嵌合抗体、人抗体、和 人源化抗体。
31.12.实施方案11的半胱氨酸改造的抗体,其中所述抗体片段为fab 片段。
32.13.实施方案11的半胱氨酸改造的抗体,其中所述半胱氨酸改造的 抗体为抗her2抗体。
33.14.实施方案1的半胱氨酸改造的抗体,其中所述半胱氨酸改造的 抗体结合受体(1)-(36)中的一种或多种:
34.(1)bmpr1b(骨形态发生蛋白受体-ib型);
35.(2)e16(lat1,slc7a5);
36.(3)steap1(前列腺的六跨膜上皮细胞抗原);
37.(4)0772p(ca125,muc16);
38.(5)mpf(mpf,msln,smr,巨核细胞强化因子,mesothelin);
39.(6)napi3b(napi-3b,nptiib,slc34a2,溶质载体家族34(磷酸钠),成 员2,ii型钠依赖性磷酸转运蛋白3b);
40.(7)sema 5b(flj10372,kiaa1445,mm.42015,sema5b,semag,脑信 号蛋白5b hlog,sema结构域,七血小板反应蛋白重复(1型和类1型),跨膜 结构域(tm)和短胞质域,(脑信号蛋白)5b);
41.(8)psca hlg(2700050c12rik,c530008o16rik,riken cdna 2700050c12,riken cdna 2700050c12基因);
42.(9)etbr(内皮缩血管肽b型受体);
43.(10)msg783(rnf124,推定蛋白flj20315);
44.(11)steap2(hgnc_8639,ipca-1,pcanap1,stamp1,steap2, stmp,前列腺癌相关基因1,前列腺癌相关蛋白1,前列腺的六跨膜上皮细 胞抗原2,六跨膜前列腺蛋白);
45.(12)trpm4(br22450,flj20041,trpm4,trpm4b,瞬时型受体电位阳 离子通道,亚家族m,成员4);
46.(13)cripto(cr,cr1,crgf,cripto,tdgf1,畸胎瘤-衍生的生长因 子);
47.(14)cd21(cr2(补体受体2)或c3dr(c3d/eb病毒受体)或hs.73792);
48.(15)cd79b(cd79b,cd79β,igb(免疫球蛋白-相关β),b29);
49.(16)fcrh2(ifgp4,irta4,spap1a(含有磷酸酶锚定蛋白1a的sh2结 构域),spap1b,spap1c);
50.(17)her2;
51.(18)nca;
52.(19)mdp;
53.(20)il20rα;
54.(21)brevican;
55.(22)ephb2r;
56.(23)aslg659;
57.(24)psca;
58.(25)geda;
59.(26)baff-r(b细胞-活化因子受体,blys受体3,br3);
60.(27)cd22(b-细胞受体cd22-b同种型);
61.(28)cd79a(cd79a,cd79α,免疫球蛋白-相关α,b细胞-特异性蛋白);
62.(29)cxcr5(伯基特淋巴瘤受体1,g蛋白-偶联受体);
63.(30)hla-dob(mhc ii类分子β亚单位(ia抗原));
64.(31)p2x5(嘌呤能受体p2x配体门控性离子通道5);
65.(32)cd72(b-细胞分化抗原cd72,lyb-2);
66.(33)ly64(淋巴细胞抗原64(rp105),富亮氨酸重复(lrr)家族的i型膜 蛋白);
67.(34)fcrh1(fc受体-样蛋白1);
68.(35)irta2(免疫球蛋白超家族受体易位相关蛋白2);和
69.(36)tenb2(推定的跨膜蛋白聚糖)。
70.15.实施方案1的半胱氨酸改造的抗体,其中所述抗体共价附着于 捕捉标记、检测标记、药物部分、或固相支持物。
71.16.实施方案15的半胱氨酸改造的抗体,其中所述抗体共价附着于 生物素捕捉标记。
72.17.实施方案15的半胱氨酸改造的抗体,其中所述抗体共价附着于 荧光染料检测标记。
73.18.实施方案17的半胱氨酸改造的抗体,其中所述荧光染料选自荧 光素类、若丹明类、丹酰、丽丝胺、花菁、藻红蛋白、德克萨斯红及其类 似物。
74.19.实施方案15的半胱氨酸改造的抗体,其中所述抗体共价附着于 选自3h、
11
c、
14
c、
18
f、
32
p、
35
s、
64
cu、
68
ga、
86
y、
89
zr、
99
tc、
111
in、
123
i、 124
i、
125
i、
131
i、
133
xe、
177
lu、
211
at、和
213
bi的放射性核素检测标记。
75.20.实施方案15的半胱氨酸改造的抗体,其中所述抗体通过螯合配 体共价附着于检测标记。
76.21.实施方案20的半胱氨酸改造的抗体,其中所述螯合配体选自 dota、dotp、dotma、dtpa和teta。
77.22.实施方案15的半胱氨酸改造的抗体,其中所述抗体共价附着于 选自美登木素生物碱、auristatin、多拉司他汀、单端孢霉烯、cc1065、加 利车霉素、烯二炔类抗生素、紫杉烷、和蒽环类抗生素的药物部分以形成 具有式i的抗体-药物偶联物:
78.ab-(l-d)
p
ꢀꢀꢀi79.其中ab为抗体,l为接头,d为药物部分,且p为1、2、3、或4。
80.23.实施方案22的半胱氨酸改造的抗体,其中所述抗体-药物偶联物 具有以下结构:
[0081][0082]
24.实施方案22的半胱氨酸改造的抗体,其中d为具有以下结构的 美登木素生物碱:
[0083][0084]
其中波状线表示d的硫原子与接头的共价附着;
[0085]
r独立选自h、甲基、乙基、1-丙基、2-丙基、1-丁基、2-甲基-1-丙基、 2-丁基、2-甲基-2-丙基、1-戊基、2-戊基、3-戊基、2-甲基-2-丁基、3-甲基
ꢀ‑
2-丁基、3-甲基-1-丁基、2-甲基-1-丁基、1-己基、2-己基、3-己基、2-甲基
ꢀ‑
2-戊基、3-甲基-2-戊基、4-甲基-2-戊基、3-甲基-3-戊基、2-甲基-3-戊基、 2,3-二甲基-2-丁基、和3,3-二甲基-2-丁基;且
[0086]
m为1、2、或3;
[0087]
25.实施方案24的半胱氨酸改造的抗体,其中d选自以下结构:
[0088]
[0089][0090]
和
[0091][0092]
26.实施方案25的半胱氨酸改造的抗体,其具有以下结构:
[0093][0094]
其中n为0、1、或2。
[0095]
27.实施方案22的半胱氨酸改造的抗体,其中d为具有以下结构的 单甲基
auristatin药物部分mmae或mmaf:
[0096]
mmaemmaf。
[0097]
28.实施方案27的半胱氨酸改造的抗体,其中所述抗体-药物偶联物 选自以下结构:
[0098][0099]
ab-mc-vc-pab-mmaf
[0100][0101]
ab-mc-vc-pab-mmae
[0102][0103]
ab-mc-mmae
[0104][0105]
ab-mc-mmaf
[0106]
其中val为缬氨酸;cit为瓜氨酸;且p为1、2、3或4。
[0107]
附图简述
[0108]
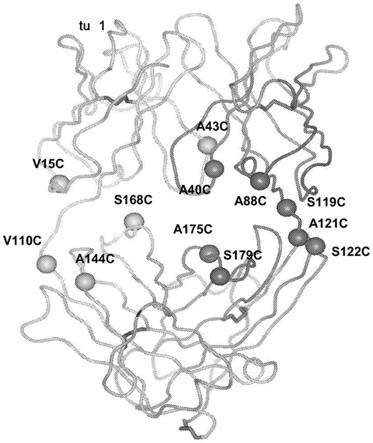
附图1a表示通过x射线晶体坐标衍生的hu4d5fabv7抗体片段的三维 代表图。对重链和轻链的例示性改造的cys残基的结构位置进行了编号(按 照序列编号系统)。
[0109]
附图1b表示4d5v7fabh的与kabat编号方案(下排)对比在n-末端开始 的序列编号方案(上排)。kabat编号插入由a、b、c标注。
[0110]
附图2a和2b表示通过与bsa(空心条柱)、her2(具条纹的条柱)或链 霉抗生物素
(实心条柱)相互作用的pheselector测定法,使用在450nm 处吸光度检测的hu4d5fabv8和hu4d5fabv8 cys突变体(thiofab)噬菌体变 体的结合测定值:(a)未生物素化噬菌体-hu4d5fabv8和(b)生物素化噬菌 体-hu4d5fabv8(b)。
[0111]
附图3a和3b表示通过与bsa(空心条柱)、her2(具条纹的条柱)和链 霉抗生物素(实心条柱)相互作用的pheselector测定法,使用在450nm 处吸光度检测的hu4d5fabv8(左)和hu4d5fabv8 cys突变体(thiofab)的结合 测定值:(a)未生物素化噬菌体-hu4d5fabv8和(b)生物素化噬菌体
ꢀ‑
hu4d5fabv8。轻链变体位于左侧,而重链变体位于右侧。硫醇反应性=链 霉抗生物素结合的od
450 nm
÷
her2(抗体)结合的od
450 nm
。
[0112]
附图4a表示野生型hu4d5fabv8上残基的表面可接近分数值(fractionalsurface accessibility value)。轻链位点位于左侧,而重链位点位于右侧。
[0113]
附图4b表示通过在450nm处检测吸光度测定的与her2(第2天)、链 霉抗生物素(sa)(第2天)、her2(第4天)和sa(第4天)的相互作用的生物素 化的hu4d5fabv8和hu4d5fabv8cys变体(thiofab)的结合测定值。分离噬 菌体-hu4d5fabv8 cys变体并且储存在4℃。在第2天或第4天时进行生物 素偶联,随后进行pheselector分析以便如实施例2中所述监测其与 her2和链霉抗生物素的相互作用并且探测改造的thiofab变体上反应性硫 醇的稳定性。
[0114]
附图5表示通过在450nm处检测吸光度测定的生物素-马来酰亚胺偶联 的-hu4d5fabv8(a121c)和未生物素化的野生型hu4d5fabv8在结合链霉抗 生物素和her2中的结合测定值。在2ng和20ng测试每种fab。
[0115]
附图6表示通过在450nm处检测生物素化的abp-hu4d5fabv8野生型 (wt)和abp-hu4d5fabv8半胱氨酸突变体v110c和a121c在结合兔清蛋 白、链霉抗生物素(sa)和her2中的吸光度的elisa分析。
[0116]
附图7表示通过在450nm处检测吸光度对生物素化的abp-hu4d5fabv8 半胱氨酸突变体(thiofab变体):(左至右)单cys变体abp-v110c、 abp-a121c和双cys变体abp-v110c-a88c和abp-v110c-a121c的在结 合兔清蛋白、her2和链霉抗生物素(sa)并且使用fab-hrp或sa-hrp探测 的elisa分析。
[0117]
附图8表示生物素化的thiofab噬菌体和抗-噬菌体hrp抗体与 her2(上)和链霉抗生物素(下)的结合。
[0118]
附图9a表示结合固定的her2的生物素化抗体在结合用于吸光度检测 的hrp标记的二抗(second antibody)的卡通画描绘。
[0119]
附图9b表示在450nm处检测吸光度测定的生物素-马来酰亚胺偶联的 硫代-曲妥单抗变体(thio-trastuzumab variant)和未-生物素化的野生型曲妥单 抗结合固定的her2的结合测定。从左至右:v110c(单cys),a121c(单cys), v110c/a121c(双cys)和曲妥单抗。以1、10和100ng测试了各thio igg变 体和曲妥单抗。
[0120]
附图10a表示结合固定的her2的生物素化抗体和用于吸光度检测的 生物素与抗-igg-hrp结合的卡通图描绘。
[0121]
附图10b表示在450nm下检测吸光度的生物素-马来酰亚胺偶联的-硫 代曲妥单抗变体和未-生物素化的野生型曲妥单抗在结合固定的链霉抗生物 素中的结合测定值。从左至右:v110c(单cys),a121c(单cys), v110c/a121c(双cys)和曲妥单抗。以1、10和100ng测
试了各thio igg变 体和曲妥单抗。
[0122]
附图11表示制备由细胞培养物表达的用于偶联的半胱氨酸改造的抗体 (thiomab)的一般方法。
[0123]
典型实施方案的详细描述
[0124]
详细内容参照本发明的某些实施方案,其实施例在附带的结构和通式 中例示。尽管结合列举的实施方案描述了本发明,但是应理解它们并非指 定用于将本发明限定到那些实施方案。相反,本发明覆盖所有的备选、变 型和等同技术方案,它们均包括在如权利要求定义的本发明范围内。
[0125]
本领域技术人员知道可以用于实施本发明的与本文所述的那些相似或 等同的许多方法和物质。本发明决不限于所述的方法和物质。
[0126]
除非另做陈述,否则,本文所用的技术和科学术语具有本发明所属技 术领域普通技术人员通常理解的相同的含义并且与如下文献中所述一致: singleton等(1994)dictionary of microbiology and molecular biology,2nd ed., j.wiley&sons,new york,ny;和janeway,c.,travers,p.,walport,m., shlomchik(2001)immonobiology,5th ed.,garland publishing,new york。
[0127]
定义
[0128]
除非另做陈述,否则,本文所用的下列术语和措词具有如下含义:
[0129]
当本文中使用商品名时,申请人意欲独立地包括产品的商品名产品制 剂、仿制药和商品名产品的活性药物组分。
[0130]
本文的术语“抗体”以其最广泛的含义使用并且特别覆盖单克隆抗体、多 克隆抗体、二聚体、多聚体、多特异性抗体(例如双特异性抗体)和抗体片段, 只要它们表现出所需的生物活性(miller等(2003)jour.of immunology 170:4854-4861)。抗体可以为鼠、人、人源化、嵌合的抗体或来源于其它物 种。抗体为由能够识别和结合特异性抗原的免疫系统产生的蛋白质(janeway, c.,travers,p.,walport,m.,shlomchik(2001)immuno biology,5th ed.,garlandpublishing,new york).靶抗原一般具有由多种抗体的cdrs识别的大量结 合位点,也称作表位。特异性结合不同表位的各抗体具有不同的结构。因 此,一种抗原可以具有一种以上相应的抗体。抗体包括全-长免疫球蛋白分 子或全-长免疫球蛋白分子的免疫活性部分,即含有特异性结合所关注靶标 的抗原或其部分的分子,这类靶标包括,但不限于癌细胞或产生与自身免 疫性疾病相关的自身免疫抗体的细胞。本文披露的免疫球蛋白可以具有免 疫球蛋白分子的任意类型(例如igg、ige、igm、igd和iga)、类别(例如igg1、 igg2、igg3、igg4、iga1和iga2)或亚类。免疫球蛋白可以来源于任意的 物种。然而,在一个方面中,免疫球蛋白来源于人、鼠或兔。
[0131]
"抗体片段"包含全长抗体的一部分,一般为其抗原结合区或可变区。抗 体片段的实例包括:fab、fab'、f(ab')2和fv片段;双抗体;线性抗体;微 抗体(minibody)(olafsen等(2004)protein eng.design&sel.17(4):315-323); fab表达文库制备的片段;抗-独特型(抗-id)抗体;cdr(互补决定区);和以 免疫特异性方式结合癌细胞抗原、病毒抗原或微生物抗原的上述任意的表 位-结合片段;单-链抗体分子;和由抗体片段形成的多特异性抗体。
[0132]
本文的术语“单克隆抗体”指从基本上同质的抗体群中获得的抗体,即除 可能少
量存在的天然发生的可能突变之外,包含在该群体中的各抗体是相 同的。单克隆抗体是高度特异的靶向单个抗原位点的抗体。而且,与典型 地包括靶向不同决定簇(表位)的不同抗体的多克隆抗体制品相反,每种 单克隆抗体只靶向抗原上的单一决定簇。除其特异性外,单克隆抗体的优 点还在于它们可以以不被其它抗体污染的方式合成。修饰语“单克隆”表示获 自基本上同质的抗体群的抗体特性,并非解释为需要由任何特定方法生产 抗体。例如,可以通过首先由kohler等(1975)nature 256:495描述的杂交瘤 方法制备用于本发明的单克隆抗体或可以通过重组dna方法制备(例如, 参见:us 4816567;us 5807715)。例如,还可以使用clackson等(1991)nature, 352:624-628;marks等(1991)j.mol.biol.,222:581-597所述的技术从噬菌体 抗体文库分离单克隆抗体。
[0133]
本文的单克隆抗体特别包括“嵌合”抗体,其中重链和/或轻链的一部分 与衍生自特定物种或属于特定抗体类型或亚型的抗体中的相应序列相同或 同源,而所述链的剩余部分与来源于另一物种或属于另一抗体类型或亚型 的抗体中的相应序列相同或同源,本文还包括嵌合抗体的片段,只要它们 展示期望的生物学活性(us 4816567;和morrison等(1984)proc.natl.acad. sci.usa,81:6851-6855)。本文关注的嵌合抗体包括“灵长化(primatized)”抗 体,其包含来源于非人的灵长类(例如old world monkey、ape等)的可变 区抗原-结合序列和人恒定区序列。
[0134]
本文的“完整抗体”为包含vl和vh结构域以及轻链恒定域(cl)和重链 恒定域ch1、ch2和ch3的抗体。恒定域可以为天然序列恒定域(例如人天 然序列恒定域)或其氨基酸序列变体。完整抗体可以具有一种或多种“效应子 功能”,意旨归因于抗体的fc恒定区(天然序列fc区或氨基酸序列变体fc 区)的那些生物活性。抗体效应子功能的实例包括c1q结合;补体依赖的细 胞毒性;fc受体结合;抗体-依赖性细胞介导的细胞毒作用(adcc);胞吞 作用;和细胞表面受体,诸如b细胞受体和bcr的减量调节。
[0135]
根据其重链恒定域的氨基酸序列的不同,可以将完整抗体指定为不同
ꢀ“
类别”。存在5种主要类别的完整免疫球蛋白抗体:iga、igd、ige、igg和 igm,且可以将其中的几种进一步分成“亚类”(亚型),例如igg1,igg2,igg3, igg4,iga1,和iga2。对应于不同抗体类别的重链恒定域分别称作α、δ、ε、 γ和μ。不同类别免疫球蛋白的亚单位结构和三维构型为众所周知的。ig型 包括铰链-修饰型或无铰链型(roux等(1998)j.immunol.161:4083-4090; lund等(2000)eur.j.biochem.267:7246-7256;us 2005/0048572;us 2004/0229310)。
[0136]“erbb受体”为属于受体erbb受体家族的蛋白酪氨酸激酶,其成员为细 胞生长、分化和存活的重要介导物。erbb受体家族包括4种不同的成员, 包括表皮生长因子受体(egfr、erbb1、her1)、her2(erbb2或p185neu)、 her3(erbb3)和her4(erbb4或tyro2)。已经使用人乳腺肿瘤细胞系skbr3 表征了一组抗-erbb2抗体(hudziak等(1989)mol.cell.biol.9(3):1165-1172。 使用称作4d5的抑制细胞增殖达56%的抗体获得最大抑制作用。在本试验 的一组抗体中的其它抗体降低细胞增殖的程度较弱。进一步发现抗体4d5 可以使过表达erbb2的乳腺肿瘤细胞系对tnf-α的细胞毒性效应敏感(us 5677171)。hudziak等讨论的抗-erbb2抗体进一步在下列文献中得到表征: fendly等(1990)cancer research 50:1550-1558;kotts等(1990)in vitro 26(3):59a;sarup等(1991)growth regulation 1:72-82;shepard等j.(1991) clin.immunol.11(3):117-127;kumar等(1991)mol.cell.biol.11(2):979-986; lewis等(1993)cancer immunol.免疫ther.37:255-263;
pietras等(1994) oncogene 9:1829-1838;vitetta等(1994)cancer research 54:5301-5309; sliwkowski等(1994)j.biol.chem.269(20):14661-14665;scott等(1991)j. biol.chem.266:14300-5;d'souza等proc.natl.acad.sci.(1994) 91:7202-7206;lewis等(1996)cancer research 56:1457-1465;和schaefer等 (1997)oncogene 15:1385-1394。
[0137]
erbb受体通常包含胞外结构域,其可以结合erbb配体;亲脂性跨膜结 构域;保守的胞内酪氨酸激酶结构域;和包含几个可以被磷酸化的酪氨酸 残基的羧基-末端信号传导结构域。erbb受体可以为“天然序列”erbb受体 或其“氨基酸序列变体”。优选erbb受体为天然序列人erbb受体。因此,
ꢀ“
erbb受体家族的成员”包括egfr(erbb1)、erbb2、erbb3、erbb4。
[0138]
术语“氨基酸序列变体”意旨在一定程度上具有不同于天然序列多肽的 氨基酸序列的多肽。氨基酸序列变体一般与天然erbb配体的至少一种受体 结合结构域或与天然erbb受体的至少一种配体结合结构域具有至少约70% 的序列同一性,并且优选它们至少约80%,更优选至少约90%的序列与这 类受体或配体结合结构域同源。氨基酸序列变体在天然氨基酸序列的氨基 酸序列内的某些位置上具有替代、缺失和/或插入。按照常规的名称,即一 字母密码和三字母密码命名氨基酸。
[0139]
将“序列同一性”定义为对序列进行序列对比排列并在必要时引入缺口 以获取最大百分比序列同一性后氨基酸序列变体中相同的残基的百分率。 用于进行序列对比的方法和计算机程序为本领域众所周知的。一种这类计 算机程序为genentech,inc.创建的“align 2”,其中归档为1991年12月10 日在united states copyright office,washington,dc 20559的用户文件。
[0140]“天然抗体”通常为由两种相同的轻(l)链和两种相同的重(h)链组成的 约150,000道尔顿的异四聚化糖蛋白。每一轻链通过一个共价二硫键与重链 连接,而二硫键的数量在不同免疫球蛋白同种型中可变。每一重链和轻链 还具有有规则间隔的链间二硫键。每一重链在一端上带有可变域(vh),随后 是大量恒定域。每一轻链在一端上带有可变(v
l
),而在另一端上带有恒定域。 将轻链的恒定域与重链的第一恒定域进行序列对比并且将轻链的可变域与 重链的可变域进行序列对比。认为特定的氨基酸残基在轻链域重链可变域 之间形成界面。
[0141]
术语“可变的”指可变区中的某些部分在抗体序列中差异广泛且用于 每种特定抗体针对其特定抗原的结合和特异性的实情。然而,变异性并非 均匀分布于抗体的整个可变区。它集中于轻链和重链可变区中称作高变区 的三个区段。可变区中更加高度保守的部分称作框架区(fr)。天然重链和轻 链的可变区各自包含四个fr,它们大多采取β-折叠构象,通过形成环状连 接且在有些情况中形成β-折叠结构一部分的三个高变区连接。每条链中的 高变区通过fr非常接近的保持在一起,并与另一条链的高变区一起促成抗 体的抗原结合位点的形成(参见kabat等人,1991,《sequences of proteinsof immunological interest》,第5版,public health service,national institutesof health,bethesda,md)。恒定区不直接参与抗体与抗原的结合,但展 现出多种效应物功能,诸如抗体依赖性细胞的细胞毒性(adcc)中抗体的参 与。
[0142]
术语“高变区”在用于本文时指抗体中负责抗原结合的氨基酸残基。 高变区通常包含来自“互补决定区”或“cdr”的氨基酸残基(例如轻链 可变区中的残基24-34(l1)、50-56(l2)和89-97(l3)及重链可变区中的残基 31-35(h1)、50-65(h2)和95-102(h3);kabat等
人,见上文)和/或那些来 自“高变环”的残基(例如轻链可变区中的残基26-32(l1)、50-52(l2)和 91-96(l3)及重链可变区中的残基26-32(h1)、53-55(h2)和96-101(h3);chothia and lesk(1987)j.mol.biol.196:901-917)。“框架区”或“fr
”ꢀ
残基指可变区中除了本文中所定义的高变区残基以外的那些残基。
[0143]
用木瓜蛋白酶消化抗体产生两个相同的抗原结合片段,称作“fab”片 段,各自具有一个抗原结合位点,和一个残余“fc”片段,其名称反映了 它易于结晶的能力。胃蛋白酶处理产生一个f(ab')2片段,它具有两个抗原 结合位点且仍能够交联抗原。
[0144]“fv”是包含完整抗原识别和抗原结合位点的最小抗体片段。此区由 紧密、非共价结合的一个重链可变区和一个轻链可变区的二聚体组成。正 是在这种构造中,各个可变区的三个高变区相互作用而在v
h-v
l
二聚体表 面确定了一个抗原结合位点。六个高变区共同赋予抗体以抗原结合特异性。 然而,即使是单个可变区(或只包含对抗原特异的三个高变区的半个fv) 也具有识别和结合抗原的能力,尽管亲和力低于完整结合位点。
[0145]
fab片段还包含轻链的恒定区和重链的第一恒定区(ch1)。fab’片段因在 重链ch1结构域的羧基末端增加了少数残基而与fab片段有所不同,包括 来自抗体铰链区的一个或多个半胱氨酸。fab
’‑
sh是本文中对其中恒定区半 胱氨酸残基携带至少一个游离硫醇基的fab’的称谓。f(ab')2抗体片段最初是 作为成对fab’片段生成的,在fab’片段之间具有铰链半胱氨酸。还知道抗 体片段的其它化学偶联。
[0146]
根据其恒定区氨基酸序列,来自任何脊椎动物物种的抗体的“轻链
”ꢀ
可归入两种截然不同类型中的一种,称作卡帕(κ)和拉姆达(λ)。
[0147]“单链fv”或“scfv”抗体片段包含抗体的vh和v
l
结构域,其中这 些结构域存在于一条多肽链上。优选的是,该fv多肽在vh和v
l
结构域之 间还包含多肽接头,使得scfv能够形成抗原结合期望的结构。关于scfv的 综述参见pl
ü
ckthun,《the pharmacology of monoclonal antibodies》,vol.113, rosenburg和moore编,springer-verlag,new york,pp.269-315,1994。 抗erbb2抗体scfv片段描述于wo 93/16185;美国专利5,571,894;和 5,587,458。
[0148]
非人(例如啮齿类)抗体的“人源化”形式指最低限度包含衍生自非 人免疫球蛋白的序列的嵌合抗体。人源化是将鼠抗原结合信息转移至非免 疫原性人抗体受体的方法,并且已经产生了许多治疗上有用的药物。人源 化方法一般通过将所有6个鼠互补决定区(cdr)转移至人抗体框架开始(jones等,(1986)nature 321:522-525)。这些cdr移植的抗体一般不会保持其 对抗原结合的最初亲和力,并且事实上,亲和力通常严重受损。除cdr外, 还必须引入选定的非人抗体框架残基以便维持正确的cdr构象(chothia等 (1989)nature 342:877)。已经证实,将关键的小鼠框架残基转移至人受体以 便支持所移植cdr的结构构象恢复抗原结合和亲和力(riechmann等(1992) j.mol.biol.224,487-499;foote和winter,(1992)j.mol.biol.224:487-499; presta等(1993)j.immunol.151,2623-2632;werther等(1996)j.immunol. methods 157:4986-4995;和presta等(2001)thromb.haemost.85:379-389)。 在极大程度上,人源化抗体指人免疫球蛋白(受体抗体)中的高变区残基 用具有期望特异性、亲和力和能力的非人物种(供体抗体)诸如小鼠、大 鼠、兔或非人灵长类的高变区残基替换的免疫球蛋白。在有些情况中,将 人免疫球蛋白的框架区(fr)残基用相应的非人残基替换。此外,人源化抗体 可包含在受体抗体或供体抗体中没
312:545-548中所述。
[0155]
本发明所涵盖的抗体的分子靶标包括cd蛋白及其配体,诸如,但不限 于:(i)cd3、cd4、cd8、cd19、cd20、cd22、cd34、cd40、cd79α(cd79a) 和cd79β(cd79b);(ii)erbb受体家族的成员,诸如egf受体、her2、her3 或her4受体;(iii)细胞粘附分子,诸如lfa-1、mac1、p150,95、vla-4、icam-1、vcam和αv/β3整联蛋白,包括其α或β亚基(例如抗cd11a、抗 cd18或抗cd11b抗体);(iv)生长因子,诸如vegf;ige;血型抗原; flk2/flt3受体;肥胖(ob)受体;mpl受体;ctla-4;蛋白c、br3、c-met、 组织因子、β7等;和(v)细胞表面和跨膜肿瘤相关抗原(taa)。
[0156]
除非另做陈述,术语“单克隆抗体4d5”指具有或衍生自鼠4d5抗体 (atcc crl 10463)的抗原结合残基的抗体。例如,单克隆抗体4d5可以为 鼠单克隆抗体4d5或其变体,诸如人源化4d5。例示性人源化4d5抗体包 括如us 5,821,337中所述的humab4d5-1、humab4d5-2、humab4d5-3、 humab4d5-4、humab4d5-5、humab4d5-6、humab4d5-7和humab4d5-8(曲 妥单抗(trastuzumab),)。
[0157]
术语“治疗”和“处理”指治疗性处理及预防性或防范性措施二者, 其中目标是预防或减缓(减轻)不想要的生理学变化或紊乱,诸如癌症的 形成或传播。为了本发明,有利或期望的临床结果包括但不限于:缓解症 状、削弱疾病的程度、疾病状态稳定(即不恶化)、延迟或减缓疾病进展、 改善或减轻疾病状态、及康复(无论是部分的还是完全的),无论是可检 测的还是不可检测的。“治疗”或“处理”还可以指与不接受治疗的预期 存活相比延长存活。需要治疗的受试者包括早就患有状况或紊乱的受试者 以及倾向于患上状况或紊乱的受试者或者要预防状况或紊乱的受试者。
[0158]
术语“治疗有效量”指在哺乳动物中有效治疗疾病或紊乱的药物量。 在癌症的情况中,药物的治疗有效量可减少癌细胞的数目;缩小肿瘤的尺 寸;抑制(即在一定程度上减缓和优选阻止)癌细胞浸润到周围器官中; 抑制(即在一定程度上减缓和优选阻止)肿瘤转移;在一定程度上抑制肿 瘤生长;和/或在一定程度上减轻一种或多种与癌症有关的症状。在药物可 阻止生长和/或杀死现有癌细胞的程度上,它可以是抑制细胞的和/或细胞毒 性的。对于癌症疗法,可通过例如评估疾病进展时间(ttp)和/或测定响应速 率(rr)来测量功效。
[0159]
术语“癌症”和“癌性”指或描述哺乳动物中特征通常为细胞生长不 受调节的生理状况。“肿瘤”包含一个或多个癌性细胞。癌症的例子包括 但不限于癌、淋巴瘤、母细胞瘤、肉瘤、及白血病或淋巴样恶性肿瘤。此 类癌症的更具体例子包括鳞状细胞癌(例如上皮鳞状细胞癌)、肺癌包括 小细胞肺癌、非小细胞肺癌(“nsclc”)、肺的腺癌和肺的鳞状癌、腹膜癌、 肝细胞癌、胃癌包括胃肠癌、胰腺癌、成胶质细胞瘤、宫颈癌、卵巢癌、 肝癌、膀胱癌、肝瘤(hepatoma)、乳癌、结肠癌、直肠癌、结肠直肠癌、子 宫内膜或子宫癌、唾液腺癌、肾癌、前列腺癌、外阴癌、甲状腺癌、肝癌、 肛门癌、阴茎癌、以及头和颈癌。
[0160]“表达erbb的癌”指包含在其细胞表面上存在erbb蛋白质的细胞的 癌。“表达erbb2的癌”指在其细胞表面上生成足够水平的erbb2,使得抗 erbb2抗体可与其结合并对癌产生治疗效果的癌。
[0161]“过表达”抗原性受体的癌指与同一组织类型的非癌性细胞相比,在 其细胞表面上具有显著更高水平的受体诸如erbb2的癌。此类过表达可以 是由基因扩增或者是由转录
dictionary of chemical terms(1984)mcgraw-hill bookcompany,new york;eliel,e.and wilen,s.,stereochemistry of organiccompunds(1994)john wiley&sons,inc.,new york。许多有机化合物以旋 光形式存在,即它们有能力旋转平面偏振光的平面。在描述旋光化合物时, 前缀d和l或r和s用于表示分子关于其手性中心的绝对构型。前缀d和 l或(+)和(-)用于表示化合物对平面偏振光的旋转的标记,其中(-)或1指化合 物是左旋的。以(+)或d为前缀的化合物是右旋的。对于指定的化学结构, 这些立体异构体是相同的,只是它们互为镜像。特定的立体异构体还可称 作对映体,此类异构体的混合物通常称作对映混合物。对映体的50:50混合 物称作外消旋混合物或外消旋物,它们可以在没有立体选择性或立体特异 性的化学反应或方法中存在。术语“外消旋混合物”和“外消旋物”指两 种对映体等摩尔混合从而丧失旋光性的混合物。
[0168]
短语“药学可接受盐”在用于本文时指adc的药学可接受的有机或无 机盐。例示性的盐包括但不限于硫酸盐、柠檬酸盐、乙酸盐、草酸盐、氯 化物、溴化物、碘化物、硝酸盐、硫酸氢盐、磷酸盐、酸式磷酸盐、异烟 酸盐、乳酸盐、水杨酸盐、酸式柠檬酸盐、酒石酸盐、油酸盐、丹宁酸盐、 泛酸盐、酒石酸氢盐、抗坏血酸盐、琥珀酸盐、马来酸盐、龙胆酸盐、富 马酸盐、葡糖酸盐、葡糖醛酸盐、糖酸盐、甲酸盐、苯甲酸盐、谷氨酸盐、 甲磺酸盐、乙磺酸盐、苯磺酸盐、对甲苯磺酸盐和扑酸盐(即1,1
’‑
亚甲基
‑ꢀ
双-(2-羟基-3-萘甲酸盐))。药学可接受盐可能牵涉包含另一种分子,诸如乙 酸盐离子、琥珀酸盐离子或其它抗衡离子。抗衡离子可以是稳定母体化合 物电荷的任何有机或无机模块。另外,药学可接受盐可以在其结构中具有 超过一种带电荷原子。在多种带电荷原子作为药学可接受盐的组成部分的 情况中可以具有多种抗衡离子。因此,药学可接受盐可具有一种或多种带 电荷原子和/或一种或多种抗衡离子。
[0169]“药学可接受溶剂化物”指一个或多个溶剂分子和adc的结合。形成 药学可接受溶剂化物的溶剂的例子包括但不限于水、异丙醇、乙醇、甲醇、 dmso、乙酸乙酯、乙酸和乙醇胺。
[0170]
半胱氨酸改造的抗体
[0171]
本发明的化合物包括半胱氨酸改造的抗体,其中野生型或亲代抗体中 的一种或多种氨基酸被半胱氨酸氨基酸替代。由此可以改造任意形式的抗 体,即使其突变。例如,可以将亲代fab抗体片段改造成半胱氨酸改造的 fab,在本文中称作“thiofab”。类似地,可以将亲代单克隆抗体改造成
ꢀ“
thiomab”。应注意单一位点突变在thiofab中产生单一改造的半胱氨酸残 基(single engineered cysteine residue),而单一位点突变在thiomab中产生两 个改造的半胱氨酸残基,这是因igg抗体的二聚化特性所致。评价被半胱 氨酸(cys)残基替代的(“改造的”)突变体的新引入的改造的半胱氨酸硫醇反 应性。硫醇反应值为0-1.0范围内的相对数值范围并且可以测定任意半胱 氨酸改造的抗体的该值。本发明半胱氨酸改造的抗体的硫醇反应值在0.6- 1.0;0.7-1.0;或0.8-1.0的范围。
[0172]
本发明的设计、选择和制备方法能够使半胱氨酸改造的抗体能够与亲 电子官能基(functionability)反应。这些方法进一步能够使抗体偶联物化合 物,诸如抗体-药物偶联物(adc)化合物与药物分子在指定、设计、选择的 位点上反应。抗体表面上的反应性半胱氨酸残基能够通过硫醇反应基,诸 如马来酰亚胺或卤代乙酰基特异性地偶联药物部分。cys残基的硫醇官能基 与马来酰亚胺基的亲核反应性约高于蛋白质中任意其它氨基酸官
能基,诸 如赖氨酸残基的氨基或n-末端氨基约1000倍。碘乙酰试剂和马来酰亚胺试 剂中的硫醇特异性官能基可以与胺基反应,但需要更高的ph(》9.0)和更长的 反应时间(garman,1997,non-radioactive labelling:a practical approach, academic press,london)。
[0173]
本发明半胱氨酸改造的抗体优选保持其野生型亲代抗体对应物的抗原 结合能力。因此,半胱氨酸改造的抗体能够结合,优选特异性结合抗原。 这类抗原包括:例如肿瘤-相关抗原(taa)、细胞表面受体蛋白和其它细胞 表面分子、跨膜蛋白、信号传导蛋白、细胞存活调节因子、细胞增殖调节 因子、与组织发育或分化相关(例如,已知或怀疑在功能上相关)的分子、淋 巴因子、细胞因子、涉及细胞周期调节的分子、涉及血管发生的分子和与 血管发生相关(例如,已知或怀疑在功能上相关)的分子。肿瘤-相关抗原可 以为分化簇因子(即cd蛋白)。能够结合半胱氨酸改造的抗体的抗原可以为 上述类型之一的亚组中的成员,其中所述类型中另一亚组包含具有不同特 性的其它分子/抗原(就所关注的抗原而言)。
[0174]
亲代抗体还可以为选自如上所述的us 5821337的表3中所述的 humab4d5-1、humab4d5-2、humab4d5-3、humab4d5-4、humab4d5-5、 humab4d5-6、humab4d5-7和humab4d5-8(曲妥单抗,)的人 源化抗体,特别将该文献引入本文作为参考;人源化520c9(wo 93/21319) 和如本文所述的人源化2c4抗体。
[0175]
本发明的半胱氨酸改造的抗体可以位点-特异性和有效地与硫醇-反应 试剂偶联。硫醇-反应试剂可以为多官能接头试剂(multifunctional linkerreagent);捕捉物,即亲和、标记试剂(例如生物素-接头试剂);检测试剂(例 如荧光团试剂);固相固定化试剂(例如sepharose
tm
、聚苯乙烯或玻璃) 或药物-接头中间体(drug-linker intermediate)。硫醇-反应试剂的一个实例为 n-乙基马来酰亚胺(nem)。在一个典型的实施方案中,thiofab与生物素
‑ꢀ
接头试剂反应得到生物素化的thiofab,通过这种方式可以检测和测定改造 的半胱氨酸残基的存在和反应性。thiofab与多官能接头试剂反应得到带有 可以与药物部分试剂或其它标记进一步反应的官能化接头的thiofab。 thiofab与药物-接头中间体反应得到thiofab药物偶联物。
[0176]
本文所述的典型方法一般可以应用于鉴定和生产抗体,并且更一般地 通过使用本文所述的设计和筛选步骤用于其它蛋白质。
[0177]
这类手段可以应用于偶联其它硫醇反应试剂,其中反应基为例如马来 酰亚胺、碘乙酰胺、吡啶基二硫化物或其它硫醇反应偶联配偶体(haugland, 2003,molecular probes handbook of fluorescent probes and researchchemicals,molecular probes,inc.;brinkley,1992,bioconjugate chem.3:2; garman,1997,non-radioactive labelling:a practical approach,academicpress,london;means(1990)bioconjugate chem.1:2;hermanson,g.inbioconjugate techniques(1996)academic press,san diego,pp.40-55, 643-671)。所述的配偶体可以为细胞毒性剂(例如毒素,诸如多柔比星 (doxorubicin)或百日咳毒素);荧光团,诸如荧光染料类荧光素或若丹明;用 于成像的螯合剂或放射性治疗金属;肽基或非-肽基标记或检测标记;或清 除-改进剂(clearance-modifying agent),诸如聚乙二醇的不同异构体;结合第 三种成分的肽或另一种碳水化合物或亲脂性试剂。
[0178]
在本文典型抗体片段hu4d5fabv8上鉴定的位点主要位于抗体的恒定域 中,其在所有抗体种类之间为充分保守的。这些位点可广泛适用于其它抗 体,而无需进一步进行结
构设计或有关特异性抗体结构的知识,并且不会 干扰对抗体可变域而言固有的抗原结合特性。
[0179]
可以用于治疗癌症的半胱氨酸改造的抗体包括,但不限于针对细胞表 面受体和肿瘤-相关抗原(taa)的抗体。这类抗体可以用作裸抗体(未与药物 或标记部分偶联)或用作式i抗体-药物偶联物(adc)。肿瘤-相关抗原为本领 域中公知的并且可以制备它们以便用于使用本领域众所周知的方法和信息 生产抗体。在发现用于癌症诊断和疗法的有效细胞靶标的尝试中,研究人 员寻求鉴定与一种或多种正常非癌细胞相比在一种或多种特定类型的癌细 胞表面上特异性表达的跨膜多肽,或肿瘤相关多肽。与非癌细胞相比,通 常这类肿瘤-相关多肽更大量地在癌细胞表面上表达。对这类肿瘤-相关细胞 表面抗原多肽的鉴定已经使人们能够特异性靶向癌细胞,通过基于抗体的 疗法对其进行破坏。
[0180]
taa的实例包括,但不限于下述taa(1)-(36)。为方便起见,均为本领 域公知的有关这些抗原的信息如下所列,并且按照national center forbiotechnology information(ncbi)的核酸和蛋白质序列鉴定规定,包括名称, 可选择的名称,genbank登记号和主要参考文献。相当于taa(1)-(36)的核 酸和蛋白质序列可以在公共数据库,诸如genbank中获得。由抗体靶向的 肿瘤-相关抗原包括所有氨基酸序列变体和同种型,它们与引述的参考文献 中鉴定的序列相比具有至少约70%,80%,85%,90%或95%序列同一性, 或表现出基本上与具有引述参考文献中发现的序列的taa相同的生物特性 或特征。例如,具有变体序列的taa一般能够特异性结合文献中所示相应 序列taa特异性结合的抗体。特别将本文特别引述的参考文献中的序列和 披露内容引入作为参考。
[0181]
肿瘤相关抗原(1)-(36):
[0182]
(1)bmpr1b(骨形态发生蛋白受体-ib型(bone morphogenetic receptor-type ib),genbank登记号nm_001203)ten dijke,p.,等science 264(5155):101-104(1994),oncogene 14(11):1377-1382(1997)); wo2004063362(权利要求2);wo2003042661(权利要求12); us2003134790-a1(38-39页);wo2002102235(权利要求13;页296); wo2003055443(91-92页);wo200299122(实施例2;528-530页); wo2003029421(权利要求6);wo2003024392(权利要求2;附图112); wo200298358(权利要求1;183页);wo200254940(100-101页); wo200259377(349-350页);wo200230268(权利要求27;376页); wo200148204(实施例;附图4);np_001194骨形态发生蛋白受体,ib型 /pid=np_001194.1.交叉参考:mim:603248;np_001194.1;ay065994
[0183]
(2)e16(lat1,slc7a5,genbank登记号nm_003486)biochem.biophys. res.commun.255(2),283-288(1999),nature 395(6699):288-291(1998), gaugitsch,h.w.,等(1992)j.biol.chem.267(16):11267-11273); wo2004048938(实施例2);wo2004032842(实施例iv);wo2003042661(权 利要求12);wo2003016475(权利要求1);wo200278524(实施例2); wo200299074(权利要求19;页127-129);wo200286443(权利要求27;222, 393页);wo2003003906(权利要求10;293页);wo200264798(权利要求 33;页93-95);wo200014228(权利要求5;133-136页);us2003224454(附 图3);wo2003025138(权利要求12;150页);np_003477溶质载体家族 7(solute carrier family 7)(阳离子氨基酸转运蛋白(cationic amino acid transporter),y+系统),成员5/pid=np_003477.3
–
人类;交叉参考: mim:600182;np_003477.3;nm_015923;nm_003486_1
[0184]
(3)steap1(前列腺的六跨膜上皮细胞抗原(six transmembrane epithelial antigen of prostate),genbank登记号nm_012449);cancer res.61(15), 5857-5860(2001),hubert,r.s.,等(1999)proc.natl.acad.sci.u.s.a. 96(25):14523-14528);wo2004065577(权利要求6);wo2004027049(附图 1l);ep1394274(实施例11);wo2004016225(权利要求2); wo2003042661(权利要求12);us2003157089(实施例5); us2003185830(实施例5);us2003064397(附图2);wo200289747(实施例 5;页618-619);wo2003022995(实施例9;附图13a,实施例53;173页, 实施例2;附图2a);np_036581前列腺的六跨膜上皮抗原;交叉参考: mim:604415;np_036581.1;nm_012449_1
[0185]
(4)0772p(ca125,muc16,genbank登记号af361486);j.biol.chem. 276(29):27371-27375(2001));wo2004045553(权利要求14); wo200292836(权利要求6;附图12);wo200283866(权利要求15; 116-121页);us2003124140(实施例16);交叉参考p:gi:34501467; aak74120.3;af361486_1
[0186]
(5)mpf(mpf,msln,smr,巨核细胞强化因子(megakaryocyte potentiating factor),mesothelin,genbank登记号nm_005823)yamaguchi,n., 等biol.chem.269(2),805-808(1994),proc.natl.acad.sci.u.s.a. 96(20):11531-11536(1999),proc.natl.acad.sci.u.s.a.93(1):136-140(1996), j.biol.chem.270(37):21984-21990(1995));wo2003101283(权利要求14); (wo2002102235(权利要求13;287-288页);wo2002101075(权利要求4; 页308-309);wo200271928(320-321页);wo9410312(52-57页);交叉参考: mim:601051;np_005814.2;nm_005823_1
[0187]
(6)napi3b(napi-3b,nptiib,slc34a2,溶质载体家族(solute carrier family)34(磷酸钠),成员2,ii型钠依赖性磷酸转运蛋白3b,genbank登记号 nm_006424)j.biol.chem.277(22):19665-19672(2002),genomics 62(2):281-284(1999),feild,j.a.,等(1999)biochem.biophys.res.commun. 258(3):578-582);wo2004022778(权利要求2);ep1394274(实施例11); wo2002102235(权利要求13;326页);ep875569(权利要求1;17-19页); wo200157188(权利要求20;329页);wo2004032842(实施例iv); wo200175177(权利要求24;139-140页);交叉参考:mim:604217; np_006415.1;nm_006424_1
[0188]
(7)sema 5b(flj10372,kiaa1445,mm.42015,sema5b,semag,脑信 号蛋白(semaphorin)5b hlog,sema结构域,七血小板反应蛋白重复(seven thrombospondin repeats)(1型(type 1)和类1型(type 1-like)),跨膜结构域(tm) 和短胞质域,(脑信号蛋白)5b,genbank登记号ab040878);nagase t.,等 (2000)dna res.7(2):143-150);wo2004000997(权利要求1); wo2003003984(权利要求1);wo200206339(权利要求1;50页); wo200188133(权利要求1;页41-43,48-58);wo2003054152(权利要求 20);wo2003101400(权利要求11);登记号:q9p283;embl; ab040878;baa95969.1.genew;hgnc:10737
[0189]
(8)psca hlg(2700050c12rik,c530008o16rik,riken cdna 2700050c12,riken cdna 2700050c12基因,genbank登记号ay358628); ross等(2002)cancer res.62:2546-2553;us2003129192(权利要求2); us2004044180(权利要求12);us2004044179(权利要求11); us2003096961(权利要求11);us2003232056(实施例5);wo2003105758(权 利要求12);us2003206918(实施例5);ep1347046(权利要求1); wo2003025148(权利要求20);交叉参考:gi:37182378;aaq88991.1; ay358628_1
wo2003042661(权利要求12);wo200230268(权利要求27;391页); us2003219806(权利要求4);wo200162794(权利要求14;附图1a-d);交 叉参考:mim:606936;np_060106.2;nm_017636_1
[0194]
(13)cripto(cr,cr1,crgf,cripto,tdgf1,畸胎瘤-衍生的生长因 子(teratocarcinoma-derived growth factor),genbank登记号np_003203或 nm_003212);ciccodicola,a.,等embo j.8(7):1987-1991(1989),am.j. hum.genet.49(3):555-565(1991));us2003224411(权利要求1); wo2003083041(实施例1);wo2003034984(权利要求12);wo200288170(权 利要求2;页52-53);wo2003024392(权利要求2;附图58);wo200216413(权 利要求1;页94-95,105);wo200222808(权利要求2;附图1);us5854399(实 施例2;col 17-18);us5792616(附图2);交叉参考:mim:187395; np_003203.1;nm_003212_1
[0195]
(14)cd21(cr2(补体受体2)或c3dr(c3d/eb病毒受体(epstein barr virus receptor))或hs.73792genbank登记号m26004);fujisaku等(1989)j. biol.chem.264(4):2118-2125);weis j.j.,等j.exp.med.167,1047-1066, 1988;moore m.,等proc.natl.acad.sci.u.s.a.84,9194-9198,1987;barel m., 等mol.immunol.35,1025-1031,1998;weis j.j.,等proc.natl.acad.sci.u.s.a. 83,5639-5643,1986;sinha s.k.,等(1993)j.immunol.150,5311-5320; wo2004045520(实施例4);us2004005538(实施例1);wo2003062401(权利 要求9);wo2004045520(实施例4);wo9102536(附图9.1-9.9); wo2004020595(权利要求1);登记号:p20023;q13866;q14212;embl;m26004;aaa35786.1
[0196]
(15)cd79b(cd79b,cd79β,igb(免疫球蛋白-相关 β(immunoglobulin-associated beta),b29,genbank登记号nm_000626或 11038674);proc.natl.acad.sci.u.s.a.(2003)100(7):4126-4131,blood(2002) 100(9):3068-3076,muller等(1992)eur.j.immunol.22(6):1621-1625); wo2004016225(权利要求2,附图140);wo2003087768,us2004101874(权 利要求1,页102);wo2003062401(权利要求9);wo200278524(实施例2); us2002150573(权利要求5,页15);us5644033;wo2003048202(权利要求 1,306和309页);wo 99/558658,us6534482(权利要求13,附图17a/b); wo200055351(权利要求11,1145-1146页);交叉参考:mim:147245; np_000617.1;nm_000626_1
[0197]
(16)fcrh2(ifgp4,irta4,spap1a(含有sh2结构域的磷酸酶锚定蛋白 1a(sh2 domain containing phosphatase anchor protein 1a),spap1b,spap1c, genbank登记号nm_030764,ay358130);genome res. 13(10):2265-2270(2003),immunogenetics
ꢀꢀ
54(2):87-95(2002),blood 99(8):2662-2669(2002),proc.natl.acad.sci.u.s.a.98(17):9772-9777(2001), xu,m.j.,等(2001)biochem.biophys.res.commun.280(3):768-775; wo2004016225(权利要求2);wo2003077836;wo200138490(权利要求5; 附图18d-1-18d-2);wo2003097803(权利要求12);wo2003089624(权利要 求25);交叉参考:mim:606509;np_110391.2;nm_030764_1
[0198]
(17)her2(erbb2,genbank登记号m11730);coussens l.,等 science(1985)230(4730):1132-1139);yamamoto t.,等nature 319,230-234, 1986;semba k.,等proc.natl.acad.sci.u.s.a.82,6497-6501,1985;swiercz j.m.,等j.cell biol.165,869-880,2004;kuhns j.j.,等j.biol.chem.274, 36422-36427,1999;cho h.-s.,等
nature 421,756-760,2003;ehsani a.,等(1993) genomics 15,426-429;wo2004048938(实施例2);wo2004027049(附图1i); wo2004009622;wo2003081210;wo2003089904(权利要求9); wo2003016475(权利要求1);us2003118592;wo2003008537(权利要求1); wo2003055439(权利要求29;附图1a-b);wo2003025228(权利要求37; 附图5c);wo200222636(实施例13;95-107页);wo200212341(权利要求 68;附图7);wo200213847(71-74页);wo200214503(页114-117);wo200153463(权利要求2;41-46页);wo200141787(15页); wo200044899(权利要求52;附图7);wo200020579(权利要求3;附图2); us5869445(权利要求3;col 31-38);wo9630514(权利要求2;页56-61); ep1439393(权利要求7);wo2004043361(权利要求7);wo2004022709; wo200100244(实施例3;附图4);登记号:p04626;embl;m11767; aaa35808.1.embl;m11761;aaa35808.1
[0199]
(18)nca(ceacam6,genbank登记号m18728);barnett t.,等genomics 3,59-66,1988;tawaragi y.,等biochem.biophys.res.commun.150,89-96, 1988;strausberg r.l.,等proc.natl.acad.sci.u.s.a.99:16899-16903,2002; wo2004063709;ep1439393(权利要求7);wo2004044178(实施例4); wo2004031238;wo2003042661(权利要求12);wo200278524(实施例2); wo200286443(权利要求27;页427);wo200260317(权利要求2);登记号: p40199;q14920;embl;m29541;aaa59915.1.embl;m18728
[0200]
(19)mdp(dpep1,genbank登记号bc017023);proc.natl.acad.sci. u.s.a.99(26):16899-16903(2002));wo2003016475(权利要求1); wo200264798(权利要求33;85-87页);jp05003790(附图6-8);wo9946284(附 图9);交叉参考:mim:179780;aah17023.1;bc017023_1
[0201]
(20)il20rα(il20ra,zcytor7,genbank登记号af184971);clark h.f., 等genome res.13,2265-2270,2003;mungall a.j.,等nature 425,805-811, 2003;blumberg h.,等cell 104,9-19,2001;dumoutier l.,等j.immunol.167, 3545-3549,2001;parrish-novak j.,等j.biol.chem.277,47517-47523,2002; pletnev s.,等(2003)biochemistry 42:12617-12624;sheikh f.,等(2004)j. immunol.172,2006-2010;ep1394274(实施例11);us2004005320(实施例5); wo2003029262(74-75页);wo2003002717(权利要求2;63页); wo200222153(45-47页);us2002042366(20-21页);wo200146261(57-59 页);wo200146232(63-65页);wo9837193(权利要求1;55-59页);登记号: q9uhf4;q6uwa9;q96sh8;embl;af184971;aaf01320.1
[0202]
(21)brevican(bcan,behab,genbank登记号af229053);gary s.c., 等gene 256,139-147,2000;clark h.f.,等genome res.13,2265-2270,2003; strausberg r.l.,等proc.natl.acad.sci.u.s.a.99,16899-16903,2002; us2003186372(权利要求11);us2003186373(权利要求11);us2003119131(权利要求1;附图52);us2003119122(权利要求1;附图52); us2003119126(权利要求1);us2003119121(权利要求1;附图52); us2003119129(权利要求1);us2003119130(权利要求1);us2003119128(权 利要求1;附图52);us2003119125(权利要求1);wo2003016475(权利要求 1);wo200202634(权利要求1)
[0203]
(22)ephb2r(drt,erk,hek5,epht3,tyro5,genbank登记号 nm_004442);chan,j.和watt,v.m.,oncogene 6(6),1057-1061(1991) oncogene 10(5):897-905(1995),annu.rev.neurosci.21:309-345(1998),int. rev.cytol.196:177-244(2000));
eur.j.biochem.22:1621-1625;hashimoto等(1994)immunogenetics 40(4):287-295;preud’homme等(1992)clin.exp.immunol.90(1):141-146; yu等(1992)j.immunol.148(2)633-637;sakaguchi等(1988)embo j. 7(11):3457-3464
[0210]
(29)cxcr5(伯基特淋巴瘤受体1(burkitt’s lymphoma receptor 1),一种 g蛋白偶联受体,由cxcl13趋化因子活化,在淋巴细胞迁移和体液防御 中起作用,在hiv-2感染中起作用和可能在aids、淋巴瘤、黑素瘤和白血 病发生中起作用);372aa,pi:8.54mw:41959tm:7[p]gene chromosome: 11q23.3,genbank登记号np_001707.1);wo2004040000;wo2004015426; us2003105292(实施例2);us6555339(实施例2);wo200261087(附图1); wo200157188(权利要求20,页269);wo200172830(12-13页); wo200022129(实施例1,152-153页,实施例2,254-256页);wo9928468(权 利要求1,页38);us5440021(实施例2,col 49-52);wo9428931(56-58页); wo9217497(权利要求7,附图5);dobner等(1992)eur.j.immunol. 22:2795-2799;barella等(1995)biochem.j.309:773-779
[0211]
(30)hla-dob(mhc ii类分子的β亚单位(ia抗原),其与肽结合并且将 其呈递给cd4+t淋巴细胞);273aa,pi:6.56,mw:30820.tm:1[p]gene chromosome:6p21.3,genbank登记号np_002111.1);tonnelle等(1985) embo j.4(11):2839-2847;jonsson等(1989)immunogenetics 29(6):411-413;beck等(1992)j.mol.biol.228:433-441;strausberg等(2002) proc.natl.acad.sci usa 99:16899-16903;servenius等(1987)j.biol.chem. 262:8759-8766;beck等(1996)j.mol.biol.255:1-13;naruse等(2002) tissue antigens 59:512-519;wo9958658(权利要求13,附图15); us6153408(col 35-38);us5976551(col 168-170);us6011146(col 145-146);kasahara等(1989)immunogenetics 30(1):66-68;larhammar等 (1985)j.biol.chem.260(26):14111-14119
[0212]
(31)p2x5(嘌呤能受体p2x配体门控离子通道5(purinergic receptor p2x ligand-gated ion channel 5),即由胞外atp门控的离子通道,可能涉及突触 传递和神经发生,其缺陷可以促使特发性逼尿肌不稳定病理生理学情况); 422aa),pi:7.63,mw:47206tm:1[p]gene chromosome:17p13.3,genbank 登记号np_002552.2);le等(1997)febs lett.418(1-2):195-199; wo2004047749;wo2003072035(权利要求10);touchman等(2000) genome res.10:165-173;wo200222660(权利要求20);wo2003093444(权 利要求1);wo2003087768(权利要求1);wo2003029277(82页);
[0213]
(32)cd72(b-细胞分化抗原cd72,lyb-2;359aa),pi:8.66,mw:40225 tm:1[p]gene chromosome:9p13.3,genbank登记号np_001773.1); wo2004042346(权利要求65);wo2003026493(51-52,57-58页); wo200075655(105-106页);von hoegen等(1990)j.immunol. 144(12):4870-4877;strausberg等(2002)proc.natl.acad.sci usa 99:16899-16903
[0214]
(33)ly64(淋巴细胞抗原64(rp105),即富含亮氨酸重复(lrr)家族i型 膜蛋白(type i memberane protein of the leucine rich repeat family),调节b-细 胞细胞活化和程序性细胞死亡,其功能缺失与患有系统性红斑狼疮的患者 的疾病活动增加有关);661aa,pi:6.20,mw:74147tm:1[p]gene chromosome:5q12,genbank登记号np_005573.1);us2002193567; wo9707198(权利要求11,39-42页);miura等(1996)genomics 38(3):299-304;miura等(1998)blood 92:2815-2822;wo2003083047; wo9744452(权利要
求8,57-61页);wo200012130(24-26页)
[0215]
(34)fcrh1(fc受体-样蛋白1(fc receptor-like protein 1),即含有c2 型ig-样结构域和itam结构域的免疫球蛋白fc结构域的推定受体,可能在 b-淋巴细胞分化中起作用);429aa,pi:5.28,mw:46925tm:1[p]gene chromosome:1q21-1q22,genbank登记号np_443170.1);wo2003077836; wo200138490(权利要求6,附图18e-1-18-e-2);davis等(2001)proc.natl. acad.sci usa 98(17):9772-9777;wo2003089624(权利要求8); ep1347046(权利要求1);wo2003089624(权利要求7)
[0216]
(35)irta2(免疫球蛋白超家族受体易位相关2,即在b细胞发育和淋巴 瘤的生成中具有可能的作用的推定的免疫受体;由于易位所导致的基因失 调在某些b细胞恶性肿瘤中发生);977aa,pi:6.88,mw:106468,tm:1 [p]gene chromosome:1q21,genbank登记号人:af343662,af343663, af343664,af343665,af369794,af397453,ak090423,ak090475, al834187,ay358085;小鼠:ak089756,ay158090,ay506558; np_112571.1;wo2003024392(权利要求2,附图97);nakayama等(2000) biochem.biophys.res.commun.277(1):124-127;wo2003077836; wo200138490(权利要求3,附图18b-1-18b-2)
[0217]
(36)tenb2(tmeff2,tomoregulin,tpef,hpp1,tr,与egf/调蛋白 (heregulin)家族生长因子和卵泡抑素(follistatin)有关的推定的跨膜蛋白聚 糖);374aa,ncbi登记号:aad55776,aaf91397,aag49451,ncbirefseq:np_057276;ncbi基因:23671;omim:605734;swissprotq9uik5;genbank登记号af179274;ay358907,caf85723,cq782436; wo2004074320;jp2004113151;wo2003042661;wo2003009814; ep1295944(69-70页);wo200230268(329页);wo200190304; us2004249130;us2004022727;wo2004063355;us2004197325; us2003232350;us2004005563;us2003124579;horie等(2000)genomics 67:146-152;uchida等(1999)biochem.biophys.res.commun. 266:593-602;liang等(2000)cancer res.60:4907-12;glynne-jones等(2001) int j cancer.oct 15;94(2):178-84。
[0218]
亲代抗体还可以为包含清蛋白-结合肽(abp)序列的融合蛋白(dennis等 (2002)“albumin binding as a general strategy for improving thepharmacokinetics of proteins”j biol chem.277:35035-35043;wo 01/45746)。本发明的抗体包括具有下列文献中教导的abp序列的融合蛋 白:(i)dennis等(2002)j biol chem.277:35035-35043,表iii和iv,35038页; (ii)us 20040001827,在[0076];和(iii)wo 01/45746,在12-13页,并且将 所有这些文献引入本文作为参考。
[0219]
诱变
[0220]
可通过本领域中公知的多种方法制备编码起始多肽的氨基酸序列变体 的dna。这些方法包括,但不限于通过位点-定向(或寡核苷酸介导的)诱变、 pcr诱变和对编码所述多肽的较早制备的dna的盒式诱变制备。还可以通 过限制片段操作或通过使用合成寡核苷酸的重叠延伸pcr构建重组抗体的 变体。诱变引物编码半胱氨酸密码子替代物。标准诱变技术可以用于产生 编码这类突变的半胱氨酸改造的抗体的dna。一般指导原则可以在下列文 献中找到:sambrook等molecular cloning,a laboratory manual,cold springharbor laboratory press,cold spring harbor,n.y.,1989;和ausubel等currentprotocols in molecular biology,greene publishing和wiley-interscience,newyork,n.y.,1993。
[0221]
位点-定向诱变为一种制备替代变体,即突变蛋白的方法。这项技术为 本领域众所周知(例如,参见,carter(1985)等nucleic acids res. 13:4431-4443;ho等(1989)基因(amst.)77:51-59;和kunkel等(1987)proc. natl.acad.sci.usa 82:488)。简言之,在进行dna位点-定向诱变过程中, 通过首先使编码所需突变的寡核苷酸与这类起始dna的单链杂交来改变起 始dna。在杂交后,将dna聚合酶用于使用杂交的寡核苷酸作为引物并 且使用起始dna单链作为模板合成完整的第二链。因此,将编码所需突变 的寡核苷酸掺入所得双链dna。位点-定向诱变可以在表达质粒中表达预进 行诱变的蛋白质的基因中进行,并且可以对所得质粒测序以便证实引入了 所需的半胱氨酸替代突变(liu等(1998)j.biol.chem.273:20252-20260)。位 点-定向方案和方式,包括那些商购的方案和方式,例如multisite-directed mutagenesis kit(stratagene,la jolla,ca)。
[0222]
pcr诱变还适合于制备起始多肽的氨基酸序列变体。参见 higuchi,(1990):pcr protocols,pp.177-183,academic press;ito等(1991)基因 102:67-70;bernhard等(1994)bioconjugate chem.5:126-132;和vallette等 (1989)nuc.acids res.17:723-733。简言之,当将少量模板dna用作pcr 中的起始物时,在序列方面稍不同于模板dna中相应区的引物可以用于产 生相对大量的特异性dna片段,这些片段仅在引物不同于模板的位置上不 同于模板序列。
[0223]
用于制备变体的另一种方法,即盒式诱变基于wells等(1985)基因 34:315-323所述的技术。起始物为包含预突变的起始多肽dna的质粒(或其 它载体)。鉴定预突变的起始dna中的密码子。在鉴定的突变位点的每侧 上必须存在独特的限制性内切核酸酶位点。如果不存在这类限制位点,那 么可以使用上述寡核苷酸介导的诱变方法产生它们,以便将其引入起始多 肽dna的适当位置上。在这些位点上切割质粒dna以使其线性化。使用 标准操作步骤合成编码在限制位点之间但含有所需突变的dna序列的双链 寡核苷酸。其中分别合成寡核苷酸的两条链然后使用标准技术彼此杂交。 通过亚磷酰胺合成法(phosphoramidite synthesis method)制备寡核苷酸(us 4415732;us 4458066;beaucage,s.和iyer,r.(1992)"advances in thesynthesis of oligonucleotides by the phosphoramidite approach",tetrahedron 48:2223-2311).这种双链寡核苷酸称作盒(cassette)。将这种盒设计成具有与 线性化质粒末端相容的5'和3'末端,使得它可以直接连接质粒。这种质粒目 前含有突变的dna序列。可以通过dna测序证实含有编码的半胱氨酸替 代物的突变dna。
[0224]
还通过寡核苷酸定向诱变,使用经pcr的诱变的双链质粒dna作为 模板产生单突变(sambrook和russel,(2001)molecular cloning:a laboratorymanual,3rd edition;zoller等(1983)methods enzymol.100:468-500;zoller, m.j.和smith,m.(1982)nucl.acids res.10:6487-6500)。
[0225]
在本发明中,在m13噬菌体上展示的hu4d5fabv8(gerstner等(2002)
ꢀ“
sequence plasticity in the antigen-binding site of a therapeutic anti-her2 antibody”,j mol biol.321:851-62)作为模型系统用于实验。将半胱氨酸突变 引入hu4d5fabv8-噬菌体、hu4d5fabv8和abp-hu4d5fabv8构建体。如上 所述使用聚乙二醇(peg)沉淀法进行hu4d5-thiofab-噬菌体制备(lowman, henry b.(1998)methods in molecular biology(totowa,new jersey) 87(combinatorial peptide library protocols)249-264)。
variant of humanized anti-p185her2 antibody 4d5和comparison with molecular modeling”(1993)j mol biol. 229:969-995)。所有的cys残基均以二硫键形式存在,由此这些残基不具有 任何与药物-马来酰亚胺偶联的反应性硫醇(reactive-thiol group)(除非用还原 剂处理)。因此,新改造的cys残基可以保持不配对并且能够与亲电子接头 试剂或药物-接头中间体(drug-linker intermediate),诸如药物-马来酰亚胺反 应,即与之偶联。附图1a表示x-射线晶体坐标衍生的hu4d5fabv8抗体片 段的三维示意图。按照顺序标号系统给重链和轻链的改造的cys残基的结 构位置编号。这种顺序编号系统(sequential numbering system)与kabat编号 系统相关(kabat等,(1991)sequences of proteins of immunological interest,5th ed.public health service,national institutes of health,bethesda,md),而 kabat编号系统用于附图1b的曲妥单抗(trastuzumab)的4d5v7fabh变体,该 附图表示从n-末端开始的顺序编号方案(上行),它不同于kabat编号方案(下 行)的方面在于a、b、c标注的插入。使用kabat编号系统,实际的线性氨 基酸序列可以含有相当于可变域的fr或cdr的缩短或插入的较少或额外 的氨基酸。通过下表中的顺序编号和kabat编号方案鉴定半胱氨酸改造的重 链变体位点:
[0235]
4d5fab重链变体顺序编号kabat编号a40cala-40ala-40a88cala-88ala-84s119cser-119ser-112s120cser-120ser-113a121cala-121ala-114s122cser-122ser-115a175cala-175ala-168
[0236]
与fab蛋白比较可以快速筛选m13噬菌粒-cys突变体fab(附图3a和 3b)。可以通过在elisa平板上分别包被her2和链霉抗生物素,随后如实 施例2中所述和附图8中描绘的用抗-fab-hrp(辣根过氧化物酶)探测测试结 合抗原和链霉抗生物素的噬菌粒-thiofab。该方法能够用改造的cys残基/ 偶联的生物素分子同时监测对抗原结合和硫醇反应性的作用。此外,该方 法可以应用于筛选在m13噬菌体上展示的任意蛋白质的反应性硫醇。通过 单纯peg沉淀纯化偶联或未偶联的噬菌粒-thiofab。
[0237]
人源化4d5的抗原-结合片段(hu4d5fab)在大肠杆菌中充分表达并且已 经在噬菌体上得到展示(garrard等(1993)基因128:103-109)。在基于elisa 的测定法中在作为模型系统的m13噬菌体上展示抗体fab片段hu4d5fabv8 以便探测硫醇反应性。附图8为pheselector测定法的示意图,其描绘 了生物素化的thiofab噬菌体和抗-噬菌体hrp抗体与her2(上)和链霉抗 生物素(下)的结合。最初从作为距抗原结合表面较远的晶体结构信息中选择 5个氨基酸残基(l-ala43、h-ala40、h-ser119、h-ala121和 h-ser122)(eigenbrot等(1993)j mol biol.229:969-995)。将蛋白质数据库x
‑ꢀ
射线晶体结构命名为1fvc。通过位点定向诱变在这些位置上改造cys残基。 分离thiofab-噬菌体制品并且使其与生物素化试剂反应。
[0238]
使用基于elisa的pheselector测定法(附图8,实施例2)与hrp(辣 根过氧化物酶)-偶联的抗-噬菌体抗体测试生物素偶联和未偶联物的变体的 her2和链霉抗生物素结
合。通过显色标准hrp反应并且在450nm处测定 吸光度用抗-m13-辣根过氧化物酶(hrp)抗体监测未-生物素化的噬菌体
ꢀ‑
hu4d5fabv8(附图2a)和生物素化的噬菌体-hu4d5fabv8(附图2b)与bsa(空 心条)、her2(灰色条)或链霉抗生物素(实心条)的相互作用。在450nm处测 定因显色底物的更新(turnover)产生的吸光度。thiofab与her2的反应性确 定抗原结合。thiofab与链霉抗生物素的反应性确定生物素化程度。thiofab 与bsa的反应性为非特异性相互作用的阴性对照。正如在附图2a中观察 到的,所有thiofab-噬菌体变体均具有与野生型hu4d5fabv8-噬菌体相似的 与her2的结合。此外,与生物素偶联不会干扰thiofab与her2结合(附 图2b)。
[0239]
令人惊奇和出人意料的是,thiofab-噬菌体样品表现出可变水平的链霉 抗生物素结合活性。在来自所有测试的噬菌体-thiofab中,a121c半胱氨 酸改造的抗体表现出最大的硫醇反应性。尽管将野生型hu4d5fabv8-噬菌体 与相同量的生物素-马来酰亚胺一起孵育,但是这些噬菌体几乎没有链霉抗 生物素结合,表明预先存在来自hu4d5fabv8和m13噬菌体包膜蛋白的半 胱氨酸残基(涉及二硫键形成)不会干扰生物素-马来酰亚胺的位点-特异性偶 联。这些结果表明可以将噬菌体elisa测定法成功地用于筛选fab表面上 的反应性硫醇。
[0240]
pheselector测定法能够筛选抗体中的反应性硫醇。通过该方法鉴 定a121c变体是典型的。可以有效地研究完整的fab分子以便鉴定更多的 带有反应性硫醇的thiofab变体。参数,表面可接近分数(fractional surface accessibility),用于鉴定和定量溶剂与多肽中的氨基酸残基的可接近性。将 表面可接近性表示为可以由溶剂分子,例如水接触的表面积水占据的 空间近似为半径球体。软件为自由可获得的或经许可的(secretary to ccp4,daresbury laboratory,warrington,wa4 4ad,united kingdom, fax:(+44)1925 603825,或通过因特网: www.ccp4.ac.uk/dist/html/index.html),如使用计算具有已知x射线衍射晶 体分析法衍生的坐标的每种蛋白质的氨基酸的表面可接近性的算法的晶体 学程序ccp4 suite(“the ccp4 suite:programs for protein crystallography”(1994)acta.cryst.d50:760-763)。执行表面可接近性计算的 两种典型的软件模块为“areaimol”和“surface”,其基于b.lee和 f.m.richards的算法(1971)j.mol.biol.55:379-400。areaimol将蛋白质的 溶剂可接近表面定义为探针球(probe sphere)(代表溶剂分子)中心的位置,此 时它在蛋白质的van der waals表面上翻转。areaimol计算溶剂可接近的 表面积,通过在有关每一原子的扩充的球体上产生表面点(在距等于原子和 探针半径总和的原子中心的距离处),并且消除属于与相邻原子结合的等同 球体内的那些点来进行。areaimol测定了pdb坐标文件中原子的溶剂可 接近面积并且概括了残基、链和完整分子的可接近面积。可以将各原子的 可接近面积(或面积差)存储成假拟-pdb输出文件。areaimol推定了每一 成分的单一半径并且仅识别有限数量的不同成分。将未知原子类型(即那些 在areaimol内部数据库中没有的原子类型)指定为的缺省半径。识 别的原子的列表为:
[0241][0242]
areaimol和surface报导了绝对可接近性,即平方埃数。通过 参比多肽内的相关氨基酸的标准状态计算表面可接近分数。参比状态为三 肽gly-x-gly,其中x为所关注的氨基酸,且参比状态应为'扩展的'构象, 即如那些在β-链中的构象。扩展的构象使可接近性x达到最大值。用计算 的可接近面积除以gly-x-gly三肽参比状态中可接近的面积并且报导商数, 其为可接近分数。可接近性百分比为可接近分数乘以100。
[0243]
计算表面可接近性的另一种典型算法基于程序xsae的solv模块 (broger,c.,f.hoffman-laroche,basel),它基于多肽的x-射线坐标计算氨基 酸残基与水球体的可接近分数。
[0244]
使用晶体结构信息计算hu4d5fabv7中的每个氨基酸的表面可接近分数 (eigenbrot等(1993)j mol biol.229:969-995;us 7521541)。将下列两个标准 应用于鉴定可以改造以便用cys残基替代的hu4d5fabv8的残基:
[0245]
1.消除完全掩蔽的氨基酸残基,即小于10%的表面可接近分数。 hu4d5fabv8中存在大于10%可接近性(表面可接近分数)的134(轻链)和 151(重链)个残基。选择上部的10个最可接近的ser、ala和val残基是因其 它氨基酸与cys的结构更相似,从而由新改造的cys向抗体中引入了仅为 最小的结构约束。还可以筛选其它半胱氨酸替代位点并且可以用于偶联。
[0246]
2.基于其在fab的功能和结构相互作用中的作用分选残基。进一步选 择抗原相互作用中未涉及并且远离存在的二硫键的残基。新改造的cys残 基应不参与(distinct from)并且不干扰抗原结合,也不会与二硫键形成中涉及 的半胱氨酸错配。
[0247]
硫醇反应性可以广泛化至任意的抗体,其中氨基酸被反应性半胱氨酸 氨基酸替代在选自下列的轻链范围内进行:l-10-l-20;l-38-l-48;l-105 -l-115;l-139-l-149;l-163-l-173;和选自下列的重链范围内进行: h-35-h-45;h-83-h-93;h-114-h-127;和h-170-h-184;和选自下列 范围的fc区中进行:h-268-h-291;h-319-h-344;h-370-h-380;和 h-395-h-405。
[0248]
硫醇反应性可以广泛化至抗体的某些结构域,诸如轻链恒定域(cl)和重 链恒定域ch1、ch2和ch3。产生约0.8和0.8以上硫醇反应值的半胱氨酸 替代可以在如下完整抗体
的重链恒定域α、δ、ε、γ和μ中进行:分别为iga、 igd、ige、igg和igm,包括igg亚类:igg1、igg2、igg3、igg4、iga1 和iga2。
[0249]
从晶体结构数据中显然可以看出选择的10种cys突变体远离抗原-结合 部位,诸如在这种情况下的与her2的界面。可以通过实验测试这些突变 体对功能相互作用的间接影响。测定所有cys fab变体的硫醇反应性并且如 实施例1和2中所述计算且列在表1中。残基l-v15c、l-v110c、h-a88c 和h-a121c具有反应性且稳定的硫醇(附图3a和3b)。突变体v15c、 v110c、a144c、s168c为轻链cys变体。突变体a88c、a121c、a175c、 s179c为重链cys变体。令人惊奇和出人意料的是具有高表面可接近分数 的位点不具有通过pheselector测定法计算的最高硫醇反应性(表1)。换 句话说,表面可接近分数(附图1a)与硫醇反应性不相关(表1)。实际上,在 具有20%-80%的中度表面可接近性的位点上改造的cys残基(附图4a)或 部分暴露的位点,如ala或val残基表现出优于在ser残基上引入的cys的 硫醇反应性,即》0.6(附图3b,表1),由此必须在硫醇反应位点筛选中使用 pheselector测定,因为仅晶体结构信息不足以选择这些位点(附图3b 和4a)。
[0250]
硫醇反应性数据如附图3a和3b中对4d5 thiofab cys突变体:(3a)未
‑ꢀ
生物素化(对照组)和(3b)生物素化的噬菌体-thiofab的氨基酸残基所示。通 过对未-生物素化的噬菌体-hu4d5fabv8(3a)和生物素化的噬菌体
ꢀ‑
hu4d5fabv8(3b)与bsa(空心条)、her2(灰色条)或链霉抗生物素(实心条) 相互作用的pheselector测定分析鉴定抗体/fab上的反应性硫醇。如实 施例2中所述进行测定。轻链变体位于左侧,而重链变体位于右侧。未-生 物素化的4d5 thiofab cys突变体的结合如所预计的低,但与her2的强力 结合得到保持。与链霉抗生物素和与生物素化的4d5 thiofab cys突变体的 her2结合比得到表1中的硫醇反应值。在450nm处的背景吸光度或生物 素化的4d5 thiofab cys突变体与bsa的少量非特异性蛋白结合也在附图 3b中显而易见。被cys残基替代的选择的氨基酸残基的表面可接近分数值 如附图4a中所示。根据可得到的hu4d5fabv7结构计算表面可接近分数 (eigenbrot等(1993)j mol biol.229:969-995)。hu4d5fabv7和hu4d5fabv8结 构的构象参数高度一致并且能够测定hu4d5fabv7的表面可接近分数计算 与hu4d5fabv8半胱氨酸突变体的硫醇反应性之间的任何相关性。在部分暴 露的残基(ala或val)上引入的噬菌体thiofab cys残基的经测定的硫醇反应 性具有优于在ser残基上引入的cys残基硫醇反应性(表1)。从来自表1的 thiofab cys突变体中可以观察到在硫醇反应性值与表面可接近分数之间几 乎没有或无相关性。
[0251]
抗体的l-15、l-43、l-110、l-144、l-168、h-40、h-88、h-119、h-121、 h-122、h-175和h-179位置上的氨基酸一般可以被游离半胱氨酸氨基酸突 变(替代)。在这些位置的每侧上约5个氨基酸残基内的范围也可以被游离半 胱氨酸替代,即l-10-l-20;l-38-l-48;l-105-l-115;l-139-l-149; l-163-l-173;h-35-h-45;h-83-h-93;h-114-h-127;和h-170-h-184, 以及选自下列的fc区的范围内:h-268-h-291;h-319-h-344;h-370- h-380;和h-395-h-405,从而得到本发明的半胱氨酸改造的抗体。
[0252]
表1噬菌体-thiofab的硫醇反应性
[0253]
噬菌体-thiofab构建体硫醇反应性
*
表面可接近性分数(%)hu4d5fabv8-wt0.125-l-v15c0.93452.46
l-a43c0.38526.80l-v110c0.85044.84l-a144c0.37323.65l-s168c0.51479.68h-a40c0.45021.97h-a88c0.91451.60h-s119c0.68018.88h-a121c0.92533.05h-s122c0.72072.87h-a175c0.1923.80h-s179c0.44699.48
[0254]
l=轻链,h=重链,a=丙氨酸,s=丝氨酸,v=缬氨酸,c=半胱氨酸 *
将硫醇反应性测定为链霉抗生物素结合的od
450nm
与her2(抗体)结合的 od
450nm
之比(实施例2)。硫醇反应性值为1表示半胱氨酸硫醇的完全生物 素化。
[0255]
选择两种来自轻链的cys变体(l-v15c和l-v110c)和两种来自重链的 cys变体(h-a88c和h-a121c)用于进一步分析,因为这些变体表现出最高 的硫醇反应性(表1)。
[0256]
不同于噬菌体纯化,fab制备可能需要2-3天,这取决于生产规模。在 此期间,因氧化而导致硫醇反应性丧失。为了探测hu4d5fabv8-噬菌体上硫 醇的稳定性,测定了噬菌体-thiofab的硫醇反应性的稳定性(附图4b)。在第 1天、第2天和第4天进行thiofab-噬菌体纯化后,使所有样品与生物素
ꢀ‑
peo-马来酰亚胺偶联并且用噬菌体elisa测定法(pheselector)探测以 测试her2和链霉抗生物素结合。l-v15c、l-v110c、h-a88c和h-a121c 与其它thiofab变体相比保持了显著的硫醇反应性(附图4b)。
[0257]
标记的半胱氨酸改造的抗体
[0258]
本发明的半胱氨酸改造的抗体可以与任意标记部分(label moiety)偶联, 所述的标记部分可以通过反应性半胱氨酸硫醇与该抗体共价结合(singh等 (2002)anal.biochem.304:147-15;harlow e.和lane,d.(1999)usingantibody:a laboratory manual,cold springs harbor laboratory press,coldspring harbor,ny;lundblad r.l.(1991)chemical试剂for proteinmodification,2nd ed.crc press,boca raton,fl)。结合的标记可以起如下作 用:(i)提供可检测标记信号;(ii)与第二种标记发生相互作用以改变由第 一种或第二种标记提供的可检测信号,例如得到fret(荧光共振能量转移); (iii)使相互作用稳定或增加与抗原或配体的结合亲和力;(iv)通过电荷、 亲水性、形状或其它物理参数影响运动性,例如电泳迁移率或细胞渗透性; 或(v)提供捕捉部分(capture moiety),以调节配体亲和力、抗体/抗原结合或 离子络合。
[0259]
标记的半胱氨酸改造的抗体可以用于诊断试验,例如用于检测所关注 抗原在特异性细胞、组织或血清中的表达。就诊断应用而言,一般用可检 测部分标记该抗体。可利用大量标记,一般可以将它们分成如下类:
[0260]
(a)放射性同位素(放射性核素),诸如3h、
11
c、
14
c、
18
f、
32
p、
35
s、 64
cu、
68
ga、
86
y、
89
zr、
99
tc、
111
in、
123
i、
124
i、
125
i、
131
i、
133
xe、
177
lu、
211
at、 或
213
bi。放射性同位素标记的抗体用于受体靶向的成像实验。可以使用 current protocols in immunology,(1991)volumes 1和2,
coligen等,ed. wiley-interscience,new york,ny,pubs.中所述的技术用配体试剂标记抗体, 所述配体试剂结合、螯合乃至复合放射性同位素金属,其中所述试剂与改 造的抗体的半胱氨酸硫醇反应。可以复合金属离子的螯合配体包括dota、 dotp、dotma、dtpa和teta(macrocyclics,dallas,tx)。可以通过与本 发明的抗体-药物偶联物复合靶向放射性核素(wu等(2005)naturebiotechnology 23(9):1137-1146)。dota-马来酰亚胺试剂与半胱氨酸改造的 抗体的游离半胱氨酸氨基酸反应并且得到抗体上的金属复合配体(lewis等 (1998)bioconj.chem.9:72-86)。螯合接头标记试剂,诸如 dota-nhs(1,4,7,10-四氮杂环十二烷-1,4,7,10-四乙酸一(n-羟基琥珀酰亚胺 酯)为商购的(macrocyclics,dallas,tx)。使用放射性核素标记的抗体成像的 受体靶标可以通过检测和定量肿瘤组织中抗体的进行性蓄积提供活化途径 标记(albert等(1998)bioorg.med.chem.lett.8:1207-1210)。
[0261]
用于成像实验的适合于作为抗体标记的金属-螯合物复合物(us 2010/0111856;us 5342606;us 5428155;us 5316757;us 5480990;us 5462725;us 5428139;us 5385893;us 5739294;us 5750660;us 5834456; hnatowich等(1983)j.immunol.methods 65:147-157;meares等(1984)anal. biochem.142:68-78;mirzadeh等(1990)bioconjugate chem.1:59-65;meares 等(1990)j.cancer1990,suppl.10:21-26;izard等(1992)bioconjugate chem. 3:346-350;nikula等(1995)nucl.med.biol.22:387-90;camera等(1993)nucl. med.biol.20:955-62;kukis等(1998)j.nucl.med.39:2105-2110;verel等 (2003)j.nucl.med.44:1663-1670;camera等(1994)j.nucl.med. 21:640-646;ruegg等(1990)cancer res.50:4221-4226;verel等(2003)j.nucl. med.44:1663-1670;lee等(2001)cancer res.61:4474-4482;mitchell,等(2003) j.nucl.med.44:1105-1112;kobayashi等(1999)bioconjugate chem. 10:103-111;miederer等(2004)j.nucl.med.45:129-137;denardo等(1998) clinical cancer research 4:2483-90;blend等(2003)cancer biotherapy& radiopharmaceuticals 18:355-363;nikula等(1999)j.nucl.med.40:166-76; kobayashi等(1998)j.nucl.med.39:829-36;mardirossian等(1993)nucl.med. biol.20:65-74;roselli等(1999)cancer biotherapy&radiopharmaceuticals, 14:209-20)。
[0262]
(b)荧光标记,诸如稀土元素螯合物(铕螯合物);荧光素类,包括fitc、 5-羧基荧光素、6-羧基荧光素;若丹明类,包括tamra;丹酰;丽丝胺(lissamine);花青(cyanines);藻红蛋白;德克萨斯红;及其类似物。例如, 可以使用同上文的current protocols in immunology中披露的技术使荧光标 记与抗体偶联。荧光染料和荧光标记试剂包括商购自invitrogen/molecularprobes(eugene,or)和pierce biotechnology,inc.(rockford,il)的那些荧光染 料和荧光标记试剂。
[0263]
检测标记,诸如荧光染料和化学发光染料(briggs等(1997)"synthesis offunctionalised fluorescent dyes和their coupling to amines and amino acids," j.chem.soc.,perkin-trans.1:1051-1058)提供了可检测信号并且一般应用于 标记抗体,这些抗体优选具有如下特性:(i)标记的抗体应产生极高的信号 与低背景,使得可以在无细胞和基于细胞的试验中灵敏地检测少量抗体; 和(ii)标记的抗体应是光稳定的,以便可以观察、监测和记录荧光信号,而 无显著的光漂白。就涉及标记抗体与膜或细胞表面,尤其是活细胞的细胞 表面结合的应用而言,标记优选(iii)具有良好的水溶性以便获得有效偶
联物 浓度和检测灵敏度和(iv)对活细胞无毒性,以便不会破坏细胞的正常代谢过 程或导致过早细胞死亡。
[0264]
(c)各种酶-底物标记为可得到的或披露的(us 4275149)。酶一般催化 可以使用各种技术测定的显色底物的化学改变。例如,酶可催化底物中的 颜色改变,而这种改变可以通过分光光度法测定。或者,酶可以改变底物 的荧光或化学发光。用于定量荧光改变的技术如上所述。化学发光底物通 过化学反应变成电激发的且然后可以发射可测定的光(例如使用化学发光计) 或给荧光接受器提供能量。酶促标记的实例包括:荧光素酶(例如荧火虫荧 光素酶和细菌荧光素酶;us 4737456);萤光素;2,3-二酞嗪二酮类;苹果酸 脱氢酶;尿素酶;过氧化物酶,诸如辣根过氧化物酶(hrp);碱性磷酸酶(ap); β-半乳糖苷酶;葡萄糖淀粉酶;溶菌酶;糖氧化酶(例如葡萄糖氧化酶、半 乳糖氧化酶和葡萄糖-6-磷酸脱氢酶);杂环氧化酶(诸如尿酸酶和黄嘌呤氧化 酶);乳过氧化物酶;微过氧化物酶等。用于使酶与抗体偶联的技术描述在 o'sullivan等(1981)“methods for the preparation of enzyme-antibody cojugatefor use in enzyme immunoassay”:methods in enzym.(ed j.langone&h.vanvunakis),academic press,new york,73:147-166中。
[0265]
酶-底物组合的实例(us 4275149;us 4318980)包括,例如:
[0266]
(i)辣根过氧化物酶(hrp)与作为底物的过氧化氢酶,其中过氧化氢酶氧 化染料前体(例如邻苯二胺(opd)或3,3',5,5'-四甲基联苯胺盐酸盐(tmb));
[0267]
(ii)碱性磷酸酶(ap)与作为显色底物的磷酸对-硝基苯基酯;和
[0268]
(iii)β-d-半乳糖苷酶(β-d-gal)与显色底物(例如对-硝基苯基-β-d-半乳 糖苷酶)或荧光底物4-甲基伞形基(umbelliferyl)-β-d-半乳糖苷酶。
[0269]
标记可以与半胱氨酸改造的抗体间接偶联。例如,抗体可以与生物素 偶联,并且上述三大类标记中的任意类可以与抗生物素蛋白或链霉抗生物 素偶联,或反之亦然。生物素选择性地结合链霉抗生物素,且由此标记可 以按照这种间接方式与抗体偶联。或者,为了实现标记与多肽变体的间接 偶联,使多肽变体与小的半抗原(例如地高辛)偶联并且上述不同类型标记之 一与抗-半抗原多肽变体偶联(例如抗-地高辛抗体)。因此,可以实现标记与 多肽变体的间接偶联(hermanson,g.(1996)in biocojugate techniquesacademic press,san diego)。
[0270]
本发明的多肽变体可以用于任意已知的测定方法中,诸如elisa、竞 争性结合测定法、直接和间接夹心式测定法和免疫沉淀测定法(zola,(1987) monoclonal antibodies:a manual of techniques,pp.147-158,crc press,inc.).
[0271]
检测标记可以用于定位、显影和定量结合或识别结果。本发明标记的 抗体可以检测细胞-表面受体。另一种用于检测标记的抗体的应用在于基于 珠的免疫捕捉,包含使珠与荧光标记的抗体偶联并且检测配体结合时的荧 光信号。类似的结合检测方法使用表面等离子共振(spr)效应以测定和检测 抗体-抗原相互作用。
[0272]
本发明标记的半胱氨酸改造的抗体用作生物医学和分子成像的各种方 法和技术的成像生物标记物和探针,所述的方法和技术诸如:(i)mri(磁共 振成像);(ii)microct(电子计算机化断层x线摄影法);(iii)spect(单光子 发射计算机断层术);(iv)pet(正电子发射断层照相术)tinianow,j.et al (2010)nuclear medicine and biology,37(3):289-297;chen等(2004) bioconjugate chem.15:41-49;us 2010/0111856;(v)生物发光;
(vi)荧光; 和(vii)超声。免疫闪烁成像为一种成像方法,其中将放射性物质标记的抗 体给予动物或人体患者并且取抗体定位的部位的图像(us 6528624)。可以客 观测定成像生物标记物并且作为正常生理过程、病理过程或对治疗干预的 药理反应的指示评价。生物标记物可以具有几种类型:0型为疾病的天然 历史标记物并且与已知的临床指标纵向相关,例如类风湿性关节炎中滑液 炎症的mri评价;i型标记捕捉按照作用机制干预的作用,即使该机制与 临床结果无关;ii型标记作为替代终点(surrogate endpoint)起作用,其中生 物标记的改变或信号预测临床有益性以便“验证”靶向的反应,诸如通过ct 在类风湿性关节炎中测定的骨质侵蚀。成像生物标记物由此可以提供有关 下列的药效(pd)治疗信息:(i)靶蛋白的表达;(ii)治疗剂与靶蛋白的结合, 即选择性;和(iii)清除和半衰期药代动力学数据。与基于实验室的生物标 记物有关的体内成像生物标记物的优点包括:非-侵害性治疗;可定量;整 体评价;重复给药和评价,即多时间点;和从前期临床(小动物)到临床(人) 结果的潜在可转移的作用。就某些应用而言,生物成像替代了前期临床研 究中的动物实验或将其次数减少到了最低限度。
[0273]
肽标记方法为众所周知的。参见haugland,2003,molecular probeshandbook of fluorescent probes and research chemicals,molecular probes, inc.;brinkley,1992,bioconjugate chem.3:2;garman,(1997)non-radioactivelabelling:a practical approach,academic press,london;means(1990) biogconjugate chem.1:2;glazer等(1975)chemical modification of proteins. laboratory techniques in biochemistry和molecular biology(t.s.work和e. work,eds.)american elsevier publishing co.,new york;lundblad,r.l.和 noyes,c.m.(1984)chemical reagents for protein modification,vols.i和ii, crc press,new york;pfleiderer,g.(1985)“chemical modification ofproteins”,modern methods in protein chemistry,h.tschesche,ed.,walterdegryter,berlin和new york;和wong(1991)chemistry of proteinconjugation and cross-linking,crc press,boca raton,fla.);deleon-rodriguez等(2004)chem.eur.j.10:1149-1155;lewis等(2001) bioconjugate chem.12:320-324;li等(2002)bioconjugate chem. 13:110-115;mier等(2005)bioconjugate chem.16:240-237。
[0274]
使用两部分,即荧光报道基团和猝灭物标记的肽类和蛋白质能够充分 近似地进行荧光共振能量转移(fret)。报道基团一般为由一定波长的光激 发的荧光染料并且可以将能量转移至接受或猝灭基团,其中对于在最大亮 度时发射而言存在适当的stokes偏移。荧光染料包括具有延长的芳香性的 分子,诸如荧光素和若丹明及其衍生物。可以通过完整肽的猝灭物部分部 分或明显地使荧光报道分子猝灭。在通过肽酶或蛋白酶裂解肽时,可以测 定荧光中的可检测到的增加(knight,c.(1995)“fluorimetric assays ofproteolytic enzymes”,methods in enzymology,academic press,248:18-34)。
[0275]
还可以将本发明标记的抗体用作亲和纯化试剂。在该方法中,使用本 领域众所周知的方法将标记的抗体固定在固相上,诸如sephadex树脂或滤纸 上。使固定化抗体与含有预纯化的抗原的样品接触,且此后用可基本上除 去样品中除预纯化的抗原外的所有物质的适当溶剂洗涤支持物,所述抗原 与固定的多肽变体结合。最终用另一种合适的溶剂,诸如ph 5.0的甘氨酸缓 冲液洗涤支持物,该溶剂能够使所述抗原从所述多肽变体中释放。
[0276]
标记试剂一般具有反应性官能基,它可以与:(i)半胱氨酸改造的抗体的 半胱氨酸硫醇直接反应而形成标记的抗体;(ii)与接头试剂反应而形成接头
‑ꢀ
标记中间体;或(iii)与接头抗体反应而形成标记的抗体。标记试剂的反应 性官能基包括:马来酰亚胺、卤代乙酰基、碘乙酰胺琥珀酰亚胺基酯(例如 nhs,n-羟基琥珀酰亚胺)、异硫氰酸酯、磺酰氯、2,6-二氯三嗪基、五氟苯 基酯和亚磷酰胺,不过,也可以使用其它的官能基。
[0277]
生物素-马来酰亚胺与thiofab的偶联
[0278]
在有噬菌体存在下建立上述thiofab特性,因为fab与噬菌体包膜蛋白 的融合体能够改变cys硫醇可接近性或反应性。因此,将thiofab构建体在 碱性磷酸酶启动子控制下克隆入表达载体(chang等(1987)gene 55:189-196) 并且通过使大肠杆菌细胞在不含磷酸盐的培养基中生长诱导thiofab表达。 使用蛋白质g sepharose
tm
柱纯化thiofab并且使用还原和非-还原 sds-page凝胶分析。这些分析能够评价thiofab是否可以保持其反应性硫 醇或因形成分子内或分子间二硫键而被失活。通过蛋白质-g sepharose
tm
柱层析法表达和纯化thiofab l-v15c、l-v110c、h-a88c和h-a121c(参 见方法的详细描述部分)。使用sds-page凝胶在还原(使用dtt)和非-还原 (不用dtt)条件下分析纯化的蛋白质。其它还原剂,诸如bme(β-硫醇乙醇) 可以用于凝胶以便裂解链间二硫键。从sds-page凝胶分析中显而易见 thiofab的主要(~90%)级分为单体形式,而野生型hu4d5fabv8基本上为单 体形式(47kda)。
[0279]
将thiofab(a121c)和野生型hu4d5fabv8与100倍过量的生物素-马来 酰亚胺一起在室温温育3小时并且使生物素化的fab上样至superdex-200
tm
凝胶过滤柱。该纯化步骤用于从寡聚化fab并且还从过量的游离生物素-马 来酰亚胺(或游离细胞毒性药物)中分离单体fab。
[0280]
附图5表示在没有噬菌体背景存在下thiofab变体特性的验证。表达不 含噬菌体融合体、hu4d5fabv8和hu4d5fabv8-a121c(thiofab-a121c)的蛋 白质并且使用蛋白质-g琼脂糖柱纯化,随后与100倍摩尔过量的生物素
‑ꢀ
马来酰亚胺一起温育。比较生物素化的cys改造的thiofab和未-生物素化 的野生型fab的链霉抗生物素和her2结合。通过elisa分析监测生物素 偶联程度(与链霉抗生物素相互作用)及其与her2的结合能力。以2ng和 20ng测试每种fab。
[0281]
生物素化的a121c thiofab保持与野生型hu4d5fabv8相差无几的 her2结合性(附图5)。通过凝胶过滤柱层析法纯化野生型fab和 a121c-thiofab。通过elisa,使用山羊抗-fab-hrp作为二抗测试两种样 品的her2和链霉抗生物素结合性。野生型(空心条)和thiofab(带虚线的条) 均具有与her2的类似结合性,但仅thiofab保持链霉抗生物素结合性。使 用未-生物素化的野生型hu4d5fabv8仅观察到与链霉抗生物素背景水平的 相互作用(附图5)。对生物素化-thiofab(a121c)的质谱(lc-esi-ms)分析产 生了与野生型hu4d5fabv8(47737道尔顿)相比具有48294.5道尔顿的主峰。 在两种分子之间存在537.5道尔顿差正相当于与thiofab偶联的单一生物素
ꢀ‑
马来酰亚胺。质谱蛋白质测序(lc-esi-串联质谱分析(lc-esi-tandem massspec analysis))结果进一步证实了偶联的生物素分子是在新改造的cys残基 上(表8,实施例3b)。
[0282]
生物素-马来酰亚胺与清蛋白结合肽(abp)-thiofab的位点特异性偶联
[0283]
血浆蛋白结合可以为改善短寿命分子的药代动力学特性的有效方式。 清蛋白为
血浆中最丰富的蛋白质。血清清蛋白结合肽类(abp)可以改变融合 的活性结构域蛋白的药效学特性,包括组织摄取、渗透和扩散的改变。可 以通过特异性选择合适的血清清蛋白结合肽序列调节这些药效学参数(us 20040001827)。通过噬菌体展示筛选鉴定一系列清蛋白结合肽(dennis等 (2002)“albumin binding as a general strategy for improving thepharmacokinetics of proteins”j biol chem.277:35035-35043;wo 01/45746)。 本发明的化合物包括由下列文献中教导的abp序列:(i)dennis等(2002)jbiol chem.277:35035-35043,表iii和iv,35038页;(ii)us 20040001827,[0076];和(iii)wo 01/45746,12-13页,并且将所有这些文献引入本文作为 参考。
[0284]
通过按照1:1(1abp/1fab)化学计算比融合清蛋白结合肽与fab重链 的c-末端改造清蛋白结合(abp)-fab。经证实这些abp-fab与清蛋白结合将 其在兔和小鼠中的半衰期增加了25倍以上。由此可以将上述反应性cys残 基引入这些abp-fab并且用于与细胞毒性药物的位点-特异性偶联,随后进 行体内动物研究。
[0285]
典型的清蛋白结合肽序列包括,但不限于seq id no:1-5中所列的氨 基酸序列:
[0286]
cdkthtgggsqrlmediclprwgclweddf seq id no:1
[0287]
qrlmediclprwgclweddf seq id no:2
[0288]
qrliediclprwgclweddf seq id no:3
[0289]
rliediclprwgclwedd seq id no:4
[0290]
diclprwgclw seq id no:5
[0291]
清蛋白结合肽(abp)序列结合来自多物种(小鼠、大鼠、兔、牛、猕猴、 狒狒和人)的清蛋白,具有的kd(兔)=0.3μm。清蛋白结合肽不与已知配体 竞争性结合清蛋白并且在兔中具有的半衰期(t1/2)为2.3小时。如上述部分中 所述使用bsa-sepharose
tm
纯化abp-thiofab蛋白,随后进行生物素-马 来酰亚胺偶联并且使用superdex-s200柱层析法纯化。纯化的生物素化的蛋 白质为均一性的(homogeneous)并且无任何寡聚化形式(实施例4)。
[0292]
附图6表示清蛋白结合肽(abp)-thiofab变体的特性。进行elisa分析 以测试abp-hu4d5fabv8-wt、abp-hu4d5fabv8-v110c和 abp-hu4d5fabv8-a121c与兔清蛋白、链霉抗生物素和her2的结合能力。 生物素化的abp-thiofab能够以与野生型abp-hu4d5fabv8相似的亲和力 结合清蛋白和her2,正如通过elisa(附图6)和biacore结合动力学分析(表 2)所证实的。如所述的给elisa平板包被清蛋白、her2和sa。用抗-fab hrp 探测生物素化的abp-thiofab与清蛋白、her2和sa的结合。与非生物素 化的对照abp-hu4d5fabv8-wt相比,生物素化的abp-thiofab能够结合链 霉抗生物素,这表明abp-thiofab与生物素马来酰亚胺类thiofab以位点 特异性方式偶联,因为相同的cys突变体用于两种变体(附图6)。
[0293]
表2生物素化的abp-hu4d5fabv8野生型和thiofab结合her2和兔清蛋 白的biacore动力学分析
[0294]
抗体k
on
(m-1
s-1
)k
off
(s-1
)kd(nm)her2结合野生型4.57x1054.19x10-5
0.0917v110c4.18x1054.05x10-5
0.097a121c3.91x1054.15x10-5
0.106兔清蛋白结合
野生型1.66x1050.0206124v110c2.43x1050.0331136a121c1.70x1050.0238140
[0295]
abp=清蛋白结合肽
[0296]
或者,可以通过经接头部分的共价结合使清蛋白-结合肽与抗体连接。
[0297]
每个fab使用两个游离硫醇基对abp-thiofab改造
[0298]
上述结果表明所有四种(l-v15c、l-v110c、h-a88c和h-a121c) thiofab(半胱氨酸改造的fab抗体)变体具有可以用于与标记试剂、接头试剂 或药物-接头中间体的位点特异性偶联的反应性硫醇。可以表达和纯化 l-v15c,但产率相对低。然而,l-v110c、h-a88c和h-a121c变体的表 达和纯化产率与hu4d5fabv8的类似。因此,这些突变体可以用于进一步分 析并且重组成每个fab中有一个以上硫醇基。为了这一目的,构建轻链上 的一个硫醇和重链上的一个硫醇以获得每个fab分子中有两个硫醇 (l-v110c/h-a88c和l-v110c/h-a121c)。在大肠杆菌表达系统中表达这两 种双cys变体并且纯化。发现纯化的生物素化的abp-thiofab的均一性 (homogeneity)与单cys变体的均一性类似。
[0299]
研究每个fab中改造两个反应性cys残基的作用(附图7)。通过使用链 霉抗生物素-hrp探测生物素化的abp-thiofab与sa的结合测试第二生物 素的存在(附图7)。为了进行her2/fab分析,用her2包被elisa平板并 且使用抗-fabhrp探测。为了进行sa/fab分析,用sa包被elisa平板并 且用抗-fab hrp探测,为了进行sa/sa分析,用sa包被elisa平板并且 用sa-hrp探测。附图7。elisa分析了生物素化的abp-hu4d5fabv8cys 变体与her2、链霉抗生物素(sa)的相互作用。her2/fab、sa/fab和sa/sa 分别表示通过抗-fab-hrp、sa-hrp监测其相互作用。sa/fab监测每个fab 中存在的单一生物素并且通过sa/sa分析监测每个fab的一个以上生物素。 her2与双cys突变体结合与her2同单cys变体的结合类似(附图7)。然而, 双cys突变体上生物素化程度高于单cys变体,这是因每个fab分子中有 一个以上游离硫醇基所致(附图7)。
[0300]
曲妥单抗的thioigg变体的改造
[0301]
将半胱氨酸引入全长单克隆抗体曲妥单抗(genentechinc.)的某些残基上。通过在含有1mm半胱氨酸的培养基中瞬时发酵在 cho(中国仓鼠卵巢)细胞中表达曲妥单抗的单cys突变体h-a88c、h-a121c 和l-v110c和曲妥单抗的双cys突变体v110c-a121c和v110c-a121c。 a88c突变体重链序列(450aa)为seq id no:6。a121c突变体重链序列(450 aa)为seq id no:7。v110c突变体轻链序列(214aa)为seq id no:8。
[0302]
evqlvesggglvqpggslrlscaasgfnikdtyihwvrqapgkglewvariyptngytry adsvkgrftisadtskntaylqmnslrcedtavyycsrwggdgfyamdywgqgtlvtvss astkgpsvfplapsskstsggtaalgclvkdyfpepvtvswnsgaltsgvhtfpavlqss glyslssvvtvpssslgtqtyicnvnhkpsntkvdkkvepkscdkthtcppcpapellgg psvflfppkpkdtlmisrtpevtcvvvdvshedpevkfnwyvdgvevhnaktkpreeqyn styrvvsvltvlhqdwlngkeykckvsnkalpapiektiskakgqprepqvytlppsree mtknqvsltclvkgfypsdiavewesngqpennykttppvldsdgsfflyskltvdksrw qqgnvfscsvmhealhnhytqkslslspgk
[0303]
seq id no:6
[0304]
evqlvesggglvqpggslrlscaasgfnikdtyihwvrqapgkglewvariyptngytry adsvkgr
ftisadtskntaylqmnslraedtavyycsrwggdgfyamdywgqgtlvtvss cstkgpsvfplapsskstsggtaalgclvkdyfpepvtvswnsgaltsgvhtfpavlqss glyslssvvtvpssslgtqtyicnvnhkpsntkvdkkvepkscdkthtcppcpapellgg psvflfppkpkdtlmisrtpevtcvvvdvshedpevkfnwyvdgvevhnaktkpreeqyn styrvvsvltvlhqdwlngkeykckvsnkalpapiektiskakgqprepqvytlppsree mtknqvsltclvkgfypsdiavewesngqpennykttppvldsdgsfflyskltvdksrw qqgnvfscsvmhealhnhytqkslslspgk
[0305]
seq id no:7
[0306]
diqmtqspsslsasvgdrvtitcrasqdvntavawyqqkpgkapklliysasflysgvps rfsgsrsgtdftltisslqpedfatyycqqhyttpptfgqgtkveikrtcaapsvfifpp sdeqlksgtasvvcllnnfypreakvqwkvdnalqsgnsqesvteqdskdstyslsstlt lskadyekhkvyacevthqglsspvtksfnrgec
[0307]
seq id no:8
[0308]
按照一个实施方案,半胱氨酸改造的thio-曲妥单抗抗体包含下列具有 游离半胱氨酸氨基酸的可变区重链序列(seq id no:9-16)中的一种或多种
[0309]
突变体序列seq id no:a40cwvrqcpgkglseq id no:9a88cnslrcedtavseq id no:10s119clvtvcsastkgpsseq id no:11s120clvtvscastkgpsseq id no:12a121clvtvsscstkgpsseq id no:13s122clvtvssactkgpsseq id no:14a175chtfpcvlqssglysseq id no:15s179chtfpavlqcsglysseq id no:16
[0310]
按照另一个实施方案,半胱氨酸改造的硫代-曲妥单抗抗体包含下列具 有游离半胱氨酸氨基酸的可变区轻链序列(seq id no:17-27)中的一种或多 种。
[0311]
[0312][0313]
检测所得全长硫代-曲妥单抗igg变体的硫醇反应性和her2结合活性。 附图9a表示生物素化抗体结合固定化her2和hrp标记的用于吸光度检 测的二抗的卡通画描绘。附图9b表示在450nm处对下列(左至右)物质进行 吸光度检测的与固定化her2的结合测定值:非-生物素化的野生型曲妥单 抗(wt)、生物素-马来酰亚胺偶联的硫代-曲妥单抗变体v110c(单cys)、 a121c(单cys)和v110c-a121c(双cys)。在1、10和100ng测试每种thioigg 变体和曲妥单抗。测定值表示生物素化的抗-her2 thiomab保持her2结 合活性。
[0314]
附图10a表示结合固定化her2的生物素化抗体在用于吸光度检测的 生物素与抗-igg-hrp结合方面的卡通图描绘。附图10b表示在450nm检测 吸光度的生物素-马来酰亚胺偶联的-硫代曲妥单抗变体和未-生物素化的野 生型曲妥单抗在结合链霉抗生物素中的结合测定值。从左至右:v110c(单 cys)、a121c(单cys)、v110c/a121c(双cys)和曲妥单抗。在1、10和100ng 测试每种thioigg曲妥单抗变体和亲代曲妥单抗。测定值表示her2 thiomab 具有高硫醇反应性。
[0315]
将半胱氨酸引入全长2h9抗-ephb2r抗体的某些残基上。通过在含有1 mm半胱氨酸的培养基中瞬时发酵在cho(中国仓鼠卵巢)细胞中表达2h9 的单cys突变体h-a121c。a121c 2h9突变体重链序列(450aa)为seq idno:28。
[0316]
evqlvesggglvqpggslrlscaasgytftsywmhwvrqapgkglewvgfinpstgytdy nqkfkdrftisadtskntaylqmnslraedtavyyctrrpkiprhanvfwgqgtlvtvss cstkgpsvfplapsskstsggtaalgclvkdyfpepvtvswnsgaltsgvhtfpavlqss glyslssvvtvpssslgtqtyicnvnhkpsntkvdkkvepkscdkthtcppcpapellgg psvflfppkpkdtlmisrtpevtcvvvdvshedpevkfnwyvdgvevhnaktkpreeqyn styrvvsvltvlhqdwlngkeykckvsnkalpapiektiskakgqprepqvytlppsree mtknqvsltclvkgfypsdiavewesngqpennykttppvldsdgsfflyskltvdksrw qqgnvfscsvmhealhnhytqkslslspgk
[0317]
seq id no:28
[0318]
半胱氨酸改造的thio-2h9抗体包含下列具有游离半胱氨酸氨基酸的fc 恒定区重链序列(seq id no:29-38)。
[0319]
突变体序列seq id no:v273chedpeckfnwyvdgvevhnaktkprseq id no:29v279chedpevkfnwycdgvevhnaktkprseq id no:30v282chedpevkfnwyvdgcevhnaktkprseq id no:31v284chedpevkfnwyvdgvechnaktkprseq id no:32a287chedpevkfnwyvdgvevhncktkprseq id no:33s324cykckvcnkalpseq id no:34s337ciektickakgqprseq id no:35a339ciektiskckgqprseq id no:36s375ckgfypcdiaveseq id no:37
s400cppvldcdgsffseq id no:38
[0320]
将半胱氨酸引入全长3a5抗-muc16抗体的某些残基上。通过在含有 1mm半胱氨酸的培养基中瞬时发酵在cho(中国仓鼠卵巢)细胞中表达 3a5的单cys突变体h-a121c。a121c 3a5突变体重链序列(446aa)包含seqid no:39。
[0321]
dvqlqesgpglvnpsqslsltctvtgysitndyawnwirqfpgnklewmgyinysgytty npslksrisitrdtsknqfflhlnsvttedtatyycarwdggltywgqgtlvtvsacstk gpsvfplapsskstsggtaalgclvkdyfpepvtvswnsgaltsgvhtfpavlqssglys lssvvtvpssslgtqtyicnvnhkpsntkvdkkvepkscdkthtcppcpapellggpsvf lfppkpkdtlmisrtpevtcvvvdvshedpevkfnwyvdgvevhnaktkpreeqynstyr vvsvltvlhqdwlngkeykckvsnkalpapiektiskakgqprepqvytlppsreemtkn qvsltclvkgfypsdiavewesngqpennykttppvldsdgsfflyskltvdksrwqqgn vfscsvmhealhnhytqkslslspgk
[0322]
seq id no:39
[0323]
半胱氨酸改造的thio-3a5抗-muc16抗体包含下列具有游离半胱氨酸 氨基酸(seq id no:40-44)的可变区重链序列。
[0324][0325][0326]
半胱氨酸改造的thio-3a5抗-muc16抗体包含下列具有游离半胱氨酸 氨基酸的可变区轻链序列(seq id no:45-49)。
[0327]
突变体序列seq id no:l15cflsvscggrvtseq id no:45a43cqkpgncprlliseq id no:46v110ceikrtcaapsvseq id no:47a144cfypreckvqwkseq id no:48s168cvteqdckdstyseq id no:49
[0328]
4d5抗her2 thiofab的改造和硫醇反应性
[0329]
将半胱氨酸导入抗her2 hu4d5fabv8 fab片段抗体的重链和轻链的每 一个位置。依照本文所述方法制备了所有440个重链突变体和轻链突变体。 依照pheselector测定法测量了硫醇反应性。重链序列依照顺序编号系 统来编号。轻链序列遵循kabat编号系统。在轻链中,kabat和顺序编号二 者表示相同的数。
[0330]
对重链hu4d5fabv8突变体选择对her2受体蛋白的有效结合(附图2 和3)和与生物素化试剂biotin-peo-马来酰亚胺的硫醇反应性(实施例1和 2)。某些重链突变体具有有限的或受损的对her2 ecd的结合,因为位于 抗体-fab可变区cdr中的残基对于抗原结合
(her2)是重要的。一些位于 fab恒定域中的残基也产生较差的her2结合,因为这些残基可促进fab的 结构和折叠,由此导致在m13噬菌体上的4d5-fab展示较差(junutula,j.r.etal.(2008)j.immunol methods,332:41-52)。具有较差her2 ecd结合的重链 hu4d5fabv8突变体包括位置1,21,31,33-36,38,48-50,59,87,95,101,104, 129,131,132,136,153,155,159,166,169,170,172,197,198,202,215,219 处的半胱氨酸突变。测量了野生型半胱氨酸变体22,96,147,203,223。其它 重链突变体具有有限的与生物素化试剂的硫醇反应性。游离半胱氨酸氨基 酸残基位于中央,侧翼残基在表3中栏的序列中。左栏表示重链中的替代 氨基酸和位置。表3seq id no:50-98重链hu4d5fabv8突变体保留了her2 结合和约0.8或0.8以上的硫醇反应性值,排除野生型半胱氨酸变体。具有 seq id no:50-98(表3)的抗体展现出硫醇反应性且可用于形成与捕捉标 记、检测标记、药物部分、或固相支持物的共价附着。表3的重链突变体 可以偶联成thiofab或thiomab,例如抗体-药物偶联物。
[0331]
表3有效结合、硫醇反应性重链hu4d5fabv8突变体
[0332]
[0333][0334]
对轻链hu4d5fabv8突变体选择对her2受体蛋白的有效结合(附图2 和3)和与生物素化试剂biotin-peo-马来酰亚胺的硫醇反应性(实施例1和 2)。某些轻链突变体具有有限的或受损的对her2的结合,因为位于抗体-fab 可变区cdr中的残基对于抗原结合(her2)是重要的。一些位于fab恒定域 中的残基也产生较差的her2结合,因为这些残基可促进fab的结构和折 叠,由此导致在m13噬菌体上的4d5-fab展示较差(junutula,j.r.et al.(2008) j.immunol methods,332:41-52)。具有较差her2结合的轻链hu4d5fabv8 突变体包括位置4,29-32,35,36,50,82,86,89-91,113,115,117,120,126, 128,139,141,146,148,179,
186,192,202处的半胱氨酸突变体。测量了野生 型半胱氨酸变体23,134,194,214。其它轻链突变体具有有限的与生物素化 试剂的硫醇反应性。游离半胱氨酸氨基酸残基位于中央,侧翼残基在表4 中栏的序列中。左栏表示轻链中的替代氨基酸和位置。表4seq id no: 99-147轻链hu4d5fabv8突变体保留了her2结合和约0.8或0.8以上的硫 醇反应性值,排除野生型半胱氨酸变体。具有seq id no:99-147(表4)的 抗体展现出硫醇反应性且可用于形成与捕捉标记、检测标记、药物部分、 或固相支持物的共价附着。表4的轻链突变体可以偶联成thiofab或 thiomab,例如抗体-药物偶联物。
[0335]
表4有效结合、硫醇反应性轻链hu4d5fabv8突变体
[0336]
[0337][0338]
thiomab的硫醇反应性
[0339]
通过生物素化和链霉抗生物素结合(us 7521541)测定全长igg半胱氨 酸改造的
抗体(thiomab)的硫醇反应性。设定蛋白质印迹试验以筛选与生物 素-马来酰亚胺特异性偶联的thiomab。在本试验中,在还原sds-page上 分析抗体并且通过与链霉抗生物素-hrp一起温育特异性探测生物素的存 在。根据使用哪种改造的cys变体和使用野生型未观察到相互作用的不同, 在重链或轻链中观察到了链霉抗生物素-hrp相互作用,表明thiomab变体 特异性偶联改造的cys残基上的生物素。实施了在固定化抗-igg-hrp和链 霉抗生物素-hrp上捕捉后还原的生物素化的thio-igg变体的变性凝胶分 析。泳道1:3a5 h-a121c。泳道2:3a5 l-v110c。泳道3:2h9 h-a121c。 泳道4:2h9 l-v110c。泳道5:抗-ephb2r 2h9亲代野生型。通过使用 hrp检测,使用抗-igg捕捉每种突变体(泳道1-4),表明保持了选择性和亲 和力。通过使用hrp检测固定化链霉抗生物素的捕捉证实了生物素在重链 和轻链上的位置。在泳道1和3中半胱氨酸改造的抗体上的半胱氨酸突变 位置为重链。在泳道2和4中半胱氨酸改造的抗体上的半胱氨酸突变位置 为轻链。半胱氨酸突变位点经历与生物素-马来酰亚胺试剂的偶联。
[0340]
lc/ms对thiomab半胱氨酸改造的抗体和2h9 v15c变体的分析给出 了对硫醇反应性的定量表示(表5).
[0341]
表5thiomab的生物素化的lc/ms定量-硫醇反应性
[0342]
thiomab变体每个thiomab中生物素的数目2h9 wt0.02h9 l-v15c0.62h9 l-v110c0.52h9 h-a121c2.03a5 l-v110c1.03a5 h-a121c2.0
[0343]
半胱氨酸改造在igg抗体的恒定域,即fc区中进行。将多种氨基酸位 点转化成半胱氨酸位点并且评价表达的突变体,即半胱氨酸改造的抗体的 硫醇反应性。在elisa测定法中通过hrp定量,经在固定化链霉抗生物素 捕捉评价生物素化的2h9 thiomab fc变体的硫醇反应性。建立快速筛选具 有反应性硫醇的cys残基的elisa测定法。通过用抗-igg-hrp探测,随后 在450nm处测定吸光度监测链霉抗生物素-生物素相互作用。这些结果证实2h9-thiofc变体v282c、a287c、a339c、s375c和s400c具有中度到最 高的硫醇反应性。通过如表6中报导的ls/ms分析对2h9 thiomab fc变体 的生物素偶联程度定量。ls/ms分析证实a282c、s375c和s400c变体具 有100%生物素偶联且v284c和a339c具有50%的偶联,表明存在反应性 半胱氨酸硫醇。其它thiofc变体和亲代野生型2h9有极弱的生物素化或没 有生物素化。
[0344]
表6 2h9 fc thiomab的生物素化的lc/ms定量
[0345]
2h9 thiomab fc变体生物素化%v273c0v279c31v282c100v284c50a287c0
s324c71s337c0a339c54s375c100s400c100(野生型2h9)0
[0346]
thio-4d5 fab轻链变体的硫醇反应性
[0347]
正如通过附图8的pheselector测定法测定的,筛选抗erbb2抗体 4d5的多种半胱氨酸改造的轻链变体fab得到了大量具有0.6和0.6以上硫 醇反应值的变体(表7)。将表7的硫醇反应值对设定为100%的重链4d5 thiofab变体(hc-a121c)校准,推定hc-a121c变体完全生物素化并且表示 为百分比值。
[0348]
表7 4d5 thiofab轻链变体的硫醇反应性百分比值
[0349][0350][0351]
抗体-药物偶联物
[0352]
本发明的半胱氨酸改造的抗体可以与任意的治疗剂,即药物部分偶联, 所述的治疗剂可以通过反应性半胱氨酸硫醇与抗体共价结合。
[0353]
抗体-药物偶联物(adc)化合物的典型实施方案包含半胱氨酸改造的抗 体(ab)和药物部分(d),其中抗体具有一个或多个游离半胱氨酸氨基酸,并 且抗体通过连接d的接头部分(l)与一个或多个游离半胱氨酸氨基酸附着 (结合);该组成具有式i:
[0354]
ab-(l-d)
p
ꢀꢀꢀi[0355]
其中p为1、2、3或4。可以通过硫醇反应接头部分与抗体分子偶联的 药物部分的数量受到通过本文所述方法引入的半胱氨酸残基数量的限制。 式i的典型adc由此包含具有1、2、3或4个改造的半胱氨酸氨基酸的抗 体。
[0356]
抗体-药物偶联物化合物(adc)的另一个典型实施方案包含半胱氨酸改 造的抗体(ab)、清蛋白-结合肽(abp)和药物部分(d),其中抗体通过接头部 分(l)与药物部分结合并且抗体通过酰胺键或第二种接头部分与清蛋白-结 合肽结合;该组成具有式ia:
[0357]
abp-ab-(l-d)
p
ꢀꢀꢀ
ia
[0358]
其中p为1、2、3或4。
[0359]
本发明的adc化合物包括那些用于抗癌活性的化合物。特别地,化合 物包括与药物部分,即毒素,通过接头与之偶联,即与之共价结合的半胱 氨酸-改造的抗体。当所述药物不与抗体偶联时,药物具有细胞毒性或抑制 细胞效应。由此通过与抗体偶联调节药物部分的生物活性。本发明的抗体
‑ꢀ
药物偶联物(adc)将有效剂量的细胞毒性剂选择性地递送至肿瘤组织,由此 可以获得更大的选择性,即较低的效应剂量(efficacious dose)。
[0360]
药物部分
[0361]
抗体-药物偶联物(adc)的药物部分(d)包括具有细胞毒性或抑制细胞效 应的任意化合物、部分(moiety)或基团。药物部分包括:(i)可以起微管蛋白 抑制剂、有丝分裂抑制剂、拓扑异构酶抑制剂或dna嵌入剂作用的化疗剂; (ii)可以通过酶促方式起作用的蛋白毒素;和(iii)放射性同位素。
[0362]
典型的药物部分包括,但不限于美登木素生物碱、auristatin、多拉司他 汀(dolastatin)、单端孢霉烯(trichothecene)、cc1065、加利车霉素 (calicheamicin)和其它烯二炔类(enediyne)抗生素、紫杉烷(taxane)、蒽环类抗 生素(anthracycline)及其立体异构体、同电子排列体(isostere)、类似物或衍生 物。
[0363]
适合于用作美登木素生物碱药物部分的美登素化合物为本领域众所周 知并且可以按照公知方法分离自天然来源,使用遗传工程技术生产(参见yu 等(2002)proc.nat.acad.sci.(usa)99:7968-7973)或按照已知方法通 过合成制备的美登醇和美登醇类似物。
[0364]
典型的美登木素生物碱药物部分包括那些具有修饰的芳族环的化合 物,诸如:c-19-去氯(us 4256746)(通过ansamytocin p2的氢化铝锂还原制 备);c-20-羟基(或c-20-去甲基)+/-c-19-去氯(us 4361650和4307016)(通过 使用链霉菌属(streptomyces)或放线菌属(actinomyces)脱甲基化或使用 lah脱氯制备);和c-20-去甲氧基、c-20-酰氧基(-ocor)、+/-去氯(us 4,294,757)(通过使用酰基氯酰化制备)和那些在其它位置上具有修饰的化合 物。
[0365]
典型的美登木素生物碱药物部分还包括那些具有诸如如下修饰的化合 物:c-9-sh(us 4424219)(通过使美登醇与h2s或p2s5反应制备);c-14-烷 氧基甲基(去甲氧基/ch
2 or)(us 4331598);c-14-羟甲基或酰氧基甲基 (ch2oh或ch2oac)(us 4450254)(由nocardia制备);c-15-羟基/酰氧基(us 4364866)(通过由链霉菌属转化美登醇制备);c-15-甲氧基(us 4313946和 4315929)(分离自trewia nudlflora);c-18-n-去甲基(us 4362663和 4322348)(通过用链霉菌属使美登醇脱甲基化制备);和4,5-脱氧(us 4371533)(通过美登醇的三氯化酞/lah还原制备)。已知美登素化合物上的 许多位置用作连接位置,这取决于连接的类型。例如,为了形成酯键,具 有羟基的c-3位、用羟甲基修饰的c-14位、用羟基修饰的c-15位和具有 羟基的c-20位均是合适的。
[0366]
式i的抗体-药物偶联物(adc)的药物部分(d)包括具有如下结构的美登 木素生物碱:
[0367][0368]
其中波状线表示d的硫原子与抗体-药物偶联物(adc)的接头(l)共价结 合。r可以独立为h或c
1-c6烷基,所述的c
1-c6烷基选自甲基、乙基、1-丙 基、2-丙基、1-丁基、2-甲基-1-丙基、2-丁基、2-甲基-2-丙基、1-戊基、2
‑ꢀ
戊基、3-戊基、2-甲基-2-丁基、3-甲基-2-丁基、3-甲基-1-丁基、2-甲基-1
‑ꢀ
丁基、1-己基、2-己基、3-己基、2-甲基-2-戊基、3-甲基-2-戊基、4-甲基-2
‑ꢀ
戊基、3-甲基-3-戊基、2-甲基-3-戊基、2,3-二甲基-2-丁基和3,3-二甲基-2-丁 基。使酰胺基与硫原子结合的亚烷基链可以为methanyl、乙基(ethanyl)或 丙基,即m为1、2或3。
[0369]
美登素化合物通过抑制有丝分裂过程中的微管蛋白形成抑制细胞增 殖,所述的抑制有丝分裂过程中的微管蛋白形成通过抑制微管蛋白,即微 管素的聚合来进行(remillard等(1975)science 189:1002-1005)。美登素和美 登木素生物碱具有高度毒性,但其在癌症疗法中的临床应用因其主要由于 对肿瘤的选择性差导致的严重的全身副作用而非常有限。因对中枢神经系 统和胃肠系统的严重不良作用而已中断了使用美登素的临床试验(issel等 (1978)can.treatment.rev.5:199-207)。
[0370]
美登木素生物碱药物部分为抗体-药物偶联物中有吸引力的药物部分, 因为它们:(i)相对易于接近以便通过发酵或化学修饰、衍生发酵产物来制 备;(ii)易于使用适合于通过非二硫化物接头与抗体偶联的官能基衍生;(iii) 在血浆中稳定;和(iv)对多种肿瘤细胞系有效(us 2005/0169933;wo2005/037992;us 5208020)。
[0371]
作为其它药物部分,对本发明的化合物而言,关注美登木素生物碱药 物部分的所有立体异构体,即在d的手性碳上的r和s构型的任意组合。 在一个实施方案中,美登木素生物碱药物部分(d)具有下列立体化学:
[0372][0373]
美登木素生物碱药物部分的典型实施方案包括:dm1,(cr2)m= ch2ch2;dm3,(cr2)m=ch2ch2ch(ch3);和dm4,(cr2)m=ch2ch2c(ch3)2, 它们具有如下结构:
[0374]
[0375][0376]
根据连接类型的不同,接头可以在不同位置上与美登木素生物碱分子 结合。例如,可以通过使用常规偶联技术与羟基反应形成酯键。该反应可 以在具有羟基的c-3位置上进行。该反应可以在具有羟基的c-3位置,使 用羟甲基修饰的c-14位置,使用羟基修饰的c-15位置和具有羟基的c-20 上进行。在一个优选的实施方案中,所述键在美登醇或美登醇类似物的c-3 位置上形成。
[0377]
式i的抗体-药物偶联物(adc)的药物部分(d)还包括多拉司他汀及其肽 类似物和衍生物auristatins(美国专利us5635483;5780588)。已经证实多拉 司他汀和auristatins可干扰微管动力学、gtp水解以及核和细胞分裂(woyke 等(2001)antimicrob.agents and chemother.45(12):3580-3584)并且具有抗癌 (us 5663149)和抗真菌活性(pettit等(1998)antimicrob.agents chemother. 42:2961-2965)。多拉司他汀或auristatin药物部分的不同形式可以通过肽药 物部分的n(氨基)末端或c(羧基)末端与抗体共价结合(wo 02/088172; doronina等(2003)nature biotechnology 21(7):778-784;francisco等(2003) blood 102(4):1458-1465)。
[0378]
药物部分包括多拉司他汀、auristatins(us 5635483;us 5780588;us5767237;
us 6124431)及其类似物和衍生物。已经证实多拉司他汀和 auristatins可干扰微管动力学、gtp水解以及核和细胞分裂(woyke等(2001) antimicrob.agents and chemother.45(12):3580-3584)并且具有抗癌(us5663149)和抗真菌活性(pettit等(1998)antimicrob.agents chemother. 42:2961-2965)。多拉司他汀或auristatin药物部分的不同形式可以通过肽药 物部分的n(氨基)末端或c(羧基)末端与抗体结合(wo 02/088172)。
[0379]
典型auristatin实施方案包括n-末端连接的monomethylauristatin药物 部分de和df,其披露在下列文献中:us 7498298和us 7659241,特别将 这些文献各自全部披露的内容引入本文作为参考。
[0380]
式i的抗体-药物偶联物(adc)的药物部分(d)包括通过n-末端与抗体连 接的monomethylauristatin药物部分mmae和mmaf,并且具有如下结构:
[0381]
mmae
[0382]
mmaf
[0383]
一般而言,可以通过在两种或多种氨基酸和/或肽片段之间形成肽键制 备基于肽的药物部分。例如,可以按照肽化学领域众所周知的液相合成法 制备这类肽键(参见e.和k.l
ü
bke,“the peptides”,volume 1,pp 76-136,1965,academic press)。
[0384]
药物部分包括加利车霉素及其类似物和衍生物。加利车霉素族抗生素 能够产生亚-皮摩尔浓度的双链dna断裂。为了制备加利车霉素族抗生素 的偶联物,参见us 5712374;us 5714586;us 5739116;us 5767285;us5770701,us 5770710;us 5773001;us 5877296。可以使用的加利车霉素 的结构类似物包括,但不限于γ
1i
、α
2i
、α
3i
、n-乙酰基-γ
1i
、psag和θ
i1
(hinman 等cancer research 53:3336-3342(1993),lode等cancer research 58:2925-2928(1998)。
[0385]
蛋白毒素包括:白喉毒素a链、白喉毒素的非结合活性片段、外毒素 a链(来自铜绿假单胞菌(pseudomonas aeruginosa))、蓖麻毒素a链(ricina chain)(vitetta等(1987)science,238:1098)、相思豆毒蛋白a链(abrin achain)、蒴莲根毒素a链(modeccin a chain)、α-八叠球菌(alpha-sarcin)、 油桐(aleurites fordii)蛋白、石竹素蛋白(dianthin proteins)、美洲商陆 (phytolaca americana)蛋白(papi、papii和pap-s)、苦瓜(momordicacharantia)抑制剂、泻果素(curcin)、巴豆毒蛋白(crotin)、sapaonaria officinalis 抑制剂、白树毒素(gelonin)、米托洁林(mitogellin)、局限曲菌素 (restrictocin)、酚霉素(phenomycin)、依诺霉素(enomycin)和 tricothecenes(wo 93/21232)。
[0386]
治疗放射性同位素包括:
32
p、
33
p、
90
y、
125
i、
131
i、
131
in、
153
sm、
186
re、 188
re、
211
at、
212
bi、
212
pb和lu的放射性同位素。
[0387]
可以按照公知方式将放射性同位素或其它标记掺入偶联物(fraker等 (1978)biochem.biophys.res.commun.80:49-57;"monoclonal antibody inimmunoscintigraphy"chatal,crc press 1989)。碳-14-标记的1-异硫氰酸根合 苄基-3-甲二乙烯三胺五乙酸(mx-dtpa)为用于放射性核素与抗体偶联的典 型螯合剂(wo 94/11026)。
[0388]
接头
[0389]“接头”(l)为具有用于连接一种或多种药物部分(d)和抗体单元(ab)而形 成式i的抗体-药物偶联物(adc)的双官能或多官能部分。可以使用具有结合 药物和抗体的反应性官能基的接头便利地制备抗体-药物偶联物(adc)。半 胱氨酸改造的抗体(ab)的半胱氨酸硫醇可以与接头试剂、药物部分或药物
‑ꢀ
接头中间体的官能基形成键。
[0390]
一个方面,接头具有反应位置,该位置上带有与存在于抗体上的亲核 半胱氨酸反应的亲电子基团。抗体的半胱氨酸硫醇与接头上的亲电子基团 反应并且与接头形成共价键。有用的亲电子基团包括,但不限于马来酰亚 胺和卤代乙酰胺基团。
[0391]
半胱氨酸改造的抗体与接头试剂或药物-接头中间体,与亲电子官能基, 诸如马来酰亚胺或α-卤代羰基按照klussman等(2004)在bioconjugatechemistry 15(4):765-773,766页上的方法和实施例4的方案反应。
[0392]
在又一个实施方案中,接头试剂或药物-接头中间体的反应基含有可以 与抗体的游离半胱氨酸硫醇形成键的硫醇-反应性官能基。硫醇-反应官能基 的实例包括,但不限于:马来酰亚胺;α-卤代乙酰基;活化的酯类,诸如 琥珀酰亚胺酯类、4-硝基苯基酯类、五氟苯基酯类、四氟苯基酯类;酸酐类; 酰基氯类;磺酰氯类;异氰酸酯类和异硫氰酸酯类。
[0393]
在另一个实施方案中,接头l可以为树枝状类型接头,其用于通过支 化多官能接头部分与抗体共价结合一个以上药物部分(sun等(2002) bioorganic&medicinal chemistry letters 12:2213-2215;sun等(2003) bioorganic&medicinal chemistry 11:1761-1768;)。树枝状接头可以增加药 物与抗体的摩尔比,即负荷,它与adc的效能相关。因此,如果半胱氨酸 改造的抗体仅带有一个反应性半胱氨酸硫醇,那么可以通过树枝状接头结 合众多药物部分。
[0394]
接头可以包含氨基酸残基,其使抗体(ab)与本发明的半胱氨酸改造的抗 体-药物偶联物(adc)的药物部分(d)连接。氨基酸残基可以形成二肽、三肽、 四肽、五肽、六肽、七肽、八肽、九肽、十肽、十一肽或十二肽单元。氨 基酸残基包括那些天然存在的以及最小的氨基酸和非-天然存在的氨基酸类 似物,诸如瓜氨酸。
[0395]
可以设计和优化有用的氨基酸残基单元在通过特定的酶,例如肿瘤相 关蛋白酶进行酶促裂解中的选择性,以便释放活性药物部分。在一个实施 方案中,氨基酸残基单元诸如缬氨酸-瓜氨酸(vc或val-cit)是其裂解由组织 蛋白酶b、c和d或纤维蛋白溶酶蛋白酶催化的单元。
[0396]
接头单元可以是自我牺牲(self-immolative)类型的,诸如对-氨基苄基氨 基甲酰基(pab)单元,其中adc具有如下典型结构:
[0397][0398]
其中q为-c
1-c8烷基、-o-(c
1-c8烷基)、-卤素、-硝基或-氰基;m为0-4 的整数;并且p为1-4。
[0399]
自我牺牲的间隔基的其它实例包括,但不限于在带电方式上与pab基 团类似的芳族化合物,诸如2-氨基咪唑-5-甲醇衍生物(us 7375078;hay等 (1999)bioorg.med.chem.lett.9:2237)和邻位或对位-氨基苄基乙缩醛类。可 以使用在酰胺键水解时进行环化的间隔基,诸如取代和未被取代的4-氨基 丁酸酰胺类(rodrigues等(1995)chemistry biology 2:223)、适当取代的双环 [2.2.1]和双环[2.2.2]环系(storm等(1972)j.amer.chem.soc.94:5815)和2-氨 基苯基丙酸酰胺类(amsberry,等(1990)j.org.chem.55:5867)。消去在甘氨酸 上被取代的含胺的药物(kingsbury等(1984)j.med.chem.27:1447)也是用于 adcs的自我牺牲的(self-immolative)间隔基的实例。
[0400]
在另一个实施方案中,接头l可以为用于通过支化多官能接头部分使 一种以上药物部分共价结合抗体的树枝状类型的接头(dendritic type linker) (sun等(2002)bioorganic&medicinal chemistry letters 12:2213-2215;sun 等(2003)bioorganic&medicinal chemistry 11:1761-1768)。树枝状接头可以 增加药物与抗体的摩尔比,即负荷,它与adc的效能相关。因此,如果半 胱氨酸改造的抗体仅带有一个反应性半胱氨酸硫醇,那么可以通过树枝状 接头结合众多药物部分(wo 2004/01993;szalai等(2003)j.amer.chem.soc. 125:15688-15689;shamis等(2004)j.amer.chem.soc.126:1726-1731; amir等(2003)angew.chem.int.ed.42:4494-4499)。
[0401]
式ia抗体-药物偶联物化合物的实施方案包括(val-cit)、(mc-val-cit)、和 (mc-val-cit-pab):
[0402]
val-cit
[0403]
mc-val-cit
[0404]
mc-val-cit-pab 式ia抗体-药物偶联物化合物的其它典型实施方案包括以下结构:
[0405][0406]
其中x为:
[0407]-(ch2)
n-,-(ch2ch2o)
n-, [0408]
y为:
[0409][0410]
且r独立为h或c
1-c6烷基;并且n为1-12。
[0411]
在另一个实施方案中,接头带有反应性官能基,该反应性官能基具有 与存在于抗
体上的亲电子基团反应的亲核基团。抗体上有用的亲电子基团 包括,但不限于醛和酮羰基。接头的亲核基团的杂原子可以与抗体上的亲 电子基团反应并且与抗体单元形成共价键。接头上有用的亲核基团包括, 但不限于酰肼、肟、氨基、肼、缩氨基硫脲(thiosemicarbazone)、肼羧酸酯 和芳基酰肼。抗体上的亲电子基团提供了用于结合(附着)接头的便利位 置。
[0412]
一般而言,可以通过在两种或多种氨基酸和/或肽片段之间形成肽键制 备肽-类接头。例如,可以按照肽化学领域众所周知的液相合成法(e.和k.(1965)“the peptides”,volume 1,pp 76-136,academic press)制备 这类肽键。
[0413]
在另一个实施方案中,接头可以被调节溶解性或反应性的基团取代。 例如,带电荷的取代基,诸如磺酸基(-so3-)或铵可以增加试剂的水溶性并且 有利于接头试剂与抗体或药物部分的偶联反应,或有利于ab-l(抗体-接头 中间体)与d或d-l(药物-接头中间体)与ab的偶联反应,这取决于用于制 备adc的合成途径。
[0414]
特别关注本发明的化合物,但不限于:用如下接头试剂制备的adc: bmpeo、bmps、emcs、gmbs、hbvs、lc-smcc、mbs、mpbh、sbap、sia、siab、smcc、smpb、smph、磺基-emcs、磺基-gmbs、磺基-kmus、 磺基-mbs、磺基-siab、磺基-smcc和磺基-smpb以及svsb(琥珀酰亚胺 基-(4-乙烯基砜)苯甲酸酯);并且包括双-马来酰亚胺试剂:dtme、bmb、 bmdb、bmh、bmoe、bm(peo)3和bm(peo)4,它们商购自piercebiotechnology,inc.,customer service department,p.o.box 117,rockford,il. 61105u.s.a,1-800-874-3723,international+815-968-0747。参见467-498页, 2003-2004applications handbook and catalog、双-马来酰亚胺试剂能够使半 胱氨酸改造的抗体的硫醇与含硫醇的药物部分、标记或接头中间体按照依 次或同时的方式结合。除马来酰亚胺外的其它与半胱氨酸改造的抗体、药 物部分、标记或接头中间体的硫醇反应的官能基包括碘乙酰胺、溴乙酰胺、 乙烯基吡啶、二硫化物、吡啶基二硫化物、异氰酸酯(盐)和异硫氰酸酯(盐)。
[0415][0416]
还可以通过其它商业渠道,诸如molecular biosciences inc.(boulder,co) 获得或按照下列文献中所述的操作步骤合成有用的接头试剂:toki等(2002) j.org.chem.67:1866-1872;walker,m.a.(1995)j.org.chem. 60:5352-5355;frisch等(1996)bioconjugate chem.7:180-186;us6214345;wo 02/088172;us 2003130189;us2003096743;wo03/026577;wo 03/043583;和wo 04/032828。
[0417]
具有马来酰亚胺stretcher和对-氨基苄基氨基甲酰基(pab)自我牺牲的 间隔基的典型缬氨酸-瓜氨酸(val-cit或vc)二肽接头试剂具有如下结构:
[0418][0419]
其中q为-c
1-c8烷基、-o-(c
1-c8烷基)、-卤素、-硝基或-氰基;且m为 0-4的整数。
[0420]
可以按照dubowchik等(1997)tetrahedron letters,38:5257-60所述制备 具有马来酰亚胺stretcher单元和对-氨基苄基自我牺牲的间隔基的典型 phe-lys(mtr)二肽接头试剂并且其具有如下结构:
[0421][0422]
其中mtr为一-4-甲氧基三苯甲基,q为-c
1-c8烷基、-o-(c
1-c8烷基)、
‑ꢀ
卤素、-硝基或-氰基;且m为0-4的整数。
[0423]
本发明典型的抗体-药物偶联物化合物包括:
[0424][0425]
ab-mc-vc-pab-mmaf
[0426][0427]
ab-mc-vc-pab-mmae
[0428][0429]
ab-mc-mmae
[0430][0431]
ab-mc-mmaf
[0432]
其中val为缬氨酸;cit为瓜氨酸;p为1、2、3或4;且ab为半胱氨 酸改造的抗体。其它典型的抗体药物偶联物具有如下结构,其中美登木素 生物碱药物部分dm1通过bmpeo接头与曲妥单抗的硫醇连接:
[0433][0434]
其中ab为半胱氨酸改造的抗体;n为0、1或2;和p为1、2、3或4。
[0435]
抗体-药物偶联物的制备
[0436]
可以通过几种途径,使用本领域技术人员公知的有机化学反应、条件 和试剂制备式i的adc,包括:(1)半胱氨酸改造的抗体的半胱氨酸基团与 接头试剂反应,从而通过共价键形成抗体-接头中间体ab-l,随后与活化的 药物部分d反应;和(2)使药物部分的亲核基团与接头试剂反应,从而通过 共价键形成药物-接头中间体d-l,随后与半胱氨酸改造的抗体的半胱氨酸 基团反应。偶联方法(1)和(2)可以用于各种半胱氨酸改造的抗体、药物部分 和接头以便制备式i的抗体-药物偶联物。
[0437]
抗体半胱氨酸硫醇为亲核性的并且能够与接头试剂和药物-接头中间体 上的亲电子基团反应而形成共价键,所述的药物-接头中间体包括:(i)活性 酯类,诸如nhs酯类、hobt酯类、卤代甲酸酯类和酰基卤类;(ii)烷基和 苄基卤化物,诸如卤代乙酰胺类;(iii)醛类、酮类、羧基和马来酰亚胺基; 和(iv)通过硫化物交换的二硫化物,包括吡啶基二硫化物。药物部分上的 亲核基团包括,但不限于:胺、硫醇、羟基、酰肼、肟、肼、缩氨基硫脲、 肼羧酸酯和芳基酰肼基团,它们能够与接头部分和接头试剂上的亲电子基 团反应而形成共价键。
[0438]
例如,可以将美登素转化成may-ssch3,可以将其还原成游离硫醇 may-sh并且使之与修饰的抗体反应(chari等(1992)cancer research 52:127-131)而生成带有二硫化物接头的美登木素生物碱-抗体免疫偶联物。 已经报导了带有二硫化物接头的抗体-美登木素生物碱偶联物(wo04/016801;us 6884874;us 2004/039176 a1;wo 03/068144;us 2004/001838 a1;美国专利us6441163,5208020,5416064;wo 01/024763)。使用接头试 剂
reagent)直接加入到在血清补充的培养基中培养的细胞中。无需进行细胞洗 涤、除去培养基和多次吸移的步骤。该系统可以在添加试剂并且混合后10 分钟内检测384-孔格中低至15个细胞/孔。可以用adc连续处理细胞,或 可以处理它们并且从adc中分离。一般而言,暂短,即3小时处理的细胞 表现出与连续处理的细胞相同的功效作用。
[0445]
同质性“添加-混合-测定”方式导致细胞裂解并且产生与存在的atp量 成比例的发光信号。atp的量与培养物中存在的细胞数量成正比。 assay产生由荧光素酶反应产生的“辉光-型(glow-type)”发光 信号,它具有一般大于5小时的半衰期,这取决于所用的细胞类型和培养 基。以相对发光单位(rlu)反映出存活细胞。底物甲虫荧光素被重组荧火虫 荧光素酶氧化脱羧化,而同时atp转化成amp并且产生光子。
[0446]
体内功效
[0447]
通过高度表达her2的转基因外植体小鼠模型测定本发明两种清蛋白 结合肽-dm1(美登木素生物碱)-抗体-药物偶联物(adc)的体内功效(实施例 10)。使同种异体移植物从不对疗法起反应或对它的反应差的 fo5 mmtv转基因小鼠增殖。用abp-rhufab4d5-cys(轻链)-dm1; abp-rhufab4d5-cys(重链)-dm1;和安慰剂pbs缓冲液对照品(媒介物)治疗 受试者并且在3周内检测以便测定肿瘤体积倍增的时间、log细胞杀伤和肿瘤 缩小。
[0448]
抗体-药物偶联物的给药
[0449]
可以通过适合于所治疗疾病的任意途径给予本发明的抗体-药物偶联物 (adc)。一般通过肠胃外途径给予adc,即输注、皮下、肌肉内、静脉内、 真皮内、鞘内和硬膜外。
[0450]
药用配制剂
[0451]
本发明的治疗性抗体-药物偶联物(adc)通常与药学上可接受的肠胃外 媒介物一起配制成单位剂量可注射形式的药用配制剂供肠胃外施用,即快 速灌注(bolus)、静脉内注射、肿瘤内注射。任选将具有所需纯度的抗体-药 物偶联物(adc)与药学上可接受的稀释剂、载体、赋形剂或稳定剂混合 (remington's pharmaceutical sciences(1980)16th edition,osol,a.ed.)成冻干 剂型或水溶液形式。
[0452]
抗体-药物偶联物治疗
[0453]
关注本发明的抗体-药物偶联物(adc)可以用于治疗各种疾病或病症, 例如其特征在于肿瘤抗原的过表达的疾病或病症。典型的疾病或过度增殖 性病症包括良性或恶性肿瘤;白血病和淋巴样恶性肿瘤。其它疾病包括神 经元、神经胶质、星形胶质细胞、下丘脑、腺体、巨噬细胞、上皮细胞、 间质、囊胚腔、炎性、血管发生和免疫性疾病,包括自身免疫性疾病。
[0454]
一般而言,所治疗的疾病或病症为过度增殖性疾病,诸如癌症。癌症 的实例包括,但不局限于癌、淋巴瘤、母细胞瘤、肉瘤和白血病或淋巴样 恶性肿瘤。更具体地说,这类癌症包括:鳞状细胞癌(例如上皮鳞状细胞癌); 肺癌,包括小细胞肺癌、非小细胞肺癌、肺腺癌和肺鳞癌;腹膜癌;肝细 胞癌;胃癌,包括胃肠癌;胰腺癌、成胶质细胞瘤;宫颈癌;卵巢癌;肝 癌(liver cancer);膀胱癌;肝细胞癌(hepatoma);乳腺癌;结肠癌;直肠癌; 结直肠癌;子宫内膜癌或子宫癌;唾液腺癌;肾癌;前列腺癌、外阴癌; 甲状腺癌;肝癌(hepatic carcinoma);肛门癌;阴茎癌和头颈部癌。
[0455]
adc化合物可以用于治疗的自身免疫性疾病包括风湿病(诸如,例如类 风湿性关
节炎;斯耶格仑氏综合征;硬皮病;狼疮,诸如sle和 狼疮性肾炎;多肌炎/皮肌炎;冷球蛋白血症;抗-磷脂抗体综合征;和牛皮 癣性关节炎)、骨关节炎、自身免疫性胃肠和肝病(诸如,例如炎症性肠病(例 如溃疡性结肠炎和克罗恩(crohn's)病)、自身免疫性胃炎和恶性贫血、自身 免疫性肝炎、原发性胆汁性肝硬变、原发性硬化性胆管炎和乳糜泻(celiacdisease))、血管炎(诸如,例如anca-相关血管炎,包括丘-施(churg-strauss) 血管炎、韦格纳(wegener's)肉芽肿和多动脉炎)、自身免疫性神经疾病(诸如, 例如多发性硬化、斜视眼肌阵挛综合征(opsoclonus myoclonus syndrome)、 重症肌无力、眼脑脊髓病、帕金森(parkinson’s)病、阿尔茨海默(alzheimer’s) 病和自身免疫性多神经病)、肾脏疾病(诸如,例如肾小球肾炎、古德帕斯彻 (goodpasture’s)综合征和贝格尔(berger’s)病)、自身免疫性皮肤病(诸如,例 如银屑病、荨麻疹(urticaria)、荨麻疹(hives)、寻常天疱疮、大疱性类天 疱疮和皮肤红斑狼疮)、血液病(诸如,例如血小板减少性紫癜、血栓性血小 板减少性紫癜、输血后紫癜和自身免疫性溶血性贫血)、动脉粥样硬化、眼 色素层炎、自身免疫性听觉疾病(诸如,例如内耳疾病和,听力丧失)、贝切特 (behcet's)病、雷诺(raynaud's)综合征、器官移植和自身免疫性内分泌病症(诸 如,例如糖尿病相关性自身免疫性疾病,诸如胰岛素依赖性糖尿病(iddm), 阿狄森(addison’s)病和自身免疫性甲状腺病(例如格雷夫斯(graves’)病和甲 状腺炎))。更优选的这类疾病包括:例如类风湿性关节炎、溃疡性结肠炎、 anca-相关血管炎、狼疮、多发性硬化、斯耶格仑综合征、格雷夫斯病、 iddm、恶性贫血、甲状腺炎和肾小球肾炎。
[0456]
为了预防或治疗疾病,adc的适当剂量取决于如上述定义的所治疗的 疾病类型、疾病的严重程度和时程、给予所述分子是为了预防还是为了治 疗目的、先前的治疗、患者的临床病史和对抗体的反应以及主治医师的判 定。将所述的分子适当对患者给予一次或在一系列治疗过程中给予。根据 疾病类型和严重程度的不同,对患者给药的分子的初始候选剂量约为1 μg/kg-15mg/kg(例如0.1-20mg/kg),例如,无论是通过一次或多次分开的 给药,还是通过连续输注。典型的每日剂量可以在约1μg/kg-100mg/kg 或更大的范围,这取决于上述因素。对患者给予的典型的adc的剂量在约 0.1-约10mg/kg患者体重的范围。
[0457]
为了在几天或几天以上时程中反复给药,根据病情的不同,将治疗持 续至对所需疾病症状的抑制发生为止。典型的给药方案包含给予约4mg/kg 的起始负荷剂量,随后给予约2mg/kg抗-erbb2抗体的每周维持剂量。其 它剂量方案也是有用的。该疗法的进展易于通过常规技术和试验监测。
[0458]
标记的抗体成像方法
[0459]
在本发明的另一个实施方案中,可以用放射性核素、荧光染料、激发 生物发光的底物部分、激发化学发光的部分、酶和其它检测标记通过半胱 氨酸硫醇来标记半胱氨酸改造的抗体以便用于具有诊断、药效学和治疗应 用的成像实验。一般而言,通过注射、灌注或口服摄入对活生物体,例如 人、啮齿动物或其它小动物、灌注器官或组织样品给予标记的半胱氨酸改 造的抗体,即“生物标记物”或“探针”。在一定时间过程中检测探针的分布并 且由影像显示。
[0460]
制品
[0461]
在本发明的另一个实施方案中,提供了含有用于治疗上述病症的物质 的制品或“试剂盒”。所述的制品包含容器和在容器上或与其相连的标签或包 装说明书。合适的容器
包括:例如瓶、小瓶、注射器、泡罩包等,容器可 以由各种材料,诸如玻璃或塑料形成。容器可以容纳有效治疗疾病的抗体
‑ꢀ
药物偶联物(adc)组合物并且可以具有无菌存取口(例如容器可以为静脉用 溶液袋或具有可刺入皮下注射针头的塞的小瓶)。组合物中至少一种活性剂 为adc。标签或包装说明书表示组合物用于治疗选择的疾病,诸如癌症。 或者或另外,所述制品可以进一步含有第二种(或第三种)容器,该容器包含 药学上可接受的缓冲剂,诸如抑菌性注射用水(bwfi)、磷酸缓冲盐水、林 格液和葡萄糖溶液。它可以进一步包括从商业和使用者角度而言需要的其 它物质,包括其它缓冲液、稀释剂、过滤器、针头和注射器。
实施例
[0462]
实施例1-生物素化的thiofab噬菌体的制备
[0463]
使thiofab-噬菌体(5x10
12
噬菌体颗粒)与150倍过量的生物素-peo
‑ꢀ
马来酰亚胺((+)-生物素基-3-马来酰亚氨基丙酰胺基-3,6-二氧杂辛二胺 (biotin-peo-maleimide((+)-biotinyl-3-maleimidopropionamidyl-3,6
ꢀ‑
dioxaoctainediamine),oda等(2001)nature biotechnology 19:379-382,piercebiotechnology,inc.)在室温反应3小时。通过重复peg沉淀(3-4次)从生物素
ꢀ‑
偶联的噬菌体中除去过量的生物素-peo-马来酰亚胺。可以使用其它商购的 带有亲电子基团的与半胱氨酸硫醇反应的生物素化试剂,包括生物素
ꢀ‑
bmcc、peo-碘乙酰基生物素、碘乙酰基-lc-生物素和生物素-hpdp(piercebiotechnology,inc.)和n
α-(3-马来酰亚胺基丙酰基)生物胞素(n
α-(3
‑ꢀ
maleimidylpropionyl)biocytin)(mpb,molecular probes,eugene,or)。其它生 物素化的双官能和多官能接头试剂的商品来源包括molecular probes, eugene,or和sigma,st.louis,mo。
[0464][0465]
生物素-peo-马来酰亚胺
[0466]
实施例2
–
pheselector测定法
[0467]
将牛血清清蛋白(bsa)、erbb2胞外结构域(her2)和链霉抗生物素(100 μl的2μg/ml)分别包被在maxisorp 96孔平板上。在用0.5%tween-20(在pbs 中)封闭后,在室温孵育生物素化和未-生物素化的hu4d5fabv8-thiofab-噬 菌体(2x10
10
个噬菌体颗粒)1小时,随后与辣根过氧化物酶(hrp)标记的二 抗(抗-m13噬菌体包膜蛋白,pviii蛋白抗体)一起孵育。附图8通过描绘fab 或thiofab与her2(上)和生物素化的thiofab与链霉抗生物素(下)结合的图 示例示了pheselector测定法。
[0468]
进行标准hrp反应并且在450nm处测定吸光度。通过计算链霉抗生物 素的od
450
/her2的od
450
之比测定硫醇反应性。硫醇反应值为1表示半胱 氨酸硫醇完全生物素化。就fab蛋白结合测定而言,使用hu4d5fabv8(2-20 ng),随后与hrp标记的山羊多克隆抗-fab抗体一起温育。
[0469]
实施例3a
ꢀ–
thiofab的表达和纯化 [0470]
在非阻抑性大肠杆菌菌株34b8中诱导时表达thiofab(baca等(1997) journal biological chemistry 272(16):10678-84)。将收集的细胞沉淀重新悬浮 于pbs(磷酸缓冲盐水)中,使所述细胞沉淀经过微流化仪(microfluidier)进行 完全细胞裂解并且通过使用蛋白质g sepharose
tm
(amersham)的亲和层 析法纯化thiofab。
[0471]
表达thiofab l-v15c、l-v110c、h-a88c和h-a121c并且通过蛋白 质-g sepharose
tm
柱层析法纯化。寡聚-fab存在于级分26-30中,并且 大部分单体形式存在于级分31-34中。收集由单体形式组成的级分并且通过 sds-page分析它们以及野生型hu4d5fabv8,并且用sds-page凝胶在还 原(使用dtt或bme)和非-还原(不使用dtt或bme)条件下分析。使用非
‑ꢀ
还原sds-page分析a121c-thiofab的凝胶过滤级分。
[0472]
如上所述使thiofab与生物素-peo-马来酰亚胺偶联并且通过 superdex-200
tm
(amersham)凝胶过滤层析法进一步纯化生物素化-thiofab, 该过程消除了游离的生物素-peo-马来酰亚胺和thiofab的寡聚级分。将野 生型hu4d5fabv8和hu4d5fabv8 a121c-thiofab(用量0.5mg)各自和单独与 100倍摩尔过量的生物素-peo-马来酰亚胺在室温温育3小时并且上样至 superdex-200凝胶过滤柱,以便从单体形式中分离游离的生物素和寡聚fab。
[0473]
实施例3b
–
thiofab的分析
[0474]
通过液相层析电喷射离子化质谱(ls-esi-ms)分析生物素化的 hu4d5fabv8(a121c)thiofab和野生型hu4d5fabv8的酶促消化片段。生物 素化的hu4d5fabv8(a121c)的原始质量48294.5与野生型hu4d5fabv8的原 始质量47737.0之差为557.5质量单位。该片段表明存在单一生物素-peo
‑ꢀ
马来酰亚胺部分(c
23h36
n5o7s2)。表8显示了片段化值,其证实了该序列。 表8胰蛋白酶消化后生物素化的hu4d5fabv8 thiofab a121c的lc-esi
‑ꢀ
质谱分析
[0475]
[0476][0477]
在superdex-200凝胶过滤前后,对生物素化的abp
‑ꢀ
hu4d5fabv8-a121c、生物素化的abp-hu4d5fabv8-v110c、生物素化的双 cys abp-hu4d5fabv8-(v110c-a88c)和生物素化的双cysabp-hu4d5fabv8-(v110c-a121c)进行使用和不使用dtt或bme还原的 sds-page凝胶分析。
[0478]
hu4d5fabv8-(v110c)-bmpeo-dm1的质谱分析(ms/ms)(superdex-200 凝胶过滤纯化后):fab+1 51607.5;fab 50515.5。该数据表示91.2%偶联。 hu4d5fabv8-(v110c)-bmpeo-dm1(还原的)的ms/ms分析:lc 23447.2; lc+1 24537.3;hc(fab)27072.5。该数据表示所有dm1偶联均在fab的轻 链上。
[0479]
实施例4
–
通过偶联abp-hu4d5fabv8-(v110c)和mc-mmae制备abp-hu4d5fabv8-(v110c)-mc-mmae
[0480]
依照us 7521541、us 7659241、和us 7498298,用已知浓度的乙腈和 水稀释溶于dmso的药物接头试剂马来酰亚氨基辛酰基-一甲基auristatin e (maleimidocaproyl-monomethyl auristatin e)(mmae),即mc-mmae并且加入 到冷却的在磷酸缓冲盐水(pbs)中的abp-hu4d5fabv8-(v110c)thiofab中。 在约1小时后,加入过量的马来酰亚胺以使反应猝灭并且将任何未反应的抗 体硫醇封端。通过离心超滤浓缩该反应混合物并且纯化 abp-hu4d5fabv8-(v110c)-mc-mmae且通过经在pbs中的g25树脂洗脱而 脱盐,通过0.2μm滤膜在无菌条件下过滤并且冷冻以便贮存。
[0481]
实施例5
–
通过偶联abp-hu4d5fabv8-(lc v110c)和mc-mmaf制备abp-hu4d5fabv8-(lc v110c)-mc-mmaf
[0482]
按照实施例4的操作步骤,通过偶联abp-hu4d5fabv8-(lc v110c) thiofab和mc-mmaf制备abp-hu4d5fabv8-(lc v110c)-mc-mmaf。
[0483]
实施例6
–
通过偶联abp-hc a121c-thiofab和mc-val-cit-pab-mmae制备abp-hc a121c-thiofab-mc-val-cit-pab-mmae
[0484]
按照实施例4的操作步骤,通过偶联abp-hu4d5fabv8-(hc a121c)和 mc-val-cit-pab-mmae制备abp-hu4d5fabv8-(hca121c)-mc-val-cit-pab-mmae。
[0485]
实施例7
–
通过偶联abp-hc a121c-thiofab和mc-val-cit-pab-mmaf制备abp-hc a121c-thiofab-mc-val-cit-pab-mmaf
[0486]
按照实施例4的操作步骤,通过偶联abp-hu4d5fabv8-(hc a121c)和 mc-val-cit-pab-mmaf制备abp-hu4d5fabv8-(hca121c)-mc-val-cit-pab-mmaf。
ventures,beverly,ma)在37℃将在cho细胞中表达 的全长半胱氨酸改造的单克隆抗体(thiomab)还原3小时。稀释还原的 thiomab(附图11)并且上样到10mm乙酸钠,ph 5中的hitrap s柱上并且用 含有0.3m氯化钠的pbs洗脱。在室温用200nm硫酸铜水溶液(cuso4)将 洗脱的还原的thiomab处理过夜。去氢抗坏血酸(dhaa)和环境空气氧化也 是有效的氧化剂。
[0515]
实施例12
–
thiomab的偶联
[0516]
将来自实施例11的再氧化的thiomab,包括硫代-曲妥单抗(hca121c)、thio-2h9(a121c)和thio-3a5(a121c)与10倍过量的药物-接头中 间体bm(peo)
3-dm1合并,混合并且在室温保持约1小时,以便进行偶联 并且形成thiomab抗体-药物偶联物,包括硫代-曲妥单抗(hca121c)-bmpeo-dm1、thio-2h9(hc a121c)-bmpeo-dm1和thio-3a5(hca121c)-bmpeo-dm1。将该偶联混合物进行凝胶过滤或上柱并且通过 hitrap s柱洗脱以便除去过量的药物-接头中间体和其它杂质。
[0517]
本发明并不限于由实施例中披露的具体实施方案的范围,这些实施例 用来例示本发明的几个方面并且在功能上等效的任意实施方案均属于本发 明的范围。实际上,除本文所示和所述的外,本发明的各种变型也对本领 域技术人员而言也是显而易见的并且属于本文所附权利要求的范围。
[0518]
通过述及明确收录贯穿本说明书引用的所有专利、专利申请、和参考 文献全文用于所有目的。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1