ECMO仿真模型、ECMO治疗系统仿真模型和ECMO仿真方法与流程
ecmo仿真模型、ecmo治疗系统仿真模型和ecmo仿真方法
技术领域
1.本发明总地涉及生物医学技术领域和医疗教学领域,具体而言涉及一种体外膜肺氧合设备的ecmo仿真模型、ecmo治疗系统仿真模型和ecmo仿真方法。
背景技术:
2.体外膜肺氧合(extracorporeal membrane oxygenation,ecmo)是模拟和替代(部分或完全替代)人体现有氧合(肺)、循环(心)的高级持续体外器官生命支持设备。在近年中国应对sars、新冠的重大公共卫生之战中,ecmo成为挽救严重心肺患者的最后救命良方。
3.真实ecmo系统主要由离心泵、氧合器、氧气源、水箱、管路等组成,根据治疗疾病的不同,分为vv、va两种基础模式,其建立、早期、中期、后期的管理需要经过严格操作培训的专业医师和医疗人员合作完成。而ecmo系统机器、耗材费用高昂,不便于培训使用。当前市场用于ecmo的培训设备多为模拟人体循环管路对ecmo建立中“插管、管道预充”环节的操作培训,目的是使被培训者掌握ecmo插管和预充的操作方法。当前市场中该类设备不能模拟ecmo建立后,早期、中期、后期管理过程中,应对不同病情的ecmo模式下设备参数调整及突发事件的处理,这不利于在使用ecmo过程中对患者各种典型疾病表现的评价、治疗方案的调整以及故障的诊断,而这些是使用ecmo治疗呼吸、循环重症成功的重中之重。
4.因此,有必要提出一种模型简单、使用方便、适用于实际临床教学培训的ecmo重症治疗系统仿真模型和仿真方法,以至少部分地解决上述问题。
技术实现要素:
5.在发明内容部分中引入了一系列简化形式的概念,这将在具体实施方式部分中进一步详细说明。本发明的发明内容部分并不意味着要试图限定出所要求保护的技术方案的关键特征和必要技术特征,更不意味着试图确定所要求保护的技术方案的保护范围。
6.为了至少部分地解决背景技术中的问题,本发明的第一个方面提供一种体外膜肺氧合设备的ecmo仿真模型,其包括:
7.流体循环模型,用于模拟所述体外膜肺氧合设备的血流路径,所述流体循环模型包括至少一个流体循环路径模拟单元,用于模拟所述血流路径的组成部分,每个所述流体循环路径模拟单元的血流的上游侧和下游侧分别形成流体循环路径节点,所述流体循环路径节点包括引血连接节点和第一物质交换节点,其中所述引血连接节点用于模拟所述体外膜肺氧合设备的引血连接端,并且能够接收对应于人体血液在进入所述体外膜肺氧合设备时的血液的物质的参数;
8.气体氧合模型,用于模拟所述体外膜肺氧合设备的供氧路径,所述气体氧合模型包括至少一个气体氧合路径模拟单元,用于模拟所述供氧路径的组成部分,每个所述气体氧合路径模拟单元的气流的上游侧和下游侧分别形成气体氧合路径节点,所述气体氧合路径节点包括第二物质交换节点,用于与所述第一物质交换节点模拟所述体外膜肺氧合设备的氧合器的物质交换;
9.设置模块,用于设置所述至少一个流体循环路径模拟单元和所述至少一个气体氧合路径模拟单元的参数;和
10.计算模块,用于计算所述流体循环路径节点的血液的物质的参数值和所述气体氧合路径节点的气体的物质的参数值,以及所述第一物质交换节点与所述第二物质交换节点的物质交换量。
11.根据本发明的ecmo仿真模型,模仿真实体外膜肺氧合设备的结构建立血液路径模型和气体路径模型,并采用数学模型模拟氧合器的氧合过程,模型结构简单、仿真程度高。
12.可选地,所述物质的参数值包括物质的含量。
13.可选地,所述物质的含量以物质的分压值的形式体现。
14.可选地,所述计算模块配置为根据菲克定律计算所述第一物质交换节点与所述第二物质交换节点的所述物质交换量。
15.根据本发明的ecmo仿真模型,氧合器用于完成气体的物质交换,因此优选以气体的分压形式表征物质的含量,并采用菲克定律计算气体的物质交换量。
16.可选地,所述计算模块配置为根据亨利定律计算物质交换后的在所述第一物质交换节点和/或所述第二物质交换节点处的所述物质的含量。
17.根据本发明的ecmo仿真模型,采用亨利定律计算溶解在血液中的气体的分压值。
18.可选地,所述物质包括氧,所述物质的含量包括所述氧的含量,所述物质交换量包括所述氧的交换量,并且/或者
19.所述物质包括二氧化碳,所述物质的含量包括所述二氧化碳的含量,所述物质交换量包括所述二氧化碳的交换量。
20.根据本发明的ecmo仿真模型,模拟肺换气过程,计算氧和二氧化碳的物质交换量。
21.可选地,所述计算模块配置为根据氧解离曲线和所述氧的分压值确定血液的血氧饱和度。
22.根据本发明的ecmo仿真模型,在得到血液中的氧分压值后,根据氧解离曲线确定血氧饱和度。
23.可选地,所述流体循环路径模拟单元包括第一恒流电流源isp,用于模拟所述体外膜肺氧合设备的血泵,其电流值用于模拟所述体外膜肺氧合设备的血流路径中的血流的速度,所述第一物质交换节点位于所述第一恒流电流源isp的下游,所述引血连接节点位于所述第一恒流电流源isp的上游。
24.根据本发明的ecmo仿真模型,采用电路模型模拟体外膜肺氧合设备的血流路径,以恒流源模拟血泵的动力,其电流值用于模拟血流速度,电流值越大则血泵动力越强、血流速度越大,仿真程度高。
25.可选地,所述流体循环模型包括回血连接节点,用于模拟所述体外膜肺氧合设备的回血连接端,所述回血连接节点位于所述第一物质交换节点的下游。
26.根据本发明的ecmo仿真模型,模拟真实体外膜肺氧合设备的结构,将经过氧合后的血液灌注回人体。
27.可选地,所述流体循环路径模拟单元还包括多个与所述第一恒流电流源isp串联的流体路径电阻,所述流体路径电阻包括:
28.引血连接端电阻rdrs,用于模拟所述体外膜肺氧合设备的引血插管,其电阻值用
于模拟所述引血插管的连接情况;
29.引血管电阻rdr,用于模拟所述体外膜肺氧合设备的引血管,其电阻值用于模拟所述引血管对所述血流的阻力,所述引血管电阻rdr串联在所述引血连接端电阻rdrs与所述第一恒流电流源isp之间;
30.回血管电阻rre,用于模拟所述体外膜肺氧合设备的回血管,其电阻值用于模拟所述回血管对所述血流的阻力,所述回血管电阻rre串联在所述第一恒流电流源isp的下游;和
31.回血连接端电阻rres,用于模拟所述体外膜肺氧合设备的回血插管,其电阻值用于模拟所述回血插管的连接情况,所述回血连接端电阻rres串联在所述回血管电阻rre的下游,
32.其中,位于所述回血管电阻rre的上游侧的所述节点为所述第一物质交换节点,位于所述引血连接端电阻rdrs的上游侧的所述节点为所述引血连接节点。
33.根据本发明的ecmo仿真模型,采用电路模型模拟体外膜肺氧合设备的血流路径,以电阻模拟血流管路的各个部分,电阻的阻值用于模拟该部分管路对血流的阻力,电阻值越大则阻力越大,仿真程度高。
34.可选地,所述流体循环路径模拟单元还包括流体循环路径电容co,用于模拟所述血流路径的顺应性,其电容容量用于模拟所述体外膜肺氧合设备的血流管路的弹性,所述流体循环路径电容co连接至所述第一物质交换节点。
35.根据本发明的ecmo仿真模型,采用电路模型模拟体外膜肺氧合设备的血流路径,以电容模拟血流管路的弹性,电容值越大则管路的弹性越大,仿真程度高。
36.可选地,位于所述回血连接端电阻rres的下游侧的所述节点为回血连接节点,用于模拟所述体外膜肺氧合设备的回血连接端。
37.可选地,所述气体氧合路径模拟单元包括第二恒流电流源is,用于模拟所述体外膜肺氧合设备的气动控制,其电流值用于模拟氧气的通气速度,所述第二物质交换节点位于所述第二恒流电流源is的下游。
38.根据本发明的ecmo仿真模型,采用电路模型模拟体外膜肺氧合设备的供氧路径,以恒流源模拟气动控制,其电流值用于模拟气流速度,电流值越大则气动控制动力越强、气流速度越大,仿真程度高。
39.可选地,所述气体氧合路径模拟单元还包括多个与所述第二恒流电流源is串联的气体路径电阻,所述气体路径电阻包括:
40.送气管电阻rin,用于模拟所述体外膜肺氧合设备的送气管,其电阻值用于模拟所述送气管对通气气流的阻力,所述送气管电阻rin连接在所述第二恒流电流源is的下游;
41.氧合器电阻rp,用于模拟所述体外膜肺氧合设备的氧合器,其电阻值用于模拟所述氧合器对通气气流的阻力,所述氧合器电阻rp连接在所述送气管电阻rin的下游;和
42.排气管电阻rout,用于模拟所述体外膜肺氧合设备的排气管,其电阻值用于模拟所述排气管对通气气流的阻力,所述排气管电阻rout连接在所述氧合器电阻rp的下游,
43.其中,所述氧合器电阻rp与所述排气管电阻rout之间的节点为所述第二物质交换节点。
44.根据本发明的ecmo仿真模型,采用电路模型模拟体外膜肺氧合设备的气流路径,
以电阻模拟气流管路的各个部分,电阻的阻值用于模拟该部分管路对气流的阻力,电阻值越大则阻力越大,仿真程度高。
45.可选地,所述气体氧合路径模拟单元还包括气体氧合路径电容cp,用于模拟所述供氧路径的顺应性,其电容容量用于模拟所述体外膜肺氧合设备的气流管路的弹性,所述气体氧合路径电容cp连接至所述第二物质交换节点。
46.根据本发明的ecmo仿真模型,采用电路模型模拟体外膜肺氧合设备的气流路径,以电容模拟气流管路的弹性,电容值越大则管路的弹性越大,仿真程度高。
47.可选地,位于所述第二恒流电流源is的上游侧的所述节点用于设置供氧气体的物质的参数,所述供氧气体的物质的参数包括氧的浓度或氧的分压。
48.根据本发明的ecmo仿真模型,采用电路模型模拟体外膜肺氧合设备的气流路径,以恒流源模拟气动控制,恒流源上游侧的节点用于模拟供氧源。
49.可选地,所述设置模块还用于设置氧气瓶的氧含量和/或所述体外膜肺氧合设备的氧合器的参数,所述氧合器的参数包括氧合器膜的有效气体交换面积、氧合器膜的厚度和氧合器的血液容量中的一个或多个。
50.根据本发明的ecmo仿真模型,通过设置模块设置多个模型参数。
51.本发明的第二方面提供一种体外膜肺氧合设备的ecmo治疗系统仿真模型,其包括:
52.上述的ecmo仿真模型;和
53.心血管仿真模型,用于模拟心肺功能障碍,并能够输出在所述心肺功能障碍情况下血液的物质的参数值,其中所述心血管仿真模型与所述流体循环模型构成对应于血液的封闭回路。
54.根据本发明的ecmo治疗系统仿真模型整体参照真实治疗场景构建。
55.可选地,所述心血管仿真模型包括:
56.下腔静脉节点,用于模拟下腔静脉血管,所述下腔静脉节点能够输出对应于人体的所述血液的物质的含量,
57.上腔静脉节点,用于模拟上腔静脉血管,和
58.主动脉节点,用于模拟主动脉血管;
59.所述ecmo仿真模型包括:
60.引血连接节点,用于模拟所述体外膜肺氧合设备的引血连接端,并且用于接收对应于人体血液在进入所述体外膜肺氧合设备时的血液的物质的参数,和
61.回血连接节点,用于模拟所述体外膜肺氧合设备的回血连接端;
62.其中,
63.所述ecmo治疗系统仿真模型包括va-ecmo仿真治疗模式,用于模拟所述体外膜肺氧合设备的va-ecmo治疗模式,在所述va-ecmo仿真治疗模式中,所述下腔静脉节点与所述引血连接节点连接,所述主动脉节点与所述回血连接节点连接;并且/或者
64.所述ecmo治疗系统仿真模型包括vv-ecmo仿真治疗模式,用于模拟所述体外膜肺氧合设备的vv-ecmo治疗模式,在所述vv-ecmo仿真治疗模式中,所述下腔静脉节点与所述引血连接节点连接,所述上腔静脉节点与所述回血连接节点连接;并且/或者
65.所述ecmo治疗系统仿真模型包括vav-ecmo仿真治疗模式,用于模拟所述体外膜肺
氧合设备的vav-ecmo治疗模式,在所述vav-ecmo仿真治疗模式中,所述下腔静脉节点与所述引血连接节点连接,所述上腔静脉节点与所述回血连接节点连接,所述主动脉节点与所述回血连接节点连接。
66.根据本发明的ecmo治疗系统仿真模型,通过调整根据本发明的ecmo仿真模型与心血管仿真模型的连接方式,可以模拟体外膜肺氧合设备的各种治疗模式。
67.可选地,所述流体循环模型包括第一恒流电流源isp,用于模拟所述体外膜肺氧合设备的血泵,其电流值用于模拟所述体外膜肺氧合设备的血流路径中的血流的速度,
68.所述心血管仿真模型包括冠状动脉节点、锁骨下动脉节点、右颈动脉节点、左颈动脉节点和腋动脉节点,其中,
69.所述ecmo治疗系统仿真模型配置为,在所述va-ecmo仿真治疗模式中,通过调整所述第一恒流电流源isp的电流值以模拟不同的分水岭现象,所述分水岭为心脏的输出血流与所述体外膜肺氧合设备的回血血流的交汇点。
70.根据本发明的ecmo治疗系统仿真模型,可以人为仿真va-ecmo治疗模式下的不同的“分水岭”情况,从而可以培训医护人员熟悉不同分水岭情况下患者的症状表现,以使医护人员能够在实际治疗过程中根据患者症状反推分水岭的位置,从而能够给患者更适宜的治疗方案。
71.可选地,所述心血管仿真模型包括:
72.至少一个模型电阻,用于模拟呼吸道,其电阻值用于模拟所述呼吸道对气流的阻力;和/或
73.至少一个模型电容,用于模拟呼吸道的顺应性,其电容容量用于模拟所述呼吸道的弹性;
74.ecmo治疗系统仿真模型配置为通过调整所述模型电阻的电阻值、所述模型电容的容量和肺交换面积参数值中的一个或多个以模拟所述心肺功能障碍。
75.可选地,所述心肺功能障碍包括心衰、严重急性呼吸窘迫综合征、心源性休克、心脏骤停和呼吸骤停中的一个或多个。
76.根据本发明的ecmo治疗系统仿真模型,也采用电路模型模拟心血管生理、病理情况,从而更易于与根据本发明的ecmo仿真模型连接。
77.可选地,所述流体循环模型包括多个流体路径电阻,分别用于模拟所述体外膜肺氧合设备的血流管路的各个部分,其电阻值用于模拟所对应的血流管路部分对血流的阻力,
78.所述ecmo治疗系统仿真模型配置为通过调整所述流体路径电阻的阻值以模拟所述血流管路的故障。
79.可选地,所述血流管路的故障包括引血插管脱管、引血管路堵塞、回血管路堵塞和回血插管脱管中的一个或多个。
80.可选地,所述气体氧合模型包括多个气体路径电阻,分别用于模拟所述体外膜肺氧合设备的气流管路的各个部分,其电阻值用于模拟所对应的气流管路部分对气流的阻力,
81.所述ecmo治疗系统仿真模型配置为通过调整所述气体路径电阻的阻值以模拟所述体外膜肺氧合设备的供氧故障。
82.可选地,所述流体循环模型包括第一恒流电流源isp,用于模拟所述体外膜肺氧合设备的血泵,其电流值用于模拟所述体外膜肺氧合设备的血流路径中的血流的速度,所述ecmo治疗系统仿真模型配置为通过调整所述第一恒流电流源isp的电流值以模拟所述血泵的故障。
83.可选地,所述血泵的故障包括血泵血栓和/或血泵有气泡。
84.可选地,所述流体循环模型包括回血管电阻rre,用于模拟所述体外膜肺氧合设备的回血管,其电阻值用于模拟所述回血管对血流的阻力,
85.所述ecmo治疗系统仿真模型配置为通过调整所述回血管电阻rre的阻值和/或所述体外膜肺氧合设备的氧合器膜的有效气体交换面积参数值以模拟所述氧合器的故障。
86.可选地,所述气体氧合模型包括第二恒流电流源is,用于模拟所述体外膜肺氧合设备的气动控制,其电流值用于模拟氧气的通气速度,
87.所述的ecmo治疗系统仿真模型配置为,通过调整所述第二恒流电流源is的电流值和氧气瓶的初始氧气含量参数值模拟氧气瓶耗尽故障。
88.根据本发明的ecmo治疗系统仿真模型,通过调整模型参数可以模拟体外膜肺氧合设备的各种故障,从而可以培训医护人员熟悉故障表现,使医护人员可以在实际治疗过程中及时发现和排除设备故障。
89.可选地,所述心血管仿真模型包括用于模拟血管生理结构的多个节点,
90.所述ecmo治疗系统仿真模型还包括输出模块,用于获取所述流体循环模型和所述心血管仿真模型的所述节点的参数值,并将其输出至输出设备。
91.可选地,所述参数值包括所述节点的血流速度、血液氧分压值、血液二氧化碳分压值和血氧饱和度中的一个或多个。
92.根据本发明的ecmo治疗系统仿真模型,可将患者的治疗情况输出至输出设备,使医护人员看到模拟治疗的结果。
93.本发明的第三方面提供一种体外膜肺氧合设备的ecmo仿真方法,其包括以下步骤:
94.s10、建立流体循环模型,用于模拟所述体外膜肺氧合设备的血流路径,所述流体循环模型包括至少一个流体循环路径模拟单元,用于模拟所述血流路径的组成部分,每个所述流体循环路径模拟单元的血流的上游侧和下游侧分别形成流体循环路径节点,所述流体循环路径节点包括引血连接节点和第一物质交换节点,其中所述引血连接节点用于模拟所述体外膜肺氧合设备的引血管的引血端,并且能够接收对应于人体血液在进入所述体外膜肺氧合设备时的血液的物质的参数;
95.s20、建立气体氧合模型,用于模拟所述体外膜肺氧合设备的供氧路径,所述气体氧合模型包括至少一个气体氧合路径模拟单元,用于模拟所述供氧路径的组成部分,每个所述气体氧合路径模拟单元的气流的上游侧和下游侧分别形成气体氧合路径节点,所述气体氧合路径节点包括第二物质交换节点,用于与所述第一物质交换节点模拟所述体外膜肺氧合设备的氧合器的物质交换;
96.s30、设置所述至少一个流体循环路径模拟单元和所述至少一个气体氧合路径模拟单元的参数;
97.s40、计算所述流体循环路径节点的血液的物质的参数值和所述气体氧合路径节
点的气体的物质的参数值,以及所述第一物质交换节点与所述第二物质交换节点的物质交换量。
98.根据本发明的ecmo仿真方法,模仿真实体外膜肺氧合设备的结构建立血液路径模型和气体路径模型,并采用数学模型模拟氧合器的氧合过程,仿真方法简单、仿真程度高。
99.可选地,所述物质的参数值包括物质的含量,所述物质的含量以物质的分压值的形式体现,在所述步骤s40中根据菲克定律计算所述第一物质交换节点与所述第二物质交换节点的所述物质交换量。
100.根据本发明的ecmo仿真方法,氧合器用于完成气体的物质交换,因此优选以气体的分压形式表征物质的含量,并采用菲克定律计算气体的物质交换量。
101.可选地,所述物质包括氧,所述物质的含量包括所述氧的含量,所述物质交换量包括所述氧的交换量,
102.所述ecmo仿真方法在所述步骤s30之后还包括:
103.s50,根据亨利定律计算物质交换后的在所述第一物质交换节点和/或所述第二物质交换节点处的所述物质的含量;
104.s60、根据氧解离曲线和所述氧的分压值确定血液的血氧饱和度。
105.根据本发明的ecmo仿真方法,采用亨利定律计算溶解在血液中的气体的分压值,并根据血液中的氧分压值和氧解离曲线进一步得到血氧饱和度。
106.可选地,所述流体循环路径模拟单元包括第一恒流电流源isp,用于模拟所述体外膜肺氧合设备的血泵,其电流值用于模拟所述体外膜肺氧合设备的血流路径中的血流的速度,所述第一物质交换节点位于所述第一恒流电流源isp的下游;并且/或者
107.所述气体氧合路径模拟单元包括第二恒流电流源is,用于模拟所述体外膜肺氧合设备的气动控制,其电流值用于模拟氧气的通气速度,所述第二物质交换节点位于所述第二恒流电流源is的下游。
108.根据本发明的ecmo仿真方法,采用电路模型模拟体外膜肺氧合设备的血流路径和供氧路径,以恒流源模拟血流和气流,仿真程度高。
109.可选地,所述流体循环路径模拟单元还包括多个与所述第一恒流电流源isp串联的流体路径电阻,分别用于模拟所述体外膜肺氧合设备的血流管路的各个部分,其电阻值用于模拟所对应的血流管路部分对血流的阻力;并且/或者
110.所述气体氧合路径模拟单元还包括多个与所述第二恒流电流源is串联的气体路径电阻,分别用于模拟所述体外膜肺氧合设备的气流管路的各个部分,其电阻值用于模拟所对应的气流管路部分对气流的阻力。
111.根据本发明的ecmo仿真方法,采用电路模型模拟体外膜肺氧合设备的血流路径和供氧路径,以电阻模拟血流管路和气流管路的各个部分对流体的阻力,仿真程度高。
112.可选地,所述流体循环路径模拟单元还包括流体循环路径电容co,用于模拟所述血流路径的顺应性,其电容容量用于模拟所述体外膜肺氧合设备的血流管路的弹性,所述流体循环路径电容co连接至所述第一物质交换节点;并且/或者
113.所述气体氧合路径模拟单元还包括气体氧合路径电容cp,用于模拟所述供氧路径的顺应性,其电容容量用于模拟所述体外膜肺氧合设备的气流管路的弹性,所述气体氧合路径电容cp连接至所述第二物质交换节点。
114.根据本发明的ecmo仿真方法,采用电路模型模拟体外膜肺氧合设备的血流路径和供氧路径,以电容模拟血流管路和气流管路的弹性,仿真程度高。
附图说明
115.本发明的下列附图在此作为本发明的一部分用于理解本发明。附图中示出了本发明的具体实施方式及其描述,用来解释本发明的原理。
116.附图中:
117.图1为真实体外膜肺氧合设备用于患者治疗的示意图;
118.图2为根据本发明的体外膜肺氧合设备的ecmo治疗系统仿真模型的优选实施方式的结构示意简图
119.图3为根据本发明的体外膜肺氧合设备的ecmo治疗系统仿真模型的一个实施方式的结构示意图;
120.图4为根据本发明的体外膜肺氧合设备的ecmo治疗系统仿真模型的又一个实施方式的结构示意图;
121.图5为根据本发明的体外膜肺氧合设备的ecmo治疗系统仿真模型的再一个实施方式的结构示意图;
122.图6为图5中的ecmo治疗系统仿真模型模拟vv-ecmo治疗模式的示意图;
123.图7为图5中的ecmo治疗系统仿真模型模拟vav-ecmo治疗模式的示意图;
124.图8为氧解离曲线的具体示例;
125.图9为图6中的ecmo治疗系统仿真模型模拟治疗呼吸骤停的血氧饱和度曲线;
126.图10为图5中的ecmo治疗系统仿真模型模拟不同治疗方法治疗心源性休克合并严重急性呼吸窘迫综合征的血氧饱和度曲线;
127.图11为图6中的ecmo治疗系统仿真模型模拟回血管堵塞故障时的氧合治疗血氧饱和度曲线;
128.图12为图5中的ecmo治疗系统仿真模型模拟治疗心源性休克合并严重急性呼吸窘迫综合征的血氧饱和度曲线。
129.附图标记说明:
130.10/110/210:ecmo仿真模型
131.20/120/220:ecmo治疗系统仿真模型
132.30/130/230:流体循环模型
133.60/160/260:气体氧合模型
134.200:心血管仿真模型
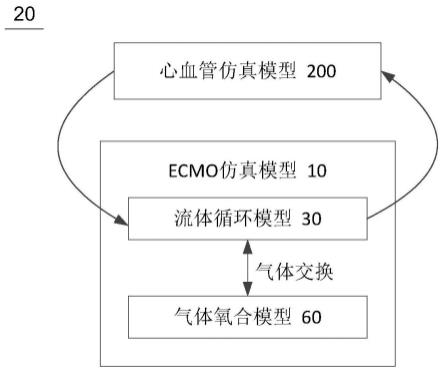
具体实施方式
135.在下文的描述中,给出了大量具体的细节以便提供对本发明更为彻底的理解。然而,对于本领域技术人员来说显而易见的是,本发明实施方式可以无需一个或多个这些细节而得以实施。在其他的例子中,为了避免与本发明实施方式发生混淆,对于本领域公知的一些技术特征未进行描述。
136.为了彻底了解本发明实施方式,将在下列的描述中介绍详细的过程。显然,本发明
实施方式的施行并不限定于本领域的技术人员所熟习的特殊细节。
137.本发明提供了一种体外膜肺氧合设备的ecmo仿真方法、ecmo仿真模型和ecmo治疗系统仿真模型。其中,根据本发明的ecmo仿真模型基于根据本发明的ecmo仿真方法建立,根据本发明的ecmo治疗系统仿真模型包括根据本发明的ecmo仿真模型。
138.根据本发明的ecmo仿真方法和ecmo仿真模型根据真实体外膜肺氧合设备结构构建。为了更好地理解根据本发明的ecmo仿真方法和ecmo仿真模型,首先简要介绍真实体外膜肺氧合设备的结构和使用方法。
139.如图1所示,体外膜肺氧合设备用于部分或完全替代人体的肺脏和/或心脏。体外膜肺氧合设备主要包括血流路径、供氧路径和氧合器三大结构体。
140.血流路径包括血流管路和血泵,其中血流管路包括引血连接端、引血管、回血管和回血连接端。引血连接端为血流管路的起点,通常位于人体的静脉(例如通过血管插管技术置入腔静脉);引血管连接在引血连接端(引血插管)与氧合器之间,用于将低氧的静脉血输送至氧合器;血泵为血流路径中的动力源,使血液可以循环流动;回血管连接在氧合器与回血连接端之间,用于将氧合后的高氧血输送回人体;回血连接端为血流管路的终点,与引血连接端类似也置于人的血管中(例如回血插管)。引血连接端也可以认为是引血管的置入人体内的端头部分,回血连接端也可以认为是回血管的置入人体内的端头部分。
141.供氧路径包括气流管路和氧气供应源,其中气流管路包括送气管和排气管。氧气供应源通过高压或泵送等气动控制技术将按需要比例配比的空气和纯氧气送至送气管;送气管连接在气泵与氧合器之间,将富含氧气的气体送至氧合器,从而静脉血可以在氧合器与富氧空气进行物质交换(例如氧和二氧化碳的交换),从而血液的氧含量增高;物质交换后的废气直接从排气管排出。
142.如图1所示,血流和气流在氧合器交汇。氧合器内设置有模拟人体肺泡的氧合器膜,血液位于氧合器膜的一侧,气体位于氧合器膜的另一侧,血液和气体通过氧合器膜进行物质交换。
143.在血流路径中,血液从引血连接端至回血连接端单向流动。在供氧路径中,气体从氧气供应源至排气管单向流动。
144.如图2所示,在一个具体的实施方式中,根据本发明的体外膜肺氧合设备的ecmo治疗系统仿真模型20包括心血管仿真模型200和根据本发明的体外膜肺氧合设备的ecmo仿真模型10。其中,心血管仿真模型200用于模拟人体的心血管情况,ecmo仿真模型10则用于模拟体外膜肺氧合设备,二者的模型参数建立连接关系,从而可以模拟体外膜肺氧合设备对呼吸、循环重症患者的治疗情况。
145.具体的,ecmo仿真模型10包括流体循环模型30和气体氧合模型60。流体循环模型30用于模拟体外膜肺氧合设备的血流路径。气体氧合模型60用于模拟体外膜肺氧合设备的供氧路径。心血管仿真模型200可以模拟心肺功能障碍,并能够输出在该心肺功能障碍情况下血液的物质的参数值,心血管仿真模型200与流体循环模型30构成对应于血液的封闭回路。
146.如图3所示,在具体的实施方式中,心血管仿真模型200模仿人体的心血管生理结构构建,例如,心血管仿真模型200包括多个用于模拟人体相应血管的节点,如下腔静脉节点(用于模拟下腔静脉)、上腔静脉节点(用于模拟上腔静脉)、主动脉节点(用于模拟主动
脉)、左臂血管节点(用于模拟左臂血管)、右臂血管节点(用于模拟右臂血管)等。在每一个节点,心血管仿真模型200可以输出该节点的血液的参数值,例如血流速度、血液氧分压值、血液二氧化碳分压值和血氧饱和度中的一个或多个。根据需要,心血管仿真模型200的节点还可输出如血红蛋白含量等的其他生理参数。
147.心血管仿真模型200采用集总参数模型、以电路结构抽象体现。心血管仿真模型200包括至少一个模型电阻和/或至少一个模型电容。模型电阻用于模拟呼吸道,例如其电阻值用于模拟呼吸道对气流的阻力(例如,当人体患病时呼吸道对气流的阻力加大,因而呼吸困难)。模型电容用于模拟呼吸道的顺应性,例如其电容容量用于模拟呼吸道的弹性(例如,当人体患病时呼吸道弹性下降,因而呼吸困难)。通过调整模型电阻的电阻值、所述模型电容的容量和肺交换面积参数值中的一个或多个以模拟所述心肺功能障碍。心血管仿真模型200可以模拟的心肺功能障碍包括心衰、严重急性呼吸窘迫综合征(ards)、心源性休克(cs)、心脏骤停和呼吸骤停等。
148.心血管仿真模型200与ecmo仿真模型联动可以仿真体外膜肺氧合设备对患者的治疗过程。为更好地理解该仿真治疗过程的实现,以下结合根据本发明的ecmo仿真方法和ecmo仿真模型进行介绍。
149.在根据本发明的ecmo仿真方法中,优选包括以下步骤。
150.s10、建立流体循环模型,用于模拟体外膜肺氧合设备的血流路径。
151.具体地,根据本发明的ecmo仿真模型包括流体循环模型30,流体循环模型30包括至少一个流体循环路径模拟单元,用于模拟体外氧合设备的血流路径的组成部分。每个流体循环路径模拟单元的血流的上游侧和下游侧分别形成流体循环路径节点。流体循环路径节点包括引血连接节点和第一物质交换节点,其中引血连接节点用于模拟体外膜肺氧合设备的引血连接端,并且能够接收对应于人体血液在进入体外膜肺氧合设备时的血液的物质的参数(例如接收来自于心血管仿真模型200的血液的物质的参数)。
152.s20、建立气体氧合模型,用于模拟体外膜肺氧合设备的供氧路径。
153.具体地,根据本发明的ecmo仿真模型包括气体氧合模型60,气体氧合模型60包括至少一个气体氧合路径模拟单元,用于模拟体外氧合设备的供氧路径的组成部分。每个气体氧合路径模拟单元的气流的上游侧和下游侧分别形成气体氧合路径节点,气体氧合路径节点包括第二物质交换节点,用于与流体循环模型30的第一物质交换节点模拟体外膜肺氧合设备的氧合器的物质交换。
154.s30、设置至少一个流体循环路径模拟单元和至少一个气体氧合路径模拟单元的参数。
155.具体地,根据本发明的ecmo仿真模型包括设置模块,用于设置至少一个流体循环路径模拟单元和至少一个气体氧合路径模拟单元的参数。
156.优选地,设置模块可设置对应于真实体外氧合治疗的技术参数的任意模型参数。例如,设置模块可设置氧气瓶的氧含量和/或体外膜肺氧合设备的氧合器的参数,氧合器的参数包括氧合器膜的有效气体交换面积、氧合器膜的厚度和氧合器的血液容量等。
157.s40、计算所述流体循环路径节点的血液的物质的参数值和所述气体氧合路径节点的气体的物质的参数值,以及所述第一物质交换节点与所述第二物质交换节点的物质交换量。
158.具体地,根据本发明的ecmo仿真模型包括计算模块,用于计算流体循环路径节点的血液的物质的参数值和气体氧合路径节点的气体的物质的参数值,以及第一物质交换节点与第二物质交换节点的物质交换量。
159.优选地,物质的参数值包括物质的含量。优选地,物质的含量以物质的分压值的形式体现。计算模块配置为根据菲克定律(见公式(1))计算所述第一物质交换节点与所述第二物质交换节点的所述物质交换量。
[0160][0161]
公式(1)中,v指物质交换后得到的气体容积,a为氧合器膜有效气体交换面积,d为气体弥散系数(4.1
×
10-11
cm2/s
·
mmhg),p1为氧合器膜一侧的物质分压,p2为氧合器膜另一侧的物质分压,t为氧合器膜厚度(交换距离)。
[0162]
具体地,物质包括氧,物质的含量包括氧的含量,物质交换量包括氧的交换量。物质还包括二氧化碳,物质的含量包括二氧化碳的含量,物质交换量包括二氧化碳的交换量。
[0163]
根据菲克定律,物质(例如气体)将从分压高的区域向分压低的区域扩散。因此,在氧合器中,氧从氧合器的气体测向血液侧扩散,二氧化碳从氧合器的血液侧向气体侧扩散,氧的物质交换量和二氧化碳的物质交换量可分别通过公式(1)进行计算。
[0164]
在本发明中,第一物质交换节点用于模拟体外膜肺氧合设备的氧合器的氧合器膜的血液侧,第二物质交换节点用于模拟氧合器膜的气体侧。公式(1)中的p1和p2分别来源于第一物质交换节点和第二物质交换节点的参数值。
[0165]
s50、计算物质交换后的在第一物质交换节点和/或第二物质交换节点处的物质的含量。
[0166]
具体地,计算模块配置为根据亨利定律(见公式(2))计算物质交换后的在第一物质交换节点和/或第二物质交换节点处的物质的含量(以物质的分压值的形式体现)。可以理解的,在第一物质交换节点,物质的含量包括血液中的氧的分压值。
[0167][0168]
在公式(2)中,p为物质的分压值,c为物质的质量体积浓度,d为物质的密度,cs为物质的溶解度。
[0169]
s60、确定血液的血氧饱和度。
[0170]
具体地,计算模块配置为根据氧解离曲线(如图8所示)和氧的分压值确定血液的血氧饱和度。例如,在第一物质交换节点,计算模块配置为根据氧解离曲线和在第一物质交换节点处的氧的分压值确定第一物质交换节点处的血液的血氧饱和度。
[0171]
在如图3所示的实施方式中,ecmo仿真模型10的流体循环模型30的流体循环路径模拟单元包括第一恒流电流源isp,用于模拟体外膜肺氧合设备的血泵。第一恒流电流源isp的电流用于模拟血流,其电流值用于模拟体外膜肺氧合设备的血流路径中的血流的速度,第一物质交换节点n5位于第一恒流电流源isp的下游,引血连接节点n1位于第一恒流电流源isp的上游。在第一物质交换节点n5的下游还设置有回血连接节点n7,用于模拟所述体外膜肺氧合设备的回血连接端。
[0172]
作为真实ecmo动力的离心泵在电路模型中使用恒流电流源isp模拟,运送引血管的静脉血进入氧合器。电流源isp是整个ecmo体外循环的驱动力及氧合回血的灌注力,其电流值为ecmo仿真模型血流速度的预设输入参数。在真实治疗中,血流速度是ecmo治疗成功与否的最重要设置参数之一,需根据病人实际病情、ecmo治疗模式、治疗目的等实际情况进行合理设置。
[0173]
ecmo仿真模型10的气体氧合模型60的气体氧合路径模拟单元包括第二恒流电流源is,用于模拟体外膜肺氧合设备的气动控制。第二恒流电流源is的电流用于模拟气流,其电流值用于模拟氧气的通气速度,第二物质交换节点ng4位于第二恒流电流源is的下游。第二恒流电流源is的上游侧的节点ng1用于设置(或接收)供氧源的气体的物质的参数值,例如供氧气体中氧的浓度、二氧化碳的浓度、氧的分压、二氧化碳的分压等。节点ng1可以理解为用于模拟体外膜肺氧合设备的氧气供应源。
[0174]
气动控制装置使用恒流电流源is模拟,气流流速是ecmo最重要的设置参数之一。is按照设置的气流速度,驱动气源内混合气持续通气至氧合器,并排出氧合后废气。真实临床上,气流速度设置需根据病人实际病情,与血流速度配合设置,给予病人最合理的通气血流比氧合治疗。电流源is上游侧节点用于设置fio2(吸入氧气浓度),控制输入气体的氧浓度。气体o2、co2等物质量按百分比形式计算构建。fio2是ecmo重要的设置参数之一。临床治疗时,需根据病人血气情况,设置合适的fio2,随治疗的加深,合理调整,是ecmo体外氧合治疗成功的关键因素之一。
[0175]
根据本发明的ecmo治疗系统仿真模型包括va-ecmo仿真治疗模式(如图3、图4和图5所示)、vv-ecmo仿真治疗模式(如图6所示)和vav-ecmo仿真治疗模式(如图7所示)。
[0176]
va-ecmo仿真治疗模式用于模拟体外膜肺氧合设备的va-ecmo治疗模式,即体外膜肺氧合设备替代人体的肺脏和部分心脏功能。因此,在va-ecmo仿真治疗模式中,心血管模型200的下腔静脉节点与ecmo仿真模型的引血连接节点n1连接,心血管模型200的主动脉节点与ecmo仿真模型的回血连接节点n7连接。
[0177]
vv-ecmo仿真治疗模式用于模拟体外膜肺氧合设备的vv-ecmo治疗模式,即体外膜肺氧合设备替代人体的肺脏功能。因此,在vv-ecmo仿真治疗模式中,心血管模型200的下腔静脉节点与ecmo仿真模型的引血连接节点n1连接,心血管模型200的上腔静脉节点与ecmo仿真模型的回血连接节点n7连接。
[0178]
vav-ecmo仿真治疗模式用于模拟体外膜肺氧合设备的vav-ecmo治疗模式,即体外膜肺氧和设备替代人体的肺脏和心脏功能。因此,在vav-ecmo仿真治疗模式中,心血管模型200的下腔静脉节点与ecmo仿真模型的引血连接节点n1连接,心血管模型200的上腔静脉节点与ecmo仿真模型的回血连接节点n7连接,心血管模型200的主动脉节点与ecmo仿真模型的回血连接节点n7连接。
[0179]
重新回到图3,心血管模型200的下腔静脉节点能够输出血液的物质的参数,例如对应于人体的血液的物质的含量,例如血液的氧分压、血液的二氧化碳分压等。当心血管模型200模拟不同的疾病时,其下腔静脉节点能够输出对应于该疾病情况下的血液的物质的参数。引血连接节点n1能够接收对应于人体血液在进入所述体外膜肺氧合设备时的血液的物质的参数。当下腔静脉节点连接至ecmo仿真模型的引血连接节点n1时,同时也将血液的物质的参数通过节点n1传递给ecmo仿真模型。在设置好ecmo仿真模型的各个参数后,计算
模块即可计算流体循环路径节点的血液的物质的参数值和气体氧合路径节点的气体的物质的参数值,以及第一物质交换节点n5与第二物质交换节点ng4的物质交换量。
[0180]
例如,在一个具体的仿真治疗过程中,以纯氧气体治疗患者。设置ecmo设备的血流速度(对应于isp的电流值)为4l/min,气流速度(对应于is的电流值)为7l/min,吸入氧气浓度(fio2)为100%,氧合器(n5节点)血液容量vb设置为250ml(相当于氧合器膜血液侧的氧合器的容积),氧合器膜有效气体交换变面积a为1.8
×
104cm2,氧合器膜厚度t为2.43
×
10-5
cm,仿真细度δt为0.02s。
[0181]
在t0时刻,ng1与ng4节点的氧分压为760mmhg(标准海平面大气压760
×
100%)、n1和n5节点氧分压初值为40mmhg(氧合治疗前的血液氧分压值,来源于心血管模型200)。在t1时刻(t1=t0+δt),恒流电流源isp将静脉血运输至n1和n5节点。当电路稳定后(对应于体外膜肺氧合设备稳定运行后),运输至各节点的血液、气体量恒定。此时,电路n5节点血液含氧分压po2(n5)=40mmhg、ng4节点氧气分压po2(ng4)=760mmhg。ng4节点与n5节点形成氧的气、液压力梯度。根据公式(1),ng4节点与n5节点进行物质交换,其中氧交换后在n5处获得的氧的容积为:
[0182][0183]
将上述a、d、t的参数值代入公式(3),计算得到v,然后计算v
×
δt=0.437ml,即在δt时长内血液侧获得了0.437ml的纯氧。类似地,也可以计算出血液向氧合器膜的气体侧释放了多少二氧化碳。
[0184]
下一步,根据公式(2)计算物质交换后在n5节点处的氧的分压:
[0185][0186]
公式(4)中,vb为氧合器的血液容量(250ml,在血流恒定的情况下该血液容量值不变),v为根据公式(3)计算得到的物质交换后血液侧获得的氧的容积(0.437ml),v0为n5节点处的未进行物质交换前的氧的容积,vn为n5节点处的进行物质交换后的氧的容积(其为n5节点处的未进行物质交换前的氧的容积v0与物质交换后血液侧获得的氧的容积v之和)。
[0187]
在公式(4)中,即为n5节点处的未进行物质交换前的氧的分压值40mmhg。
[0188]
将氧气溶解度cs=0.024/atm代入公式(4),可计算得到物质交换后n5节点处的氧分压值为95.4mmhg。根据氧解离曲线(如图8所示),此时n5节点的富氧血的血氧饱和度约为98%,完成第一个δt时长内的对体外膜肺氧合治疗过程的模拟。随仿真执行,对每个δt均进行上述运算,将高氧合血经回血连接节点n7灌注回心血管仿真模型,促使体循环氧合恢复。
[0189]
类似地,二氧化碳的物质交换量和其血中的分压值也可通过上述方法计算。气体氧合模型60中的各个节点的氧和二氧化碳的含量可根据氧气供应源的初始设置(ng1节点的预设值)和交换量计算。
[0190]
为模拟真实治疗过程中对患者生命体征和各项生理参数的监护,在本发明中,通
过输出模块获取流体循环模型30和心血管仿真模型200的各个节点的参数值,并将其输出至输出设备(例如显示器、打印机等)。节点的参数值例如节点的血流速度、血液氧分压值、血液二氧化碳分压值和血氧饱和度等。伴随仿真时间的延续,可以得到监护曲线。如图9为根据本发明的体外膜肺氧合设备的ecmo治疗系统仿真模型仿真模拟的一例呼吸骤停体外膜肺氧合治疗的血氧饱和度恢复结果。
[0191]
根据本发明的ecmo治疗系统仿真模型和ecmo仿真模型可以用于医护人员的岗前培训和日常培训。因此,医护人员可以在模型中调整各项治疗相关参数(例如血泵动力、供氧浓度、氧合器参数、管路参数等)然后观察不同治疗方案的治疗结果,从而可以分析、总结对不同人群、不同疾病的各种治疗方案的优劣,以在实际治疗过程中快速做出决断、挽救患者生命。如图10为根据本发明的体外膜肺氧合设备的ecmo治疗系统仿真模型仿真模拟的一例心源性休克合并严重急性呼吸窘迫综合征的体外膜肺氧合治疗在不同治疗方案的血氧饱和度恢复结果的比较,其中在不同的治疗方案中采用了不同的血泵动力。
[0192]
为更加近似地模拟体外膜肺氧合设备的各个部分,在图4所示的实施方式中,根据本发明的ecmo治疗系统仿真模型120包括心血管模型200和根据本发明的ecmo仿真系统110。其中ecmo仿真系统110包括流体循环模型130和气体氧合模型160。ecmo仿真系统110与ecmo仿真系统10的区别在于,在流体循环模型130中,流体循环路径模拟单元除第一恒流电流源isp之外,还包括多个与第一恒流电流源isp串联的流体路径电阻,分别用于模拟体外膜肺氧合设备的血流管路的各个部分,其电阻值用于模拟所对应的血流管路部分对血流的阻力;相应地,在气体氧合模型160中,气体氧合路径模拟单元除第二恒流电流源is外,还包括多个与第二恒流电流源is串联的气体路径电阻,分别用于模拟体外膜肺氧合设备的气流管路的各个部分,其电阻值用于模拟所对应的气流管路部分对气流的阻力。
[0193]
具体地,流体路径电阻包括引血连接端电阻rdrs、引血管电阻rdr、回血管电阻rre和回血连接端电阻rres。引血连接端电阻rdrs用于模拟体外膜肺氧合设备的引血插管,其电阻值用于模拟引血插管的连接情况(连接不良导致血流不畅,因此引血连接端电阻rdrs的阻值也可解释为用于模拟引血插管对血流的阻力);引血管电阻rdr用于模拟体外膜肺氧合设备的引血管,其电阻值用于模拟引血管对血流的阻力,引血管电阻rdr串联在引血连接端电阻rdrs与所述第一恒流电流源isp之间;回血管电阻rre用于模拟体外膜肺氧合设备的回血管,其电阻值用于模拟回血管对血流的阻力,回血管电阻rre串联在第一恒流电流源isp的下游;回血连接端电阻rres用于模拟体外膜肺氧合设备的回血插管,其电阻值用于模拟回血插管的连接情况(与引血连接端电阻rdrs类似),回血连接端电阻rres串联在所述回血管电阻rre的下游。各个电阻的阻值增大用于模拟血流阻力增大(例如管路堵塞),各个电阻的阻值减小用于模拟血流阻力减小。各流体路径电阻和第一恒流电流源isp的上游侧与下游侧分别形成流体循环路径节点n1-n7。其中,位于回血管电阻rre的上游侧的节点n5为第一物质交换节点,位于引血连接端电阻rdrs的血流上游侧的节点n1为引血连接节点,位于回血连接端电阻rres的下游侧的节点为回血连接节点n7。
[0194]
在实际临床治疗中,ecmo管路需根据使用人群不同(成人、儿童、新生儿)和实际情况,选择不同的内径尺寸,并且管路长度、接头数量均需合理,否则会导致该处管路功能异常,影响氧合治疗。血流管路的内径、长度、接头数量等可综合体现为管路的阻力。例如,如果引血管阻力过高,会使人体引血至血泵的血流速度降低,静脉血不能快速得到氧的补给,
进而影响治疗效果,若不及时更换或调整引血管,随时间持续恶化发展,最终可导致患者死亡。
[0195]
正常情况下,各个流体路径电阻的电阻值数值极低(例如为0.01-0.05mmhg
·
s/ml),基本不影响模型物质传输。但当电阻值增大时,可极大影响血流速度,影响氧合,严重时可能破坏设备。
[0196]
在本发明中,通过调整(增大)流体路径电阻的阻值可以模拟血流管路的故障。具体地,分别对应于增大引血连接端电阻rdrs、引血管电阻rdr、回血管电阻rre和回血连接端电阻rres的电阻值,可以模拟引血插管脱管、引血管路堵塞、回血管路堵塞和回血插管脱管的血流管路故障。
[0197]
以回血管电阻rre为例,若rre阻值大幅增大为100mmhg s/ml时,n5节点处的电压(用于模拟氧合器内液压)变化量δu(n5)=rre
×
isp=100
×4×
1000/60=6666.67mmhg,n5节点压力骤增接近10倍大气压,一方面使回血端电路堵塞,血流不能通过n7节点灌注回人体,另一方面导致n5节点气、液压力梯度失衡,导致氧合失效甚至破坏,模型实时监测回血端血流可见血氧饱和度下降。如图11所示为对回血管堵塞50%的情况的模拟。优选地,此时模型发出“ecmo回血流速过低”警报,提醒用户ecmo系统异常。
[0198]
与n5节点类似,流体循环模型130中的各个节点的电压值用于模拟所对应的血流管路的液压值。管路中液压值增大会导致血流速度下降,不利于低氧血快速获得氧气。
[0199]
具体地,气体路径电阻包括送气管电阻rin、氧合器电阻rp和排气管电阻rout。送气管电阻rin用于模拟体外膜肺氧合设备的送气管,其电阻值用于模拟送气管对通气气流的阻力,送气管电阻rin连接在第二恒流电流源is的下游;氧合器电阻rp用于模拟体外膜肺氧合设备的氧合器,其电阻值用于模拟氧合器对通气气流的阻力,氧合器电阻rp连接在送气管电阻rin的下游;排气管电阻rout用于模拟体外膜肺氧合设备的排气管,其电阻值用于模拟排气管对通气气流的阻力,排气管电阻rout连接在所述氧合器电阻rp的下游。各个电阻的阻值增大用于模拟气流阻力增大,各个电阻的阻值减小用于模拟气流阻力减小。各气体路径电阻和第二恒流电流源is的上游侧与下游侧分别形成气体氧合路径节点ng1-ng4。其中,氧合器电阻rp与排气管电阻rout之间的节点ng4为第二物质交换节点。
[0200]
正常情况下,气体流进、流出的能力是相同的,电阻rin、rout均设置为极低的值(例如为0.01-0.05mmhg
·
s/ml),基本不影响模型物质传输。当电阻rin阻力增大,可阻碍供氧气源送气,导致氧合器气体侧氧浓度降低,影响氧合。电阻rout增大,导致排气异常,使氧合器内co2分压升高、压力增大,严重时可导致氧合器损坏。
[0201]
在本发明中,与模拟血流管路故障(例如回血管堵塞)类似,通过调整(增大)各气体路径电阻的阻值可以模拟体外膜肺氧合设备的供氧故障。与流体循环模型130类似,气体氧合模型160中各个节点的电压值用于模拟所对应的气流管路的气压值。当管路中气压值增大时,供氧路径的通气能力下降,不利于低氧血快速获得氧气。
[0202]
在本发明中,对各种故障的模拟是为了使医护人员在看到异常的监护波形时能快速判断该异常是否由于设备故障所致,从而可以及时检查设备、排除故障。
[0203]
在本发明中,可选地,还可以通过调整回血管电阻rre的阻值和/或体外膜肺氧合设备的氧合器膜的有效气体交换面积参数值以模拟氧合器的故障;可以通过调整第一恒流电流源isp的电流值模拟血泵的故障(例如血泵血栓、血泵有气泡);可以通过调整第二恒流
电流源is的电流值和氧气瓶的初始氧气含量参数值模拟氧气瓶耗尽故障。
[0204]
可选地,根据本发明的ecmo治疗系统仿真模型还可以对血流速过高、血流速过低、血泵管路有气泡、氧气耗尽等情况报警。具体地,在本发明中可以通过报警模块完成对上述各项故障情况的报警。
[0205]
为更进一步模拟真实的体外膜肺氧合设备的实际情况,在本发明的又一个实施方式中,增加了体现体外膜肺氧合设备的血流管路和气流管路的顺应性的电容。如图5所示,根据本发明的ecmo治疗系统仿真模型220包括心血管模型200和根据本发明的ecmo仿真系统210。其中,ecmo仿真系统210包括流体循环模型230和气体氧合模型260。ecmo仿真系统210与ecmo仿真系统110的区别在于,在流体循环模型230中,流体循环路径模拟单元增加了流体循环路径电容co,用于模拟血流路径的顺应性,其电容容量用于模拟体外膜肺氧合设备的血流管路的弹性,该流体循环路径电容co连接至第一物质交换节点n5;相应地,在气体氧合模型260中,增加了气体氧合路径电容cp,用于模拟供氧路径的顺应性,其电容容量用于模拟体外膜肺氧合设备的气流管路的弹性,该气体氧合路径电容cp连接至第二物质交换节点ng4。
[0206]
由于模拟体外膜肺氧合设备的血流管路和气流管路采用柔性材料制作,具有一定的弹性,因此在血流和气流充盈管路的初期,管路在流体压力的作用下会有所膨胀。这导致管路的容积变大,血流和气流不能按照恒定的流量流动,从而影响氧合治疗效果。
[0207]
模型运行后,血流电路恒流源isp将静脉血运输至n1~n5节点。电容co表示血流管路的弹性特征。通血瞬间,电容co充电,存储电量增加,表现血流管路的微小弹性扩张(即电流在n5节点向电容co分流)。同时刻,气体电路恒流源is将纯氧运输至ng1~ng4节点。电容cp表征气体管路的弹性特性。通气瞬间,电容cp充电,存储电量增加,表现气流管路的微小弹性扩张(即电流在ng4节点向电容cp分流)。电路稳定后,各节点电压恒定,运输至各节点内血液、气体量恒定。正常情况下,电容co和cp的容量设置极低(例如为0.01-0.05ml/mmhg),在模型稳定运行后不影响氧合效果。
[0208]
在实际临床中,在使用va-ecmo治疗模式的情况下,回血灌注后会出现“分水岭”现象,这是由于ecmo回血血流与人体心脏正常血流方向相反,两股血流在主动脉弓交汇,于交汇处形成“分水岭”。在va-ecmo治疗模式中,心输出量包含ecmo灌注回血和人体自身左心泵血,当自身供氧不足或呼吸设备支持不足时,可导致冠状动脉、脑、右臂供氧不足,此时ecmo监测可见左臂氧饱和度高、而右臂氧饱和度偏低现象,这种差异性低氧临床上又称为“harlequin综合征”。若设置ecmo回血流速过大,则“分水岭”接近主动脉瓣,增加左心室后负荷,使主动脉瓣打开异常,有导致左心室血栓风险,甚至若分水岭越过主动脉瓣,则会导致左心室收缩反流。
[0209]
在本发明中,通过在心血管仿真模型200设置对应于真实血管结构的冠状动脉节点、脑动脉节点、右臂动脉节点、左臂动脉节点等,使得根据本发明的ecmo治疗系统仿真模型可以模拟“harlequin综合征”。
[0210]
在实际临床中,“分水岭”的确切位置很难客观检测。因此,为使医护人员熟悉不同“分水岭”情况下患者的症状表现,从而可以在真实治疗过程通过观察患者症状逆向推断分水岭位置,在本发明中,在心血管仿真模型200的主动脉弓血管通路进行了仿真人体主动脉弓解剖结构的精细构建,如图3-6心血管仿真模型200的示意图中虚线框出部分,分别体现
了冠状动脉至心肌通路(冠状动脉节点)、锁骨下动脉至右臂通路(锁骨下动脉节点)、右颈动脉至脑通路(右颈动脉节点)、左颈动脉至脑通路(左颈动脉节点)和腋动脉至左臂通路(腋动脉节点)。由于本发明采用电流模拟血流,因此在根据本发明的模型中,电流为0(或接近0)处即为“分水岭”的位置。在va-ecmo仿真治疗模式中,通过调整第一恒流电流源isp的电流值可以模拟不同的“分水岭”现象。
[0211]
模型中,主动脉弓各通路节点进行该处通路的血液物质计算。随患者氧合循环疾病差异和/或ecmo不同血流速度设置时,表现出冠状动脉、脑、右臂、左臂的不同氧饱和情况,体现不同“harlequin综合征”氧合现象(如图12所示)。根据本发明的模型还可仿真出现“harlequin综合征”时的干预治疗,如可在合理范围内增大ecmo血流流速,使ecmo血流回输进入冠状动脉、脑、右臂,改善其血液供氧;也可采用图7所示的vav-ecmo模式连接,使富氧血进入右心,随心血管循环增加左心血氧含量。
[0212]
根据本发明的ecmo仿真方法和ecmo仿真模型采用实体结构模拟与数学模型相结合的形式仿真体外膜肺氧合治疗设备,根据本发明的ecmo仿真模型应用于根据本发明的ecmo治疗系统仿真模型,为相关的研究、教学和培训工作提供了仿真性高、实用性强的医学模拟方法,有利于医护人员快速熟悉ecmo治疗设备的性能、熟练掌握其在临床治疗中的使用方法、以及有效将其运用于各类相关适应证的治疗,从而提高医疗水平。
[0213]
除非另有定义,本文中所使用的技术和科学术语与本发明的技术领域的技术人员通常理解的含义相同。本文中使用的术语只是为了描述具体的实施目的,不是旨在限制本发明。
[0214]
本发明已经通过上述实施方式进行了说明,但应当理解的是,上述实施方式只是用于举例和说明的目的,而非意在将本发明限制于所描述的实施方式范围内。本领域技术人员可以理解的是,根据本发明的教导还可以做出更多种的变型和修改,这些变型和修改均落在本发明所要求保护的范围以内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1