一种喷射原位生成的微创神经接口及其制备方法和应用
1.本发明属于医用检测元件领域,具体涉及一种喷射原位生成的微创神经接口及其制备方法和应用。
背景技术:
2.神经接口是外界人工设备与生物体的神经系统信息交互的界面,其可以用于测量神经信号,并用于检测疾病,特别地,其针对神经系统的炎症、退行性病变等具有很好的预防和提前诊断的能力。同时神经接口还可以用于对神经系统传入刺激,依照传入刺激的目的不同,常见的有控制肌肉、刺激视觉皮层、刺激听觉皮层、刺激触觉皮层、刺激温度感受器等。此外,还有一类神经接口主要用于治疗和修复。在常见的损伤如压伤和拉拔伤后通过一定频率和电流的刺激,神经将表现出更活跃的修复倾向。
3.目前现有技术中的神经接口包括传统侵入性电极和传统非侵入接口。其中,传统侵入性的电极有神经袖带,其由一个或多个位于绝缘衬底上的电极组成,衬底通过外科手术防治,电极出点围绕神经干的神经外表面。虽然这种方法可以非常直接地与目标神经结合,但多点故障和植入程序的复杂性增加了手术风险和成本,并可能导致外周神经接口效果大量的可变性。传统非侵入接口虽然没有侵入性,但是其的神经刺激与记录则因为信号噪音多,溯源性差等导致无法用于精细的神经系统功能调控。
4.采用目前现有技术中的传统侵入性电极和传统非侵入接口无法实现细小的,无法通过手术植入或手术操作过于复杂的神经接口植入,同时如果采用非侵入方式无法保证信号的稳定性和准确性。
技术实现要素:
5.为解决现有技术中的问题,提供了一种喷射原位生成的神经接口以及制备喷射原位生成的神经接口的系统,本发明提供的神经接口能够通过胶体喷射实现在体内原位生成神经接口,解决了解决传统神经界面植入过程中的损伤过大,恢复缓慢的问题;同时还能解决细小神经无法通过手术植入或者手术过于复杂的问题。
6.本发明一个方面提供一种射流原位生成的神经接口,所述神经接口包含贴皮电极、导电自连接内电极;导电自连接内电极在皮肤内由导电自连接电极分散液原位生成,且一端与神经连接,另一端在皮肤表面与贴皮电极可拆卸的连接;所述导电自连接电极分散液包含等渗分散液以及外部包含粘性层的导电颗粒;其中粘性层为在导电颗粒外部依次设置的聚多巴胺层和氧化聚合成键层,所述氧化聚合成键层选自聚乙烯二氧噻吩层、聚吡咯层。
7.在本发明的技术方案中,所述导电自连接电极分散液中外部包含粘性层的导电颗粒的浓度为0.1mg/ml-100mg/ml,优选为1mg/ml-50mg/ml,例如为2mg/ml、3mg/ml、4mg/ml、5mg/ml、6mg/ml、7mg/ml、8mg/ml、9mg/ml、10mg/ml、15mg/ml、20mg/ml、25mg/ml、30mg/ml、35mg/ml、40mg/ml、50mg/ml。
8.在本发明的技术方案中,所述的等渗分散液选自浓度为280~320mmol/l的溶液,例如生理盐水、磷酸盐缓冲盐溶液、5%葡萄糖水溶液、硼酸缓冲液。
9.在本发明的技术方案中,所述的导电颗粒选自金属纳米材料、碳纳米材料、mxene或上述任一种经过修饰的上述导电颗粒。例如所述金属纳米材料选自银纳米材料、铁纳米材料、镁纳米材料、铝纳米材料;碳纳米材料选自石墨烯、碳纳米管;所述的mxene选自ti3c2、ti2c、nb2c、v2c、mo2c。
10.在本发明的技术方案中,所述外部包含粘性层的导电颗粒的制备方法为:
11.1)利用迈克尔加成反应聚合多巴胺:将多巴胺在碱性缓冲溶液中进行预聚合,然后将预聚溶液与导电颗粒混合反应,得到具有聚合多巴胺层的导电颗粒;
12.2)进一步原位聚合获得氧化聚合成键层:将乙烯二氧噻吩原料或吡咯原料分散在水溶性有机溶剂中,并加入步骤2)具有聚合多巴胺层的导电颗粒的水溶液中,在不包含氧化剂的条件下进行,获得具有聚合多巴胺层和氧化聚合成键层的外部包含粘性层的导电颗粒。
13.在本发明的技术方案中,所述贴皮电极与导电自连接内电极可拆卸的连接。
14.在本发明的技术方案中,导电自连接内电极在皮肤内原位生成的方法为将导电自连接内电极分散液注射至皮下,导电自连接内电极分散液注射形成的液体通路,导电自连接内电极分散液中的等渗分散液被移除后外部包含粘性层的导电颗粒自连接生成导电自连接内电极。
15.在本发明的技术方案中,将导电自连接内电极分散液注射至皮下的方法为采用产生高压射流微水柱的压力装置使其中的导电自连接内电极分散液穿透人体表皮到达皮下。
16.在本发明的技术方案中,所述产生高压射流微水柱的压力装置选自射流注射器。
17.在本发明的技术方案中,所述贴皮电极选自贴片电极;优选地,所述贴片电极具有导电水凝胶或弹性体构成的粘附位点,以及导电导线。
18.本发明另一个方面提供了一种用于制备射流原位生成的神经接口的系统,所述系统包括导电自连接内电极分散液、注射装置以及贴皮电极,
19.所述导电自连接电极分散液包含等渗分散液以及外部包含粘性层的导电颗粒;其中粘性层为在导电颗粒外部依次设置的聚多巴胺层和氧化聚合成键层;所述氧化聚合成键层选自聚乙烯二氧噻吩层、聚吡咯层;所述注射装置为产生高压射流微水柱的压力装置;优选为射流注射器。
20.在本发明的技术方案中,所述导电自连接电极分散液中外部包含粘性层的导电颗粒的浓度为0.1mg/ml-100mg/ml,优选为1mg/ml-50mg/ml,例如为2mg/ml、3mg/ml、4mg/ml、5mg/ml、6mg/ml、7mg/ml、8mg/ml、9mg/ml、10mg/ml、15mg/ml、20mg/ml、25mg/ml、30mg/ml、35mg/ml、40mg/ml、50mg/ml。
21.在本发明的技术方案中,所述的等渗分散液选自浓度为280~320mmol/l的溶液,例如生理盐水、磷酸盐缓冲盐溶液、5%葡萄糖水溶液、硼酸缓冲液。
22.在本发明的技术方案中,导电颗粒选自金属纳米材料、碳纳米材料、mxene或上述任一种经过修饰的上述导电颗粒。例如所述金属纳米材料选自银纳米材料、铁纳米材料、镁纳米材料、铝纳米材料;碳纳米材料选自石墨烯、碳纳米管;所述的mxene选自ti3c2、ti2c、nb2c、v2c、mo2c。
23.在本发明的技术方案中,所述系统中还包括外部记录电信号的装置。
24.本发明再一个方面提供了一种射流原位生成的神经接口的制备方法,通过注射装置将电自连接内电极分散液注射至皮下,导电自连接内电极分散液注射形成的液体通路生成导电自连接内电极,贴附贴皮电极于植入位点;所述注射装置为产生高压射流微水柱的压力装置;优选为射流注射器。
25.本发明再一个方面提供了上述射流原位生成的神经接口的应用,所述应用为神经电信号收集、神经修复、神经疾病治疗界面、神经疾病诊断传感器、或对神经进行电刺激中的用途。
26.本发明再一个方面提供了一种导电自连接电极分散液,所述导电自连接电极分散液包含等渗分散液以及外部包含粘性层的导电颗粒;其中粘性层为在导电颗粒外部依次设置的聚多巴胺层和氧化聚合成键层;所述氧化聚合成键层选自聚乙烯二氧噻吩层、聚吡咯层。
27.在本发明的技术方案中,所述导电自连接电极分散液中外部包含粘性层的导电颗粒的浓度为0.1mg/ml-100mg/ml,优选为1mg/ml-50mg/ml,例如为2mg/ml、3mg/ml、4mg/ml、5mg/ml、6mg/ml、7mg/ml、8mg/ml、9mg/ml、10mg/ml、15mg/ml、20mg/ml、25mg/ml、30mg/ml、35mg/ml、40mg/ml、50mg/ml。
28.在本发明的技术方案中,所述的等渗分散液选自浓度为280~320mmol/l的溶液,例如生理盐水、磷酸盐缓冲盐溶液、5%葡萄糖水溶液、硼酸缓冲液。
29.在本发明的技术方案中,导电颗粒选自金属纳米材料、碳纳米材料、mxene或上述任一种经过修饰的上述导电颗粒。例如所述金属纳米材料选自银纳米材料、铁纳米材料、镁纳米材料、铝纳米材料;碳纳米材料选自石墨烯、碳纳米管;所述的mxene选自ti3c2、ti2c、nb2c、v2c、mo2c。
30.本发明再一个方面提供了上述导电自连接电极分散液在制备神经接口中的应用。
31.有益效果
32.1、本发明神经接口植入程序的复杂度低,植入过程损伤小。
33.2、材料生物相容性高,无需引入额外的交联剂,可以有效降低机体的氧化应激以及炎症反应。
34.2、本发明神经接口对运动限制小,最后形成的通路可以抵抗一定程度的组织形变,增加了接口的稳定性。
附图说明
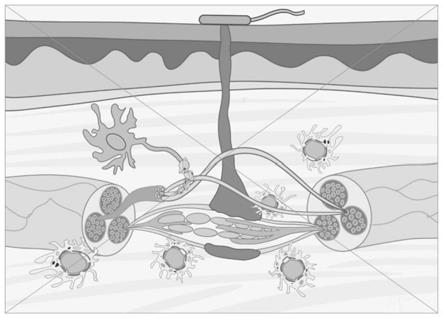
35.图1为用于导电自连接分散液射流注入的射流注入设备示意图。
36.图2为腿部安装电极小鼠模型照片。
37.图3为腿部安装电极小鼠运动过程中照片和电信号的对应结果图。
具体实施方式
38.为了使本发明的上述目的、特征和优点能够更加明显易懂,下面对本发明的具体实施方式做详细的说明,但不能理解为对本发明的可实施范围的限定。
39.本发明一些具体实施方案提供了一种射流原位生成的神经接口,所述神经接口包
含贴皮电极、导电自连接内电极,导电自连接内电极在皮肤内原位生成,且一端与神经连接,另一端在皮肤表面与贴皮电极可拆卸的连接。
40.在本发明的一些具体实施方案中,所述导电自连接电极分散液包含等渗分散液以及外部包含粘性层的导电颗粒;其中粘性层为在导电颗粒外部依次设置的聚多巴胺层和氧化聚合成键层。
41.在本发明的一些具体实施方案中,所述导电自连接电极分散液中外部包含粘性层的导电颗粒的浓度为0.1mg/ml-100mg/ml,优选为1mg/ml-50mg/ml,例如为2mg/ml、3mg/ml、4mg/ml、5mg/ml、6mg/ml、7mg/ml、8mg/ml、9mg/ml、10mg/ml、15mg/ml、20mg/ml、25mg/ml、30mg/ml、35mg/ml、40mg/ml、50mg/ml。
42.在本发明的一些具体实施方案中,所述的等渗分散液选自浓度为280~320mmol/l的溶液,例如生理盐水、磷酸盐缓冲盐溶液、5%葡萄糖水溶液、硼酸缓冲液。
43.在本发明的一些具体实施方案中,导电颗粒选自金属纳米材料、碳纳米材料、mxene或上述任一种经过修饰的上述导电颗粒。例如所述金属纳米材料选自银纳米材料、铁纳米材料、镁纳米材料、铝纳米材料;碳纳米材料选自石墨烯、碳纳米管。所述的mxene选自ti3c2、ti2c、nb2c、v2c、mo2c。
44.在本发明的一些具体实施方案中,氧化聚合成键层选自聚乙烯二氧噻吩层、聚吡咯层。
45.在本发明的一些具体实施方案中,上述外部包含粘性层的导电颗粒通过以下方法获得:
46.1)利用迈克尔加成反应聚合多巴胺:将多巴胺在碱性缓冲溶液中进行预聚合,然后将预聚溶液与导电颗粒混合反应,得到具有聚合多巴胺层的导电颗粒;
47.2)进一步原位聚合获得氧化聚合成键层层:将乙烯二氧噻吩原料或吡咯原料分散在水溶性有机溶剂中,并加入步骤2)具有聚合多巴胺层的导电颗粒的水溶液中,在不包含氧化剂的条件下进行获得具有聚合多巴胺层和氧化聚合成键层的导电颗粒。
48.在本发明的一些具体实施方案中,所述贴皮电极与导电自连接内电极可拆卸的连接。
49.在本发明的一些具体实施方案中,导电自连接内电极在皮肤内原位生成的方法为将导电自连接内电极分散液注射至皮下,导电自连接内电极分散液注射形成的液体通路,导电自连接内电极分散液中的等渗分散液被移除后外部包含粘性层的导电颗粒自连接生成导电自连接内电极。
50.在本发明的一些具体实施方案中,将导电自连接内电极分散液注射至皮下的方法为采用产生高压射流微水柱的压力装置使其中的导电自连接内电极分散液穿透人体表皮到达皮下。
51.在本发明的一些具体实施方案中,所述产生高压射流微水柱的压力装置选自射流注射器。所述射流注射器具有储存液体的发射端,一部分为推动液体喷射的压力装置,当扣动扳机,压力装置会被触发,推动储存液体的发射端向前喷射,产生射流注入效果,将自连接内电极分散液射流植入体内。
52.在本发明的一些具体实施方案中,所述贴皮电极选自贴片电极;优选地,所述贴片电极具有导电水凝胶或弹性体构成的粘附位点,以及导电导线。
53.在本发明的一个优选的具体实施方案中,所述包含粘性层的导电颗粒为表面改性的mxene纳米片,所述mxene纳米片中具有na离子和磺酸插层,同时表面还具有聚多巴胺层和聚乙烯二氧噻吩层。聚多巴胺层和聚乙烯二氧噻吩层依次设置。聚乙烯二氧噻吩层占表面改性的mxene纳米片总质量的0.05%-0.8%,优选为0.3%-0.7%,更优选为0.5%。
54.在本发明的一个优选的具体实施方案中,上述表面改性的mxene纳米片通过以下方法获得:
55.a)na离子和磺酸的插层改性:将二维mxene纳米片分散在含有钠离子的碱性溶液中,混合获得na离子插层的二维mxene纳米片;将na离子插层的二维mxene纳米片与磺胺酸重氮盐反应,得到na离子和磺酸的插层改性的mxene纳米片;
56.b)利用迈克尔加成反应聚合多巴胺:将多巴胺在碱性缓冲溶液中进行预聚合,然后将预聚溶液与na离子和磺酸的插层改性的mxene纳米片混合反应,得到具有聚合多巴胺层且na离子和磺酸的插层改性的mxene纳米片;
57.c)进一步原位聚合获得非氧化性聚乙烯二氧噻吩层:将乙烯二氧噻吩原料分散在水溶性有机溶剂中,并加入步骤2)所得mxene纳米片的水溶液中,在不包含氧化剂的条件下进行获得具有聚合多巴胺层和非氧化性聚乙烯二氧噻吩层,且na离子和磺酸的插层改性的mxene纳米片。
58.在本发明的一个优选的具体实施方案中,其中步骤a)中所述二维mxene纳米基片选自ti3c2、ti2c、nb2c、v2c或mo2c中的其中一种或多种的组合;所述二维mxene纳米基片通过将max相陶瓷通过hf酸进行选择性刻蚀获得;所述max相陶瓷选自ti3alc2、ti2alc、nb2alc、v2alc、mo2alc中的其中一种或多种的组合;含有钠离子的碱性溶液选自naoh溶液、na2co3溶液、nahco3溶液、koh溶液、k2co3溶液、khco3溶液;钠离子插层后采用水冲洗至中性,例如冲洗至ph值为7-8;磺胺酸重氮盐通过将磺胺酸、盐酸与亚硝酸钠反应获得,优选地,上述反应在-5~10℃条件下反应;磺胺酸重氮盐与钠离子插层mxene纳米片在0-5℃下反应2-10小时,离心去除分离大的聚集体和未反应的颗粒。
59.在本发明的一个优选的具体实施方案中,其中步骤b)中碱性缓冲溶液的ph值选自8.5-9;多巴胺与na离子和磺酸的插层改性的mxene纳米片的质量比为1:6-20,优选为1:8-12。
60.在本发明的一个优选的具体实施方案中,其中步骤c)中乙烯二氧噻吩原料选自3,4-乙烯二氧噻吩;乙烯二氧噻吩原料与具有聚合多巴胺层且na离子和磺酸的插层改性的mxene纳米片的质量比为0.001-0.01:1,优选为0.003-0.008:1,更优选为0.005:1。优选地,步骤c)反应中不添加氧化剂。
61.本发明另一个方面提供了一种用于制备射流原位生成的神经接口的系统,所述系统包括导电自连接内电极分散液、注射装置以及贴皮电极,所述导电自连接电极分散液包含等渗分散液以及外部包含粘性层的导电颗粒;其中粘性层为在导电颗粒外部依次设置的聚多巴胺层和氧化聚合成键层。
62.在本发明的一些具体实施方案中,所述导电自连接电极分散液中外部包含粘性层的导电颗粒的浓度为0.1mg/ml-100mg/ml,优选为1mg/ml-50mg/ml,例如为2mg/ml、3mg/ml、4mg/ml、5mg/ml、6mg/ml、7mg/ml、8mg/ml、9mg/ml、10mg/ml、15mg/ml、20mg/ml、25mg/ml、30mg/ml、35mg/ml、40mg/ml、50mg/ml。
63.在本发明的一些具体实施方案中,所述的等渗分散液选自浓度为280~320mmol/l的溶液,例如生理盐水、磷酸盐缓冲盐溶液、5%葡萄糖水溶液、硼酸缓冲液。
64.在本发明的一些具体实施方案中,所述系统中还包括外部记录电信号的装置。
65.本发明一些具体实施方案提供了一种喷射原位生成的神经接口的制备方法,通过注射装置将电自连接内电极分散液注射至皮下,导电自连接内电极分散液注射形成的液体通路生成导电自连接内电极,贴附贴皮电极于植入位点。其中,当导电自连接内电极分散液被注射到受试者皮下后,形成了液体通路,连通皮肤外侧和神经,随着其中的等渗分散液不断被组织转移,留下的导电自连接颗粒将进一步氧化形成稳定的连接通路。
66.本发明一些具体实施方案提供了上述喷射原位生成的神经接口的应用,所述神经接口用于记录和传输神经电信号、神经电信号收集、神经修复、神经疾病治疗界面、神经疾病诊断传感器、或对神经进行电刺激。
67.在本发明中,所述神经接口可以应用于人体或动物体。
68.实施例1制备导电自连接颗粒
69.1)将3g ti3alc2粉末缓慢浸入装有40ml hf水溶液的聚四氟乙烯烧杯中,并在室温下蚀刻48小时。然后将所得悬浮液转移到离心管中并离心。湿沉淀物用去离子水洗涤并离心数次。得到二维mxene材料ti3c2。倾析上一步液体后,向离心管中滴加少量稀naoh溶液,将溶液转移至烧杯中,搅拌2小时。将产物离心并用大量去离子水洗涤数次,直至顶部液体的ph值为7-8,得到mxene-n(na
+
插层的mxene材料)。将3g磺胺酸悬浮在30ml水中,冷却至0-5℃。将9ml hcl和30ml水的溶液预冷至0-5℃,并在冰浴条件下搅拌下缓慢加入悬浮液中。15分钟后,将2.4g亚硝酸钠(18ml)的冷溶液滴加到悬浮液中,搅拌30分钟,得到重氮盐溶液。将上述合成的重氮盐溶液在冰浴中边搅拌边滴加到mxene-n的水分散液中,混合物在0-5℃保持约4小时。反应结束后,将混合物离心并洗涤数次,然后以4000rpm离心1小时以分离大的聚集体和未反应的颗粒。然后,将上清液冻干成mxene-ns粉末(na离子和磺酸的插层改性的mxene纳米片)。
70.2)将获得的mxene-ns粉末以2.5mg/ml的浓度用60ml去离子水分散,并向溶液中滴加15ml tris-hcl溶液(ph 8.5)。同时,将15mg多巴胺(da)加入15ml tris-hcl溶液(ph8.5)搅拌15分钟进行预聚合。然后将da预聚合溶液滴加到mxene-ns溶液中并搅拌4小时,得到mxene-nsd纳米片(具有聚合多巴胺层且na离子和磺酸的插层改性的mxene纳米片)。mxene-nsd纳米片经过离心和洗涤数次。
71.3)用60ml去离子水将32g mxene-nsd纳米片重新分散,将160mg 3,4-乙烯二氧噻吩(edot)溶于10ml乙醇中;然后将edot溶液滴加到mxene-nsd溶液中并在室温下搅拌24小时。之后,将溶液离心,洗涤数次后冻干,获得mxene-nsd-pedot纳米片(具有聚合多巴胺层和非氧化性聚乙烯二氧噻吩层,且na离子和磺酸的插层改性的mxene纳米片),即导电自连接分散液。
72.实施例2配制导电自连接分散液
73.将实施例1导电自连接颗粒以5mg/ml的浓度分散在等渗液体分散体系生理盐水中分散均匀。
74.实施例3配置喷射注射通路和贴皮电极
75.将实施例2制备得到的分散液装入射流注射器上。确定目标植入区域,然后将装载
有导电自连接颗粒的分散液的射流注射器对准相应区域。扣动扳机后,导电自连接颗粒分散液将被植入对应区域,随着等渗分散液不断被组织转移,留下的导电自连接颗粒将进一步氧化形成稳定的连接通路。
76.将贴皮电极贴附于植入位点,使导电通路连通,将连接通路接收到的神经电信号传输出去。
77.配置喷射注射通路和贴皮电极的小鼠模型见图2,可以观察到小鼠腿部外侧安装一对贴皮电极,小鼠在被放置在小动物跑步机,并运动状态下的收集神经信号和对应的运动状态。神经信号的采集如图3。通过图3可以看出,小鼠在运动状态下不同阶段的神经信号的区别。
78.实施例4制备导电自连接颗粒nfe-nsd-pedot
79.采用实施例1的方法制备导电自连接颗粒,区别仅在于将mxene-ns粉末替换为纳米铁粉制备得到nfe-nsd-pedot导电自连接纳米颗粒。
80.实施例5制备导电自连接颗粒nc-nsd-pedot
81.采用实施例1的方法制备导电自连接颗粒,区别仅在于将mxene-ns粉末替换为碳纳米管制备得到nc-nsd-pedot导电自连接纳米颗粒。
82.实施例6制备导电自连接颗粒gr-nsd-ppy
83.采用实施例1的方法制备导电自连接颗粒,区别仅在于将mxene-ns粉末替换为石墨烯,将3,4-乙烯二氧噻吩替换为吡咯,制备得到gr-nsd-ppy导电自连接纳米颗粒。
84.实施例7导电自连接颗粒的自连接测试
85.将实施例4-6导电自连接颗粒分散在水中,然后干燥。通过扫描电镜下,观察在室温自然状态下干燥时的表面形貌。扫描电镜图显示上述导电自连接颗粒具有自连接性能。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1