一种用于运载mRNA的核酸药物递送载体及其制备方法和应用
一种用于运载mrna的核酸药物递送载体及其制备方法和应用
技术领域
1.本发明涉及一种核酸递送载体及其制备方法和应用,特别涉及一种用于运载mrna的核酸药物递送载体及其制备方法和应用。本发明属于生物医药技术领域。
背景技术:
2.以核酸为基础的疫苗,包括病毒载体、质粒dna(pdna)和mrna,引起了越来越多的关注,因为它们能够诱导广泛的保护性免疫反应,而且可以通过快速和灵活的制造过程产生。由于核酸疫苗的生产过程是独立于编码抗原的,基于相同核酸平台的不同疫苗可以利用相同的生产和纯化方法以及生产设施,只需要在验证方法上进行调整,从而降低了疫苗生产的成本和时间。接种疫苗后,核酸疫苗模拟病毒感染,在原位表达疫苗抗原,引起体液和细胞毒性t细胞反应。这种优势对于消除细胞内的病原体或感染是至关重要的,在这些病原体或感染中,需要强有力的体液和细胞免疫反应才能达到保护作用。此外,核酸疫苗具有固有的佐剂特性,因为它们可以被特定的模式识别受体(prrs)识别,并激发先天免疫反应,这对树突状细胞(dc)的成熟至关重要,从而增强后续适应性免疫反应的诱导。然而,pdna导入靶细胞细胞核的效率较低,病毒载体可诱导机体对病毒结构蛋白的特异性免疫反应,因此人们对mrna疫苗的兴趣和研究活动越来越多。
3.在过去的二十多年中,基于mrna开发出针对传染病的预防性疫苗的技术不断发展。rna生物学,化学,稳定性和递送系统的技术进步加速了全合成mrna疫苗的开发。在动物模型中观察到的有效,持久和安全的免疫反应,以及来自早期临床试验的数据,使得基于mrna的疫苗接种成为常规疫苗方法之外具有吸引力的替代方法。另外,mrna疫苗具有简化疫苗发现和开发,促进对新兴传染病快速反应的潜力,加上mrna制备合成相对简便,成本较低,mrna疫苗的前景非常广阔。
4.mrna疫苗需要一种输送系统才能发挥其全部潜能,因为裸露的rna不仅易于被核酸酶降解,而且分子量大、带负电荷,无法被动穿过细胞膜。据推测,裸露的mrna的细胞摄取率在万分之一左右。因此,mrna的传递领域集中于发现和开发可将rna转运到细胞中的方法和材料。2018年,fda(美国食品药品监督管理局)批准了第一例sirna药物(patisiran),它是hattr(遗传性运甲状腺素蛋白淀粉样变性)的候选疗法,使用由dlin
‑
mc3
‑
dma、dspc、peg
‑
dmg和胆固醇组成的脂质体进行递送。得益于在sirna递送领域已经取得的进步与成果,目前有几种主要的运载工具正在研究中,一些将mrna分子封装成颗粒,另一些使用带正电荷的聚合物通过电荷相互作用与rna结合,还有研究试图创造出类似于病毒的颗粒,这种颗粒能够保护mrna不受内切及外切酶的干扰,有效地将mrna传递到细胞中,并获得足够水平的编码蛋白。在所有情况下,载体都必须穿过靶细胞膜,并且在摄取细胞后(通常是通过内吞作用),它必须逃脱内涵体并将其mrna释放到发生翻译的胞质中。
5.目前,在rna疫苗的临床及临床前研究中多使用阳离子脂质体递送,阳离子脂质体依靠其与mrna的正负电荷间的静电相互作用结合并包载mrna。许多实验室已成功的将阳离子脂质体转染mrna对抗各种病原体如狂犬病毒、寨卡病毒、流感病毒等的研究中。但是,阳
离子脂质体的毒性较强,且易于在生理条件下带负电的血清蛋白结合,产生免疫原性、肝脏毒性并使sirna易在靶器官外释放。这些缺陷限制了阳离子脂质体在包载mrna成药的进一步应用。
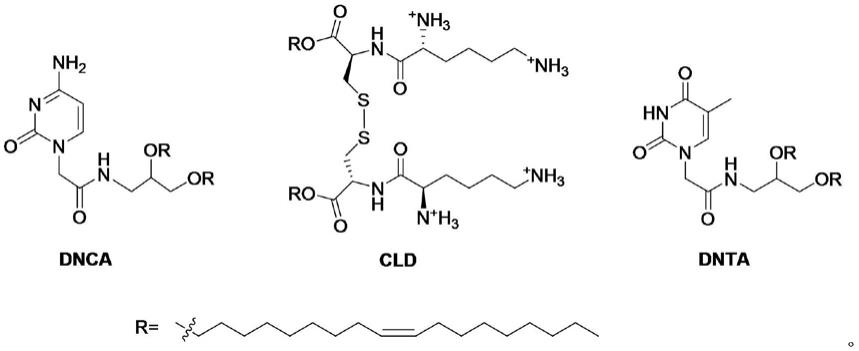
6.本发明人前期设计合成了碱基乙酰胺甘油醚分子dnca(cn108059619a),因其具有碱基性质的头部,可以通过氢键作用和π
‑
π堆积作用结合并包载单链核酸药物和质粒(cn1084478807a)。结合dnca及发明人前期设计合成的以赖氨酸作为头部的阳离子脂材cld共同包载3’,3”双肽缀sirna已在细胞水平成功应用(mol pharm,2019,16,4920)。在此,我们对包载方法进行优化,重新制定并探索了最优的dnca/cld转染处方,以优化混合制剂体内应用的性质,成功构建了以中性脂材为主体,辅之以阳离子脂材的mrna药物包载递送系统。在体内递送mrna时,还可选用dnta等摩尔量替代dnca,以获得更佳的转染效率。
技术实现要素:
7.为了提高rna疫苗入胞效率及胞内释放的有效性,本发明提供了一种高效低毒的核酸药物载体递送策略。本发明利用中性脂材和阳离子脂材混合包载mrna疫苗,以实现更有效且安全无毒的体内mrna递送,从而提高mrna的成药性。
8.为了达到上述目的,本发明采用的技术方案如下:
9.本发明的一种用于运载mrna的核酸药物递送载体,其特征在于,所述的载体中包括中性碱基脂质体及阳离子脂质体,其中,所述的中性碱基脂质体为dnca或dnta,所述的阳离子脂质体为cld,所述dnca、dnta以及cld结构式如下所示:
[0010][0011]
其中,优选的,所述的中性碱基脂质体与阳离子脂质体的质量比为1
‑
5:1
‑
5。
[0012]
其中,优选的,所述的载体中还包括dspe
‑
peg。
[0013]
进一步的,本发明还提供了一种制备所述的核酸药物递送载体的方法,包括将所述的中性碱基脂质体及阳离子脂质体用乙醇溶解混匀,之后冻干,使用时再用适量乙醇复溶。
[0014]
其中,优选的,所述的方法中还包括在溶解有中性碱基脂质体及阳离子脂质体的乙醇溶液中加入dspe
‑
peg,涡旋混匀的步骤。
[0015]
其中,优选的,dspe
‑
peg用量为dnca和cld总摩尔量的5%。
[0016]
更进一步的,本发明还提出了所述的核酸药物递送载体在制备mrna运载试剂中的应用。
[0017]
其中,优选的,所述的mrna为mrna疫苗或用于治疗流感及后期可能的其他病症的mrna。
[0018]
其中,优选的,将mrna用无rna酶水或生理盐水溶解,然后与所述的核酸药物递送载体,在室温超声条件下形成脂质复合物。
[0019]
其中,优选的,所述的核酸药物递送载体与mrna质量比为2
‑
6:1,优选5:1。
[0020]
相较于现有技术,本发明的优点在于:
[0021]
1.使用本发明的核酸药物递送载体运载流感病毒mrna疫苗可在细胞中表达出大量的ha蛋白,成功激活小鼠体内体液细胞免疫,诱导中和抗体产生,降低流感病毒感染的小鼠死亡率,而且该mrna疫苗在细胞水平和动物水平应用的安全性好,无明显毒性,为mrna疫苗在临床的广泛应用奠定了基础;
[0022]
2.中性核苷脂材具有碱基头部,可以与mrna通过氢键作用和π
‑
π堆积作用结合,并且与阳离子脂材和mrna间的电荷作用相比,在体内应用时更为稳定,在循环过程中不易吸附带电的颗粒或蛋白,避免了脂质复合物在靶器官外的解体与mrna的释放。并且基于非电性作用的结合减少了阳离子脂材在制剂处方中的用量,阳离子脂材与mrna的质量比仅为2
‑
6:1,远低于其余报道中的阳离子脂材用量。
附图说明
[0023]
图1为不同质量的dnca/cld脂质体包封ha mrna琼脂糖凝胶组织结果;
[0024]
其中:1.maker 2000;2.dnca/cld;3.ha mrna;4.dnca/cld:ha mrna=2:1;5.dnca/cld:ha mrna=3:1;6.dnca/cld:ha mrna=4:1;7.dnca/cld:ha mrna=5:1;8.dnca/cld:ha mrna=6:1;
[0025]
图2为透射电子显微镜下dnca/cld/ha mrna复合物形态;
[0026]
图3为dnca/cld/ha mrna复合物粒径和电位;
[0027]
图4为倒置荧光显微镜观察dnca/cld脂质体递送的egfp mrna在hek
‑
293t细胞中绿色蛋白的表达情况;
[0028]
图5为微孔板式化学发光仪检测dnca/cld脂质体递送fluc mrna在hek
‑
293t细胞中firefly luciferase的表达情况;
[0029]
图6为动物活体成像系统检测dnca/cld脂质体递送的luciferase mrna在balb/c小鼠体内蛋白表达后生物发光信号;
[0030]
图7为western blot验证dnca/cld脂质体递送的流感病毒mrna疫苗在hek
‑
293t细胞中ha蛋白表达;
[0031]
注:m:marker;1:1μg ha mrna;2:2μg ha mrna;3:3μg ha mrna;4:control;
[0032]
图8为流感病毒mrna疫苗第3次免疫balb/c小鼠后体内中和抗体水平;
[0033]
图9为流感病毒mrna疫苗(80μg)免疫后的流感病毒感染balb/c小鼠在14天内生存率;
[0034]
图10为动物活体成像系统检测dnca/cld、dnca/cld/peg、dnta/cld/peg脂质体递送的luciferase mrna在balb/c小鼠体内蛋白表达后生物发光信号;
[0035]
图11为peg掺入对dnca/cld/mrna脂质复合物粒径的影响;
[0036]
图12为peg掺入对dnca/cld/mrna脂质复合物电位的影响;
[0037]
图13为动物活体成像系统检测dnca/cld对递送luciferase mrna在balb/c小鼠体内蛋白表达后生物发光信号最佳比例筛选。
具体实施方式
[0038]
下面结合具体实施例来进一步描述本发明,本发明的优点和特点将会随具体实施例的描述而更为清楚。但实施例仅是范例性的,并不对本发明的范围构成任何限制。本领域技术人员应该理解的是,在不偏离本发明的精神和范围下可以对本发明技术方案的细节和形式进行修改或替换,但这些修改和替换均落入本发明的保护范围内。
[0039]
实施例1
[0040]
本实施例主要说明dnca/cld脂质体与ha mrna最佳结合比例以及复合物的形状粒径电位。
[0041]
1.dnca/cld/ha mrna制备
[0042]
ha mrna溶于无rnase酶水,然后将溶于纯乙醇的dnca/cld脂质体(1μldnca/cld=1.76μg dnca+1.58μg cld,dnca以及cld用乙醇溶解混匀,之后冻干,使用时再用适量乙醇复溶)加入ha mrna溶液中,再加入适量的无rnase水,室温超声10min,即得dnca/cld/ha mrna复合物。
[0043]
2.dnca/cld与ha mrna最佳比例确定
[0044]
通过上述方法将dnca/cld与ha mrna以不同的质量比结合(2:1;3:1;4:1;5:1;6:1),然后把复合物(1μg ha mrna)加入到1%琼脂糖凝胶中,设置电压100v,时间30min,最后使用凝胶成像仪观察dnca/cld包裹ha mrna情况。
[0045]
3.dnca/cld/ha mrna形态粒径电位确定
[0046]
透射电子显微镜(tem)下观察dnca/cld/ha mrna复合物(5:1)的形态,粒度仪测定复合物的粒径和电位。
[0047]
结果如图1
‑
3所示,dnca/cld与ha mrna最佳结合为5:1,形成的复合物为球形纳米颗粒,粒径为292.7
±
7.98nm,电位为23.9
±
0.6mv。
[0048]
实施例2
[0049]
本实施例主要说明dnca/cld脂质体递送的egfp mrna可在细胞中表达出大量的绿色荧光蛋白。
[0050]
材料与方法:
[0051]
1.hek
‑
293t细胞、egfp mrna、dnca/cld脂质体(同实施例1)、hek
‑
293t细胞培养液为含10%胎牛血清的dmem(gibco)培养液。
[0052]
2.倒置荧光显微镜观察dnca/cld脂质体递送的egfp mrna在hek
‑
293t细胞中蛋白的表达。dnca/cld/egfp mrna制备同实施例1。hek
‑
293t细胞在含10%胎牛血清的dmem(gibco)培养基中,于37℃、5%co2培养箱中培养。观察细胞生长状态良好,培养至对数生长期后,将细胞接种至12孔板中,5
×
105个/孔,37℃、5%co2培养箱培养,待细胞融合度达到80%可进行转染。实验分细胞对照组、egfp mrna组、dnca/cld/egfp mrna(5:1)组。将12孔板取出,弃去培养基,每孔各加入1ml opti
‑
mem,然后再加入1μg egfp mrna,于37℃、5%co2培养箱中培养,4h之后换液,换成含10%胎牛血清的dmem培养基,于37℃、5%co2培养箱中培养。待24h或48h后倒置显微镜下观察蛋白表达。
[0053]
结果:
[0054]
egfp mrna组24h和48h均基本无绿色荧光蛋白表达,dnca/cld/egfp mrna组,24h和48h均有大量的绿色荧光蛋白表达(图4)。
[0055]
综上所述,dnca/cld脂质体递送的egfp mrna可在细胞中表达出大量的绿色荧光蛋白。
[0056]
实施例3
[0057]
本实施例主要说明dnca/cld脂质体递送的fluc(firefly luciferase)mrna可在细胞中表达出大量的firefly luciferase蛋白。
[0058]
材料与方法
[0059]
1.hek
‑
293t细胞、fluc mrna、dnca/cld脂质体(同实施例1)、hek
‑
293t细胞培养液为含10%胎牛血清的dmem(gibco)培养液。
[0060]
2.promega双荧光素酶报告试剂盒检测dnca/cld脂质体递送的fluc mrna在hek
‑
293t细胞中蛋白的表达。dnca/cld/fluc mrna制备同实施例1。hek
‑
293t细胞在含10%胎牛血清的dmem(gibco)培养基中,于37℃、5%co2培养箱中培养。观察细胞生长状态良好,培养至对数生长期后,将细胞接种至24孔板中,1
×
105个/孔,37℃、5%co2培养箱培养,待细胞融合度达到80%可进行转染。实验分细胞对照组、fluc mrna组、dnca/cld/fluc mrna(2:1、3:1、4:1、5:1、6:1等比例)组。将24孔板取出,加入150ng fluc mrna,于37℃、5%co2培养箱中培养,6h之后弃去培养基,按双荧光素酶试剂盒说明书方法裂解细胞,将裂解液转移至96孔白板中,使用微孔板式化学发光仪检测,每孔加入50μl裂解液和20μl荧光素酶底物。
[0061]
结果:
[0062]
fluc mrna组(m7)基本无firefly荧光素酶表达,其余各dnca/cld/fluc mrna组6h均有firefly荧光素酶表达,其中m14组dnca/cld与mrna质量比为5:1(图5)。
[0063]
综上所述,dnca/cld脂质体递送的fluc mrna可在细胞中表达出大量的firefly荧光素酶。
[0064]
实施例4
[0065]
本实施例主要说明dnca/cld脂质体递送的mrna可在balb/c小鼠体内表达出蛋白。
[0066]
材料与方法:
[0067]
1.雌性balb/c小鼠,spf级,12
‑
14g,北京维通利华实验动物技术有限公司提供;luciferase mrna斯维生物技术有限公司提供。
[0068]
试剂配制:
[0069]
dnca/cld/luciferase mrna复合物(每只10μg luciferase mrna配制):luciferase mrna浓度为1μg/μl,取40μl luciferase mrna加入500μl生理盐水,再加入浓度为60μg/μl的dnca/cld脂质体(同实施例1)3.4μl,最后加入256.6μl生理盐水,超声10min。
[0070]
2.实验分组:空白组、dnca/cld/luciferase mrna组。采用肌肉注射的方式注入200μl mrna,空白组注射相应剂量的生理盐水。在24h和48h后腹腔注射30mg/ml d
‑
luciferin(perkin eimer),于5min后使用气体麻醉3min,最后通过小动物活体成像系统检测小鼠体内生物发光信号。
[0071]
结果:
[0072]
通过小动物活体成像系统发现,注射dnca/cld/luciferase mrna组小鼠体内在24h和48h均检测到生物发光信号(图6)。表明,dnca/cld脂质体递送的mrna可在balb/c小鼠体内表达出蛋白。
[0073]
实验例5
[0074]
本实施例主要说明dnca/cld脂质体在递送流感病毒mrna疫苗上的应用。
[0075]
材料与方法:
[0076]
1.雌性balb/c小鼠,spf级,12
‑
14g,北京维通利华实验动物技术有限公司提供;h1n1型fm1株流感病毒和流感病毒mrna疫苗由北京军事医学研究院二所六室提供。
[0077]
试剂配制:
[0078]
戊巴比妥钠溶液:称量60mg戊巴比妥钠,用生理盐水配制6ml、浓度为10mg/ml的戊巴比妥钠溶液。
[0079]
dnca/cld/ha mrna复合物(每只80μg ha mrna配制,制备同实施例1):ha mrna浓度为4μg/μl,取120μl ha mrna加入750生理盐水,再加入浓度为60μg/μl的dnca/cld脂质体40μl,最后加入290μl生理盐水,超声10min。
[0080]
2.western blot方法确定dnca/cld递送的流感病毒mrna疫苗在细胞中表达抗原蛋白。(1)hek
‑
293t细胞在含10%胎牛血清的dmem(gibco)培养基中,于37℃、5%co2培养箱中培养。观察细胞生长状态良好,培养至对数生长期后,将细胞接种至6孔板中,1
×
106个/孔,37℃、5%co2培养箱培养,待细胞融合度达到80%可进行转染。实验分细胞对照组、dnca/cld/ha mrna组(ha mrna含量为1、2、3μg)。将12孔板取出,弃去培养基,每孔各加入2ml opti
‑
mem,再加入1、2、3μg ha mrna,37℃、5%co2培养箱培养,4h后换液,换成2ml含10%胎牛血清的dmem(gibco)培养基,37℃、5%co2培养箱培养24h。(2)提取各孔细胞总蛋白,进行western blot。
①
进行10%sds
‑
聚丙烯酰胺凝胶电泳(80v电泳30min,然后120v电泳60min);电泳结束后,取凝胶,依据蛋白marker位置,留所需部位的凝胶;根据凝胶剪取相应大小pvdf膜和滤纸,pvdf膜甲醇中活化1min,接着同滤纸在转膜液中放10min。从下往上分别为滤纸、pvdf膜、凝胶和滤纸,依次放在转膜仪上。根据滤纸大小设置电流,时间1.5
‑
2h;转移完毕后将膜放入50ml 5%脱脂奶粉中摇育,40r/min,孵育40min,封闭过夜;封闭完成后将膜移至ha一抗(义翘神州,1:1000)中,40r/min,室温摇育2h;用1
×
封闭液分别以5min、5min和20min,80r/min洗膜3次;将洗好的膜移至二抗(proteintech,1:2000)中,室温摇育1h;用1
×
封闭液分别以5min、5min和20min,80r/min洗膜3次;pvdf膜放入成像仪中,显影;
②
内参定量,将pvdf膜用1
×
封闭液,80r/min洗15min;将洗好的膜再放入膜再生液30min,膜再生后用1
×
封闭液,80r/min洗膜15min;将膜移至βaction一抗(proteintech,1:50000)中孵育过夜;用1
×
封闭液分别以5min、5min和20min,80r/min洗膜3次;将洗好的膜移至二抗(proteintech,1:2000)中,室温摇育1h;用1
×
封闭液分别以5min、5min和20min,80r/min洗膜3次;pvdf膜放入成像仪中,显影。
[0081]
3.流感病毒动物模型验证流感病毒mrna疫苗的免疫保护效力。balb/c小鼠随机分为3组,每组5只,包括空白组、模型组、dnca/cld/ha mrna组。采用肌肉注射的方式每只注射200μl mrna疫苗,空白组和模型组注射相应剂量的生理盐水。免疫3次,2周/次。3次免疫后第10天尾静脉取血,分离血清,通过血凝抑制实验检测中和抗体。第14天使用致死剂量的h1n1型fm1株流感病毒滴鼻攻毒,具体方法如下:称取小鼠重量,以0.15ml/20g戊巴比妥钠
麻醉,20μl/只剂量的流感病毒滴鼻攻毒,在攻毒后14天内对小鼠进行称重与观察,记录死亡情况。
[0082]
结果:
[0083]
western blot实验证明dnca/cld脂质体递送的流感病毒mrna疫苗能在细胞内表达ha蛋白(图7)。血清抑制实验证明免疫小鼠后可在小鼠体内产生中和抗体(图8),采用致死剂量流感病毒进行攻毒实验,结果显示未免疫组小鼠攻毒后14天小鼠存活率为20%,而免疫组小鼠存活率为100%(图9),提示dnca/cld脂质体递送的流感病毒mrna疫苗可对小鼠产生预防保护作用。
[0084]
实施例6
[0085]
本实施例主要说明dnca/cld/peg或dnta/cld/peg脂质体递送的mrna可在balb/c小鼠体内表达出蛋白。
[0086]
材料与方法:
[0087]
1.雄性balb/c小鼠,spf级,25g左右,北京维通利华实验动物技术有限公司提供;luciferase mrna珠海丽凡达生物技术有限公司提供。
[0088]
试剂配制:
[0089]
dnca/cld/luciferase mrna复合物(每只3μg luciferase mrna配制):luciferase mrna浓度为1.5μg/μl,取2μl luciferase mrna加入30μl genopti,再加入浓度为8.26μg/μl的dnca/cld脂质体(同实施例1)2μl,涡旋混匀,最后加入66μl genopti,室温超声10~15min。
[0090]
dnca/cld/peg/luciferase mrna或dnta/cld/peg/luciferase mrna复合物(每只3μg luciferase mrna配制):luciferase mrna浓度为1.5μg/μl,取2μlluciferase mrna加入30μl genopti,再加入浓度为8.26μg/μl的dnca/cld脂质体(同实施例1)2μl,涡旋混匀,再加入浓度为1.5μg/μl的dspe
‑
peg 2μl,涡旋混匀,最后加入64μl genopti,室温超声10~15min。
[0091]
2.实验分组:空白组、dnca/cld/luciferase mrna组、dnca/cld/peg/luciferase mrna组。采用肌肉注射的方式注入100μldnca/cld/luciferase mrna或dnca/cld/peg/luciferase mrna,空白组注射相应剂量的pbs。在6h后肌肉注射100μl luciferase assay reagent ii(promega),使用异氟烷气体麻醉3min,最后通过小动物活体成像系统检测小鼠体内生物发光信号。
[0092]
结果:
[0093]
通过小动物活体成像系统发现,注射dnca/cld/peg/luciferase mrna组小鼠体内在6h可检测到明显生物发光信号(图10),dnca/cld/luciferase mrna组生物发光信号极弱。表明,dnca/cld/peg脂质体递送的mrna可在balb/c小鼠体内表达出蛋白,且peg在制剂成分中具有重要作用,包括使制剂粒径降低,及掩蔽脂质体表面负值过高的电位(图11、图12)。调整dnca(dnta):cld比值,包括1:5,3.5:3和5:1(dnca或dnta和cld总质量不变),比值为5:1效果最佳。(图13)
[0094]
本文显示并详细描述的信息足以实现本发明的上述目的,因此本发明的优选实施方案代表本发明的主题,该主题为本发明所广泛涵盖。本发明的范围完全涵盖其它对本领域技术人员来说显而易见的实施方案,因此,本发明的范围不被除所附权利要求之外的任
何内容所限制,其中除了明确说明外,所用元素的单数形式并不是指“一个和唯一”,而是指“一个或更多”。对本领域一般技术人员来说,所有公知的上述优选的实施方案和附加实施方案部分的结构、组成和功能上的等价物因此引入本文作参考,而且试图被本发明的权利要求所涵盖。
[0095]
此外,不需要某种设备或方法来表达本发明所解决的每个问题,因为它们都已包括在本发明的权利要求之内。另外,无论本发明公开事实中的所有部分、成分,或者方法步骤是否在权利要求中被明确叙述,它们都没有贡献给公众。但是,对本领域普通技术人员来说,很明显在不背离如所附权利要求中所阐明的本发明的实质和范围的前提下,可以在形式、试剂和合成细节上做出各种改变和修饰。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1