一种胶质瘤治疗性小胶质细胞亚群及其诱导方法
1.本发明属于医学领域,涉及小胶质细胞亚群,具体涉及一种胶质瘤治疗性小胶质细胞亚群,即具有p2ry12
high ccl12
low
特征的小胶质细胞亚群,并涉及该细胞亚群的诱导方法,以及一种诱导治疗性小胶质细胞亚群的动物模型的构建方法。
背景技术:
2.胶质母细胞瘤(glioblastoma,gbm)是恶性程度最高的脑原发性肿瘤,患者平均生存约12个月,5年生存率9.8%。当前,最有效的治疗仍是手术及术后替莫唑胺(temozolomide,tmz)同步放化疗并联合替莫唑胺辅助化疗,但治疗后肿瘤快速复发,患者平均生存仅延长约2-3个月
1.。延长胶质瘤患者生存已成为当前迫切的临床需要。尽管众多药效包括免疫疗法在一些临床前研究中取得良好的治疗效果,但在临床试验中均告失败
[2,3]
。这强烈提示当前的临床前药效评价胶质瘤动物模型与临床不匹配,不能准确的反映gbm的病理生理过程及治疗反应。显然,使用可靠、贴近临床gbm的病理特征及治疗反应特征的动物模型,才能最大限度提高临床前研究成果的转化效率。
[0003]
肿瘤的发生发展及治疗反应与其微环境密切相关。胶质瘤微环境独特:具有血脑屏障、脑组织致密和脑细胞组成特殊。正常脑内缺乏血源性或骨髓源性免疫细胞,因而被当作“免疫豁免器官”。小胶质细胞(microglia,简称小胶)是脑内固有免疫细胞,在胚胎早期即定居于脑内,主要行使吞噬、免疫监视功能
[4]
。病理状态下包括肿瘤,各种外周免疫细胞可以进入脑组织,与小胶共同调控免疫反应。小胶受各种病理因素刺激,活化或极化反应强烈,形态、功能多变,在不同的疾病或不同病理过程中具有促炎或抗炎(杀伤或保护)的双刃作用
[5]
。以往认为成年脑内病理状态下小胶主要由血源性单核细胞转化而来;但最新谱系追踪结合单细胞测序(scrna-seq)更正了这一观点,确定小胶源于自我更新,与血源性单核细胞转化而来的细胞(主要是巨噬细胞)不同
[6]
。最新单细胞测序证实胶质瘤组织同时存在小胶和血源性单核/巨噬细胞
[7]
。显然,以往将脑内血源性单核/巨噬细胞与小胶混同的概念,无法真正解析小胶在胶质瘤的功能
[6]
。单细胞测序证实小胶是胶质瘤组织内主要的免疫细胞,但异质性高,可区分为十多个细胞亚群
[7]
。当前,胶质瘤组织的小胶亚群标志物还未确定,功能未知
[5]
。已知gbm组织t细胞浸润很少且单一免疫治疗(包括pd-1抗体,pd-1:程序性死亡受体1,也称cd279)对gbm无效,提示gbm组织强大的免疫抑制环境
[2,3]
。作为gbm组织中的主要免疫细胞,小胶可能主要发挥了免疫抑制和促癌作用。因此,在gbm发生发展过程中,常规研究方法很难发现并确定具有治疗作用的小胶质细胞亚群。
[0004]
本专利申请人于近期建立了一种新的、稳定的小鼠同种胶质母细胞瘤原位模型(即g422
tn-gbm模型)
[8]
。全基因组测序确定该肿瘤细胞株的基因型为:idh1/2
野生型
chromosome1/19
完整
tert-promoter
野生型
atrx
突变
trp53
突变
,符合人源三阴型(triple negative,tn)原发胶质母细胞瘤亚型分型标准,因此命名为g422
tn-gbm
[8]
。g422
tn-gbm细胞为本专利申请的申请人自主诱导建立的小鼠三阴型原发胶质母细胞瘤细胞,已提交给位于中国.武汉.武汉大学的中国典型培养物保藏中心保藏,保藏的培养物名称为:小鼠三阴型原发胶质
母细胞瘤g422
tn-gbm;保藏号为cctcc no:c2020267;保藏日期为:2020年12月17日。小鼠原位接种1
×
104至1
×
105个g422
tn-gbm细胞(致死量),肿瘤组织具有快速生长、出血坏死、高侵袭、t细胞匮乏的典型人gbm病理特征
[8]
。小鼠原位接种5
×
104个g422
tn-gbm细胞(优化的稳定模型),动物存活时间稳定在14-23天,中位生存期稳定在16-19天,符合gbm患者生存期短的临床特点
[8]
。在优化的小鼠原位g422
tn-gbm模型,不同时间窗的放疗、替莫唑胺、替莫唑胺同步放化疗的治疗效果与临床gbm治疗效果相似:即单独放疗无效、手术和替莫唑胺单药有效、替莫唑胺同步放化疗优于替莫唑胺单药;替莫唑胺单药或同步放化疗的治疗效果与起始治疗时间早正相关,即早期(第5天)优于》中期(第7天)》晚期(第9天);替莫唑胺单药和(或)同步放化疗治疗有效但不能治愈(治愈标准:小鼠荷瘤存活≥100天)
[8]
。这些治疗反应特征反映了gbm临床标准治疗的有效性和难治性。
[0005]
在以上优化的g422
tn-gbm稳定模型,我们发现仅替莫唑胺同步放化疗联合其他药物可以达到部分治愈效果(治愈率≤50%)。在荷瘤小鼠“治愈”后,再次颅内接种等量同种g422
tn-gbm细胞但不予治疗(即肿瘤再挑战试验),其中又有50%的“治愈”小鼠可长期存活≥100天(对照荷瘤小鼠存活≤23天),确认其获得了对g422
tn-gbm的免疫而使肿瘤自动消退,命名为“治愈-免疫”小鼠。在“治愈-免疫”小鼠(也称“长期存活”,long-term survival,lts),再次接种等量同种g422
tn-gbm细胞而不予治疗,接种后第7天,取肿瘤组织,分离单个活细胞,进行单细胞rna测序(scrna-seq)。与对照相比,“治愈-免疫”小鼠的肿瘤组织中明显增多的细胞亚群仅有1个小胶亚群(总共有3个小胶亚群)和t细胞,其他亚群(尤其是肿瘤细胞)均明显减少。单细胞rna测序结果显示增多的这个小胶亚群,其高表达的小胶标签基因前5位依次为:p2ry12(嘌呤能受体)、cx3cr1、btg2、hexb和cst3;同时低表达ccl12(趋化因子(c-c基序)配体12)等小胶标签基因(与另2个小胶亚群相比),因此命名该增多的小胶亚群为:p2ry12
high ccl12
low
小胶质细胞亚群。信号通路功能分析显示p2ry12 hi ccl12
lo
小胶亚群主要发挥增强其他免疫细胞(如t细胞)功能的作用(与对照组相比)。由于“治愈-免疫”小鼠种植的g422
tn-gbm能自动消退,可以确定其肿瘤微环境是一个治愈环境,其中增多的免疫细胞起治疗作用,因此可以确定p2ry12
high ccl12
low
小胶的增多与gbm治愈正相关。为证实p2ry12
high ccl12
low
小胶亚群的治疗作用,分离、纯化p2ry12
high
小胶(代表p2ry12
high ccl12
low
小胶亚群),输注p2ry12
high
小胶可以有效延长g422
tn-gbm荷瘤小鼠存活。因此,p2ry12
high ccl12
low
小胶亚群的治疗作用可以进一步应用于临床前研究或临床试验。参考文献:[1]stupp r,mason wp,van den bent mj,weller m,fisher b,taphoorn mj,belanger k,brandes aa,marosi c,bogdahn u,curschmann j,janzer rc,ludwin sk,gorlia t,allgeier a,lacombe d,cairncross jg,eisenhauer e,mirimanoff ro;european organisation for research and treatment of cancer brain tumor and radiotherapy groups;national cancer institute of canada clinical trials group.radiotherapy plus concomitant and adjuvant temozolomide for glioblastoma.n engl j med.2005mar 10;352(10):987-9;[2]
[0006]
shergalis a,bankhead a3rd,luesakul u,muangsin n,neamati n.current challenges and opportunities in treating glioblastoma.pharmacol rev.2018jul;70(3):412-445;[3]chen rq,liu f,qiu xy,chen xq.the prognostic and therapeutic value of pd-l1 in glioma.front pharmacol.2019jan 9;9:1503;[4]izquierdo p,
attwell d,madry c.ion channels and receptors as determinants of microglial function.trends neurosci.2019apr;42(4):278-292;[5]g
ó
mez morillas a,besson vc,lerouet d.microglia and neuroinflammation:what place for p2ry12?int j mol sci.2021feb 6;22(4):1636;[6]prinz m,jung s,priller j.microglia biology:one century of evolving concepts.cell.2019oct 3;179(2):292-311;[7]klemm f,maas rr,bowman rl,kornete m,soukup k,nassiri s,brouland jp,iacobuzio-donahue ca,brennan c,tabar v,gutin ph,daniel rt,hegi me,joyce ja.interrogation of the microenvironmental landscape in brain tumors reveals disease-specific alterations of immune cells.cell.2020jun 25;181(7):1643-1660.e17;[8]liu f,xu x,li c,li c,li y,yin s,yu s,chen xq.mannose synergizes with chemoradiotherapy to cure cancer via metabolically targeting hif-1in anovel triple-negative glioblastoma mouse model.clin transl med.2020nov;10(7):e226.
技术实现要素:
[0007]
本发明的任务是提供一种胶质瘤治疗性小胶质细胞亚群及其诱导方法,该亚群细胞的代表性高表达基因是嘌呤能受体p2ry12(p2ry12
high
),代表性低表达基因是趋化因子(c-c基序)配体12)(ccl12 low
),因而是一群p2ry12
high ccl12
low
的小胶质细胞亚群。p2ry12
high ccl12
low
的小胶质细胞亚群在胶质瘤治疗环境中可以被诱导增多,主要起免疫正调控作用,具有胶质瘤治疗作用。
[0008]
本发明的另一个任务是提供一种可诱导治疗性小胶质细胞亚群(p2ry12
high ccl12 low
亚群)的“治愈-免疫”动物模型,即g422
tn-gbm的有效治疗(替莫唑胺同步放化疗联合其他药物),该模型同时可以诱导肿瘤组织的t细胞浸润增多。
[0009]
实现本发明的技术方案是:本发明提供的胶质瘤治疗性小胶质细胞亚群(p2ry12
high clc12
low
小胶质细胞亚群)的诱导方法,包括以下步骤:
[0010]
(a)在昆明小鼠脑内接种致死数量的g422
tn-gbm细胞,接种后第7天给予放化疗联合免疫治疗;所述的g422
tn-gbm细胞已在位于中国.武汉.武汉大学的中国典型培养物保藏中心保藏,保藏号为cctcc no:c2020267;保藏的培养物名称为小鼠三阴型原发胶质母细胞瘤g422
tn-gbm;保藏号为cctcc no:c2020267;保藏日期为2020年12月17日。
[0011]
(b)对在步骤(a)中获得治愈效果的小鼠进行肿瘤再挑战试验,即第二次在小鼠大脑纹状体接种致死数量的g422
tn-gbm细胞且不予治疗;
[0012]
(c)对在步骤(b)中再次存活≥100天的小鼠(改小鼠获得对该肿瘤的免疫使肿瘤自动消退,即“治愈-免疫”)进行第二次肿瘤再挑战试验,即第三次在小鼠脑内接种致死数量的g422
tn-gbm细胞且不予治疗,接种后第7天的再挑战肿瘤组织p2ry12
high clc12
low
小胶质细胞亚群和t细胞显著增多,同时肿瘤细胞显著减少,p2ry12
high clc12
low
小胶质细胞亚群诱导成功。
[0013]
上述本发明诱导方法步骤(b)中所述的获得治愈效果的小鼠,是荷瘤存活≥100天的小鼠。根据speranza mc等人2018年发表在《neuro-oncology》的文章,小鼠从接种肿瘤开始,经药物干预,长期存活≥100天(long-term survivors,lts),认定为小鼠肿瘤的“治愈”;恶性肿瘤临床治愈标准为5年生存;小鼠荷瘤存活100天,与肿瘤患者5年生存相近;因
而,在小鼠恶性肿瘤模型的治疗文献中,通常将荷瘤小鼠存活≥100天,认定为“治愈”。
[0014]
上述本发明诱导方法中所述的在小鼠脑内接种致死数量的g422
tn-gbm细胞的具体方法是:在小鼠原位接种5
×
104个g422
tn-gbm细胞。在本模型接种1
×
103个以上g422
tn-gbm细胞的小鼠100%成瘤并致死,为了保证动物存活稳定在一个狭窄范围,确保肿瘤治疗效果,我们选用较高的肿瘤细胞接种量。
[0015]
前述方法中所述的放化疗联合免疫治疗是替莫唑胺同步放化疗联合其他药物进行治疗,其中所述的其他药物包括但不限于pd-1抗体、脑红蛋白穿膜肽、荜茇酰胺、tgf-β抗体或/和tgf-β抑制剂等。所述的替莫唑胺同步放化疗联合其他药物进行治疗的具体方案可以是:
[0016]
(a)替莫唑胺化疗:小鼠替莫唑胺灌胃,剂量:50mg/kg,共10剂/12天,给药5天,停药2天,然后再给药5天,即12天中的前后5天给药,中间2天不给药;
[0017]
(b)同步x-射线放射治疗:小鼠全脑x-射线照射一次,10gy;于替莫唑胺第一次给药前当日放疗,即替莫唑胺同步放化疗方案;
[0018]
(c)pd-1抗体治疗:小鼠腹腔注射200微克pd-1抗体,6剂/12天,于替莫唑胺第一次给药后当日开始给pd-1抗体;
[0019]
(d)脑红蛋白穿膜肽(tat-ngb)治疗或荜茇酰胺治疗或tgf-β抗体治疗或tgf-β抑制剂治疗:
[0020]
所述脑红蛋白穿膜肽(tat-ngb)治疗的方案可以是:于替莫唑胺第一次给药后当日开始给脑红蛋白穿膜肽,小鼠腹腔注射脑红蛋白穿膜肽,剂量:10mg/kg,共10剂/12天,给药5天,停药2天,然后再给药5天,即12天中的前后5天给药,中间2天不给药;
[0021]
所述荜茇酰胺治疗的方案可以是:腹腔注射,5mg/kg,10剂/12天,给药5天,停药2天,然后再给药5天,即12天中的前后5天给药,中间2天不给药;
[0022]
所述tgf-β抗体治疗方案可以是:腹腔注射,200微克/小鼠,6剂/12天;
[0023]
所述tgf-β抑制剂(galunisertib)治疗方案可以是:灌胃口服,50mg/kg,每日两次,10剂/12天,给药5天,停药2天,然后再给药5天,即12天中的前后5天给药,中间2天不给药。
[0024]
本发明提供的胶质瘤治疗性小胶质细胞亚群(p2ry12
high clc12
low
小胶质细胞亚群)是用前述诱导方法诱导后经分离、纯化获得的p2ry12
high clc12
low
小胶质细胞亚群,该细胞亚群具有嘌呤能受体p2ry12高表达和趋化因子(c-c基序)配体12(clc12)低表达的特征,其高表达的小胶标志性基因前5位是p2ry12、cx3cr1、btg2、hexb和cstd。p2ry12
high clc12
low
小胶质细胞亚群能用于制备或筛选治疗胶质瘤的药物。
[0025]
本发明提供的诱导p2ry12
high clc12
low
小胶质细胞亚群的原位胶质瘤“治愈-免疫”动物模型(也称为一种诱导治疗性小胶质细胞亚群的动物模型)的构建方法,包括前述的本发明提供的诱导方法中的步骤(a)至(b)或步骤(a)至(c)。
[0026]
本发明建立了一种胶质瘤“治愈-免疫”动物模型,在优化的“皮下接种
→
体外24小时培养
→
纹状体接种”模型系统稳定传代g422
tn-gbm细胞;接种优化的5
×
104个g422
tn-gbm细胞于雄性昆明小鼠右侧纹状体;接种后第7天开始采取替莫唑胺同步放化疗+pd-1抗体+tat-ngb(脑红蛋白穿膜肽;ngb,neuroglobin,脑红蛋白)的联合治疗(至第18天结束);记录荷瘤小鼠存活时间(接种日定为第0天),生存时间分析;荷瘤小鼠存活达100天以上定为治
愈(常规小鼠肿瘤治愈标准,“治愈”小鼠);在“治愈”小鼠左侧纹状体(对应右侧纹状体接种位置)接种优化的5
×
104个g422
tn-gbm细胞(优化过程同前),不予治疗(即肿瘤再挑战,re-challenge),对照为接种肿瘤细胞的正常同龄雄性昆明小鼠;记录荷瘤小鼠存活时间;再挑战小鼠再次存活达100天以上确认为肿瘤免疫(治愈后获得免疫力,即“治愈-免疫”小鼠,或称“长期存活”,long-term survival,lts小鼠);在这种“治愈-免疫”小鼠左侧纹状体不同位置再次接种5
×
104个g422
tn-gbm细胞(优化过程同前),不予治疗,对照为接种肿瘤细胞的正常同龄雄性昆明小鼠;接种后第7天,处死动物;取肿瘤脑组织;单个活细胞分离,确定活细胞质量检测达标,送诺禾致源生物公司单细胞rna测序(10x genomics)。
[0027]
使用cellranger(4.0.0版本)对单细胞rna测序原始数据进行数据质控过滤、比对、定量,最终得到各细胞的基因表达矩阵。后续采用seurat(3.0.2版本)进一步细胞过滤(每个细胞的umi》2000,基因数目》500,线粒体基因表达占比《0.2)、基因过滤(至少在10个以上的细胞中表达)、标准化、细胞亚群分类,分群结果显示肿瘤组织总共可区分为17个细胞亚群(cluster 0-16),其中小胶亚群有3个(即cluster 2、8、9),t细胞亚群一个(cluster7);与对照(control)相比,“治愈-免疫”小鼠(即lts)中仅cluster 8(小胶)和cluster7(t细胞)亚群显著增多(包括绝对数量和相对比值),而肿瘤细胞各亚群(即cluster 0、1、3、4、6)均显著减少。其他亚群减少或变化不明显。cluster 2、8、9小胶亚群各自top5标签基因依次为:c1qc
high c1qa
high c1qb
high ccl12
high cstd
high
、p2ry12
high cx3cr1
high btg2
high hexb
high cstd
high
、aif1
high c1qc
high c1qb
high tmsb4x
high ccl12
high
;依据cluster 8小胶亚群高表达嘌呤能受体p2ry12和低表达趋化因子(c-c基序)配体12(ccl12
low
,相对cluster2、cluster9小胶亚群的ccl12的高表达)特征,命名该亚群为p2ry12
high ccl12
low
小胶;metascape数据库分析,与对照相比,“治愈-免疫”组的p2ry12
high ccl12
low
小胶亚群的差异表达基因主要富集在免疫反应及免疫调节信号通路,包括“免疫反应的正调节”、“细胞因子介导的信号通路”、“获得性免疫反应”、“白细胞介导的免疫”等。由于“治愈-免疫”小鼠接种致死数量的g422
tn-gbm细胞后,肿瘤自动消退,动物长期存活,可以确定“治愈-免疫”小鼠肿瘤内增多的免疫细胞具有治疗作用,显然,增多的p2ry12
high ccl12
low
小胶和t细胞与g422
tn-gbm的治愈正相关。
[0028]
为进一步证实p2ry12
high ccl12
low
小胶的治疗作用,在以上g422
tn-gbm原位模型鼠予替莫唑胺同步放化疗+pd-1抗体+脑红蛋白穿膜肽的联合治疗(同前),流式细胞术分选有效治疗的肿瘤组织内p2ry12
high
小胶亚群活细胞(代表p2ry12
high ccl12
low
小胶);取200个p2ry12
high
小胶活细胞输注于第5天的g422
tn-gbm肿瘤内;结果证明输注p2ry12
high
小胶的小鼠存活时间显著延长(与输注p2ry12
low
小胶组相比)。
[0029]
本发明提供的一种确定可靠的原位胶质瘤“治愈-免疫”小鼠模型,可应用于诱导p2ry12
high ccl12
low
治疗性小胶和t细胞,或用于恶性胶质瘤治愈疗法的临床前疗效评估以及治愈靶标的筛选。我们验证了替莫唑胺同步放化疗+pd-1抗体+脑红蛋白穿膜肽对g422
tn-gbm原位肿瘤的治愈作用(肿瘤种植后第7天起始治疗,治愈率25%);进一步通过肿瘤再挑战实验确认了经这种联合治愈后获得了对同种肿瘤的免疫(免疫率50%),确认再挑战动物的长期存活是免疫治疗环境起作用的结果。因此本模型可用于恶性胶质瘤的免疫治疗药效评估,为临床前治疗研究提供重要的评估资料。总之,我们建立一种稳定可靠的恶性胶质瘤“治愈-免疫”小鼠模型,可以真实地反映治疗的有效性及其诱导的肿瘤特异免疫,可用于抗
肿瘤免疫新疗法和治疗靶点的临床前评估。
[0030]
本发明属于医药领域,建立了一种贴近临床的小鼠胶质母细胞瘤(gbm)治疗模型,获得了“治愈”小鼠,在这种“治愈”小鼠进行肿瘤再挑战,小鼠肿瘤自动消退,动物获得长期存活,这表明“治愈”小鼠获得了对该肿瘤的免疫,命名该小鼠为“治愈-免疫”小鼠。在“治愈-免疫”小鼠颅内接种肿瘤细胞,特异诱导了一种小胶质细胞(简称小胶)亚群,该小胶亚群主要具有嘌呤能受体p2ry12基因高表达特征(p2ry12
high
)和促进免疫的功能特征,输注p2ry12
hi
小胶亚群可显著延长胶质瘤荷瘤小鼠生存时间。我们自主建立了一种稳定的小鼠三阴型(triple negative,tn)胶质母细胞瘤原位模型(命名为:g422
tn-gbm),其恶性病理特征和常规放化疗治疗特征与临床gbm贴近:生长快、高侵袭、t细胞匮乏、致死性强(荷瘤小鼠存活《30天);手术联合替莫唑胺同步放化疗或替莫唑胺同步放化疗治疗有效,但无法治愈(治愈标准:荷瘤存活≥100天)。替莫唑胺同步放化疗联合脑红蛋白穿膜肽(tat-ngb)及pd-1抗体可以使25%的g422
tn-gbm荷瘤小鼠获得治愈;在“治愈”小鼠再次接种等量同种肿瘤细胞但不予治疗(即肿瘤再挑战),其中50%的“治愈”小鼠获得免疫而再次存活≥100天(“治愈-免疫”小鼠);在“治愈-免疫”小鼠再次肿瘤再挑战,接种肿瘤细胞后第7天取脑肿瘤组织,单细胞rna测序。结果显示:仅一个小胶亚群显著增多,伴t细胞显著增多和肿瘤细胞显著减少(对照为同龄未治疗荷瘤小鼠)。单细胞测序分析显示:该小胶亚群高表达特征基因前5位依次为p2ry12、cx3cr1、btg2、hexb、cst3,低表达特征基因主要包括趋化因子(c-c基序)配体12(ccl12
low
)等,因此定义该群小胶为p2ry12
high ccl12
low
亚群;与对照相比,“治愈-免疫”(即lts)小鼠的p2ry12
high ccl12
low
小胶亚群差异基因富集在促进免疫功能相关的信号通路。在第5天的g422
tn-gbm荷瘤小鼠输注p2ry12
high
小胶亚群显著延长动物存活时间。因此可以确定p2ry12
hi ccl12
lo
小胶质细胞亚群具有胶质瘤治疗作用。
附图说明
[0031]
图1:小鼠原位g422
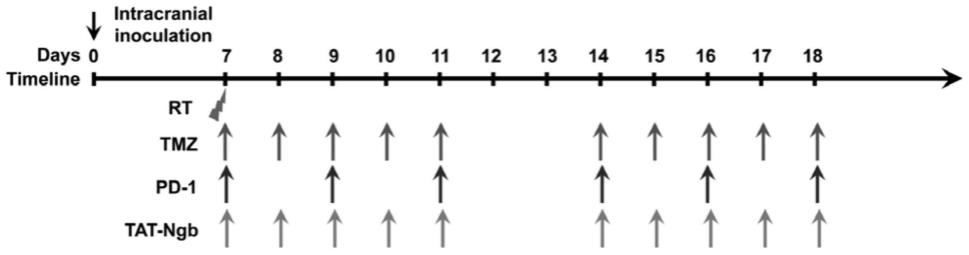
tn-gbm模型的联合治疗(替莫唑胺同步放化疗联合pd-1抗体和脑红蛋白穿膜肽)日程安排示意图。timeline:时间轴;箭头指示肿瘤细胞接种日或给药日。第0天:接种日;第7-18天:放疗或药物治疗期。rt,x-射线照射;tmz,替莫唑胺,rt当日照射后4小时予tmz灌胃给药(p.o.),每日一次(qd),其后固定上午9-10点给药,共10剂;pd-1抗体,腹腔注射(i.p),每日一次,共6剂;tat-ngb,脑红蛋白穿膜肽,腹腔注射,每日一次,共10剂;多药治疗方案中,按tmz-1小时间隔-pd-1抗体-1小时间隔-tat-脑红蛋白顺序给药,给药日按箭头所示。注:图中箭头的颜色深浅不代表额外含义,仅表示给药时间点。
[0032]
图2:联合治疗各组的荷瘤小鼠小鼠生存时间(左)和体重变化(右)结果图。小鼠颅内接种5
×
104个g422
tn-gbm细胞后,随机分为以下8个组(n=8/组):control(对照组,腹腔注射等量生理盐水)、tat-ngb、pd-1、tat-ngb/pd-1(脑红蛋白穿膜肽与pd-1抗体联合治疗)、rt/tmz(替莫唑胺同步放疗)、rt/tmz/tat-ngb(替莫唑胺同步放疗联合tat-ngb)、rt/tmz/pd-1(替莫唑胺同步放疗联合pd-1抗体)、rt/tmz/pd-1/tat-ngb(替莫唑胺同步放疗联合pd-1抗体和tat-ngb)。按以上图1日程治疗,结果显示:仅rt/tmz/pd-1/tat-ngb联合治疗具有治愈效果(接种肿瘤细胞后存活》100天,小鼠肿瘤治愈标准;治愈率25%,2/8)。**p《0.01;***p《0.001。
[0033]
图3:rt/tmz/pd-1/tat-ngb和rt/tmz/pd-1联合治疗组小鼠颅内肿瘤大小比较(左
图为肿瘤细胞表达荧光素酶的肿瘤大小结果图,右图为左图的统计图)。在以上图2的治疗组中,对rt/tmz/pd-1/tat-ngb和rt/tmz/pd-1两个联合治疗组的所有荷瘤小鼠,在其肿瘤接种后的第20天(治疗期第7-18天),予活体荧光素酶生物发光成像(bioluminescent imaging,bli),以显示颅内肿瘤大小。结果证明,rt/tmz/pd-1/tat-ngb治疗组动物颅内相对肿瘤大小平均值显著低于rt/tmz/pd-1治疗组(肿瘤细胞表达荧光素酶)。*p《0.05。
[0034]
图4:治愈小鼠肿瘤再挑战及其对照小鼠颅内肿瘤成像(左)及其生存分析(右)结果图。在以上图2的肿瘤治愈小鼠(rt/tmz/pd-1/tat-ngb组,n=2)进行肿瘤再挑战实验(第110天)。在治愈小鼠和同龄正常对照鼠(control,n=4)左侧纹状体接种5
×
104个g422
tn-gbm细胞,不予任何治疗,接种后第10天,动物活体予bli成像,显示肿瘤大小(左图)。肿瘤再挑战及其对照荷瘤小鼠生存时间结果图(右图)。结果证明仅一只治愈小鼠接种肿瘤后再次存活》100天(即再挑战成功,“治愈-免疫”)。在本模型,接种5
×
104个g422
tn-gbm细胞后,不予治疗的所有荷瘤小鼠存活《23天,因此,“治愈-免疫”小鼠只能是该小鼠获得了对该肿瘤的免疫能力,在肿瘤微环境存在杀伤肿瘤细胞的免疫细胞,使肿瘤不能生长,自动消退而达到再次长期存活。
[0035]
图5:“治愈-免疫”小鼠二次再挑战肿瘤组织单细胞rna测序的实验流程示意图。d,day。小鼠原位g422
tn-gbm模型的联合治疗方案参见图1;联合治疗(即rt/tmz/pd-1/tat-ngb组)的治疗结果参见图2;“治愈”小鼠(n=2)的肿瘤再挑战结果参见图4,其中一只肿瘤再挑战小鼠获得长期存活,即“治愈-免疫”小鼠。在该“治愈-免疫”小鼠(即lts组,n=1,第220天)左侧纹状体(与前次不同位置)再次予颅内接种5
×
104个g422
tn-gbm细胞,设同龄正常小鼠对照(n=2,相同位置接种等量肿瘤细胞);肿瘤细胞种植后第7天,用预冷pbs灌流,脑肿瘤组织剪碎后随即消化(胶原酶ⅳ+dnaseⅰ),70%/37%/30%(混合细胞层)percoll进行单细胞分离(800g,4℃,30min),,制备单个活细胞;活细胞质量达标,送诺禾致源生物公司单细胞rna测序(scrna-seq)。
[0036]
图6:单细胞rna测序结果的细胞亚群展示图。使用cellranger(4.0.0版本)、seurat(3.0.2版本)对g422
tn-gbm肿瘤组织的单细胞测序原始数据进行整理、分类,确定总有效测序细胞数:control(对照鼠),7547个;lts(“治愈-免疫”鼠),4465个;细胞分群结果显示肿瘤组织细胞可区分为17个细胞亚群(clusterid,0-16),各亚群的细胞总数分别为:3302(0群)、2935(1群)、1149(2群)、965(3群)、956(4群)、675(5群)、553(6群)、471(7群)、232(8群)、214(9群)、204(10群)、103(11群)、82(12群)、61(13群)、53(14群)、29(15群)、28(16群)。采用singler包进行主要的细胞类型(cell type)注释,0-16群细胞分别注释为:0群成纤维细胞(0fibroblasts)、1群成纤维细胞(1fibroblasts)、2群小胶质细胞(2microglia)、3群成纤维细胞(3fibroblasts)、4群成纤维细胞(4fibroblasts)、5群单核细胞(5monocytes)、6群红细胞(6erythrocytes)、7群t细胞(7t cells)、8群小胶质细胞(2microglia)、9群小胶质细胞(9microglia)、10群内皮细胞(10endothelial cells)、11群巨噬细胞(11macrophages)、12群b细胞(12b cells)、13群内皮细胞(13endothelial cells)、14群少突胶质细胞(14oligodendrocytes)、15群单核细胞(15monocytes)、16群单核细胞(16monocytes)。其中小胶质细胞亚群有3个,即2、8和9群(clusterid:2、8、9)。由于参考数据集中只有小鼠正常的细胞类型,因而注释结果中未显示肿瘤细胞;而脑组织中缺乏的成纤维细胞(fibroblasts,cluster 0、1、3、4)、红细胞(erythrocytes,cluster 6,已
清洗去除且无转录功能)则大量存在;因此,推测cluster 0、1、3、4、6为g422
tn-gbm细胞亚群,与肿瘤组织中肿瘤细胞数量最多相符。(注:图由seurat软件自动生成,不能修改。)
[0037]
图7:染色体拷贝数变异分析确定肿瘤细胞亚群的结果。肿瘤细胞的核心特征是其基因组的改变,因此可以通过染色体拷贝数变异(copy number variations,即infercnv技术)确定肿瘤细胞亚群。cluster2(小胶细胞)和cluster5(单核细胞)作为参考细胞,对cluster 0、1、3、4、6亚群细胞做infercnv分析,结果显示cluster 0、1、3、4、6亚群细胞(b)在1,2,14,17号染色体有明显的拷贝数缺失,在3,8号染色体有明显的拷贝数增加(箭头指示高cnv区)。因此,可以确定cluster 0、1、3、4、6为g422
tn-gbm细胞亚群。(注:图由infercnv软件自动生成,不能修改。)
[0038]
图8:各亚群前5位高表达差异基因在所有细胞亚群中的相对表达展示结果。(因打印关系将图8拆分成三个小图置于三页)。其中,cluster2小胶亚群top5高表达的差异基因依次为:c1qc、c1qa、c1qb、ccl12、ctsd;cluster8小胶亚群:p2ry12、cx3cr1、btg2、hexb、cst3;cluster9小胶亚群:aif1、c1qc、c1qb、tmsb4x、ccl12。其中,cluster8小胶亚群的p2ry12高表达、ccl12低表达与其他2个小胶亚群较突出,因此,命名cluster8小胶亚群为p2ry12
hi ccl12
lo
亚群。(注:该图由seurat软件自动生成,不能修改。因该图8自动生成为3页,故编号为图8-1、图8-2、图8-3)。
[0039]
图9:“治愈-免疫”小鼠肿瘤组织中cluster2与cluster8小胶亚群主要差异基因表达比较的结果。结果显示p2ry12在cluster 8小胶亚群表达明显高于cluster2。lts,“治愈-免疫”小鼠。(注:图由seurat软件自动生成,不能修改。)
[0040]
图10:“治愈-免疫”小鼠肿瘤组织中cluster9与cluster8小胶亚群主要差异基因表达比较的结果。结果显示p2ry12也是cluster 8小胶亚群突出的高表达基因。(注:图由seurat软件自动生成,不能修改。)
[0041]
图11:cluster 8小胶亚群与cluster2、cluster 9小胶亚群的gas、il-2细胞通讯信号通路差异。结果显示cluster 8小胶亚群主要通过il-2信号通路与其他亚群细胞进行细胞通讯活动,而cluster2,9小胶亚群主要通过gas信号通路与其他亚群细胞进行细胞通讯活动。(注:该结果图由细胞通讯信号通路cellchat软件根据实际测序数据自动生成,线段深浅颜色不代表数据本身有差异,而是不同组别的区分方式,而线段粗细代表两者细胞之间通讯信号通路越强,主要结果在图中已经用黑色箭头标识。)
[0042]
图12:“治愈-免疫”小鼠与对照小鼠肿瘤组织中cluster 8小胶亚群主要差异基因比较的结果。结果显示“治愈-免疫”与其对照小鼠中的cluster 8小胶亚群的代表性差异表达基因。(注:图由seurat软件自动生成,不能修改。)
[0043]
图13:“治愈-免疫”小鼠与对照小鼠肿瘤组织中cluster 8小胶亚群差异基因go信号通路富集结果。结果显示其差异基因go富集主要集中在免疫相关的信号通路,表明在“治愈-免疫”小鼠的gbm组织,cluster 8小胶亚群与抗肿瘤的免疫正调节环境相关,与t细胞增多正相关。因此,可以确定cluster 8小胶亚群在“治愈-免疫”小鼠的肿瘤组织具有免疫促进作用。(注:图由metascap软件自动生成,不能修改。)
[0044]
图14:“治愈-免疫”小鼠与对照小鼠肿瘤组织中cluster 8小胶亚群差异基因的kegg信号通路富集结果。metascape富集分析结果显示其差异基因kegg富集主要集中在免疫相关的信号通路。(注:图由metascape软件自动生成,不能修改;划线标注部分为差异基
因富集的免疫相关通路。)
[0045]
图15:“治愈-免疫”小鼠与对照小鼠肿瘤组织中cluster 9小胶亚群差异基因的kegg信号通路富集结果。结果显示cluster 9小胶亚群差异基因kegg富集主要集中在非免疫相关的信号通路。(注:图由metascap软件自动生成,不能修改。)
[0046]
图16:“治愈-免疫”小鼠与对照小鼠肿瘤组织中cluster 2小胶亚群差异基因的kegg信号通路富集结果。结果显示其差异基因kegg富集主要集中在非免疫相关的信号通路。(注:图由metascap软件自动生成,不能修改。)
[0047]
图17:p2ry12
high
小胶亚群治疗小鼠原位g422
tn-gbm的结果。小鼠颅内接种5
×
104个g422
tn-gbm细胞后,随机分为2组:对照组(n=8)和联合治疗组(n=20)。接种后第5-16日予联合治疗(替莫唑胺同步放化疗+pd-1抗体+脑红蛋白穿膜肽的联合治疗,给药方案同图1);第17日取肿瘤组织,选取治疗有效(50%)肿瘤组织,分离单个活细胞,与p2ry12荧光抗体共孵育,流式细胞术分选有效p2ry12
high
和p2ry12
low
活细胞。将200个p2ry12
high
或p2ry12
low
活细胞分别注入第5日的小鼠原位g422
tn-gbm组织中(n=7/组)。结果证明:输注p2ry12
high
小胶的荷瘤小鼠存活时间显著延长(***p《0.001,与p2ry12
low
组相比)。
[0048]
图18:为提供摘要附图生成的组合图。
具体实施方式
[0049]
实施例1
[0050]
本发明提供的小鼠原位g422
tn-gbm胶质瘤“治愈-免疫”模型可诱导一种治疗性小胶质细胞亚群,该小胶亚群细胞主要具有p2ry12高表达、ccl12低表达的转录特征,即p2ry12
high ccl12
low
小胶。本发明提供的p2ry12
high ccl12
low
小胶亚群主要具有免疫调节功能,具有促进肿瘤组织t细胞浸润,对胶质瘤有免疫治疗的作用。将本发明提供的小鼠原位g422
tn-gbm胶质瘤“治愈-免疫”模型应用于p2ry12
high ccl12
low
小胶质细胞亚群的诱导和转换以及免疫治疗的评估,具体实施如下:
[0051]
实验细胞:g422
tn-gbm细胞:该细胞体外培养不扩增,使用皮下或颅内接种交替传代,以便更好的维持其生物学特性。冻存条件为:80%rpmi 1640基础培养基/10%二甲基亚砜/10%胎牛血清。将g422
tn-gbm(100万细胞/0.2ml pbs)接种于成年昆明雄性小鼠右前肢肩部皮下,待皮下瘤生长至7-9天时,取皮下瘤用胰酶消化成单细胞悬液,孵育24小时后收集细胞并计数,取5万活细胞接种至小鼠大脑右侧或纹状体内。g422
tn-gbm细胞为本专利申请的申请人自主诱导建立的小鼠三阴型原发胶质母细胞瘤细胞,已提交给位于中国.武汉.武汉大学的中国典型培养物保藏中心保藏,保藏的培养物名称为:小鼠三阴型原发胶质母细胞瘤g422
tn-gbm;保藏号为cctcc no:c2020267;保藏日期为:2020年12月17日。
[0052]
实验动物:本发明中实验用的昆明小鼠(雄性,18-22g)购于北京斯贝福生物技术有限公司,许可证号为:scxk(京)2019-0010。所有小鼠均按昼夜12小时交替方式饲养于同济医学院实验动物管理中心,自由进食与饮水,并依据华中科技大学同济医学院伦理委员会发布条例进行相关实验动物操作。
[0053]
试剂:(1)实验药物:替莫唑胺(temozolomide,tmz)购于abmole,配药方法:将5mg羧甲基纤维素钠置于1ml生理盐水表面,静置1天,待其充分溶胀,然后加入5mg替莫唑胺粉末后超声30min形成稳定固体分散体,终浓度为5mg/ml,现配现用。tat-ngb定制于金斯瑞生
物科技公司。pd-1抗体(anti-pd-1antibody)购于bioxcell公司(批号:735019j2)。d-luciferin(potassium salt)购于cayman chemical company。15mg/ml d-荧光素钾,配药方法:150mg d-荧光素钾避光条件下溶解于10ml无菌pbs,现配现用。流式荧光抗体:多克隆抗p2ry12-藻红蛋白标记荧光抗体(polyclonal anti-p2y12-pe antibody)购于赛默飞世尔科技公司(thermo fisher scientific,货号product#pa5-77677)、单克隆抗cd11b-异硫氰酸标记荧光抗体(monoclonal anti-cd11b-fitc antibldy)购于biolegend(货号:clone m1/70)。(2)细胞培养试剂:胎牛血清购于gemini公司,rpmi 1640基础培养基、0.25%胰酶、pbs(ph=7.4)购于gibco公司,0.4%台盼蓝染液、二甲基亚砜购于sigma公司,青霉素-链霉素溶液购于hyclone公司。
[0054]
仪器:脑立体定位仪(美国stoelting);二氧化碳培养箱(forma,美国);体视显微镜(77020,深圳市瑞沃德生命科技有限公司);动物活体光学成像(lago x);小鼠x射线辐照仪(rs2000pro);bd facsverse流式细胞仪。
[0055]
实验步骤:
[0056]
(1)小鼠原位g422
tn-gbm模型及其rt/tmz/pd-1/tat-ngb联合治疗
[0057]
a.制备小鼠原位g422
tn-gbm模型。g422
tn-gbm细胞为本实验室建立,经全基因组测序确定该细胞株的基因型为:idh1/2
wt
chromosome1/19
intact
tert-promoter
wt
atrx
mutant
trp53
mutant
,符合人源三阴型(triple negative,tn)原发胶质母细胞瘤亚型分型标准,命名为g422
tn-gbm细胞。g422
tn-gbm细胞只能活体传代,不能体外培养。我们建立了一种“皮下接种
→
体外24小时培养(无增殖)
→
纹状体接种”的优化g422
tn-gbm模型系统,使所有颅内接种5万个g422
tn-gbm细胞的成年昆明小鼠(小鼠原位g422
tn-gbm模型)均在25天内死亡,生存时间短且稳定。在小鼠原位g422
tn-gbm模型上,我们建立了gbm的替莫唑胺同步放化疗(temozolomide concurrent chemoradiotherapy,rt/tmz)治疗模型,rt/tmz的联合治疗有效,但不能治愈(存活《35天,第5天早期开始治疗),治疗反应与临床gbm贴近。参见文献“clin transl med.2020nov;10(7):e226”。
[0058]
b.小鼠原位g422
tn-gbm肿瘤的rt/tmz/pd-1/tat-ngb联合治疗。rt、tmz、pd-1抗体、tat-ngb给药流程示意图参见图1。第0天颅内接种g422
tn-gbm细胞:使用脑立体定位仪(美国stoelting co.620wheat lane型立体定位仪),用汉密尔顿微量进样针(1701rn,33g)将5万个优化的g422
tn-gbm细胞/1微升(表达荧光素酶)注射到正常成年雄性昆明小鼠(18-22g)右侧纹状体(坐标:前囟前0.5mm、旁开2mm;深度3.5mm)。第7-18天治疗期:接种肿瘤细胞后的第7天开始单药或联合治疗;第7天予一次性全脑照射(x射线辐照仪rs2000pro,照射参数设定为:160kv,25ma,1gy/48.4sec,x射线照射总剂量10gy;3mm铅板遮挡其他身体部位),rt/tmz联合治疗方案组4小时后予tmz灌胃一次(50mg/kg),1小时后予腹腔注射tat-ngb一次(200微克,10mg/kg)(tat-ngb单药或联合治疗组),再1小时后予腹腔注射pd-1抗体(anti-pd-1antibody,pd-1,200微克)(pd-1抗体单药或联合治疗组);第8-18天依给药方案给予相应治疗(箭头指示日,图1)。记录生成时间。
[0059]
(2)小鼠原位g422
tn-gbm模型治愈后肿瘤再挑战及“治愈-免疫”小鼠二次肿瘤再挑战肿瘤组织单细胞测序
[0060]
a.“治愈”小鼠肿瘤再挑战。原位g422
tn-gbm荷瘤小鼠经rt/tmz/pd-1/tat-ngb联合治疗(第7-18天),部分荷瘤小鼠(2/8)获得治愈(存活≥100天,即长期存活,lts)(图2)。在“治愈”小鼠左侧纹状体第二次接种5万的g422
tn-gbm细胞(坐标:前囟前0.5mm、旁开2mm;深度3.5mm)。对照小鼠使用同龄正常雄性昆明小鼠,同样接种g422
tn-gbm细胞。不予治疗,记录接种后动物生存时间。其中一只“治愈”小鼠的肿瘤自动消退(1/2),再次获得长期存活(二次接种肿瘤后存活≥100天,获得对g422
tn-gbm细胞的免疫能力,命名为“治愈-免疫”小鼠)(图4);另一只“治愈”小鼠bli显示肿瘤明显,二次接种肿瘤后存活《20天(图4)。
[0061]
b.“治愈-免疫”小鼠的肿瘤二次肿瘤再挑战和肿瘤组织单细胞测序。实验流程参见图5。在以上“治愈-免疫”小鼠(即lts组)的左侧纹状体再次接种5万优化的g422
tn-gbm细胞(坐标:前囟前0.5mm、旁开3mm;深度2.5mm)。对照小鼠使用同龄正常雄性昆明小鼠(n=2),同样接种g422
tn-gbm细胞。接种肿瘤细胞后第7天,用预冷pbs灌流,脑肿瘤组织剪碎后随即消化(胶原酶ⅳ+dnaseⅰ),70%/37%/30%(混合细胞层)percoll进行单细胞分离(800g,4℃,30min),,制备单个活细胞悬液,细胞活性和数量检测达到单细胞测序要求,送诺禾致源生物有限公司行单细胞rna测序。获得测序原始测序结果(上传至https://www.ncbi.nlm.nih.gov/geo/query/acc.cgi?acc=gse166525)。
[0062]
c.二次再挑战g422
tn-gbm肿瘤单细胞rna测序结果、小胶质细胞亚群特征及其功能分析。使用常用生物信息学分析软件和数据包,如cellranger(4.0.0版本)、seurat(3.0.2版本)singler包等,对g422
tn-gbm肿瘤组织的单细胞测序原始数据进行细胞类型(cell type)注释、基因表达分析、染色体拷贝数变异(copy number variations,即infercnv技术)分析、细胞通讯(cellchat软件)信号通路差异、metascape数据库分析(go信号通路富集、kegg信号通路富集),结果确定g422
tn-gbm可以将确定“治愈-免疫”小鼠g422
tn-gbm肿瘤二次再挑战主要诱导一种p2ry12
high ccl12
low
的小胶质细胞亚群和t细胞增多,与“治愈-免疫”小鼠的肿瘤再挑战长期存活正相关。
[0063]
(3)p2ry12
high
小胶亚群输注治疗小鼠原位g422
tn-gbm。
[0064]
a.制备p2ry12
high
小胶亚群活细胞。小鼠颅内接种5
×
104个g422
tn-gbm细胞后,随机分为2组:对照组(n=8)和联合治疗组(n=20)。接种后第5-16日按图1方案给予“替莫唑胺同步放化疗+pd-1抗体+脑红蛋白穿膜肽”的联合治疗(第5天开始治疗则提高治愈率达50%,参见文献8);第17日取肿瘤组织,选取治疗有效的肿瘤组织(10个肿瘤体积较对照减小约50%,与50%的治愈率相一致),分离单个活细胞,与多克隆p2ry12-pe荧光抗体(10μg/100万细胞)、单克隆cd11b-fitc抗体(小胶质细胞流式细胞术分离表面标志物,10μg/100万细胞)4度共孵育30分钟,流式细胞术分选cd11b阳性(cd11b
+
,全体小胶质细胞标志物)p2ry12高表达(p2ry12
high
,代表p2ry12
high ccl12
low
小胶亚群细胞;ccl12在细胞内部,不能用于活细胞分选)、cd11b阳性p2ry12低表达(p2ry12
low
,代表p2ry12
low
ccl12
high
小胶亚群细胞)。
[0065]
b.p2ry12
high
小胶促进荷瘤小鼠存活。将以上200个cd11b
+
p2ry12
high
或cd11b
+
p2ry12
low
活细胞分别注入第5日的小鼠原位g422
tn-gbm组织中(n=7/组)。结果证明:输注cd11b
+
p2ry12
high
小胶的荷瘤小鼠存活时间显著延长(***p《0.001,与cd11b
+
p2ry12
low
组相比)。
[0066]
实验结果:
[0067]
(1)脑红蛋白穿膜肽和pd-1抗体联合替莫唑胺同步放化疗可治愈小鼠原位g422
tn-gbm肿瘤
[0068]
我们自主建立了稳定的一种小鼠原位三阴型胶质母细胞瘤(g422
tn-gbm)模型:在优化的模型,昆明成年雄性小鼠纹状体接种5万g422
tn-gbm细胞,荷瘤小鼠100%存活《25天。在该模型,肿瘤接种后第7天予替莫唑胺同步放化疗(rt/tmz,x-全脑照射,10gy;tmz:50mg/kg,灌胃,10剂/12天),可显著延长动物存活,但无治愈效果(存活《35天)(clin transl med.2020nov;10(7):e226)。
[0069]
我们前期已证明内源性脑红蛋白(neuroglobin,ngb)在肝癌细胞中发挥抑癌作用(mol pharmacol.2013may;83(5):1109-19);证明纯化的外源性脑红蛋白穿膜肽(tat-ngb,即含ygrkkrrqrrr的tat多肽与人源脑红蛋白的融合蛋白)可以进入细胞,且具有促进神经元突起再生的功能(cell death dis.2018feb 7;9(2):163)。pet28a-tat-ngb原核表达载体的构建参见熊昕昕博士论文“脑红蛋白促进神经元缺血损伤后轴突生长的作用及机制研究”(华中科技大学,doi:10.7666/d.d01313107)。我们在g422
tn-gbm细胞也证明过表达ngb可延长荷瘤小鼠生存时间,而敲降g422
tn-gbm细胞内源性ngb这缩短荷瘤小鼠生存时间,但存活时间均《25天(结果未展示)。
[0070]
依据以上结果,我们推测rt/tmz与tat-ngb、pd-1抗体的联合可能具有治愈g422
tn-gbm的效果。因此,我们在稳定的小鼠g422
tn-gbm模型予rt/tmz/pd-1/tat-ngb联合治疗方案,同时设各种单药或联合治疗对照(图1)。生存曲线显示(图2,n=8/组):tat-ngb、pd-1抗体单药治疗组荷瘤小鼠生存时间与对照组(control,无治疗)相比无差异;rt/tmz治疗显著延长荷瘤小鼠生存(与control组相比);tat-ngb/pd-1联合治疗与tat-ngb、pd-1抗体单药治疗相比,显著延长动物生存时间;rt/tmz联合tat-ngb或pd-1抗体单药不能延长动物生存(与rt/tmz组相比);rt/tmz联合tat-ngb和pd-1抗体显著延长动物生存(与rt/tmz、rt/tmz/tat-ngb、rt/tmz/pd-1组相比),且25%的荷瘤小鼠(2/8)获得“治愈”(肿瘤种植后存活》100天,达到小鼠的胶质瘤治愈标准)。
[0071]
在治疗过程中,第20天(接种后时间)对以上rt/tmz/pd-1/tat-ngb、rt/tmz/pd-1治疗组动物予荧光素酶活体成像显示肿瘤大小(图3)。结果显示rt/tmz/pd-1/tat-ngb治疗组动物颅内肿瘤相对较小。统计分析表明,rt/tmz/pd-1/tat-ngb治疗组小鼠颅内肿瘤荧光素酶的平均光密度值显著低于rt/tmz/pd-1治疗组。具体方法参见文献“clin transl med.2020nov;10(7):e226”。
[0072]
对以上rt/tmz/pd-1/tat-ngb治疗组的2只“治愈”小鼠予肿瘤再挑战试验。在“治愈”小鼠左侧纹状体再次接种5万g422
tn-gbm细胞,不予治疗。同龄正常小鼠接种等量肿瘤细胞为对照(control,n=4)。接种后第10天,予荧光素酶活体成像,结果(图4)显示其中一只“治愈”小鼠肿瘤显著小于对照组,生存曲线显示该“治愈”小鼠脑内肿瘤自动消退(获得对g422
tn-gbm细胞的免疫力),动物长期生存》100天,命名为“治愈-免疫”小鼠;而另一只“治愈”小鼠肿瘤明显(未获得对g422
tn-gbm细胞的免疫力),动物生存《20天;对照小鼠生存《20天。
[0073]
(2)“治愈-免疫”小鼠二次再挑战肿瘤组织诱导小胶质细胞亚群转变和t细胞增多
[0074]
在我们的小鼠原位g422
tn-gbm模型,所有未治疗动物存活不足25天,模拟临床标准放化疗(即rt/tmz)可有效延长动物存活,但所有动物存活仍不足35天;表明本模型肿瘤恶性程度高、对rt/tmz治疗抵抗,是当前稳定性最好的临床前治疗模型。因此,rt/tmz/pd-1/tat-ngb联合治疗获得的“治愈”小鼠可以准确的反映治疗作用。在获得的“治愈”小鼠进行
肿瘤再挑战试验,仅1/2的动物可以未经治疗而再次获得长期存活(lts,即“治愈-免疫”小鼠),表明该lts小鼠的脑内微环境发生了转变,已经成为了一个可以治疗肿瘤的免疫微环境。在这种治疗免疫微环境中,可以确定增加的非肿瘤细胞成分具有免疫治疗作用。
[0075]
基于以上的分析,我们在以上“治愈-免疫”小鼠(lts,n=1),再次颅内接种g422
tn-gbm细胞(第二次肿瘤再挑战,实验流程参见图5)。考虑到第一次肿瘤再挑战时,肿瘤接种后的第10天,“治愈-免疫”小鼠颅内有快速消退的趋势,我们推测肿瘤微环境的抗癌细胞组分可能在一周内已被充分诱导。因此,我们在第二次肿瘤再挑战的第7天,取肿瘤组织,进行单细胞rna测序(single-cell rnasequencing,scrna-seq)。同时,取一只未经治疗的同龄对照小鼠脑肿瘤组织作为对照(control组)。
[0076]
单细胞rna测序结果显示(图6):测序有效细胞总数,control小鼠:7547,lts小鼠:4465,与“治愈-免疫”小鼠(即lts组)肿瘤组织较小的结果一致;肿瘤组织细胞可区分为17个亚群(cluster 0-16),细胞数目依次减少;与对照相比,“治愈-免疫”小鼠肿瘤组织中仅cluster8(小胶质细胞亚群)和cluster7(t细胞)增多。显然,这2群增多的细胞是导致“治愈-免疫”小鼠g422
tn-gbm肿瘤治愈的细胞成分。因此,cluster8小胶亚群是一群具有gbm治疗作用的小胶。在以往的胶质模型中,由于模型的治疗作用稳定性不佳,治愈结果大多未经肿瘤再挑战试验验证,因此,不能确定肿瘤的微环境与治愈结果的相关性;而小胶亚群本身具有较高的异质性,因而以往的动物模型难以发现或确定具有治疗作用的小胶。
[0077]
(3)染色体拷贝数变异分析确定单细胞测序中的cluster 0、1、3、4、6细胞亚群是g422
tn-gbm细胞
[0078]
目前还没有确定的小鼠胶质瘤中肿瘤细胞亚群的标志基因,因此,以上原始分析结果中没有显示肿瘤细胞(图6)。cnv(染色体拷贝数变化)分析是确定scrna-seq肿瘤细胞的方法。与正常细胞(references)比对,cluster 0、1、3、4、6具有明显的染色拷贝数缺失和增加(图7),脑组织中没有“fibroblasts”,而“erythrocytes”没有大量的转录本且绝大部分被去除。因此,可以确定cluster 0、1、3、4、6是g422
tn-gbm细胞。cluster2,5正常细胞没有明显的染色体拷贝数变化(图7a),与原始分析结果中显示的细胞类型相符(图7b)。
[0079]
(4)各亚群差异表达基因分析显示cluster8小胶质细胞的高表达特征基因前5分别是p2ry12、cx3cr1、btg2、hexb、cstd
[0080]
在以上scrna-seq所测细胞中,g422
tn-gbm肿瘤细胞总数最多(cluster 0、1、3、4、6),其次是小胶质细胞(cluster2、8、9)。cluster2、8、9小胶亚群各自top1-5标签基因依次为(图8):c1qc、c1qa、c1qb、ccl12、cstd(cluster2)、p2ry12、cx3cr1、btg2、hexb、cstd(cluster8)、aif1、c1qc、c1qb、tmsb4x、ccl12(cluster9)。其中,p2ry12高表达(p2ry
high
)和clc12低表达(ccl12
low
)在cluster8小胶较明显。因此,我们命名cluster8小胶为p2ry12
high clc12
low
小胶质细胞亚群。利用p2ry12、clc12这2个标志物,结合其他小胶质细胞和单核细胞通用标志物如cd11b、cd45等,可以分类、纯化cluster8小胶亚群,用于进一步的研究或治疗应用。(注:cluster2、8、9小胶亚群各自前6-10位的标签基因依次为egr1
high fcer1g
high tryobp
high grn
high cstz
high
、mafb
high tmem119
high hexb
high zfp36
high jun
high
、trem2
high hexb
high lgmn
high ifi30
high ly6a
high
。)
[0081]
(5)“治愈-免疫”小鼠中的cluster8区别于cluster2小胶亚群的主要特征是p2ry12高表达和clc12低表达
[0082]
图8中的小胶亚群包含来自“治愈-免疫”(即lts组)和control小鼠的细胞。由于“治愈-免疫”和control小鼠的肿瘤微环境不同,而小胶的转录异质性较高;“治愈-免疫”和control小鼠肿瘤组织中的同种小胶亚群,其基因表达也可能有差异。因此,我们进一步比较了“治愈-免疫”小鼠肿瘤组织中cluster8与cluster2(图9)小胶亚群的主要差异基因。结果显示“治愈-免疫”小鼠中:与cluster2小胶相比,cluster8小胶的高表达p2ry12和低表达ccl12特征较明显(图9)。在“治愈-免疫”小鼠,cluster2细胞数量仍是最多,因此,同时使用p2ry12高表达和clc12低表达两种特征,将有利于cluster8小胶与其他2个小胶亚群的区分开。
[0083]
(6)“治愈-免疫”小鼠中的cluster8区别于cluster9小胶亚群的主要特征基因是p2ry12高表达
[0084]
比较“治愈-免疫”小鼠肿瘤组织中cluster8与cluster9(图10)小胶亚群的主要差异基因。结果显示“治愈-免疫”小鼠中:与cluster9小胶相比,cluster8小胶的高表达p2ry12较明显(图10)。结合图9结果,显然,p2ry12高表达(p2ry12
high
)是“治愈-免疫”小鼠cluster8小胶的最主要标志物。已知p2ry12是正常脑组织小胶发挥吞噬、释放活性氧(ros)的主要受体分子。显然,p2ry12高表达的cluster8小胶也可通过p2ry12分子吞噬并释放ros杀伤肿瘤细胞。
[0085]
(7)cluster8小胶与cluster2、cluster9其他小胶的功能有明显不同
[0086]
我们进一步比较了cluster2、cluster8和cluster9小胶亚群差异基因对细胞通讯的影响,结果发现(图11):cluster8小胶亚群的细胞对话信号通路大多较cluster2显著减弱,其中gas信号通路网络在cluster8缺失;而il-2对话信号通路网络有增强的趋势。已知正常脑组织为免疫免疫器官;而在control小鼠肿瘤生长快速;显然,数量最多、比例最高的cluster2小胶代表了小胶免疫抑制力量。因此,cluster8小胶的信号对话减弱(如gas信号网络)主要体现了其免疫抑制功能的解除。已知il-2是强大的细胞毒t细胞诱导因子,促进肿瘤免疫,具有肿瘤治疗作用。cluster8小胶的il-2信号对话增强与“治愈-免疫”小鼠中cluster8小胶增多、t细胞增多有一致性,反映了cluster8小胶的免疫治疗作用。
[0087]
(8)cluster8小胶在“治愈-免疫”小鼠肿瘤微环境主要发挥免疫治疗作用
[0088]
已知小胶高度异质,其表型或功能与其所处微环境密切相关,受众多病理因素调节。cluster8小胶在“治愈-免疫”小鼠显著增多,其功能也可能受微环境影响。我们比较了“治愈-免疫”和control小鼠的cluster8小胶亚群的基因表达,结果显示两组动物的cluster8小胶亚群的众多基因表达存在差异(图12)。其中,ccl12在“治愈-免疫”小鼠的cluster8小胶表达较control组低。这一结果也支持将ccl12低表达作为“治愈-免疫”小鼠cluster8的标志物之一。
[0089]
通过比较“治愈-免疫”、control小鼠cluster8小胶亚群的差异表达基因,进一步做功能分析。go信号通路富集(图13)结果显示:cluster8小胶亚群在“治愈-免疫”小鼠主要集中在免疫反应或免疫调节功能,如“免疫反应正性调节”、“获得性免疫反应”、“针对其他微生物的防御反应”等。kegg信号通路富集(图14)结果显示:cluster8小胶亚群在“治愈-免疫”小鼠也主要集中在免疫反应或免疫调节功能,如“自然杀伤细胞介导的细胞毒作用”、“细胞因子-细胞因子受体相互作用”、“抗原处理与提呈”等。同样比较“治愈-免疫”、control小鼠cluster9(图15)、cluster2(图16)小胶亚群的差异表达基因,结果显示kegg富
集信号通路集中与免疫通路无关。
[0090]
通过单细胞rna测序及其,我们确认了“治愈-免疫”小鼠的胶质瘤组织中p2ry12
high ccl12
low
(即cluster8)小胶亚群与其自动消退正相关。显然,在“治愈-免疫”小鼠的第一次的联合治疗过程中,已经诱导了p2ry12
high ccl12
low
小胶,而之后的肿瘤再挑战是再次激发p2ry12
high ccl12
low
小胶的过程。因此,我们通过提取联合治疗(替莫唑胺同步放化疗+pd-1抗体+脑红蛋白穿膜肽)有效胶质瘤组织中的cd11b
+
p2ry12
high
小胶(cd11b
+
区分小胶与其他细胞,p2ry12
high
区分p2ry12
high ccl12
low
小胶亚群),将之输注到小鼠原位g422
tn-gbm组织中,以证实p2ry12
high ccl12
low
小胶亚群的功能。结果证明输注cd11b
+
p2ry12
high
小胶显著延长荷瘤小鼠存活时间(***p《0.001,与cd11b
+
p2ry12
low
组相比)。以上结果,证明p2ry12
high ccl12
low
小胶是一个胶质瘤治疗性的小胶亚群,可以应用于临床试验。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1