一种传递姜黄素的岩藻多糖-介孔二氧化硅复合纳米粒子
一种传递姜黄素的岩藻多糖
‑
介孔二氧化硅复合纳米粒子
技术领域
1.本发明涉及载药纳米粒子,具体涉及一种传递姜黄素的岩藻多糖
‑
介孔二氧化硅复合纳米粒子。
背景技术:
2.核/壳纳米结构是一种很有前途的多功能材料,由于负载能力强、比表面积大等优点具有许多潜在的应用,如生物医学中的生物活性分子载体。而介孔二氧化硅复合粒子由于丰富孔隙和易于实现的表面改性,以及上述独特的性质而备受关注。
3.岩藻多糖(fuc)是褐藻中衍生的岩藻糖基硫酸多糖,自身具有抗氧化、抗炎、抗肿瘤、抗菌、抗病毒、抗凝、抗血栓、抗纤、免疫调节等多种生物学活性,进入体内后不仅很少引起副反应,而且还可以辅助所运载的活性物质发挥作用,是一种良好的载药纳米粒子构建材料。
技术实现要素:
4.本发明以介孔二氧化硅(msn)为底物,通过二硫键(ss)交联结构的引入,将岩藻多糖包裹至介孔二氧化硅外层,构建了一类能够实现细胞内药物gsh触发释放药物载体,控制药物姜黄素的定点释放,在药物输送领域具有一定的应用价值。
5.一种传递姜黄素的岩藻多糖
‑
介孔二氧化硅复合纳米粒子的制备,其包括以下步骤:
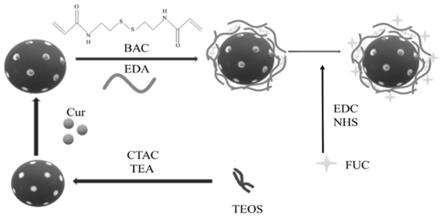
6.1)称取姜黄素(cur)加入无水乙醇配成姜黄素溶液,取姜黄素溶液于msn中,加入10ml pbs磷酸缓冲液于室温避光搅拌12h,得msn
‑
cur溶液;
7.2)将岩藻聚糖(fuc)溶解于含有n
‑
羟基琥珀酰亚胺nhs和1
‑
乙基
‑
碳酰二亚胺edc的二甲基亚砜(dmso)中,然后在黑暗环境下搅拌2h,得岩藻聚糖(fuc)悬浮液;
8.3)将msn
‑
cur溶液超声分散到岩藻聚糖(fuc)悬浮液中,加入乙二胺,使其中的msn:fuc摩尔比为2:1,然后在室温下搅拌24h。
9.4)用水和乙醇离心,3次洗涤去除多余的姜黄素与褐藻多糖溶液,得到复合纳米颗粒,产物分别表示为msn
‑
cur
‑
fuc和msn
‑
cur
‑
ss
‑
fuc。
10.作为优选,所述步骤1)中的姜黄素溶液的溶度为2mg/m l。
11.作为优选,所述步骤1)中的pbs磷酸缓冲液的ph值为7.4。
12.作为优选,所述步骤1)中的msn与姜黄素溶液的重量体积比mg/ml为20:1。
13.作为优选,所述步骤1)中的姜黄素溶液与pbs磷酸缓冲液的体积比1:10。
14.作为优选,所述步骤2)中岩藻聚糖(fuc):n
‑
羟基琥珀酰亚胺nhs:1
‑
乙基
‑
15.碳酰二亚胺edc的重量比为1:2:2。
16.作为优选,所述步骤2)中岩藻聚糖与二甲基亚砜(dmso)的重量体积比mg/ml为10:1。
17.作为优选,所述步骤3)中所述msn
‑
cur溶液与乙二胺的重量体积比mg/ml为50:2。
18.作为优选,所述步骤4)中的离心转速10000r/min,每次5min。
19.本发明以介孔二氧化硅(msn)为底物,通过二硫键(ss)交联结构的引入,将岩藻多糖包裹至介孔二氧化硅外层,构建一类能够实现细胞内药物gsh触发释放药物载体。本发明复合纳米粒子能够对gsh浓度升高做出相应反应,控制药物姜黄素的定点释放,在药物输送领域具有一定的应用价值。
附图说明
20.图1为实施例1msn
‑
cur
‑
ss
‑
fuc复合纳米颗粒的合成图。
21.图2为实施例2纳米粒子表面电荷,粒径和纳米粒径分散图。
22.图3为实施例3不同比例的纳米粒子的透射电镜tem图。
23.其中,c,d,e,f分别代表不同比例(msn:fuc=3:1,2:1,1:1,1:2)。
24.图4为实施例4msn
‑
cur
‑
ss
‑
fuc复合纳米颗粒的sem图。
25.图5为实施例5不同纳米粒子的热重分析图。
26.图6为实施例6为msn
‑
cur
‑
ss
‑
fuc复合纳米颗粒中加入到含有不同浓度gsh的pbs紫外可见光谱分析图。
27.图7为实施例7不同ph条件下msn
‑
cur
‑
ss
‑
fuc和msn
‑
cur的体外释放情况对比图。
具体实施方式
28.下列实施例用于进一步解释说明本发明,但是,它们并不构成对本发明范围的限制或限定。
29.实施例1
30.1)称取姜黄素(cur)50mg加入25ml无水乙醇配成2mg/m l姜黄素溶液,取1m l姜黄素溶液于20mg msn中,加入10ml pbs(ph7.4,由磷酸二氢钠nah2po4,na2hpo4和k2hpo4配制)于室温避光搅拌12h;
31.2)将50mg岩藻聚糖(fuc)溶解于含有100mg nhs和100mg edc的5.0ml二甲基亚砜(dmso)中,然后在黑暗环境下搅拌2h。将50mg msn
‑
cur溶液超声分散到岩藻聚糖(fuc)悬浮液中,加入乙二胺(2ml),在没有或存在bac(0.1mg/ml)的情况下达到msn:fuc比为2:1,然后在室温下搅拌24h。
32.3)用水和乙醇离心洗涤(5ml h2o,转速10000r/min,每次5min)3次洗去多余的姜黄素与褐藻多糖溶液,得到复合纳米颗粒,产物分别表示为msn
‑
cur
‑
fuc和msn
‑
cur
‑
ss
‑
fuc,见附图1。
33.实施例2
34.zeta电势(zeta
‑
potential)用于表征纳米粒子表面电荷,粒径和纳米粒径分散情况。采用英国malvern公司的nano zs90纳米粒径电位分析仪进行zeta电势和size粒径的表征。称取样品,用去离子水分散,测量前超声15min,移取悬浊液于专用样品池中,选择分散剂为水的模式下进行测量(平行测定三次)。
35.msn
‑
cur
‑
ss
‑
fuc纳米粒子的粒径稍大,这主要是由于使用bac交联剂结合更加紧密。在图中显示,msn与fuc为2:1时,其粒径更小显示为最优比例。结果见图2。
36.实施例3
37.电镜采用tem图像通过日本jem
‑
2100透射电子显微镜测试获得。适量的纳米粒子粉末样品均匀地铺在导电铜网上,进行tem扫描。
38.图c,d,e,f分别是不同比例(msn:fuc=3:1,2:1,1:1,1:2)制备的纳米粒子的透射电镜tem图像。在tem中看到纳米粒子呈现圆形,粒径约为50nm,与扫描电镜下基本一致,随着fuc的增加,纳米粒子的tem图变化出现规律性的特征,当msn与fuc比例为1∶1与1∶2时,外层的大片灰色物质为多糖,msn被多糖严重覆盖,大部分团聚在多糖中,看不清粒子结构,并不能分散出来,大部分多糖剩余。这两个比列不适合实验。当msn与fuc比例为2∶1时,可以清晰看到复合纳米粒子的原貌,且多糖包覆在msn表面,聚集现象减弱,没有观察到其介孔结构,其孔隙被填充,说明多糖完美的富集在粒子表面,该比例较为合适。而比例为3∶1时,基本看不到多糖包裹粒子的现象,这与多糖较少或者部分脱离进入msn内部有关。结果见图3。
39.实施例4
40.采用sem(s
‑
4800)来评价纳米粒子的表面形貌。所有纳米粒子均匀吹散至硅片上,真空中镀金膜后在20kv的加速电压下以适当的放大倍数观察这些样品。
41.通过sem测试可以发现,可以观察到粒子的孔道模糊,表明多糖严密包裹了msn,且cur顺利进入到孔隙中,纳米粒子的粒径略微增加。其外层的灰色阴影为多糖,由于多糖的粘连效果,结果见图4。
42.实施例5
43.热重分析(tga)在日本岛津公司tga
‑
50型热分析仪上于在氮气流下加热速度为10℃/min进行。称取适量样品置于坩埚中,待仪器校正过后设置测试区间37
‑
800℃。
44.此外,热重分析(tga)如图5所示。由室温至78℃三种材料的重量同时损失,此时损失的是表面吸附水,仅损失11.1%,表明msn具有很好的热稳定性。继续升温msn粒子的重量损失趋于平稳,msn
‑
ss
‑
fuc和msn
‑
cur
‑
ss
‑
fuc的重量仍然下降。当温度升高至800℃时,msn、msn
‑
ss
‑
fuc和msn
‑
cur
‑
ss
‑
fuc的重量损失分别为12.3%、49.6%和50.1%,成功证实fuc已接枝到msn表面,由于其在高温下,易降导致较高的失重率。这进一步表明每个步骤的成功修改,姜黄素成功装载入了孔道。
45.实施例6
46.为了确定姜黄素聚合物的降解率,将纳米制剂(含或不含bac交联剂)加入到含有不同浓度gsh的pbs(ph 5.0)中24小时。离心后,从上清液中收集姜黄素,并用紫外
‑
可见光谱分析。结果如图6。
47.随着gsh浓度的增加,上清液中姜黄素的吸光度增加,说明被释放出姜黄素的量增加,表明gsh的浓度与纳米制剂释放姜黄素的量呈正相关。在相同浓度的gsh作用下,交联的比未交联的纳米制剂具有更快的姜黄素释放速率,说明姜黄素聚合物的水解速率与二硫键的存在有关,这些结果证实了二硫键交联的纳米粒子在不含gsh或含有较低浓度gsh的缓冲溶液中能够保持相对稳定状态,保护了姜黄素。
48.实施例7
49.由于肿瘤环境为微酸状态,我们考察了同时在ph 7.4和ph 5.0条件下的pbs溶液(含或不含20mm/l gsh)中msn
‑
cur
‑
ss
‑
fuc和msn
‑
cur的体外释放情况。结果如图7。
50.两者共同刺激作用下使纳米制剂从msn的孔道中快速释放cur。这些结果表明,fuc外层能有效避免孔道内药物泄露,在ph和gsh的双重刺激下才会快速释药,具有良好的药物
控制释放能力。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1