CXCR2抑制剂在改善肿瘤免疫微环境中的应用
cxcr2抑制剂在改善肿瘤免疫微环境中的应用
技术领域
1.本发明涉及肿瘤免疫领域,具体涉及cxcr2抑制剂在改善肿瘤免疫微环境中的应用。
背景技术:
2.肿瘤相关巨噬细胞(tumor-associated macro-phages,tams)是浸润在肿瘤组织中的巨噬细胞,其作为肿瘤基质的重要组分,是肿瘤微环境中数量最多的免疫细胞。近年来,许多研究表明tams可诱导免疫抑制,能够加速肿瘤细胞生长和侵袭转移、促进肿瘤血管的发生和稳定,与肿瘤的发生、发展密切相关。
3.肿瘤细胞与肿瘤微环境之间的相互作用是促成恶性肿瘤转移的必要条件。肿瘤微环境主要由细胞外基质、可溶性分子和肿瘤间质细胞等共同构成的局部内环境。肿瘤细胞对周围微环境的改造往往是从驱动间质细胞向特定表型转化开始的,进而形成一种由后者主导的动态变化的内环境。在这些间质细胞中,免疫和炎症细胞等肿瘤间质细胞的活化对于肿瘤微环境的塑造尤为重要。由此可见,改善肿瘤免疫微环境对肿瘤免疫以及临床用药至关重要。
技术实现要素:
4.本发明提供了cxcr2抑制剂在改善肿瘤免疫微环境中的应用,利用cxcr2抑制剂对肿瘤免疫微环境进行改善,从而抑制肿瘤细胞的生长和侵袭转移。
5.根据本发明的第一个方面,提供cxcr2抑制剂在改善肿瘤免疫微环境中的应用。
6.肿瘤相关巨噬细胞(tams)是肿瘤微环境中最为重要的免疫细胞。根据分子表型与功能特征,巨噬细胞可分成m1型巨噬细胞和m2型巨噬细胞两大类型,二者的基因表达模式存在着很大的差异,各自受完全不同的基因调控系统所支配。肿瘤组织中的巨噬细胞多具有m2型巨噬细胞的表型和功能,提示肿瘤组织存在促使巨噬细胞主要朝着m2型巨噬细胞分化的特殊微环境,而m2型巨噬细胞具有双向分化潜能,即具有既杀伤肿瘤细胞又促进肿瘤细胞生长的双重作用。本发明把cxcr2抑制剂应用于制备治疗肿瘤的药物中,能够有效地诱导tams向m1型巨噬细胞极化,进而改善肿瘤免疫微环境,促进巨噬细胞对肿瘤的杀伤作用的同时降低巨噬细胞对肿瘤生长的促进作用,在增进或改善肿瘤治疗疗效方面产生积极的影响。
7.优选地,肿瘤为非霍奇金淋巴瘤。非霍奇金淋巴瘤是一类异质性极强的恶性肿瘤,主要包括t细胞淋巴瘤和b细胞淋巴瘤,约占淋巴瘤的90%,发病率非常高。本方案利用cxcr2抑制剂促进非霍奇金淋巴瘤组织中的巨噬细胞向m1型巨噬细胞极化,进而改善非霍奇金淋巴瘤中的免疫微环境,以提高非霍奇金淋巴瘤的后续用药疗效。
8.优选地,非霍奇金淋巴瘤为套细胞淋巴瘤。套细胞淋巴瘤属于非霍奇金淋巴瘤分型中的b细胞侵袭淋巴瘤,其恶性程度较高,病情进展快,预后较差,生存率极低,本方案利用cxcr2抑制剂改善套细胞淋巴瘤中的免疫微环境,能够在一定程度上延缓病情进展、提高
预后和生存率。
9.优选地,cxcr2抑制剂选自sb225002、azd5069、danirixin、nicotinamide n-oxide中的至少一种。
10.优选地,cxcr2抑制剂为sb225002。
11.优选地,采用btk抑制剂与cxcr2抑制剂配合使用。
12.优选地,btk抑制剂为伊布替尼。
13.优选地,cxcr2抑制剂与btk抑制剂的浓度比为1:1-2。
14.btk抑制剂主要通过抑制b细胞淋巴瘤中异常激活的btk信号通路来抑制肿瘤细胞的增殖,在多项临床研究中显示出卓越的疗效,btk抑制剂也常用于淋巴瘤的治疗。然而,仍有部分患者在接受btk抑制剂的治疗后,出现病情持续进展、病灶残留或短期内复发等情况。采用cxcr2抑制剂(sb225002)与btk抑制剂配合使用能够进一步改善肿瘤的免疫微环境,并且cxcr2抑制剂与btk抑制剂联合使用具有协同抗肿瘤作用,使得肿瘤患者的生存率大大提高。
15.根据本发明的第二个方面,提供一种用于改善肿瘤免疫微环境的组合物,该组合物的有效成分包括cxcr2抑制剂,该cxcr2抑制剂能够促进m2型巨噬细胞向m1型巨噬细胞极化。
16.本方案提供的组合物的有效成分包括cxcr2抑制剂,能够促进m2型巨噬细胞向m1型细胞极化,有效地改善肿瘤免疫微环境,对肿瘤的药物治疗具有极其重要的临床意义。
17.优选地,cxcr2抑制剂选自sb225002、azd5069、danirixin、nicotinamide n-oxide中的至少一种。
18.优选地,cxcr2抑制剂为sb225002。
19.优选地,上述组合物的有效成分还包括btk抑制剂。
20.优选地,上述组合物中的btk抑制剂为伊布替尼。
21.优选地,上述组合物中cxcr2抑制剂与btk抑制剂的浓度比为1:1-2。
22.肿瘤进展往往涉及到肿瘤与肿瘤免疫微环境的相互作用,本发明把cxcr2抑制剂应用于抗肿瘤药物的制备中,能够促进m2型巨噬细胞向m1型巨噬细胞极化,从而改善肿瘤免疫微环境,能够延缓肿瘤进展,提高肿瘤患者的生存率,对肿瘤的临床治疗意义重大。
附图说明
23.图1为本发明的巨噬细胞与mcl细胞共培养后的巨噬细胞表型变化图。
24.图2为本发明的伊布替尼和sb225002对共培养体系中的巨噬细胞表型变化影响图。
25.图3为伊布替尼和sb225002在体内对巨噬细胞表型变化影响图。
具体实施方式
26.下面结合具体实施方式对本发明提供的技术方案中的技术特征作进一步清楚、完整的描述,显然,所描述的实施例仅仅是本发明一部分实施例,而不是全部的实施例。基于本发明中的实施例,本领域技术人员在没有做出创造性劳动前提下所获得的所有其他实施例,都属于本发明保护的范围。
27.实施例1
28.从美国菌种保存中心(american type culture collection,atcc,usa)购买人源细胞淋巴瘤(mcl)细胞系mino和jeko-1,均采用含10%-20%的胎牛血清(fetal bovine serum,fbs,gibco,usa)的rpmi-1640(invitrogen,usa)培养基在37℃,5%co2的培养箱(thermo electron corporation,美国)中培养,得到mino细胞系和jeko-1细胞系。
29.实施例2
30.在获得书面知情同意书后,抽取人外周血5-10ml至edta抗凝管中,1500rpm离心10min,吸弃上清。将人外周血标本与pbs缓冲液(磷酸缓冲液,ph7.4)以1:1的混合比进行稀释后加入50ml离心管中。
31.将ficoll(聚蔗糖)溶液在避光条件下放至室温,备用。向15ml离心管中加入4ml ficoll溶液,向其中缓慢加入5ml上述稀释后的血液,1500rpm离心15min。经过离心后,离心管中的内容物分为三层,上层为血浆(内含细胞碎片),中间层为分层液,底层为红细胞,在上、中层液体界面处可以观察到乳白混浊的单核细胞层(较薄的白膜层),吸弃上清至白膜层上2-3mm处,将白膜层转移至干净的15ml离心管中,向其中加入10ml pbs缓冲液,1000rpm离心10min,利用pbs缓冲液重复清洗2次。随后用pbs缓冲液重悬细胞,于显微镜下计数。根据计数结果,每1
×
107个细胞用80μl pbs缓冲液进行重悬,并加入20μl可以吸附cd14
+
单核细胞的磁珠(130-050-201,美天旎,德国),于冰上孵育15min,然后用1-2ml pbs缓冲液清洗一次,再重悬细胞至3ml。将得到的重悬液加入ls分选柱(130-093-545,美天旎,德国),洗两次,将磁极(130-042-301,美天旎,德国)从分选柱上拿下,并用pbs缓冲液将目的细胞冲洗下来,计数后,1500rpm离心10min,用含有人巨噬细胞集落刺激因子(macrophage-colony stimulating factor,m-csf,150ng/ml,peprotech,rocky hill,nj)的培养基进行重悬,种板,得到人源巨噬细胞。
32.实施例3
33.设置两组单独培养的巨噬细胞作为对照组(control),培养一段时间后,收集单细胞,利用流式细胞技术检测巨噬细胞的表型,随后将实施例1得到的mino细胞系、jeko-1细胞系分别加入到两组巨噬细胞培养体系中作为实验组(coculture),进行共培养一段时间后,收集单细胞,利用流式细胞技术对共培养体系中巨噬细胞的表型进行检测。
34.利用流式细胞技术检测巨噬细胞表型的具体操作步骤如下:
35.(1)用1
×
pbs缓冲液稀释死细胞染料fixable viability stain 700(fvs700)(1:4000),向收集的每组单细胞悬液中加入1ml死细胞染液,轻柔混匀,置于冰上避光孵育10-15min,最后加入2ml染色缓冲液以终止染色,将细胞悬液在4℃,1500rpm下离心5min,舍弃上清液,洗涤细胞沉淀一次,重悬细胞沉淀;
36.(2)将收集好的单细胞悬液用500ul 1
×
bingding buffer重悬至细胞密度约1
×
106个/ml;
37.(3)将流式抗体与染色缓冲液预混,每100ul细胞悬液中加入2-5μl的bv421荧光标记的抗cd68流式抗体(bd biosciences,no.564943),fitc荧光标记的抗cd86流式抗体(bd biosciences,no.555657)和pe荧光标记的抗cd206荧光抗体(biolegend,no.321105),轻弹管壁以混匀。同时另外留一管单细胞悬液,加入与检测项目无关的荧光标记的单抗,作为对照组;
38.(4)抗体与细胞在冰上避光孵育30min;
39.(5)孵育结束后,用1ml的1
×
bingding buffer终止染色,在4℃,1500rpm下离心5min,舍弃上清,加入1
×
pbs缓冲液,重复上述离心步骤,最后收集细胞沉淀,用1
×
bingding buffer将细胞密度调整约为1
×
106个/ml,上机检测。
40.共培养前后巨噬细胞的表型变化如图1所示。由图1可知,与mino、jeko-1细胞系共培养前(对照组),m2型巨噬细胞与m1型巨噬细胞的比值较低,均小于2,说明此时巨噬细胞的表型主要以m2型为主,而与mino、jeko-1共培养后(共培养组),m2型巨噬细胞与m1型巨噬细胞的比值均显著增高,即m2型巨噬细胞的数量显著增加,这说明巨噬细胞与mino、jeko-1细胞系共培养后,能够促进巨噬细胞向m2型巨噬细胞极化。
41.实施例4
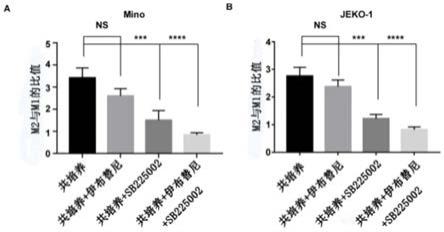
42.将实施例2所得的巨噬细胞分别与实施例1所得的mino细胞系、jeko-1细胞系在体外进行共培养,巨噬细胞与mino细胞系、jeko-1细胞系共培养体系各设置4个实验组,随后向共培养体系中分别加入伊布替尼(共培养+伊布替尼组)、sb225002(共培养+sb225002组)、伊布替尼和sb225002(共培养+伊布替尼+sb225002组),并设置两个不加伊布替尼和/或sb225002的共培养体系作为空白对照组(共培养组),共培养一段时间后,收集单细胞,利用流式细胞技术对共培养体系中巨噬细胞的表型进行检测,巨噬细胞的表型检测结果如图2所示。
43.有研究表明伊布替尼直接作用于巨噬细胞会导致巨噬细胞的吞噬功能下降,而伊布替尼作用于肿瘤细胞,则会导致肿瘤细胞分泌的促m2型极化细胞因子分泌减少。因此,伊布替尼对肿瘤免疫微环境而言是把双刃剑。
44.由图2可知,在共培养体系中加入伊布替尼(共培养+伊布替尼组)能够在一定程度上降低m2型巨噬细胞与m1型巨噬细胞的比值,但其比值与原共培养体系(共培养组)中m2型巨噬细胞与m1型巨噬细胞的比值无显著性差异;在共培养体系中加入sb225002之后(共培养+sb225002组),m2型巨噬细胞与m1型巨噬细胞的比值显著低于加入伊布替尼的共培养体系;在共培养体系中同时加入伊布替尼和sb225002(共培养+伊布替尼+sb225002组),m2型巨噬细胞与m1型巨噬细胞的比值显著低于仅加入伊布替尼或sb225002的共培养体系。上述结果说明,伊布替尼单药对肿瘤相关巨噬细胞(tams)有促进m1型极化的作用,但效果不显著,sb225002或sb225002联合伊布替尼则可以明显逆转共培养诱导的m2型极化。因此,sb225002可以在体外促进共培养体系中的巨噬细胞向m1型极化,进而改善肿瘤免疫微环境。
45.实施例5
46.将mino细胞(5
×
106/μl)与人源巨噬细胞(5
×
106/μl)按照1:1的比例进行混合,分别接种于2组小鼠(10只)的腹股沟区域,接种14天后,形成可触摸的皮下瘤,其中一组开始接受伊布替尼灌胃处理(共培养+伊布替尼组),另外一组接受伊布替尼联合sb225002灌胃处理(共培养+伊布替尼+sb225002组),5mg/kg,每周连续用药5天,休息2天,共2周。将小鼠的皮下瘤组织制成单细胞悬液,并用流式细胞技术检测各处理组tams的极化情况,结果如图3中的内图a所示。由图3a的巨噬细胞表型结果可知,经过伊布替尼单药处理的肿瘤组织中m2型巨噬细胞与m1型巨噬细胞的比值显著高于伊布替尼联合sb225002处理组的比值。
47.此外,还利用多重染色技术对小鼠皮下瘤组织中tams表型变化进行了进一步分
析,结果如图3中的内图b、c所示。由图3中的内图b、c的多重染色结果和tams表型变化结果可知,经过伊布替尼单药处理的小鼠皮下瘤组织中m2型tams与m1型tams的比值较大(共培养+伊布替尼组),而经过伊布替尼联合sb225002处理(共培养+伊布替尼+sb225002组)的小鼠皮下瘤组织中m2型tams与m1型tams的比值显著低于单独伊布替尼处理组的比值。
48.综上所述,sb225002可以通过促进m2型巨噬细胞向m1型巨噬细胞转化,改善肿瘤免疫微环境,进而改善肿瘤对药物的敏感性。
49.以上实施例仅用以说明本发明的技术方案而非对本发明保护范围的限制,尽管参照上述实施例对本发明进行了详细的说明,所属领域的普通技术人员应当理解,可以对本发明的技术方案进行修改或者等同替换,但这些修改或替换均在本发明的保护范围之内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1