腺苷激酶抑制剂在制备抗冠状病毒制剂中的应用
1.本发明涉及生物医药技术领域,具体地说,涉及腺苷激酶抑制剂在制备抗冠状病毒制剂中的应用。
背景技术:
2.新型冠状病毒肺炎(corona virus disease 2019,covid
‑
19)严重威胁人类健康,是由新型冠状病毒(severe acute respiratory syndrome coronavirus 2,sars
‑
cov
‑
2)引起的。抗新型冠状病毒病的新药发现,是防控措施的重要组成部分,新药发现将为临床防治新型冠状病毒病提供重要的治疗方案。
3.基因测序结果表明,sars
‑
cov
‑
2与sars
‑
cov和mers
‑
cov一样,同属于冠状病毒β属,与sars
‑
cov的基因序列同源性为75%~80%,与蝙蝠sars样冠状病毒(bat
‑
sl
‑
covzc45)的同源性超过85%。与sars
‑
cov病毒相比,sars
‑
cov
‑
2病毒具有更强的感染性,其感染系数(r0)可达5.7(sars
‑
cov为2.0左右),同时潜伏期为7
‑
14天,大大超过了sars
‑
cov(2
‑
7天),并有大量具有传染能力的无症状感染者,病毒的防控面临巨大挑战。
4.疫苗和抗病毒药物是防治新冠病毒的最有效手段。老药新用是寻找抗sars
‑
cov
‑
2病毒药物的重要思路,who推出4种最有希望的新冠肺炎治疗方案:瑞德西韦、氯喹和羟氯喹、洛匹那韦/利托那韦以及洛匹那韦/利托那韦/阿比多尔。多数核苷类似物整合到病毒rna时,会被冠状病毒表达的非结构性蛋白nsp14外切酶(nonstructural protein nsp14 exoribonuclease,nsp14
‑
exon)切除,但瑞德西韦对于nsp14
‑
exon具有抗性,这使其优于其他核苷类似物。然而随后的临床试验研究表明这些药物副作用大及疗效不显著,不适用于广泛的抗sars
‑
cov
‑
2治疗。因此,仍有必要研发新型抗新冠感染有效治疗药物。
5.sars
‑
cov
‑
2病毒是正股单链rna病毒,sars
‑
cov
‑
2基因组长度为29.8kb~29.9kb。目前认为其生活周期包括病毒吸附进入,脱衣壳,基因组转录和复制,病毒蛋白合成,组装和释放等过程。病毒编码16个非结构蛋白(nsp1~nsp16)。这16种nsps中的一些是sars
‑
cov
‑
2复制所必需的酶。其中包括木瓜样蛋白酶(nsp3)、胰凝乳蛋白酶样蛋白酶(3cl蛋白酶,nsp5)、引物酶复合物(nsp7
‑
nsp8)、rna依赖的rna聚合酶rdrp(nsp12)、解旋酶(nsp13)和外切酶(nsp14),这些都是抗sars
‑
cov
‑
2药物开发的潜在靶点。
6.新冠病毒rna依赖的rna聚合酶(rna dependent polymerase,rdrp)主要负责病毒rna的复制,是研究广谱抗病毒药物靶点。一方面,新冠病毒的rna聚合酶是由病毒自身编码的rna依赖的rna聚合酶与哺乳动物细胞内的dna依赖的rna聚合酶完全不同;另外,新冠病毒编码聚合酶各亚基的基因序列在不同新冠病毒毒株间高度保守,使得新冠病毒rna聚合酶是极赋潜力的抗新冠病毒药物靶标。研究表明rdrp的形成需要病毒的辅助因子nsp7和nsp8的参与。核苷类似物作为rdrp的广谱抑制剂,通过病毒的rdrp结合,占据核苷结合空间使rna的合成受阻,从而发挥抗病毒作用。由美国吉利德(gilead)公司研发的一种新型核苷类似物前药瑞德西韦(remdesivir,gs
‑
5734),静脉注射给药后在体内代谢为gs
‑
441542,而gs
‑
441542进一步被三磷酸化为具有药理学活性的三磷酸核苷(ntp)。病毒在进入细胞后,
rdrp和细胞竞争性结合核苷。由于细胞的rna聚合酶不能识别瑞德西韦这类核苷类似物,因此不会受到影响。同样,其他的核苷类似物只有在体内被代谢为三磷酸化才能具有抗病毒的效果。这种复杂的作用机制严重制约了酶活分析方法的发展,直接影响了以新冠rdrp为靶点的药物筛选和研发。虽然在基础研究中,可以从纯化的病毒颗粒中分离到具有活性的rdrp,但这种高成本低收率的实验方法难以应用于大规模的药物筛选和药效评价。
[0007]5‑
碘杀结核菌素(iodotubercidin,itu)是一种广泛的激酶抑制剂,包括cdc2样激酶(clks)、双特异性酪氨酸(y)磷酸化调节激酶(dual
‑
specificity tyrosine(y)
‑
phosphorylation
‑
regulated kinases,dyrks)等,尤其是腺苷激酶(adenosine kinase,adk)的抑制剂,可对细胞的增殖和生存产生影响。5
‑
碘杀结核菌素作为腺苷激酶的抑制剂被广泛使用。细胞内腺苷激酶是腺苷再摄取及代谢的关键酶,其通过将胞内腺苷转化为amp而调节细胞内腺苷水平,通过抑制腺苷激酶活性则可有效提高细胞微环境腺苷水平。而以腺苷激酶为靶点的干预措施可造成体内腺苷稳态失衡,其在癫痫、退行性神经疾病以及精神疾病方面发挥重要作用。
‑
张晓敏等(张晓敏.5
‑
碘代杀结核菌素诱导神经管畸形及其机制研究[d].山西医科大学)研究发现,5
‑
碘杀结核菌素可引起结肠癌细胞hct
‑
116的dna损伤,激活amp
‑
p53途径,引起p53基因表达上调,促进结肠癌细胞凋亡;同时应用5
‑
碘杀结核菌素还可使裸鼠的结肠癌肿瘤迅速缩小,而对照组则依然正常生长;因此推测5
‑
碘杀结核菌素可能是一种新的基因毒药物,具有化疗作用的潜能。张灵敏(张灵敏,王亚旭,谢凯,等.5
‑
碘代杀结核菌素对ht
‑
29细胞dlc
‑
1基因的去甲基化作用[j].第三军医大学学报,2015,37(002):106
‑
110)研究发现,5
‑
碘杀结核菌素可抑制结肠癌细胞ht
‑
29的增殖、诱导结肠癌细胞凋亡,并预测5
‑
碘杀结核菌素可能作为一种新的化疗药物。另外,孟祥智(孟祥智.cd44靶向纳米脂质体装载的iodotubercidin对乳腺癌肿瘤干细胞作用的研究[d].南开大学)研究发现,5
‑
碘杀结核菌素可以降低乳腺癌细胞mda
‑
mb
‑
231及肺癌细胞h460中侧群细胞的比例,可能对乳腺癌干细胞起到抑制作用。这表明5
‑
碘杀结核菌素具有不同的生物学活性,针对冠状病毒有效的化合物仍有待开发研究。
技术实现要素:
[0008]
本发明的目的是提供腺苷激酶抑制剂在制备抗冠状病毒制剂中的应用。
[0009]
为了实现本发明目的,第一方面,本发明提供腺苷激酶抑制剂在制备抗冠状病毒制剂中的应用,所述腺苷激酶抑制剂为5
‑
碘代杀结核菌素,其结构如式i所示:
[0010][0011]
所述冠状病毒包括sars
‑
cov
‑
2,如hcov
‑
oc43和hcov
‑
nl63等。
[0012]
本发明发现一种可有效抑制sars
‑
cov
‑
2rdrp的化合物,并利用gaussia luciferase(gluc)报告基因,成功建立了细胞水平cov
‑
rdrp
‑
gluc报告系统,通过建立的该
细胞水平sars
‑
cov
‑
2rdrp高通量报告系统,借由检测荧光强度对新冠病毒rdrp活性进行了定量分析验证。并通过qrt
‑
pcr实验,检测了本发明cov
‑
rdrp
‑
gluc系统中gluc正链和负链rna水平的变化,发现5
‑
碘代杀结核菌素能够显著降低gluc正链和负链rna的水平。接着,本发明又利用sars
‑
cov
‑
2rdrp外切酶模型进一步验证,发现该化合物依旧能够表现出对sars
‑
cov
‑
2外切酶nsp14具有很好的抗性。从而最终说明了式i化合物对冠状病毒抑制的有效性。
[0013]
第二方面,本发明提供一种抗冠状病毒药物,活性成分为5
‑
碘代杀结核菌素。
[0014]
进一步地,所述药物还包含药学上可接受的助剂。
[0015]
所述助剂包括载体、赋形剂或稀释剂等中的一种或多种。
[0016]
载体材料包括但不限于水溶性载体材料(如聚乙二醇、聚乙烯吡咯烷酮、有机酸等)、难溶性载体材料(如乙基纤维素、胆固醇硬脂酸酯等)、肠溶性载体材料(如醋酸纤维素酞酸酯和羧甲乙纤维素等)。优选水溶性载体材料。使用这些材料可以制成多种剂型,包括但不限于片剂、胶囊、滴丸、气雾剂、丸剂、粉剂、溶液剂、混悬剂、乳剂、颗粒剂、脂质体、透皮剂、口含片、栓剂、冻干粉针剂等。可以是普通制剂、缓释制剂、控释制剂及各种微粒给药系统。为了将单位给药剂型制成片剂,可以广泛使用本领域公知的各种载体。例如稀释剂与吸收剂,如淀粉、糊精、硫酸钙、乳糖、甘露醇、蔗糖、氯化钠、葡萄糖、尿素、碳酸钙、白陶土、微晶纤维素、硅酸铝等;湿润剂与粘合剂,如水、甘油、聚乙二醇、乙醇、丙醇、淀粉浆、糊精、糖浆、蜂蜜、葡萄糖溶液、阿拉伯胶浆、明胶浆、羧甲基纤维素钠、紫胶、甲基纤维素、磷酸钾、聚乙烯吡咯烷酮等;崩解剂,如干燥淀粉、海藻酸盐、琼脂粉、褐藻淀粉、碳酸氢钠与枸橼酸、碳酸钙、聚氧乙烯、山梨糖醇脂肪酸酯、十二烷基磺酸钠、甲基纤维素、乙基纤维素等;崩解抑制剂,如蔗糖、三硬脂酸甘油酯、可可脂、氢化油等;吸收促进剂,例如季铵盐、十二烷基硫酸钠等;润滑剂,如滑石粉、二氧化硅、玉米淀粉、硬脂酸盐、硼酸、液体石蜡、聚乙二醇等。还可以将片剂进一步制成包衣片,如糖包衣片、薄膜包衣片、肠溶包衣片,或双层片和多层片。为了将单位给药剂型制成丸剂,可以广泛使用本领域公知的各种载体。例如稀释剂与吸收剂,如葡萄糖、乳糖、淀粉、可可脂、氢化植物油、聚乙烯吡咯烷酮、gelucire、高岭土、滑石粉等;粘合剂,如阿拉伯胶、黄蓍胶、明胶、乙醇、蜂蜜、液糖、米糊或面糊等;崩解剂,如琼脂粉、干燥淀粉、海藻酸盐、十二烷基磺酸钠、甲基纤维素、乙基纤维素等。为了将单位给药剂型制成栓剂,可以广泛使用本领域公知的各种载体。例如聚乙二醇、卵磷脂、可可脂、高级醇、高级醇的酯、明胶、半合成甘油酯等。为了将单位给药剂型制成注射用制剂,如溶液剂、乳剂、冻干粉针剂和混悬剂,可以使用本领域常用的所有稀释剂,例如,水、乙醇、聚乙二醇、1,3
‑
丙二醇、乙氧基化的异硬脂醇、多氧化的异硬脂醇、聚氧乙烯山梨醇脂肪酸酯等。另外,为了制备等渗注射液,可以向注射用制剂中添加适量的氯化钠、葡萄糖或甘油,此外,还可以添加常规的助溶剂、缓冲剂、ph调节剂等。此外,根据实际需要,也可以向药物制剂中添加着色剂、防腐剂、香料、矫味剂、甜味剂或其它材料。使用上述剂型可以经注射给药,包括皮下注射、静脉注射、肌肉注射和腔内注射等;腔道给药,如经直肠和阴道;呼吸道给药,如经鼻腔;粘膜给药。上述给药途径优选为口服或注射(静脉注射)给药。
[0017]
本发明首次发现5
‑
碘代杀结核菌素能够抑制新冠病毒sars
‑
cov
‑
2rna依赖的rna聚合酶活性进而抑制新冠病毒的复制,并可有效抑制冠状病毒hcov
‑
oc43和hcov
‑
nl63的复制,为研发新型抗新冠病毒先导化合物提供关键数据,同时为研发covid
‑
19有效治疗药物
提供理论依据。也可用于制备抗多种类型的冠状病毒的药物中。
[0018]
第三方面,本发明提供腺苷激酶抑制剂在抗冠状病毒中的应用。
[0019]
所述腺苷激酶抑制剂为5
‑
碘代杀结核菌素,
[0020]
所述冠状病毒包括sars
‑
cov
‑
2,如hcov
‑
oc43和hcov
‑
nl63等。
[0021]
与现有技术相比,本发明至少具有以下优点:
[0022]5‑
碘代杀结核菌素在低细胞毒性的条件下,能够表现出很好的抑制新冠病毒sars
‑
cov
‑
2rdrp的活性,且这种抑制效果在cov
‑
rdrp
‑
gluc rna水平上也得到了验证。因此,该化合物有望发展成为临床上sars
‑
cov
‑
2rdrp的小分子抑制剂。此外,本发明还发现该化合物能够有效抑制hcov
‑
oc43和hcov
‑
nl63病毒的复制。
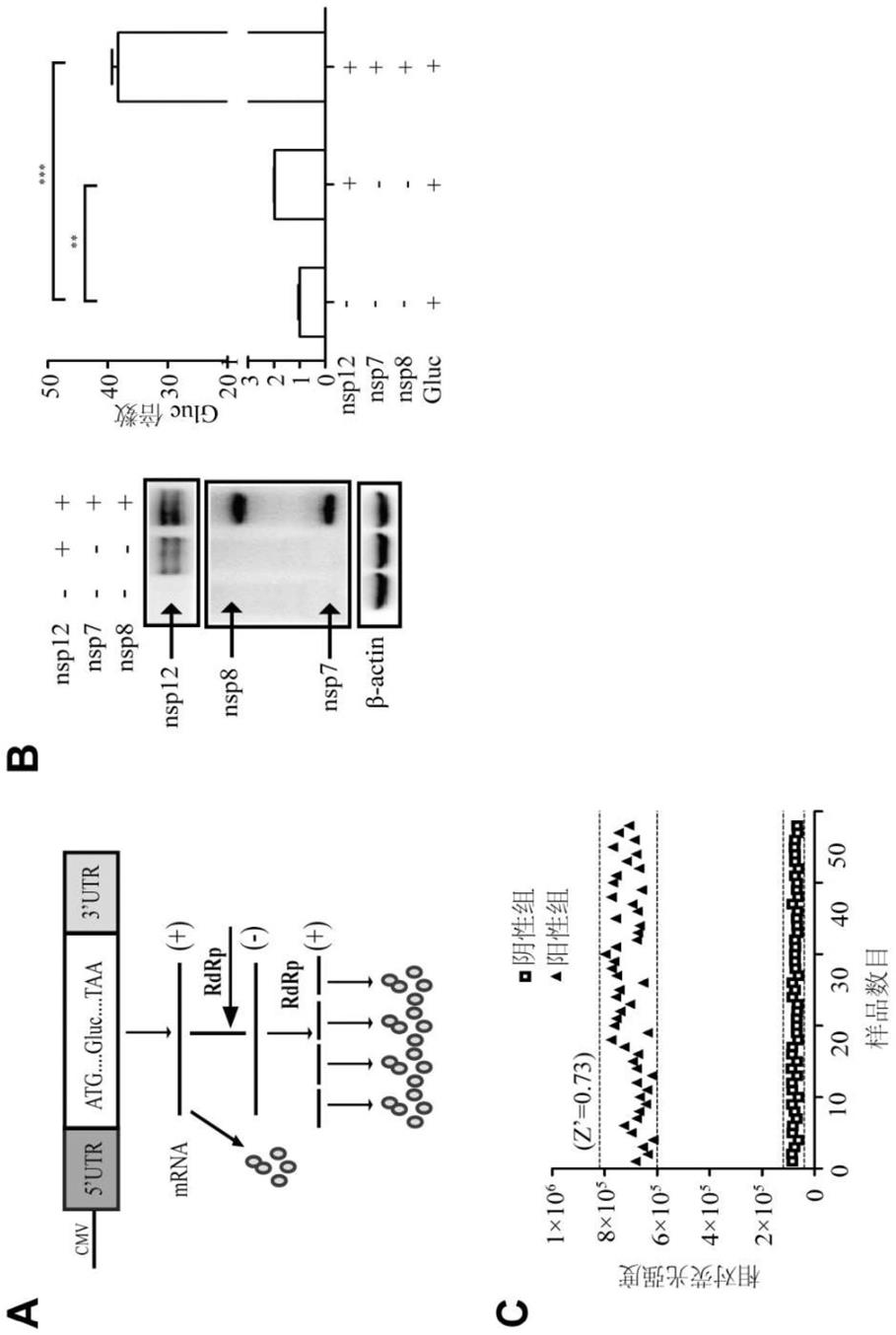
附图说明
[0023]
图1为本发明实施例1的报告系统构建原理示意图及验证结果图;其中,a为利用cov
‑
rdrp
‑
gluc报告系统构建原理示意图;b中的左图为利用western blot检测cov
‑
rdrp
‑
gluc报告系统中nsp12、nsp7、nsp8蛋白的表达结果;b中的右图为利用酶标仪centro xs
3 lb 960检测cov
‑
rdrp
‑
gluc报告系统中各组gluc的表达结果;c为cov
‑
rdrp
‑
gluc报告系统用于高通量检测的z’因子检测结果。
[0024]
图2为本发明实施例2中sars
‑
cov
‑
2rna依赖的rna聚合酶的抑制效果图;其中,a为化合物5
‑
碘代杀结核菌素、瑞德西韦对sars
‑
cov
‑
2rna依赖的rna聚合酶的抑制率结果图;b为化合物5
‑
碘代杀结核菌素对sars
‑
cov
‑
2rna依赖的rna聚合酶的ec
50
结果图;c为阳性化合物瑞德西韦对sars
‑
cov
‑
2rna依赖的rna聚合酶的ec
50
结果图。
[0025]
图3为本发明实施例3中sars
‑
cov
‑
2rna依赖的rna聚合酶转录活性的影响结果图;其中,a为化合物5
‑
碘代杀结核菌素在mrna水平对sars
‑
cov
‑
2rna依赖的rna聚合酶转录活性的影响结果图;b为阳性化合物瑞德西韦在mrna水平对sars
‑
cov
‑
2rna依赖的rna聚合酶转录活性的影响结果图。
[0026]
图4为本发明实施例4的实验结果图;其中,a为利用western blot检测sars
‑
cov
‑
2外切酶nsp14报告系统中nsp12、nsp7、nsp8、nsp14、nsp10蛋白的表达结果;b为利用酶标仪centro xs
3 lb 960检测sars
‑
cov
‑
2外切酶nsp14报告系统中gluc的表达结果;c为化合物5
‑
碘代杀结核菌素对sars
‑
cov
‑
2外切酶nsp14的抗性结果图;d为阳性化合物瑞德西韦对sars
‑
cov
‑
2外切酶nsp14的抗性结果图,e为阴性化合物利巴韦林对sars
‑
cov
‑
2外切酶nsp14的抗性结果图。
[0027]
图5为本发明实施例5中化合物5
‑
碘代杀结核菌素和瑞德西韦(remdesivir)对冠状病毒hcov
‑
oc43(a)和hcov
‑
nl63(b)毒株的抑制效果。
具体实施方式
[0028]
本发明提供一种可有效抗冠状病毒的化合物。
[0029]
本发明采用如下技术方案:本发明提供一种腺苷激酶抑制剂在制备冠状病毒依赖的rna聚合酶拮抗剂中的应用,所述腺苷激酶抑制剂为5
‑
碘代杀结核菌素,即式i所示的化合物。
[0030]
式i所示的化合物能够抑制新冠病毒sars
‑
cov
‑
2rna依赖的rna聚合酶活性进而抑
制新冠病毒的复制,并可有效抑制冠状病毒hcov
‑
oc43和hcov
‑
nl63的复制,为研发新型抗新冠病毒先导化合物提供数据支持,同时为研发covid
‑
19有效治疗药物提供理论依据,也可用于制备抗多种类型的冠状病毒的药物。
[0031]
以下实施例用于说明本发明,但不用来限制本发明的范围。若未特别指明,实施例均按照常规实验条件,如sambrook等分子克隆实验手册(sambrook j&russell dw,molecular cloning:a laboratory manual,2001),或按照制造厂商说明书建议的条件。
[0032]
以下实施例中涉及的真核密码子优化的质粒pcovid19
‑
nsp7、真核密码子优化的质粒pcovid19
‑
nsp8、真核密码子优化的质粒pcovid19
‑
nsp10、真核密码子优化的质粒pcovid19
‑
nsp12、真核密码子优化的质粒pcovid19
‑
nsp14是将nsp7、nsp8、nsp10、nsp12、nsp14基因分别通过xhoi无缝克隆到pcmv6
‑
entry载体(购自origen)所获得的质粒。
[0033]
nsp7、nsp8、nsp10、nsp12、nsp14基因参见ren ll,wang ym,wu zq,xiang zc,guo l,xu t,jiang yz,xiong y,li yj,li xw,li h,fan gh,gu xy,xiao y,gao h,xu jy,yang f,wang xm,wuc,chen l,liu yw,liu b,yang j,wang xr,dong j,li l,huang cl,zhao jp,hu y,cheng zs,liu ll,qian zh,qin c,jin q,cao b,wang jw.identification of a novel coronavirus causing severe pneumonia in human:a descriptive study.chin med j 2020;00:00
–
00.doi:10.1097/cm9.0000000000000722。
[0034]
实施例1细胞水平cov
‑
rdrp
‑
gluc报告系统的建立
[0035]
本实施例建立了新冠病毒sars
‑
cov
‑
2rdrp特异启动的荧光素酶报告系统,简称cov
‑
rdrp
‑
gluc。在新冠病毒5
′
utr和3
′
utr之间插入gaussia luciferase(gluc)编码序列(如seq id no:1所示),然后将其插入pretrox
‑
tight
‑
pur(clontech)载体bamhi
‑
hf(#r3136l,neb)和notl(noti
‑
hf,neb)位点之间,使用正向引物(5
′‑
ggcggatccattaaaggtttatac
‑3′
)和反向引物(5
′‑
ttagcggccgcgtcattctcctaagaa
‑3′
),构建了pcov
‑
gluc质粒。在cmv启动子的作用下,正链的gluc(mrna)发生转录,经翻译产生gluc蛋白。当在系统中同时表达新冠病毒rna依赖的rna聚合酶(nsp12)时,rdrp首先以正链的gluc为模板合成负链的vrna,随后vrna被转录为正链gluc(mrna),最终翻译成gluc蛋白。因此,加入rdrp后增加的gluc反映了sars
‑
cov
‑
2rdrp的活性。构建原理示意图见图1中的a。
[0036]
另外,nsp12发挥功能时需要nsp7和nsp8的参与。因此本实施例分别设置了三组试验进行比较:单独表达cov
‑
gluc(上述构建的pcov
‑
gluc质粒)(10ng),共表达cov
‑
gluc(10ng)和真核密码子优化的质粒pcovid19
‑
nsp12(nsp12)(200ng)以及共表达cov
‑
gluc(10ng)、nsp12(200ng)、真核密码子优化的质粒pcovid19
‑
nsp7(nsp7)(600ng)和真核密码子优化的质粒pcovid19
‑
nsp8(nsp8)(600ng)。实验过程中为了保证质粒总的转染量相同,各组中添加空载体质粒pcmv6
‑
entry补齐。具体结果参见图1中的b。b中的左图为本发明实施例1中利用western blot检测cov
‑
rdrp
‑
gluc报告系统中nsp12、nsp7、nsp8蛋白的表达结果;b中的右图为本发明实施例1中利用酶标仪centro xs
3 lb 960检测cov
‑
rdrp
‑
gluc报告系统中各组gluc的表达结果。
[0037]
western blot、centro xs
3 lb 960具体检测方法如下:
[0038]
(1)western blot实验
[0039]
将2.5
×
105个/ml的hek 293t细胞悬液,按照每孔2ml接种于6孔板中。hek 293t细胞所用培养基分别为含10%胎牛血清(fbs)的dmem培养基;将细胞在37℃含5%二氧化碳恒
温培养箱培养。待细胞长至80%时,hek 293t细胞组每孔按上述实验组设计进行质粒转染。转染后4小时将培养基换成含10%胎牛血清(fbs)的dmem培养基;继续培养24小时。弃培养基,每孔加入80μl的ripa裂解液,将裂解液转移至1.5ml ep管中冰上裂解20分钟,每管加入20μl的5
×
蛋白上样缓冲液(loading buffer),100℃金属浴煮30分钟。sds
‑
page凝胶电泳分离,western blot检测nsp12、nsp7和nsp8表达量。检测结果见图1中b的左图。
[0040]
(2)gasussia荧光素酶活性检测
[0041]
将250μg的底物coelenterazine
‑
h冻干粉末溶解于600μl无水乙醇中,制成浓度为1.022mm的底物母液,保存在
‑
20℃;测量前,将母液以1:60的比例(体积比)稀释于pbs中,制成底物工作液。在室温静置30min以稳定工作液,由于底物见光不稳定,全程需要避光处理;取10μl细胞培养上清(上述western blot实验中转染后培养24小时后的细胞上清)到白色不透明96孔板中,利用酶标仪centro xs
3 lb 960自动进样器将避光孵育的底物工作液按每孔60μl的进样量逐孔加入,持续收集信号0.5秒,测量结果以相对光单位relative light units(rlu)表示。实验设置了三组平行,并进行了统计学分析,其中,**p<0.01,***p<0.001是以单独表达cov
‑
gluc组为参照。实验数据以表示,并用graphpad prism 5.0进行作图和统计学分析。检测结果见图1中b的右图。
[0042]
实验结果显示,共表达cov
‑
gluc和nsp12组以及cov
‑
gluc、nsp12、nsp7和nsp8组分别是单独表达cov
‑
gluc组gluc的2倍和38倍。上述结果说明本发明所构建的cov
‑
rdrp
‑
gluc系统中gluc蛋白的表达特异性地依赖于新冠病毒rdrp。
[0043]
本实施例还对上述cov
‑
rdrp
‑
gluc报告系统进行了z’因子检测,检测方法如下:
[0044]
将2.5
×
105个/ml的hek 293t细胞悬液,按照每孔2ml接种于6孔板中,培养24h后转染。分两组进行:表达质粒cov
‑
gluc(10ng)的细胞为阴性对照(补加1.4μg质粒pcmv6
‑
entry,购自origen),共表达质粒cov
‑
gluc(10ng)、nsp12(200ng)、nsp7(600ng)和nsp8(600ng)的细胞为阳性对照组。转染12h后,分别将两组细胞用胰酶消化,加入dmem培养基制成细胞悬液,接种于96孔板(1
×
105个/ml),每孔100μl。培养24h后检测荧光素酶活性。计算公式为:z
′
因子=1
‑
(3
×
阳性对照组相对荧光值sd+3
×
阴性对照组相对荧光值sd)/(阳性对照组相对荧光值平均值
‑
阴性对照组相对荧光值平均值)。
[0045]
检测结果见图1中的c,其为本发明实施例1中cov
‑
rdrp
‑
gluc报告系统用于高通量筛选的z’因子检测结果,根据结果可知z’因子为0.73,符合高通量筛选的要求。
[0046]
实施例2利用cov
‑
rdrp
‑
gluc报告系统对腺苷激酶抑制剂(5
‑
碘代杀结核菌素)进行测试
[0047]
将2.5
×
105个/ml的hek 293t细胞悬液,按照每孔2ml接种于6孔板中。待细胞长至80%时,hek 293t细胞组每孔共转染10ng实施例1构建的pcov
‑
gluc,200ng真核密码子优化的质粒pcovid19
‑
nsp12,600ng真核密码子优化的质粒pcovid19
‑
nsp7和600ng真核密码子优化的质粒pcovid19
‑
nsp8质粒。转染后4小时将培养基换成含10%胎牛血清(fbs)的dmem培养基,继续培养12小时。将六孔板中的细胞消化后制成细胞悬液,按1.0
×
104个/ml的hek 293t细胞接种于96孔板,每孔100μl。每孔分别加入1μl浓度为10μm的化合物5
‑
碘代杀结核菌素(式i的化合物)和瑞德西韦,接着培养细胞24小时。其中阴性对照组每孔加入1μl dmso(二甲基亚砜)。最后按照实施例1的方法检测荧光值。实验设置了三组平行,并进行了统计
学分析,数据以dmso组的值为参比进行了百分化处理。实验数据以表示,并用graphpad prism 5.0进行作图和统计学分析。试验结果显示,化合物5
‑
碘代杀结核菌素相比于阴性对照组(dmso组)表现出85%以上抑制sars
‑
cov
‑
2rdrp的活性(参见图2中的a,其中,***p<0.001是以dmso组为参照)。抑制率=(阴性对照组-样品组)/(阴性对照组-阳性对照组)
×
100%。
[0048]
本实施例继续对化合物5
‑
碘代杀结核菌素进行sars
‑
cov
‑
2rdrp活性实验的验证,以检测其抑制的ec
50
。实验步骤如上所述,化合物5
‑
碘代杀结核菌素和瑞德西韦的终浓度分别为0.39、0.78、1.56、3.125、6.25、12.5、25和50μm。实验组进行了三次,每次实验以每组的dmso组为参照。实验数据以表示,并用graphpad prism5.0进行作图和统计学分析。结果参见图2,其中,b为化合物5
‑
碘代杀结核菌素对sars
‑
cov
‑
gluc rdrp的ec
50
结果图,c为阳性化合物瑞德西韦对sars
‑
cov
‑
gluc rdrp的ec
50
结果图。实验结果表明,化合物5
‑
碘代杀结核菌素抑制sars
‑
cov
‑
2rdrp的ec
50
为0.75μm,而阳性化合物瑞德西韦的ec
50
值为1.07μm,两者ec
50
(5
‑
碘代杀结核菌素/瑞德西韦)的比值为0.69。实验结果表明,小分子5
‑
碘代杀结核菌素是极具潜力的sars
‑
cov
‑
2rdrp抑制剂。
[0049]
实施例3 5
‑
碘代杀结核菌素在mrna水平抑制sars
‑
cov
‑
2rdrp的转录活性实验
[0050]
在mrna水平检测5
‑
碘代杀结核菌素对sars
‑
cov
‑
gluc的影响可以进一步证实5
‑
碘代杀结核菌素对sars
‑
cov
‑
2rdrp转录活性的影响。本发明采用qrt
‑
pcr方法检测了5
‑
碘代杀结核菌素在mrna水平对sars
‑
cov
‑
2rdrp的抑制情况。
[0051]
将2.5
×
105个/ml的hek 293t细胞悬液,按照每孔2ml接种于6孔板中。待细胞长至80%时,hek 293t细胞组每孔共转染10ng pcov
‑
gluc,200ng真核密码子优化的质粒pcovid19
‑
nsp12,600ng真核密码子优化的质粒pcovid19
‑
nsp7和600ng真核密码子优化的质粒pcovid19
‑
nsp8质粒。转染后4小时将培养基换成含10%胎牛血清(fbs)的dmem培养基,其中一组按照每孔5.00mm或10.00mm的5
‑
碘代杀结核菌素各加入2μl,另一组以dmso(二甲基亚砜)作为阴性对照,同时选用广谱抗病毒核苷类抑制剂瑞德西韦作为阳性对照,每孔5.00mm或10.00mm的瑞德西韦各加入2μl,继续培养24小时。最后将培养基吸掉,每孔加入1ml的trizol试剂,从trizol中提取出mrna之后,利用反转录法获得全基因组cdna,随后进行qrt
‑
pcr检测gluc mrna的表达量。本发明利用gapdh作为内参基因。实验设置了三组平行,并进行了统计学分析,其中,**p<0.01,***p<0.001是以dmso组为参照。实验数据以表示,并用graphpad prism 5.0进行作图和统计学分析。实验结果见图3,其中,a为本发明实施例3中5
‑
碘代杀结核菌素在mrna水平对sars
‑
cov
‑
2rdrp转录活性的影响结果图;b为本发明实施例3中阳性化合物瑞德西韦在mrna水平对sars
‑
cov
‑
2rdrp转录活性的影响结果图。
[0052]
试验结果显示,5
‑
碘代杀结核菌素在2.00μm与10.00μm的浓度下可以显著抑制sars
‑
cov
‑
gluc中gluc mrna表达量,结合实施例2的试验结果,本发明分别从不同的方面说明了5
‑
碘代杀结核菌素是一类新型sars
‑
cov
‑
2rdrp小分子抑制剂。
[0053]
实施例4 5
‑
碘代杀结核菌素对新冠病毒外切酶nsp14的抗性实验
[0054]
核苷类似物抑制新冠病毒rdrp时,由于新冠病毒外切酶nsp14的校准功能,导致多数核苷类似物对nsp14的抗性较差。这也导致核苷类似物作为rdrp抑制剂在治疗新冠病毒
的疗效较差。因此,本发明在sars
‑
cov
‑
gluc系统的基础上,共表达nsp14和nsp10,检测了化合物对新冠病毒外切酶的抗性。
[0055]
具体实验步骤参照实施例1,不同之处在于:在hek 293t细胞中,每孔单独表达cov
‑
gluc(10ng),共表达cov
‑
gluc(10ng)、nsp12(200ng)、nsp7(600ng)和nsp8(600ng),共表达cov
‑
gluc(10ng)、nsp12(200ng)、nsp7(600ng)、nsp8(600ng)、真核密码子优化的质粒pcovid19
‑
nsp14(nsp14)(500ng)和真核密码子优化的质粒pcovid19
‑
nsp10(nsp10)(500ng),其它操作相同。为了更清楚地展示nsp10和nsp14蛋白的位置和表达情况,在图4的a的western blot中还单独对两个蛋白分别进行了检测。实验设置了三组平行,并进行了统计学分析,其中***p<0.001,以单独表达cov
‑
gluc组为参照。实验数据以表示,并用graphpad prism 5.0进行作图和统计学分析。具体结果参见图4,其中,a为本发明实施例4中利用western blot检测cov
‑
rdrp
‑
gluc外切酶nsp14报告系统中nsp12,nsp7,nsp8,nsp14,nsp10蛋白的表达结果;b为本发明实施例4中利用酶标仪centro xs
3 lb 960检测cov
‑
rdrp
‑
gluc外切酶nsp14报告系统中gluc的表达结果。
[0056]
本实施例进一步检测了5
‑
碘代杀结核菌素和瑞德西韦对sars
‑
cov
‑
2外切酶nsp14的抗性。具体方法如下:
[0057]
具体实验步骤参照实施例2,不同之处在于,在hek 293t细胞中,共表达cov
‑
gluc(10ng)、nsp12(200ng)、nsp7(600ng)、nsp8(600ng)、nsp14(500ng)和nsp10(500ng),其它操作相同。
[0058]
检测结果如图4中的c、d、e所示,c为本发明实施例4中5
‑
碘代杀结核菌素对sars
‑
cov
‑
2外切酶nsp14的抗性结果图;d为本发明实施例4中阳性化合物瑞德西韦对sars
‑
cov
‑
2外切酶nsp14的抗性结果图,e为本发明实施例4中阴性化合物利巴韦林对sars
‑
cov
‑
2外切酶nsp14的抗性结果图。
[0059]
试验结果显示,5
‑
碘代杀结核菌素对sars
‑
cov
‑
2外切酶的ec
50
为1.42μm,阳性化合物瑞德西韦对sars
‑
cov
‑
2外切酶的ec
50
值为2.08μm,两者ec
50
(5
‑
碘代杀结核菌素/瑞德西韦)的比值为0.68。而阴性化合物利巴韦林对sars
‑
cov
‑
2外切酶的ec
50
值为>1000μm。实验结果表明,5
‑
碘代杀结核菌素对sars
‑
cov
‑
2外切酶nsp14不敏感,且略优于瑞德西韦。
[0060]
实施例5 5
‑
碘代杀结核菌素抑制冠状病毒hcov
‑
oc43和hcov
‑
nl63复制的实验
[0061]
hct
‑
8或llc
‑
mk2细胞按1.0
×
104个/ml接种于96孔板,每孔100μl,细胞培养基为含10%fbs的dmem培养基,培养48小时。弃上清,更换为含2%fbs的新鲜dmem培养基。在hct
‑
8细胞以moi=0.1感染hcov
‑
oc43(atcc:vr
‑
1558)或在llc
‑
mk2以moi=0.01感染hcov
‑
nl43(amsterdam i)病毒。每孔加入梯度稀释的化合物5
‑
碘代杀结核菌素(终浓度从50μm按2倍稀释,稀释9个梯度)1μl,阴性对照组每孔加入1μl dmso(二甲基亚砜),采用广谱抗病毒核苷类抑制剂瑞德西韦作为阳性对照(终浓度从50μm按2倍稀释,稀释9个梯度)每孔加入1μl,接着在33℃下继续培养60小时。每孔加入20μl cell proliferation colorimetric assay(mts)试剂37℃作用3小时。最后检测490nm波长下产生的吸收峰。抑制率的计算公式:抑制率=(病毒组
–
样品组)/(病毒组
–
空白组)
×
100%。
[0062]
图5为本发明实施例5中化合物5
‑
碘代杀结核菌素和瑞德西韦对冠状病毒hcov
‑
oc43和hcov
‑
nl63毒株的抑制效果。试验结果显示,5
‑
碘代杀结核菌素对冠状病毒hcov
‑
oc43抑制的ec
50
约为1.56μm(图5中的a),对冠状病毒hcov
‑
nl63抑制的ec
50
约为3.62μm(图5
中的b),与阳性化合物瑞德西韦的抗冠状病毒的活性接近,进一步说明5
‑
碘代杀结核菌素有希望发展成新型抗新冠病毒先导化合物,且为研发covid
‑
19有效治疗药物提供理论依据。
[0063]
虽然,上文中已经用一般性说明及具体实施方案对本发明作了详尽的描述,但在本发明基础上,可以对之做一些修改或改进,这对本领域技术人员而言是显而易见的。因此,在不偏离本发明精神的基础上所做的这些修改或改进,均属于本发明要求保护的范围。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1