基于噬菌体载体的新型冠状病毒疫苗及其制备方法
1.本发明涉及一种疫苗,具体涉及一种基于噬菌体载体的新型冠状病毒疫苗 及其制备方法。
背景技术:
2.在没有特效药的情况下,控制疫情最好的方法就是疫苗。目前已上市的疫 苗有灭活疫苗、蛋白亚单位疫苗等五大类,为疫情防控做出了巨大的贡献。全 球范围内正在进行的大多数新冠疫苗研究针对的都是刺突蛋白(s蛋白,spikeglycoprotein)。这是因为,新冠病毒正是利用高度糖基化的同源三聚体s蛋白 进入宿主细胞。s蛋白经历多种结构排列后将病毒融入宿主细胞的细胞膜。这一 过程包括病毒的s1亚基结合到宿主细胞受体上,引发三聚体不稳定性的发生, 进而造成s1亚基脱落和s2的折叠,从而使s蛋白更容易与宿主受体血管紧张 素转换酶2(ace2)结合,其中s1亚基中的受体结合结构域(rbd)是受体结 合的关键位点,rbd凹面的受体结合基序(rbm)与受体直接接触。表面等离子 共振技术(spr)实验发现新冠病毒与ace2的解离常数kd为15nm,而sars的 kd值为325.8nm,也就是说新冠病毒与ace2的结合力是sras的10-20倍。正 是由于新冠病毒的s蛋白和ace2结合更加紧密,造成了新冠病毒比sras更容 易传播。以衡量床染病的传播能力的指数基本传染数r0来看,预计新冠病毒的 r0值为3-4,而sras的r0值在2-3,而中东呼吸综合症的r0值仅为0.5左右。 这一发现为研制新冠病毒疫苗获得了靶标,即通过阻断s蛋白与ace2的结合, 从而避免病毒的感染,这是目前除灭活疫苗以外大多数疫苗采取的策略。
[0003][0004]
但是,因为新冠病毒是单链rna病毒,特别容易变异,截至目前,已出现 多种新型变异株,包括alpha(b.1.1.7)、beta(b.1.351)、gamma(p.1)、delta (b.1.617.2)、eta(b.1.525)、lota(b.1.526)、kappa(b.1.617.1)和lambda, 等。变异毒株的传播性更强、与肺细胞受体的结合更强,同时具有更强的免疫 逃逸能力,现有疫苗效果可能削弱。因此,研制能够快速应对病毒可能产生的 进化及突变的新型疫苗,保证疫苗免疫效果,迫在眉睫。
[0005]
噬菌体是一种以细菌为宿主的具有严格宿主特异性的病毒,在防控食品业 微生物污染、临床疾病的防治和诊断、养殖业、环境治理等领域的应用取得了 突破性进展。噬菌体基因数目少,结构相对简单,是一种很容易被多元化群体 操纵的病毒。噬菌体主要由核酸和蛋白质衣壳组成,不能独立生存,通过吸附、 侵入、增殖、成熟(装配)和裂解(释放)5个阶段在宿主细胞中进行生长繁殖。 噬菌体感染细菌具有惊人的效率,一个噬菌体颗粒重复4个感染周期后可以杀 死10亿个细菌,具有指数增殖能力。噬菌体的指数增殖能力是其显著优点之一。 从理论上讲,一个噬菌体颗粒就可以杀灭细菌,这种现象为“全”或“无”效 应。在条件合适的情况下,每个裂解周期内,噬菌体都会产生约200个子代, 所以其增殖速度可达200n。另外,噬菌体作为一种感染细菌的病毒,具有严格 的宿主特异性,对非目的细菌不起作用,因此,免疫人体或动物后不会影响机 体内的其他正常菌群。
[0006]
噬菌体展示技术(phage display technology)是将外源多肽或蛋白质的编 码序
列整合到噬菌体基因组中以融合蛋白的形式展示在噬菌体表面的一种技术 (zani ml,moreau t.phage display as a powerful tool to engineer proteaseinhibitors.biochimie,2012,92(11):1689-1704.)。其具体原理是将外源 目的基因dna片段插入到噬菌体一个特定编码外膜蛋白的基因中,使外源dna 编码的表达产物与噬菌体的外壳蛋白形成融合蛋白展示在噬菌体表面。目前, 有多种噬菌体可用于噬菌体展示,根据表达外源性蛋白或多肽的噬菌体的不同 类别,噬菌体展示系统包括丝状噬菌体展示系统、t4噬菌体展示系统、λ噬菌 体展示系统和噬菌粒展示系统。
[0007]
噬菌体展示技术为基因工程疫苗的筛选和设计提供了有效手段,可以相对 的弥补传统疫苗的不足。噬菌体展示技术在疫苗研究中具有很大优势:
[0008]
首先,噬菌体作为一种新型活病毒载体,其自身具有免疫原性,可直接作 为佐剂样颗粒。因此,利用噬菌体作为载体的疫苗免疫接种时所需的剂量比传 统疫苗低,而且能达到更好的效果(hashiguchi s,yamaguchi y,takeuchi o, et a1.immunological basis of m13 phage vaccine:regulation under myd88and tlr9 signaling.bioehem biophys res commun,2010,402(1):l9-22.)。 以噬菌体展示技术展示的蛋白或多肽是通过生物体自身翻译机制产生的天然构 象产物。噬菌体疫苗作为一种颗粒性抗原,能快速地被抗原提呈细胞(antigenpresenting cell,apc)摄取。因此,以整个噬菌粒(phagemid)或噬菌体作为疫 苗传递载体时,更易于诱发机体产生免疫应答。噬菌体自身具有较强的免疫原 性,表达在噬菌体表面的蛋白或多肽易于被免疫系统识别(samoylova ti,norrismd,samoylov am,et a1.infective and inactivated filamentous phageas cmtiers for immunogenic peptides.j virol methods,2012,183(1): 63-68.)。噬菌体颗粒的不对称性有利于募集th细胞,能诱导更强的细胞免疫 反应。当用携带整合有真核启动子控制下外源基因的噬菌体免疫动物后,可在 动物体内表达保护性抗原,而且该抗原可以在噬菌体上有正确的折叠和恰当的 翻译。因此,与传统活病毒载体疫苗相比,噬菌体重组疫苗在免疫效果上具有 更为显著的优势。
[0009]
其次,噬菌体可进行多靶标抗原展示。噬菌体载体可插入较大的外源dna片 段,可展示的肽段大,使在单一的噬菌体中进行多种靶标抗原的展示成为可能, 其中包括将细胞因子协同表达作为免疫佐剂,以增强噬菌体颗粒免疫的效果。
[0010]
另外,噬菌体的宿主是易于培养、生长周期短的细菌,不需细胞培养与融 合、成本低,比一般蛋白疫苗更易于制备纯化。再加上噬菌体疫苗的制备速度 比较快,生产周期短且易于扩增、浓缩,仅需要几周甚至是几天的时间,便能 够达到疫苗期望的浓度并投入使用。
[0011]
最后,噬菌体对理化因素的抵抗力较强,在宽的ph范围内具有高稳定性, 具备在不同环境下长期保存的能力。
[0012]
综上,噬菌体疫苗兼有重组蛋白疫苗和dna疫苗的优点,比其他病毒载体 疫苗更安全方便。因此,在新冠病毒疫苗的研制上具有很大的应用价值。
技术实现要素:
[0013]
本发明的目的是提供一种基于噬菌体载体的新型冠状病毒疫苗及其制备方 法,利用噬菌体表面呈现技术,构建更安全、更有效的新冠疫苗,用以提高新 型冠状病毒疫苗
的快速研制能力。
[0014]
为了达到上述目的,本发明所采用的技术方案为:
[0015]
基于噬菌体载体的新型冠状病毒疫苗制备方法,其特征在于:
[0016]
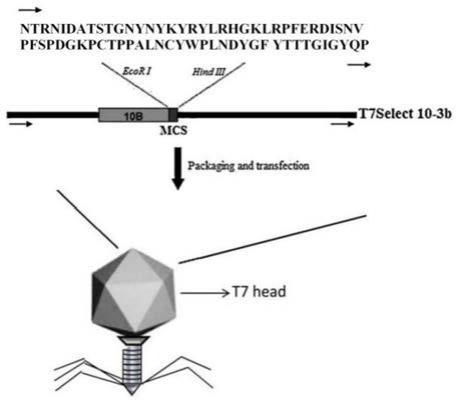
将新冠病毒s蛋白的rbm结构域,克隆入t7select 10-3b噬菌体载体,使 rbm抗原呈现于噬菌体10b蛋白的c末端,得到表面呈现rbm多肽的t7-rbm重 组噬菌体,即为基于噬菌体载体的新型冠状病毒疫苗。
[0017]
所述方法具体包括以下步骤:
[0018]
第一步:克隆新冠病毒s蛋白rbm结构域的核苷酸序列,插入t7select 10-3b 噬菌体载体,获得重组噬菌体载体;
[0019]
第二步:将第一步获得的重组噬菌体载体,加入t7select 10-3b噬菌体包 装液中,包装得到t7-rbm重组噬菌体,新冠病毒s蛋白的rbm抗原呈现于噬菌 体10b蛋白的c末端,得到表面呈现新冠病毒s蛋白rbm结构域的t7-rbm重组 噬菌体,即为基于噬菌体载体的新型冠状病毒疫苗。
[0020]
所述新冠病毒s蛋白rbm结构域的氨基酸序列为seq id no:1,具体为:
[0021]
ntrnidatstgnynykyrylrhgklrpferdisnvpfspdgkpctppalncywplndygfyttt gigyqp。
[0022]
所述新冠病毒s蛋白rbm结构域的核苷酸序列插入t7select 10-3b噬菌体 载体的酶切位点为ecori与hindiii之间。
[0023]
所克隆的新冠病毒s蛋白rbm结构域的核苷酸序列为seq id no:2,具体 为:
[0024]
aattctaacaatcttgattctaaggttggtggtaattataattacctgtatagattgtttagga agtctaatctcaaaccttttgagagagatatttcaactgaaatctatcaggccggtagcacaccttgt aatggtgttgaaggttttaattgttactttcctttacaatcatatggtttccaacccactaatggtgt tggttaccaacca。
[0025]
如所述的方法获得的基于噬菌体载体的新型冠状病毒疫苗。
[0026]
与现有技术相比,本发明的有益效果如下:
[0027]
1.本发明的噬菌体载体构建方法较为简便,使用基因工程技术,具有快速 响应能力;
[0028]
2.本发明的噬菌体疫苗自身具有免疫原性,可直接作为佐剂样颗粒用于免 疫,成功激发机体的特异性抗体产生以及t细胞活性;
[0029]
3.本发明的噬菌体疫苗易于培养、生长周期短、成本低、易于制备纯化;
[0030]
4.本发明的噬菌体疫苗安全性高,未发现不良反应。
附图说明
[0031]
为了更清楚地说明本发明实施例或现有技术中的技术方案,下面将对实施 例或现有技术描述中所需要使用的附图作简单地介绍,显而易见地,下面描述 中的附图仅仅是本发明的一些实施例,对于本领域普通技术人员来讲,在不付 出创造性劳动的前提下,还可以根据这些附图获得其他实施例的附图。
[0032]
图1是t7-rbm重组噬菌体构建模式图;
[0033]
图2是t7-rbm重组噬菌体包装效率测定图。
[0034]
图3是t7-rbm重组噬菌体中rbm目的基因pcr鉴定图。
[0035]
图4是t7-rbm重组噬菌体中目的基因测序图。
[0036]
图5是plaque lift assay(噬菌斑测定)检测t7-rbm重组噬菌体中rbm 多肽图。
[0037]
图6是b检测t7-rbm重组噬菌体中10b-rbm融合蛋白图。
[0038]
图7是t7-rbm重组噬菌体免疫小鼠的特异性抗体检测图。
[0039]
图8是t7-rbm重组噬菌体免疫小鼠的中和性抗体检测图。
[0040]
图9是t7-rbm重组噬菌体免疫小鼠的t细胞活性检测图(左图为ifn-gamma 分泌水平检测图,右图为il-4分泌水平检测图)。
[0041]
图10是t7-rbm重组噬菌体免疫小鼠的体重监测图。
[0042]
图11是t7-rbm重组噬菌体免疫小鼠的进食情况监测图。
[0043]
图12是t7-rbm重组噬菌体免疫小鼠的体温监测图。
[0044]
图13是t7-rbm重组噬菌体免疫小鼠的脏器一般情况监测图。
具体实施方式
[0045]
为了便于理解本发明,下面将参照相关附图对本发明进行更全面的描述。 附图中给出了本发明的较佳实施方式。但是,本发明可以以许多不同的形式来 实现,并不限于本文所描述的实施方式。相反地,提供这些实施方式的目的是 使对本发明的公开内容理解的更加透彻全面。
[0046]
新型冠状病毒s蛋白中s1亚基中的受体结合结构域(rbd)是受体结合的 关键位点,rbd凹面的受体结合基序(rbm)与受体直接接触,是良好的疫苗开 发靶标。本发明采用噬菌体表面呈现技术,提出了一种基于噬菌体载体的新型 冠状病毒疫苗制备方法,将新冠病毒s蛋白的rbm结构域,克隆入t7select 10-3b 噬菌体系统,使rbm抗原呈现于噬菌体10b蛋白的c末端,得到表面呈现rbm 多肽的t7-rbm重组噬菌体,即为基于噬菌体载体的新型冠状病毒疫苗。
[0047]
上述方法具体包括以下步骤:
[0048]
第一步:克隆新冠病毒s蛋白rbm结构域的核苷酸序列,插入t7select 10-3b 噬菌体载体,获得重组噬菌体载体。
[0049]
新冠病毒s蛋白的rbm结构域的氨基酸序列为seq id no:1,具体为:
[0050]
ntrnidatstgnynykyrylrhgklrpferdisnvpfspdgkpctppalncywplndygfyttt gigyqp。
[0051]
新冠病毒s蛋白的rbm结构域的核苷酸序列插入t7select 10-3b噬菌体载 体的酶切位点为ecori与hindiii之间。
[0052]
所克隆的新冠病毒s蛋白rbm结构域的核苷酸序列为seq id no:2,具体 为:
[0053]
aattctaacaatcttgattctaaggttggtggtaattataattacctgtatagattgtttagga agtctaatctcaaaccttttgagagagatatttcaactgaaatctatcaggccggtagcacaccttgt aatggtgttgaaggttttaattgttactttcctttacaatcatatggtttccaacccactaatggtgt tggttaccaacca。
[0054]
第二步:将第一步获得的重组噬菌体载体,加入t7select 10-3b噬菌体包 装液中,包装得到t7-rbm重组噬菌体,新冠病毒s蛋白的rbm抗原呈现于噬菌 体10b蛋白的c末端,得到表面呈现新冠病毒s蛋白rbm结构域的t7-rbm重组 噬菌体,即为基于噬菌体载体的新型冠状病毒疫苗。
[0055]
实施例1:重组噬菌体疫苗的构建
[0056]
在北京奥科鼎盛生物科技有限公司合成了密码子优化后的rbm基因 (gh20b001),插入t7select 10-3b噬菌体载体的ecori与hindiii之间,获 得重组噬菌体载体。将此载体取0.5μg加于t7select 10-3b噬菌体包装液25μl 中,温柔搅拌后22℃孵育2h,加入270μl灭菌lb or tb终止反应。包装得到 的重组噬菌体,rbm抗原呈现于噬菌体10b蛋白的c末端,即表面呈现rbm多 肽的t7-rbm重组噬菌体,命名为t7-rbm(图1)。
[0057]
接下来用双层平板法检测t7-rbm重组噬菌体滴度,评估包装效率。
[0058]
1、取blt5403菌株于mgtb(carb)培养基中,37℃振荡培养至od600nm=1.0;
[0059]
2、将宿主菌放于4℃(不能超过48h);
[0060]
3、融化足够体积的琼脂糖上层胶,每个稀释度的平板倒5ml(将融化好的 琼脂糖取置于45℃-50℃水浴);
[0061]
4、用无菌lb or tb制备不同稀释度的重组噬菌体。初始1:100稀释度为 制备方法为,在10ul样品中加入990ul培养基。稀释度通过以1:100的比例在 100ul样品中加入900ul培养基(103),100ul的103的稀释液中加入900ul培 养基则为104稀释度,以此类推;
[0062]
5、准备一系列的4ml无菌管分别吸取250ul宿主细胞从最高稀释度开始, 每个管中加入100ul噬菌体稀释液每次换枪头避免交叉污染;
[0063]
6、管中加入3ml上层琼脂糖然后倾倒于37℃预热的lb/carb平板上,迅速 温柔旋转平板使琼脂糖均一;
[0064]
7、待上层胶凝后,37℃倒置培养3-4小时;
[0065]
8、计数噬菌斑计算噬菌体效价,噬菌体效价=平板中噬菌斑数量
×
稀释倍 数。
[0066]
如图2所示t7-rbm重组噬菌体的包装效率达到2
×
106pfu/ml。
[0067]
实施例2:t7-rbm重组噬菌体的pcr及测序鉴定
[0068]
1、用无菌枪头从上层琼脂糖胶质刮取噬菌斑于50ul 10mmedta,ph8.0 ep 管中;
[0069]
2、将ep管在涡旋振动器上短暂振荡,之后65℃水浴10min;
[0070]
3、室温冷却后14000g离心3min取上清进行pcr检测,引物为t7 selectup primer(seq id no:3,具体为5
’‑
ggagctgtcgtattccagtc-3’)以及t7 selectdown primer(seq id no:4,具体为5
’‑
taaacgggtcttgaggggtt-3’)。
[0071]
4、pcr产物分2部分,一部分进行琼脂糖电泳,另一部分送上海生工生物 科技有限公司进行测序。
[0072]
结果如图3所示,pcr获得大小约213bp的条带,进一步的测序结果也显示 序列正确(图4),证实rbm基因成功插入t7噬菌体基因组。
[0073]
实施例3:t7-rbm重组噬菌体的噬菌斑测定及免疫印迹测定
[0074]
其中,噬菌斑测定实验步骤如下:
[0075]
1、硝基纤维素膜贴于双层平板表面40分钟,使噬菌斑在4℃下转移到硝 基纤维素膜上,风干30分钟;
[0076]
2、硝基纤维素膜置于5%脱脂牛奶tbs缓冲液封闭60分钟;
[0077]
3、使用包含0.05%tween-20的tbs(tbst)溶液清洗膜一次,和用tbs+0.1% bsa稀释的1/1000anti-rbd(sino biological inc.40592-t62)在室温孵育2 小时;
[0078]
4、同上溶液洗膜3次后,使用1/20000碱性磷酸酶标记的山羊抗兔igg (abcam)在
室温孵育0.5小时;
[0079]
5、随后添加ecl发光液进行暗室发光。
[0080]
其中,免疫印迹实验步骤如下:
[0081]
1、电泳后,将胶板拆下;
[0082]
2、剥离胶,立刻放入加有转膜液的培养皿,将裁好的胶浸过甲醇的pvdf 膜和滤纸和滤纸在转膜液中平衡10min;
[0083]
3、将转膜夹插入电转槽中,加入4℃预冷的转膜buffer,置入冰盒进行电 转;
[0084]
4、取出pvdf膜并浸入封闭液,室温封闭1h;
[0085]
5、用含有5%脱脂奶粉的tbst将一抗稀释至适当浓度,孵育pvdf膜4℃过 夜;
[0086]
6、用tbst在脱色摇床室温下洗膜3次,每次10min;
[0087]
用含有5%脱脂奶粉的tbst稀释二抗,室温孵育1小时,tbst洗膜3次,10min 每次;
[0088]
7、随后添加ecl发光液进行暗室发光。
[0089]
8、我们用rbd多抗进行噬菌斑测定,结果显示,t7-rbm重组噬菌体的噬菌 斑能够显色(图5);进一步用rbd多抗进行重组噬菌体全蛋白的western-blot 实验,也证实重组噬菌体表面成功呈现了10b-rbm融合蛋白(图6)。
[0090]
实施例4:t7-rbm重组噬菌体的液体扩增及纯化
[0091]
1、挑取blt5403单菌落培养于10ml mgtb(carb)培养基中,37℃150rpm/min 过夜;
[0092]
2、以1%的比例接入500ml mgtb培养基(carb+)37℃180rpm慢速培养至 od600约0.7~0.9;
[0093]
3、按公式od600
×
108×
培养体积,计算培养基中宿主菌blt5403细胞数;
[0094]
4、按0.1%-1%(感染噬菌体/宿主菌)接种噬菌体平板扩增浸出液,37℃, 150r/min,至出现残丝物时加入加入dnaase(1mg/ml),继续摇15min,使dna 裂解;
[0095]
5、每500ml mglb加29.3nacl(1mol/l),混合均匀,促进细菌碎片沉淀, 冰浴1h或过夜
[0096]
6、上述混合液移入250ml离心管中,12000r/min,4℃离心30min收集上 清并0.22μm过滤;
[0097]
7、在滤液中加入聚乙二醇8000(peg8000)至终浓度为10%,磁力搅拌充 分促其溶解,冰浴1h,促进噬菌体与peg8000共沉淀;
[0098]
8、上述混合液移入250ml离心管中12000r/min冰冻离心20min,弃上清并 倒扣于吸水纸上淋干上清
[0099]
9、用5ml生理盐水重悬离心管底的噬菌体沉淀。噬菌体沉淀重悬液使用等 体积氯仿(终浓度50%,)抽提,涡旋震荡混匀,4000r/min离心10min后取上 清(重复一次)
[0100]
10、纯化后噬菌体双层平板法检测滴度,-20℃贮存备用。
[0101]
实施例5:t7-rbm重组噬菌体疫苗的初步药效学评价
[0102]
1、17-19g的balb/c小鼠分7组,每组各6只;
[0103]
2、t7-rbm重组噬菌体组和t7-wt噬菌体组,免疫剂量分别为:1
×
10
11
pfu/ml, 1
×
10
12
pfu/ml,1
×
10
13
pfu/ml,生理盐水组每只每次100μl;
[0104]
3、免疫方法为:共免疫三次,为皮下多点注射,每只100μl;
[0105]
4、第三次免疫后14天眼球取血,取得的小鼠血液在4℃放置数小时,12,000g 离心
10分钟,上清即为小鼠抗血清,置于-20℃保存;
[0106]
5、用重组新冠rbd蛋白通过elisa法检测特异性抗体;
[0107]
6、通过进一步的ace2竞争性结合elisa法检测中和性抗体滴度;
[0108]
7、取各组小鼠的pbmc,2
×
106/ml加入24孔板,10%血清1640完全培养基, 37℃co2孵箱培养,分组刺激48-72h,抗原刺激组:5ug/ml重组新冠rbd蛋白; 阳性对照组:4ug/ml pha;阴性对照组:10%血清1640完全培养基。
[0109]
如图7所示,与t7-wt噬菌体组相比,t7-rbm重组噬菌体组均诱导出了特 异性抗体,其中1
×
10
13
pfu/ml剂量组抗体滴度最高。ace2竞争性elisa结果显 示t7-rbm重组噬菌体中高剂量组诱导出了中和性抗体(图8)。抗原特异性t细 胞的elisa结果显示,阳性对照pha组相比阴性对照组分泌ifn-gamma及il-4 的t细胞增多,与文献结果一致,证明实验体系成立。重组新冠s1-rbd蛋白可 以刺激cd4及cd8细胞分泌ifn-gamma及il-4,提示t7-rbm重组噬菌体疫苗免 疫刺激了抗原特异性t细胞的生成(图9)。
[0110]
实施例6:t7-rbm重组噬菌体疫苗的初步安全性评估
[0111]
1、同前免疫17-19g的balb/c小鼠,分7组,每组各6只。t7-rbm重组噬 菌体组和t7-wt噬菌体组,免疫剂量分别为:1
×
10
11
pfu/ml,1
×
10
12
pfu/ml,1
ꢀ×
10
13
pfu/ml,生理盐水组每只每次100μl;
[0112]
2、免疫期间,每周进行小鼠的体重称量:将小鼠放到烧杯内,待称量天平 读数相对稳定时记录精确数值;
[0113]
3、免疫期间,每周进行小鼠的摄食量监测:上次加入的饲料量减去剩余量, 即为该笼小鼠的总摄食量,除以小鼠只数,即为每只小鼠的平均摄食量;
[0114]
4、免疫期间,每周进行小鼠的体温监测:肛温计探头涂抹甘油后,水平插 入小鼠肛门,进行温度记录;
[0115]
5、免疫完成后,取肺、心、肝、脾、肾新鲜组织块,锋利手术刀切小块投 入预先配好的固定液中固定,常规脱水透明、石蜡包埋并切片,苏木精-伊红染 色,脱水透明与树胶封固后进行光镜下组织病理学检查、拍照。
[0116]
实验结果显示,在免疫给药期间,各组小鼠体重稳步增长,各组间相比无 显著差异;t7-rbm重组噬菌体免疫对小鼠的进食、体温均无显著影响;免疫小 鼠的心、肝、脾、肺、肾he染色无明显变化(图10-13)。
[0117]
本发明通过噬菌体展示技术构建了新冠疫苗,通过上述方法的描述以及实 验的分析,说明基于噬菌体载体的新冠疫苗具有可行性。新冠病毒的s蛋白通常 以三聚体的形式存在,与宿主受体结合的过程会导致三聚体蛋白的构象变化。因 此,聚合体形式的s蛋白是公认的具有高稳定性以及高免疫原性的抗原形式,能 够引起机体更强烈的免疫应答。本发明创造性的利用t7select 10-3b噬菌体系 统能够以多拷贝的形式呈现外源基因的特性,将s蛋白与靶细胞膜受体ace2结 合的核心区域,即rbm基序,高密度呈现在t7select 10-3b噬菌体表面,从而 构建出具类似天然病毒表面结构的多聚体抗原,具有高免疫原性,更有利于激发 机体免疫反应,促进疫苗的保护作用。另外,噬菌体疫苗不需要接触病原体,制 备过程安全;噬菌体扩增迅速,仅需要几个小时,其制备速度远远快于灭活疫苗、 腺病毒疫苗、重组蛋白疫苗等现有疫苗;噬菌体制备工艺简单,仅需要沉淀离心 等简单步骤,不需要复杂精密的厂房设备,便于推广应用;噬菌体免疫原性强, 不需要佐剂辅助,减少了佐
剂可能带来的副作用;噬菌体稳定性好,可以不依赖 于冷链进行保存与运输。综上所述,噬菌体新型冠状病毒疫苗相比其他类型的疫 苗,具有独特的优势。
[0118]
以上应用了具体个例对本发明进行阐述,只是用于帮助理解本发明,并不 用以限制本发明。对于本发明所属技术领域的技术人员,依据本发明的思想,还 可以做出若干简单推演、变形或替换。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1