一种琥珀酸舒马普坦缓释片及其制备方法与流程
1.本发明属于医药技术领域,提供了一种琥珀酸舒马普坦缓释片及其制备方法。
背景技术:
2.偏头痛是神经内科门诊常见的原发性头痛之一,是一种常见的慢性神经血管性疾病,其病情特征为反复发作、一侧或双侧搏动性的剧烈头痛且多发生于偏侧头部,可合并自主神经系统功能障碍如恶心、呕吐、畏光和畏声等症状,约1/3的偏头痛患者在发病前可出现神经系统先兆症状。中国偏头痛的患病率为9.3%,女性与男性之比约为3:1。
3.2015年lancet杂志发表的世界卫生组织(who)2013年全球疾病负担调查的研究结果表明,偏头痛为人类第三位常见疾病,按失能所致生命年损失计算,偏头痛为第六位致残性疾病。偏头痛除疾病本身可造成损害外,还可以导致脑白质病变、认知功能下降、后循环无症状性脑梗死等。此外,偏头痛还可与多种诸如焦虑、抑郁的疾病共患。
4.偏头痛的病因仍不明确。约50%的患者有家族史,女性患者则倾向于在月经来潮前后发病,有15%的女性偏头痛患者仅在月经前后发生,即所谓“真性经期偏头痛”,至怀孕以后发作减少,其中75%~80%在孕期停止发作,提示发作可能与内分泌或水潴留有关。精神紧张、过度劳累、强光刺激、烈日照射、低血糖、应用扩血管药物利舍平,或使用高酪胺食物(如巧克力、乳酪、柑橘)及酒精类饮料,均可诱发偏头痛发作。
5.偏头痛的发病机制尚不清楚,大体上分为血管源性学说和神经源性学说:
6.①
血管源性学说,患者服用麦角胺后颞动脉波动幅度降低,同时伴随头痛的缓解,由此认为典型偏头痛有颅内动脉收缩、局部血流减少,导致视觉改变、感觉异常或轻度偏瘫先兆症状,继而颅内及颅外动脉扩张,出现头痛。
7.②
神经源性学说,偏头痛的病变源于cns,内分泌改变及血管舒缩障碍是一种继发现象,即偏头痛的血管性表现是继发于神经中枢“释放”。偏头痛呈现的各种复杂症状是大脑皮质功能紊乱的结果,可能是原发于下丘脑/间脑水平的脑部阈值障碍。偏头痛患者多有遗传倾向,使发病阈值降低;在各种环境因素及诱发因素影响下,可导致脑部阈值进一步下降,通过一系列改变最终形成偏头痛发作。
8.琥珀酸舒马普坦为英国csk公司研制的一种新型抗偏头痛的药物。
9.舒马普坦的作用机制是高度选择性激动血管5
‑
ht1d受体,使颅内动脉收缩,血液重新分布,使脑血流供应得以改善。血管5
‑
ht1d受体在颈动脉循环中占优势,且药物的收缩作用集中在此循环内的动静脉吻合处,故能减轻硬脑膜中神经源性炎症,也有助于改善偏头痛。
10.根据国外文献报道,本品口服后能迅速吸收,但吸收不完全,因首过效应绝对生物利用度约为15%。口服本品25mg、100mg平均最大血药浓度分别为18ng/ml(7
‑
47ng/ml)和51ng/ml(28
‑
100ng/ml)。偏头痛发作期和间歇期cmax无明显差异,发作期t1/2为2.5h,间歇期t1/2为2.0h。单剂量口服25
‑
100mg,其吸收程度(auc)呈剂量依赖性,但是在大于100mg剂量后,auc比期望值(以25mg剂量为基础)约少25%。食物对其生物利用度无明显影响,但可
稍延长达峰时间约0.5h。本品的血浆蛋白结合率较低(14
‑
21%)。表观分布容积为2.4l/kg。本品的消除半衰期t1/22.5大约为小时。口服14c标记物后测得,大部分(约60%)是以代谢物形式通过肾排泄,40%在粪便中发现。尿中排出的标记物大多数是舒马普坦的主要代谢产物
‑
非活性的吲哚乙酸(iaa)或iaa的葡糖醛酸酯,而原形药只有约3%。本品主要同单胺氧化酶
‑
a(mao
‑
a)代谢,因此,该酶的抑制剂对可改变舒马普坦的药动学,降低吸收率。
11.舒马普坦等曲坦类药物的半衰期较短,常常在用后造成头疼症状复发。
技术实现要素:
12.本发明的目的在于提供一种琥珀酸舒马普坦缓释片及其制备方法,本发明的缓释片是骨架型和膜控型结合的缓释制剂,释药徐缓,使血药浓度平稳,避免峰谷现象,并且能长时间维持有效血药浓度,发挥最佳治疗效果。
13.本发明具体技术方案如下:
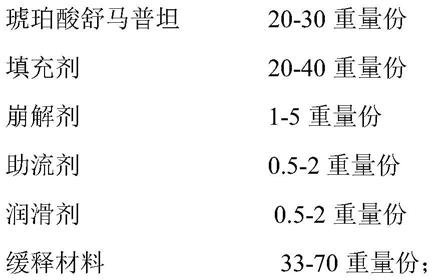
14.本发明所述的琥珀酸舒马普坦缓释片包含以下成分:
[0015][0016]
所述的缓释材料包括缓释颗粒材料和缓释包衣材料。
[0017]
优选的,所述的琥珀酸舒马普坦缓释片包含以下成分:
[0018][0019]
进一步优选的,所述的缓释颗粒材料和缓释包衣材料的比例为1:1
‑
10;更优选的,所述的缓释颗粒材料和缓释包衣材料的比例为1:1
‑
5。
[0020]
进一步优选的,所述的缓释包衣层包含以下组分:
[0021]
eudragit rs 30d
ꢀꢀꢀꢀꢀꢀ
20
‑
40重量份
[0022]
柠檬酸三乙酯
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
10
‑
20重量份
[0023]
二甲基硅油乳液
ꢀꢀꢀꢀꢀꢀꢀꢀ
0.1
‑
1.0重量份;
[0024]
更优选的,所述的缓释包衣层包含以下组分:
[0025]
eudragit rl 30d
ꢀꢀꢀꢀ
20
‑
30重量份
[0026]
柠檬酸三乙酯
ꢀꢀꢀꢀꢀꢀꢀ
12
‑
16重量份
[0027]
二甲基硅油乳液
ꢀꢀꢀꢀꢀ
0.4
‑
0.8重量份。
[0028]
进一步优选的,所述的缓释颗粒材料为羟乙基纤维素、羟丙甲纤维素、卡波姆树脂、羧甲基纤维素钠、海藻酸钠中的一种或多种;优选的,所述的缓释颗粒材料为羟乙基纤维素、海藻酸钠的混合物;优选的,所述的羟乙基纤维素、海藻酸钠的比例为1:3
‑
10;优选的,所述的羟乙基纤维素、海藻酸钠的比例为1:3
‑
8。
[0029]
进一步优选的,所述的填充剂为微晶纤维素、乳糖、淀粉、无水磷酸氢钙、预胶化淀粉、甘露醇中的一种或多种混合;优选的,所述填充剂为预胶化淀粉、甘露醇的混合物;进一步优选的,预胶化淀粉、甘露醇的比例为1:0.5
‑
3;优选的,预胶化淀粉、甘露醇的比例为1:0.8
‑
1.5。
[0030]
进一步优选的,所述的崩解剂为低取代羟丙基纤维素、干淀粉、羧甲基淀粉钠、交联pvp中的一种或多种混合;优选的,所述的崩解剂为低取代羟丙基纤维素、羧甲基淀粉钠的混合物;优选的,所述的低取代羟丙基纤维素、羧甲基淀粉钠的比例为1:0.5
‑
5;优选的,所述的低取代羟丙基纤维素、羧甲基淀粉钠的比例为1:1
‑
3。
[0031]
进一步优选的,所述的助流剂为微粉硅胶、二氧化硅的一种或两种混合。
[0032]
进一步优选的,所述的润滑剂为硬脂酸镁、微粉硅胶、氢化植物油、硬脂富马酸钠中的一种或多种混合;优选的,所述的润滑剂为硬脂酸镁。
[0033]
本发明还提供了上述琥珀酸舒马普坦缓释片的制备方法,具体的,所述制备方法包括以下步骤:
[0034]
a:取琥珀酸舒马普坦、填充剂、崩解剂、缓释颗粒材料、助流剂混合,压片,得素片备用;
[0035]
b:取缓释包衣材料,加水制作包衣液,备用;
[0036]
c:将步骤a中所得素片用步骤b中所得包衣液进行包衣,即得琥珀酸舒马普坦缓释片。
[0037]
更具体的,所述制备方法包括以下步骤:
[0038]
a:取处方量的琥珀酸舒马普坦、预胶化淀粉、甘露醇、低取代羟丙基纤维素、羧甲基淀粉钠、羟乙基纤维素、海藻酸钠、助流剂混合,压片,得素片备用;
[0039]
b:取处方量的eudragit rl 30d、柠檬酸三乙酯、二甲基硅油乳液,加适量水制作包衣液,备用;
[0040]
c:将步骤a中所得素片用步骤b中所得包衣液进行包衣,即得琥珀酸舒马普坦缓释片。
[0041]
与现有技术相比,本发明具有以下技术效果:
[0042]
本发明所制备的琥珀酸舒马普坦缓释片在消化液中释药徐缓,胃肠道转运时间相对恒定,避免剂量突释现象,具有较高的生物利用度,且稳定性高,能保证临床用药安全性;同时制备工艺简单,技术难度低,批次间的差异小,释放曲线重现性好,利于工业化的大规模生产。
附图说明
[0043]
图1为实施例1、2、3所得琥珀酸舒马普坦缓释片的体外累积释放曲线图。
[0044]
图2为实施例1、4、5、6所得琥珀酸舒马普坦缓释片的体外累积释放曲线图。
[0045]
图3为实施例1、9、10、11所得琥珀酸舒马普坦缓释片的体外累积释放曲线图。
[0046]
图4为实施例1、对比实施例1、2所得琥珀酸舒马普坦缓释片,对比实施例3所得琥珀酸舒马普坦片的体外累积释放曲线图。
具体实施例
[0047]
实施例1:琥珀酸舒马普坦缓释片(1000片)
[0048][0049][0050]
制备方法:
[0051]
取处方量的琥珀酸舒马普坦、预胶化淀粉、甘露醇混合均匀,再加入处方量的低取代羟丙纤维素、羧甲基淀粉钠、羟乙纤维素、海藻酸钠、微粉硅胶混合均匀,最后加入处方量的硬脂酸镁混合均匀,压片机制得素片,备用。
[0052]
取处方量的eudragit rs 30d、柠檬酸三乙酯加入水中,匀浆机匀化,过滤,加入处方量二甲基硅油乳液,得包衣液,备用。
[0053]
将上述所得素片在包衣锅中以上述所得包衣液进行包衣,即得琥珀酸舒马普坦缓释片。
[0054]
实施例2琥珀酸舒马普坦缓释片(1000片)
[0055][0056][0057]
制备方法参考实施例1。
[0058]
实施例3琥珀酸舒马普坦缓释片(1000片)
[0059]
[0060]
制备方法参考实施例1。
[0061]
实施例4琥珀酸舒马普坦缓释片(1000片)
[0062][0063][0064]
制备方法参考实施例1。
[0065]
实施例5琥珀酸舒马普坦缓释片(1000片)
[0066][0067]
制备方法参考实施例1。
[0068]
实施例6琥珀酸舒马普坦缓释片(1000片)
[0069][0070]
[0071]
制备方法参考实施例1。
[0072]
实施例7琥珀酸舒马普坦缓释片(1000片)
[0073][0074]
制备方法参考实施例1。
[0075]
实施例8琥珀酸舒马普坦缓释片(1000片)
[0076]
[0077][0078]
制备方法参考实施例1。
[0079]
实施例9琥珀酸舒马普坦缓释片(1000片)
[0080][0081]
制备方法参考实施例1。
[0082]
实施例10琥珀酸舒马普坦缓释片(1000片)
[0083][0084][0085]
制备方法参考实施例1。
[0086]
实施例11
[0087][0088]
对比实施例1琥珀酸舒马普坦缓释片(1000片)
[0089][0090]
制备方法:
[0091]
取处方量的琥珀酸舒马普坦、预胶化淀粉、甘露醇混合均匀,再加入处方量的低取代羟丙纤维素、羧甲基淀粉钠、微粉硅胶混合均匀,最后加入处方量的硬脂酸镁混合均匀,压片机制得素片,备用。
[0092]
取处方量的eudragit rs 30d、柠檬酸三乙酯加入水中,匀浆机匀化,过滤,加入处方量二甲基硅油乳液,得包衣液,备用。
[0093]
将上述所得素片在包衣锅中以上述所得包衣液进行包衣,即得琥珀酸舒马普坦缓释片。对比实施例2琥珀酸舒马普坦缓释片(1000片)
[0094]
[0095]
制备方法:
[0096]
取处方量的琥珀酸舒马普坦、预胶化淀粉、甘露醇混合均匀,再加入处方量的低取代羟丙纤维素、羧甲基淀粉钠、微粉硅胶混合均匀,最后加入处方量的硬脂酸镁混合均匀,压片机制得素片,备用。
[0097]
取处方量的eudragit rs 30d加入水中,匀浆机匀化,过滤,得包衣液,备用。
[0098]
将上述所得素片在包衣锅中以上述所得包衣液进行包衣,即得琥珀酸舒马普坦缓释片。
[0099]
对比实施例3琥珀酸舒马普坦片(1000片)
[0100][0101][0102]
制备方法:
[0103]
取处方量的琥珀酸舒马普坦、微晶纤维素、无水磷酸氢钙混合均匀,再加入处方量的交联羧甲基纤维素钠、碳酸氢钠混合均匀,最后加入处方量的硬脂酸镁混合均匀,压片机制得素片,备用。
[0104]
取处方量的羟丙甲纤维素加入水中,匀浆机匀化,过滤,得包衣液,备用。
[0105]
将上述所得素片在包衣锅中以上述所得包衣液进行包衣,即得琥珀酸舒马普坦片。
[0106]
溶出检测
[0107]
释放度照溶出度与释放度测定法(中国药典2015年版四部通则0931第二法)测定。
[0108]
将实施例1、2、3、4、5、6、9、10、11,对比实施例1、2所得琥珀酸舒马普坦缓释片、对比实施例3所得琥珀酸舒马普坦片分别以磷酸缓冲液(ph7.4)900ml为溶出介质,转速每分钟50转,依法操作,经10min、20min、30min、60min、90min、120min、180min、240min、360min时分别取样5ml,制作供试品溶液。取琥珀酸舒马普坦对照品制作对照品溶液。分别取供试品溶液和对照品溶液做溶出曲线测定。测试结果如表1所示。
[0109]
由实验结果可知,本发明所制备的琥珀酸舒马普坦缓释片在6h内平稳释放,可有效避免突释现象。
[0110]
表1琥珀酸舒马普坦缓释片体外累积释放度(%)
[0111][0112][0113]
稳定性考察:
[0114]
取实施例1
‑
4、实施例9
‑
11、对比实施例1
‑
3所得片剂进行加速、长期实验,考察稳定性。
[0115]
加速试验:按市售包装,在温度40℃
±
2℃,相对湿度75%
±
5%的条件下放置6个月,分别于第1、2、3、6个月取样,考察其有关物质和含量,并与初始相比较,评价其稳定性。
[0116]
长期实验:按市售包装,在温度25℃
±
2℃,相对湿度60%
±
10%的条件下放置12个月,分别于第3、6、9、12个月取样,考察其有关物质和含量,并与初始相比较,评价其稳定性。
[0117]
经稳定性试验考察,本发明所得琥珀酸舒马普坦缓释片稳定性明显优于对比实施例。
[0118]
表2琥珀酸舒马普坦缓释片有关物质考察(%)
[0119][0120]
表3琥珀酸舒马普坦缓释片含量考察(%)
[0121][0122]
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1