子宫内皮修复的脐血干细胞外泌体复合制剂的制备方法与流程
1.本发明涉及脐血干细胞外泌体制备及应用技术领域,具体是涉及子宫内皮修复的脐血干细胞外泌体复合制剂的制备方法。
背景技术:
2.脐带血是指胎儿娩出,将脐带结扎并离断后,残留在胎盘和脐带中的血液。脐带血中含有大量的干细胞,包括造血干细胞和多种其他干细胞,统称为脐血干细胞。脐带血造血干细胞已经有30多年拯救生命的历史。目前还有多项脐带血在再生医学方面的临床研究,目的是利用脐带血干细胞促进机体组织和器官的损伤修复。
3.目前,脐血干细胞的作用机理已成为当今研究的热点,尤其是培养基中的生物活性因子,如外泌体和可溶性的因子等被广泛的开发研究,尤其是由脐血干细胞外泌体制备的复合制剂可以对各种人体组织进行损伤修复,抑制炎症反应,调节免疫系统等。同时,外泌体制剂相比细胞更具有优势,其稳定易保存且兼容性强不存在排斥各类反应,为许多疾病提供了新的启发,如减少心肌梗死的面积,促进肾脏的损伤修复,调节免疫应答等,脐血干细胞外泌体复合制剂有望成为未来干细胞治疗的又一新的方向。
4.子宫内皮是指构成哺乳类子宫内壁的一层。对雌激素和孕激素都起反应,因此可随着性周期(发情周期、月经周期)发生显著的变化。子宫内皮病变引发的疾病目前正呈多发趋势,影响了10—15%的女性。目前对于子宫内皮修复的治疗一般采取药物治疗和手术治疗,根据严重程度不同采取不同的治疗方法,而目前还少有将脐血干细胞外泌体为主要制剂用于治疗子宫内皮疾病。
5.此外,对于外泌体制剂的治疗机制还需进一步明确,同时对于外泌体制剂的制备方法及配方还需改进。专利cn107519207a公开了一种免疫抑制细胞制剂及其制备方法和应用,具体包括:treg细胞、脐带间充质干细胞外泌体、脐血单个核细胞、脐血浆和医学上可接受的溶剂,以及所述免疫抑制细胞制剂在制备预防和治疗系统性红斑狼疮药物中的应用。同时还提供了上述免疫抑制细胞制剂的制备方法。该发明专利的有益效果在于treg细胞和脐带间充质干细胞外泌体先发挥抑制机体免疫亢进、平衡机体免疫系统功能,脐血单个核细胞再发挥免疫调控作用,改善血液环境,从根本上解决免疫系统紊乱的问题。但是,该外泌体制剂的应用范围比较有限,针对性有待提高,对于外泌体的利用效果有待于进一步改进。
技术实现要素:
6.针对上述存在的问题,本发明提供了一种子宫内皮修复的脐血干细胞外泌体复合制剂的制备方法
7.本发明的技术方案是:
8.子宫内皮修复的脐血干细胞外泌体复合制剂的制备方法,包括以下步骤:
9.s1、取样:将脐带血放入容器中进行表面消毒处理,持续进行紫外线消毒,并向容
器中加入抗凝血剂和质量浓度为6%的羟乙基淀粉,混匀并去除红细胞;
10.s2、梯度离心:将所述容器密封后倒置静置60min去上清液保留沉淀细胞,再在10-14℃温度下、150-200g离心力条件下离心8-10min去上清液保留沉淀细胞,使用注射器注入含有白细胞的血浆,在室温下、180-220g离心力条件下离心8-10min去上清液保留沉淀细胞,注入氯化钠注射液后混匀,在200-220g离心力条件下离心8-10min去上清液保留沉淀细胞即为脐血干细胞;
11.s3、培养基培养:将dmem/f12培养基放入培养皿中,加入步骤s2得到的脐血干细胞,待脐血细胞增殖融合至80%后按照1:5的传代比进行传代,待第四代脐血细胞增殖融合至对数生长期时,去除培养基并使用磷酸盐缓冲液漂洗3次,随后加入处理后的dmem培养基,继续培养24h,收集脐血干细胞培养基;
12.s4、外泌体分离:预冷离心机至0-4℃,加入步骤s3中得到的脐血干细胞培养基在300-350g离心力作用下离心8-10min,去除细胞碎片保留上清液,将上清液转移至超速离心管中并加入磷酸盐缓冲液至离心前的重量,在29500-30000g离心力作用下离心16-20min,去除细胞碎片保留上清液,使用过滤器过滤,再转移至另一无菌消毒超速离心管中,在120000-130000g离心力作用下离心90-100min,去上清液保留管底脐血干细胞外泌体;
13.s5、复合制剂制备:取步骤s4中得到的脐血干细胞外泌体1-5重量份,透明质酸2-4重量份,苦参0.2-0.6重量份,藏红花0.1-0.5重量份以及椿白皮0.1-0.3重量份,溶解于5-7重量份的甘油溶剂中,加温至18-24℃静置30min,再加入s4中得到的脐血干细胞外泌体1-3重量份混匀,得到脐血干细胞外泌体复合制剂。
14.进一步地,所述步骤s1中在放入脐带血之前对容器瓶口使用爱尔碘擦拭2遍,去除红细胞的步骤为:加入抗凝血剂和质量浓度为6%的羟乙基淀粉后,混匀时间为5-8min,在10-14℃温度下、50g离心力作用下离心10min,静置15min分层清晰后,使用注射器匀速从容器中抽取红细胞。排除红细胞对收集的脐血干细胞的干扰。
15.更进一步地,所述去除红细胞的步骤中,使用注射器匀速从容器中抽取红细胞时抽取至分层界面距离容器底部2-3cm。避免抽取过多的红细胞造成脐血干细胞的流失。
16.进一步地,所述步骤s1中脐带血为15重量份,抗凝血剂为2-3重量份,羟乙基淀粉为1-2重量份。制备比例可根据使用需要进行调节。
17.进一步地,所述步骤s2中含有白细胞的血浆为3-4重量份,其中人血白蛋白占血浆总量的20-25%,所述氯化钠注射液为2.5-3重量份。该成分配比能够达到更好的分离效果。
18.进一步地,所述步骤s3中dmem/f12培养基为5-7重量份,dmem培养基的处理方法为:将7重量份的dmem培养基在120000g离心力的作用下离心12h,得到上清液,向上清液中加入1重量份的β-磷酸甘油、0.4-0.7重量份的地塞米松、0.1重量份的维生素c,混匀后再加入1-1.3重量份的型i胶原酶,混匀5min得到处理后的dmem培养基。通过对培养基的改良提高提取效果,更有利于脐血干细胞的生长,从而节省了人力物力财力。
19.进一步地,所述步骤s4中过滤器滤孔为0.22μm。滤去杂质以及除菌作用。
20.进一步地,所述步骤s4中磷酸盐缓冲液的配制方法为:将2重量份的kcl、8重量份的nacl、2.4-3重量份的kh2po4、0.7-1.1重量份的na2hpo4溶于15-20重量份的二次蒸馏水中,高压灭菌6h,得到磷酸盐缓冲液。该缓冲液兼容性好,不会对脐血干细胞外泌体结构造成损伤。
21.进一步地,所述步骤s5还包括:将所得得到的脐血干细胞外泌体复合制剂置于-45~-33℃条件下冷冻保存24h,取出后粉碎得到脐血干细胞外泌体复合制剂冻干粉末。有利于保存以及便于分装使用。
22.本发明的有益效果是:
23.(1)本发明的脐血干细胞外泌体复合制剂的制备方法通过科学合理地设置工艺流程,达到取得完整外泌体的目的,通过对脐带血进行处理并梯度离心,从而收集活性较好的脐血干细胞,再通过外泌体分离得到结构较为完整的外泌体,避免外泌体中的rna或蛋白等成分在分离过程中丢失,同时也在一定程度上节省了培养基的消耗。
24.(2)本发明的脐血干细胞外泌体复合制剂通过对培养基的改良从而提高脐血干细胞的增殖能力,保证了细胞完整性达到最大的培养效率,以及对复合制剂各个组分的配比选用调整,使其在用于子宫内皮修复时能够起到良好的效果,免疫排斥反应低,为脐血干细胞外泌体的应用提供了新的研究思路。
具体实施方式
25.实施例1
26.子宫内皮修复的脐血干细胞外泌体复合制剂的制备方法,包括以下步骤:
27.s1、取样:将脐带血放入容器中进行表面消毒处理,持续进行紫外线消毒,在放入脐带血之前对容器瓶口使用爱尔碘擦拭2遍,并向容器中加入抗凝血剂和质量浓度为6%的羟乙基淀粉,混匀并去除红细胞,脐带血为15重量份,抗凝血剂为2.6重量份,羟乙基淀粉为1.4重量份,去除红细胞的步骤为:加入抗凝血剂和质量浓度为6%的羟乙基淀粉后,混匀时间为6min,在11.8℃温度下、50g离心力作用下离心10min,静置15min分层清晰后,使用注射器匀速从容器中抽取红细胞,使用注射器匀速从容器中抽取红细胞时抽取至分层界面距离容器底部2.2cm;
28.s2、梯度离心:将容器密封后倒置静置60min去上清液保留沉淀细胞,再在11.8℃温度下、160g离心力条件下离心9min去上清液保留沉淀细胞,使用注射器注入含有白细胞的血浆,在室温下、200g离心力条件下离心9min去上清液保留沉淀细胞,注入氯化钠注射液后混匀,在215g离心力条件下离心9min去上清液保留沉淀细胞即为脐血干细胞;
29.s3、培养基培养:将6重量份dmem/f12培养基放入培养皿中,加入步骤s2得到的脐血干细胞,待脐血细胞增殖融合至80%后按照1:5的传代比进行传代,待第四代脐血细胞增殖融合至对数生长期时,去除培养基并使用磷酸盐缓冲液漂洗3次,随后加入处理后的dmem培养基,继续培养24h,收集脐血干细胞培养基,含有白细胞的血浆为3重量份,其中人血白蛋白占血浆总量的22%,氯化钠注射液为2.7重量份,dmem培养基的处理方法为:将7重量份的dmem培养基在120000g离心力的作用下离心12h,得到上清液,向上清液中加入1重量份的β-磷酸甘油、0.5重量份的地塞米松、0.1重量份的维生素c,混匀后再加入1.2重量份的型i胶原酶,混匀5min得到处理后的dmem培养基;
30.s4、外泌体分离:预冷离心机至2℃,加入步骤s3中得到的脐血干细胞培养基在334g离心力作用下离心9min,去除细胞碎片保留上清液,将上清液转移至超速离心管中并加入磷酸盐缓冲液至离心前的重量,在29700g离心力作用下离心18min,去除细胞碎片保留上清液,使用0.22μm过滤器过滤,再转移至另一无菌消毒超速离心管中,在126000g离心力
作用下离心95min,去上清液保留管底脐血干细胞外泌体,磷酸盐缓冲液的配制方法为:将2重量份的kcl、8重量份的nacl、2.7重量份的kh2po4、1重量份的na2hpo4溶于19重量份的二次蒸馏水中,高压灭菌6h,得到磷酸盐缓冲液;
31.s5、复合制剂制备:取步骤s4中得到的脐血干细胞外泌体3重量份,透明质酸3重量份,苦参0.5重量份,藏红花0.2重量份以及椿白皮0.2重量份,溶解于6重量份的甘油溶剂中,加温至21℃静置30min,再加入s4中得到的脐血干细胞外泌体2重量份混匀,得到脐血干细胞外泌体复合制剂,将所得得到的脐血干细胞外泌体复合制剂置于-41℃条件下冷冻保存24h,取出后粉碎得到脐血干细胞外泌体复合制剂冻干粉末。
32.实施例2
33.本实施例与实施例1基本相同,其不同之处在于:步骤s1取样中脐带血和抗凝血剂、羟乙基淀粉的配比不同。
34.s1、取样:将脐带血放入容器中进行表面消毒处理,持续进行紫外线消毒,在放入脐带血之前对容器瓶口使用爱尔碘擦拭2遍,并向容器中加入抗凝血剂和质量浓度为6%的羟乙基淀粉,混匀并去除红细胞,脐带血为15重量份,抗凝血剂为2重量份,羟乙基淀粉为1重量份。
35.实施例3
36.本实施例与实施例1基本相同,其不同之处在于:步骤s1取样中脐带血和抗凝血剂、羟乙基淀粉的配比不同。
37.s1、取样:将脐带血放入容器中进行表面消毒处理,持续进行紫外线消毒,在放入脐带血之前对容器瓶口使用爱尔碘擦拭2遍,并向容器中加入抗凝血剂和质量浓度为6%的羟乙基淀粉,混匀并去除红细胞,脐带血为15重量份,抗凝血剂为3重量份,羟乙基淀粉为2重量份。
38.实施例4
39.本实施例与实施例1基本相同,其不同之处在于:步骤s1取样中去除红细胞的步骤不同。
40.去除红细胞的步骤为:加入抗凝血剂和质量浓度为6%的羟乙基淀粉后,混匀时间为5min,在10℃温度下、50g离心力作用下离心10min,静置15min分层清晰后,使用注射器匀速从容器中抽取红细胞,使用注射器匀速从容器中抽取红细胞时抽取至分层界面距离容器底部2cm。
41.实施例5
42.本实施例与实施例1基本相同,其不同之处在于:步骤s1取样中去除红细胞的步骤不同。
43.去除红细胞的步骤为:加入抗凝血剂和质量浓度为6%的羟乙基淀粉后,混匀时间为8min,在14℃温度下、50g离心力作用下离心10min,静置15min分层清晰后,使用注射器匀速从容器中抽取红细胞,使用注射器匀速从容器中抽取红细胞时抽取至分层界面距离容器底部3cm。
44.实施例6
45.本实施例与实施例1基本相同,其不同之处在于:步骤s2梯度离心的方法不同。
46.s2、梯度离心:将容器密封后倒置静置60min去上清液保留沉淀细胞,再在10℃温
度下、150g离心力条件下离心8min去上清液保留沉淀细胞,使用注射器注入含有白细胞的血浆,在室温下、180g离心力条件下离心8min去上清液保留沉淀细胞,注入氯化钠注射液后混匀,在200g离心力条件下离心8min去上清液保留沉淀细胞即为脐血干细胞。
47.实施例7
48.本实施例与实施例1基本相同,其不同之处在于:步骤s2梯度离心的方法不同。
49.s2、梯度离心:将容器密封后倒置静置60min去上清液保留沉淀细胞,再在14℃温度下、200g离心力条件下离心10min去上清液保留沉淀细胞,使用注射器注入含有白细胞的血浆,在室温下、220g离心力条件下离心10min去上清液保留沉淀细胞,注入氯化钠注射液后混匀,在220g离心力条件下离心10min去上清液保留沉淀细胞即为脐血干细胞。
50.实施例8
51.本实施例与实施例1基本相同,其不同之处在于:步骤s3培养基培养的方法不同。
52.s3、培养基培养:将5重量份dmem/f12培养基放入培养皿中,加入步骤s2得到的脐血干细胞,待脐血细胞增殖融合至80%后按照1:5的传代比进行传代,待第四代脐血细胞增殖融合至对数生长期时,去除培养基并使用磷酸盐缓冲液漂洗3次,随后加入处理后的dmem培养基,继续培养24h,收集脐血干细胞培养基,含有白细胞的血浆为3重量份,其中人血白蛋白占血浆总量的20%,氯化钠注射液为2.5重量份,dmem培养基的处理方法为:将7重量份的dmem培养基在120000g离心力的作用下离心12h,得到上清液,向上清液中加入1重量份的β-磷酸甘油、0.4重量份的地塞米松、0.1重量份的维生素c,混匀后再加入1重量份的型i胶原酶,混匀5min得到处理后的dmem培养基。
53.实施例9
54.本实施例与实施例1基本相同,其不同之处在于:步骤s3培养基培养的方法不同。
55.s3、培养基培养:将7重量份dmem/f12培养基放入培养皿中,加入步骤s2得到的脐血干细胞,待脐血细胞增殖融合至80%后按照1:5的传代比进行传代,待第四代脐血细胞增殖融合至对数生长期时,去除培养基并使用磷酸盐缓冲液漂洗3次,随后加入处理后的dmem培养基,继续培养24h,收集脐血干细胞培养基,含有白细胞的血浆为4重量份,其中人血白蛋白占血浆总量的25%,氯化钠注射液为3重量份,dmem培养基的处理方法为:将7重量份的dmem培养基在120000g离心力的作用下离心12h,得到上清液,向上清液中加入1重量份的β-磷酸甘油、0.7重量份的地塞米松、0.1重量份的维生素c,混匀后再加入1.3重量份的型i胶原酶,混匀5min得到处理后的dmem培养基。
56.实施例10
57.本实施例与实施例1基本相同,其不同之处在于:步骤s4外泌体分离的方法不同。
58.s4、外泌体分离:预冷离心机至0℃,加入步骤s3中得到的脐血干细胞培养基在300g离心力作用下离心8min,去除细胞碎片保留上清液,将上清液转移至超速离心管中并加入磷酸盐缓冲液至离心前的重量,在29500g离心力作用下离心16min,去除细胞碎片保留上清液,使用0.22μm过滤器过滤,再转移至另一无菌消毒超速离心管中,在120000g离心力作用下离心90min,去上清液保留管底脐血干细胞外泌体。
59.实施例11
60.本实施例与实施例1基本相同,其不同之处在于:步骤s4外泌体分离的方法不同。
61.s4、外泌体分离:预冷离心机至4℃,加入步骤s3中得到的脐血干细胞培养基在
350g离心力作用下离心10min,去除细胞碎片保留上清液,将上清液转移至超速离心管中并加入磷酸盐缓冲液至离心前的重量,在30000g离心力作用下离心20min,去除细胞碎片保留上清液,使用0.22μm过滤器过滤,再转移至另一无菌消毒超速离心管中,在130000g离心力作用下离心100min,去上清液保留管底脐血干细胞外泌体。
62.实施例12
63.本实施例与实施例1基本相同,其不同之处在于:步骤s4中磷酸盐缓冲液的成分配比不同。
64.磷酸盐缓冲液的配置方法为:将2重量份的kcl、8重量份的nacl、2.4重量份的kh2po4、0.7重量份的na2hpo4溶于15重量份的二次蒸馏水中,高压灭菌6h,得到磷酸盐缓冲液。
65.实施例13
66.本实施例与实施例1基本相同,其不同之处在于:步骤s4中磷酸盐缓冲液的成分配比不同。
67.磷酸盐缓冲液的配置方法为:将2重量份的kcl、8重量份的nacl、3重量份的kh2po4、1.1重量份的na2hpo4溶于20重量份的二次蒸馏水中,高压灭菌6h,得到磷酸盐缓冲液。
68.实施例14
69.本实施例与实施例1基本相同,其不同之处在于:步骤s5复合机制备方法不同。
70.s5、复合制剂制备:取步骤s4中得到的脐血干细胞外泌体1重量份,透明质酸2重量份,苦参0.2重量份,藏红花0.1重量份以及椿白皮0.1重量份,溶解于5重量份的甘油溶剂中,加温至18℃静置30min,再加入s4中得到的脐血干细胞外泌体1重量份混匀,得到脐血干细胞外泌体复合制剂,将所得得到的脐血干细胞外泌体复合制剂置于-33℃条件下冷冻保存24h,取出后粉碎得到冻干粉末。
71.实施例15
72.s5、复合制剂制备:取步骤s4中得到的脐血干细胞外泌体5重量份,透明质酸4重量份,苦参0.6重量份,藏红花0.5重量份以及椿白皮0.3重量份,溶解于7重量份的甘油溶剂中,加温至24℃静置30min,再加入s4中得到的脐血干细胞外泌体3重量份混匀,得到脐血干细胞外泌体复合制剂,将所得得到的脐血干细胞外泌体复合制剂置于-45℃条件下冷冻保存24h,取出后粉碎得到冻干粉末。
73.实验例
74.将实施例1-15制备的脐血干细胞外泌体复合制剂进行性能检测实验,主要对分离的脐血干细胞密度进行测定,同时与常规自然沉降结合离心的方法进行对比;对复合制剂作用在子宫内皮上的修复效果进行测定,同时与市售常规复合制剂进行对比,结果如表1和2所示。
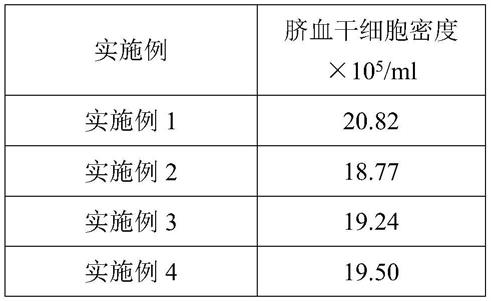
75.表1实施例1-7中分离的脐血干细胞密度
[0076][0077][0078]
由上表可以看出,实施例1-7中的脐血干细胞提取方法所提取的脐血干细胞密度明显比常规沉降加离心的方法得到的脐血干细胞密度大,本方法的脐血干细胞采集和分离效果较好,且受操作条件的影响较小,对比实施例1-7中可以看出,各组实施例的结果差距不大,其中,选用合适的抗凝血剂、羟乙基淀粉的配比对脐血干细胞密度有一定影响,在本发明给出的范围内均能够打到一个较好的采集效果,而实施例1中的脐带血和抗凝血剂、羟乙基淀粉的配比为最优配比;
[0079]
在去除红细胞以及梯度离心时,离心不稳定会对脐血干细胞造成伤害,且离心力的大小、温度以及离心时间均会对脐血干细胞的回收率产生影响,实施例6中采用了较小的离心力进行离心,收集到的脐血干细胞密度自然较低,但是完整度较好,实施例7中采用了较大的离心力,收集到的脐血干细胞密度较高但是在离心过程中可能会存在脐血干细胞的损伤,从而也影响了回收率,因此,选用实施例1中的梯度离心参数最优。
[0080]
在对复合制剂作用在子宫内皮上的修复效果进行测定时,采用动物的子宫内皮进行实验,将复合制剂作用在子宫内皮上之后,在第14天根据形态学分析子宫内皮创面愈合率,利用塑料薄膜覆盖伤口,方格纸计算伤口面积,新生组织表达角朊细胞标志物ck14,he染色后拍取照片,软件测量新生表皮厚度,结果如下:
[0081]
表2实施例1、8-15的脐血干细胞复合制剂对子宫内皮修复效果
[0082]
[0083][0084]
由上表可以看出,实施例1、8-15中使用本发明的脐血干细胞复合制剂对子宫内皮的修复效果要明显优于市售常规复合制剂,对比实施例1、8、9,本发明对dmem培养基的处理方法更有利于脐血干细胞的生长,其中,培养基的组分配比以及处理方法均对脐血干细胞的培养增殖有一定影响,从而对最终的子宫内皮修复效果产生影响,实施例1中的培养条件能够取得最优培养效果,如何取得更好的培养效果还需要更多的实验探索;
[0085]
对比实施例1、10、11,外泌体的分离对于本发明的复合制剂产生重要影响,选择合适的离心力以及离心时间能够有效地去除死亡细胞、大的细胞残骸、凋亡小体以及其他的细胞器,得到较为完整的外泌体,同时使用纳米级的过滤器过滤也是十分必要的,可以将细胞碎片及大于200nm的囊泡全部去除,同时不会使外泌体穿过过滤器时被阻挡,在最少的操作步骤达到最优的分离效果,优选实施例1中的外泌体分离参数;
[0086]
对比实施例1、12、13,缓冲液的使用对于本发明的复合制剂起到辅助作用,能够保持外泌体的结构完整,选用本发明给出的缓冲液制备方法参数范围均能够取得较好的分离效果;
[0087]
对比实施例1、14、15,在通过外泌体制备复合制剂时,各个组分的选用以及配比能够对复合制剂的效果产生影响,同时合理的保存条件也是重要的影响因素之一,本发明的复合制剂组成成分对人体副作用小,且能够起到良好的恢复作用,适当的保存温度能够使复合制剂中的外泌体保持活性,从而保持其对于子宫内皮的修复性能,实施例1中的复合制剂制备参数为最优。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1