PTH1R作为靶点在治疗或预防非酒精性脂肪性肝纤维化中的应用
pth1r作为靶点在治疗或预防非酒精性脂肪性肝纤维化中的应用
技术领域
1.本发明涉及pth1r作为靶点在治疗或预防非酒精性脂肪性肝纤维化中的应 用,属于生物医药技术领域。
背景技术:
2.随着肥胖流行和生活方式的改变,非酒精性脂肪性肝病(nonalcoholic fattyliver disease,nafld)发病率呈逐年递增,威胁全球近四分之一人口的医疗健 康。脂肪性肝损伤造成肝细胞过氧化应激、内质网应激等,导致肝细胞死亡,并 进一步形成了肝脂肪积蓄-肝损伤-胰岛素抵抗-脂质代谢紊乱的恶性循环。肝细胞 损伤激发炎症反应,趋化免疫细胞浸润,诱发炎症形成。既往报道nafld进展 过程中脂质过氧化、炎症小体与肠道微生物的相互作用、祖细胞扩增、适应性免 疫等多种机制均可最终诱导肝星状细胞(hepatic stellate cells,hscs)激活或转 分化为肌纤维母细胞,表达平滑肌肌动蛋白(alpha-smooth muscle actin,α-sma) 及细胞珠蛋白,分泌大量细胞外基质,尤其是胶原纤维(i型和iii型),诱导肝 纤维化形成。因此,脂肪性肝细胞损伤的持续及炎症应答将诱导肝纤维化持续进 展,是否伴有肝纤维化已成为非酒精性脂肪性肝炎(nonalcoholic steatohepatitis, nash)远期预后的重要指标。目前认为肝纤维化是一种动态、早期可逆的病程, 抑制脂毒性环境下hsc的活化及胶原分泌是有效的治疗策略。但是,尚无公认 的药物治疗方案,尤其是针对进展到肝纤维化甚至肝硬化的患者,缺乏早期有效 的干预将威胁患者生命。针对这一高危人群的抗肝纤维化药物研发、筛选治疗靶 点是现阶段亟待解决的临床问题。
3.甲状旁腺激素1型受体(parathyroid hormone 1receptor,pth1r)是一类b 类g蛋白偶联受体,且在hsc细胞中表达。目前发现pth1r与其配体甲状旁 腺激素(parathyroid hormone,pth)结合后可参与调控多种重要的病理生理过 程。而肥胖患者血清pth升高,和人体脂肪含量、nafld发病率呈独立正相关 关系,是重度肥胖患者罹患nash的预测因素之一。基于pth1r的激活机制以 及其对多种疾病的调控作用,研发以pth1r信号级联反应为靶点的药物是重要 的肝纤维化治疗的应用方向。但目前pth1r在nash肝纤维化中的作用机制尚 不清楚。
技术实现要素:
4.本发明所要解决的技术问题是:目前尚无有效的能够治疗nash肝纤维化、 肝硬化的药物。
5.为了解决上述技术问题,本发明提供了抑制pth1r表达和/或活性的试剂、 抑制pth1r/pth信号通路的试剂在制备治疗和/或预防非酒精性脂肪性肝纤维 化的药物中的应用。
6.优选地,所述的抑制pth1r表达和/或活性的试剂包括pth1r的特异性干 扰rna或
pth1r的抑制剂。
7.优选地,所述的pth1r的特异性干扰rna为:正义链序列如seqidno:1(gcacacagcagccaacauatt)所示、反义链序列如seqidno:2(uauguuggcugcugugugctt)所示的sirna。
8.优选地,所述的pth1r的抑制剂包括pth1r中和抗体。
9.优选地,所述药物包括医学上可接受的载体和有效量的活性成分,所述活性成分为抑制pth1r表达和/或活性的试剂或抑制pth1r/pth信号通路的试剂。
10.本发明通过动物实验证明,在不同疾病进展阶段,pth1r敲除可以降低nash小鼠血清中谷丙转氨酶(alt)和谷草转氨酶(ast)的水平。降低nash小鼠肝组织炎症基因表达的升高。组织染色显示敲除pth1r可以显著减轻nash小鼠的肝纤维化程度,而激活pth1r信号可以明显加重nash小鼠肝脏胶原纤维沉积。说明pth1r信号活化对预防或治疗nash肝纤维化具有重要的调控作用。
11.本发明通过细胞实验证明,在肝纤维化进程中pth1r在hsc细胞中表达水平显著升高。pth1r的敲除可以显著下降hsc细胞的增殖力,降低hsc细胞中多种细胞活化相关基因的表达,如α-sma、i型胶原纤维的分泌等。同时,pth1r敲除抑制hsc细胞肿瘤生长因子β(tgfβ)的表达,从而显著抑制hsc细胞的自我放大级联反应;相反的,激活pth1r信号可以促进hsc细胞活化,增加细胞增殖能力,促进大量胶原纤维分泌。说明pth1r参与nash疾病进展中胶原纤维沉积,抑制pth1r的表达可以显著地减缓或预防nash肝纤维化、肝硬化的发生。
12.与现有技术相比,本发明的有益效果在于:
13.本发明提供了pth1r作为靶点在治疗或预防nash肝纤维化中的新用途,特别是针对在脂毒性条件下抑制hsc细胞活化、增殖及分泌胶原纤维,为临床上nash肝纤维化疾病的防治提供了新的策略。
附图说明
14.图1为nash患者肝组织中pth1r表达情况,其中,a、b分别为人类肝纤维化组织样本单细胞测序数据的聚类分析图和小提琴分析图,c为nash患者肝组织样本中pth1r与纤维化标记蛋白α-sma的免疫荧光共定位染色分析;
15.图2为nash肝纤维化模型中pth1r的表达情况,其中,a为pth1r-gfapko小鼠及其野生对照小鼠肝脏原代肝细胞(ph)、星状细胞(hsc)、内皮细胞(lesc)中pth1r的mrna水平,b为pth1r-gfapko小鼠及其野生对照小鼠肝脏hsc细胞中pth1r的蛋白水平,c为pth干预小鼠及干预对照小鼠肝脏hsc细胞中pth1r的表达水平;
16.图3为nash肝纤维化模型下的pth1r-gfapko小鼠及其野生对照小鼠肝脏组织h&e、天狼星红染色及马松染色结果图;
17.图4为nash肝纤维化模型下的pth1r-gfapko小鼠及其野生对照小鼠血清中alt含量(a)和ast含量(b)的对比图;
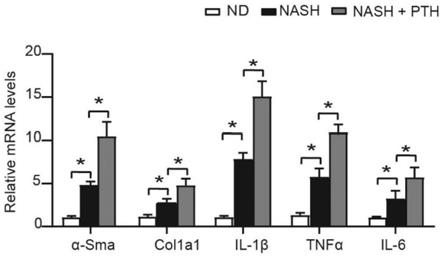
18.图5为nash肝纤维化模型下的pth1r-gfapko小鼠及其野生对照小鼠肝脏组织α-sma、col1a1、il-1β、tnf-α及il-6的mrna表达水平;
19.图6为在nash肝纤维化模型诱导后,pth干预下pth1r信号激活小鼠及其野生对照
并转移至-80℃冰箱中冻存备用。
34.(二)临床样本来源及检测方法
35.临床样本:
36.人类肝硬化组织样本由南京大学附属鼓楼医院伏晓博士合作提供,纳入标 准:选取2015年9月至2021年3月就诊于南京鼓楼医院并接受肝脏切除手术或 者胆囊手术的患者资料。经临床及病理诊断为有或无肝硬化的患者样本。样本收 集过程中受试者均已签署知情同意书并经伦理委员会批准。
37.检测方法:
38.1.原代肝hsc细胞提取
39.使用肝脏两步灌注法,先将小鼠浸没入75%乙醇中消毒10秒,取出后放入 超净台中的托盘上。用剪刀“十”字形切口开腹,切口最上面剪开肋骨,打开胸腔。 将小肠拨到小鼠的左边,显露出下腔静脉和肝门静脉。在胸腔中结扎下腔静脉, 将恒流泵出水管端的针从下向上插入下腔静脉,再用另外一根线固定针头。剪开 肝门静脉,用预热的灌注液1灌注肝脏,速度约10ml/分钟,灌注时间约7分 钟。用预热的灌注液2灌注肝脏,速度约10ml/分钟,灌注时间约10分钟。取 下肝脏组织后离心得到细胞悬液,用percoll分离法获得纯化的hsc细胞,细胞 培养条件是dmem培养基+10%胎牛血清,37℃,5%co2。
40.灌注液配方如下:
41.灌注液1:33mm kcl,0.441mm kh2po4,4.17mm nahco3,137.93mmnacl,0.338mm na2hpo4,4.75mg/ml d
–
葡萄糖,0.5mm乙二醇双(2-氨基乙 基醚)四乙酸。用1mm氢氧化钠调节至ph 7.4,0.22μm滤器无菌过滤。
42.灌注液2:3mm cacl2,1mm mgcl2,5.33mm kcl,0.441mm kh2po4,4.17 mm nahco3,137.93mm nacl,0.338mm na2hpo4,4.75mg/ml d
–
葡萄糖, 0.72%(w/v)牛血清白蛋白,0.005%ⅳ型胶原酶。用1mm氢氧化钠调节至ph 7.4,0.22μm滤器无菌过滤。
43.2.血清ast、alt测定
44.根据商业试剂盒说明书,按照下表配制检测:
[0045][0046]
血清alt的计算公式如下:
[0047]
alt(u/l)=(
▲
a样本管/分钟-▲
a空白管/分钟)
×
k;
[0048]
其中,k=4180(标准品较准理论k值)。
[0049]
ast计算同上。
[0050]
2.苏木素-伊红(h&e)染色
[0051]
肝脏组织用4%多聚甲醛固定24小时,石蜡包埋,切成4微米的切片脱蜡后 进行苏木素染色,经脱水、分化及封片步骤后利用显微镜进行图像采集分析。
[0052]
3.天狼星红染色
[0053]
肝脏石蜡包埋切片同上,滴入配制好天狼星红染液100μl(0.5%天狼星红染 液与饱和苦味酸溶液1:9混匀,加盐酸调节ph至小于4),37℃孵育2h。 经脱水、透明及封片步骤后利用显微镜进行图像采集分析。
[0054]
4.马松(masson)染色
[0055]
肝脏石蜡包埋切片同上,脱蜡后分别经重铬酸钾、铁苏木素、丽春红、磷钼 酸及苯胺蓝染色及超纯水冲洗,无水乙醇脱水后封片并利用显微镜进行图像采集 分析。
[0056]
5.f4/80荧光染色
[0057]
肝脏石蜡包埋切片同上,脱蜡后枸橼酸盐缓冲液微波抗原修复,封闭后滴加 f4/80一抗(美国cst公司)4℃过夜,洗涤后二抗敷育,dapi复染,梯度酒精 脱水,二甲苯透明,抗荧光淬灭封片剂封片。荧光显微镜下观察,可选用的激发 波长范围为450-500nm,发射波长为515-565nm(绿色荧光)。
[0058]
6.tunel染色
[0059]
肝脏石蜡包埋切片同上,脱蜡后滴加蛋白酶k工作液,漂洗后滴加平衡液 工作液,再滴加50μl的tdt酶工作液,加盖玻片于37℃湿盒避光反应。dapi 复染,抗荧光淬灭封片剂封片。荧光显微镜下观察,可选用的激发波长范围为 450-500nm,发射波长为515-565nm(绿色荧光)。
[0060]
7.α-sma荧光染色
[0061]
肝脏石蜡包埋切片同上,脱蜡后枸橼酸盐缓冲液微波抗原修复,滴加α-sma 一抗(美国cst公司)4℃过夜,洗涤后二抗敷育,dapi复染,梯度酒精脱水, 二甲苯透明,抗荧光淬灭封片剂封片。荧光显微镜下观察,可选用的激发波长范 围为450-500nm,发射波长为515-565nm(绿色荧光)。
[0062]
8.实时定量pcr
[0063]
使用trizol(美国invitrogen公司,货号15596018)裂解小鼠细胞及肝脏组 织,根据takara公司逆转录试剂盒逆转录成cdna,使用引物设计软件primer 5 设计pcr引物,并使用ncbi网站blast功能检测pcr引物特异性。在冰上 加样完成后,将反应板放入lightcycler 480荧光定量pcr仪中,设置如下反应 参数:
[0064]
过程反应条件时间预变性95℃5min扩增95℃15s(循环数:40)60℃1min 60℃34s 95℃5s溶解曲线65℃1min冷却40℃30s
[0065]
最后,计算相对定量:以gapdh为内参,采用相对定量方法即2-δδct
法计算目 的基
因相对含量。
[0066]
rt-pcr引物序列如下:
[0067][0068]
9.蛋白免疫印迹技术(western blots)
[0069]
利用ripa裂解液(含1mm磷酸酶抑制剂+1mm蛋白磷酸酶抑制剂)提取 肝组织或细胞中蛋白,进行十二烷基硫酸钠聚丙烯酞氨凝胶电泳(sds-page), 再bio-rad仪器进行转膜(200ma),封闭剂封闭后加入相应浓度一抗(稀释比), pth1r(1:1000)、α-sma(1:1000)、collagen i(1:1000)、tgfβ1(1: 1000)及gapdh(1:2000);4℃摇床过夜。洗涤后敷育二抗。将条带浸泡入 发光液中,然后置于自动曝光机中,读取条带图像并按样本名称保存;利用imagej软件分析图像各泳道条带灰度值,以目的蛋白/内参蛋白计算相对灰度值,并进 行组间比较。
[0070]
10.统计学方法
[0071]
各组数据结果均采用平均数
±
标准误方法表示;各组间差异比较使用单因素 方差分析,两两比较采用最小显著差异法。数据分析采用spss 22.0统计软件进 行,p<0.05(双侧)认为有统计学差异。
[0072]
(三)实验及结果
[0073]
1.确定pth1r在肝纤维化进程中主要的应答细胞类型
[0074]
如图1显示,基于单细胞测序检测技术的生物学信息分析的聚类分析图(图 1a)和小提琴分析图(图1b)显示,在纤维化进程中人类肝脏组织中pth1r 主要在hsc细胞中表达水平显著增加。免疫荧光共定位的染色分析显示在nash 患者肝组织中,pth1r与纤维化标记蛋白α-sma存在显著的共定位关系,如图 1c显示。提示hsc细胞是pth1r在nash肝纤维化进程中的主要作用细胞。
[0075]
2.pth1r-gfap ko小鼠与pth干预激活pth1r小鼠模型的建立
[0076]
取成年小鼠肝脏组织进行western blotting分析,相比于野生型wt小鼠, 结果如图2a-b显示,ko小鼠原代hsc细胞中pth1r蛋白表达显著降低,而 不是总细胞或肝细胞;同时,图2c显示pth干预小鼠原代hsc中pth1r表达 水平明显高于对照组小鼠。说明成功建立了pth1r-gfap ko小鼠与pth干预 激活pth1r的小鼠模型。
[0077]
3.pth1r-gfap ko小鼠可以抵抗nash诱导的肝纤维化形成
[0078]
饮食诱导nash纤维化模型并进行组织学评估,结果如图3显示,he组织 染色显示nash模型小鼠肝组织严重脂肪变性、炎症浸润,肝索结构明显紊乱、 界板形成,天狼星红染色及马松染色显示nash模型小鼠肝组织胶原纤维显著 沉积、肝纤维化形成。相较之下,pth1r-gfap ko小鼠肝组织中的胶原沉积明 显减轻,由此看出,hsc中pth1r在nash肝纤维化中是有力的干预点。同时, 结果如图4所示,nash肝纤维化模型小鼠肝脏血清肝酶alt、ast较wt小 鼠显著升高,而pth1r-gfap ko小鼠中肝酶水平显著下降。提示敲除pth1r 可以显著降低nash肝纤维化小鼠肝酶水平。
[0079]
4、pth1r-gfap ko对nash小鼠肝脏炎症反应的影响
[0080]
炎症状态是nash肝纤维化进展的重要诱导因素。为进一步评估nash疾 病中脂毒性相关肝脏炎症的损伤改变,检测了肝组织中炎症标志物il-1β、tnf-α 及il-6的表达水平。结果如图5所示,pcr检测结果发现nash肝纤维化模型 小鼠肝脏α-sma、col1a1、il-1β、tnf-α及il-6的mrna表达水平较wt小 鼠明显升高,而pth1r-gfap ko小鼠较对照组上述炎症基因水平显著下降。这 些结果进一步印证了pth1r敲除可以有效抑制nash纤维化进程中的肝脏炎症 水平。
[0081]
5.pth1r信号激活加重nash所致的肝纤维化损伤
[0082]
在动物模型中,pth干预nash小鼠12周,检测pth1r活化后肝组织肝 纤维化程度改变。结果如图6所示,pth干预组pth1r蛋白表达水平明显增加, he组织染色显示肝索结构明显紊乱、界板形成,天狼星红染色及马松染色均显 示pth1r激活组小鼠肝脏胶原染色面积较对照组显著增加。f4/80及tunel染 色显示pth干预组小鼠肝脏炎症及肝细胞凋亡明显增加。提示pth1r信号激活 进一步加重nash肝纤维化进展。
[0083]
6.pth1r信号激活升高nash纤维化进程中的炎症水平
[0084]
pcr检测结果发现pth1r激活组小鼠肝脏il-1β、tnf-α及il-6的mrna 表达水平较nash对照组小鼠明显升高,结果如图7所示。这些结果进一步印 证了pth1r活化可以促进nash纤维化进程中的肝脏炎症水平。
[0085]
7.pth1r敲除抑制hsc细胞的增殖、胶原分泌能力及活化诱导因子tgfβ 表达
[0086]
在脂毒性所致纤维化进程中,hsc细胞是pth1r信号的主要效应细胞。通 过si-rna(sense5'-3'(seq id no:1):gcacacagcagccaacauatt; antisense5'-3'(seq id no:2):uauguuggcugcugugugctt)转染敲除鼠 源hsc细胞中的pth1r,利用cck8试剂盒检测细胞增殖能力,结果如图8所 示,pth1r敲除显著降低了hsc细胞的增殖能力。如图9a-c所示,westernblotting检测发现,pth1r敲除组或pth1r中和抗体(novus,货号nbp1-40067) 组,hsc细胞α-sma的表达水平较其各自对照组显著降低。如图9d显示pth1r 敲除组较对照组i型胶原的分泌量降低。均提示pth1r敲除可抑制hsc细胞分 泌大量纤维化因子。
[0087]
8.pth1r信号激活促进hsc细胞的增殖、胶原分泌能力及活化诱导因子 tgfβ表达
[0088]
在体外培养hsc细胞模型中,pth干预24小时激活hsc细胞中pth1r信 号,利用cck8试剂盒检测细胞增殖能力,结果如图10所示,pth1r信号活化 显著促进了人hsc细胞的增殖能力。进一步western blotting检测,结果如图11 所示,发现pth1r激活组hsc细胞i型胶原、α-sma及tgfβ蛋白的表达水平。 以上结果说明pth1r异常活化可促进tgfβ表达,放大hsc激活过程并促进 hsc细胞分泌大量胶原纤维。
[0089]
上述实施例仅为本发明的优选实施例,并非对本发明任何形式上和实质上的 限制,应当指出,对于本技术领域的普通技术人员,在不脱离本发明的前提下, 还将可以做出若干改进和补充,这些改进和补充也应视为本发明的保护范围。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1