一种心脏靶向载药外泌体及其制备方法、应用和运载体与流程
1.本发明涉及生物医药技术领域,具体涉及一种心脏靶向载药外泌体及其制备方法、应用和运载体。
背景技术:
2.对于心血管疾病,一直以药物治疗和外科手术治疗为主,近年来随着分子生物学技术的不断发展,基因转移逐渐成为心血管疾病治疗的新途径,常被用于治疗重要蛋白质的过度表达和矫正基因的缺陷。如血管内皮生长因子(vegf)和成纤维细胞生长因子(fgf)等基因转移,可以促进血管新生,改善缺血性心肌的供血和冠脉侧枝循环形成,为经皮冠状动脉腔内成形术和冠脉内支架植入后再狭窄的防治带来新的希望。
3.心脏病的基因治疗目前主要集中在两个方面,即血管新生疗法和冠脉再狭窄的防治。血管新生疗法又称为“分子搭桥术”,即应用基因治疗或其他治疗手段刺激心肌缺血区小血管生长和侧枝循环形成,在缺血的心肌区域架起新的桥梁。如应用血管内皮生长因子基因治疗梗塞性血管病已经获准应用于临床,并展示出良好的应用前景。但是长期大量应用血管生长因子可能对其他组织和血管产生不良影响,并且血管生长因子半衰期短,不能对患者的全身进行应用。
4.目前,通过向心肌内直接注射裸dna或带有编码基因的腺病毒载体是早期基因治疗心血管疾病的常用方法,使得基因能进行一定的转移。
5.然而,需要通过胸廓切开术等损伤性的方式来实现,术后容易引发注射部位的炎症和纤维症。向心包灌注重组质粒,基因能够获得比直接注射更高的转移效率,但就目前的实际情况而言,此种活体外的基因转移只适用于移植的心脏。因此,对心脏疾病进行治疗的过程中,亟需解决在治疗中不能进行有效、安全和可控地进行靶向给药治疗的情况。
技术实现要素:
6.针对现有技术存在的不足,本发明提出一种心脏靶向载药外泌体及其制备方法、应用和运载体,以解决使用药物对心脏进行治疗的过程中,不能进行有效、安全和可控地进行靶向给药治疗的问题。
7.为达到上述目的,本发明采用如下技术方案:一种心脏靶向载药外泌体,包括心脏靶向外泌体和用于治疗心脏疾病的药物,所述心脏靶向外泌体来源于小肠细胞,所述心脏靶向外泌体内装载有所述药物。
8.采用上述技术方案时,心脏靶向外泌体来源于小肠细胞,通过心脏靶向外泌体装载不同的药物,把药物靶向运输到心脏组织,提高心脏疾病的治疗效果,降低药物毒副反应。
9.优选的,所述小肠细胞包括人小肠细胞、动物小肠细胞、人小肠癌细胞、动物小肠癌细胞和诱导多能干细胞诱导的小肠细胞。
10.优选的,所述人小肠细胞包括小肠组织上皮细胞fhs 74 lnt、int407、小肠粘膜上
皮细胞、人小肠隐窝上皮细胞、人小肠内皮细胞;所述人小肠癌细胞包括hic细胞。
11.优选的,所述动物小肠细胞和动物小肠癌细胞中的动物包括猴、小鼠、仓鼠和大鼠。
12.优选的,所述药物包括核酸类药物、蛋白、抗体、多肽、小分子化药、tpo、epo、tpa、ldl受体、myod基因、血管内皮生长因子和碱性成纤维内皮细胞生长因子。
13.优选的,所述核酸类药物包括shrna、microrna、sirna和mrna。
14.本发明还提供一种心脏靶向载药外泌体的制备方法,包括以上所述的心脏靶向载药外泌体,具体的制备步骤如下:获取心脏靶向外泌体与药物,把心脏靶向外泌体与药物转移到电转杯中;采用指数波或方形波,使用50-300v电压通过电转杯对所述药物和所述心脏靶向外泌体进行电转,形成电转产物;将所述电转产物于37℃中水浴30min后,在100000g离心力下离心120min,并去除游离的药物,得到心脏靶向载药外泌体。
15.优选的,所述心脏靶向外泌体的具体制备步骤为:收集小肠细胞,使用无外泌体血清和培养基对所述小肠细胞进行培养,得到小肠细胞培养液;取小肠细胞的培养液在2000g离心力下离心10min,取上清液;再在10000g离心力下离心30min,取上清液,弃去细胞碎片及沉淀物;将离心后的细胞培养液在100000g离心力下离心2 h,沉淀用无菌pbs重悬收集,4℃短期保存,即得所述心脏靶向外泌体。
16.本发明还提供以上所述心脏靶向载药外泌体在治疗心脏疾病中的应用。
17.本发明还提供一种运载体,包括以上任一项所述的心脏靶向载药外泌体。
18.通过心脏靶向载药外泌体对心脏组织具有靶向性,从而实现对心脏组织进行靶向治疗。
19.本方案产生的有益效果是:通过把用于治疗心脏疾病的药物装载到心脏靶向外泌体中,心脏靶向外泌体来源于小肠细胞,通过心脏靶向载药外泌体把药物运输到心脏组织,对心脏组织进行靶向给药治疗,从而实现对心脏疾病治疗更加的有效、安全和可控,提高心脏疾病的治疗效果,降低药物毒副反应。
附图说明
20.为了更清楚地说明本发明具体实施方式,下面将对具体实施方式中所需要使用的附图作简单地介绍。
21.图1为本发明一种心脏靶向载药外泌体的制备方法中人小肠组织上皮细胞fhs 74 lnt分泌的外泌体的标志性蛋白检测图。
22.图2为本发明一种心脏靶向载药外泌体的制备方法中人小肠组织上皮细胞fhs 74 lnt分泌的外泌体的粒径分布检测。
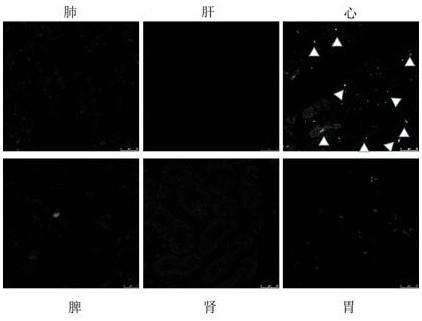
23.图3为本发明一种心脏靶向载药外泌体中的心脏靶向外泌体在不同组织中的分布图。
24.图4为本发明一种心脏靶向载药外泌体中载有用于治疗心脏疾病的药物实验效果对比图。
具体实施方式
25.下面将结合附图对本发明技术方案的实施例进行详细的描述。以下实施例仅用于更加清楚地说明本发明的技术方案,因此只作为示例,而不能以此来限制本发明的保护范围。
26.请参阅图1-图4,一种心脏靶向载药外泌体,包括心脏靶向外泌体和用于治疗心脏疾病的药物,心脏靶向外泌体来源于小肠细胞,心脏靶向外泌体内装载有药物。
27.其中,小肠细胞包括但不限于人小肠细胞、动物小肠细胞、人小肠癌细胞、动物小肠癌细胞和诱导多能干细胞诱导的小肠细胞。
28.具体的,人小肠细胞包括但不限于小肠组织上皮细胞fhs 74 lnt、int407、小肠粘膜上皮细胞、人小肠隐窝上皮细胞、人小肠内皮细胞;所述人小肠癌细胞包括hic细胞。同时,动物小肠细胞和动物小肠癌细胞中的动物包括但不限于猴、小鼠、仓鼠和大鼠。
29.其中,药物包括但不限于核酸类药物、蛋白、抗体、多肽、小分子化药、tpo、epo、tpa、ldl受体、myod基因、血管内皮生长因子和碱性成纤维内皮细胞生长因子。本实施例中,核酸类药物包括但不限于shrna、microrna、sirna和mrna。
30.心脏靶向外泌体来源于小肠细胞,通过心脏靶向外泌体装载不同的药物,把药物运输到心脏组织,从而对心脏组织进行靶向给药,提高心脏疾病的治疗效果,降低药物毒副反应。
31.本发明还提供心脏靶向载药外泌体在治疗心脏疾病中的应用。通过心脏靶向外泌体,实现对心脏的相关疾病进行靶向治疗的目的。
32.本发明还提供一种运载体,包括以上的心脏靶向载药外泌体。
33.通过心脏靶向载药外泌体对心脏组织具有靶向性,通过运载体的运输,使得药物靶向运输到心脏组织,从而通过运载体对心脏靶向载药外泌体进行运输,药物靶向运输到心脏组织,从而实现对心脏组织进行靶向治疗。
34.同时,本发明还提供了一种心脏靶向载药外泌体的制备方法,具体的制备步骤如下:步骤一、获取心脏靶向外泌体与药物。把心脏靶向外泌体与药物转移到电转杯中。
35.本实施例中,心脏靶向外泌体以正常的人小肠组织上皮细胞fhs 74 lnt为例,用于治疗心脏疾病的药物选用血管内皮生长因子(vegf),vegf购买于碧云天生物技术公司。
36.取150μg的心脏靶向外泌体与vegf混合并转移至电转杯中。电转杯规格可选用0.2cm或0.4cm。其中,选用的电转缓冲液可以为pbs、dmem、cytomix或tris-hcl,并把电转缓冲液补足至150μl。
37.步骤二、采用指数波或方形波,使用50-300v电压通过电转杯对药物和心脏靶向外泌体进行电转,形成电转产物。
38.本实施例中,采用指数波,使用50v的电压对电转杯中的心脏靶向外泌体和vegf进行电转。或使用100v、200v、250v或300v的电压对电转杯进行电转。
39.步骤三、将电转产物于37℃中水浴30min后,在100000g离心力下离心120min,收集
上清液,并去除游离的药物,得到心脏靶向载药外泌体。其中,心脏靶向载药外泌体的载药量为(蛋白总量-上清蛋白量)/蛋白总量。
40.即,可得通过以上的步骤,vegf成功载入了心脏靶向外泌体中。其中,150μg的心脏靶向外泌体与150 ug vegf在不同的电压下进行电转,载药量在20%-40%之间。其中,150μg心脏靶向外泌体与150 ug vegf在250v的电压下进行电转,载药量可达33.6%。
41.具体的,心脏靶向外泌体的具体制备步骤为:步骤一、收集小肠细胞,使用无外泌体血清和dmem培养基对小肠细胞进行培养,得到小肠细胞培养液。
42.本实施例中,收集的小肠细胞为正常人小肠组织上皮细胞fhs 74 lnt。
43.步骤二、取小肠细胞的培养液在2000g离心力下离心10min,取上清液。
44.步骤三、再在10000g离心力下离心30min,取上清液,弃去细胞碎片及沉淀物。
45.步骤四、将离心后的细胞培养液在100000g(g为重力加速度)离心力下离心2 h,沉淀用无菌pbs重悬收集,4℃短期保存,即得心脏靶向外泌体。
46.请一并参阅图1和图2,为提取分离所得的心脏靶向外泌体表面标记蛋白及粒径分布。对小肠细胞分泌的心脏靶向外泌体表达量进行测定,通过bca法检测小肠细胞分泌的心脏靶向外泌体的蛋白浓度为2.48μg/μl。
47.针对于来源于小肠细胞的心脏靶向外泌体具有的靶向运输的性质,本实施例中,通过小肠组织上皮细胞fhs 74 lnt分泌的心脏靶向外泌体进行如下的体内试验:用pkh67染色,对小肠细胞分泌的心脏靶向外泌体在体内的分布进行示踪,具体步骤如下:取100μg的小肠组织上皮细胞fhs 74 lnt分泌的心脏靶向外泌体,与1μl pkh67 4℃避光孵育过夜,在100000g(g为重力加速度)离心力下离心2 h,弃掉上清,用pbs清洗两次后,无菌pbs重悬得到心脏靶向外泌体,并将心脏靶向外泌体经尾静脉注射入c57bl/6小鼠体内。
48.需要说明的是:本实施例中,雄性c57bl/6为4-6周的小鼠,购买于北京华阜康生物科技股份有限公司,所有小鼠均培育于spf级设施;24h后,麻醉小鼠,取小鼠的心脏,肝脏,脾脏,心脏脏,肾脏、胃和肠做冰冻切片,hoechst33342染细胞核后,观察小肠细胞分泌的心脏靶向外泌体在小鼠各个器官的生物分布。
49.结果显示:请一并参阅图3,用小肠组织上皮细胞fhs 74 lnt分泌的心脏靶向外泌体在心脏组织中出现明显富集,心脏靶向效率可高达65%-90%;而在其他组织中未出现富集,说明制备的心脏靶向外泌体具有心脏组织靶向性的特殊性质。
50.同时,本实施例中,通过体外实验,进一步验证载有用于治疗心脏疾病的药物vegf的心脏靶向外泌体对血管内皮细胞血管生成的促进作用。
51.本实施例中,具体的试验步骤如下:请一并参阅图4,将huvec细胞铺于96孔板中,每孔5
×
10 3
个细胞,分别加入心脏靶向外泌体(对照组)、载有心脏治疗药物vegf的心脏靶向载药外泌体,血管生成实验检测载有心脏治疗药物vegf的心脏靶向载药外泌体对huvec的促进小管形成作用。
52.即,在体外实验中,载有心脏治疗药物vegf的心脏靶向载药外泌体相较于单纯的心脏靶向外泌体能够有效的促进huvec细胞小管的生成。
53.同时,小肠细胞也可以进行基因修饰或改造以使其对心脏组织具有靶向性,包括但不限于基因改造、基因修饰、基因过表达或删除和分子修饰等。小肠细胞分泌的心脏靶向外泌体也可以进行表面修饰或改造以使其对心脏组织具有靶向性,包括但不限于表面蛋白修饰、表面改造和表面小分子修饰等。
54.本发明,实现使用小肠细胞分泌的心脏靶向外泌体不需要作任何修饰就能够在心脏部位富集,用小肠细胞来源的外泌体,解决了心脏靶向外泌体产量的问题,具有很好的心脏靶向的应用前景。而且用小肠细胞来源的心脏靶向外泌体能够装载不同药物或活性分子,通过靶向心脏组织给药,提高心脏疾病的治疗效果,降低药物毒副反应。
55.以上实施例仅用以说明本发明的技术方案,对于本领域技术人员而言,显然本发明实施例不限于上述示范性实施例的细节,而且在不背离本发明实施例的精神或基本特征的情况下,能够以其他的具体形式实现本发明实施例。因此,无论从哪一点来看,均应将实施例看作是示范性的,而且是非限制性的;尽管参照前述各实施例对本发明进行了详细的说明,本领域的普通技术人员应当理解:其依然可以对前述各实施例所记载的技术方案进行修改,或者对其中部分或者全部技术特征进行等同替换;而这些修改或者替换,并不使相应技术方案的本质脱离本发明各实施例技术方案的范围,其均应涵盖在本发明的权利要求和说明书的范围当中。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1