一种抑制炎症因子释放治疗痛风急性发作的聚合物微针及制备方法与流程
1.本技术涉及痛风治疗技术领域,特别是涉及一种抑制炎症因子释放治疗痛风急性发作的聚合物微针及制备方法。
背景技术:
2.痛风为全球常见疾病,据流行病学统计,20世纪90年代欧美高尿酸血症的患病率报道为2%
‑
24%,美国1993年报道的高尿酸血症的患病率为10.1%,中国2008年统计高尿酸血症整体患病率为13.2
‑
21.04%。世界各地痛风总患病率介于0.13
‑
15.3%之间,全球年发病率在0.20%
‑
0.35%之间。欧美国家痛风和高尿酸血症的发病率明显高于其它国家,且呈逐年增加的趋势。其中,美国痛风患者患病率约为3.9%,据此估算,美国大约有920万患者;美国和欧洲的痛风患者均超过800万,日本成年男性高尿酸血症人数在25%
‑
30%;2017年统计中国高尿酸血症患者约有1.7亿,保守估算我国痛风病患者大于3500万人。
3.痛风(gout)是一种单钠尿酸盐(monosodium urate,msu)沉积所致的晶体相关性关节病,与嘌呤代谢紊乱和/或尿酸排泄减少所致的高尿酸血症直接相关,属于代谢性风湿病范畴。痛风特指急性特征性关节炎和慢性痛风石疾病,可并发肾脏病变,重者可出现关节破坏、肾功能受损,也常伴发代谢综合征的其他组,如腹型肥胖、高脂血症、高血压、2型糖尿病以及心血管疾病。痛风不再仅仅被视为一种关节疾病,据统计,高尿酸血症患者并发症发生率非常高,例如心血管疾病、2型糖尿病、代谢综合征、慢性肾脏疾病、癌症和过早衰老。尿酸升高是否与痛风合并症的发病机制有关仍是一个有争议的问题,但是越来越多的流行病学研究发现高尿酸血症是痛风并发症的独立危险因素。痛风发作缓解后,患者进入无症状期,又称间期、间歇期或发作间期;但大部分患者都会复发,随着发作频率的上升,症状可能会更加严重持久,而无症状期会缩短。反复发作的患者主要以高尿酸血症、急性痛风性关节炎反复发作、痛风石沉积、慢性痛风性关节炎和关节畸形、肾实质性病变和尿酸石形成为特征。
4.痛风急性发作引起剧烈疼痛。当疼痛发作时,患者会在半夜熟睡中疼醒,有患者描述疼痛感类似于大脚趾被火烧一样。最常发病的关节是大脚趾,即第一跖骨;但发病的关节不限于此,还常见于手部的关节、膝盖、肘部等。发病的关节最终会红肿、发炎,水肿后组织变软,活动受限,随着时间的推延,痛风因屡屡发作的关节,不仅组织损害,而且骨质的关节端有侵蚀,再加上痛风石的沉积,使关节呈慢性炎症和关节畸形和功能性障碍,致残率极高,最后影响日常生活。反复发作的患者以及发展为慢性关节炎的患者可使用降尿酸药物长期预防,以防痛风复发或发展为慢性痛风石性疾病。
5.至今,痛风关节炎还不能被根治,治疗的主要目标是缓解病情。因此,对于痛风急性发作的治疗目标是迅速、安全地缓解疼痛和失能,包含传统治疗,以非甾体抗炎药、传统的改善病情糖皮质激素,代表药物有对乙酰氨基酚、吲哚美辛、萘普生,布洛芬,氢化考的松、地塞米松、强的松等。即使不给予治疗,发作也通常会在数日到数周内完全缓解,特别是
早期疾病。虽然早期疾病可以不用治疗也能够数周内完全缓解;但是,抗炎药物能加快症状缓解,对治疗具有积极作用。不过,虽然传统药物在治疗方面比较有效,但一些副作用限制了其应用,且一部分患者应用疗效欠佳,皮质激素易破坏免疫系统,而秋水仙碱毒性更大;这些药物只能暂时消除疼痛和降低炎症。
6.对于发展为慢性关节炎的患者,控制人体的血尿酸在目标水平是防治痛风最根本、最关键的措施。可使用降尿酸药物长期预防,以防痛风复发或发展为慢性痛风石性疾病。尽管目前已经有一些治疗方案,但痛风的治疗效果并不理想。基于痛风形成的机制,如果降尿酸药物无法将所有患者的血尿酸控制到5mg/dl以下的正常水平,则无法从根本上解除痛风发作。但是目前临床现有的药物无论是单独给药还是联合给药,即便剂量达到了无法耐受的水平,仍然无法在临床将痛风患者的血尿酸水平降至5mg/dl以下。
7.研究显示,高水平的尿酸(缩写ua)使msu沉积在关节等组织中,msu在关节腔中的沉积激活炎症细胞因子,诱导巨噬细胞和中性粒细胞的积累,从而导致痛感关节炎。氧化应激在痛风的发病机制中扮演重要角色,并导致一系列炎症事件。
8.根据痛风的发病机制,抑制炎症反应和降低血清ua水平被认为是有效的治疗策略。痛风性关节炎的治疗常用秋水仙碱(col)、皮质类固醇和非甾体抗炎药。别嘌呤醇和非布索坦(fbx)是治疗高尿酸血症的主要临床药物。然而,许多不良反应已被报道,包括肝损伤、肾毒性、骨髓抑制和机体过敏反应。因此,寻找治疗高尿酸血症和痛风性关节炎的替代药物及有效治疗方法尤为重要。
9.丝氨酸蛋白酶抑制剂α1
‑
抗胰蛋白酶(缩写aat)在人类血液中浓度约为1~2mg/ml,是人体血循环中最丰富的蛋白质之一。从人类血浆中纯化的aat的使用已经20年,用于治疗aat缺乏症患者,这是一种导致肺部和胰腺疾病的疾病。由于aat是一种天然存在的蛋白质,用人血浆制备的aat治疗aat缺陷患者十分的安全有效,无显著的感染和突变致癌副作用。
10.研究显示,aat具有广泛的抗炎特性,aat的蛋白酶功能包括抑制caspase
‑
1和抑制tnf和il
‑
1β的产生。此外,aat还能诱导il
‑
1受体拮抗剂(il
‑
1ra)和血管生成素相关蛋白的转录和分泌。在痛风关节炎的小鼠模型中,人源aat减轻了小鼠关节炎症,降低血中il
‑
1β水平。从人血浆制备的aat已成功用于急性st段升高的心肌梗塞和1型儿童糖尿病;但是,aat在治疗痛风急性发作方面尚没有相关的研究和应用。
11.基于aat的治疗方法,其缺点是aat需要静脉注射。目前的解决方案是,将aat与igg的fc片段融合,产生了一种新颖的重组aat
‑
fc融合蛋白形式。在尿酸结晶引起的关节炎症小鼠模型中,aat
‑
fc减轻关节炎症效果比血浆制备的aat高40~50倍。aat
‑
fc效力强劲,可进行皮下注射;此外,重组aat
‑
fc也没有用来自其他人的血液衍生产品治疗人类相关的病毒传播风险;并且,重组aat
‑
fc的成本也低于血浆制备aat的成本。
12.但是,使用针剂经皮给药,由于需要频繁的注射,可能会使经常施打的部位皮肤产生角质增生、红肿、硬结等不良副反应,同时也会给病人带来强烈的疼痛与不适感。重组aat
‑
fc虽然效力强劲,但是,皮下注射通过全身性途径这种给药方式,仍然需要相对较高的剂量才能使病征部位达到有效浓度。这些相对较高的全身剂量的aat
‑
fc可导致非特异性免疫抑制,从而增加感染率和各种不良反应发生几率。这些不利因素限制了aat
‑
fc的疗效及广泛应用。
技术实现要素:
13.本技术的目的是提供一种新的抑制炎症因子释放治疗痛风急性发作的聚合物微针及制备方法。
14.本技术采用了以下技术方案:
15.本技术的一方面公开了一种抑制炎症因子释放治疗痛风急性发作的聚合物微针,该聚合物微针的针尖包埋有纳米材料包裹的含有效剂量的丝氨酸蛋白酶抑制剂的药物制剂;药物制剂含有0.005
‑
0.05重量份的丝氨酸蛋白酶抑制剂、0.05
‑
0.15重量份的磷酸钠、0.0025
‑
0.025重量份的甘露醇和0.005
‑
0.025重量份的氯化钠。
16.需要说明的是,本技术创造性的将丝氨酸蛋白酶抑制剂与微针阵列结合起来,兼顾了两者的优点。一方面在给药方式上利用微针贴片针头极为细小,微创无痛与使用方便以及友善的患者使用体验等特点,可减轻患者在治疗用药阶段的痛苦;另一方面,利用纳米材料包裹的丝氨酸蛋白酶抑制剂来延长药物释放时间,使丝氨酸蛋白酶抑制剂能够阻断局部病灶的炎症反应,提高了丝氨酸蛋白酶抑制剂的吸收率的同时,藉由缓慢释放避免短时间大量外来药物进入人体内导致不良副作用出现。另外,本技术聚合物微针的优势是其可将静脉滴注或皮下注射的药物改成皮下外敷贴。这种给药途径的切换有两大优势:第一,可以增加用药的方便性,患者在自己家中就可以完成给药,特别是病人痛风发作引发剧痛,行走困难时,及时方便止痛是病人第一需求;第二,因无需到医护人员的协助,医疗成本大大降低。
17.还需要说明的是,本技术创造性的将丝氨酸蛋白酶抑制剂包埋在纳米颗粒中,并将其制成聚合物微针,通过微针进行给药;将本技术的聚合物微针贴于病征部位,能够有效的治疗痛风急性发作炎症反应;并且,通过微针给药能够最大程度的减小中毒现象,减少对肾、肝、脾、心、胰脏和骨髓等的损伤。可以理解,本技术的聚合物微针是直接作用于病征部位,与现有的通过静脉滴注或皮下注射的方式相比,本技术的聚合物微针作用方式更直接,治疗效果更好。
18.还需要说明的是,在药物控制释放方面,本技术的聚合物微针使用具有生物降解性的纳米材料包裹药物制剂来达到控制缓释的效果。利用生物可降解的纳米材料对药物制剂进行包裹,药物进入人体后,纳米颗粒在一定时间后才会降解并释放药物,因此药物可以长时间的充分作用于病灶部位,从而具有更好的定点、靶向治疗效果,生物吸收率和利用率更高。
19.总的来说,本技术的聚合物微针,将纳米颗粒与微针贴片结合起来进行药物控制释放,具有无痛微创、方便易用、药物利用率高等优点;丝氨酸蛋白酶抑制剂直接作用于病征部位,并且能够控制缓释,很好的解决了丝氨酸蛋白酶抑制剂的全身循环半衰期问题。同时,由于无需全身性途径的给予丝氨酸蛋白酶抑制剂,使得丝氨酸蛋白酶抑制剂的有效剂量大大降低,这不仅节约了药物成本,而且避免了全身性途径过量使用丝氨酸蛋白酶抑制剂导致的非特异性免疫抑制和各种不良反应等问题。
20.优选的,丝氨酸蛋白酶抑制剂包括但不仅限于天然α1
‑
抗胰蛋白酶(缩写aat)和/或重组α1
‑
抗胰蛋白酶。
21.可以理解,本技术的关键在于将丝氨酸蛋白酶抑制剂与聚合物微针结合,并研发了丝氨酸蛋白酶抑制剂适用剂型。至于具体的丝氨酸蛋白酶抑制剂,可以是天然α1
‑
抗胰蛋
白酶或重组α1
‑
抗胰蛋白酶,或者两者的组合,在此不作具体限定。
22.优选的,丝氨酸蛋白酶抑制剂为天然α1
‑
抗胰蛋白酶、重组α1
‑
抗胰蛋白酶、具有丝氨酸蛋白酶抑制剂活性的α1
‑
抗胰蛋白酶变体和具有丝氨酸蛋白酶抑制剂活性的α1
‑
抗胰蛋白酶的融合蛋白中的至少一种。
23.优选的,α1
‑
抗胰蛋白酶的融合蛋白为重组aat
‑
fc融合蛋白。
24.本技术中,天然α1
‑
抗胰蛋白酶是指收集自血清的天然aat;重组α1
‑
抗胰蛋白酶是指利用基因工程获得的aat;α1
‑
抗胰蛋白酶的融合蛋白为重组aat与其它多肽和蛋白融合形成的融合蛋白,例如aat
‑
fc融合蛋白。
25.需要说明的是,本技术的α1
‑
抗胰蛋白酶主要是指天然的α1
‑
抗胰蛋白酶或重组aat,可以理解,与α1
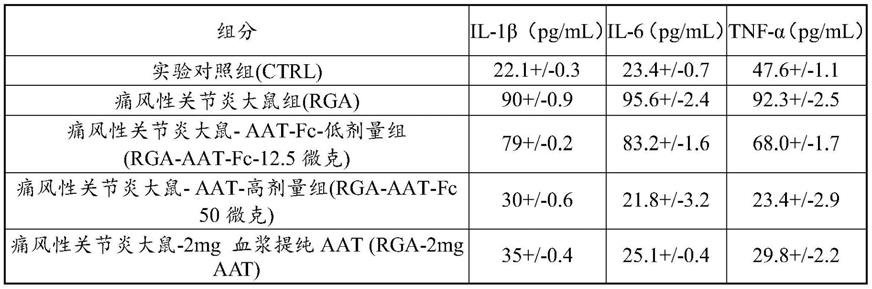
‑
抗胰蛋白酶具有至少90%、95%、97%或99%同一性的氨基酸变体,或者在α1
‑
抗胰蛋白酶基础上进行缺失、插入、倒位和替换等突变,形成的同样具有丝氨酸蛋白酶抑制剂活性的α1
‑
抗胰蛋白酶变体,必然也可以用于本技术。具有丝氨酸蛋白酶抑制剂活性的α1
‑
抗胰蛋白酶的融合蛋白是指,与其它蛋白或多肽融合,例如aat与igg的fc片段融合,产生的一种新颖的重组aat
‑
fc融合蛋白,在尿酸结晶引起的关节炎症小鼠模型中,aat
‑
fc减轻关节炎症效果比血浆制备的aat高40~50倍,效力强劲;这样的融合蛋白同样可以用于本技术。
26.优选的,纳米材料为聚乳酸
‑
羟基乙酸共聚物。
27.优选的,聚合物微针由羧甲基纤维素钠制备。
28.本技术的另一面公开了本技术的聚合物微针在制备治疗痛风、类风湿性关节炎,或α1
‑
抗胰蛋白酶缺乏引起的相关疾病的药物中的应用。
29.可以理解,研究发现丝氨酸蛋白酶抑制剂可以治疗痛风、类风湿性关节炎;因此,本技术的聚合物微针当然可以用于治疗这些疾病的药物。原则上,本技术含有丝氨酸蛋白酶抑制剂的聚合物微针可以用于治疗任何α1
‑
抗胰蛋白酶缺乏引起的相关疾病。并且,相比于静脉滴注或皮下注射而言,本技术的聚合物微针能够直接作用于病征部位,效果更佳。
30.本技术的再一面公开了本技术的聚合物微针的制备方法,包括以下步骤:
31.药物制剂制备,包括将丝氨酸蛋白酶抑制剂和磷酸缓冲液按配比混合,并加聚乳酸
‑
羟基乙酸共聚物溶液分散均匀,采用喷雾干燥机制成第一纳米颗粒;将甘露醇和氯化钠混合,并加聚乳酸
‑
羟基乙酸共聚物溶液分散均匀,采用喷雾干燥机制成第二纳米颗粒;将第一纳米颗粒和第二纳米颗粒按比例混合均匀,即获得药物制剂;
32.药物制剂包裹步骤,包括将聚乳酸
‑
羟基乙酸共聚物溶于有机溶剂中,制成包裹材料溶液;将制备的药物制剂的纳米颗粒均匀分散到制备的包裹材料溶液中,加入维生素e聚乙二醇琥珀酸酯溶液形成纳米颗粒,即获得本技术的纳米材料包裹的药物制剂;
33.聚合物微针制备,包括将纳米材料包裹的药物制剂按照每片聚合物微针的剂量加入羧甲基纤维素钠溶液中,制成混合溶液,将混合溶液倒入微针贴片模具中,然后在离心机中进行离心处理,使得混合溶液进入微针贴片模具的针孔空腔内,并使大部分纳米材料包裹的药物制剂沉积在针尖;然后固化成型,脱模,即获得本技术的聚合物微针。
34.其中,脱模可以参考现有的聚合物微针制备方法,例如采用聚合物微针贴片的基片,通过胶粘结固定在基片上进行脱模;或者,采用没有添加纳米材料包裹的药物制剂的羧甲基纤维素钠溶液,凝固后进行脱模。具体根据产品设计或生产条件而定,在此不作具体限
定。
35.优选的,药物制剂包裹步骤采用的有机溶剂为乙酸乙酯。
36.优选的,具体在0℃左右3℃的温度环境下制备纳米颗粒。
37.优选的,聚合物微针制备的离心处理的条件为5000
‑
6000rpm离心3
‑
6min。
38.需要说明的是,本技术采用离心处理制备聚合物微针,一方面,通过离心力可以使混合溶液填充到微针贴片模具的针孔空腔中;另一方面,可以使大部分纳米材料包裹的药物制剂沉积在针尖,提高聚合物微针的使用效率。
39.本技术的有益效果在于:
40.本技术的聚合物微针,直接将聚合物微针贴片贴于病征部位即可,使用简单方便;通过纳米材料包裹缓释,使得药物能够充分发挥作用,具有更好的定点、靶向治疗效果,药物利用率更高;不仅解决了丝氨酸蛋白酶抑制剂经过全身循环难以长期作用于病征部位的问题,而且避免了全身性途径过量使用丝氨酸蛋白酶抑制剂导致的非特异性免疫抑制和各种不良反应等问题。本技术的聚合物微针,创造性的将丝氨酸蛋白酶抑制剂与微针给药系统结合起来,为临床治疗痛风或丝氨酸蛋白酶抑制剂相关的疾病提供了一种更高效、安全的治疗方案。
附图说明
41.图1是本技术实施例中纳米材料包裹的药物制剂的hplc分析结果图;
42.图2是本技术实施例中纳米材料包裹的药物制剂室温放置1天的纳米颗粒的降解程度测试结果;
43.图3是本技术实施例中纳米材料包裹的药物制剂室温放置7天的纳米颗粒的降解程度测试结果;
44.图4是本技术实施例中纳米材料包裹的药物制剂室温放置14天的纳米颗粒的降解程度测试结果;
45.图5是本技术实施例中聚合物微针贴片使用方式示意图;
46.图6是本技术实施例聚合物微针贴片作用于皮肤后释放药物的示意图;
47.图7是本技术实施例中聚合物微针的共聚焦荧光显微镜观察结果图;
48.图8是本技术实施例中聚合物微针体外透皮给药实验结果;
49.图9是本技术实施例中采用聚合物微针治疗后各试验组和对照组的痛风性关节炎炎症因子il
‑
1β的检测结果;
50.图10是本技术实施例中采用聚合物微针治疗后各试验组和对照组的痛风性关节炎炎症因子il
‑
6的检测结果;
51.图11是本技术实施例中采用聚合物微针治疗后各试验组和对照组的痛风性关节炎肿瘤坏死因子tnf
‑
α的检测结果。
具体实施方式
52.目前利用微创无痛的可溶微针贴片作为一种新型给药手段已被大量研究,相关研究成果已经可以被应用在疫苗接种、糖尿病治疗、癌症治疗等领域。在药物控制释放方面,微针给药系统还可使用具有生物降解性的纳米颗粒包裹药物来达到控制缓释的效果。但
是,针对痛风治疗的微针还鲜有研究和报道。
53.本技术创造性的尝试将丝氨酸蛋白酶抑制剂与微针给药系统结合起来,并研发了适用于聚合物微针的丝氨酸蛋白酶抑制剂的药物制剂。具体的,利用生物可降解的纳米颗粒对丝氨酸蛋白酶抑制剂进行包裹,然后制成聚合物微针;药物进入人体后,纳米颗粒在一定时间后才会降解并释放药物,因此药物可以与关节尿酸盐结晶引发炎症病灶部位充分作用,得到更好的定点,精准阻断局部病灶的炎症反应,生物吸收率高。因此将纳米颗粒与微针贴片结合起来进行药物控制释放,由于其微针可溶、无痛微创、方便易用、药物利用率高等优势,它们可用于有效地皮内局部递送丝氨酸蛋白酶抑制剂,用于痛风急性发作炎症的局部治疗,具有强大市场竞争力和广阔的应用前景。
54.需要说明的是,本技术的发明人实际上研发出了系列新一代治疗用生物制品新药微针给药系统,在小型临床研究中,已被证明可迅速,有效缓解痛风急性发作症状,无副作用,并延迟痛风再一次发作时间间隔,有非常好预防效果。应用微针局部给药,迅速抑制痛风急性发作的局部细胞炎症反应,方便反复给药。特别是本技术的针尖包埋有纳米材料包裹的含有效剂量的丝氨酸蛋白酶抑制剂的药物制剂的聚合物微针,不仅解决了目前丝氨酸蛋白酶抑制剂全身循环难以长期作用于病征部位的问题,而且避免了全身性途径过量使用丝氨酸蛋白酶抑制剂导致的非特异性免疫抑制和各种不良反应等问题。
55.下面通过具体实施例对本技术进行详细说明。以下实施例仅用于对本技术进行说明,不应理解为对本技术的限制。
56.实施例
57.一、药物制剂制备
58.本例的药物制剂中含有0.005
‑
0.05重量份的丝氨酸蛋白酶抑制剂、0.05
‑
0.15重量份的磷酸钠、0.0025
‑
0.025重量份的甘露醇和0.005
‑
0.025重量份的氯化钠。本例可采用天然α1
‑
抗胰蛋白酶和/或重组α1
‑
抗胰蛋白酶,尤其是重组aat
‑
fc融合蛋白。本例具体采用的是通过基因工程克隆表达获得的重组aat
‑
fc融合蛋白。本例预先将药物制剂制成纳米颗粒,然后再用于后续试验,具体制备方法如下:
59.称取0.12g的重组aat
‑
fc融合蛋白分散于ph7.1
‑
9.0的磷酸钠缓冲液中,加入少量聚乳酸
‑
羟基乙酸共聚物溶液,聚乳酸
‑
羟基乙酸共聚物的用量约为重组aat
‑
fc融合蛋白重量的20%
‑
70%,本例具体采用0.06g的聚乳酸
‑
羟基乙酸共聚物,采用喷雾干燥机制成第一纳米颗粒。磷酸钠缓冲液中含有0.36g的磷酸钠。
60.称取氯化钠0.06g和甘露醇0.06g混合均匀,并加入聚乳酸
‑
羟基乙酸共聚物溶液中,分散均匀,聚乳酸
‑
羟基乙酸共聚物的用量约为重组aat
‑
fc融合蛋白重量的20%
‑
70%,本例具体采用0.06g的聚乳酸
‑
羟基乙酸共聚物,采用喷雾干燥机制成第二纳米颗粒。
61.将第一纳米颗粒和第二纳米颗粒混合均匀,即获得本例的药物制剂。本例制备的药物制剂总量为0.72g,其中含有0.12g重组aat
‑
fc融合蛋白、0.36g磷酸钠、0.06g氯化钠和0.06g甘露醇,以及0.12g聚乳酸
‑
羟基乙酸共聚物。
62.二、药物制剂的纳米包裹及检测
63.1.纳米颗粒制备
64.本例采用聚乳酸
‑
羟基乙酸共聚物(缩写plga)作为包裹材料,具体包裹方法如下:
65.(1)称取0.48g的plga,将其溶于10ml的有机溶剂乙酸乙酯中,制成包裹材料溶液;
66.(2)配制0.45l浓度为0.3%w/v的维生素e聚乙二醇琥珀酸酯溶液,备用;
67.(3)将“一、药物制剂制备”获得的药物制剂加入包裹材料溶液中,分散均匀;然后,将含有药物制剂的包裹材料溶液,使用巴斯德移液管滴加到其两倍体积的维生素e聚乙二醇琥珀酸酯溶液中,一边滴加,一边进行高速震荡,直至添加完成后,再继续震荡15s,获得乳液;将乳液转移到超声波发生器中,保持容器浸入冰水中,并超声波处理四次,每次8s,本例采用的是800w超声仪,振幅为35%,探头尖端尺寸为1/8,在每次8s超声处理之间暂停使溶液冷却后再继续,上下移动探头以确保均匀的超声处理;
68.(4)将步骤(3)超声处理后的产物全部转移到剩余的维生素e聚乙二醇琥珀酸酯溶液中,持续搅拌三个小时让纳米颗粒硬化,该硬化的纳米颗粒即本例的纳米材料包裹的药物制剂;
69.(5)将步骤(4)的产物平均分到两个离心管中,17000g离心30min,去除上清液,各离心管再加入3ml去离子水,洗涤至少两次,最后采用1ml去离子水重悬,所获得的悬浮液即纳米材料包裹的药物制剂(纳米颗粒),可用于后续试验。
70.2.包裹率检测
71.本例总计制备获得了1.2g纳米材料包裹的药物制剂,其中含有0.12g重组aat
‑
fc融合蛋白、0.36g磷酸钠、0.06g氯化钠和0.06g甘露醇,以及0.6g聚乳酸
‑
羟基乙酸共聚物。0.6g聚乳酸
‑
羟基乙酸共聚物包括药物制剂纳米颗粒中的聚乳酸
‑
羟基乙酸共聚物,以及作为外壳的聚乳酸
‑
羟基乙酸共聚物。
72.从制备的1.2g纳米材料包裹的药物制剂中,精确称量5mg,溶解于4ml乙腈中,获得检测溶液;将检测溶液通过0.22μm的聚四氟乙烯针筒过滤器过滤,然后采用高压液相色谱法(hplc)进行分析。
73.其中,5mg纳米材料包裹的药物制剂中含有0.5mg重组aat
‑
fc融合蛋白、1.5mg磷酸钠、0.25mg氯化钠和0.25mg甘露醇,以及2.5mg聚乳酸
‑
羟基乙酸共聚物。
74.本例使用waters 2695 separation module system(waters公司,milford,ma,usa),tskgel up
‑
sw columns(4.6
×
30cm),并保持在室温下;检测波长280nm,流速取1ml/min;流动相是甲醇70:水30的混合物;注射量为20ml;使用校准线计算每次使用中活性成份的量。
75.测量结果如图1所示,结果显示,本例制备的纳米材料包裹的药物制剂中,几乎全部药物都被包裹到plga纳米颗粒中,包裹率达到90%以上。
76.3.纳米材料包裹的药物制剂释放速度测量
77.将20mg制备的纳米材料包裹的药物制剂加入10ml加盖玻璃小瓶中,并加入6ml的ph7.4浓度为20mm的pbs溶液中。其中,pbs溶液中含有20%体积的甲醇,其作用是加速药物释放。小瓶在振荡器中以50rpm振荡,温度设置为37℃。每过预设的间隔时间,将小瓶从振荡器中取出并静置几分钟以使微球沉下底部。然后,取出1ml上清液并加入等量的新鲜含甲醇的pbs。将小瓶放回振荡器中。使用hplc系统和上述方法分析取出的溶液样品。
78.测量结果显示,本例的纳米材料包裹的药物制剂的缓释时间约为5天左右;并且,可以通过控制聚乳酸
‑
羟基乙酸共聚物的用量控制药物释放速度,起到缓释作用,可以控制药物释放的时间实现更好的药物利用效果。
79.4.纳米材料包裹的药物制剂的稳定性测试
80.本例通过检测纳米颗粒的包裹材料聚乳酸
‑
羟基乙酸共聚物的分子量变化来判断纳米颗粒的降解程度,以此表征纳米材料包裹药物制剂的纳米颗粒的稳定性。
81.具体的,本例分别测试了纳米颗粒分别在室温(约25℃)放置1天、7天、14天后的聚乳酸
‑
羟基乙酸共聚物的分子量下降程度。分子量的测量方法包括:采用凝胶渗透色谱法测定原始和降解后的聚合物样品的分子量;其中,凝胶渗透色系统由waters hplc泵和差分折射检测器组成;两个聚苯乙烯型交联共聚物的凝胶渗透色谱柱连接在一起以覆盖更宽的分子量范围,保持温度在35℃;在两个凝胶渗透色谱柱之前连接一个聚苯乙烯型交联共聚物保护柱;使用氯仿作为流动相,流速为0.25ml/min,注射量为100μl;使用聚苯乙烯标准物建立分子量校准线。测试结果如图2至图4所示,图2为放置1天的测试结果,图3为放置7天的测试结果,图4为放置14天的测试结果。
82.测量结果显示,在1天内,本例的纳米材料包裹的药物制剂中,纳米颗粒的分子量几乎不下降,7天内分子量降低仅仅约10%,分子量降低50%的时间大于14天,表明本例的纳米颗粒稳定性良好。
83.三、聚合物微针的制备及检测
84.1.聚合物微针制备
85.将本例制备的纳米材料包裹的药物制剂溶于10%的羧甲基纤维素钠溶液中,制成混合溶液;其中,药物制剂的量为羧甲基纤维素钠的5%
‑
20%(w/w),本例具体约为10%(w/w);具体的,将100mg制备的纳米材料包裹的药物制剂,分散于9.9ml浓度为10%的羧甲基纤维素钠溶液中,获得约10ml混合溶液。将50μl混合溶液加入到微针贴片模具中,将模具置于离心机中6000rpm离心4min,使混合溶液充分进入模具上的针孔空腔,并使大部分的纳米材料包裹的药物制剂沉积在针尖。离心后完成,移去空腔外的混合溶液,风干过夜,使混合溶液凝固。再向模具内加入10%的羧甲基纤维素钠溶液300μl,4000rpm离心1min。离心完成后,静置模具,风干过夜,形成微针贴片。贴片成型后,将贴片从模具上剥离下来,即获得本例的聚合物微针贴片。本例聚合物微针贴片的底面积为1.5cm
×
1.5cm,微针密度为100针每平方厘米,微针的高度约为500μm
‑
1mm。可以理解,贴片的底面积和微针密度都取决于模具;至于微针的高度一方面取决于模具,另一方面取决于混合溶液是否有效的进入模具的针孔空腔;虽然本例采用离心使混合溶液充分进入针孔空腔,但是,仍然不能保障混合溶液百分之百的完全填充针孔空腔,因此微针高度为500μm
‑
1mm,这样的高度范围能够满足使用需求。
86.其中,将50μl混合溶液加入到微针贴片模具中后,离心的速度可以是5000
‑
6000rpm,离心时间一般为3
‑
6min,在该条件下,不仅能够使混合溶液充分进入模具的针孔空腔内,而且能够使纳米材料包裹的药物制剂大部分沉积在微针的尖部,从而方便药物释放。
87.本例的微针贴片使用50μl含有纳米材料包裹的药物制剂的混合溶液制备,其中,50μl混合溶液中含有约0.5mg纳米材料包裹的药物制剂,而0.5mg纳米材料包裹的药物制剂中含有0.05mg重组aat
‑
fc融合蛋白、0.15mg磷酸钠、0.025mg氯化钠和0.025mg甘露醇,以及0.25mg聚乳酸
‑
羟基乙酸共聚物;因此,本例制备的微针贴片中含有总量约50μg的重组aat
‑
fc融合蛋白、150μg的磷酸钠、25μg的氯化钠和25μg甘露醇。
88.本例的微针贴片,使用时,如图5所示,直接将微针贴片01贴于患处即可;微针贴片
01的微针穿透表皮11和真皮12,针尖略微接触皮下组织13,将药物直接释放到病征位置处。图5中,a图为微针贴片作用于患处的示意图;b图为微针内纳米材料包裹的药物制剂的示意图,图中02表示药物制剂纳米颗粒;c图为患者病征部位示意图,a图和c图中14表示尿酸盐结晶引发的炎症病灶部位。聚合物微针如图6所示,其底部为水溶性羟甲基纤维素钠底座31,针尖部位含有大量的水性聚乳酸
‑
羟基乙酸共聚物包裹的药物制剂32;在微针插入皮肤后,其作用过程如图6所示,包括刺入33、种植34、迅速释放35和持续释放36;其中,刺入33后,针尖部位会停留在皮肤内,将纳米材料包裹的药物制剂种植在病患部位,纳米材料包裹的药物制剂迅速从微针针尖部位释放出来,在纳米包裹材料的生物降解过程中持续释放药物;通过控制微针的生物降解使纳米材料包裹的药物制剂逐步释放出来;通过控制纳米包裹材料的降解,缓释药物制剂,使得药物制剂能够在病征部位长期施药,从而提高药物制剂的利用率和作用周期,起到有效治疗痛风的效果。
89.2.聚合物微针内药物分布测试
90.为了观察聚合物微针内药物分布情况,本例在药物制剂纳米微球的包裹材料,即聚乳酸
‑
羟基乙酸共聚物中添加荧光染料磺酰罗丹明b,并在制备聚合物微针的羧甲基纤维素钠中添加荧光染料库马林314;按照前述方法制备聚合物微针;然后使用共聚焦荧光显微镜,观察荧光分子分布;根据荧光染料磺酰罗丹明b和荧光染料库马林314的分布情况判断聚合物微针内药物制剂纳米微球的分布。
91.结果如图7所示,图7中,左图为荧光染料库马林314的观察结果图,中间图为荧光染料磺酰罗丹明b的观察结果图,右图为库马林314和磺酰罗丹明b两个荧光通道的叠加视图。图7的结果显示,大部分荧光染料都分布在微针尖端,与预期结果相符。
92.3.聚合物微针体外透皮给药实验
93.为了评估微针aat
‑
fc的时间依赖性皮内释放速率,本例使用cy3标记的aat
‑
fc微针,刺入猪皮样品中,然后在不同时间间隔,通过测量猪皮样本中的cy3荧光变化,确定cy3标签aat
‑
fc的转移效率和药物释放动力学曲线。
94.将本例制备的聚合物微针贴片分为9组,每组扎入猪皮后依序分别停留5min、l0min、20min、40min、80min;然后,将聚合物微针贴片拔出。采用显微镜观察拔出后的聚合物微针贴片的微针尖端的形貌,以及猪皮内的药物进入与分布情况,利用光谱荧光仪检测处理前后的微针贴片内的药物含量。
95.部分统计结果如图8所示,随着停留时间增加,微针贴片在猪皮内吸收组织水分慢慢溶解释放尖端药物,微针尖端荧光慢慢减弱;相应的,猪皮内药物的荧光强度渐渐增强。本例具体的,在5分钟内,约50%的包埋在微针针尖的aat
‑
fc被释放到皮肤上,释放高峰在20
‑
40分钟之间,有约75%的aat
‑
fc释放到皮肤微环境中。
96.4.聚合物微针皮肤刺激试验
97.本例将制备的微针贴片连续3天,每天一次施用于大鼠背部皮肤相同的位置,施用方式为微针贴片粘贴10分钟后拔出微针贴片。观察在用微针贴片处理的皮肤上是否有可见的皮肤刺激,以此评估本例聚合物微针贴片的安全性。
98.结果显示,与未进行任何处理的皮肤相比,在用本例的聚合物微针贴片处理的皮肤上没有观察到可见的刺激。将微针穿刺部位周围的皮肤解剖并进行组织学检查,观察是否有皮肤炎症细胞浸润,采用未处理的皮肤作为对照组;结果显示,与未处理的皮肤相比,
在重复插入微针贴片的皮肤上未观察到明显的皮肤炎症细胞浸润。以上试验结果表示,本例的聚合物微针贴片不会诱导皮肤产生显著的炎症反应,安全性高。
99.5.聚合物微针的动物实验
100.本试验主要检测aat
‑
fc对痛风细胞炎症因子的影响,本试验构建了大鼠痛风性关节炎急性模型,并采用本例制备的聚合物微针对其进行治疗。具体如下:
101.采用8周龄的雄性wistar大鼠50只。所有大鼠均置于恒温23
±
1℃,55%相对湿度的塑料笼中,光照/暗光周期12小时光照时间为7:00
‑
19:00,自由食用标准食品和矿泉水。
102.尿酸钠(msu)诱导的大鼠痛风性关节炎模型:
103.在生物安全柜中用无菌水制备msu(sigma
‑
aldrich)悬浮液。
104.50只大鼠随机分为5组,每组10只。第5天下午4:00,除ctrl大鼠注射0.9%盐水外,其余大鼠均向右脚踝(0.1ml)关节内注射20mg/ml的msu。msu注射前,从大鼠的尾静脉中采集血样200微升。大鼠在第6、7及第8天实施安乐死之前,从大鼠的尾静脉中采集血样200微升。
105.50只大鼠随机分为5组(n=10只/组),各组设计如下:
106.1)ctrl对照组,第五天注射msu后,用不含aa
‑
fc纳米微针贴片贴于大鼠右脚踝,每天更换纳米微针贴,持续3天;2)痛风性关节炎大鼠,用不含aat
‑
fc纳米微针贴片贴于大鼠右脚踝,每天更换纳米微针贴,持续3天;3)痛风性关节炎大鼠
‑
aat
‑
fc低剂量组,含aat
‑
fc 12.5微克(0.5毫克/公斤)纳米微针贴片(aat
‑
fc来自深圳鹰岗国际),每天更换纳米微针贴,持续3天;4)痛风性关节炎大鼠
‑
aat
‑
fc高剂量组(aat
‑
fc来自深圳鹰岗国际),含aat
‑
fc 50微克(2毫克/公斤)纳米微针贴片,每天更换纳米微针贴,持续3天。5)痛风性关节炎大鼠
‑
aat组,含血浆提纯aat 2毫克(80毫克/公斤)纳米微针贴片(血浆提纯aat购自sigma
‑
aldrich,usa),每天更换纳米微针贴,持续3天。以ctrl对照组、痛风性关节炎大鼠分别作为阴性对照组和模型对照组,分析aat
‑
fc纳米微针贴对痛风性关节炎模型大鼠细胞炎症因子的影响,以及aat
‑
fc与血浆提纯aat在抑制细胞炎症因子il
‑
β,il
‑
6和tnf
‑
α的效果比较。
107.其中,含aat
‑
fc 50微克纳米微针贴片,是使用50μl含有纳米材料包裹的药物制剂的混合溶液制备,其中,50μl混合溶液中含有约0.5mg纳米材料包裹的药物制剂,而0.5mg纳米材料包裹的药物制剂中含有0.05mg重组aat
‑
fc融合蛋白、0.15mg磷酸钠、0.025mg氯化钠和0.025mg甘露醇,以及0.25mg聚乳酸
‑
羟基乙酸共聚物;因此,制备的微针贴片中含有总量约50μg的重组aat
‑
fc融合蛋白、150μg的磷酸钠、25μg的氯化钠和25μg甘露醇。含aat
‑
fc 12.5微克纳米微针贴片,在制备微针贴片时,只需要使用12.5μl含有纳米材料包裹的药物制剂的混合溶液即可;相应的,12.5μl混合溶液中含有约0.125mg纳米材料包裹的药物制剂,而0.125mg纳米材料包裹的药物制剂中含有0.0125mg重组aat
‑
fc融合蛋白、0.0375mg磷酸钠、0.00625mg氯化钠和0.00625mg甘露醇,以及0.0625mg聚乳酸
‑
羟基乙酸共聚物;由此制备的微针贴片中含有总量约12.5μg的重组aat
‑
fc融合蛋白、37.5μg的磷酸钠、6.25μg的氯化钠和6.25μg甘露醇。
108.在急性痛风关节炎大鼠模型中,血清il
‑
1β、il
‑
6和肿瘤坏死因子(tnf
‑
α)水平在msu注射后不同时间内的变化,采用r&d systems,minneapolis,mn,usa有限公司elisa试剂盒测定,检测流程根据厂商的说明书进行。测试结果如表1和图9至图11所示。其中,图9是采用聚合物微针治疗后各试验组和对照组的痛风性关节炎炎症因子il
‑
1β的检测结果,图10
是采用聚合物微针治疗后各试验组和对照组的痛风性关节炎炎症因子il
‑
6的检测结果,图11是采用聚合物微针治疗后各试验组和对照组的痛风性关节炎肿瘤坏死因子tnf
‑
α的检测结果,其中图9至图11还比较了不同剂量aat
‑
fc聚合物微针治疗后以及血浆提纯aat聚合物微针治疗后抑制痛风性关节炎肿瘤坏死因子的效果。
109.表1本例微针贴对大鼠急性痛风关节炎细胞炎症因子影响
[0110][0111]
表1的测试结果为平均值
±
sd,其中,平均值是每组n=10的平均值,标准差来自3次重复试验,即一个样品进行三次重复试验。
[0112]
图9至图11的测试结果为平均值
±
sd,其中,平均值是每组n=10的平均值,标准差来自3次重复试验,即一个样品进行三次重复试验。
[0113]
表1、图9至图11的结果显示,在痛风关节炎模型组大鼠,高尿酸血症和促炎细胞因子il
‑
1和il
‑
6水平升高,(p<0.05)。而与实验对照组大鼠相比,aat
‑
fc微针处理组的大鼠il
‑
1β的水平减少34.2%(p<0.05),il
‑
6减少27.3%(p<0.05)和肿瘤坏死因子
‑
α(tnf
‑
α)减少13.2%(p<0.05)。血浆提纯aat也有类似抑制效果,但aat
‑
fc的剂量12.5微克对细胞因子无抑制效果,而aat
‑
fc的剂量50微克达到了血浆提纯aat的2毫克同样抑制细胞炎症因子的效果(40倍)。
[0114]
以上试验显示,本例制备的聚合物微针能够直接贴于病征部位,对痛风关节炎具有良好的治疗效果,并且aat
‑
fc融合蛋白解决了丝氨酸蛋白酶抑制剂全身循环难以长期作用于病征部位的问题,避免了全身性途径过量使用丝氨酸蛋白酶抑制剂导致的非特异性免疫抑制和各种不良反应等问题。本例的聚合物微针,为临床治疗痛风或丝氨酸蛋白酶抑制剂相关的疾病提供了一种更高效、安全的治疗方案。
[0115]
以上内容是结合具体实施方式对本技术所作的详细说明,不能认定本技术的实现方式只局限于这些说明。对于本技术技术领域的普通技术人员来说,在不脱离本技术基本发明构思的前提下,还可以进行若干简单推演或替换。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1