转铁蛋白与抗体结合超顺磁性氧化铁纳米粒及其制备方法和应用
1.本发明属于医药领域,具体涉及一种转铁蛋白与抗体结合超顺磁性氧化铁纳米粒及其制备方法和应用。
背景技术:
2.乳腺癌是目前女性最常见的恶性肿瘤之一,在世界范围内发病率逐年上升,并有年轻化的趋势。乳腺癌具有侵袭性强、易复发和易转移的特点。为了提高患者的生存率和生活质量,需要更安全有效的治疗方法来降低乳腺癌的复发率。常用的常规治疗方式有病灶切除、放疗和化疗,或单独进行,或联合进行,但这些治疗一般具有侵袭性,不具有选择性,多数情况下对肿瘤的治疗效果明显有限,对健康器官、组织和细胞也会产生不良副作用。目前,纳米靶向给药系统(tddss)在乳腺癌的靶向治疗中得到了广泛的关注,以缓解乳腺癌的症状,提高或延长患者的生存期。
3.不同类型的磁性纳米颗粒(mnps)作为载体已成为肿瘤治疗领域的基本应用。mnps作为一种药物传递系统,由于其独特的磁性和生物相容性,可以在外磁场作用下靶向于人体的特定部位。迄今为止,超顺磁性氧化铁纳米粒子(spions)是应用最广泛的mnps类型之一。spions具有超顺磁性、催化性、低毒性和生物导电性等多种性质,使其在生物医学领域的应用成为可能。临床上,这类粒子广泛应用于磁共振成像(mri),热疗,将抗癌药物传递到特定的位置、生物传感器、传感器、体内细胞追踪、和癌细胞磁分离。当spions装载药物时,它们在确保磁性靶区的药物浓度达到治疗浓度的同时降低药物剂量;降低非靶区的药物浓度以降低其毒性和副作用。
4.一般来说,spions可以通过被动或主动靶向机制给药。渗漏的肿瘤微血管(tmv)导致通透性和滞留(epr)效应增强,这是nps被动靶向机制的基础,因为mnps可以通过tmv内皮细胞的孔隙和空隙渗出并积聚在宽松的肿瘤微环境(tme)中。另一方面,spions与特定聚合物功能化可以增强组织的对比度。癌细胞通常比正常细胞在细胞表面过表达更多的特定蛋白质,这些蛋白质被用作癌症生物标志物,如粘蛋白1(muc1)、tf受体(tfrs)、叶酸受体、cd44受体、epidermal growth factor(egf)受体等。利用适体、配体、抗体等生物相容性修饰物对spions进行进一步功能化,可以提高spions在外磁场作用下在癌细胞附近的定位,进而通过识别和结合肿瘤生物标志物实现靶向给药,这称为主动靶向机制。
5.专利cn102784400a、wo2009033176a1、wo2020236998a2等公开了偶联转铁蛋白的超顺磁性氧化铁纳米粒。粘蛋白1(muc1)与纳米粒载体结合也已有文献报道(siminzar p et al.;targeted delivery of doxorubicin by magnetic mesoporous silica nanoparticles armed with mucin-1aptamer;j drug target.;2020jan;28(1):92-101)。但转铁蛋白+抗粘蛋白1双修饰/双靶向的超顺磁性氧化铁纳米粒未见报道。
技术实现要素:
6.针对现有技术的不足,本发明的目的在于提供一种转铁蛋白与抗体结合超顺磁性氧化铁纳米粒及其制备方法和应用。
7.本发明的技术方案通过制备双靶向纳米结合物来实现。转铁蛋白(transferrin,tf)是一种跨膜糖蛋白,其受体tfrs在多种癌症中过度表达,例如乳腺癌、脑癌、卵巢癌、胶质母细胞瘤。癌细胞比健康细胞过度表达tfrs,同时tf对tfrs有很强的亲和力,这使得tf成为最广泛使用的肿瘤靶向配体之一。
8.粘蛋白-1(muc1)是一种具有异常糖基化胞外结构域的跨膜蛋白,在肺癌、乳腺癌、胰腺癌和卵巢癌等多种恶性腺癌中至少高表达10倍。肿瘤相关的muc1与健康细胞中表达的muc1由于其结构、细胞分布和生化特征不同。spions经适体修饰后,能选择性识别癌细胞表面的muc1并与之结合。因此,muc1作为一种生物标记分子,在适体定向向癌细胞靶向递送抗癌药物方面受到了广泛关注。
9.在此,结合在spions上的tf和抗muc1能够特异识别乳腺癌细胞系(mda-mb-231)表面的tfrs和抗muc1。与未修饰的spions相比,这种复合spions能显著提高细胞的摄取。
10.本发明是由以下技术方案实现的。
11.转铁蛋白与抗体结合超顺磁性氧化铁纳米粒,其特征在于,所述纳米粒为转铁蛋白和抗粘蛋白-1修饰的超顺磁性氧化铁纳米粒(tf-anti-muc1-spions)。
12.进一步的,所述tf-anti-muc1-spions是将裸spions上的羧基用1-乙基-3,3-二甲氨基丙基碳二亚胺盐酸盐(edc)和磺基-n-羟基丁二酰亚胺(磺基-nhs)活化后,再进行转铁蛋白(tf)和抗粘蛋白-1(anti-muc1)偶联。
13.进一步的,所述裸spions、转铁蛋白(tf)和抗粘蛋白-1(anti-muc1)的质量比为(7~9)∶(2~6)∶1;更进一步的,所述质量比为8∶(3~4)∶1;最优选为8∶4∶1。
14.进一步的,所述tf-anti-muc1-spions的粒径为50~150nm,zeta电位为-20~-40mv;更进一步的,所述粒径为110nm,所述zeta电位为-32mv。
15.进一步的,所述tf-anti-muc1-spions负载阿霉素,所述阿霉素与所述tf-anti-muc1-spions的质量比为22∶1。
16.进一步的,本发明还提供包含所述tf-anti-muc1-spions和药学上允许的载体的药物组合物。
17.本发明的另一方面是提供所述tf-anti-muc1-spions的制备方法,其特征在于,包括如下步骤:
18.(1)用edc和磺基-nhs活化裸spions;
19.(2)加入转铁蛋白(tf)和抗粘蛋白-1(anti-muc1)充分混合反应即可。
20.进一步的,所述裸spions、转铁蛋白(tf)和抗粘蛋白-1(anti-muc1)的质量比为(7~9)∶(2~6)∶1;更进一步的,所述质量比为8∶(3~4)∶1;最优选为8∶4∶1。
21.进一步的,所述制备方法还包括步骤(3)离心去除多余的tf和抗muc1,然后将纳米粒再悬浮后储存过夜。
22.进一步的,所述tf-anti-muc1-spions的制备方法为:
23.(1)将1ml的spions(0.55nmol/ml)超声分散在2ml ph=6的mes缓冲液中,添加4μmol、191.7g/mol的edc hcl;
24.(2)向(1)获得的溶液中添加10.0μmol、217.13g/mol的磺基nhs,并充分混合,封口膜封好;
25.(3)将(2)获得的溶液反应在室温下摇床培养10分钟-15分钟;
26.(4)11000rpm,离心15分钟,以去除过量未反应的edc和nhs;
27.(5)去掉上清液,将活化后的spions超声分散在2ml的ph=7.2的pbs缓冲液中;
28.(6)将0.5ml的转铁蛋白tf和0.1ml的anti-muc1加入到活化的spions中,快速超声分散30s,室温下摇床2h-2.5h,之后离心洗涤以去除多余的tf和anti-muc1,然后将偶连后的spions再悬浮在无菌的pbs中;最后,将产品储存在4℃过夜即得。
29.进一步的,所述裸spions的浓度为0.55nmol/ml;所述转铁蛋白的浓度为1mg/ml;所述anti-muc1的浓度为1.2mg/ml。
30.进一步的,所述转铁蛋白的分子量mw为80000da;所述anti-muc1的分子量mw为260000da。
31.第三方面,本发明还提供了所述tf-anti-muc1-spions在制备抗肿瘤药物中的应用,优选在制备具备肿瘤诊断和治疗双重功能的药物中的应用;进一步优选在制备具有乳腺癌诊断和治疗双重功能的药物中的应用。
32.本发明具有以下有益效果:
33.本发明将spions设计成在磁场下通过abs配体介导的内吞作用渗入癌组织,并将药物传递给癌细胞。本发明用tf和anti-muc1修饰羧基功能化spions,得到dox可以被装载到mda-mb-231细胞的核-壳结构。采用不同的方法测试双修饰spions的大小、形状、载药量、磁性、细胞摄取、生物相容性等理化性质;并比较dox-tf-anti-muc1-spions对mda-mb-231细胞和健康人皮肤成纤维细胞(hdf)的细胞毒性。我们发现双修饰spions可以有效地将dox导入癌细胞,并通过主动靶向机制呈现出显著的抗mda-mb-231细胞毒性。我们证明,这些双靶向粒子,同步靶向乳腺癌细胞,是人类乳腺癌治疗的有希望的候选方案(图1)。
附图说明
34.图1是载dox的tf和抗muc1结合spions靶向递送到肿瘤细胞的机制的示意图。
35.图2是tf、spions和tf spions的ft-ir光谱图。
36.图3是(左)裸spions和(右)含dox的tf-anti-muc1-spions的tem图像。
37.图4是spions、dox spions、dox-tf spions、dox-anti-muc1-spions和dox-tf-anti-muc1-spions的磁化强度变化。
38.图5是dox负载的nps对mda-mb-231细胞(a)和hdf细胞(b)的细胞毒性结果。spions对mda-mb-231和hdf细胞的生物相容性如(c)所示(数据以平均值表示
±
sd,n=3,**代表p《0.01)。
39.图6是描绘细胞摄取dox负载np的荧光显微照片:(dox-spions,dox-tf-spions,dox-anti-muc1-spions和dox-tf-anti-muc1-spions)对mda-mb-231细胞(a)和hdf细胞(b)的作用;图像显示dox荧光在细胞、细胞核被hoechst染色,以及三张图像的叠加。
具体实施方式
40.下面结合具体实施方式对本发明作进一步详细说明。应该强调的是:下述说明仅
仅是示例性的,而不是为了限制本发明的范围及其应用。
41.材料:
42.直径为20nm的超顺磁性氧化铁纳米颗粒购买于ocean nanotech(san diego,ca,usa),mda-mb-231和hdf细胞系来自于american type culture collection(manassas,va,usa)。细胞培养、合成和分析的所有培养基和材料均来自sigma-aldrich chemie gmbh(美国密苏里州圣路易斯市),包括dulbecco改良eagle's培养基(dmem)、胎牛血清(fbs)、聚d-赖氨酸排气螺旋盖烧瓶、标准96孔微孔板,96孔透明底微孔板、青霉素-链霉素(ps)、triton x-100、转铁蛋白(tf)和抗muc1适体。细胞滴度细胞增殖分析水溶液(mts)购自promega公司(美国威斯康星州麦迪逊)。hoechst 33342(10mg/ml水中)和alexa fluor
tm
488个小麦胚芽凝集素购自thermo fisher scientific(waltham,ma,usa)。
43.spions的仪器和特性
44.为了确定500-4000cm-1
范围内的功能基团,采用傅立叶变换红外光谱(ft-ir,vertex 70v:bruker,billerica,ma usa)对tf和抗muc1修饰的spions进行了表征。功能化材料spions的动态光散射(dls)和zeta电位是使用zs90纳米仪器(malvern instruments,malvern,uk)测定的。利用透射电子显微镜(tem,jeol,东京,日本)观察了修饰spions的大小和形态。为了制备用于tem分析的样品,使用超声波发生器将改性spions(500mg/ml)分散在去离子水中3分钟,约5μl悬浮液被小心地放置在一个300目碳涂层铜支撑网格上,并在室温下风干。在室温下,用振动样品磁强计(vsm,7404系列,美国韦斯特维尔湖岸低温电子学公司)评估了改性spions的磁饱和强度。
45.实施例1 tf-spions的制备
46.(1)将1ml的spions(0.55nmol/ml)超声分散在2ml mes缓冲液(ph=6)中,添加0.77mg edc hcl(4μmol,191.7g/mol),1spions∶8edc;
47.(2)向该溶液中添加2.17mg磺基nhs(10.0μmol,217.13g/mol),并充分混合,封口膜封好,1edc∶2.5磺基nhs;
48.(3)将该反应在室温下摇床培养10分钟-15分钟;
49.(4)11000rpm,离心15分钟,以去除过量未反应的edc和nhs;
50.(5)去掉上清液,将活化后的spions超声分散在2ml的pbs缓冲液(ph=7.2)中;
51.(6)将0.5ml的transferrin(tf,1mg/ml,mw=80000da)加入到活化的spions中,快速超声分散30s,室温下摇床2h-2.5h,之后离心洗涤以去除多余的tf,然后将偶连后的spions再悬浮在无菌的pbs中;最后,将产品储存在4℃过夜即得。
52.实施例2 anti-muc1-spions的制备
53.(1)将1ml的spions(0.55nmol/ml)超声分散在2ml mes缓冲液(ph=6)中,添加0.77mg edc hcl(4μmol,191.7g/mol),1spions∶8edc;
54.(2)向该溶液中添加2.17mg磺基nhs(10.0μmol,217.13g/mol),并充分混合,封口膜封好,1edc∶2.5磺基nhs;
55.(3)将该反应在室温下摇床培养10分钟-15分钟;
56.(4)11000rpm,离心15分钟,以去除过量未反应的edc和nhs;
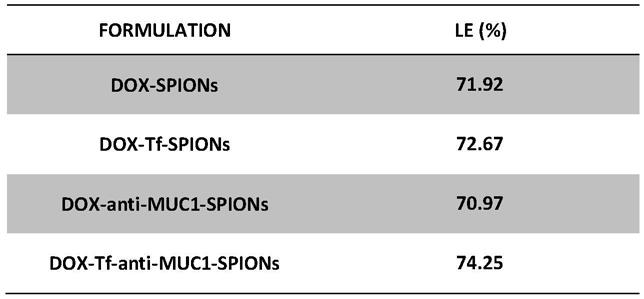
57.(5)去掉上清液,将活化后的spions超声分散在2ml的pbs缓冲液(ph=7.2)中;
58.(6)将0.1ml的anti-muc1(1.2mg/ml,mw=260000da)加入到活化的spions中,快速
超声分散30s,室温下摇床2h-2.5h,之后离心洗涤以去除多余的anti-muc1,然后将偶连后的spions再悬浮在无菌的pbs中;最后,将产品储存在4℃过夜即得。
59.实施例3 tf-anti-muc1-spions的制备
60.(1)将1ml的spions(0.55nmol/ml)超声分散在2ml mes缓冲液(ph=6)中,添加0.77mg edc hcl(4μmol,191.7g/mol),1spions∶8edc;
61.(2)向该溶液中添加2.17mg磺基nhs(10.0μmol,217.13g/mol),并充分混合,封口膜封好,1edc∶2.5磺基nhs;
62.(3)将该反应在室温下摇床培养10分钟-15分钟;
63.(4)11000rpm,离心15分钟,以去除过量未反应的edc和nhs;
64.(5)去掉上清液,将活化后的spions超声分散在2ml的pbs缓冲液(ph=7.2)中;
65.(6)将0.5ml的transferrin(tf,1mg/ml,mw=80000da)和0.1ml的anti-muc1(1.2mg/ml,mw=260000da)加入到活化的spions中,快速超声分散30s,室温下摇床2h-2.5h,之后离心洗涤以去除多余的tf和anti-muc1,然后将偶连后的spions再悬浮在无菌的pbs中;最后,将产品储存在4℃过夜即得。
66.实施例4阿霉素负荷
67.为了获得最高的负载效率,在四根eppendorf管中分别加入60g dox,其中分别含有1.5mg spions、tf-spions、anti-muc1-spions和tf-anti-muc1-spions。然后,混合,并在4℃下避光培养持续24小时。利用磁棒分别收集装载dox的dox-spions、dox-anti-muc1-spions、dox-tf-spions和dox-tf-anti-muc1-spions。取回上清液,并通过荧光微孔板读取器(spectra max m3,molecular devices,sunnyvale,ca,usa)测量四个eppendorf管中残余dox的浓度以评估载药量。dox在改性spions中的负载效率(le)通过以下公式计算得出:
68.le(%)=[(w
t-wf)/w
t
]
×
100%
[0069]wt
表示总药物的重量,wf表示上清液中游离药物的重量。
[0070]
高载药量是纳米载体的一个重要特性,它可以减少药物的释放量,提高肿瘤细胞的清除率。dox是一种含有伯胺基的阳离子药物。为了获得最高的负载效率,dox被分散在共轭spions溶液中。dox通过在dox的氨基和spions的羧基之间形成酰胺键而负载在spions上。为了量化spions的负载效率,采用分光光度法测定标准药物浓度的吸收值,作为评价dox负载浓度的参考。双改性spions的dox负载效率相对较高(表1)。
[0071]
表1.dox-spions、dox-tf-spions、dox-anti-muc1-spions和dox-tf-anti-muc1-spions的dox加载效率
[0072][0073]
实施例5 ft-ir表征
[0074]
在400-4000cm-1
的波数范围内记录了表面修饰的spions的ft-ir光谱中(见图2),约1637cm-1
和1533cm-1
处的吸收峰分别属于c-o键和n-h键。另外,3284cm-1
处的谱带是由于tf的nh2伸缩振动所致。在3284cm-1
和1556cm-1
处观察到两个明显的吸收峰,分别表示o-h键和c=o键。它们主要是由spions的羧基引起的,spions悬浮液中残留的水进一步促进了o-h键的形成。在tf-spions的ft-ir光谱中,1646cm-1
处的特征吸收峰为c=o键,1538cm-1
处出现酰胺键伸缩带的c-n,3278cm-1
处的宽吸收带是酰胺键的n-h伸缩带。这说明在edc和磺基nhs的作用下,spions的羧基与tf氨基酸的氨基之间形成了酰胺键,tf被成功地结合到spions上。
[0075]
实施例6形态学研究
[0076]
用透射电镜(tem)测量了裸spions和双改性spions的表面形貌和核心粒径。获得的典型图像如图3所示。从高分辨率tem显微照片来看,双修饰dox负载spions具有核-壳结构。双修饰spions与裸spions的粒径差别不大,粒径分布均匀,约为20nm,此粒径范围是药物释放的首选。这些图像进一步说明共轭纳米颗粒具有均匀的球形和单分散的形貌。
[0077]
实施例7 dls分析
[0078]
为了确定复合纳米载体的zeta电位和流体力学尺寸,使用dls技术,借助90plus zeta动态光散射仪(dls,brookhaven instruments corporation,holtsville,ny,usa)分析了水中分散的spions。数据如表2所示。spions的平均粒径从裸spions到双修饰spions逐渐增大。观察到抗muc1共轭spions的直径大于tf共轭spions。dls法与tem法在平均粒径测量上的差异可能是由于制备过程中spions的脱水或衰减所致。此外,spions的累积可能导致dls对平均粒径的高估。按照dox-spions、dox-tf-spions、dox-anti-muc1-spions和dox-tf-anti-muc1-spions的顺序,多分散指数逐渐增加。总结水分散体系中spions体系zeta电位的测量数据,发现dox负载粒子主要产生较高的zeta电位,spions是阴离子型的。tf-共轭spions对zeta电位无影响,而抗muc1-共轭spions的zeta电位因dox掺入而适度降低。
[0079]
表2.spions、dox-spions、dox-tf-spions、dox-anti-muc1-spions和dox-tf-anti-muc1-spions的dls相关参数
[0080][0081]
实施例8 vsm
[0082]
在外加磁场作用下,用vsm研究了spions的磁性能。五种spions的室温磁化曲线如图4所示。表面改性后保持spions的磁性很重要。通过观察不同的磁滞曲线,发现所有spions体系的剩余磁化强度和矫顽力都接近于零,表明共轭spions能够保持超顺磁性的特
性。裸spions的磁饱和最高,约为25emu/g,而双改性spions在5000oe时的磁饱和约为10emu/g。表面修饰spions的磁化强度略有下降,这可能与tf和抗muc1修饰引起的载药量增加和粒径增大有关。超顺磁性使spions能够被外磁场有效地操纵到所需的位置,这表明本研究制备的双靶向spions可以用于磁场操纵的临床应用,如磁热疗和靶向给药。
[0083]
实施例9细胞培养
[0084]
将人乳腺癌细胞mda-mb-231和hdf细胞接种于添加1%(v/v)青霉素/链霉素和10%(v/v)胎牛血清(fbs)的培养基(dmem)中。将烧瓶保持在37℃下5%co2的细胞培养箱中。每2-4天更换一次细胞培养基,以确保最佳的细胞健康和活力。
[0085]
实施例10体外细胞毒性研究
[0086]
为了评估裸spions、dox-spions、dox-tf-spions、dox-anti-muc1-spions和dox-tf-anti-muc1-spions系统的细胞毒性作用,测试了这些纳米颗粒对mda-mb-231和hdf细胞活力的影响。用胰蛋白酶从每个培养瓶中分离出两种细胞,在160rcf下离心5分钟,然后再悬浮在新鲜培养基中,用血细胞仪计数。100μl稀释细胞悬液分别注入96孔板,密度约为每孔5000个细胞。将96孔板放置在标准培养箱中,温度为37℃,二氧化碳浓度为5%持续24小时。在细胞贴壁和生长期结束后,取出96孔板中的细胞培养基,并在孔板中立即加入用无菌培养基稀释的100μl不同种类的spions。然后进入孵育期,用5%co2在37℃下处理96孔板中的细胞持续24小时。处理后,加入20μl的mts和100μl的dmem组成的1:5的混合液,并将比色指示剂混合物添加到含有mda-mb-231和hdf细胞的每个孔中。然后,在37℃、5%co2下培养放置4h,使细胞代谢引起的量热变化出现。每个孔的光吸收值在490nm波长下由微孔板阅读器检测(spectra max m3,molecular devices,sunnyvale,ca,usa)。数据以平均细胞存活率表示。
[0087]
为了研究和对比dox负载的spions(dox spions、dox tf spions、dox-anti-muc1-spions和dox-tf-anti-muc1-spions)对mda-mb-231和hdf细胞的细胞毒作用,在各种条件下进行mts分析,由此获得的结果分别如图5a和图5b所示。数据显示,与裸spions相比,dox负载spions在两种细胞系中的细胞毒性都很高,并且依赖于药物相互作用的浓度。tf-spions和anti-muc1-spions对细胞的毒性作用在所有浓度下基本相似。双靶向spions对mda-mb-231细胞有明显的杀伤作用,尤其是在80μg/ml、160μg/ml和320μg/ml的处理浓度下(图5a)。这一现象可归因于乳腺癌细胞对这些修饰spions的摄取增强,这在随后的细胞摄取部分的荧光结果中得到了证实。同时,hdf细胞在20-40μg/ml浓度范围内表现出轻微的细胞毒性。当改性spions的浓度提高到80μg/ml、160μg/ml和320μg/ml,细胞活力仍高达80%(图5b)。病细胞与对照细胞在细胞摄取上的差异导致细胞存活率的差异。
[0088]
tf和tfrs、muc1和抗muc1适体的有效结合有助于介导双修饰spions的内吞作用。双靶向spions能够高效地将dox导入表面过度表达tfrs和muc1的mda-mb-231细胞,从而产生高死亡率的癌细胞。同时,双修饰spions的杀伤力与浓度有关。此外,tf或anti-muc1修饰的spions在所有浓度下都具有相似且较低的细胞毒性。用dox-tf-spions、dox-anti-muc1-spions和dox-tf-anti-muc1-spions孵育mda-mb-231细胞,细胞活力依次下降。这种现象意味着双修饰spions对mda-mb-231细胞的损伤更大。通过对对照细胞的观察,四种修饰spions对hdf细胞的细胞毒性均较低,这可能是由于细胞内化效率低下所致。然而,缺乏靶向适体配体的dox-spions在较高浓度下对对照细胞也表现出轻微的细胞毒作用,这种轻微
的细胞毒作用可能是由于dox-spions在较长时间内加速释放药物,药物随后通过被动扩散进入细胞。实验结果表明,dox-tf-anti-muc1-spions对乳腺癌具有较好的靶向性和治疗效果。
[0089]
裸spions没有对mda-mb-231或hdf细胞造成明显的细胞死亡(图5c)。mda-mb-231和hdf细胞暴露于最高浓度(320μg/ml)的裸spions与未经spions处理的对照细胞具有相同的代谢功能。裸spions处理mda-mb-231和hdf细胞的存活率分别为94%和94.68%。高细胞存活率表明羧基功能化spions在实验期间具有很低的毒性和较好的生物相容性。
[0090]
实施例11细胞摄取
[0091]
采用蔡司axio observer荧光显微镜,将mda-mb-231和hdf细胞与5种spions孵育一段时间,观察细胞对dox的摄取情况。首先,将100μl的dmem培养基加入黑色光学底96孔微孔板中。mda-mb-231和hdf细胞以每孔7000个细胞的密度接种在微孔板中,并在37℃的加湿co2培养箱中培养持续24小时。然后,用含dox-spions(80μg/ml),dox-tf-spions(80μg/ml),dox-anti-muc1-spions(80μg/ml),dox-tf-anti-muc1-spions(80μg/ml)的新鲜dmem培养基代替生长培养基,并在37℃时将微孔板重新引入5%co2下培养箱放置4h。随后用预热的pbs缓冲溶液洗涤细胞,并在室温下在4%多聚甲醛中固定15分钟。固定处理完成后,用hanks平衡盐溶液洗涤细胞,并用alexa fluor培养
tm
488麦胚凝集素结合物(5μg/ml),室温下在避光放置10分钟。细胞被0.1%的tritonx-100渗透20分钟,然后用pbs冲洗至少三次。用hoechst 33342染色液(2μg/ml)均匀等分于含有通透性细胞的微孔板的每个孔中,细胞核在室温下在避光条件下染色10分钟,染色细胞干燥后在蔡司axio observer荧光显微镜下10
×
放大倍率进行分析。利用zen和imagej软件对采集到的图像文件进行处理。
[0092]
通过荧光显微镜评估mda-mb-231和hdf细胞对dox负载的spions(dox spions、dox tf spions、dox-anti-muc1-spions和dox-tf-anti-muc1-spions)的细胞摄取,所得图像分别如图6(a)和(b)所示。经修饰的spions处理后的两种细胞都有不同程度的spions内化。5种dox负载spions处理的mda-mb-231和hdf细胞均出现红色荧光。然而,与同等dox浓度下的其他四个样品相比,用双靶向spions处理的mda-mb-231细胞具有最强的红色荧光强度,这可能是由于活性细胞增强了dox-tf-anti-muc1-spions的内化(图6a)。hoechst33342能将mda-mb-231和hdf活细胞的细胞核染成蓝色。与mda-mb-231细胞相比,四种dox负载spions处理的hdf细胞的蓝色荧光强度相似且更强(图6b)。同时,观察hoechst33342染色的mda-mb-231细胞,发现tf结合spions和抗muc1结合spions处理的mda-mb-231细胞的蓝色荧光强度相近,而双修饰spions处理的细胞蓝色荧光强度较弱(图6a),这一现象表明dox-tf-anti-muc1-spions对hdf细胞没有显著影响,但增加了mda-mb-231细胞的死亡率。总之,dox-spions被mda-mb-231和hdf细胞轻度内化,dox-tf-spions和dox-anti-muc1-spions处理显示两种细胞对dox-spions的吸收中等,而且dox-tf-anti-muc1-spions对mda-mb-231细胞的内化有显著的促进作用。上述现象表明,双靶向spions在mda-mb-231细胞中具有最高的细胞特异性摄取。所有这些结果都可以用abs配体介导的乳腺癌细胞内吞作用原理来解释,这种内吞作用过度表达muc1跨膜蛋白和tfrs。从这些数据可以证明,应用tf蛋白和抗muc1可以积极影响细胞摄取羧基功能化dox负载spions的效率。dox-tf-anti-muc1-spions能够高效地将dox递送并靶向乳腺癌细胞。
[0093]
最后说明的是,以上实施例仅用于说明本发明的技术方案而非限制,尽管参照较
佳实施例对本发明进行了详细说明,本领域的普通计时人员应当理解,可以对本发明的技术方案进行修改或者同等替换,而不脱离本发明技术方案的宗旨和范围,均应涵盖在本发明的权利要求范围当中。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1