五味子酚在制备防治霉酚酸所致腹泻药物中的应用
1.本发明涉及腹泻药物技术领域,具体涉及五味子酚在制备防治霉酚酸所致腹泻药物中的应用。
背景技术:
2.肾移植已经成为各种原发疾病引起肾功能衰竭的最有效的治疗方法,移植术后需要终身服用免疫抑制剂以预防排斥反应的发生。肾移植术后一线三联抗排斥方案为霉酚酸(mycophenolic acid,mpa)、他克莫司(tacrolimus)联合糖皮质激素。mpa通过抑制嘌呤从头合成途径中的限速酶次黄嘌呤核苷酸脱氢酶(inosine monophosphate dehydrogenase,impdh),减少嘌呤的生成,从而引起淋巴细胞选择性免疫抑制,减少移植排斥,延长受体生存期。由于mpa特殊的作用机制,其在肾移植抗排斥治疗方案中作用尚无其他药物可以替代。
3.足量且规律的使用mpa可有效地提高移植物的长期存活率。但由于用药后的不良反应如:胃肠道(gastrointestinal,gi)毒副作用、骨髓抑制、感染等,导致大量患者减少剂量、中断或停用mpa,从而导致急性排斥反应风险增加和移植物长期存活率降低。数据显示,mpa 21%
‑
54.2%的剂量调整与胃肠道不良反应有关,因此如何减少mpa相关的肠道不良反应的发生,是肾移植术后重点关注的问题之一。
4.mpa引起的胃肠道症状包括腹痛、腹泻和黏膜改变(如溃疡和黏膜下炎症)。mpa及其代谢产物霉酚酸酰基葡糖醛酸(mycophenolic acid acyl glucuronide,acmpag)。acmpag可形成蛋白加合物,n
‑
(2
‑
羟乙基)
‑
吗啉可对上皮细胞产生局部刺激作用。mpa的抗增殖特性也可能与其胃肠道不良反应有关。肠道上皮细胞也部分依赖嘌呤核苷酸从头合成途径进行生长和复制,mpa的抑制作用使快速分裂的胃肠道上皮细胞停留在细胞周期s期,从而促进炎症的发生,导致肠黏膜受损、肠道屏障破坏、液体吸收减少以及菌群失调等变化而诱发腹泻。
5.肠上皮细胞机械屏障是维持肠道正常生理功能的重要环节,主要由肠粘膜上皮细胞、细胞尖端的紧密连接复合物(apical junctional complex,ajc)构成。ajc能够减少肠上皮细胞之间的空隙,限制肠内细菌及内毒素的通过。ajc结构异常或丢失是导致腹泻的重要机制之一。ajc的主要成分为紧密连接蛋白(tight junctions,tjs),而mpa的暴露会导致tjs中zo
‑
1和occludin的表达降低,并改变其在肠道上皮中的位置,恢复tjs蛋白的表达可改善mpa引起的肠道毒副作用。
6.目前已知肠道局部的炎症反应及上皮细胞内的氧化应激是导致zo
‑
1、occludin表达下调的原因。炎性细胞浸润后分泌大量炎性因子如tnf
‑
α、il
‑
1β及ifn
‑
γ等。tnf
‑
α是炎性因子级联释放的始动因子,tnf
‑
α刺激克隆结肠腺癌细胞(caco
‑
2)单层细胞,可以引起细胞跨膜电阻改变,并导致纤维激动蛋白(f
‑
actin)重排,细胞收缩导致肠上皮细胞间隙增大,同时tnf
‑
α下调zo
‑
1及occludin的表达。这一过程可能与tnf
‑
α激活nf
‑
κb,进一步引起肌蛋白轻链激酶(myosin light
‑
chain kinase,mlck)磷酸化有关。同时tnf
‑
α可以激活
mir
‑
122a,后者可以引起occludin mrna的降解。il
‑
1β是由多种免疫细胞分泌的促炎症因子,il
‑
1β刺激caco
‑
2单层细胞能引起时间依赖的跨膜电阻变化,增加caco
‑
2的通透性。而在这之前il
‑
1β会首先上调mlck mrna的表达,并下调zo
‑
1及occludin的表达。nf
‑
κb的抑制剂能逆转il
‑
1β引起的肠通透性增高,提示il
‑
1β可能通过nf
‑
κb/mlck信号途径影响肠上皮细胞屏障功能。ifn
‑
γ是最早发现的能影响肠屏障功能的细胞因子,ifn
‑
γ刺激人源性单层上皮细胞t84,能引起其跨膜电阻的变化,对甘露醇和菊粉的通透性增高,并呈剂量和时间依赖性。通过使用ifn
‑
γ受体阻断剂对肠屏障功能具有显著的保护作用。抑制pi3k或nf
‑
kb的激活能够阻断ifn
‑
γ引起的occludin表达下调。这些结果都提示ifn
‑
γ可能是通过pi3k/nf
‑
kb信号通过介导肠屏障功能的损伤。
7.氧化应激是氧化与抗氧化系统失衡的结果,导致胞内活性氧(ros)水平急剧升高。机体内ros主要来源于还原型烟酰胺腺嘌呤二核苷酸磷酸氧化酶(nox)系统和线粒体呼吸链。肠道组织主要表达nox亚型1和4,二者均需要与p22结合形成异二聚体维持催化酶的活性。正常生理条件下,ros维持在一定水平,过量的自由基通常被抗氧化酶如超氧化物歧化酶(sod)、过氧化氢酶(cat)、谷胱甘肽过氧化物酶(gphp
x
)清除。然而,在抗氧化系统与氧化系统失衡的情况下,ros清除减少,过量的ros亦可通过细胞内钙信号激活nf
‑
κb,进而调节mlck的活性,下调zo
‑
1及occludin的表达,影响肠机械屏障功能。
8.组织病理学发现mpa会导致肠道绒毛萎缩,肠道上皮细胞脱落,肠细胞空泡化和肠固有层的淋巴细胞和炎性细胞浸润,引起肠道炎症反应。同时mpa可引起剂量依赖性线粒体功能障碍,导致线粒体膜电位的丧失和细胞凋亡,增加ros的产生,高浓度mmf通过增加hct116细胞中ros和丙二醛水平来诱导氧化损伤导致细胞凋亡。因此抑制mpa引起的肠道炎症及氧化应激,进一步恢复zo
‑
1、occludin等紧密连接蛋白的表达和分布,维持肠上皮机械屏障的完整性是改善mpa肠道毒性的可行手段。
9.南五味子的主要化学成分为木质素类,其中五味子酚(sal)为其主要活性成分之一,分子式是c
23
h
30
o6,其常被用作治疗药物。如公开号为cn104546705a的专利公开五味子酚均质混悬剂对帕金森病具有良好的治疗效果。
10.论文《五味子提取物对ces2,cyp450s的抑制作用及其对缓解伊立替康所致腹泻的影响》(舒恒.五味子提取物对ces2,cyp450s的抑制作用及其对缓解伊立替康所致腹泻的影响[d].大连医科大学,2017.)中记载五味子酚可抑制羧酸酯酶2(ces2)的活性,推测其能够减少伊立替康传化为其毒性代谢产物sn
‑
38,从而对伊立替康所致腹泻有保护作用,但是现有技术中并没有公开五味子酚能够应用于制备防治霉酚酸所致腹泻制剂。
技术实现要素:
[0011]
本发明所要解决的技术问题在于提供一种五味子酚的新用途,五味子酚在制备防治霉酚酸所致腹泻药物中的应用。
[0012]
本发明通过以下技术手段实现解决上述技术问题:
[0013]
五味子酚在制备防治霉酚酸所致腹泻药物中的应用。
[0014]
有益效果:五味子酚能够恢复肠道紧密连接蛋白的表达,从而改善mpa对肠道的损伤,从而缓解霉酚酸导致的腹泻。
[0015]
霉酚酸原型药物及其代谢产物acmpag均可导致肠道损伤,因此药物代谢与其肠道
不良反应的发生没有相关性。
[0016]
优选地,所述的药物为五味子酚和药学上可接受的辅剂配制而成的制剂。
[0017]
本发明的优点在于:五味子酚能够恢复肠道紧密连接蛋白的表达,从而改善mpa对肠道的损伤,从而缓解霉酚酸导致的腹泻。
附图说明
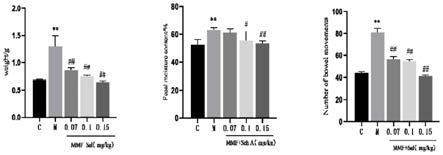
[0018]
图1为本发明实施例1中模型组小鼠和对照组小鼠排便次数、排便总量及粪便含水量测定结果图;图中左为排便总量,中为粪便含水量,右为排便次数;
[0019]
图2为本发明实施例1中模型组小鼠和对照组小鼠回肠和结肠he染色结果;
[0020]
图3为本发明实施例1中模型组小鼠和对照组小鼠血清tnf
‑
α、il
‑
1β、il
‑
6和ifn
‑
γ表达水平结果图;
[0021]
图4为本发明实施例1中模型组小鼠和对照组小鼠回肠匀浆tnf
‑
α、il
‑
1β、il
‑
6和ifn
‑
γ表达水平结果图;
[0022]
图5为本发明实施例1中模型组小鼠和对照组小鼠血清dao和et含量结果图;
[0023]
图6为本发明实施例1中模型组小鼠和对照组小鼠回肠组织紧密连接蛋白zo
‑
1和occludin蛋白表达结果图;
[0024]
图7为本发明实施例1中模型组小鼠和对照组小鼠免疫组化法显示小鼠回肠组织紧密连接蛋白occludin和zo
‑
1蛋白表达水平图;
[0025]
图8为本发明实施例1中模型组小鼠和对照组小鼠组回肠组织bax/bcl
‑
2、caspase 3/cleaved
‑
caspase 3表达测定结果图;
[0026]
图9为本发明实施例2中霉酚酸、五味子酚浓度对caco
‑
2细胞存活率的影响结果图;图中a为霉酚酸浓度对caco
‑
2细胞存活率的影响;b为五味子酚浓度对caco
‑
2细胞存活率的影响;c为霉酚酸+五味子酚对caco
‑
2细胞存活率的影响;
[0027]
图10为本发明实施例2中免疫荧光实验结果图;图中左为caco
‑
2细胞中zo
‑
1蛋白表达结果图,右为caco
‑
2细胞中occludin蛋白表达结果图,occludin和zo
‑
1显示绿色荧光,dapi染细胞核显示蓝色荧光;
[0028]
图11为本发明实施例2中流式细胞术检测细胞内ros水平曲线图;
[0029]
图12为图11的量化图。
具体实施方式
[0030]
为使本发明实施例的目的、技术方案和优点更加清楚,下面将结合本发明实施例,对本发明实施例中的技术方案进行清楚、完整地描述,显然,所描述的实施例是本发明一部分实施例,而不是全部的实施例。基于本发明中的实施例,本领域普通技术人员在没有做出创造性劳动前提下所获得的所有其他实施例,都属于本发明保护的范围。
[0031]
下述实施例中所用的试验材料和试剂等,如无特殊说明,均可从商业途径获得。
[0032]
实施例中未注明具体技术或条件者,均可以按照本领域内的文献所描述的技术或条件或者按照产品说明书进行。
[0033]
实施例1
[0034]
五味子酚(sal)对mpa诱导的肠道损伤动物模型试验
[0035]
将体重25
±
2g的小鼠适应性喂养一周,分为正常组(control)、模型组给予mpa前药霉酚酸酯(mmf 500mg/kg)、低剂量组(mmf 500mg/kg+sal 0.07mg/kg)、中剂量组(mmf 500mg/kg+sal 0.1mg/kg)、高剂量组(mmf 500mg/kg+sal 0.15mg/kg),每组6只。小鼠灌胃给予上述药物21天,第21天测定小鼠24h排便次数、排便总重量及粪便含水量。
[0036]
禁食8h后处死小鼠,收集静脉血,elisa测定血清中炎症因子tnf
‑
α、il
‑
1β、il
‑
6和ifn
‑
γ及通透性指标dao和et的含量。取小鼠的回肠及结肠段2cm进行he染色,并取部分回肠用生理盐水进行匀浆,elisa测定匀浆中tnf
‑
α、il
‑
1β、il
‑
6、ifn
‑
γ和pge2的含量。western blot和免疫组化法检测小鼠回肠组织中紧密连接蛋白zo
‑
1、occludin的表达。
[0037]
上述实验结果如图所示。如图1所示,与对照组相比,模型组小鼠24h排便次数,排便总重及粪便含水量显著增加。与模型组相比,给药组明显减低小鼠排便次数,排便总重及粪便含水量。
[0038]
如图2所示,he染色结果显示,对照组组织学表现正常,模型组小鼠回肠(ileum)和结肠(colon)结构破坏明显,回肠和结肠黏膜有炎性细胞浸润。与模型组相比,五味子酚给药组明显减轻了回肠和结肠的病理学特征,减少了炎性细胞的数量。
[0039]
如图3和图4所示,elisa结果显示,模型组小鼠血清和回肠组织匀浆tnf
‑
α、il
‑
1β、il
‑
6和ifn
‑
γ水平均显著上升。与模型组相比,五味子酚各剂量组明显降低tnf
‑
α、il
‑
1β、il
‑
6和ifn
‑
γ表达水平。与对照组相比,模型组小鼠回肠组织匀浆pge2水平显著上升,五味子酚各剂量组明显降低pge2表达水平。
[0040]
与对照组相比,模型组小鼠血清dao和et含量显著上升。如图5所示与模型组相比,五味子酚各剂量组明显降低dao和et表达水平。说明mmf会导致小鼠肠道及血清中炎症因子表达上升,肠道通透性增加,肠粘膜屏障破坏,而五味子酚可以改善mmf导致的小鼠肠黏膜屏障破坏。
[0041]
如图6和图7所示,模型组小鼠回肠组织zo
‑
1和occludin蛋白表达下降,而给药组可以升高其蛋白水平。免疫组化法显示小鼠回肠组织紧密连接蛋白occludin和zo
‑
1蛋白表达水平,与对照组相比,模型组回肠紧密连接蛋白表达下降,与模型组相比,五味子酚给药组蛋白表达上升。
[0042]
如图8所示,模型组bax/bcl
‑
2、caspase 3/cleaved
‑
caspase3表达升高,给药组bax/bcl
‑
2、caspase 3/cleaved
‑
caspase3下降,均表明五味子酚可改善肠上皮细胞的凋亡。
[0043]
实施例2
[0044]
细胞实验
[0045]
mtt法:将caco
‑
2人结肠癌细胞接种于96孔板中,接种密度约为4000个细胞/孔。培养48h,分组加入不同浓度的霉酚酸、五味子酚以及溶剂对照dmso,分别为对照组(control)、不同浓度药物组(霉酚酸的浓度依次为2.5μm、5μm、10μm、20μm、40μm、80μm、100μm;五味子酚的浓度依次为2.5μm、5μm、10μm、25μm、50μm、75μm),dmso溶剂对照组。继续培养24h或48h。培养结束后每孔加入5g
·
l
‑1的mtt溶液20μl,继续培育4h。吸去培养基,每孔加入150μl的dmso,振荡,混匀。用酶标仪在490nm处测定各孔od值,记录结果。以细胞存活率(cell viability)对剂量作图。
[0046]
结果计算:细胞存活率=(试验组细胞od值
‑
空白组细胞od值)/(对照组细胞od值
‑
空白组细胞od值)
×
100%。
[0047]
westen blot:将对数生长期的caco
‑
2细胞接种于6孔板中,分别分为正常组(control)、模型组(mpa 10μm)和不同剂量药物组(mpa 10μm+sal 10μm、mpa 10μm+sal 20μm、mpa 10μm+sal 40μm),每组重复3次实验。接种后细胞在板内融合生长一周,分别加入刺激及药物。继续培养24小时。pbs洗三遍,收集细胞,提取总蛋白,通过western blot法检测zo
‑
1和occludin的蛋白表达。
[0048]
免疫荧光染色:将caco
‑
2细胞接种于24孔板,分别分为正常组(control)、模型组(mpa 10μm)和给药组(mpa 10μm+sal 20μm),加药培养24小时后,用多聚甲醛固定15分钟,0.5%triton x
‑
100打孔10分钟,再用10%的bsa封闭10分钟,pbs洗两遍后孵育一抗zo
‑
1(1:250),4℃过夜,pbs洗两遍后敷荧光二抗,然后将所有细胞用4',6
‑
二脒基
‑2‑
苯基吲哚(dapi)核染色10min。使用荧光倒置显微镜进行显微照相。
[0049]
细胞内活性氧(ros)检测:将对数生长期的caco
‑
2细胞接种于6孔孔板中,分别分为正常组(control)、模型组(mpa 10μm)和不同剂量药物组(mpa 10μm+sal 10μm、mpa 10μm+sal 20μm、mpa 10μm+sal40μm),每组重复3次实验。pbs洗三遍,用胰蛋白酶消化收集细胞以制备活细胞悬液106细胞/ml供流式细胞仪检测。在37℃下用1ml h2dcfda工作溶液处理(h2dcfda储备溶液用pbs稀释以制备5μm)。然后用pbs洗两遍,分别使用流式细胞仪检测。
[0050]
实验结果:mtt结果如图9所示,霉酚酸对caco
‑
2细胞的增殖具有明显抑制作用,sal浓度在50μm范围内对caco
‑
2细胞没有毒性,可作为安全剂量使用。sal改善霉酚酸对caco
‑
2细胞增殖的抑制作用。
[0051]
免疫荧光实验结果如图10所示,可知mpa使caco
‑
2细胞紧密连接蛋白zo
‑
1和occludin的表达水平降低,而sal使zo
‑
1和occludin的表达水平升高。以上结果表明五味子酚可有效逆转霉酚酸对caco
‑
2细胞紧密连接结构的破坏。
[0052]
流式细胞术检测细胞内ros水平结果如图11和图12所示,mpa组荧光增强,sal组荧光减弱,表明mpa组活性氧水平升高,sal组活性氧水平显著降低。以上结果表明,霉酚酸导致氧化与抗氧化系统失衡,造成过量的ros在细胞内积累引起氧化应激,进而减少紧密连接破坏肠上皮细胞,而五味子酚可减少活性氧的产生,通过发挥抗氧化作用保护紧密连接结构,保护被霉酚酸损伤的肠上皮细胞。
[0053]
以上实施例仅用以说明本发明的技术方案,而非对其限制;尽管参照前述实施例对本发明进行了详细的说明,本领域的普通技术人员应当理解:其依然可以对前述各实施例所记载的技术方案进行修改,或者对其中部分技术特征进行等同替换;而这些修改或者替换,并不使相应技术方案的本质脱离本发明各实施例技术方案的精神和范围。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1