蟾蜍甾烯类化合物在制备治疗EGFR和/或STAT3驱动疾病的药物或保健品中的应用
蟾蜍甾烯类化合物在制备治疗egfr和/或stat3驱动疾病的药物或保健品中的应用
技术领域
1.本发明属于蟾蜍甾烯类化合物的新用途技术领域,具体涉及蟾蜍甾烯类化合物在制备治疗egfr和/或stat3驱动疾病的药物或保健品中的应用。
背景技术:
2.全国每年新发恶性肿瘤392.9万例,发病率高达285.83/10万,死亡病例数约为233.8万例。发病率前五位的恶性肿瘤分别是肺癌(57.26万)、乳腺癌(45.29万)、胃癌(29.31万)、结直肠癌(28.2万)、肝癌(26.92万)。死亡率前五位分别是肺癌(45.87万)、肝癌(23.72万)、胃癌(21.16万)、食管癌(13.68万)、结直肠癌(13.61万)。脑瘤位居中国恶性肿瘤发病率和死亡率前十位,神经胶质瘤在脑癌中占比超过三分之二,手术加放化疗后其总体生存期在13到15个月。早诊断和手术切除配合放化疗是恶性肿瘤患者的主要治疗手段。
3.egfr基因在肺癌、乳腺癌、结直肠癌、脑癌等多种恶性肿瘤中扩增和/或突变,与肿瘤的发生发展密切相关。超过60%的非小细胞肺癌患者表达egfr,而非小细胞肺癌患者在肺癌中超过85%,在神经胶质瘤中egfr扩增和突变率接近50%。stat3在70%的肿瘤中过表达或组成型激活,进而上调许多对生存和增殖相关基因的表达,在肺癌、结直肠癌、肝癌和神经胶质瘤中均有表达增加、活性增强,与肿瘤发生发展的密切关系倍受重视。egfr扩增和/或stat3过度激活促进多种恶性肿瘤的发生发展,靶向抑制egfr或/stat3信号通路是治疗多种恶性肿瘤的有效途径。
4.stat3激活在肝脏纤维化和肺纤维化等慢性炎症疾病中也发挥重要作用,抑制stat3信号通路有望治疗该类疾病。
5.pten通过介导pip3的去磷酸化从而抑制pi3k信号通路,是抑癌基因,pten失活、缺失或表达减少在各种肿瘤中高频率发生,在神经胶质瘤中egfr扩增伴随pten缺失是恶性度最高的肿瘤类型,是导致egfr靶向治疗耐药性的重要病理机制。
6.针对egfr的靶向治疗主要有小分子酪氨酸激酶抑制剂和单克隆抗体。egfr单抗联合化疗是安全的,但生存获益不明显。egfr小分子抑制剂已发展到第四代,在疗效方面,不同的第一代药物之间疗效无显著性差异;第二代比第一代药物疗效更佳;第三代药物相对于第一、二代药物显示出更强大的抗肿瘤活性,且对t790m突变治疗效果更好;首个第四代egfr抑制剂eai045与atp位点的结合不依赖于cys 797,从而克服了t790m/c797s突变患者的耐药问题,布加替尼(brigatinib)是一种选择性的双靶点(alk/egfr)抑制剂,对t790m获得性耐药突变患者的客观缓解率为25%。
7.目前还未有针对stat3靶向治疗的小分子化合物进入临床运用,其中opb-31121和opb-51602进入临床试验,由于药代动力学性质和耐受性差,这两种抑制剂的临床试验暂时终止。
8.蟾酥为蟾蜍科动物中华大蟾蜍(bufo bufo gargarizans cantor)或黑眶蟾蜍(bufo melanostictus schneider)的干燥分泌物,作为一种传统中药,具有镇痛、消炎、麻
醉、抗肿瘤等作用。主要活性成分包括以下四类:一、蟾毒配基类(bufogenins),包括华蟾酥毒基(cinobufagin)、脂蟾毒配基(resibufogenin)、蟾毒灵(bufalin)、沙蟾毒精(arenobufagin)和20s,21-环氧脂蟾毒配基(20s,21-epoxyresibufogenin)等;二、蟾蜍毒素类(bufotoxins),有蟾毒灵-3-半辛二酸酯(bufalin-3-hemisuberate)、华蟾毒精-3-丁二酰精氨酸酯(cinobufagin-3-succinolylarginine ester)、日蟾毒它灵-3-己二酰精氨酸酯(gamabufotalin-3-adipoylarginine ester)、沙蟾毒精-3-硫酸酯(arenobufagin-3-sulfate)等;三、蟾毒色胺类(bufotenines),包括蟾蜍色胺(bufotenine)、5-羟色胺(serotonin),去氢蟾蜍色胺(dehydrobufotenine),蟾蜍噻咛(bufothionine)等;四、甾醇类,有胆甾醇(cholesterol),麦角甾醇(ergosterol)等。
9.华蟾素注射液为中华大蟾蜍皮的水溶性制剂,具有清热解毒、化瘀散结、利水消肿等功效,临床广泛应用于多种恶性肿瘤。华蟾素注射液单独使用时,对中晚期肝癌,胃癌,食管癌具有一定疗效。其主要活性物质为四类:一、吲哚生物碱类成分,包括蟾蜍色胺,脱羟基蟾蜍色胺,蟾蜍噻咛,脱氢蟾蜍噻咛等;二、乙型强心苷类成分,也即蟾蜍甾烯类化合物,包括蟾毒灵,蟾毒他灵,华蟾素毒基,远华蟾毒精等,该类成分生物活性主要体现在抗肿瘤方面;三、多肽类成分,是一类分子量分布范围为700da到5000da的混合多肽;四、核酸类成分,包括腺嘌呤,鸟嘌呤,胸腺嘧啶,尿嘧啶等。
10.蟾酥和华蟾素注射液中蟾蜍甾烯类化合物包含蟾毒配基类(bufogenins)和蟾蜍毒素类(bufotoxins),是其主要的抗癌活性成分。
11.蟾蜍甾烯类化合物如蟾毒灵、蟾毒他灵、华蟾酥毒基、远华蟾毒精等,在体外细胞实验中对肝癌、结直肠癌、非小细胞肺癌、乳腺癌、胰腺癌、黑色素瘤、骨肉瘤等细胞系展现一定的抗肿瘤活性,主要通过诱导细胞凋亡、阻止细胞周期、抑制细胞增殖发挥抗癌功效。反应停(thalidomide)联合华蟾酥毒基用药可以缓解肺癌病人恶病质。有关蟾蜍甾烯类化合物的抗肿瘤分子机制,不同研究团队在不同肿瘤不同细胞系中揭示的分子机制各不相同,可能与诱导线粒体凋亡、抑制抗凋亡蛋白bcl-2等表达、影响notch、gsk-3β、nf-kb等信号通路有关。尽管蟾蜍甾烯类化合物对多种肿瘤均有一定的抗肿瘤活性,然而蟾蜍甾烯类化合物具体对哪种类型的肿瘤有效不清楚,限制了该类化合物的抗肿瘤药用价值。
技术实现要素:
12.本发明提供了蟾蜍甾烯类化合物在制备治疗egfr和/或stat3驱动疾病的药物或保健品中的应用,可以解决现有技术中的上述缺陷。
13.本发明提供了蟾蜍甾烯类化合物在制备治疗egfr和/或stat3驱动疾病的药物或保健品中的应用。
14.优选地,egfr和/或stat3驱动疾病为由egfr和/或stat3信号通路介导的肿瘤或慢性炎症性疾病的药物或保健品。
15.优选地,所述egfr和/或stat3信号通路介导的肿瘤为神经胶质瘤、肺癌、结直肠癌、肝癌、肺纤维化、肝脏纤维化中的任意一种或两种以上。
16.优选地,以蟾蜍甾烯类化合物作为活性成分制备治疗由egfr/stat3信号通路激活并伴随pten缺失的神经胶质瘤、肺癌、结直肠癌、肝癌、肺纤维化、肝脏小纤维化中的任意一种或两种以上疾病的药物或保健品。
17.优选地,所述蟾蜍甾烯类化合物为蟾毒配基类化合物(bufogenins)和/或蟾蜍毒素类化合物(bufotoxins)。
18.优选地,将蟾蜍甾烯类化合物或其药学上可接受的盐制备成注射液、片剂、粉针剂、颗粒剂、胶囊、口服液剂、膏剂、或霜剂的药物或保健品。
19.其中,优选口服剂型,如:胶囊剂、片剂、口服液、颗粒剂、丸剂、散剂、丹剂、膏剂等。所述的口服剂型可含有常用的赋形剂,诸如粘合剂、填充剂、稀释剂、压片剂、润滑剂、崩解剂、着色剂、调味剂和湿润剂,必要时可对片剂进行包衣。适宜的填充剂包括纤维素、甘露糖醇、乳糖和其它类似的填充剂;适宜的崩解剂包括淀粉、聚乙烯吡咯烷酮和淀粉衍生物,例如羟基乙酸淀粉钠;适宜的润滑剂包括,例如硬脂酸镁;适宜的药物可接受的湿润剂包括十二烷基硫酸钠。
20.与现有技术相比,本发明的有益效果如下:
21.1、蟾蜍甾烯类化合物在体外和体内显著抑制egfr和stat3磷酸化,降低其活性,从而抑制egfr和stat3调控的下游信号分子,促进肿瘤细胞凋亡和细胞毒性、阻止细胞周期、抑制细胞增殖,对egfr阳性肿瘤具有显著的抑制作用,对于将蟾蜍甾烯类化合物用于开发egfr和/或stat3驱动疾病的治疗或协同治疗的药物或保健品具有重要研究意义和应用意义;
22.2、经实验证明,蟾蜍甾烯类化合物在体内和体外可以有效抑制egfr和/或stat3阳性肿瘤,蟾蜍甾烯类化合物修饰部位不同影响该类化合物的选择性、特异性和有效性,可促使蟾蜍甾烯类化合物充分发挥其药用价值,如华蟾酥毒基(cinobufagin)、华蟾毒它灵(cinobufotalin)对egfr阳性肿瘤的选择性抑制效果好于酯蟾毒配基(resibufogenin),;
23.3、蟾蜍甾烯类化合物来源广泛、成本低,对于蟾蜍甾烯类化合物的研究和应用具有重要意义。
24.当然,实施本发明的任一产品并不一定需要同时达到以上所述的所有优点。
25.说明书附图
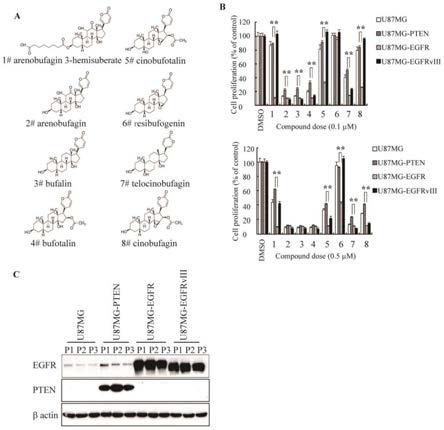
26.图1为蟾蜍甾烯类化合物抑制egfr过表达神经胶质瘤细胞的增殖;a.蟾蜍甾烯类化合物的结构,b.蟾蜍甾烯类化合物对egfr扩增pten缺失神经胶质瘤细胞的增殖抑制,c.weestern blot验证神经胶质瘤细胞egfr和pten的表达情况;
27.图2为蟾蜍甾烯类化合物华蟾酥毒基抑制egfr/stat3及其下游的信号通路;a.华蟾酥毒基剂量依赖地抑制egfr/stat3及其下游的信号通路,b.华蟾酥毒基时间依赖地抑制egfr/stat3及其下游的信号通路;
28.图3为蟾蜍甾烯类化合物华蟾酥毒基诱导egfr过表达细胞凋亡和毒性;a.华蟾酥毒基诱导egfr过表达细胞凋亡,b.华蟾酥毒基诱导egfr过表达细胞毒性;
29.图4为蟾蜍甾烯类化合物华蟾酥毒基阻止细胞周期于g2/s期(a)、特异抑制egfr过表达pten缺失细胞的增殖(b);
30.图5为华蟾酥毒基抑制egfr阳性及突变肺癌细胞增殖;a.华蟾酥毒基抑制egfr阳性及突变肺癌细胞增殖;b.华蟾酥毒基抑制肺癌细胞egfr/stat3信号通路;
31.图6为华蟾酥毒基抑制egfr阳性直肠癌细胞增殖;a.华蟾酥毒基抑制阳性直肠癌细胞增殖;b.华蟾酥毒基抑制阳性直肠癌细胞egfr/stat3信号通路;
32.图7为华蟾酥毒基抑制egfr阳性肝癌细胞增殖;a.华蟾酥毒基抑制阳性肝癌细胞
增殖;b.华蟾酥毒基抑制阳性肝癌细胞egfr/stat3信号通路;
33.图8为pten缺失增强蟾蜍甾烯类化合物华蟾酥毒基的细胞增殖抑制活性;a.华蟾酥毒基在pten野生型和缺失神经胶质瘤细胞中有效抑制egfr/stat3信号通路,b.华蟾酥毒基对pten野生型和缺失神经胶质瘤细胞增殖的抑制作用,c.pten敲减增强华蟾酥毒基抑制细胞增殖的作用,d.western确认pten的敲减效果;
34.图9为蟾蜍甾烯类化合物华蟾酥毒基抑制裸鼠皮下移植瘤生长;a.华蟾酥毒基抑制egfr过表达pten缺失肿瘤生长,b.华蟾酥毒基抑制体内肿瘤egfr/stat3信号通路,c.华蟾酥毒基抑制体内肿瘤细胞增殖,d.华蟾酥毒基诱导体内肿瘤细胞凋亡;
35.图10为蟾蜍甾烯类化合物华蟾酥毒基抑制脑内原位瘤生长并延长小鼠生存期;a.华蟾酥毒基延长小鼠生存期,b.和c.华蟾酥毒基抑制体内脑癌原位瘤生长,d.华蟾酥毒基抑制体内肿瘤egfr/stat3信号通路,e.华蟾酥毒基抑制体内肿瘤细胞增殖,f.华蟾酥毒基诱导体内肿瘤细胞凋亡。
具体实施方式
36.在本文中,由「一数值至另一数值」表示的范围,是一种避免在说明书中一一列举该范围中的所有数值的概要性表示方式。因此,某一特定数值范围的记载,涵盖该数值范围内的任意数值以及由该数值范围内的任意数值界定出的较小数值范围,如同在说明书中明文写出该任意数值和该较小数值范围一样。
37.下面结合具体实施例,进一步阐述本发明。应该理解,这些实施例仅用于说明本发明,而不用于限定本发明的保护范围。在实际应用中本领域技术人员根据本发明做出的改进和调整,仍属于本发明的保护范围。
38.一、以下实施例所使用的实验材料如下:
39.1.1药材
40.1)沙蟾毒精-3-辛二酸半酯(arenobufagin 3-hemisuberate,cas:30219-16-0,分子式:c
32h44
o9,分子量572.69)、2)沙蟾毒精(arenobufagin,cas:464-74-4,分子式:c
24h32
o6,分子量416.5)、3)蟾毒灵(bufalin,cas:465-21-4,分子式:c
24h34
o4,分子量386.52)、4)蟾蜍它灵(bufotalin,cas:471-95-4,分子式:c
26h36
o6,分子量444.56)、5)华蟾毒它灵(cinobufotalin,cas:1108-68-5,分子式:c
26h34
o7,分子量458.54)、6)酯蟾毒配基(resibufogenin,cas:465-39-4,分子式:c
24h32
o4,分子量384.51)、7)远华蟾蜍精(telocinobufagin,cas:472-26-4,分子式:c
24h34
o5,分子量402.52)、8)华蟾酥毒基(cinobufagin,cas:470-37-1,分子式:c
26h34
o6,分子量442)。其中沙蟾毒精、蟾蜍它灵、蟾蜍它灵、华蟾酥毒基由上海诗丹德标准品有限公司提供;沙蟾毒精-3-辛二酸半酯、华蟾毒它灵购买自成都普思生物有限公司;酯蟾毒配基和远华蟾蜍精购买自上海远慕生物科技有限公司。化合物纯度均》98%。
41.1.2细胞
42.hepg2、huh7、sk-hep-1、u87mg从美国atcc购买,其它细胞系从中国科学院上海生命科学研究院细胞资源中心购买。
43.细胞培养于含有10%胎牛血清(fbs)、100u/ml青霉素和100μg/ml链霉素的dmem或prmi1640培养基中,置于37℃、5%co2的培养箱,当细胞量达到培养皿的70%~80%时,用
胰酶消化接种到适合的培养皿或培养板。
44.1.3实验动物
45.体重18
±
2g的裸鼠(6-8周),由上海斯莱克实验动物有限责任公司提供,置于spf级别饲养环境,自由进食和饮水。
46.二、以下实施例所采用的实验方法如下:
47.2.1细胞增殖实验
48.将2000-3000个细胞种植于96孔版,16h后更换培养基,加入不同浓度的药物或对照,继续培养3d,每孔加入10μl cck-8,37℃孵育1h,450nm读取吸光值,用于分析细胞增殖情况,三次重复。
49.2.2乳酸脱氢酶(ldh)释放量测定
50.将3000个细胞种于96孔板,16h后更换培养基,加入不同浓度的药物或对照,继续培养6h或72h,每孔吸取培养基50μl加入50μl ldh底物,37℃孵育1h,450nm读取吸光值,用于分析细胞毒性,三次重复。
51.2.3caspase3/7活性测定
52.将3000个细胞接种于96孔板,16h后更换培养基,加入不同浓度的药物或对照,继续培养6h或24h,每孔加入10μl caspase3/7底物,37℃孵育0.5h,450nm读取吸光值,用于分析细胞凋亡情况,三次重复。
53.2.4细胞周期分析
54.将细胞传代培养于6cm培养皿,16h后更换培养基,加入不同浓度药物或对照,继续培养24h,收细胞,乙醇固定于-20℃,经rna酶消化和pi染色,经流式细胞仪分析dna合成倍增情况,分析细胞周期,三次重复。
55.2.5western blot检测信号通路
56.将细胞样品或肿瘤组织样品裂解提取总蛋白,加入sds上样缓冲液,95℃煮5min,蛋白经sds-page电泳,转膜至硝酸纤维素膜,室温5%脱脂牛奶封闭1h,4℃孵育一抗过夜,tbst缓冲液洗3次,室温孵育hrp标记二抗1h,tbst洗3次,加入化学发光底物,曝光检测。
57.2.6皮下移植瘤模型构建及给药
58.将2
×
106的u87mg-egfr细胞重悬于dmem生长培养基,注射到裸鼠背部后肢处,当肿瘤体积达到100mm3时,将小鼠随机分为3组每天腹腔注射一次对照、1mg/kg、5mg/kg的华蟾酥毒基,并用游标卡尺测量肿瘤最大直径和垂直直径,同时检测小鼠体重。
59.2.7脑内移植瘤模型构建及给药
60.在立体定位仪固定小鼠并定位到bregma前卤0.7mm、旁开2mm、深3mm,将1
×
105的u87mg-egfr-luciferase细胞经蠕动泵5min缓慢注射到纹状体。10天后腹腔注射d-luciferin钾盐,小鼠异氟烷麻醉活体成像确定肿瘤形成,将小鼠随机分为两组,每天分别腹腔注射对照和5mg/kg华蟾酥毒基,2w后再次活体成像。
61.2.8免疫荧光标记
62.小鼠肿瘤组织经常规多聚甲醛固定、石蜡包埋和组织切片,再经脱蜡水化和柠檬酸抗原修复,3%bsa封闭,分别孵育ki67、active-caspase3抗体和小鼠igg对照过夜,经tbst洗3次,孵育荧光二抗,dapi染色,显微镜观察拍照,每个小鼠一张片子,每张片子随机选取3个视野计数,用于计算ki67和active-caspase3阳性细胞数。
63.2.9统计分析
64.所有实验数据均重复3次,采用spss统计软件对实验数据采用t-test和双向方差分析(two-way anova)及bonferroni检验,所有的数据呈现均为平均值
±
sd,p《0.05为统计学上差异有显著性,*p《0.05,**p《0.01。
65.实施例1
66.蟾蜍甾烯类化合物抑制egfr过表达pten缺失神经胶质瘤细胞增殖。
67.图1体现了8个蟾蜍甾烯类化合物对egfr过表达神经胶质瘤细胞(u87mg-egfr和u87mg-egfrviii)和对照细胞(u87mg和u87mg-pten)增殖的抑制作用,蟾蜍甾烯类化合物甾体母核上不同部位的修饰影响该类化合物的选择性和活性,综合分析,华蟾酥毒基(cinobufagin)和华蟾毒它灵(cinobufotalin)更有效地抑制u87mg-egfr和u87mg-egfrviii细胞增殖,而对其它细胞影响较小,选择性更好。对照dmso对细胞未见抑制作用。**p《0.01。
68.实施例2
69.蟾蜍甾烯类化合物通过抑制egfr/stat3信号通路诱导细胞凋亡、细胞毒性、阻止细胞周期、抑制细胞增殖。
70.图2体现了蟾蜍甾烯类化合物华蟾酥毒基特异抑制egfr/stat3信号通路的作用分子机制:华蟾酥毒基对egfr/stat3信号通路的抑制作用呈剂量依赖性和时间依赖性,未加药物的dmso对照对egfr/stat3信号通路没有影响;
71.图3体现了蟾蜍甾烯类化合物华蟾酥毒基和酯蟾毒配基特异诱导egfr过表达神经胶质瘤细胞凋亡和细胞毒性的作用:华蟾酥毒基诱导u87mg-egfr细胞凋亡(caspase3/7活性)和细胞毒性(ldh释放)显著强于对照细胞u87mg-pten和mef,华蟾酥毒基诱导u87mg-egfr细胞毒性作用强于酯蟾毒配基;
72.图4体现了蟾蜍甾烯类化合物华蟾酥毒基特异抑制egfr过表达神经胶质瘤细胞周期从而抑制细胞增殖的作用及机制:对照细胞u87mg-pten细胞周期g2/s期被华蟾酥毒基阻止最小,u87mg-egfr细胞受影响最大,华蟾酥毒基对egfr阳性细胞及对照细胞增殖抑制作用依次递减:u87mg-egfr》u87mg-egfrviii》u87mg》u87mg-pten。
73.实施例3
74.蟾蜍甾烯类化合物华蟾酥毒基通过抑制egfr/stat3信号通路抑制egfr阳性肿瘤细胞增殖
75.图5体现了蟾蜍甾烯类化合物华蟾酥毒基通过抑制egfr/stat3信号通路特异抑制egfr阳性及突变肺癌细胞增殖的作用及机制,华蟾酥毒基对egfr/stat3信号通路和细胞增殖的抑制呈剂量依赖性;
76.图6体现了蟾蜍甾烯类化合物华蟾酥毒基通过抑制egfr/stat3信号通路特异抑制egfr阳性结直肠癌细胞增殖的作用及机制:华蟾酥毒基对egfr阳性细胞hct116的抑制作用显著高于对照细胞sw620;
77.图7体现了蟾蜍甾烯类化合物华蟾酥毒基通过抑制egfr/stat3信号通路特异抑制egfr阳性肝癌细胞增殖的作用及机制。
78.实施例4
79.蟾蜍甾烯类化合物华蟾酥毒基对egfr扩增伴随pten缺失的恶性肿瘤细胞具有更
好的抑制活性
80.图8体现了蟾蜍甾烯类化合物华蟾酥毒基对egfr扩增叠加pten缺失的肿瘤细胞具有更好的抑制作用,华蟾酥毒基对pten缺失细胞u87mg-egfr的细胞增殖抑制作用显著高于pten野生型细胞ln229-egfr和sf763-egfr,在ln229-egfr和sf763-egfr敲减pten显著增加华蟾酥毒基的细胞增殖抑制效果,**p《0.01。
81.实施例5
82.蟾蜍甾烯类化合物华蟾酥毒基有效抑制小鼠皮下肿瘤的生长
83.图9体现了蟾蜍甾烯类化合物华蟾酥毒基对裸鼠u87mg-egfr皮下移植瘤的生长抑制作用,通过抑制egfr/stat3信号通路,抑制细胞增殖并诱导细胞凋亡,从而发挥抑制肿瘤生长的作用。与vehicle相比,华蟾酥毒基剂量依赖地抑制裸鼠皮下肿瘤的生长(**p《0.01),经华蟾酥毒基治疗后,移植瘤细胞增殖和细胞凋亡分别显著低于和高于对照组(*p《0.05)。
84.实施例6
85.蟾蜍甾烯类化合物华蟾酥毒基有效抑制小鼠脑内原位肿瘤的生长并延长小鼠生存期
86.图10体现了蟾蜍甾烯类化合物华蟾酥毒基对裸鼠u87mg-egfr脑内原位移植瘤的生长抑制和延长小鼠生存期的作用,该抑制作用通过抑制egfr/stat3信号通路,抑制细胞增殖并诱导细胞凋亡,从而发挥抑制肿瘤生长的作用。与vehicle对照组中位生存期(20.5d)相比,华蟾酥毒基治疗组中位生存期(23d)显著延长(*p《0.05)。与对照组相比,华蟾酥毒基治疗组小鼠移植瘤荧光强度显著减弱(*p《0.05)、肿瘤细胞增殖显著减少(**p《0.01)、肿瘤细胞凋亡显著增加(**p《0.01)。
87.以上公开的仅为本发明优选实施例。优选实施例并没有详尽叙述所有的细节,也不限制该发明仅为所述的具体实施方式。显然,根据本说明书的内容,可作很多的修改和变化。本说明书选取并具体描述这些实施例,是为了更好地解释本发明的原理和实际应用,从而使所属领域技术人员能很好地利用本发明。本发明仅受权利要求书及其全部范围和等效物的限制。
88.在本发明及上述实施例的教导下,本领域技术人员很容易预见到,本发明所列举或例举的各原料或其等同替换物、各加工方法或其等同替换物都能实现本发明,以及各原料和加工方法的参数上下限取值、区间值都能实现本发明,在此不一一列举实施例。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1