78c或其药物组合物在制备抗类风湿性关节炎产品中的应用
1.本发明属于生物医药技术领域,具体涉及化合物78c在制备抗类风湿性关节炎治疗药物中的应用。
背景技术:
2.公开该背景技术部分的信息仅仅旨在增加对本发明的总体背景的理解,而不必然被视为承认或以任何形式暗示该信息构成已经成为本领域一般技术人员所公知的现有技术。
3.类风湿性关节炎(rheumatoid arthritis,ra)是自我免疫性疾病,以侵蚀性关节炎为主要特征,是一种病因未明的慢性、以炎性滑膜炎为主的系统性疾病。目前药物治疗药物为非甾体类抗炎药(nsaids)和改善病情抗风湿药物(dmards),后者除了经典的金制剂、氯喹、青霉胺、免疫抑制剂等药物之外还包括生物制剂(bdmards)和小分子靶向药(tsdmards)。上述治疗药物的作用机制各不相同,为了实现患者的病情缓解(包括临床缓解和影像学缓解),患者需要遵照医嘱组合用药才能实现理想的达标治疗,降低致残率。其中,传统的改善病情抗风湿药物(dmards)如金制剂、氯喹、左旋咪唑等,其作用原理至今尚不完全明确;免疫制剂如环磷酰胺、硫唑嘌呤、氨甲喋呤等属于经典化疗药物,上述两种类型的药物都具有严重的副作用。
4.针对上述研究背景,发明人认为,类风湿性关节炎作为一种免疫系统相关的炎性疾病,对免疫系统功能的纠正是根本,而炎性症状的改善则关系到患者症状的改善。现有类风湿性关节炎治疗药物中,单一药物还难以同时实现免疫系统和炎性症状的改善,而组合用药会加重患者肾脏负担、经济负担等。因此,开发能够同时实现免疫系统功能改善和炎性症状缓解的新型治疗药物能够有效减少患者的服药剂量,提高患者顺应性,具有广阔的应用前景。
技术实现要素:
5.本发明技术目的在于提供类风湿性关节炎的潜在治疗药物,化合物78c(cas号:1700637-55-3)是噻唑烷酮类化合物(thiazoloquin(az)olinones),本发明研究使用78c治疗cia小鼠和处理人cd38+nk细胞,旨在确定78c作为治疗ra潜在药物的可能性,并探讨其作用机制。
6.为了类风湿性关节治疗药物展开研究,本发明首先建立了cia模型。78c治疗后,cia小鼠的足趾肿胀明显减轻,滑膜组织中的细胞增殖以及炎性细胞浸润显著减少,外周血中白细胞比例、中性粒细胞比例、淋巴细胞比例、血红蛋白比例和血小板浓度也降低。以上结果表明,78c对cia有明显的治疗作用。78c治疗后,cia小鼠外周血淋巴细胞中b细胞和nk细胞百分比显著降低,ifn-γ、il-6、il-12p70、il-17a、il-27及tnf-α、il-1α水平也降低,表明78c对cia小鼠免疫和炎症均有抑制作用,是一种可以实现“标本兼治”的治疗药物,具有良好的开发前景。基于78c的上述药物活性,本发明首先提供化合物78c及包含化合物78c
的药物组合物在制备抗类风湿关节炎产品中的应用。
7.本发明第一方面,提供一种药物组合物,所述药物组合物中,78c作为活性成分。
8.本发明所述化合物78c,cas号为1700637-55-3,具有如下式ⅰ所示结构:
[0009][0010]
应当说明的是,本发明所述化合物78c,除式ⅰ所示结构的化合物实体,还包括78c药学上可接受的盐、酯、溶剂化物、代谢产物或前药;其中,所述“药学上可接受的盐”通产表示为了改善化合物的物理性质(如熔点、溶解度等)而获得的碱金属盐形式(如钾盐、钠盐等),或与无机酸或有机酸形成的盐;具体的实例中,所述无机酸为盐酸、硫酸、硝酸或氢溴酸;所述有机酸为甲磺酸、甲苯磺酸或三氟乙酸。
[0011]
优选的,所述药物组合物中,还包括抗类风湿性关节炎成分,包括但不限于非甾体抗炎药、金制剂、氯喹、左旋咪唑、青霉胺、免疫抑制剂、中药提取物、生物制剂中的一种或几种的组合。
[0012]
进一步的,所述非甾体抗炎药的实例如塞来昔布、布洛芬、阿司匹林、吲哚美辛等。
[0013]
进一步的,所述免疫抑制剂的实例如环磷酰胺、硫唑嘌呤、氨甲喋呤等。
[0014]
进一步的,所述中药提取物包括雷公藤多甙等。
[0015]
进一步的,所述生物制剂包括巴瑞替尼(baricitinib)、托法替布(tofacitinib)等。
[0016]
优选的,所述药物组合物中,还包括药学上所必需的辅料。
[0017]
本发明第二方面,提供化合物78c或第一方面所述药物组合物在制备抗类风湿性关节炎产品中的应用。
[0018]
优选的,所述抗类风湿性关节炎产品包括但不限于药物、保健品或模型药物中的一种。
[0019]
进一步的,所述药物为包括但不限于血清制品、疫苗、诊断制品、化学药物、生化药物中的一种或几种。
[0020]
更进一步的实施方式中,所述药物优选为口服制剂、外用制剂或注射剂中的一种。所述口服制剂包括固体制剂和液体制剂,所述固体制剂包括膏剂、颗粒剂、丸剂(蜜丸、水丸、糊丸、蜡丸和浓缩丸)、散剂、片剂(肠溶片、包衣片、薄膜衣片、糖衣片、浸膏片、分散片、划痕片)、胶囊剂等,所述液体制剂包括溶液剂、混悬剂、糖浆剂、合剂、酊剂等。所述外用制剂为包括但不限于散剂、溶液、酊剂、洗剂、软膏、乳膏、糊剂、油剂、凝胶剂、涂膜剂、擦剂、滴剂、气雾剂、湿敷剂、栓剂、贴剂、喷剂等。所述注射剂为包括但不限于粉针剂、溶液、悬液或
乳浊液。
[0021]
treg细胞是免疫稳态的重要调节因子,通过抑制炎症反应、促进自身耐受来调节免疫反应。当treg细胞的数量和功能受损时,th17/treg平衡被打破,导致免疫失衡和免疫耐受受损。类风湿性关节炎是一种常见的免疫稳态受损的自身免疫性疾病。大量研究表明,th1/th2、th17/treg失衡以及treg细胞异常均参与ra及其他自身免疫性疾病的发生、发展。在活动性ra中,功能性促炎th17细胞和抗炎treg细胞的平衡被破坏。ra中treg细胞比例显著降低,并与ra的活动程度显著相关。许多研究指出,提高treg细胞比例或修复treg细胞功能是治疗自身免疫性疾病的有效策略。发明人以往研究证实了外源性人treg细胞注入大鼠模型后,cia明显减轻。
[0022]
在本发明构建的疾病模型中,cia小鼠的treg细胞比例和il-10浓度显著降低,th1/th2比值升高,表明免疫稳态受损。而78c处理的cia小鼠中treg细胞比例和il-10浓度均较cia小鼠明显升高,表明78c通过提高treg细胞比例恢复了免疫稳态。此外,当前研究发现cd38+nk细胞抑制cd4+t细胞向treg细胞分化,78c减轻了cd38+nk细胞对cd4+t细胞的抑制。因此,该研究认为cia小鼠中大量的cd38+nk细胞导致了treg细胞数量减少,78c治疗通过减少cd38+nk细胞数量和抑制其cd38活性恢复免疫平衡。基于78c对机体的这种免疫调节功能,本发明第二方面的技术方案中,还提供了78c在制备保健品中的应用,进一步的,所述保健品包括保健食品、保健药品、保健用品等。
[0023]
本发明第三方面,提供一种治疗类风湿性关节炎的治疗药物,所述治疗药物中,包括化合物78c、化合物78c药学上可接受的盐、酯、溶剂化物、代谢产物、前药或第一方面所述药物组合物。
[0024]
本发明第四方面,提供一种免疫功能调节产品,所述产品中,包括化合物78c、化合物78c药学上可接受的盐、酯、溶剂化物、代谢产物、前药或第一方面所述药物组合物。
[0025]
应当说明是,上述第三方面所述治疗药物及第四方面所述免疫功能调节产品中,78c的药物剂量是依据本领域常规技术手段可以确定的内容。
附图说明
[0026]
构成本发明的一部分的说明书附图用来提供对本发明的进一步理解,本发明的示意性实施例及其说明用于解释本发明,并不构成对本发明的不当限定。
[0027]
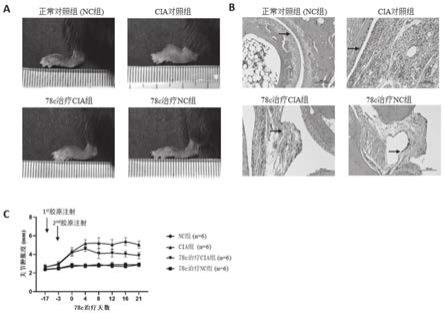
图1为实施例1中所述78c对小鼠cia的作用;
[0028]
其中图1a为78c处理21天后各组小鼠关节肿胀度的一般观察;
[0029]
图1b为各组小鼠踝关节he染色结果;
[0030]
图1c为根据足趾肿胀绘制的炎症曲线。
[0031]
图2为实施例1中所述78c对小鼠血常规指标的影响;
[0032]
*表示p《0.05,**表示p《0.01,***表示p《0.001。
[0033]
图3为实施例1中所述78c对小鼠外周血各淋巴细胞亚型比例的影响;
[0034]
每种细胞亚型的比例为该类细胞占总淋巴细胞的比例。*表示p《0.05,**表示p《0.01,***表示p《0.001。
[0035]
图4为实施例1中所述流式检测血清中各细胞因子的表达结果;
[0036]
其中,图4a为血清中各细胞因子的浓度;
[0037]
图4b为基于血清中各细胞因子的浓度计算的th1/th2比例;*表示p《0.05,**表示p《0.01,***表示p《0.001。
[0038]
图5为实施例1中所述cd38+nk细胞与cd4+t细胞共培养结果;
[0039]
其中图5a为不同实验组中treg细胞所占cd4+t细胞比例;
[0040]
图5b为不同实验组中th17/treg的细胞比例;
[0041]
图5c为不同实验组中th1/th2的细胞比例;*表示p《0.05,**表示p《0.01,***表示p《0.001。
具体实施方式
[0042]
应该指出,以下详细说明都是例示性的,旨在对本发明提供进一步的说明。除非另有指明,本文使用的所有技术和科学术语具有与本发明所属技术领域的普通技术人员通常理解的相同含义。
[0043]
需要注意的是,这里所使用的术语仅是为了描述具体实施方式,而非意图限制根据本发明的示例性实施方式。如在这里所使用的,除非上下文另外明确指出,否则单数形式也意图包括复数形式,此外,还应当理解的是,当在本说明书中使用术语“包含”和/或“包括”时,其指明存在特征、步骤、操作、器件、组件和/或它们的组合。
[0044]
正如背景技术所介绍的,目前类风湿性关节的治疗往往需要不同机制的治疗药物组合才能实现有效的症状缓解,开发能够同时改善免疫功能和炎性症状的单一药物能够显著减轻患者的用药负担。为了解决如上的技术问题,本发明提出了化合物78c在制备抗类风湿性关节炎产品中的应用。
[0045]
为了使得本领域技术人员能够更加清楚地了解本发明的技术方案,以下将结合具体的实施例详细说明本发明的技术方案。
[0046]
实施例1
[0047]
一、材料和方法
[0048]
1、材料
[0049]
1.1实验动物
[0050]
6周龄c57bl/6jnifdc雄性小鼠购自北京维通利华实验动物技术有限公司,实验动物饲养和操作按赫尔辛基动物保护公约和中华人民共和国实验动物管理条例进行。
[0051]
1.2临床标本
[0052]
本实施例研究收集的健康志愿者外周血样本(n=30)来自于青岛大学附属医院查体中心,样本采集和实验设计均经青岛大学附属医院伦理委员会批准,所有患者均填写书面知情同意。
[0053]
2、方法
[0054]
2.1 78c处理胶原诱导性关节炎小鼠模型
[0055]
将24只小鼠随机分为2组,正常对照组(normal control,nc,n=12)和cia(collagen-induced arthritic,胶原诱导性关节炎)模型组(n=12)。将鸡ii型胶原(sigma)溶于0.1m冰乙酸,配成浓度为2mg/ml的溶液。cia模型组小鼠每只以0.1ml/只的剂量在小鼠尾根部皮内注射鸡ii型胶原和完全弗氏佐剂(sigma)等量混合的乳化剂。两周后,同样的方法给小鼠注射鸡ii型胶原和不完全弗氏佐剂(美国sigma)等量混合的乳化剂,进
行加强免疫。用游标卡尺测量足趾厚度变化,根据足趾变化,绘制炎症曲线。
[0056]
以上建模小鼠在第二次免疫3天后随机分为cia模型对照组(n=6)和78c治疗cia组(n=6),正常对照组随机也分为正常对照组(n=6)和78c治疗正常组(n=6)。78c(medchemexpress,美国)添加到10%dmso和90%corn oil混合液中避光溶解。用78c对治疗组小鼠尾静脉注射(2mg/kg),每周2次,连续给药6次。此时,cia模型组和正常对照组小鼠注射同剂量corn oil。
[0057]
给药结束后,即第一次78c注射后第21天处死小鼠。取右脚踝关节,除去多余组织后于4%多聚甲醛中固定。按常规脱钙,制备石蜡包切片并进行苏木素伊红(hemetoxylin-eosin,he)染色,10x光镜下观察组织病理学变化。
[0058]
2.2小鼠血清细胞因子的检测
[0059]
给药结束后,即第一次78c注射后第21天,麻醉小鼠,采集小鼠外周血,血液室温凝固后,取上清。用小鼠细胞因子试剂盒(biolegend,美国)检测小鼠血液细胞因子变化水平。流式细胞仪(英国apogee a50,novocyte d2040r)检测小鼠血清中il-1α、il-1β、il-6、il-12p70、il-10、il-17a、il-23、il-27、ifn-γ、ifn-β、gm-csf、mcp-1、tnf-α的浓度变化。
[0060]
2.3小鼠外周血中淋巴细胞亚型的检测
[0061]
用edta采血管采集小鼠外周血,加入红细胞裂解液,4℃离心沉淀白细胞,加入磷酸盐缓冲液(phosphate buffered saline,pbs)重悬细胞。加入各类流式抗体,用流式细胞仪检测各细胞亚型。本实施例采用apc anti-mo-cd3e抗体(ebioscience)检测cd3+t细胞,用apc anti-mo-cd3e抗体、fitc anti-mo-cd4抗体(ebioscience)检测cd3+cd4+t细胞,用fitc anti-mo-cd4抗体、apc anti-mo-cd25抗体(ebioscience)检测cd4+cd25+treg细胞,用apc anti-mo-cd3e抗体、pe anti-mo-cd19抗体(ebioscience)检测cd3-cd19+b细胞,用apc anti-mo-cd3e抗体、fitc anti-mouse-cd38抗体(biolegend)、pe anti-mouse-nk1.1抗体(biolegend)检测cd38+cd3-nk细胞。
[0062]
2.4小鼠血常规指标的检测
[0063]
用edta采血管采集小鼠外周血。用全自动血液细胞分析仪(mindray,中国)检测小鼠血液中白细胞、中性粒细胞、淋巴细胞、单核细胞、嗜酸性粒细胞、嗜碱性粒细胞、血红蛋白、血小板等指标。
[0064]
2.5ficoll密度梯度离心法分离外周血单个核细胞
[0065]
收集外周血,用等体积的磷酸盐缓冲液稀释血液,在离心管中加入外周血体积1.5倍的ficoll(灏洋生物,中国),将稀释好的血液缓慢加在ficoll细胞分离液上。离心后,吸取“白环层”,加入3-5倍pbs,离心,沉淀即外周血单个核细胞(mononuclear cell,mnc)。
[0066]
2.6从单个核细胞中分离cd4+t细胞和cd38+nk细胞
[0067]
使用naive cd4+t细胞分离试剂盒(naive cd4+t cell isolation kitⅱ)(miltenyi biotec,德国)提取cd4+t细胞。将mnc重新悬浮于含有2mm edta(solarbio,中国)和0.5%牛血清白蛋白(bsa)(solarbio)的pbs中,并与试剂盒中naive cd4+t cell biotin-antibody cocktail ii混合。该试剂包括针对cd8、cd14、cd16、cd19、cd36、cd45ro、cd56、cd123、tcrγ/δ和glycophorin a的生物素缀合的单克隆抗体。4℃孵育5分钟。加入试剂盒中抗生物素单克隆抗体缀合的微珠(microbeads conjugated to a monoclonal anti-biotin antibody),4℃将混合物孵育10分钟。将macs分离柱(miltenyi biotec,德
国)置于合适的macs分离器(miltenyi biotec)的磁场中。将细胞悬浮液加到分离柱上,将代表cd4+t细胞的未标记细胞流经分离柱并收集。
[0068]
使用nk细胞分离试剂盒(nk cell isolation kit)(miltenyi biotec)提取集nk细胞。mnc用含有2mm edta和0.5%牛血清白蛋白的pbs重新悬浮。添加试剂盒中nk cell biotin-antibody cocktail,该试剂包括针对除nk细胞外的所有淋巴细胞、单核细胞和浆细胞未表达抗原的生物素结合单克隆抗体。将混合物在4℃孵育5分钟。添加试剂盒中抗生物素抗体结合的微珠,并将混合物4℃孵育10分钟。将细胞悬液置于分离柱上。将代表nk细胞的未标记细胞流经分离柱并收集。
[0069]
使用cd38微珠试剂盒(miltenyi biotec)富集cd38+nk细胞。上述nk细胞悬浮于2mm edta和0.5%bsa的pbs缓冲液中。加入生物素缀合的抗cd38抗体(biotin-conjugated anti cd38)(miltenyi biotec),在4℃孵育10分钟。离心洗涤细胞,再将细胞重新悬浮在缓冲液中。加入抗生物素抗体缀合的微珠,4℃孵育15分钟。将细胞悬液置于在macs柱(miltenyi biotec)上,然后将分离柱从分离器中取出置于合适的收集管上。向柱中加入适量的缓冲液,立即冲洗出的部分为富集的cd38+nk细胞。
[0070]
2.7 cd38+nk细胞和cd4+t细胞共培养
[0071]
cd38+nk细胞用最终浓度为7.3nm的78c培养24小时。通过以300
×
g离心5分钟去除78c,再用培养基稀释细胞,并将细胞置于孔径为0.4μm的transwell装置(corning,美国)的上室。将cd4+t细胞置于transwell装置的下室,将细胞共培养48小时。
[0072]
2.8流式细胞仪检测共培养中treg细胞
[0073]
将上述transwell下室中的细胞收集于离心管中,pbs重悬,加入fitc anti-human cd4(multi sciences)和apc anti-human cd25(multi sciences),避光孵育。离心,弃上清。加入固定/破膜工作液(fixation/permeabilization)(multi sciences),避光孵育30分钟。加入破膜缓冲液工作液(permeabilization buffer)(multi sciences),离心,弃上清,pbs重悬。加入pe anti-human foxp3(multi sciences),震荡混匀,避光孵育。加入破膜缓冲液工作液离心洗涤细胞,离心后去上清液。每管加入流式染色缓冲液flow cytometry staining buffer(multi sciences)重悬细胞,用流式细胞仪检测。
[0074]
2.9流式细胞仪检测培养液中th17、th1、th2细胞
[0075]
将上述transwell下室中的细胞收集于离心管中,pbs重悬。加入apc-cy7anti-human cd4,室温避光孵育15分钟。每管加入fix&perm medium a(multi sciences),室温避光孵育15分钟。每管加入预冷flow cytometry staining buffer(multi sciences),离心,弃上清。每管加入fix&perm medium b(multi sciences)、pe anti-human il-17a(multi sciences)、apc anti-human il-4(multi sciences)、fitc anti-human ifn-γ(multi sciences),室温避光孵育15分钟。每管加入flow cytometry staining buffer,离心,pbs重悬。用流式细胞仪检测。根据treg和th17细胞的比例计算th17/treg比率。根据th1和th2细胞的比例计算th1/th2比率。
[0076]
3.1统计学处理
[0077]
采用spss 19.0软件(biomedical computer programs)进行正态和方差齐性的检验。采用lsd法进行两组间比较,单因素方差分析进行多组间显著性,相关性分析采用pearson相关分析,p<0.05为差异有统计学。
[0078]
二、实验结果
[0079]
1. 78c对cia小鼠的作用
[0080]
与正常对照组相比,cia模型小鼠的足踝、足趾红肿,活动障碍,小鼠踝关节几乎无法弯曲,显示cia成功建模。与corn oil处理的cia小鼠相比,78c治疗后cia小鼠关节红肿减轻,关节活动得到一定程度的恢复,结果见图1a。he染色结果显示,cia小鼠关节腔内有坏死脱落的组织团块,伴有大量炎性细胞侵润,滑膜增生明显,有炎性细胞浸润。78c治疗的cia小鼠的滑膜也增生,但组织中炎性细胞浸润明显减少。结果见图1b。炎症曲线统计结果表明,在78c治疗后16天后,与正常对照组相比,cia小鼠足趾肿胀达到最高值(p《0.0001)。与cia模型小鼠相比,78c药物治疗cia组足趾肿胀的程度显著降低(p<0.0001)。结果见图1c。血常规检测结果显示,与正常对照组相比,cia模型小鼠白细胞比例、中性粒细胞比例、血红蛋白比例、血小板比例增高(p=0.003、0.0001、0.01、0.0149,respectively)。与cia小鼠相比,78c治疗后cia组白细胞、中性粒细胞、淋巴细胞、血红蛋白、血小板比例降低(p=0.0005、0.0001、0.0436、0.0047、0.0115,respectively)。结果见图2。以上结果显示78c对小鼠cia有显著治疗作用。
[0081]
2. 78c对cia小鼠免疫的作用
[0082]
与正常对照组相比,cia模型小鼠b、nk细胞占外周血淋巴细胞的比例明显升高(p=0.0204和0.0064),cd38+nk细胞占外周血淋巴细胞的比例变化也明显升高(p=0.0037),treg细胞占外周血淋巴细胞的比例却显著降低(p=0.002)。与cia小鼠相比,78c药物治疗后cia小鼠b、nk细胞比例明显降低(p=0.0046和0.0474),cd38+nk细胞比例也降低(p=0.0133),但treg细胞比例显著升高(p=0.0001)。结果见图3。
[0083]
与正常对照组相比,cia模型小鼠ifn-γ、il-6、il-12p70、il-17a、il-27、tnf-α的浓度明显升高(p=0.0228、0.0018、0.0095、0.0018、0.0250和0.0043),il-10的浓度降低(p=0.0375)。与cia小鼠相比,78c治疗后cia小鼠中ifn-γ、il-6、il-12p70、il-17a、il-27、tnf-α的浓度降低(p=0.0018、0.0027、0.0068、0.0056、0.0048和0.0028),il-10的浓度升高(p=0.0153)。结果见图4a。
[0084]
th1细胞主要分泌th1型细胞因子,如il-2、ifn-γ、tnf-α等。th2主要分泌th2型细胞因子,如白细胞介素il-4、il-5、il-10和il-13等,可以根据上述细胞因子浓度进行分析th1/th2比值。与正常对照组相比,cia模型小鼠ifn-γ/il-10、tnf-α/il-10比例升高(p=0.0075和0.0015),与cia小鼠相比,78c治疗后cia小鼠ifn-γ/il-10、tnf-α/il-10比例降低(p=0.0008和0.0010)。结果见图4b。
[0085]
3.cd38+nk细胞对cd4+t细胞的作用
[0086]
本实施例研究收集了30名健康志愿者的外周血,随机地将每10个样本提取的mnc后混合在一起,然后从中分选出cd38+nk细胞和cd4+t细胞。
[0087]
与未共培养的cd4+t细胞相比,与cd38+nk细胞共培养后的cd4+t细胞中treg细胞比例降低(p=0.0038和<0.0001),与78c预处理的cd38+nk细胞共培养后cd4+t细胞中treg细胞比例也降低(p=0.0125)。但是,与cd38+nk细胞共培养后的cd4+t细胞相比,与78c预处理的cd38+nk细胞共培养后cd4+t细胞中treg细胞比例增高(p=0.0401)。与未共培养的cd4+t细胞相比,与cd38+nk细胞共培养后的cd4+t细胞中th17/treg和th1/th2比例升高(p=0.0273和《0.001),与78c预处理cd38+nk细胞共培养后cd4+t细胞中th17/treg和th1/th2细
胞比例也升高(p=0.0099和0.02)。但是,与cd38+nk细胞共培养后的cd4+t细胞相比,与78c预处理的cd38+nk细胞共培养后cd4+t细胞中th17/treg和th1/th2细胞比例却降低(p=0.0408和0.0233)。结果见图5。
[0088]
以上所述仅为本发明的优选实施例而已,并不用于限制本发明,对于本领域的技术人员来说,本发明可以有各种更改和变化。凡在本发明的精神和原则之内,所作的任何修改、等同替换、改进等,均应包含在本发明的保护范围之内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1