一种用于大尺寸球囊的药物涂层及其制备方法与流程
1.本发明属于医疗器械技术领域,涉及介入医疗器械,具体涉及一种用于大尺寸球囊的药物涂层及其制备方法。
背景技术:
2.血管成形术是用一种方法使狭窄了的血管恢复它原来的形状,即使血管恢复成原来未狭窄时的形状,从而使血流重新畅通,供血恢复或接近正常。血管成形术常用的方法包括裸球囊扩张、植入裸支架或者药物支架等方式。但这些治疗方式均存在着不同缺陷。
3.药物涂层球囊扩张导管是指在裸球囊表面涂覆一层抗血管增生的药物,然后当球囊到达病变血管壁处并被扩张后,药物快速释放和转移至血管壁上,起到抗血管内膜增生的作用,同时也对内膜增生引发的再狭窄起预防作用。药物涂层球囊也因具有在特定血管壁释放药物,无金属遗留物,缩短了抗血小板治疗时间的优势,而吸引了越来越多的关注。同时,2020《dcb国际专家共识》也明确指出了可应用药物涂层球囊扩张导管血管造影指征。
4.而药物涂层球囊扩张导管在输送和释放过程中的药物丢失也严重制约了产品的应用。有研究表面,药物球囊中有80%以上的药物都在手术过程中丢失了,这样不仅降低了药物的利用率和治疗效果,而且脱落的药物容易产生血栓和远端堵塞。这种药物丢失的问题在大尺寸球囊中尤其严重,其原因主要如下:1、大尺寸球囊需喷涂的区域范围大且长,使得在循环喷涂中不同区域的药物分布均匀性低;2、大尺寸球囊的比表面积大,携带的药物多,药物丢失的概率也相应增大;3、大尺寸球囊涂敷的周期长,溶剂的挥发速度不一致,导致药物的结晶过程不受控,降低了药物的结晶度均一性和晶型均匀度,从而减弱了药物的牢固度。
5.授权公告号为cn111317907b、授权公告日为2021年01月19日公开一种复合药物涂层球囊,其制备方法以及复合药物涂层球囊扩张导管,在球囊表面覆盖的复合药物涂层包括底层涂层、中间层涂层和外层涂层,所述底层涂层涂覆于球囊表面,其由药物a和亲水性赋形剂组成;所述中间层涂层由包裹剂包裹的药物b和亲水性赋形剂/亲脂性赋形剂/两亲性赋形剂组成;所述外层涂层由药物c和亲脂性赋形剂/两亲性赋形剂组成。降低球囊输送过程中药物的损失,同时能够使得血管病变位置短期拥有有效药物浓度,抑制血管再狭窄,而且还可以提供长时间的药物释放,保持更长药物作用时间,降低再狭窄率。但是也存在一些缺陷,由于使用三层涂层,在涂层溶液的配置和涂层工艺上更为繁琐、复杂。
6.还有现有技术,将活性药物制成晶种后,再分散形成晶种悬浮液进行喷涂,由于晶种的存在,使得喷涂不均匀,药物在球囊表面的均匀性差。
技术实现要素:
7.本发明要解决的技术问题是提供一种用于大尺寸球囊的药物涂层,以提高药物在球囊表面的均匀性和结晶度,减少药物在血管穿刺过程中的损失率,从而提高药物涂层球囊导管的有效性和安全性,而且还可以保持长时间的药物作用时间,降低血管的再狭窄率。
8.为了解决上述技术问题,本发明提供了如下的技术方案:一种用于大尺寸球囊的药物涂层,由药物组合溶液涂布于气囊表面而形成,所述药物组合溶液包括药物溶液和共轭溶液,所述共轭溶液包括溶剂a和溶剂b,溶剂a包含去离子水、甲醇、乙醇、乙腈、二甲基亚砜、异丙醇、丙酮、四氢呋喃中的任意一种或至少两种的组合;溶剂b包含乙醚、二氯甲烷、甲酸乙酯、乙酸甲酯、大豆油中的任意一种或至少两种的组合。
9.本发明使用共轭溶液,两种及两种以上液体形成平衡共存的饱和溶液所构成的系统,有利于对药物的溶解(水相和非水相的溶解),从而有利于过饱和溶液的形成。
10.作为优选,溶剂b和溶剂a的体积比例为5~50:1。
11.作为优选,所述药物溶液包括活性药物和辅助剂,所述辅助剂为一种或多种溶剂的组合,如丙三醇、丙二醇、聚乙二醇、聚山梨酯、丁酰柠檬酸三正己酯,辅助剂的总量不超过药物含量的10%。
12.本发明对所述活性药物不进行限定,可以是一种或多种血管内膜抑制增生的活性药物的组合,如紫杉醇、紫杉醇的结构衍生物、雷帕霉素、雷帕霉素的结构衍生物等。
13.本发明还提供一种上述药物涂层的制备方法,包括以下步骤:(1)制备共轭溶液;(2)将药物溶液扩散或混合在共轭溶液中,以获得过饱和的药物组合溶液;(3)将步骤(2)中的药物组合溶液超声雾化成均匀液珠;(4)对待药物涂层的球囊进行表面预处理;(5)将步骤(3)中的药物混合溶液喷涂至步骤(4)中经过表面预处理的球囊表面,并经后处理得到载药球囊扩张导管。
14.大尺寸球囊的球囊有效长度40mm~300mm,球囊直径4mm ~40mm。
15.作为优选,步骤(1)中所述共轭溶液的制备方法:使溶剂a与溶剂b置于密封容器中,加热至平衡温度20℃-35℃,形成平衡共存的饱和溶液。
16.作为优选,步骤(2)中所述药物混合液的制备方法:在特定压力和特定温度梯度下,采用漩涡振荡或超声助溶法获得过饱和的药物混合液。
17.作为优选,所述特定压力10kpa~50kpa压力,优选为30kpa;作为优选,所述特定温度梯度为以(0.1-1.5)℃/s的速率,自室温升温至40℃-60℃,优选为50℃。
18.作为优选,所述过饱和药物浓度为30mg/ml-75mg/ml。
19.作为优选,所述步骤(3)中通过超声发生器将药物雾化成均匀液珠。
20.作为优选,所述超声发生器的功率0.5w-3.0w。
21.作为优选,所述超声发生器的喷头孔径15μm-25μm,喷涂宽幅1mm-10mm,喷雾流量0.001ml/min-2ml/min。
22.作为优选,所述超声发生器的载气为氮气或氦气的一种或组合,载气流速为2.0-4.0l/min,载气经过加热套和增湿器,以得到与药物混合药液一致的温度和湿度(≥55%rh)。
23.作为优选,步骤(4)中所述球囊表面预处理的方法:使用特定溶剂对球囊表面进行擦拭,并使用红外灯进行烘烤。
24.所述特定溶剂为乙醇、乙腈、异丙醇中任意一种或至少两种的组合,优选为乙腈。
25.作为优选,所述红外灯的波长范围为0.75μm-80μm,发生功率为5w-150w,聚焦面为5mm-20mm。
26.作为优选,所述烘烤的温度范围为20℃-45℃。
27.步骤(5)中所述特定工艺:喷涂设备按特定的喷涂工艺,使雾化的药物液珠喷涂至球囊表面。
28.作为优选,所述药物喷涂环境的温度18℃-28℃,湿度≥55%rh。
29.作为优选,所述药物喷涂工艺的换气次数1次/min~30次/min。
30.作为优选,所述药物喷涂工艺的水平向喷涂速度10mm/s-40mm/s,水平向行程40mm-400mm。
31.作为优选,所述药物喷涂工艺的旋转速度0.1r/s~1.0r/s;旋转角度20
°
~ 360
°
。
32.作为优选,所述药物喷涂工艺的喷涂高度10mm~120mm。
33.作为优选,所述药物喷涂工艺的循环喷涂次数1~10次。
34.步骤(5)中所述后处理:用红外灯辐射对喷涂药物后的球囊表面进行扫描烘烤,使得药物结晶成针状晶体。
35.作为优选,所述红外灯的波长范围0.75μm-80μm,发生功率5w-150w,聚焦面5mm-20mm。
36.作为优选,所述烘烤的温度范围20℃-45℃。
37.作为优选,所述后处理后的涂层厚度0.5μm~10μm。
38.作为优选,所述后处理后的球囊载药量2μg/mm2~4μg/mm2,辅助剂量≤0.4μg/mm2。
39.作为优选,所述针状晶体的长径比为1~50:1,针状晶体直径≤500nm。
40.本发明还提供一种球囊,其表面涂布有上述的药物涂层,球囊载药量2μg/mm2~4μg/mm2。
41.通过实施上述技术方案,相比于现有技术,本发明具有如下的有益效果:1、本发明中,药物涂层球囊的制备方法适用于大尺寸球囊,药物涂层均匀致密,克服了大尺寸球囊药物涂层均匀性和牢固度不高的缺点;2、本发明中,药物组合溶液中添加了辅助剂,能有效提高药物在球囊表面的均匀性和结晶度,有利于保持涂层的均匀致密完整牢固,进一步并减少药物在输送过程中的损失;3、本发明中,在药物涂层前,对球囊表面进行了预处理,能有效提高球囊表面的活化能,增强球囊与药物间的连接,降低了药物被血流冲刷损失的概率和远端栓塞的风险;4、本发明中,喷涂的药物液滴在球囊表面形成纳米级针状药物晶体,易于穿透内膜快速转移到血管壁,并形成微储库缓释药物,长期维持有效浓度,持续抑制内膜增生。
42.具体实施方式
43.实施例1在本实施例中,所述药物球囊扩张导管通过以下制备方法制备:(1)混合乙醇和二氯甲烷的形成共轭溶液,其中乙醇10ml,二氯甲烷100ml。另取紫
杉醇药物5.5g,聚乙二醇0.5ml,在30kpa和升温至50℃下形成药物组合,混合于上述共轭溶液中,并采用漩涡振荡法获得过饱和的药物混合液。
44.(2)球囊扩张导管的球囊直径为4.0mm,球囊有效长度为40mm,并采用乙腈进行擦拭,并用红外灯烘干。
45.(3)超声发生器的功率2.5w,喷头孔径20μm,喷涂宽幅3mm,喷雾流量0.02ml/min;载气为氮气,载气流速为3.0l/min,载气经过加热套和增湿器,以控制药物混合药液的温度30℃~40℃和湿度(≥55%rh);药物雾化的输送管路密封,并配备加热套,以维持药物混合药液的温度30℃~40℃,输送泵流量200μl/min;药物喷涂工艺的换气次数10次/min;药物喷涂工艺的水平向喷涂速度30mm/s,水平向行程40mm;药物喷涂工艺的旋转速度0.5r/s;旋转角度60
°
;药物喷涂工艺的喷涂高度50mm。
46.(4)药物涂覆完成后,采用红外灯对药物球囊进行烘烤3min,得到所述药物球囊扩张导管。所述球囊扩张导管的药物涂层厚度2μm~7μm,球囊载药量3.01μg/mm2,药物涂层的针状晶体直径100nm~200nm。
47.实施例2在本实施例中,所述药物球囊扩张导管通过以下制备方法制备:(1)混合乙醇和二氯甲烷的形成共轭溶液,其中乙醇10ml,二氯甲烷100ml。另取紫杉醇药物5.5g,丙三醇0.5ml,在30kpa和升温至50℃下形成药物组合,混合于上述共轭溶液中,并采用漩涡振荡法获得过饱和的药物混合液。
48.(2)球囊扩张导管的球囊直径为6.0mm,球囊有效长度为300mm,并采用异丙醇进行擦拭,并用红外灯烘干。
49.(3)超声发生器的功率2.5w,喷头孔径20μm,喷涂宽幅3mm,喷雾流量0.02ml/min;载气为氮气,载气流速为3.0l/min,载气经过加热套和增湿器,以控制药物混合药液的温度(30℃~40℃)和湿度(≥55%rh);药物雾化的输送管路密封,并配备加热套,以维持药物混合药液的温度(30℃~40℃),输送泵流量200μl/min;药物喷涂工艺的换气次数15次/min;药物喷涂工艺的水平向喷涂速度30mm/s,水平向行程300mm;药物喷涂工艺的旋转速度0.5r/s;旋转角度60
°
;药物喷涂工艺的喷涂高度52mm。
50.(4)药物涂覆完成后,采用红外灯对药物球囊进行烘烤3min,得到所述药物球囊扩张导管。所述球囊扩张导管的药物涂层厚度3μm~7μm,球囊载药量2.93μg/mm2,药物涂层的针状晶体直径80nm~200nm。
51.实施例3在本实施例中,所述药物球囊扩张导管通过以下制备方法制备:(1)混合去离子水和甲酸乙酯的形成共轭溶液,其中去离子水20ml,甲酸乙酯100ml。另取紫杉醇药物6.0g,丙三醇0.5ml,在30kpa和升温至50℃下形成药物组合,混合于上述共轭溶液中,并采用漩涡振荡法获得过饱和的药物混合液。
52.(2)球囊扩张导管的球囊直径为12.0mm,球囊有效长度为40mm,并采用乙腈进行擦拭,并用红外灯烘干。
53.(3)超声发生器的功率2.5w,喷头孔径20μm,喷涂宽幅3mm,喷雾流量0.02ml/min;载气为氮气,载气流速为3.0l/min,载气经过加热套和增湿器,以控制药物混合药液的温度(30℃~40℃)和湿度(≥55%rh);药物雾化的输送管路密封,并配备加热套,以维持药物混合
药液的温度(30℃~40℃),输送泵流量200μl/min;药物喷涂工艺的换气次数15次/min;药物喷涂工艺的水平向喷涂速度30mm/s,水平向行程40mm;药物喷涂工艺的旋转速度0.5r/s;旋转角度60
°
;药物喷涂工艺的喷涂高度54mm。
54.(4)药物涂覆完成后,采用红外灯对药物球囊进行烘烤3min,得到所述药物球囊扩张导管。所述球囊扩张导管的药物涂层厚度3μm~8μm,球囊载药量3.05μg/mm2,药物涂层的针状晶体直径100nm~250nm。
55.实施例4在本实施例中,所述药物球囊扩张导管通过以下制备方法制备:(1)混合去离子水,乙腈和乙醚的形成共轭溶液,其中去离子水15ml,乙腈5ml,乙醚100ml。另取紫杉醇药物5.0g,丙三醇0.5ml,在30kpa和升温至50℃下形成药物组合,混合于上述共轭溶液中,并采用漩涡振荡法获得过饱和的药物混合液。
56.(2)球囊扩张导管的球囊直径为30.0mm,球囊有效长度为100mm,并采用乙腈进行擦拭,并用红外灯烘干。
57.(3)超声发生器的功率2.5w,喷头孔径20μm,喷涂宽幅3mm,喷雾流量0.02ml/min;载气为氮气,载气流速为3.0l/min,载气经过加热套和增湿器,以控制药物混合药液的温度(30℃~40℃)和湿度(≥55%rh);药物雾化的输送管路密封,并配备加热套,以维持药物混合药液的温度(30℃~40℃),输送泵流量200μl/min;药物喷涂工艺的换气次数25次/min;药物喷涂工艺的水平向喷涂速度30mm/s,水平向行程100mm;药物喷涂工艺的旋转速度0.5r/s;旋转角度60
°
;药物喷涂工艺的喷涂高度62mm。
58.(4)药物涂覆完成后,采用红外灯对药物球囊进行烘烤3min,得到所述药物球囊扩张导管。所述球囊扩张导管的药物涂层厚度3μm~7μm,球囊载药量2.90μg/mm2,药物涂层的针状晶体直径100nm~300nm。
59.实施例5在本实施例中,所述药物球囊扩张导管通过以下制备方法制备:(1)混合去离子水和大豆油形成共轭溶液,其中去离子水20ml,大豆油100ml。另取紫杉醇药物5.0g,聚山梨酯0.5ml,在25kpa和升温至45℃下形成药物组合,混合于上述共轭溶液中,并采用漩涡振荡法获得过饱和的药物混合液。
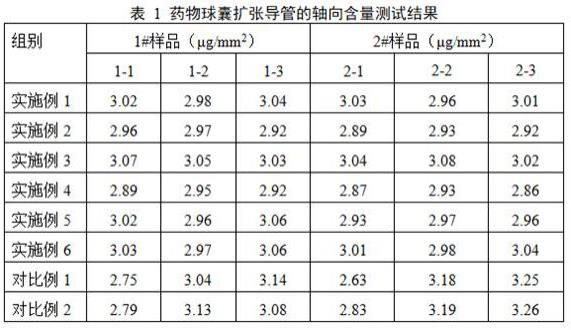
60.(2)球囊扩张导管的球囊直径为6.0mm,球囊有效长度为300mm,并采用异丙醇和乙腈的混合液(体积比1:1)进行擦拭,并用红外灯烘干。
61.(3)超声发生器的功率2.5w,喷头孔径15μm,喷涂宽幅4mm,喷雾流量0.04ml/min;载气为氮气,载气流速为4.0l/min,载气经过加热套和增湿器,以控制药物混合药液的温度(30℃~40℃)和湿度(≥55%rh);药物雾化的输送管路密封,并配备加热套,以维持药物混合药液的温度(30℃~40℃),输送泵流量200μl/min;药物喷涂工艺的换气次数15次/min;药物喷涂工艺的水平向喷涂速度30mm/s,水平向行程300mm;药物喷涂工艺的旋转速度0.5r/s;旋转角度60
°
;药物喷涂工艺的喷涂高度52mm。
62.(4)药物涂覆完成后,采用红外灯对药物球囊进行烘烤3min,得到所述药物球囊扩张导管。所述球囊扩张导管的药物涂层厚度3μm~8μm,球囊载药量2.98μg/mm2,药物涂层的针状晶体直径80~250nm。
63.实施例6
在本实施例中,所述药物球囊扩张导管通过以下制备方法制备:(1)混合去离子水,异丙醇和二氯甲烷的形成共轭溶液,其中去离子水15ml,乙醇5ml,二氯甲烷100ml。另取紫杉醇药物6.0g,聚山梨酯0.5ml,在25kpa和升温至45℃下形成药物组合,混合于上述共轭溶液中,并采用漩涡振荡法获得过饱和的药物混合液。
64.(2)球囊扩张导管的球囊直径为30.0mm,球囊有效长度为100mm,并采用异丙醇进行擦拭,并用红外灯烘干。
65.(3)超声发生器的功率2.5w,喷头孔径15μm,喷涂宽幅4mm,喷雾流量0.04ml/min;载气为氮气,载气流速为4.0l/min,载气经过加热套和增湿器,以控制药物混合药液的温度(30℃~40℃)和湿度(≥55%rh);药物雾化的输送管路密封,并配备加热套,以维持药物混合药液的温度(30℃~40℃),输送泵流量200μl/min;药物喷涂工艺的换气次数20次/min;药物喷涂工艺的水平向喷涂速度30mm/s,水平向行程100mm;药物喷涂工艺的旋转速度0.5r/s;旋转角度60
°
;药物喷涂工艺的喷涂高度62mm。
66.(4)药物涂覆完成后,采用红外灯对药物球囊进行烘烤3min,得到所述药物球囊扩张导管。所述球囊扩张导管的药物涂层厚度3μm~9μm,球囊载药量3.02μg/mm2,药物涂层的针状晶体直径120nm~300nm。
67.对比例1在本对比例中,所述药物球囊扩张导管通过以下制备方法制备:(1)混合乙醇和二氯甲烷的形成共轭溶液,其中乙醇10ml,二氯甲烷100ml。另取紫杉醇药物5.5g,混合于上述共轭溶液中,并采用漩涡振荡法获得过饱和的药物混合液。
68.(2)球囊扩张导管的球囊直径为6.0mm,球囊有效长度为300mm。
69.(3)超声发生器的功率2.5w,喷头孔径20μm,喷涂宽幅3mm,喷雾流量0.02ml/min;载气为氮气,载气流速为3.0l/min,;药物的输送泵流量200μl/min;药物喷涂工艺的换气次数15次/min;药物喷涂工艺的水平向喷涂速度30mm/s,水平向行程300mm;药物喷涂工艺的旋转速度0.5r/s;旋转角度60
°
;药物喷涂工艺的喷涂高度52mm。药物涂覆完成后,即得到所述药物球囊扩张导管。
70.对比例2在本对比例中,所述药物球囊扩张导管通过以下制备方法制备:(1)混合去离子水,异丙醇和二氯甲烷的形成共轭溶液,其中去离子水15ml,乙醇5ml,二氯甲烷100ml。另取紫杉醇药物6.0g,混合于上述共轭溶液中,并采用漩涡振荡法获得过饱和的药物混合液。
71.(2)球囊扩张导管的球囊直径为30.0mm,球囊有效长度为100mm。
72.(3)超声发生器的功率2.5w,喷头孔径15μm,喷涂宽幅4mm,喷雾流量0.04ml/min;载气为氮气,载气流速为4.0l/min;药物的输送泵流量200μl/min;药物喷涂工艺的换气次数20次/min;药物喷涂工艺的水平向喷涂速度30mm/s,水平向行程100mm;药物喷涂工艺的旋转速度0.5r/s;旋转角度60
°
;药物喷涂工艺的喷涂高度62mm。药物涂覆完成后,得到所述药物球囊扩张导管。
73.性能测试1:药物球囊扩张导管的轴向含量分布将一根药物球囊平均切割成3段,分别放入一定体积的玻璃容器内。取适量的乙腈,置于上述玻璃容器内,并确保球囊完全浸没于乙腈中,超声使得紫杉醇完全溶解,摇匀,
分别制得各段待测液。同时,取紫杉醇对照品适量,置于一定体积的量瓶中,用乙腈溶解并,制成浓度为100μg/ml的对照品溶液。
74.采用液相色谱系统对各溶液进行测试,并按外标法以峰面积计算(以段1为例子,其余各段与段1一致)各段单位面积的药物含量。
75.,f为校正因子。
76.根据以上测试方法,得到的测试结果如表1所示。
77.从表1中可以看出,各实施例的药物涂层均沿球囊轴向分布均匀,每根球囊扩张导管各单位段的药物含量均在3
±
0.2μg/mm2范围内,而对比例的药物涂层均沿球囊轴向分布较不均匀,球囊两端的药物含量相差较大。
78.性能测试2:药物球囊扩张导管药物涂层释放微粒将模拟血管通路的硅胶管置于200ml 纯化水中,随后将球囊导管的球囊部分穿过硅胶管,并充盈至名义压力,保持60s后卸压,将球囊和硅胶管从烧杯中撤出,制得球囊导管药物涂层在体外模拟血管释放过程的微粒待测溶液。
79.采用微粒检测仪对待测溶液进行检测,并取样品中的≥10μm、25-50μm、51-100μm、>100μm微粒测定结果的平均值,作为1ml微粒待测溶液的微粒测定值,而体外释放过程中的微粒数(个)=样品检测液结果(个/ml)
×
200ml—纯化水结果(个/ml)
×
200ml体外释放过程中的微粒数(个/mm2)。同时,计算球囊单位面积的微粒数,计算公式如下所示。
80.根据以上测试方法,得到的测试结果如表2所示。
81.从表2中可以看出,各实施例的涂层释放微粒与对比例的涂层释放微粒相比,不同微粒粒径的微粒数量均明显较少。
82.性能测试3:药物球囊扩张导管药物涂层体外释放率将模拟血管通路的硅胶管,浸入适当体积的释放介质中(释放介质:乙醇和pbs缓冲液体积比=80%:20%),随后将球囊导管的球囊部分穿进硅胶管中,并将球囊充盈至名义压力(充盈介质:注射用水),扩张时间分别为扩张30s,60s,90s,120s。球囊扩张至相应时间后,对球囊抽负压并立即取出球囊。剪下球囊,并将球囊置于适宜体积的玻璃容器内,加入适量乙醇溶解不溶物,再加入乙腈,定容至刻度,即得残留药物溶液b。
83.转移释放溶液至合适体积容量瓶中,用适量乙腈润洗2次释放容器和硅胶管后将润洗液倒入容量瓶,定容,即得释放药物溶液a。
84.对照品溶液配制:取紫杉醇对照品适量,置于一定体积的量瓶中,用乙腈溶解并,制成浓度为100 μg/ml的对照品溶液。按外标法以峰面积计算,即得药物的含量。
85.,f为校正因子。
86.残留药物含量(μg)=f
×
残留样品峰面积
×
样品稀释体积释放药物含量(μg)= f
×
释放样品峰面积
×
样品稀释体积根据以上测试方法,得到的测试结果如表3所示。
[0087]87.从表3中可以看出,各实施例和对比例药物球囊扩张导管的药物涂层体外释放率
均满足≥70%的要求,但各实施例的体外药物释放率明显高于对比例,药物能更有效的释放至病变位置的血管组织中。
[0088]
综上所述,本发明的药物涂层球囊扩张导管与对比例相比,药物的轴向含量分布更加均匀,药物涂层释放微粒更少,药物涂层的牢固度更高,在输送和释放过程中的药物丢失率更低。此外,药物涂层的体外释放率更高,球囊扩张30s的药物释放率就能达到90%以上,能够保证更多的药物进入至病变位置的血管组织中,更少的药物残留在球囊上,有效保证药物的利用率,从而能有效保证临床的有效性(有效抑制血管再狭窄)和安全性。
[0089]
以上列举的仅是本发明的具体实施例子。显然,本发明不限于以上实施例子,还可以有许多变形。本领域的普通技术人员能从本发明公开的内容直接导出或联想到的所有变形,均应认为是本发明的保护范围。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1