基于多组学数据融合的药物敏感性预测方法和装置
1.本发明属于药物敏感性检测与评价技术领域,具体涉及一种基于多组学数据融合的药物敏感性预测方法和装置。
背景技术:
2.癌症的治疗是全世界都在努力解决的一个重大难题,高通量测序技术和人工智能技术的发展为癌症的精准治疗提供了无限可能。如何利用个体丰富的生物学信息和深度学习、人工智能等高效分析手段,自动学习个体的特异性特征,为每个个体制定特意化的诊断和治疗方案,从而实现精准诊断、精准治疗,是全世界研究者和工业界都非常关注的一个重要问题。不少研究者在这一问题上做出了很多努力和贡献,尝试运用个体的基因组学数据对患者进行个性化诊断和用药推荐。然而,现有研究仍然面临一个重要的问题,如何充分利用每个个体复杂多样的多种组学数聚,从而能够实现更加精准的药物药效预测和用药推荐,仍然是亟待解决的重要问题。
3.随着人们对基因组学研究的深入,一些公开数据集开始被越来越广地应用于生物信息学研究,例如抗癌药物敏感性基因组学数据集(cancer cell line encyclopedia ,ccle)和(genomics of drug sensitivity in cancer,gdsc),癌症基因组图谱(the cancer genome atlas,tcga)等数据集,以及研究人类基因/蛋白之间相互作用的蛋白组学数据集(string database)、研究人类信息通路的代谢组学数据集(gsea dataset)等。例如申请公布号为cn105005693a的专利申请公开的一种基于遗传物质特异性的肿瘤细胞药物敏感性评估方法,单独使用肿瘤细胞样本集预测半抑制浓度(ic50值),再如申请公布号为cn112164474a的专利申请公开的一种基于自表达模型的药物敏感性预测方法,同时采用gdsc数据集和癌细胞系百科全书来实现半抑制浓度(ic50值)的预测。
4.以上数据集仍然在不断地扩充和发展,为研究疾病的发生、发展、预后和转归等提供了丰富的样本数据基础。然而,现有的数据很少能够被充分地利用,从而解决药物敏感性预测和药物推荐的问题。例如,现有的方法只使用ccle和gdsc数据库中提供的个体基因组学数据,通过对基因组学的分析来实现半抑制浓度的预测,然而,这样的方法往往忽略掉个体基因在其他组学层面上可能存在的联系。因此,这样的方法虽然取得了一定的进展,但是对于半抑制浓度预测的准确率仍然不够。因此,目前尚未有比较好的模型能够充分融合个体的多组学信息,从而对药物敏感性(半抑制浓度)进行更加准确的预测。
技术实现要素:
5.鉴于上述,本发明目的是提供一种基于多组学数据融合的药物敏感性预测方法和装置,以解决因为忽略基因之间潜在联系而导致药物敏感性预测准确性差的问题。
6.为实现上述发明目的,本发明提供以下技术方案:第一方面,实施例提供了一种基于多组学数据融合的药物敏感性预测方法,包括以下步骤:
获取细胞系的多组学数据、药物数据、药物对细胞系的半抑制浓度数据,其中,细胞系的多组学数据包括基因组学数据、蛋白组学数据、代谢组学数据;构建药物敏感性预测模型,包括细胞系图表征模块、细胞系图特征提取模块、药物特征提取模块以及药物敏感性预测模块,其中,细胞系图表征模块用于将细胞系的多组学数据编码成细胞系多边图,即将每个样本的基因作为细胞系多边图的节点,并将基因对应的基因表达量、基因突变情况和拷贝数变异情况作为节点特征,以根据基因组学数据确定的基因之间的相关性、根据蛋白组学数据确定的基因之间的蛋白相互作用、根据代谢组学数据确定的基因之间的代谢通路信息构建节点之间的连边;细胞系图特征提取模块用于从细胞系多边图中提取细胞系特征;药物特征提取模块用于从药物数据中提取药物特征;药物敏感性预测模块用于依据细胞系特征和药物特征预测药物的半抑制浓度;以细胞系的多组学数据、药物数据作为样本数据,以药物对细胞系的半抑制浓度数据作为真值标签,对药物敏感性预测模型进行参数优化;利用参数优化后的药物敏感性预测模型进行药物敏感性预测。
7.在一个实施例中,所述细胞系图表征模块中,根据基因组学数据,计算两个基因的基因表达数据之间的皮尔森相关系数以确定基因之间的相关性,当皮尔森相关系数大于设定阈值时,构建两个基因对应的节点之间的连边;根据蛋白组学数据获取两个基因之间的相互作用作为蛋白相互作用,在存在蛋白相互作用的两个基因对应的节点之间构建连边,同时将相互作用的交互分数作为连边权重;根据代谢组学数据获取基因之间的代谢通路信息,当多种基因同时出现在某一条代谢通路时,对这些基因对应的节点之间构建一条超边作为连边。
8.在一个实施例中,所述细胞系图特征提取模块包括由多个图卷积层组成的第一图神经网络单元和门控循环单元,相邻两个图卷积层之间通过门控循环单元连接,其中,第一图神经网络单元用于从细胞系多边图中提取细胞系特征,门控循环单元用于对提取的细胞系特征进行特征关注。
9.在一个实施例中,在每个卷积层中,对节点特征进行三步特征聚合,包括:第一步特征聚合,依据基因之间的相关性构建的第一连边,确定当前节点的所有第一一阶邻居节点,通过以下公式(1)进行特征聚合;(1)其中,表示第i个当前节点的当前节点特征,表示经过第一步特征聚合后的新节点特征, 表示第j个第一一阶邻居节点的节点特征,表示第i个当前节点与第j个第一一阶邻居节点之间的第一连边的权重,表示第一一阶邻居节点的个数,表示经过第一步特征聚合后的新节点特征;第二步特征聚合,依据基因之间的蛋白相互作用构建的第二连边,确定当前节点的所有第二一阶邻居节点,通过以下公式(2)进行特征聚合;(2)
其中,表示第i个当前节点的新节点特征经过节点门控单元进行注意力关注后的新节点特征,表示第k个第二一阶邻居节点的节点特征,表示第i个当前节点与第k个第二一阶邻居节点之间的第二连边的权重,表示第二一阶邻居节点的个数,表示经过第二步特征聚合后的新节点特征;第三步特征聚合,依据基因之间的代谢通路信息构建的第三连边,确定当前节点的所有第三一阶邻居节点,通过以下公式(3)进行特征聚合;(3)其中,表示第i个当前节点的新节点特征经过节点门控单元进行注意力关注后的新节点特征,表示第t个第三一阶邻居节点的节点特征,表示第i个当前节点特征与第t个第三一阶邻居节点之间的第三连边的权重,表示第三一阶邻居节点的个数,表示经过第三步特征聚合后的新节点特征;当前节点的新节点特征经过经过节点门控单元进行注意力关注后的新节点特征作为下一卷积层的当前节点特征。
10.在一个实施例中,所述药物特征提取模块包括转换单元和第二图神经网络单元,其中,转换单元用于将药物数据转换成药物分子图,第二图神经网络单元用于从输入的药物分子图中提取药物特征。
11.在一个实施例中,所述转换单元采用开源库rdkit将药物数据编码成药物分子图;所述第二图神经网络单元基于图同构原理构建。
12.在一个实施例中,所述药物敏感性预测模块包括多个全连接层,用于对输入的细胞系特征和药物特征的拼接特征,进行特征融合和回归预测药物的半抑制浓度。
13.在一个实施例中,在获取细胞系的多组学数据、药物数据和药物对细胞系的半抑制浓度数据之后,还对数据进行异常值和缺失值剔除处理,处理后的数据用于构建训练样本。
14.在一个实施例中,对药物敏感性预测模型进行参数优化时,以半抑制浓度的预测值和对应的真值标签的均方误差作为损失函数来更新药物敏感性预测模型的模型参数。
15.第二方面,实施例提供了一种基于多组学数据融合的药物敏感性预测装置,包括:数据获取单元,用于获取细胞系的多组学数据、药物数据、药物对细胞系的半抑制浓度数据,其中,细胞系的多组学数据包括基因组学数据、蛋白组学数据、代谢组学数据;模型构建单元,用于构建药物敏感性预测模型,包括细胞系图表征模块、细胞系图特征提取模块、药物特征提取模块以及药物敏感性预测模块,其中,细胞系图表征模块用于将细胞系的多组学数据编码成细胞系多边图,即将每个样本的基因作为节点,并将基因对应的基因表达量、基因突变情况和拷贝数变异情况作为节点特征,以根据基因组学数据确定的基因之间的相关性、根据蛋白组学数据确定的基因之间的蛋白相互作用、根据代谢组学数据确定的基因之间的代谢通路信息构建节点之间的连边;细胞系图特征提取模块用于从细胞系多边图中提取细胞系特征;药物特征提取模块用于从药物数据中提取药物特征;
药物敏感性预测模块用于依据细胞系特征和药物特征预测药物的半抑制浓度;优化学习单元,用于以细胞系的多组学数据、药物数据作为样本数据,以药物对细胞系的半抑制浓度数据作为真值标签,对药物敏感性预测模型进行参数优化;预测单元,用于利用参数优化后的药物敏感性预测模型进行药物敏感性预测。
16.第三方面,实施例提供了一种基于多组学数据融合的药物敏感性预测装置,包括存储器、处理器以及存储在存储器中并可在处理器上执行的计算机程序,处理器执行计算机程序时实现第一方面所述的基于多组学数据融合的药物敏感性预测方法步骤。
17.与现有技术相比,本发明具有的有益效果至少包括:通过细胞系图表征模块来整合个体细胞系的基因组学数据、蛋白组学数据、代谢组学数据这三类多组学信息得到细胞系多边图,该细胞系多边图充分考虑细胞系的多组学信息,以及基因在多组学层面其表达的产物之间的潜在联系,然后通过细胞系图特征提取模块对细胞系多边图进行特征提取,以充分提取细胞系多边图中的节点特征和边特征作为细胞系特征,最后采用药物敏感性预测模块根据细胞系特征和基于药物特征提取模块提取的药物特征预测药物的半抑制浓度,这样在综合考虑基因组学数据、蛋白组学数据、代谢组学数据的基础上提高了药物敏感性的预测准确率。
附图说明
18.为了更清楚地说明本发明实施例或现有技术中的技术方案,下面将对实施例或现有技术描述中所需要使用的附图做简单地介绍,显而易见地,下面描述中的附图仅仅是本发明的一些实施例,对于本领域普通技术人员来讲,在不付出创造性劳动前提下,还可以根据这些附图获得其他附图。
19.图1是实施例提供的基于多组学数据融合的药物敏感性预测方法的流程图;图2是实施例提供的药物敏感性预测模型的结构示意图;图3是实施例提供的细胞系图表征模块中构建细胞系多边图的原理图;图4是实施例提供的细胞系图特征提取模块中提取特征的原理图;图5是实施例提供的基于多组学数据融合的药物敏感性预测装置的结构示意图。
具体实施方式
20.为使本发明的目的、技术方案及优点更加清楚明白,以下结合附图及实施例对本发明进行进一步的详细说明。应当理解,此处所描述的具体实施方式仅仅用以解释本发明,并不限定本发明的保护范围。
21.为了解决由于存在未考虑个体多组学信息的复杂特征、及基因在多组学层面上可能存在的多种潜在关系而导致的药物敏感性预测模型精度低,难以精确预测药物敏感性的问题。实施例提供了一种于多组学数据融合的药物敏感性预测方法和装置。通过考虑基因组学、蛋白组学、代谢组学等多组学信息及基因之间可能存在的潜在关系,同时配合结合图神经网络单元和门控循环单元来提取数据特征,以提升药物敏感性预测模型的预测准确率。
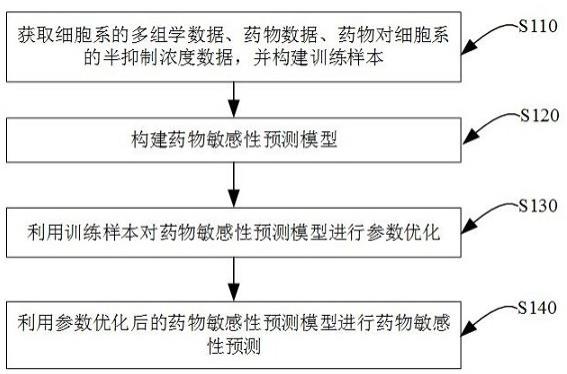
22.图1是实施例提供的基于多组学数据融合的药物敏感性预测方法的流程图。如图1所示,实施例提供的基于多组学数据融合的药物敏感性预测方法,包括以下步骤:
s110,获取细胞系的多组学数据、药物数据、药物对细胞系的半抑制浓度数据,并构建训练样本。
23.对于每个细胞系样本,均可以获得对应的多组学数据、药物数据、药物对细胞系的半抑制浓度数据。其中,多组学数据包括基因组学数据、蛋白组学数据和代谢组学数据。药物数据是指作用于细胞系的药物名称,通过药物名称可以获得药物分子式。半抑制浓度数据表征细胞系对药物的抵抗能力,半抑制浓度数据越小,表示细胞系对药物的抗体特异性就越强。对于细胞系所包含的全部基因而言,基因组学数据包含基因表达量、基因突变情况和拷贝数变异情况;蛋白组学数据反应基因之间在蛋白层面上的相互作用,即蛋白相互作用(ppi);代谢组学数据反应基因之间在代谢通路层面上的对应关系,即是否多个基因存在于同一条代谢通路上。
24.实施例中,获取数据可以来自于多组学数据集,例如:ccle数据集记载细胞系的基因组学数据,包括基因表达量、拷贝数变异情况和基因突变情况;string数据集记录人类基因/蛋白之间相互作用,gsea数据集记录人类代谢组学信息通路的代谢组学信息,gdsc数据集记载细胞系对某个药物的半抑制浓度值。在这些数据集中一般药物数据以名称的形式表示,为了方便提取药物分子图,还需要从数据库(例如pubchem数据库)中获取药物分子式作为药物研究对象。
25.需要对获取数据进行样本划分,以用于优化药物敏感性预测模型参数。具体地,从gdsc数据集的每条记录信息提取细胞系信息、药物数据以及半抑制浓度数据,再从ccle、string、gsea数据集中获取每个细胞系相应的多组学数据,其中,以每条记录对应的数据作为训练样本,即以细胞系的多组学数据、药物数据作为样本数据,以药物对细胞系的半抑制浓度数据作为真值标签。
26.在一个可能的实施方式中,为了提升训练样本质量进而提升模型的训练效果,在获取细胞系的多组学数据、药物数据和药物对细胞系的半抑制浓度数据之后,还对数据进行异常值和缺失值剔除处理,处理后的数据用于构建训练样本。
27.s120,构建药物敏感性预测模型。
28.图2是实施例提供的药物敏感性预测模型的结构示意图。如图2所示,实施例提供的药物敏感性预测模型包括细胞系图表征模块、细胞系图特征提取模块、药物特征提取模块以及药物敏感性预测模块。其中,细胞系图表征模块用于将细胞系的多组学数据编码成细胞系多边图,实现基于多组学数据融合的细胞系多边图表征;细胞系图特征提取模块用于从细胞系多边图中提取细胞系特征;药物特征提取模块用于从药物数据中提取药物特征;药物敏感性预测模块用于依据细胞系特征和药物特征预测药物的半抑制浓度。
29.图3是实施例提供的细胞系图表征模块中构建细胞系多边图的原理图。如图3所示,首先构建节点和节点特征,具体地,以每个样本的基因作为细胞系多边图的节点,相应地根据每个基因的基因组学数据构建节点的三种特征,即将基因对应的基因表达量、基因突变情况和拷贝数变异情况作为节点特征,其中,基因突变情况理解为是否发生基因突变,拷贝数变异情况理解为是否存在拷贝数变异。
30.然后构建节点之间的连边信息,具体地,以根据基因组学数据确定的基因之间的相关性、根据蛋白组学数据确定的基因之间的蛋白相互作用、根据代谢组学数据确定的基因之间的代谢通路信息构建节点之间的连边。
31.在根据基因之间的相关性构建节点之间的连边时,计算两个基因的基因表达数据之间的皮尔森相关系数以确定基因之间的相关性,当皮尔森相关系数大于设定阈值时,构建两个基因对应的节点之间的连边,相应的权重设为1,不存在的连边权重为0。
32.在根据基因之间的蛋白相互作用建节点之间的连边时,根据蛋白组学数据获取两个基因之间的相互作用作为蛋白相互作用,在存在蛋白相互作用的两个基因对应的节点之间构建连边,同时将相互作用的交互分数作为连边权重。
33.在根据基因之间的代谢通路信息建节点之间的连边时,根据代谢组学数据获取基因之间的代谢通路信息,当多种基因同时出现在某一条代谢通路时,对这些基因对应的节点之间构建一条超边作为连边。实施例中,通过超边展开(clique expansion)和边合并(edge merging)两个步骤获得任意两个基因之间连边及权重。具体而言,对于多个基因构成的一条超边,首先将这条超边展开,得到多个基因对应的节点之间两两节点互相连通的全连通图,两两节点之间形成普通的连边。对所有超边进行超边展开操作之后,两个基因对应的节点之间可能形成多条连边,对这些所有连边进行边合并操作,将两节点之间存在的连边的数量作为这两个节点的连边权重。
34.图4是实施例提供的细胞系图特征提取模块中提取特征的原理图。如图4所示,在充分考虑构建的细胞系多边图的特定结构,实施例提供的细胞系图特征提取模块包括第一图神经网络单元和门控循环单元,其中,第一图神经网络单元包括多个图卷积层,如8个图卷积层,用于从细胞系多边图中提取节点特征作为细胞系特征。门控循环单元连接相邻两个图卷积层,用于对提取的节点特征给予不同的注意力以进行特征关注,即前一卷积层提取的节点特征经过门控循环单元特征关注后,作为后一卷积层进行特征提取的基础,这样能够实现在特征提取过程中有效特征的高度关注。
35.如图4所示,在每个卷积层中,对节点特征进行三步特征聚合,分别用来实现细胞系多边图中节点特征通过不同种类边进行信息聚合,具体包括:第一步特征聚合,依据基因之间的相关性构建的第一连边,确定当前节点的所有第一一阶邻居节点,通过以下公式(1)进行特征聚合;(1)其中,表示第i个当前节点的当前节点特征,表示经过第一步特征聚合后的新节点特征, 表示第j个第一一阶邻居节点的节点特征,表示第i个当前节点与第j个第一一阶邻居节点之间的第一连边的权重,表示第一一阶邻居节点的个数,表示经过第一步特征聚合后的新节点特征;第二步特征聚合,依据基因之间的蛋白相互作用构建的第二连边,确定当前节点的所有第二一阶邻居节点,通过以下公式(2)进行特征聚合;(2)其中,表示第i个当前节点的新节点特征经过节点门控单元进行注意力关注后的新节点特征,表示第k个第二一阶邻居节点的节点特征,表示第i个当前节点与第k个第二一阶邻居节点之间的第二连边的权重,表示第二一阶邻居节点的个数,表示经过第二步特征聚合后的新节点特征;第三步特征聚合,依据基因之间的代谢通路信息构建的第三连边,确定当前节点
的所有第三一阶邻居节点,通过以下公式(3)进行特征聚合; (3)其中,表示第i个当前节点的新节点特征经过节点门控单元进行注意力关注后的新节点特征,表示第t个第三一阶邻居节点的节点特征,表示第i个当前节点特征与第t个第三一阶邻居节点之间的第三连边的权重,表示第三一阶邻居节点的个数,表示经过第三步特征聚合后的新节点特征;当前节点的新节点特征经过节点门控单元进行注意力关注后的新节点特征作为下一卷积层的当前节点特征。
36.以上三个步骤的特征聚合分别聚合三种边所构成的一阶邻居节点的节点特征,因此,每个图卷积层会将三种边构成的所有一阶邻居节点的节点特征进行一遍聚合,每个步骤之后经过一个节点层面的节点门控单元进行特征注意,从而适当的给予不同种类的连边所聚合的节点特征不同的权重。
37.如图2所示,药物特征提取模块包括转换单元和第二图神经网络单元,其中,转换单元用于将药物数据转换成药物分子图,第二图神经网络单元用于从输入的药物分子图中提取药物特征。在一个可能实施方式中,转换单元采用开源库rdkit将药物数据编码成药物分子图,第二图神经网络单元基于图同构原理构建,即通过开源库rdkit将药物数据编码成药物分子图后,利用基于图同构原理构建的第二图神经网络单元对药物分子图进行特征提取,以得到药物特征。
38.基于图同构原理构建的第二图神经网络单元包括多个图同构网络(graph isomorphism network,gin)结构,每个gin结构包括卷积层(ginconv)、批归一化层(bn)以及relu激活层(relu),每个gat模块包括gat的卷积层(gatconv)、批归一化层(bn)以及relu激活层(relu)。
39.如图2所示,药物敏感性预测模块包括多个全连接层,如3个全连接层,细胞系特征和药物特征进行拼接后输入药物敏感性预测模块,利用多个全连接层对输入的拼接特征进行特征融合和回归预测,以输出预测的药物
‑
细胞系对的药物的半抑制浓度。
40.s130,利用训练样本对药物敏感性预测模型进行参数优化。
41.实施例中,以细胞系的多组学数据、药物数据作为样本数据,以药物对细胞系的半抑制浓度数据作为真值标签,对药物敏感性预测模型进行参数优化。具体地,将细胞系的多组学数据输入到细胞系图表征模块,经过表征后的细胞系多边图输入细胞系图特征提取模块,经过信息表征和特征提取,得到细胞系特征;将药物数据输入药物特征提取模块,经过信息表征和特征提取,得到药物特征;将细胞系特征和药物特征输入药物敏感性预测模块,经过计算输出半抑制浓度的预测值,根据半抑制浓度的预测值和对应的真值标签的均方误差作为损失函数来更新药物敏感性预测模型的模型参数。
42.s140,利用参数优化后的药物敏感性预测模型进行药物敏感性预测。
43.在应用预测时,细胞系的多组学数据输入至药物敏感性预测模型,利用细胞系图表征模块将细胞系多组学数据编码成细胞系多边图,并输入到细胞系图特征提取模块,经过信息表征和特征提取,得到细胞系特征;将药物数据输入药物特征提取模块,经过信息表征和特征提取,得到药物特征;将细胞系特征和药物特征输入药物敏感性预测模块,经过计算输出半抑制浓度的预测值。例如,利用药物敏感性预测模型在泛癌种的564个细胞系和
170种药物上的训练和测试,发现测试集上的rmse仅有0.7943,远好于现有的各类模型。
44.图5是实施例提供的基于多组学数据融合的药物敏感性预测装置的结构示意图。如图5所示,实施例提供的药物敏感性预测装置500,包括:数据获取单元510,用于获取细胞系的多组学数据、药物数据、药物对细胞系的半抑制浓度数据,其中,细胞系的多组学数据包括基因组学数据、蛋白组学数据、代谢组学数据;模型构建单元520,用于构建药物敏感性预测模型,包括细胞系图表征模块、细胞系图特征提取模块、药物特征提取模块以及药物敏感性预测模块,其中,细胞系图表征模块用于将细胞系的多组学数据编码成细胞系多边图,即将每个样本的基因作为节点,并将基因对应的基因表达量、基因突变情况和拷贝数变异情况作为节点特征,以根据基因组学数据确定的基因之间的相关性、根据蛋白组学数据确定的基因之间的蛋白相互作用、根据代谢组学数据确定的基因之间的代谢通路信息构建节点之间的连边;细胞系图特征提取模块用于从细胞系多边图中提取细胞系特征;药物特征提取模块用于从药物数据中提取药物特征;药物敏感性预测模块用于依据细胞系特征和药物特征预测药物的半抑制浓度;优化学习单元530,用于以细胞系的多组学数据、药物数据作为样本数据,以药物对细胞系的半抑制浓度数据作为真值标签,对药物敏感性预测模型进行参数优化;预测单元540,用于利用参数优化后的药物敏感性预测模型进行药物敏感性预测。
45.需要说明的是,上述实施例提供的基于多组学数据融合的药物敏感性预测装置在进行药物敏感性预测时,应以上述各功能单元的划分进行举例说明,可以根据需要将上述功能分配由不同的功能单元完成,即在终端或服务器的内部结构划分成不同的功能单元,以完成以上描述的全部或者部分功能。另外,上述实施例提供的基于多组学数据融合的药物敏感性预测装置与基于多组学数据融合的药物敏感性预测方法实施例属于同一构思,其具体实现过程详见基于多组学数据融合的药物敏感性预测方法实施例,这里不再赘述。
46.实施例还提供了一种基于多组学数据融合的药物敏感性预测装置,包括存储器、处理器以及存储在存储器中并可在处理器上执行的计算机程序,处理器执行计算机程序时实现上述基于多组学数据融合的药物敏感性预测方法步骤。
47.本领域普通技术人员可以理解实现上述实施例方法中的全部或部分流程,是可以通过计算机程序来指令相关的硬件来完成,所述的计算机程序可存储于非易失性计算机可读取存储介质中,该计算机程序在执行时, 可包括如上述各方法的实施例的流程。其中,本技术所提供的各实施例中,存储器可以为在近端的易失性存储器,如ram,还可以是非易失性存储器,如rom,flash,软盘,机械硬盘等,还可以是远端的存储云。处理器可以为中央处理器(cpu)、微处理器(mpu)、数字信号处理器(dsp)、或现场可编程门阵列(fpga)。
48.以上所述的具体实施方式对本发明的技术方案和有益效果进行了详细说明,应理解的是以上所述仅为本发明的最优选实施例,并不用于限制本发明,凡在本发明的原则范围内所做的任何修改、补充和等同替换等,均应包含在本发明的保护范围之内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1