用于诱发单核细胞免疫应答的重组LAG-3或其衍生物的应用的制作方法
用于诱发单核细胞免疫应答的重组lag-3或其衍生物的应用
1.本技术是申请日为2016年4月11日、申请号为“201610221687.0”、发明名称为“用于诱发单核细胞免疫应答的重组lag-3或其衍生物的应用”的中国专利申请的分案申请。原申请是申请日为2008年10月3日、申请号为“200880117476.6”、发明名称为“用于诱发单核细胞免疫应答的重组lag-3或其衍生物的应用”的中国专利申请的分案申请。
技术领域
2.本发明涉及重组lag-3或其衍生物的应用以促进单核细胞介导的免疫应答。
3.本发明使血液中单核细胞的数量增加。
4.本发明发现了多种应用,特别是在癌症免疫治疗中的新型治疗试剂的开发应用。
5.参考文献参见随附在说明书后面方括号[]中的参考文献。
背景技术:
[0006]
在人cd4
+
和cd8
+
活化的t细胞中以及在活化的nk细胞中表达的淋巴细胞活化基因3(hlag-3)编码503个氨基酸1型膜蛋白(lag-3)以及四个细胞外免疫球蛋白超家族(igsf)结构域[1]。克隆了小鼠淋巴细胞活化基因3(mlag-3)并且发现与hlag-3有大约70%的同源性,在细胞质内的氨基酸链中具有相同的富含脯氨酸结构。
[0007]
正如mhc ii类的天然高度亲和配体描述的,lag-3(cd223)已知在体外诱导单核细胞衍生的树突状细胞的成熟,并且在体内用作免疫治疗佐剂诱导cd41型辅助性t细胞反应和cd8t细胞反应[2]。关于lag-3和其用作免疫刺激剂的进一步信息可在triebele等人[1]、triebel等人[3]以及huard等人[4]的著作中找到。
[0008]
可溶性lag-3的一些形式能够与mhc ii类分子结合并且能够诱导树突状细胞成熟并迁移至次级淋巴器官,在次级淋巴器官中它们能够启动导致肿瘤排斥的原态cd4-辅助和cd8细胞毒性t细胞[5]。
[0009]
最近,重组可溶性人lag-3ig融合蛋白显示在先天性免疫应答和获得性免疫应答中均能激活大范围的效应器细胞,例如诱导单核细胞-巨噬细胞分泌细胞因子/趋化因子[6]。
[0010]
单核细胞由来自称为成单核细胞的造血干细胞前体的骨髓生成。它们在血液中构成了3%-8%之间的白细胞。单核细胞在血流中循环约24小时(8小时的半衰期),随后通常进入全身组织中。在组织中,单核细胞成熟为巨噬细胞、上皮状细胞或抗原提呈细胞(apcs,例如树突状细胞)。单核细胞负责体内外来物质的吞噬(吸收)。单核细胞能够使用中间(调理作用)蛋白例如包被病原体的抗体或补体,以及通过经识别病原体的模式识别受体直接与病原体结合,从而进行吞噬作用。单核细胞还能够通过抗体杀死感染的宿主细胞,称为抗体依赖性细胞介导的细胞毒性(adcc)。由于它们的分泌作用和吞噬作用特性,单核细胞-巨噬细胞存在于非特异性和特异性免疫应答中。
[0011]
膜标记物的研究允许识别单核细胞群体,无论是成熟的或未成熟的、营养缺陷的或非营养缺陷的。存在于单核细胞膜(成熟的或未成熟的)上的分子几乎总是非特异性的而
是与以下活性相对应:
[0012]-igg的fc片段的受体(cd16、cd32、cd64),
[0013]-ige的fc片段的受体(cd23),
[0014]-补体片段的受体(cd11b,cd21/cd35),
[0015]-白细胞粘附蛋白(cd11a,cd11c),
[0016]-促进与革兰氏细菌的lps结合的蛋白(cd14),
[0017]-具有酪氨酸磷酸酶活性的蛋白(cd45)。
技术实现要素:
[0018]
目前,本发明的发明人完全意外地发现了当接种至高度恶性的肿瘤患者时人lag-3或其衍生物,例如转移性乳腺癌(mbc)或转移性肾透明细胞癌(mrcc)患者体内时诱导单核细胞依赖性的强效免疫力。
[0019]
所述诱导的免疫力通过血液中单核细胞计数的显著增加表现自身。
[0020]
该结果通过多次将lag-3或其衍生物施入接受免疫治疗或化学免疫治疗的患者体内的方式来获得。
[0021]
该结果相当令人吃惊,因为在与单核细胞结合和单核细胞活化之后的单核细胞扩增是非预期的。事实上,单核细胞是结束分化的造血细胞并且不能增殖。它们能够作为单核细胞或在不同细胞因子的影响下朝着巨噬细胞或树突状细胞分化而停留在血液里,直至它们死亡。因此,可以相信在不受以下理论的限制下涉及的作用机理可以是针对存在于骨髓中的造血前体细胞(在前单核细胞阶段之前)的增殖信号,或者是成熟循环单核细胞的半衰期或停留时间的增加。
[0022]
因此,本发明涉及在制备用于治疗感染性疾病或癌症的诱导单核细胞数量增加的药物中诱发单核细胞介导的免疫应答的重组lag-3或其衍生物的应用。
[0023]
从本发明意义上而言,“lag-3的衍生物”是指lag-3的突变体、变型或片段,假设它们保持与mhc ii类分子结合的lag-3的能力。
[0024]
因此,可使用lag-3的以下形式:
[0025]-全部lag-3蛋白;
[0026]-由四个免疫球蛋白细胞外结构域中的至少一个所组成的其可溶性多肽片段,即在法国专利申请fr9000126中公开的、由从lag-3序列的第23位氨基酸延伸至第448位氨基酸的细胞外区域组成的lag-3的可溶性部分;
[0027]-基本上由所有的第一个和第二个结构域组成的lag-3的片段;
[0028]-基本上由所有的第一个和第二个结构域或者所有四个结构域组成的lag-3的片段,例如在wo95/30750中定义的;
[0029]-可溶性lag-3的突变形式或者包含d1和d2细胞外结构域并且由以下位点的氨基酸置换组成的其片段:
[0030]
*在以下位点之一的氨基酸置换:
[0031]
73位,arg被glu置换;
[0032]
75位,arg被ala或glu置换;
[0033]
76位,arg被glu置换;
[0034]
或者两个或多个这些置换的组合;
[0035]
*在以下位点之一的氨基酸置换:
[0036]
30位,asp被ala置换;
[0037]
56位,his被ala置换;
[0038]
77位,tyr被phe置换;
[0039]
88位,arg被ala置换;
[0040]
103位,arg被ala置换;
[0041]
109位,asp被glu置换;
[0042]
115位,arg被ala置换;
[0043]
或者54位和66位之间包含的区域的缺失;
[0044]
或者两个或多个这些置换的组合。
[0045]
huard等人(proc.natl.acad.sci.usa,11:5744-5749,1997)描述了这些突变体。
[0046]-由含d1、d2和d3的可溶性52kda蛋白组成的lag-3的生理变型。
[0047]-重组可溶性人lag-3ig融合蛋白(imp321),一种在采用质粒转染的中国仓鼠卵巢细胞中生产的200kda二聚体,该质粒编码与人igg1fc融合的hlag-3的细胞外结构域。
[0048]
从本发明意义上而言,“药物”是指有效多剂量的重组lag-3蛋白或其衍生物。
[0049]
从本发明意义上而言,“有效多剂量的重组lag-3蛋白或其衍生物”是指允许每一至几周施用一剂重组lag-3蛋白或其衍生物,持续至少12周,优选地持续至少24周,由13天
±
2天停药间隔期所隔开的制剂。优选地,施药为每两周方案。
[0050]
从本发明意义上而言,“一剂重组lag-3蛋白或其衍生物”是指允许一次施药在0.25~30mg范围内,优选地1~6.25mg,更优选地6~30mg,例如,向体重指数(体重/身高2)在18~30kg/m2范围内的患者根据需要施用大约1.25mg的重组lag-3蛋白或其衍生物。
[0051]
通过将它们进行全身性接种例如作为皮下、肌肉或静脉注射,优选地作为皮下注射,以游离形式例如以溶液形式施用重组lag-3蛋白或其衍生物。
[0052]
所述重组lag-3蛋白或其衍生物还可以进行配制,以便允许与具有抗癌或抗感染疾病免疫治疗或化学治疗特性的化合物一起施用。
[0053]
从本发明意义上而言,“与化合物一起施用”是指在施用所述化合物之前、过程中或者之后施用重组lag-3蛋白或其衍生物。
[0054]
从本发明意义上而言,“具有抗癌或抗感染疾病化学治疗特性的化合物”是指,例如选自紫杉醇类(紫杉醇和多西紫杉醇)、吉西他滨和蒽环类(阿霉素)的化疗试剂或者抗病毒试剂例如利巴韦林。
[0055]
在本发明的具体实施例中,在第一次施用具有抗癌或抗感染疾病化学治疗特性的细胞毒性化合物之后,给患者施用重组lag-3蛋白或其衍生物。
[0056]
优选地,在施用具有抗癌或抗感染疾病化学治疗特性的细胞毒性化合物之后12~96小时,给患者施用重组lag-3蛋白或其衍生物。
[0057]
在另一实施例中,在第一次施用具有抗癌或抗感染疾病化学治疗特性的细胞毒性化合物之后一或两天,给患者施用重组lag-3蛋白或其衍生物。
[0058]
在本发明的另一具体实施例中,同时、单独或序贯地施用重组lag-3蛋白或其衍生物和具有抗癌或抗感染疾病化学治疗特性的细胞毒性化合物。
[0059]
优选地,在本发明的该具体实施例中,施用重组lag-3蛋白或其衍生物至少6次,例如7次、10次,12次或更多。
[0060]
优选地,在本发明的该具体实施例中,按照每两周方案施用重组lag-3蛋白或其衍生物。
[0061]
优选地,以包含0.25~30mg之间的剂量,最终以包含6~30mg之间的剂量、最终以包含8~25mg之间的剂量、最终以包含介于12~20mg之间的剂量施用重组lag-3蛋白或其衍生物。
[0062]
从本发明意义上而言,“具有抗癌或抗感染疾病化学治疗特性的化合物”也指,例如选自由通过adcc(抗体依赖性细胞毒性)杀死肿瘤细胞的治疗抗体的化合物组成的组,以及其混合物,优选地选自由利妥昔单抗、西妥昔单抗、依决洛单抗和曲妥珠单抗组成的组。
[0063]
在本发明的具有实施例中,将重组lag-3蛋白或其衍生物同时、单独或序贯地施予患者。
[0064]
优选地,在本发明的具有实施例中,重组lag-3蛋白或其衍生物与治疗抗体在同一天施用。
[0065]
本发明还涉及试剂盒,即包含用于同时、单独或序贯使用的重组lag-3蛋白或其衍生物与治疗抗体的组合制剂。
[0066]
优选地,该试剂盒包含重组lag-3蛋白或其衍生物和选自由利妥昔单抗、西妥昔单抗、依决洛单抗和曲妥珠单抗组成的组的治疗抗体。
[0067]
优选地,本发明的试剂盒包含重组lag-3蛋白或其衍生物和利妥昔单抗。
[0068]
本发明的试剂盒中,由于两种组分之间的协同细胞毒性作用,重组lag-3蛋白或其衍生物和治疗抗体形成功能统一体。这种效应是一种新的联合效应,因为在单独施用两种组分时不产生与作为组合制剂施用时相同的效应。
[0069]
本发明还涉及试剂盒,即包含重组lag-3蛋白或其衍生物和具有抗癌或抗感染疾病化学治疗特性的组合制剂,用于同时、单独或序贯使用。
[0070]
优选地,本发明的试剂盒包含重组lag-3蛋白或其衍生物和选自由紫杉醇类(紫杉醇和多西紫杉醇)、吉西他滨和蒽环类(阿霉素)组成的组的具有抗癌或抗感染疾病化学治疗特性的化合物。
[0071]
本发明还涉及用于治疗涉及单核细胞介导的免疫应答的病理状态的方法,包括根据患者的需要,向其施用如上定义的药物。
[0072]
从本发明意义上而言,“涉及单核细胞介导的免疫应答的病理状态”是指病毒感染性疾病、寄生感染性疾病、细菌感染性疾病、以及癌症。
[0073]
通过以下给出的非限制性实例,本发明的其他优点对于本领域的技术人员来说也可以是显而易见的,并通过附图示出。
附图说明
[0074]
图1表示来自转移性乳腺癌患者的pbmc中单核细胞(即cd14
+
cd45
+
细胞)的荧光激活细胞分选(facs)分析。
[0075]
图2表示来自转移性乳腺癌患者的新鲜全血中单核细胞(即cd14
+
cd45
+
细胞)的荧光激活细胞分选(facs)分析。
[0076]
图3表示来自转移性肾细胞癌患者的新鲜全血中单核细胞(即cd14
+
cd45
+
细胞)的荧光激活细胞分选(facs)分析。
[0077]
图4表示来自转移性乳腺癌患者的新鲜全血中单核细胞(即cd14
+
cd45
+
细胞)的荧光激活细胞分选(facs)分析。
[0078]
图5表示在转移性肾细胞癌患者血浆中通过elisa法测定的imp321的药代动力学曲线。
[0079]
图6表示用利妥昔单抗和/或imp321在不同条件下培养的pbmc的流式细胞仪分析。
具体实施方式
[0080]
实施例1:使用低imp321剂量在转移性乳腺癌(mbc)患者中单核细胞的增加
[0081]
接受已知诱导肿瘤细胞吞噬作用的5例mbc患者,在每两周一次的化学治疗之后1-2天分别接受一剂皮下注射imp321,剂量为0.25mg,持续24周,通过14天的停药间隔期隔开。
[0082]
在最后一次注射imp321(即,观察产品的持续性免疫调节效应)后14天、在3个月(第85天)和6个月(第170天)采集每例患者的血液样品置于肝素锂采血管(vacutainer;bd biosciences)中。使用leucosep管(greiner bio-one)在ficoll-paque梯度(pharmacia)上分离pbmc,并立即使用。
[0083]
在所述新鲜pbmc样品(因为单核细胞对冷冻敏感)中,通过荧光激活细胞分选(facs)法分析单核细胞数量的增加,并与在imp321施用(第1天)之前采集的基于新鲜pbmc样品进行的单核细胞计数进行比较。
[0084]
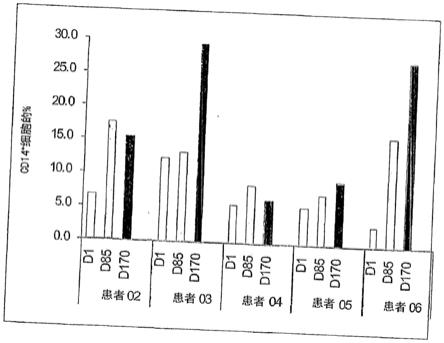
结果见图1。
[0085]
结果表明,在这种低imp321剂量临床方案下,单核细胞计数平均增加2.5倍(在3个月,第85天)和3.5倍(在6个月,第170天)。
[0086]
为了证实上述结果,采用了更加直接和很可能更加准确的方法,该方法通过首先测定采用稀释的荧光微珠进行分析的血液的准确体积并且随后计数存在于该全血量中的门控cd45
+
(白细胞)中的cd14
+
细胞(即单核细胞)的数量在体外直接定量全血细胞中单核细胞的数量(即未事先在ficoll梯度上纯化的pbmc)。
[0087]
结果见图2。
[0088]
结果表明,当以低剂量(0.25mg)给予imp321持续很长的时间,即6个月,注射12次时,单核细胞计数在第170天平均增加44倍(在第85天为2.8倍),表明靶向的mhc ii
+
类单核细胞样造血细胞的强而直接的刺激作用。
[0089]
实施例2:使用高imp321剂量在转移性肾透明细胞癌(mrcc)患者中单核细胞的增加3例mrcc患者分别接受一次皮下注射imp321,剂量为6.25mg,每两周一次,持续12周,通过14天的停药间隔期隔开。
[0090]
采用如上所述的方法,在最后一次注射imp321之后14天(即,观察产品的持续性免疫调节效应)、在2个月(第57天)和3个月(第85天),采集每例患者的血液样品,并立即使用。
[0091]
在新鲜血液样品中(因为单核细胞对冷冻敏感),通过facs分析cd14
+
cd45
+
细胞的扩增,并与基于在施用imp321(第1天)之前采集的新鲜血液样品进行的单核细胞计数进行比较。
[0092]
结果见图3。
[0093]
结果表明,采用该种高imp321剂量临床方案,单核细胞计数平均增加2倍(在3个月,第85天),在该临床方案中,患者仅接受6次注射。
[0094]
实施例3:在接受紫杉醇和imp321剂量的转移性乳腺癌患者中单核细胞的增加
[0095]
在28天疗程的第1、8和15天接受作为转移性乳腺癌6个疗程紫杉醇(静脉注射给予80mg/m2)的一线化疗的患者,在每个28疗程的第2和16天接受皮下注射imp3211-30mg。或者在第3或17天施用imp321。
[0096]
因此,每例患者接受了每周1次紫杉醇和12次皮下注射imp321的标准6个月疗程,在每两周方案中施用紫杉醇后1至2天给予每次注射。
[0097]
与第1天比较,在最后一次注射后14天,在3个月(第85天)和6个月(第170天)通过荧光激活细胞分选(facs)法分析每微升新鲜血液中绝对单核细胞计数的增加。
[0098]
在注射低剂量imp321(1.25mg)的患者中获得的结果见图4。
[0099]
这些数据表明,在大多数患者(如果不是全部)中1.25mg的剂量(图4)诱导血液中单核细胞亚群库的扩增。
[0100]
预计imp321的最佳剂量方案将是介于6和30mg/注射之间。
[0101]
基于在转移性肾细胞癌患者中获得的药代动力学数据结果(图5),这些剂量已经表明是安全的并且给出可接受的全身暴露量。在接受大于6mg的imp321剂量注射的患者中,在皮下注射后至少24小时可获得高于1ng/ml的imp321的血液浓度(图5)。
[0102]
实施例4:接受吉西他滨和imp321剂量的晚期胰腺癌患者的治疗
[0103]
在28天疗程的第1、8和15天接受作为晚期胰腺癌6个疗程标准吉西他滨(30分钟内静脉注射1mg/m2)的一线化疗的患者(或者不符合外科手术移除肿瘤的患者),在每个28疗程的第2和16天另外接受6至30mg皮下注射imp321。或者,在第3或17天施用imp321。
[0104]
因此,每例患者接受了吉西他滨和12次皮下注射imp321的标准6个月疗程,在每两周方案中吉西他滨施用后1至2天给予每次注射。
[0105]
如实施例1所述的方法,通过荧光激活细胞分选(facs)法分析单核细胞的数量。
[0106]
实施例5:通过低剂量imp321诱导利妥昔单抗介导的adcc的增加
[0107]
首先,将pbmc与il-2(100u/ml),含或不含imp321(浓度为0μg/ml、0.03μg/ml或0.1μg/m1)一起孵育40个小时。然后,在靶细胞(即人cd20
+
raji b细胞)存在下,将pbmc与增加浓度的利妥昔单抗(0、0.5和5μg/ml)一起孵育。
[0108]
首先采用cfse(羧基荧光素琥珀酰亚胺酯)标记raji细胞,在添加0、0.5和5μg/ml的利妥昔单抗的培养基中孵育并与效应器细胞以效应器-靶细胞25:1的比率,在37℃下共培养6小时。
[0109]
然后,将细胞与7-aad(7-氨基-放线菌素-d)一起在冰上孵育15min并通过流式细胞仪进行分析以确定死亡的cfse
+
7-aad
+
raji靶细胞的百分比(即细胞毒性%)。
[0110]
结果见图6。
[0111]
增加利妥昔单抗的浓度增加了细胞毒性的百分比,清楚地表明剂量依赖性adcc活性。
[0112]
当添加0.03或0.1μg/ml imp321时,细胞毒性的比例大大提高。例如,在0.1μg/ml imp321存在下,采用0.5μg/ml利妥昔单抗观察到30%的细胞毒性,该30%细胞毒性高于在缺乏imp321时采用5μg/ml利妥昔单抗获得的25%细胞毒性值。
[0113]
因此,添加0.1μg/ml imp321可能具有10-15倍的利妥昔单抗活性,因为当添加低剂量imp321(0.1μg/m1)时采用小于10倍的抗体获得优良的细胞毒性。
[0114]
这些数据显示利妥昔单抗和imp321之间的协同作用。
[0115]
本技术还涉及以下实施方案:
[0116]
1.一种在制备用于治疗感染性疾病或癌症的诱导单核细胞数量增加的药物中诱发单核细胞介导的免疫应答的重组lag-3或其衍生物的用途。
[0117]
2.根据实施方案1的用途,其中,所述药物由有效剂量的重组lag-3蛋白或其衍生物组成。
[0118]
3.根据实施方案2的用途,其中,配制所述剂量的重组lag-3蛋白或其衍生物以便允许每1至几周施用一剂量,持续至少12周,优选地持续至少24周,通过13天
±
2天停药间隔期隔开。
[0119]
4.根据实施方案2或3的用途,其中,配制所述剂量的重组lag-3蛋白或其衍生物以便允许向体重指数(体重/身高2)在18~30kg/m2范围内的患者根据其需要皮下或静脉施用范围为0.25~30mg,优选地为6~30mg的重组lag-3蛋白或其衍生物。
[0120]
5.根据实施方案2~4中任一项的用途,其中,配制所述剂量的重组lag-3蛋白或其衍生物以便允许与具有抗癌或者抗感染疾病免疫治疗或者化学治疗特性的化合物一起施用。
[0121]
6.根据实施方案5的用途,其中,重组lag-3蛋白或其衍生物的剂量包含0.25~30mg,优选地6~30mg的所述重组lag-3蛋白或其衍生物。
[0122]
7.根据实施方案5或6的用途,其中,所述化合物选白化疗试剂。
[0123]
8.根据实施方案7的用途,其中,所述化疗试剂选自由例如紫杉醇和多西紫杉醇的紫杉醇类,例如阿霉素的蒽环类,以及吉西他滨组成的组。
[0124]
9.根据实施方案5或6的用途,其中,所述化合物选自由通过adcc(抗体-依赖性细胞-介导的细胞毒性)杀死肿瘤细胞的治疗抗体、以及其混合物组成的组。
[0125]
10.根据实施方案9的用途,其中,所述治疗抗体选自由利妥昔单抗、西妥昔单抗、依决洛单抗和曲妥珠单抗组成的组。
[0126]
11.试剂盒,包含重组lag-3蛋白或其衍生物和如实施方案9或10中所述的治疗抗体,用于同时、单独或序贯使用。
[0127]
12.试剂盒,包含重组lag-3蛋白或其衍生物和如实施方案7或8中所述的具有抗癌化学治疗特性的化合物,用于同时、单独或序贯使用。
[0128]
参考文献
[0129]
[1]triebel et al.,j.exp.med.,171:1393-1405,1990
[0130]
[2]brignone et al.,j.immune based ther immunotherapies,5:5,2007
[0131]
[3]triebel et al.,trends immunol.,24:619-622,2003
[0132]
[4]huard et al.,proc.natl.acad.sci.usa,94:5744-5749,1997
[0133]
[5]prigent et al.,eur.j.immunol.,29:3867-3876,1999
[0134]
[6]brignone et al.,j.immunol.,179:4202-4211,2007
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1