一种可用于肌肉注射的20(S)-PPD白蛋白纳米囊及其制备方法和应用与流程
一种可用于肌肉注射的20(s)-ppd白蛋白纳米囊及其制备方法和应用
技术领域
1.本发明涉及医药技术领域,具体涉及一种可用于肌肉注射的20(s)-ppd 白蛋白纳米囊及其制备方法和应用。
背景技术:
2.20(s)-原人参二醇(20(s)-protopanaxadiol,简称20(s)-ppd)主要来源于人参、西洋参、三七等五加科植物,为原人参二醇型皂苷的苷元。 20(s)-ppd具有抗肿瘤、抗炎、抗氧化、抗抑郁、提高人体免疫力等诸多药理活性,对中枢神经系统、心血管系统、生殖功能、生物代谢、免疫功能及肾功能均有重要影响。近年来,研究发现,20(s)-ppd在抗肿瘤方面,能够诱导肿瘤细胞发生凋亡,阻止肿瘤细胞的生长(李秋妍,王浩丞,彭瑶,任德志,朱文斌,王小龙,于海涛,张春晶.原人参二醇对非小细胞肺癌的抑制作用及机制[j].中国临床药理学杂志,2020,36(22):3657-3660);在中枢神经系统方面,能够通过升高去甲肾上腺素(na)、hav和5-羟色胺(5-ht) 水平,发挥抗抑郁的作用(杨红艳,龚韦凡,李竣,张华林.抗抑郁20(s)
ꢀ‑
原人参二醇型人参皂苷成分分析[j].现代食品科技,2018,34(05):251-256);同时,20(s)-ppd能够激活体内源性凝血系统,影响体内血小板和红细胞参数,促进血浆中纤维蛋白原生成,通过影响钙离子和camp信号通路,增加血小板ca
2+
内流、cd62p释放和促进pac-1的表达,诱导血小板聚集,以止血(宿文杰,张玉尧,李荣森,王隶书,徐云凤,张鹤.20(s)-原人参二醇止血作用及其机制[j].中成药,2021,43(03):605-612)。
[0003]
20(s)-ppd为亲脂性化合物,难溶于水,口服生物利用度低,半衰期短,其剂型开发受到限制,限制了其在临床上的使用。陈晨采用反溶剂法制备出了稳定的原人参二醇纳米混悬液冻干制剂,但制剂载药量较低,且该制备方法不易放大生产(陈晨,孙倩.原人参二醇纳米混悬液体外含量测定及冻干保护剂的研究[j].辽宁化工,2020,49(02):140-143)。李之韬等将原人参二醇制备成纳米混悬剂,与原人参二醇原料药相比纳米混悬剂能显著改善原人参二醇的肠道吸收,但此制剂采用溶剂蒸发法制备,虽提高了原人参二醇的在体肠吸收,具有良好的应用潜能,但该制备方法不易放大生产(李之韬,王向涛,郑欢,韩美华.原人参二醇纳米混悬剂的大鼠在体肠吸收研究[j].药物评价研究,2015,38(02):175-179)。金鑫等将原人参二醇制成脂质立方液晶纳米粒,口服给药相对生物利用度是原料药的1.66倍,口服相对生物利用度仍较低(金鑫,张振海,孙娥,刘其媛,贾晓斌.原人参二醇脂质立方液晶纳米粒在大鼠体内的药动学研究[j].中国中药杂志,2013,38(02):263-268)。陈玉玺等制得了表面光滑、流动性好、粒径均一、具有一定缓释作用的20(s)
ꢀ‑
ppd微球,其缓释作用有助于持续发挥作用,提高药效,但未对其体内释药性能进行研究(陈玉玺,王冰,浦益琼,蔡贞贞,张彤.20(s)-原人参二醇聚乳酸-羟基乙酸缓释微球的制备[j].中国实验方剂学杂志,2013,19 (06):4-7)。
[0004]
专利cn 2014100095849(一种20(s)-原人参二醇纳米粒及其制备方法)采用超声-沉淀联合法制得了性质稳定,处方组成简单的20(s)-原人参二醇纳米粒,但其口服生物利
用度与原料药口服生物利用度相比仅仅提高了3.48倍,且制备工艺不易于放大生产。
[0005]
专利cn2011101005738(20s-原人参二醇β-环糊精包合物制备及其医药用途和组合物)制备了一种20(s)-原人参二醇的β-环糊精包合物,其在一定程度上提高了20(s)-ppd的口服生物利用度,但专利中所述三种制备工艺,研磨法、超声法、饱和水溶液法制备时间均较长,不适合放大生产。
[0006]
专利cn 2004100021095(抗肿瘤的原人参二醇注射剂及其制备方法)原人参二醇注射剂制备时需用有机溶媒或使用较大量的增溶剂,如聚氧乙烯蓖麻油等,此类表面活性剂使用后病人易出现过敏反应、呼吸困难等不良反应。
[0007]
上述专利中公开了多种不同剂型的20(s)-ppd制剂,但一些口服制剂仍存在一定程度的首过效应,生物利用度仍较低,且上述多个专利中尚未陈述制剂的药动学数据及有益的药效数据,无法考证进一步开发生产的可行性,仍有诸多问题需进一步改善,故仍需一种更优制剂。
技术实现要素:
[0008]
本发明的目的在于提供一种可用于肌肉注射的20(s)-ppd白蛋白纳米囊及其制备方法和应用。本发明所述纳米囊组成简单,载药量高,稳定性好,药效显著,能有效解决20(s)-ppd的体内吸收利用度低的问题。
[0009]
本发明提供了一种用于肌肉注射的20(s)-ppd白蛋白纳米囊,所述纳米囊的制备方法包括以下步骤:
[0010]
将20(s)-ppd作为纳米囊囊心,与有机溶剂混合,得到油相;
[0011]
将白蛋白作为纳米囊囊材,与水混合,得到水相;
[0012]
将油相和水相混合,进行乳化,去除有机溶剂,得到20(s)-ppd白蛋白纳米囊;
[0013]
所述白蛋白在水相中的质量百分含量为1~10%;所述20(s)-ppd和白蛋白的质量比为1:(1~10);所述油相和水相的体积比为(1~50):100。
[0014]
优选的是,所述有机溶剂包括二氯甲烷、三氯甲烷、乙酸乙酯、无水乙醇和苯甲醇中的一种或两种以上。
[0015]
优选的是,所述白蛋白包括人血清白蛋白(hsa)和/或牛血清白蛋白 (bsa)。
[0016]
优选的是,所述纳米囊的剂型包括冻干制剂。
[0017]
本发明还提供了上述技术方案所述纳米囊的制备方法,包括以下步骤:
[0018]
将20(s)-ppd作为纳米囊囊心,与有机溶剂混合,得到油相;
[0019]
将白蛋白作为纳米囊囊材,与水混合,得到水相;
[0020]
将油相和水相混合,进行乳化,去除有机溶剂,得到20(s)-ppd白蛋白纳米囊;
[0021]
所述白蛋白在水相中的质量百分含量为1~10%;所述20(s)-ppd和白蛋白的质量比为1:(1~10);所述油相和水相的体积比为(1~50):100。
[0022]
优选的是,所述乳化的方法包括搅拌、超声、剪切和高压均质中的一种或两种以上。
[0023]
优选的是,所述乳化的方法包括高速剪切和高压均质;所述乳化的方法包括以下步骤:以5000~20000rpm的转速高速剪切1~10min,然后以 200~1000bar的压力进行高压均质,所述高压均质的循环次数为2~10次。
[0024]
优选的是,当所述纳米囊为冻干制剂时,冻干的条件包括:预冻阶段:0.5~4h从室温降至-40℃,-40℃预冻维持2~8h;抽真空至20~60pa并维持30~60min;升华阶段:1~4h升温至-20℃并维持1~5h,1~4h升温至-10℃并维持1~5h,1~4h升温至0℃并维持1~5h;解析干燥:1~4h升温至20℃,维持1~4h。
[0025]
本发明还提供了上述技术方案所述的纳米囊或上述技术方案所述制备方法制备得到的纳米囊在制备免疫增强药物中的应用,所述免疫增强药物能够增加白细胞数量。
[0026]
本发明还提供了上述技术方案所述的纳米囊或上述技术方案所述制备方法制备得到的纳米囊在制备抗肿瘤药物或与其它抗肿瘤药物联合应用的药物中的应用。
[0027]
本发明提供了一种可用于肌肉注射的20(s)-ppd白蛋白纳米囊。本发明所述纳米囊处方组成简单,载药量高,稳定性好,肌肉注射绝对生物利用度高,约达95%。本发明所述纳米囊经肌肉注射后,可均衡的升高血液中各类白细胞数量,进一步以用于肿瘤治疗过程中化疗药物使用引起的骨髓抑制的治疗与预防。同时单独使用及与其他抗肿瘤类药物联用均具有显著的抗肿瘤疗效。
[0028]
目前,国内外尚未有报道公开过可供肌内注射的20(s)-ppd白蛋白纳米囊。本发明制备出一种可用于肌肉注射的20(s)-ppd白蛋白纳米囊,肌肉注射绝对生物利用度高,药效显著。试验结果表明,本发明所述纳米囊对环磷酰胺诱导的免疫抑制小鼠白细胞减少症具有显著药效,其可均衡的升高血液中各类白细胞数量,进一步以用于肿瘤治疗过程中化疗药物使用引起的骨髓抑制的治疗与预防,此外,单独使用及与其他抗肿瘤类药物联用均具有显著的抗肿瘤疗效,可谓“一药双效”。本发明所制备的20(s)-ppd纳米囊中20(s)-ppd作为囊心以纳米级无定型物存在,白蛋白作为纳米囊囊材,正是这种独特的药物结构及肌肉注射这种给药方式使其具有了优越的生物利用度及独特的药效。
附图说明
[0029]
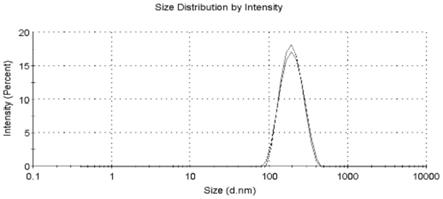
图1为本发明提供的20(s)-ppd白蛋白纳米囊粒径图;
[0030]
图2为本发明提供的20(s)-ppd白蛋白纳米囊电位图;
[0031]
图3为本发明提供的20(s)-ppd白蛋白纳米囊透射电镜(tem)图;
[0032]
图4为本发明提供的20(s)-ppd白蛋白纳米囊粉末x射线衍射(p-xrd)图;
[0033]
图5为本发明提供的20(s)-ppd白蛋白纳米囊累计释放曲线1;
[0034]
图6为本发明提供的20(s)-ppd白蛋白纳米囊累计释放曲线2;
[0035]
图7为本发明提供的药时曲线;
[0036]
图8为本发明提供的白细胞计数结果图;
[0037]
图9为本发明提供的嗜中性粒细胞计数结果图;
[0038]
图10为本发明提供的淋巴细胞计数结果图;
[0039]
图11为本发明提供的肌注20(s)-ppd白蛋白纳米囊对移植乳腺癌4t1balb/c小鼠的抗肿瘤药效实验(n=6);
[0040]
图12为本发明提供的移植乳腺癌balb/c小鼠各组肿瘤体积及相对肿瘤体积(rtv)的变化趋势(x
±
sd,n=6,*p《0.05vscontrol);
[0041]
图13为本发明提供的各组肿瘤重量(balb/c)(x,n=6,*p《0.05vscontrol);
[0042]
图14为本发明提供的白细胞计数结果图;
[0043]
图15为本发明提供的嗜中性粒细胞计数结果图;
[0044]
图16为本发明提供的淋巴细胞计数结果图。
具体实施方式
[0045]
本发明提供了一种用于肌肉注射的20(s)-ppd白蛋白纳米囊,所述纳米囊的制备方法包括以下步骤:
[0046]
将20(s)-ppd作为纳米囊囊心,与有机溶剂混合,得到油相;
[0047]
将白蛋白作为纳米囊囊材,与水混合,得到水相;
[0048]
将油相和水相混合,进行乳化,去除有机溶剂,得到20(s)-ppd白蛋白纳米囊;
[0049]
所述白蛋白在水相中的质量百分含量为1~10%;所述20(s)-ppd和白蛋白的质量比为1:(1~10);所述油相和水相的体积比为(1~50):100。
[0050]
本发明将20(s)-ppd作为纳米囊囊心,与有机溶剂混合,得到油相。本发明优选在无菌条件下进行本发明的纳米囊的制备。本发明对所述20(s)
ꢀ‑
ppd的来源没有特殊限定,采用本领域技术人员熟知的常规20(s)-ppd 市售产品即可。在本发明中,所述有机溶剂优选包括二氯甲烷、三氯甲烷、乙酸乙酯、无水乙醇和苯甲醇中的一种或两种以上。在本发明中,所述有机溶剂更优选为三氯甲烷和无水乙醇的混合物。在本发明中,当所述有机溶剂为三氯甲烷和无水乙醇的混合物时,无水乙醇和三氯甲烷的体积比优选为1: (1~10)。
[0051]
本发明将白蛋白作为纳米囊囊材,与水混合,得到水相。在本发明中,所述白蛋白在水相中的质量百分含量优选为1~10%,更优选为2~9%。在本发明中,所述白蛋白优选包括人血清白蛋白(hsa)和/或牛血清白蛋白 (bsa)。在本发明中,所述水优选为灭菌注射用水。
[0052]
得到油相和水相后,本发明将油相和水相混合,进行乳化,去除有机溶剂,得到20(s)-ppd白蛋白纳米囊。在本发明中,所述20(s)-ppd和白蛋白的质量比优选为1:(1~10),更优选为1:(2~9);所述油相和水相的体积比优选为(1~50):100,更优选为(1~40):100。在本发明中,所述乳化的温度优选为0~60℃,更优选为0~40℃。本发明所述乳化的方法优选包括搅拌、超声、剪切和高压均质中的一种或两种以上。在本发明中,所述乳化的方法更优选包括高速剪切和高压均质;具体的,所述乳化的方法更优选包括以下步骤:以5000~20000rpm的转速高速剪切1~10min,然后以200~1000 bar的压力进行高压均质,所述高压均质的循环次数为2~10次。在本发明中,所述高速剪切的转速更优选为8000~16000rpm,时间更优选为2~8min。在本发明中,所述高压均质的压力更优选为300~800bar,均质循环次数更优选为 4~8次。在本发明中,所述去除有机溶剂的方法优选包括常压去除(液中干燥法)或减压去除。
[0053]
在本发明中,所述纳米囊的剂型优选包括冻干制剂。在本发明中,当所述纳米囊为冻干制剂时,在去除有机溶剂后,本发明优选还包括冻干的工艺,冻干的条件优选包括:预冻阶段:0.5~4h从室温降至-40℃,-40℃预冻维持 2~8h;抽真空至20~60pa并维持30~60min;升华阶段:1~4h升温至-20℃并维持1~5h,1~4h升温至-10℃并维持1~5h,1~4h升温至0℃并维持1~5 h;解析干燥:1~4h升温至20℃,维持1~4h。
[0054]
在本发明中,所述纳米囊的平均粒径优选小于600nm,更优选小于300nm,24h累计释放量优选为60%~90%。本发明纳米囊制备条件的限定能够制备得到本技术纳米囊产
品,且保持较高的24h累计释放量和生物利用度。
[0055]
本发明所述20(s)-ppd白蛋白纳米囊粒径图如图1所示,电位图如图 2所示,透射电镜(tem)图如图3所示,粉末x射线衍射(p-xrd)图如图4所示。图1结果显示制剂的粒径约为250nm,pdi小于0.2,表明制剂均匀度良好。图2结果显示制剂的电位约为-35mv,表明制剂稳定性良好。图3图谱所示,20(s)-ppd白蛋白纳米囊大小均匀,成圆整、规则球形。图4p-xrd图谱所示,20(s)-ppd原料药图谱(a)中和物理混合物图谱(c)中的原料药均有很明显的特征衍射峰,表明药物是以晶体形式存在的,在20 (s)-ppd白蛋白纳米囊制剂图谱(d)中,无药物结晶峰,仅存在白蛋白特征衍射峰,说明药物在20(s)-ppd白蛋白纳米囊中以无定型存在。本发明所述20 (s)-ppd白蛋白纳米囊的优点如下:
[0056]
1)处方组成简单,制备工艺简便,载药量高;
[0057]
2)稳定性好:以冻干态贮存,大大提高药物和制剂的稳定性,同时,便于制剂的储存和运输;
[0058]
3)肌肉注射绝对生物利用度高,药效显著。
[0059]
本发明所述纳米囊经肌肉注射给药,与静脉注射给药途径相比,患者的依从性更高,本发明所制备的20(s)-ppd纳米囊中20(s)-ppd作为囊心以纳米级无定型物存在,白蛋白作为纳米囊囊材,形成与白蛋白结合型紫杉醇(abraxane)不同的制剂结构。
[0060]
本发明还提供了上述技术方案所述纳米囊的制备方法,包括以下步骤:
[0061]
将20(s)-ppd作为纳米囊囊心,与有机溶剂混合,得到油相;
[0062]
将白蛋白作为纳米囊囊材,与水混合,得到水相;
[0063]
将油相和水相混合,进行乳化,去除有机溶剂,得到20(s)-ppd白蛋白纳米囊;
[0064]
所述白蛋白在水相中的质量百分含量为1~10%;所述20(s)-ppd和白蛋白的质量比为1:(1~10);所述油相和水相的体积比为(1~50):100。
[0065]
本发明所述制备方法的具体条件优选如上文所述,在此不再赘述。
[0066]
本发明还提供了上述技术方案所述的纳米囊或上述技术方案所述制备方法制备得到的纳米囊在制备免疫增强药物中的应用,所述免疫增强药物能够增加白细胞数量,以用于肿瘤治疗过程中化疗药物使用引起的骨髓抑制的治疗与预防。在本发明中,所述免疫增强药物针对的优选是免疫抑制疾病,更优选为环磷酰胺诱导的免疫抑制疾病。在本发明中,所述白细胞优选包括嗜中性粒细胞和/或淋巴细胞。具体的,给药对环磷酰胺诱导的免疫抑制小鼠具有显著的升高血液白细胞数量的作用,主要为升高中性粒细胞和/或淋巴细胞。
[0067]
本发明还提供了上述技术方案所述的纳米囊或上述技术方案所述制备方法制备得到的纳米囊在制备抗肿瘤药物或与其它抗肿瘤药物联合应用的药物中的应用。在本发明中,所述肿瘤优选包括乳腺癌。在本发明中,所述其它抗肿瘤药物优选包括多西他赛。
[0068]
下面结合具体实施例对本发明所述的一种可用于肌肉注射的20(s)-ppd 白蛋白纳米囊及其制备方法和应用做进一步详细的介绍,本发明的技术方案包括但不限于以下实施例。
[0069]
实施例1
[0070]
实施例2~21中纳米囊均采用如下方法制备,具体工艺参数见各实施例。
[0071]
s1:称取处方量20(s)-ppd原料药溶于有机溶剂中,作为油相;
[0072]
s2:称取处方量hsa或bsa或两者的混合物溶解于灭菌注射用水中制成水相;
[0073]
s3:一定温度条件下,将油相快速注入水相中剪切乳化,形成初混悬液,将初混悬液转移至高压均质机中,高压均质,制得20(s)-ppd白蛋白纳米囊;
[0074]
s4:将所得20(s)-ppd白蛋白纳米囊常压或减压去除有机溶剂后灌装,半压塞,放于冻干机中进行冷冻干燥。
[0075]
s5:冷冻干燥结束后,压塞,出箱,加压铝盖包装贮存,既得20(s)
ꢀ‑
ppd白蛋白纳米囊冻干制剂。
[0076]
实施例2
[0077]
处方如表1。
[0078]
表1处方
[0079]
处方质量20(s)-ppd0.5ghsa2.5g无水乙醇5ml三氯甲烷15ml灭菌注射用水100ml
[0080]
工艺参数如表2。
[0081]
表2工艺参数
[0082]
剪切转速8000rpm/min剪切时间8min均质压力600bar均质次数8次
[0083]
冻干曲线如表3。
[0084]
表3冻干曲线
[0085][0086]
制备得到的20(s)-ppd白蛋白纳米囊平均粒径约为280nm,zeta电位大于-36mv,显微观察药物呈圆整球形。
[0087]
实施例3
[0088]
处方如表4。
[0089]
表4处方
[0090]
处方质量20(s)-ppd0.5ghsa2.5g无水乙醇3.33ml
三氯甲烷16.67ml灭菌注射用水100ml
[0091]
工艺参数如表5。
[0092]
表5工艺参数
[0093][0094][0095]
冻干曲线如表6。
[0096]
表6冻干曲线
[0097][0098]
制备得到的20(s)-ppd白蛋白纳米囊平均粒径约为280nm,zeta电位大于-36mv,显微观察药物呈圆整球形。
[0099]
实施例4
[0100]
处方如表7。
[0101]
表7处方
[0102]
处方质量20(s)-ppd0.5ghsa2.5g无水乙醇2.5ml三氯甲烷17.5ml灭菌注射用水100ml
[0103]
工艺参数如表8。
[0104]
表8工艺参数
[0105]
剪切转速12000rpm/min剪切时间5min均质压力600bar均质次数8次
[0106]
冻干曲线如表9。
[0107]
表9冻干曲线
[0108]
[0109]
制备得到的20(s)-ppd白蛋白纳米囊平均粒径约为250nm,zeta电位大于-35mv,显微观察药物呈圆整球形。
[0110]
实施例5
[0111]
处方如表10。
[0112]
表10处方
[0113][0114][0115]
工艺参数如表11。
[0116]
表11工艺参数
[0117]
剪切转速12000rpm/min剪切时间5min均质压力800bar均质次数8次
[0118]
冻干曲线如表12。
[0119]
表12冻干曲线
[0120][0121]
制备得到的20(s)-ppd白蛋白纳米囊平均粒径约为250nm,zeta电位大于-35mv,显微观察药物呈圆整球形。
[0122]
实施例6
[0123]
处方如表13。
[0124]
表13处方
[0125]
处方质量20(s)-ppd0.5gbsa3.5g无水乙醇4ml三氯甲烷16ml灭菌注射用水100ml
[0126]
工艺参数如表14。
[0127]
表14工艺参数
[0128]
剪切转速12000rpm/min剪切时间5min
均质压力800bar均质次数8次
[0129]
冻干曲线如表15。
[0130]
表15冻干曲线
[0131][0132]
制备得到的20(s)-ppd白蛋白纳米囊平均粒径约为250nm,zeta电位大于-37mv,显微观察药物呈圆整球形。
[0133]
实施例7
[0134]
处方如表16。
[0135]
表16处方
[0136]
处方质量20(s)-ppd0.5gbsa4.5g无水乙醇4ml三氯甲烷16ml灭菌注射用水100ml
[0137]
工艺参数如表17。
[0138]
表17工艺参数
[0139]
剪切转速12000rpm/min剪切时间5min均质压力800bar均质次数8次
[0140]
冻干曲线如表18。
[0141]
表18冻干曲线
[0142][0143]
制备得到的20(s)-ppd白蛋白纳米囊平均粒径约为250nm,zeta电位大于-37mv,显微观察药物呈圆整球形。
[0144]
实施例8
[0145]
处方如表19。
[0146]
表19处方
[0147]
处方质量
20(s)-ppd0.5gbsa2.5g无水乙醇2ml三氯甲烷8ml灭菌注射用水100ml
[0148]
工艺参数如表20。
[0149]
表20工艺参数
[0150]
剪切转速16000rpm/min剪切时间5min均质压力800bar均质次数8次
[0151]
冻干曲线如表21。
[0152]
表21冻干曲线
[0153][0154][0155]
制备得到的20(s)-ppd白蛋白纳米囊平均粒径约为250nm,zeta电位大于-40mv,显微观察药物呈圆整球形。
[0156]
实施例9
[0157]
处方如表22。
[0158]
表22处方
[0159]
处方质量20(s)-ppd0.5gbsa2.5g无水乙醇6ml三氯甲烷24ml灭菌注射用水100ml
[0160]
工艺参数如表23。
[0161]
表23工艺参数
[0162]
剪切转速16000rpm/min剪切时间5min均质压力800bar均质次数8次
[0163]
冻干曲线如表24。
[0164]
表24冻干曲线
[0165][0166]
制备得到的20(s)-ppd白蛋白纳米囊平均粒径约为250nm,zeta电位大于-40mv,显微观察药物呈圆整球形。
[0167]
实施例10
[0168]
处方如表25。
[0169]
表25处方
[0170]
处方质量20(s)-ppd0.5gbsa2.5g无水乙醇8ml三氯甲烷32ml灭菌注射用水100ml
[0171]
工艺参数如表26。
[0172]
表26工艺参数
[0173]
剪切转速16000rpm/min剪切时间5min均质压力800bar均质次数8次
[0174]
冻干曲线如表27。
[0175]
表27冻干曲线
[0176][0177]
制备得到的20(s)-ppd白蛋白纳米囊平均粒径约为250nm,zeta电位大于-40mv,显微观察药物呈圆整球形。
[0178]
实施例11
[0179]
处方如表28。
[0180]
表28处方
[0181]
处方质量20(s)-ppd1.0gbsa5.0g无水乙醇4ml三氯甲烷16ml
灭菌注射用水100ml
[0182]
工艺参数如表29。
[0183]
表29工艺参数
[0184]
剪切转速16000rpm/min剪切时间8min均质压力800bar均质次数8次
[0185]
冻干曲线如表30。
[0186]
表30冻干曲线
[0187][0188]
制备得到的20(s)-ppd白蛋白纳米囊平均粒径约为280nm,zeta电位大于-40mv,显微观察药物呈圆整球形。
[0189]
实施例12
[0190]
处方如表31。
[0191]
表31处方
[0192]
处方质量20(s)-ppd1.0gbsa5.0g无水乙醇4ml三氯甲烷16ml灭菌注射用水100ml
[0193]
工艺参数如表32。
[0194]
表32工艺参数
[0195]
剪切转速16000rpm/min剪切时间8min均质压力800bar均质次数8次
[0196]
冻干曲线如表33。
[0197]
表33冻干曲线
[0198][0199]
制备得到的20(s)-ppd白蛋白纳米囊平均粒径约为280nm,zeta电位大于-40mv,显
微观察药物呈圆整球形。
[0200]
实施例13
[0201]
处方如表34。
[0202]
表34处方
[0203]
处方质量20(s)-ppd1.0gbsa5.0g无水乙醇4ml三氯甲烷16ml灭菌注射用水100ml
[0204]
工艺参数如表35。
[0205]
表35工艺参数
[0206]
剪切转速16000rpm/min剪切时间8min均质压力800bar均质次数8次
[0207]
冻干曲线如表36。
[0208]
表36冻干曲线
[0209][0210]
制备得到的20(s)-ppd白蛋白纳米囊平均粒径约为280nm,zeta电位大于-40mv,显微观察药物呈圆整球形。
[0211]
实施例14
[0212]
处方如表37。
[0213]
表37处方
[0214]
处方质量20(s)-ppd0.5gbsa2.5g无水乙醇6ml二氯甲烷24ml灭菌注射用水100ml
[0215]
工艺参数如表38。
[0216]
表38工艺参数
[0217]
剪切转速15000rpm/min剪切时间5min
均质压力800bar均质次数8次
[0218]
冻干曲线如表39。
[0219]
表39冻干曲线
[0220][0221]
制备得到的20(s)-ppd白蛋白纳米囊平均粒径约为500nm,zeta电位大于-40mv,且显微观察有少量药物针晶存在。
[0222]
实施例15
[0223]
处方如表40。
[0224]
表40处方
[0225]
处方质量20(s)-ppd0.5gbsa2.5g无水乙醇6ml二氯甲烷36ml灭菌注射用水100ml
[0226]
工艺参数如表41。
[0227]
表41工艺参数
[0228]
剪切转速16000rpm/min剪切时间5min均质压力800bar均质次数8次
[0229]
冻干曲线如表42。
[0230]
表42冻干曲线
[0231][0232][0233]
制备得到的20(s)-ppd白蛋白纳米囊平均粒径约为500nm,zeta电位大于-40mv,显微观察有少量药物针晶存在。
[0234]
实施例16
[0235]
处方如表43。
[0236]
表43处方
[0237]
处方质量20(s)-ppd0.5gbsa2.5g苯甲醇6ml二氯甲烷30ml灭菌注射用水100ml
[0238]
工艺参数如表44。
[0239]
表44工艺参数
[0240]
剪切转速15000rpm/min剪切时间5min均质压力800bar均质次数8次
[0241]
冻干曲线如表45。
[0242]
表45冻干曲线
[0243][0244]
制备得到的20(s)-ppd白蛋白纳米囊平均粒径约为600nm,zeta电位大于-40mv,显微观察有少量药物针晶存在。
[0245]
实施例17
[0246]
处方如表46。
[0247]
表46处方
[0248]
处方质量20(s)-ppd0.5gbsa2.5g苯甲醇6ml二氯甲烷36ml灭菌注射用水100ml
[0249]
工艺参数如表47。
[0250]
表47工艺参数
[0251]
剪切转速16000rpm/min剪切时间5min均质压力800bar均质次数8次
[0252]
冻干曲线如表48。
[0253]
表48冻干曲线
[0254][0255]
制备得到的20(s)-ppd白蛋白纳米囊平均粒径约为600nm,zeta电位大于-40mv,显微观察有少量药物针晶存在。
[0256]
实施例18
[0257]
处方如表49。
[0258]
表49处方
[0259]
处方质量20(s)-ppd0.5gbsa3.0g无水乙醇10ml乙酸乙酯30ml灭菌注射用水100ml
[0260]
工艺参数如表50。
[0261]
表50工艺参数
[0262]
剪切转速16000rpm/min剪切时间6min均质压力800bar均质次数8次
[0263]
冻干曲线如表51。
[0264]
表51冻干曲线
[0265][0266]
制备得到的20(s)-ppd白蛋白纳米囊平均粒径约为500nm,zeta电位大于-40mv,显微观察有少量药物针晶存在。
[0267]
实施例19
[0268]
处方如表52。
[0269]
表52处方
[0270]
处方质量20(s)-ppd0.5gbsa3.5g无水乙醇10ml乙酸乙酯40ml
灭菌注射用水100ml
[0271]
工艺参数如表53。
[0272]
表53工艺参数
[0273]
剪切转速16000rpm/min剪切时间5min均质压力800bar均质次数8次
[0274]
冻干曲线如表54。
[0275]
表54冻干曲线
[0276][0277]
制备得到的20(s)-ppd白蛋白纳米囊平均粒径约为500nm,zeta电位大于-40mv,显微观察有少量药物针晶存在。
[0278]
实施例20
[0279]
处方如表55。
[0280]
表55处方
[0281]
处方质量20(s)-ppd0.5gbsa4.0g苯甲醇10ml乙酸乙酯40ml灭菌注射用水100ml
[0282]
工艺参数如表56。
[0283]
表56工艺参数
[0284]
剪切转速16000rpm/min剪切时间6min均质压力800bar均质次数8次
[0285]
冻干曲线如表57。
[0286]
表57冻干曲线
[0287][0288]
制备得到的20(s)-ppd白蛋白纳米囊平均粒径约为550nm,zeta电位大于-40mv,显
微观察有少量药物针晶存在。
[0289]
实施例21
[0290]
处方如表58。
[0291]
表58处方
[0292][0293][0294]
工艺参数如表59。
[0295]
表59工艺参数
[0296]
剪切转速16000rpm/min剪切时间5min均质压力800bar均质次数8次
[0297]
冻干曲线如表60。
[0298]
表60冻干曲线
[0299][0300]
制备得到的20(s)-ppd白蛋白纳米囊平均粒径约为550nm,zeta电位大于-40mv,显微观察有少量药物针晶存在。
[0301]
对比例1
[0302]
处方如表61。
[0303]
表61处方
[0304]
处方质量20(s)-ppd0.5gbsa4.0g丙酮35ml灭菌注射用水100ml
[0305]
工艺参数如表62。
[0306]
表62工艺参数
[0307]
剪切转速16000rpm/min剪切时间5min均质压力800bar均质次数8次
[0308]
油相水相经乳化后,20(s)-ppd析出,无法制备得到20(s)-ppd白蛋白纳米囊,未进一步制备冻干制剂。
[0309]
对比例2
[0310]
处方如表63。
[0311]
表63处方
[0312][0313][0314]
工艺参数如表64。
[0315]
表64工艺参数
[0316]
剪切转速16000rpm/min剪切时间5min均质压力800bar均质次数8次
[0317]
油相水相经乳化后,20(s)-ppd析出,无法制备得到20(s)-ppd白蛋白纳米囊,未进一步制备冻干制剂。
[0318]
应用例1
[0319]
本发明20(s)-ppd白蛋白纳米囊的体外释放试验(试验样品为实施例 4及实施例14所制备)
[0320]
试验方法:本试验采用扩散池法考察制剂的体外释放特性,体外释放结果如图5及图6所示。
[0321]
图5为20(s)-ppd白蛋白纳米囊(实施例4所制备)累计释放曲线,由图5可知,在体外累积释放研究中,20(s)-ppd白蛋白纳米囊在24h内累积释放量为90%。
[0322]
图6为20(s)-ppd白蛋白纳米囊(实施例14所制备)累计释放曲线,由图6可知,在体外累积释放研究中,20(s)-ppd白蛋白纳米囊在24h内累积释放量为65%。
[0323]
体外释放结果表明,药物的释放趋向于骨架型释药模式,具有一定的缓释作用。
[0324]
应用例2
[0325]
本发明进行大量试验,将20(s)-ppd制备成了多种剂型,对多种剂型进行药物代谢动力学研究,结果如下。
[0326]
20(s)-ppd不同剂型制剂大鼠体内药动学研究
[0327]
1、药代动力学参数表如表65所示:
[0328]
表65药代动力学参数表
[0329][0330][0331]
2、药时曲线
[0332]
药时曲线如图7所示。
[0333]
3、绝对生物利用度
[0334]
绝对生物利用度结果如表66所示。
[0335]
表66绝对生物利用度
[0336][0337]
本发明通过进行大量试验,将20(s)-ppd制备成了多种剂型,对多种剂型进行药物代谢动力学研究,所制备的20(s)-ppd油溶液、脂肪乳肌注绝对生物利用度仍很低,仅为13.09%、28.43%,均未达到预期效果。而本发明所制备的20(s)-ppd白蛋白纳米囊肌注绝对生物利用度显著提高,其中实施例4及实施例5所制备的20(s)-ppd白蛋白纳米囊肌注绝对生物利用度约达95%,而实施例14及实施例15所制备的20(s)-ppd白蛋白纳米囊肌注绝对生物利用度稍低,因此本实验优选更小粒径制剂。
[0338]
实验结果表明,更小粒径的20(s)-ppd白蛋白纳米囊制剂(实施例4 及实施例5所制备)肌肉注射后在大鼠体内的auc约为20(s)-ppd油溶液和的20(s)-ppd脂肪乳14倍和7倍,绝对生物利用度分别由20(s)-ppd 油溶液的13.09%、和20(s)-ppd脂肪乳的28.43%提高至约95%,生物利用度得到明显提高;cmax分别增加了约10倍和1.5倍,tmax也显著延长,
说明20(s)-ppd白蛋白纳米囊可延长达峰时间,维持平稳的血药浓度。依据实验数据及药时曲线分析,纳米囊制剂在体内的释药机制为:在释药前期表现为快速释放,这时血药浓度的贡献主要来自颗粒与组织液的直接接触并溶解;后期血药浓度下降是因为机体产生免疫反应,部分药物颗粒被巨噬细胞吞噬或包埋在肉芽组织中,无法持续暴露新的溶解表面,减缓药物释放,血药浓度趋于平稳。
[0339]
应用例3
[0340]
本发明20(s)-ppd白蛋白纳米囊的药效学研究试验,试验样品为实施例11所制备的20(s)-ppd白蛋白纳米囊。
[0341]
目的:探究20(s)-ppd白蛋白纳米囊对环磷酰胺诱导的免疫抑制小鼠的免疫增强作用。
[0342]
小鼠白细胞减少症模型建立
[0343]
小鼠一次性腹腔注射环磷酰胺150mg/kg,建立小数白细胞减少症模型。
[0344]
实验分组
[0345]
42只icr小鼠,雄性,随机分为7组,每组6只。
[0346]
空白组(不造模)、模型组(造模不给药)、阳性组(g-csf,50μg/kg,ip)、20(s)-ppd白蛋白纳米囊肌肉注射组(50mg/kg,im)、20(s)-ppd 纳米混悬液肌肉注射组(50mg/kg,im)、白蛋白肌肉注射组(50mg/kg,im)、 20(s)-ppd真溶液尾静脉注射(50mg/kg,iv)。
[0347]
实验方法
[0348]
药物先连续给药干预3天后造模,模型组、阳性药组在造模前不做干预,在造模后2d、4d、6d分别眼球后静脉丛取血,血球仪检测外周血象白细胞的变化。
[0349]
实验结果
[0350]
白细胞计数结果如图8所示。嗜中性粒细胞计数结果如图9所示。淋巴细胞计数结果如图10所示。
[0351]
实验结论
[0352]
实验结果表明,造模后6天,阳性药组、20(s)-ppd白蛋白纳米囊肌肉注射组与模型组比较,对环磷酰胺诱导的免疫抑制小鼠具有显著的升高血液白细胞数量的作用,主要为升高嗜中性粒细胞和/或淋巴细胞,且均有显著统计学差异。
[0353]
应用例4
[0354]
本发明20(s)-ppd白蛋白纳米囊的药效学研究试验,试验样品为实施例11所制备的20(s)-ppd白蛋白纳米囊。
[0355]
目的:探究20(s)-ppd白蛋白纳米囊抗肿瘤活性。
[0356]
实验方法
[0357]
建立4t1肿瘤模型
[0358]
将2x106个细胞重悬于0.1mlpbs中,并将该悬液皮下注射到balb/c 小鼠右侧腋下。等瘤体积至50-150mm3后随机分组,每天给药,持续给药2 到4周,每3天测量瘤体积及小鼠体重,观察小鼠给药后有无腹泻、发热、便血等不良反应,给药结束后,脱颈处死小鼠,剥取瘤块拍照记录肿瘤体积及小鼠重量,将肿瘤迅速放置-80℃保存;
[0359]
比较种瘤后balb/c小鼠给完药后肿瘤体积、肿瘤重量。
[0360]
实验分组
[0361]
18只balb/c小鼠,按肿瘤体积大小随机分为3组,每组6只。
[0362]
空白组、20(s)-ppd白蛋白纳米囊组(15mg/kg,im)、20(s)-ppd 白蛋白纳米囊组(40mg/kg,im)。
[0363]
实验结果
[0364]
肌注20(s)-ppd白蛋白纳米囊对移植乳腺癌4t1 balb/c小鼠抗肿瘤药效实验结果如图11。
[0365]
图11为肌注20(s)-ppd白蛋白纳米囊对移植乳腺癌4t1 balb/c小鼠的抗肿瘤药效实验(n=6)。
[0366]
移植乳腺癌4t1 balb/c小鼠各组肿瘤体积及相对肿瘤体积(rtv)的变化趋势如图12。
[0367]
图12为移植乳腺癌balb/c小鼠各组肿瘤体积及相对肿瘤体积(rtv) 的变化趋势(x
±
sd,n=6,*p《0.05 vs control)
[0368]
图11和图12实验结果表明,与同期control组相比,给药10天时,注射ptx注射液15mg/kg组的瘤体积与rtv均值均显著降低(p《0.05);给药 13天时,肌注20(s)-ppd白蛋白纳米囊40mg/kg组的瘤体积与rtv均值均显著降低(p《0.05)
[0369]
各组移植乳腺癌4t1 balb/c小鼠肿瘤重量结果如图13和表67所示。
[0370]
图13为各组肿瘤重量(balb/c)(x,n=6,*p《0.05 vs control)。
[0371]
表67肿瘤重量
[0372][0373]
图13和表67实验结果表明,移植乳腺癌balb/c小鼠给药组瘤重均明显低于模型组,显示了原人参二醇的抗肿瘤作用。
[0374]
总实验结论
[0375]
肌注20(s)-ppd白蛋白纳米囊对于移植瘤balb/c小鼠数据显示在给药10天时与control组出现显著差异,移植乳腺癌balb/c小鼠给药组瘤重均明显低于模型组,数据均显示了原人参二醇的抗肿瘤作用。
[0376]
应用例5
[0377]
本发明20(s)-ppd白蛋白纳米囊的药效学研究试验,试验样品为实施例11所制备的20(s)-ppd白蛋白纳米囊。
[0378]
目的:探究20(s)-ppd白蛋白纳米囊与多西他赛联用抗肿瘤活性。
[0379]
试验方法
[0380]
建立4t1肿瘤模型
[0381]
将2
×
106个细胞重悬于0.1ml pbs中,并将该悬液皮下注射到balb/c 小鼠右侧腋下。等瘤体积至50-150mm3后随机分组,每天给药,持续给药2 到4周,每3天测量瘤体积及小鼠体重,观察小鼠给药后有无腹泻、发热、便血等不良反应,给药结束后,脱颈处死小鼠,剥取瘤块拍照记录肿瘤体积及小鼠重量,将肿瘤迅速放置-80℃保存;
[0382]
比较种瘤后balb/c小鼠给完药后肿瘤重量。
[0383]
比较外周血象白细胞的变化,给药完成后,分别眼球后静脉丛取血,血球仪检测外周血象白细胞的变化。
[0384]
实验分组
[0385]
18只balb/c小鼠,按肿瘤体积大小随机分为3组,每组6只。
[0386]
模型组,多西他赛组(15mg/kg,iv),20(s)-ppd白蛋白纳米囊(20mg/kg, im)+多西他赛组(10mg/kg,iv)。
[0387]
实验结果
[0388]
各组移植乳腺癌4t1 balb/c小鼠肿瘤重量结果如表68。
[0389]
各组肿瘤重量(balb/c)(x,n=6,*p《0.05 vs control)。
[0390]
表68肿瘤重量
[0391]
组别瘤重(g)ircontrol2.066
±
0.608-多西他赛1.203
±
0.20146%20(s)-ppd白蛋白纳米囊+多西他赛1.056
±
0.34251%
[0392]
白细胞计数结果如图14;嗜中性粒细胞计数结果如图15;淋巴细胞计数结果如图16。
[0393]
实验结论
[0394]
实验结束,移植乳腺癌balb/c小鼠给药组瘤重均明显低于模型组。20 (s)-ppd白蛋白纳米囊与多西他赛联用较单独使用多西他赛具有更好的抑制肿瘤作用,且血液中白细胞数量较单独使用多西他赛降低程度更低,说明 ppd在治疗肿瘤的同时升高白细胞数量可谓“一药双效”。
[0395]
以上所述仅是本发明的优选实施方式,应当指出,对于本技术领域的普通技术人员来说,在不脱离本发明原理的前提下,还可以做出若干改进和润饰,这些改进和润饰也应视为本发明的保护范围。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1