12-HEPE或其药学上可接受的脂肪酸改善精子发生障碍的应用
12
‑
hepe或其药学上可接受的脂肪酸改善精子发生障碍的应用
技术领域
1.本发明属生物医药领域,具体涉及12
‑
hepe或其药学上可接受的脂肪酸在改善精子发生障碍方面的应用。
背景技术:
2.男性不育已成为人类健康的一个重要问题。在全球范围内,超过10%的夫妇无法生育,男性因素占不孕的一半。男性不育最常见的原因是原发性睾丸功能障碍,通常以精子发生异常为特征,临床表现为非梗阻性无精子症(non
‑
obstructive azoospermia,noa)。
3.精子发生是精原细胞经过有丝分裂、减数分裂、精子发生和精子释放等阶段产生精子细胞的精确过程。精子发生受独特的睾丸微环境调控,该微环境由支持细胞、间质细胞、管周肌样细胞及其分泌体组成,包括骨形态发生蛋白(bmps)、胶质源神经营养因子(gdnf)、集落刺激因子1(csf
‑
1)和成纤维细胞生长因子2(fgf2)。然而,这些睾丸细胞以及微环境成分在精子发生中的具体作用尚不清楚,这限制了男性不育的医疗范围。
4.既往研究表明,gdnf、褪黑素、肝脏生长因子(lgf)等因子可部分恢复白消安诱导的非阻塞性无精子小鼠模型后的精子发生。此外,维甲酸(ra),一个小的极性分子,已经被证明可以通过激活维生素a诱导未分化的精原细胞向分化的精原细胞的转化。虽然在小鼠中有许多促进精子发生的因素,但对精原细胞再生的细胞和分子机制仍然知之甚少。因此,优化内源性精原细胞再生反应将为治疗男性不育提供新的策略。
5.在人类的饮食结构中脂肪类和油类可以占到30%是重要的能量代谢营养物质并参与细胞膜组成,主要分为饱和脂肪酸和不饱和脂肪酸,其中omega
‑
3多不饱和脂肪酸主要包括:α
‑
亚麻酸(ala)、二十碳五烯酸(epa)、二十二碳六烯酸(dha),是细胞膜磷脂结构的重要组织部分,同时还是细胞代谢的能量供体,参与细胞信号传导。omega
‑
3多不饱和脂肪酸通过环氧合酶(cox)、脂氧合酶(lox)和细胞色素p450(cyp)途径催化生成各种代谢产物。越来越明显的是,epa和dha的大部分生理效应是通过它们的代谢产物介导的。12
‑
hepe为omega
‑
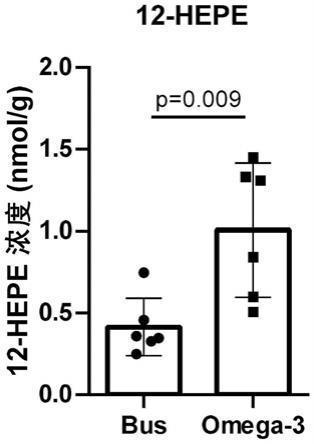
3的代谢产物,参与了许多生理过程的调节。睾丸和精子具有一种特殊的脂质成分,富含多不饱和脂肪酸。精子发生的过程包括一系列的增殖阶段、分化和随后的分裂到有丝分裂、减数分裂和精子成熟。每个阶段都涉及不同的细胞类型,包括精原细胞、精母细胞和精子细胞,在整个精子发生过程中脂滴增加。支持细胞是精子发生的支持细胞,在精子发生的内分泌和旁分泌调控中起着重要的作用。这种现象表明在精子发生过程中脂质代谢改变和生育能力之间存在密切的联系。
技术实现要素:
6.发明目的:提供一种12
‑
hepe或其药学上可接受的脂肪酸的新应用,能够有效改善精子发生障碍。
7.技术方案:
8.本发明提供了12
‑
hepe或其药学上可接受的脂肪酸在制备治疗noa药物中的应用。
9.进一步的,12
‑
hepe或其药学上可接受的脂肪酸在制备治疗noa药物后,12
‑
hepe或其药学上可接受的脂肪酸的使用剂量为0.05~0.15μg/2day。
10.本发明还提供了一种治疗noa药物,治疗noa药物中包含12
‑
hepe或其药学上可接受的脂肪酸。
11.进一步的,治疗noa药物在使用时,12
‑
hepe或其药学上可接受的脂肪酸的施用剂量为0.05~0.15μg/2day。
12.进一步的,治疗noa药物的连续使用周期为11~13周。
13.进一步的,治疗noa药物为胶囊、片剂、丸剂、栓剂、颗粒剂、冲剂、注射药或喷剂。
14.进一步的,治疗noa药物的给药方式为口服给药、非胃肠道给药、吸入喷雾给药、局部给药、直肠给药、鼻给药、颊给药、睾丸注射给药、通过植入的贮药装置给药中的至少一种。
15.进一步的,非胃肠道给药包括皮下、皮内、静脉内、肌内、关节内、动脉内、滑膜内、胸骨内、损伤部位内、颅内中的至少一种方式的注射或输注给药。
16.本发明还提供了12
‑
hepe或其药学上可接受的脂肪酸在体外非治疗性地改善哺乳动物生精功能的应用。
17.进一步的,体外非治疗性地改善哺乳动物生精功能包括改善哺乳动物精子发生障碍、恢复哺乳动物生精功能和/或促进哺乳动物精子功能。
18.进一步的,改善哺乳动物精子发生障碍包括改善生精上皮厚度以及完整性;恢复哺乳动物生精功能包括恢复精原细胞的增殖分化以及支持细胞旁分泌因子功能;促进哺乳动物精子功能包括促进精子浓度以及精子活动率。
19.进一步的,体外非治疗性地改善哺乳动物生精功能的应用方法为给哺乳动物施用12
‑
hepe或其药学上可接受的脂肪酸。
20.进一步的,12
‑
hepe或其药学上可接受的脂肪酸施用剂量为0.05~0.15μg/2day。
21.进一步的,12
‑
hepe或其药学上可接受的脂肪酸的连续施用周期为11~13周。
22.进一步的,12
‑
hepe或其药学上可接受的脂肪酸的施用方法为皮下注射、皮内注射、肌肉注射、腹腔注射、静脉注射、口服法、灌胃法中的至少一种。
23.进一步的,哺乳动物为患有非梗阻性无精子症的雄性哺乳动物。
24.进一步的,患有非梗阻性无精子症的雄性哺乳动物包括白消安诱导的非梗阻性无精子症。
25.本发明与现有技术相比,其有益效果是:本发明使用12
‑
hepe或其药学上可接受的脂肪酸能够通过促进小鼠经白消安损伤内源性精原细胞增殖和分化发挥治疗作用,从而为男性不育提供一种新的治疗策略。
附图说明
26.图1显示12
‑
hepe在白消安诱导noa模型以及omega
‑
3给药小鼠睾丸组织中代谢组学结果(n=6);
27.图2显示12
‑
hepe恢复bus诱导的小鼠血清睾酮水平(n=6);
28.图3显示12
‑
hepe恢复bus诱导的小鼠血清抑制素b水平(n=6);
29.图4显示12
‑
hepe恢复bus诱导的小鼠血清黄体生成素水平(n=6);
30.图5显示12
‑
hepe恢复bus诱导的小鼠血清卵泡刺激素水平(n=6);*,p<0.05
31.图6显示12
‑
hepe恢复bus诱导的小鼠附睾尾精子数量(n=6);
32.图7显示12
‑
hepe恢复bus诱导的小鼠附睾尾精子活动率(n=6);
33.图8显示12
‑
hepe恢复bus诱导的小鼠附睾尾组织形态;
34.图9显示12
‑
hepe恢复bus诱导的小鼠睾丸组织形态;
35.图10显示12
‑
hepe恢复bus诱导的小鼠睾丸生精小管的完整性(n=3);
36.图11显示12
‑
hepe恢复bus诱导的小鼠睾丸生精小管的上皮厚度(n=8);
37.图12显示12
‑
hepe恢复bus损伤小鼠生精细胞marker(mvh)免疫荧光图;
38.图13显示12
‑
hepe恢复bus损伤小鼠生精细胞计数(n=3);**,p<0.01;
39.图14显示12
‑
hepe恢复bus损伤小鼠未分化精原细胞marker(lin28)免疫荧光图;
40.图15显示12
‑
hepe恢复bus损伤小鼠未分化精原细胞计数(n=3);**,p<0.01;
41.图16显示12
‑
hepe恢复bus损伤小鼠分化精原细胞数(c
‑
kit)免疫荧光图;
42.图17显示12
‑
hepe恢复bus损伤小鼠分化精原细胞计数(n=3);**,p<0.01;***,p<0.001;
43.图18显示12
‑
hepe恢复bus损伤小鼠支持细胞旁分泌因子bmp4蛋白水平(n=3)。
具体实施方式
44.下面结合附图对本发明技术方案进行详细说明,但是本发明的保护范围不局限于所述实施例。若未特别指明,实施例中所用的技术手段为本领域技术人员所熟知的常规手段;实施例中所用的试剂为市售商品。
45.实施例1:
46.本实例是基于前期在白消安诱导noa模型组与omega
‑
3给药组的睾丸组织类二十烷酸靶向代谢组学检测结果,发现12
‑
hepe在omega
‑
3给药小鼠睾丸组织中显著升高,如图1所示,进一步验证12
‑
hepe给药noa小鼠对精子发生障碍的恢复潜能。
47.具体验证步骤如下:
48.1、实验材料选用:
49.动物选用b6普通小鼠,雄性,体重为20
‑
25g,5周龄,spf级;omega
‑
3选用成都国为生物医药有限公司的;12
‑
hepe选用美国glpbio公司的。
50.2、小鼠饲养条件:
51.所有小鼠均自由觅食和饮水,在室温为25
±
2℃、相对湿度40%
‑
70%环境下饲养;12小时光照黑暗交替,在小鼠适应性喂养一周后开始实验。
52.3、小鼠分组与模型设置:
53.在b6小鼠适应性喂养一周后,按照体重随机分为三组:对照组(ctl)、白消安模型组(busulfan,bus)以及12
‑
hepe给药组(12
‑
hepe)。灌胃4周后,第5周开始白消安模型组以及12
‑
hepe给药组均单次腹腔注射35mg/kg白消安溶液,对照组小鼠腹腔注射等比例dmso。
54.4、药物剂量设置:
55.对12
‑
hepe给药组小鼠进行灌胃,12
‑
hepe给药组设置的剂量优选为0.1μg,每两天一次;白消安模型以及对照组给生理盐水。
56.5、给药方法:
57.给药途径为:灌胃;
58.给药体积为:12
‑
hepe(100μl);
59.给药浓度为:12
‑
hepe(2μm);
60.给药次数为:造模前预保护给药优选为4周,造模后优选为连续8周给药,12
‑
hepe每两天一次。
61.6、动物取材为:
62.小鼠经麻醉后,摘眼球采血,颈椎脱臼处死后取下小鼠睾丸和附睾,左侧置于4%多聚甲醛中,右侧于
‑
80℃保存。
63.7、主要检测分析步骤为:
64.7.1、血清激素elisa检测:小鼠摘眼球采血,室温静置30min后,离心,1500rpm离心10min,取上清,用小鼠elisa试剂盒测定各组血清样品中卵泡刺激素(follicle
‑
stimulating hormone,fsh)、黄体生成素(luteinzing hormone,lh)、抑制素b(inhibin b,inhb)以及睾酮(testosterone,t)的含量;
65.7.2、精子悬浮液制备与精子计数:b6雄鼠颈椎脱臼处死,75%酒精喷洒其腹部,解剖下腹部取出左侧附睾尾浸于400ul htf中,于体式镜下用1ml注射器轻轻划拨,使乳白色精子团缓缓游出,收集精子,37℃孵育10min,吹匀,casa检测精子浓度;
66.7.3、精子活动率分析:吸取混悬液滴在载玻片上,盖上盖玻片,casa检测。由于受白消安造模影响,精子浓度较低,计算活动精子与总精子的占比。
67.7.4、睾丸附睾病理组织形态学变化观察:睾丸用4%甲醛固定后取材,进行常规脱水,石腊包埋,切片经he染色,光学显微镜观察睾丸及附睾的病变,并用image
‑
pro plus 6.0计算病变后生精小管直径,评判其萎缩程度,再参照miosan法利用光学显微镜记录睾丸中“完整”生精上皮(intact spermatogenic epithelium,ise)、“部分完整”生精上皮(partiallyintact spermatogenic epithelium,pise)和“不完整”生精上皮(incomplete spermatogenic epithelium,icse)曲细精管比例;
68.7.5、免疫组织荧光染色:睾丸切片经脱蜡、水化以及高温法抗原修复后,洗脱,山羊血清封闭1.5小时后,按说明书进行抗体稀释,一抗孵育过夜超过20小时,第二天避光孵育荧光二抗1小时后,dapi核染10min,荧光显微镜下拍照观察;一抗:mvh(abcam,usa),lin28(abcam,usa),c
‑
kit(abcam,usa);二抗:羊抗兔igg抗体/fitc(sigma,usa),标记羊抗兔igg抗体/tritc(sigma,usa);
69.7.6、western blotting蛋白免疫印迹:用含1mmol/l苯甲基磺酰氟(pmsf)的ripa裂解睾丸组织进行蛋白提取;使用bcaprotein assay kit(thermo fisher scientific,usa)分析蛋白浓度,并在每个泳道上样20μg蛋白进行凝胶电泳;使用的一抗为:抗bmp4(1:1000)(abcam,usa)和内参抗vinculin(1:2000)(proteintech,usa);使用的二抗为:山羊抗兔igg(1:4000)(invitrogen,usa)或山羊抗小鼠igg(1:4000)(invitrogen,usa);采用ecl增强化学发光法显色观察蛋白条带灰度。
70.8、结果:
71.小鼠经腹腔注射白消安后,睾丸持续损伤,在经过一个完整的生精周期后,睾丸生精功能受到严重损伤。如图2
‑
5显示,与noa小鼠相比,给药12
‑
hepe治疗的小鼠血清性激素
水平无显著差异。如图6
‑
8显示,noa小鼠精子数量大幅度降低趋近于零,精子活动率呈极显著下降,给药12
‑
hepe后,小鼠附睾尾精子损失得到了显著抑制,且精子活动率得到了较好的保护。从图9
‑
11显示睾丸内生精小管大部分均严重空泡化,各级生精细胞丢失,仅有部分精原细胞在基底膜上稀疏排列,而12
‑
hepe抑制生精小管中支持细胞萎缩、抑制生精小管空泡化,降低生精细胞丢失程度,促进生精上皮恢复,加快睾丸功能恢复。图12
‑
17显示noa小鼠睾丸组织mvh、lin28、c
‑
kit生精标志物荧光细胞数量明显下降,而12
‑
hepe促进mvh、lin28、c
‑
kit生精标志物荧光细胞数量明显上升。图18显示,与noa小鼠睾丸相比,给药12
‑
hepe促进bmp4蛋白水平明显恢复。
72.9、结论:
73.本发明利用白消安建立小鼠生殖障碍模型,验证omega
‑
3代谢产物12
‑
hepe对生精功能的改善作用。结果表明,12
‑
hepe可减轻生精功能障碍小鼠的生殖系统损伤,能有效抑制生精小管的空泡化,降低生精细胞丢失,促进生精小管上皮的增厚,促进已损伤的睾丸组织恢复,有效改善生精微环境,增强睾丸支持细胞的旁分泌功能,维持精子数量和活动率,是omega
‑
3治疗生精功能障碍的主要有效成分之一。
74.如上所述,尽管参照特定的优选实施例已经表示和表述了本发明,但其不得解释为对本发明自身的限制。在不脱离所附权利要求定义的本发明的精神和范围前提下,可对其在形式上和细节上作出各种变化。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1