多功能水凝胶及其制备方法
1.本发明属于生物医用材料技术领域,更具体地,本发明涉及一种多功能水凝胶及其制备方法。
背景技术:
2.细菌感染是皮肤创面愈合和再生最常见的问题,因感染引起的严重炎症反应不仅明显增加创面感染诱发的疾病数量,而且使正常炎症期因为有害酶、氧自由基和炎性细胞的释放而延长,最终导致组织破坏,使创面进一步恶化,很难愈合。此外,创面被细菌感染后容易形成细菌生物被膜,生物被膜中的细菌将自身包裹在一种细胞外聚合物(eps)屏蔽基质中。eps基质可以作为保护屏障,不仅保护细菌免受宿主先天免疫细胞的侵害,同时也防止抗菌剂的渗透。因此使用抗生素很难将其彻底清除,只能杀死被膜表面或血中引起感染发作的游离细菌。当机体抵抗力下降时,生物被膜中存活的细菌又可以释放出来,重新引发感染。而且,由于eps的封装,生物膜微环境缺氧,导致无氧糖酵解,形成酸性和高还原性的微环境。例如,耐甲氧西林金黄色葡萄球菌(mrsa)生物膜微环境的ph值为5.5甚至更低,大肠杆菌生物膜中还原性谷胱甘肽(gsh)的浓度高达10mm。生物被膜犹如一个“菌巢”,导致感染反复发作,形成慢性感染性创面,长期不能愈合,不仅给患者带来极大的痛苦,也给社会造成巨大的经济负担。
3.目前,临床上的治疗方法包括新型敷料的应用、抗生物膜疗法、负压封闭引流、高压氧疗法、生长因子治疗和干细胞疗法等。在各种新型敷料中,水凝胶因可提供湿润的微环境、可吸收组织渗透液和抗感染等特性已成为最有前景的创面敷料。但是,大多数传统水凝胶往往缺乏多功能特性,需要借助其他辅助手段来促进感染性创面愈合。用于感染性创面愈合的理想水凝胶应具备以下特点:适当的机械性能、可自愈合、可快速止血、具有较强的组织粘附性、抗菌活性和良好的生物相容性等。例如:自愈合水凝胶可以在创面修复过程中保持结构稳定;具有较强组织粘附性的水凝胶可以较好地附着在创面部位,在愈合过程不会脱落,可使创面在整个愈合过程中保持湿润的微环境,减少疤痕的形成;水凝胶快速的止血能力可在创面愈合早期快速止血,避免组织失血过多利于创面愈合;具有抗菌活性的水凝胶可以有效抵抗细菌感染,减少细菌生物被膜形成和创面部位的炎症反应;良好的生物相容性可以降低水凝胶的细胞毒性,还可促进细胞增殖。虽然临床上已出现不少水凝胶伤口敷料,如:康惠尔、tegaderm
3m
、爱肤宁和聚氨酯凝胶等,但其价格昂贵,用于感染性创面治疗不能有效解决破坏细菌生物被膜、改善创面微环境、抗感染能力差、组织粘附性弱和愈合差等关键问题。
4.因此,开发具有多功能特性的新型水凝胶用于感染性创面愈合治疗迫在眉睫。
技术实现要素:
5.基于此,本发明的目的之一是提供一种多功能水凝胶,该多功能水凝胶具有促进感染性皮肤创面愈合的功能,还具有实现止血、抗细菌感染的作用。
6.实现上述发明目的的具体技术方案包括如下:
7.一种多功能水凝胶,其是包括由醇类-阳离子聚合物的水溶液、醛基化生物医用高分子的水溶液和3,3'-二硫代双(丙酰肼)的水溶液制备而成。
8.在其中一些实施例中,所述醇类-阳离子聚合物中的醇类为丙三醇、季戊四醇或聚乙二醇;和/或所述醇类-阳离子聚合物中的阳离子聚合物为ε-聚赖氨酸或羧甲基壳聚糖。
9.在其中一些实施例中,所述醇类-阳离子聚合物通过以下方法制备得到:将醇类化合物与对甲苯磺酰氯反应制备醇-ots;再将醇-ots与阳离子聚合物反应制备醇-阳离子聚合物。
10.在其中一些实施例中,所述醛基化生物医用高分子为醛基化pluronic f127、醛基化透明质酸、醛基化普鲁兰多糖和醛基化葡聚糖中的一种或几种。
11.在其中一些实施例中,所述醛基化pluronic f127是通过以下方法制备而得:将pluronic f127与对甲苯磺酰氯反应制备f127-ots;再将f127-ots与4-羟基苯甲醛和碳酸钾反应制备醛基化pluronic f127。
12.在其中一些实施例中,所述醛基化透明质酸是通过透明质酸与高碘酸钠反应制备而得;所述醛基化普鲁兰多糖是通过普鲁兰多糖与高碘酸钠反应制备而得;所述醛基化葡聚糖是通过葡聚糖与高碘酸钠反应制备而得。
13.在其中一些实施例中,所述醇类-阳离子聚合物的水溶液、醛基化生物医用高分子的水溶液、和3,3'-二硫代双(丙酰肼)的水溶液的体积比为1~10:16~30:1~10,所述醇类-阳离子聚合物的水溶液的质量浓度为2%~30%,所述醛基化生物医用高分子的水溶液的质量浓度为5%~40%,所述3,3'-二硫代双(丙酰肼)的水溶液的质量浓度为1%~10%。
14.在其中一些实施例中,所述醇类-阳离子聚合物的水溶液的质量浓度为5%~20%;和/或所述醛基化生物医用高分子的水溶液的质量浓度为5%~30%;和/或所述3,3'-二硫代双(丙酰肼)的水溶液的质量浓度为5%~10%。
15.在其中一些实施例中,步骤(2)中所述醇类-阳离子聚合物的水溶液、醛基化生物医用高分子的水溶液和3,3'-二硫代双(丙酰肼)的水溶液的体积比为1~8:18~24:1~8。
16.本发明还提供了一种上述多功能水凝胶的制备方法,具体技术方案包括如下:
17.一种多功能水凝胶的制备方法,包括以下步骤:将醇类-阳离子聚合物的水溶液和3,3'-二硫代双(丙酰肼)的水溶液混匀后,加入至醛基化生物医用高分子的水溶液中,室温放置5min~24h,即得。
18.与现有技术相比,本发明具有以下有益效果:
19.(1)、本发明的多功能水凝胶中,发明人通过选择合适的醇类化合物与具有较强抗菌性的阳离子聚合物改性成为具有较好生物相容性的醇类-阳离子聚合物,并将生物医用高分子醛基化得到含有醛基的高分子化合物,再加入具有二硫键的dtph通过席夫碱反应得到具有多功能的水凝胶(gad),在此构思下,该水凝胶(gad)同时具有促进感染性创面愈合、止血、抗细菌感染、毒性小的多重功能。
20.(2)、本发明所述多功能水凝胶,可自愈合、可快速止血,具有氧化还原响应性和较低的细胞毒性,对大肠杆菌、金黄色葡萄球菌和甲氧西林耐药的金黄色葡萄球菌都具有较强的抗菌性,能有效抵抗细菌生物被膜,能有效促进小鼠细菌生物被膜感染性皮肤创面愈合,而且制备方法简单,成本低,环保(无有机溶剂残留),毒性小,有望成为一种可同时实现
止血、抗感染和促进创面愈合的新型多功能生物材料,在慢性感染性皮肤创面的临床治疗中有着很好的应用前景。
附图说明
21.图1为本发明实施例1中gad1水凝胶的制备组分之一gepl的1h-nmr核磁谱图。
22.图2为本发明实施例1中gad1水凝胶的制备组分之一fcho的1h-nmr核磁谱图。
23.图3为本发明实施例1中gad1水凝胶成凝胶过程图。
24.图4为本发明实施例1中gad1水凝胶各组分的红外谱图。
25.图5为本发明试验例中gad1水凝胶氧化还原刺激响应的溶胶-凝胶转变过程。
26.图6为本发明试验例中gad1水凝胶自愈合结果。
27.图7为本发明试验例中gad2水凝胶的组织粘附性测定结果。
28.图8为本发明试验例中gad3及各组分在不同浓度下对l929细胞的毒性测定结果。
29.图9为本发明试验例中gad4和gad5水凝胶及对照组对大肠杆菌(e.coli)、金黄色葡萄球菌(s.aureus)和甲氧西林耐药金黄色葡萄球菌(mrsa)的抗菌结果。
30.图10为本发明试验例中gad5水凝胶的止血能力测定结果。
31.图11为本发明试验例中gad5水凝胶对生物被膜中gsh的消耗测定结果。
32.图12为本发明试验例中gad5水凝胶及各对照组对小鼠细菌生物被膜感染性皮肤损伤修复结果。
具体实施方式
33.为了便于理解本发明,下面将对本发明进行更全面的描述。本发明可以以许多不同的形式来实现,并不限于本文所描述的实施例。相反地,提供这些实施例的目的是使对本发明公开内容的理解更加透彻全面。
34.除非另有定义,本发明所使用的所有的技术和科学术语与属于本发明的技术领域的技术人员通常理解的含义相同。本发明的说明书中所使用的术语只是为了描述具体的实施例的目的,不用于限制本发明。本发明所使用的术语“和/或”包括一个或多个相关的所列项目的任意的和所有的组合。
35.在其中一个方面,本发明提供了一种多功能水凝胶,其是包括由醇类-阳离子聚合物的水溶液、醛基化生物医用高分子的水溶液、和3,3'-二硫代双(丙酰肼)的水溶液制备而成。
36.在使用时,既考虑到抗菌作用,又考虑到毒性的大小,将阳离子聚合物进行改性,其中所述醇类-阳离子聚合物中醇类选择为丙三醇、季戊四醇或聚乙二醇(分子量优选为2000,5000和10000),阳离子聚合物选择为ε-聚赖氨酸或羧甲基壳聚糖。结合以醛基化的生物医用高分子作为水凝胶的主体结构,不仅具有较好的生物相容性,还能增强水凝胶的组织粘附性,具有快速止血和促进新生血管生成等作用,更创造性地引入dtph作为水凝胶的组分之一,其末端氨基通过与醛基发生席夫碱反应参与凝胶网络的形成,使得凝胶网络结构更稳定,其结构中的二硫键不仅可以赋予凝胶网络氧化还原响应性,还能消耗生物被膜微环境中的gsh,改善创面微环境,利于创面愈合。在各组分的有机协同作用下,本发明的水凝胶可显著促进感染性皮肤创面愈合,且具有止血、抗菌功能。
37.更进一步地,本发明的发明人对上述三种组分的浓度和体积配比进行了筛选,浓度和体积比直接影响到水凝胶能否成胶,也会影响到水凝胶的功能。浓度和体积比变化,会影响凝胶的强度、模量大小以及组织粘附性强弱、止血能力大小、抗菌活性的高低和创面愈合能力大小等功能。从毒性和凝胶强度综合考虑,所述醇类-阳离子聚合物水溶液的合适的质量浓度为2%~30%,所述醛基化生物医用高分子水溶液的合适的质量浓度为5%~40%,所述3,3'-二硫代双(丙酰肼)水溶液的合适的质量浓度为1%~10%,醇类-阳离子聚合物水溶液、醛基化生物医用高分子水溶液、和3,3'-二硫代双(丙酰肼)水溶液的合适的体积比为1~10:16~30:1~10。
38.以下结合具体实施例和附图对本发明作进一步详细的说明。
39.实施例1多功能水凝胶及其制备方法
40.本实施例的多功能水凝胶,其是包括由5μl醇类-阳离子聚合物水溶液(丙三醇-聚赖氨酸聚合物gepl,20wt%)、90μl醛基化生物医用高分子水溶液(f127-对羟基苯甲醛fcho,20wt%)和5μl dtph(3,3'-二硫代双(丙酰肼))水溶液(10wt%)制备而成。
41.本实施例的多功能水凝胶的制备方法,包括以下步骤:
42.(1)、制备pluronic f127-对甲苯磺酸酯(f127-ots)
43.将6.2g pluronic f127溶于60ml无水氯仿中,然后依次加入0.42ml三乙胺和0.57g对甲苯磺酰氯,于室温下反应24h。反应完毕后,分别用稀盐酸和饱和碳酸氢钠溶液洗涤有机相。除去多余的有机溶剂后,将其浓缩在冰乙醚中沉淀即得到f127-ots(产率86%)。
44.(2)、制备f127-对羟基苯甲醛(fcho)
45.先将2g f127-ots溶于40ml dmf中,然后依次加入0.09g 4-羟基苯甲醛和0.1g碳酸钾(k2co3),于80℃下反应72h。反应结束等反应液冷却至室温后,加入50ml水并用二氯甲烷萃取。有机相经无水硫酸镁干燥后,在冰乙醚中沉淀可得到fcho(产率91%)。
46.图1是f127-对羟基苯甲醛(fcho)的1h-nmr核磁图谱,从图中可知归属于f127和对羟基苯甲醛的各特征峰均能在谱图上显示出来,说明fcho被成功合成。
47.(3)、制备丙三醇-对甲苯磺酸酯(醇-ots)
48.将1g丙三醇溶于50ml二氯甲烷中,然后依次加入3ml三乙胺和4g对甲苯磺酰氯,于室温下反应24h。反应完毕后,分别用稀盐酸和饱和碳酸氢钠溶液洗涤有机相。将有机相旋转蒸发,即得到丙三醇-ots(产率80%)。
49.(4)、制备丙三醇-聚赖氨酸聚合物(gepl)
50.将0.31g丙三醇-ots和10g epl(ε-聚赖氨酸)分别溶于5ml水和100ml dmso中,然后将丙三醇-ots水溶液加入epl溶液于60℃下反应72h。反应结束后,用截留分子量为5000的透析袋在蒸馏水中透析3天,冷冻干燥即得到gepl聚合物。
51.图2是丙三醇-聚赖氨酸聚合物(gepl)的1h-nmr核磁图谱,从图中可知归属于丙三醇和epl(ε-聚赖氨酸)的各特征峰均能在谱图上显示出来,说明gepl被成功合成。
52.(5)、制备水凝胶(gad1)
53.将5μl gepl聚合物(20wt%)溶液和5μl dtph(3,3'-二硫代双(丙酰肼))水溶液(10wt%)混匀后,加入90μlfcho水溶液(20wt%)中,混合均匀后室温放置5min,得到本实施例的gad1水凝胶。图3为gad1水凝胶成凝胶过程的图片,由图可知,将gepl和dtph加入fcho溶液5min后,成为凝胶状态,即为gad1(其中,g为醇-阳离子聚合物;a为醛基化生物医用高
分子;d为3,3'-二硫代双(丙酰肼)水凝胶。
54.以5μl水替代dtph水溶液,制备的样品ga1为对照组。
55.图4为本实施例制备得到的gad1水凝胶各组分的红外谱图,从图中可知,f127的c-h伸缩振动吸收峰位于2876cm-1
,1692cm-1
和1600cm-1
分别是fcho苯环上的骨架振动和醛基的特征吸收峰,表明fcho的成功合成。1692cm-1
处醛基峰消失和1669cm-1
处亚胺键的伸缩振动说明fcho的醛基和gepl的氨基通过席夫碱反应形成了gad1水凝胶网络。此外,3320cm-1
处来自于dtph上伯胺的特征吸收峰消失,说明dtph的伯胺也与fcho的醛基发生席夫碱反应参与了gad1凝胶网络的形成。
56.实施例2多功能水凝胶及其制备方法
57.本实施例的多功能水凝胶,其是包括由30μl醇类-阳离子聚合物水溶液(聚乙二醇-聚赖氨酸聚合物pepl,10wt%)、120μl醛基化生物医用高分子水溶液(f127-对羟基苯甲醛fcho,20wt%)和20μl dtph(3,3'-二硫代双(丙酰肼))水溶液(5wt%)制备而成。
58.本实施例的多功能水凝胶的制备方法,包括以下步骤:
59.(1)、制备pluronic f127-对甲苯磺酸酯(f127-ots)
60.同实施例1步骤(1)。
61.(2)、制备f127-对羟基苯甲醛(fcho)
62.同实施例1步骤(2)。
63.(3)、制备聚乙二醇-对甲苯磺酸酯(peg-ots)
64.将5g聚乙二醇(分子量2000)溶于100ml二氯甲烷中,然后依次加入1.4ml三乙胺和1.9g对甲苯磺酰氯,于室温下反应72h。反应完毕后,分别用稀盐酸和饱和碳酸氢钠溶液洗涤有机相。将有机相旋转蒸发,即得到聚乙二醇-ots(peg-ots)(产率83%)。
65.(4)、制备聚乙二醇-聚赖氨酸聚合物(pepl)
66.将1g peg-ots和2.5g epl(ε-聚赖氨酸)分别溶于20ml水和30mldmso中,然后将peg-ots水溶液加入epl溶液于60℃下反应72h。反应结束后,用截留分子量为6000的透析袋在蒸馏水中透析3天,冷冻干燥即得到pepl聚合物。
67.(5)、制备水凝胶(gad2)
68.将30μl pepl聚合物(10wt%)溶液和20μl dtph水溶液(5wt%)混匀后,加入120μl fcho水溶液(20wt%)中,混合均匀后室温放置5min,即成为凝胶状态,得到本实施例的gad2水凝胶。
69.以20μl水替代dtph水溶液,制备的样品ga2为对照组。
70.实施例3多功能水凝胶及其制备方法
71.本实施例的多功能水凝胶,其是包括由10μl醇类-阳离子聚合物水溶液(季戊四醇-聚赖氨酸聚合物tepl,10wt%)、80μl醛基化生物医用高分子水溶液(醛基化透明质酸ha-cho,5wt%)和10μl dtph(3,3'-二硫代双(丙酰肼))水溶液(10wt%)制备而成。
72.本实施例的多功能水凝胶的制备方法,包括以下步骤:
73.(1)、制备醛基化透明质酸(ha-cho)
74.将1g透明质酸(ha)溶于100ml蒸馏水中,加入210mg高碘酸钠(naio4)于室温下避光反应3h。反应结束后,加入500μl乙二醇淬灭反应。然后,将反应液用截留分子量14000的透析袋在蒸馏水中透析3天,冷冻干燥即得到醛基化透明质酸(ha-cho)(产率85%)。
75.(2)、制备季戊四醇-对甲苯磺酸酯(醇-ots)
76.将1g季戊四醇溶于50ml二氯甲烷中,然后依次加入5ml三乙胺和6.7g对甲苯磺酰氯,于室温下反应24h。反应完毕后,分别用稀盐酸和饱和碳酸氢钠溶液洗涤有机相。将有机相旋转蒸发,即得到季戊四醇-ots(产率82%)。
77.(3)、制备季戊四醇-聚赖氨酸聚合物(tepl)
78.将0.2g季戊四醇-ots和10g epl(ε-聚赖氨酸)分别溶于5ml水和100ml dmso中,然后将季戊四醇-ots水溶液加入epl溶液于60℃下反应72h。反应结束后,用截留分子量为10000的透析袋在蒸馏水中透析3天,冷冻干燥即得到tepl聚合物。
79.(4)、制备水凝胶(gad3)
80.将10μl tepl聚合物(10wt%)溶液和10μl dtph水溶液(10wt%)混匀后,加入80μl ha-cho水溶液(5wt%)中,混合均匀后室温放置10min,即成为凝胶状态,得到本实施例的gad3水凝胶。
81.以10μl水替代dtph水溶液,制备的样品ga3为对照组。
82.实施例4多功能水凝胶及其制备方法
83.本实施例的多功能水凝胶,其是包括由5μl醇类-阳离子聚合物水溶液(聚乙二醇-羧甲基壳聚糖聚合物pcs,5wt%)、90μl醛基化生物医用高分子水溶液(醛基化透明质酸ha-cho,5wt%)和5μl dtph(3,3'-二硫代双(丙酰肼))水溶液(10wt%)制备而成。
84.本实施例的多功能水凝胶的制备方法,包括以下步骤:
85.(1)、制备醛基化透明质酸(ha-cho)
86.同实施例3步骤(1)。
87.(2)、制备聚乙二醇-对甲苯磺酸酯(peg-ots)
88.同实施例2步骤(3)。
89.(3)、制备聚乙二醇-羧甲基壳聚糖聚合物(pcs)
90.将1g peg-ots和2g羧甲基壳聚糖溶于100ml水中,于60℃下反应72h。反应结束后,用截留分子量为14000的透析袋在蒸馏水中透析3天,冷冻干燥即得到pcs聚合物。
91.(4)、制备水凝胶(gad4)
92.将5μl pcs聚合物(5wt%)溶液和5μl dtph水溶液(10wt%)混匀后,加入90μl ha-cho水溶液(5wt%)中,混合均匀后室温放置1h,即成为凝胶状态,得到本实施例的gad4水凝胶。
93.以5μl水替代dtph水溶液,制备的样品ga4为对照组。
94.实施例5多功能水凝胶及其制备方法
95.本实施例的多功能水凝胶,其是包括由5μl醇类-阳离子聚合物水溶液(季戊四醇-聚赖氨酸聚合物tepl,20wt%)、90μl醛基化生物医用高分子水溶液(醛基化普鲁兰多糖pu-cho,10wt%)和5μl dtph(3,3'-二硫代双(丙酰肼))水溶液(5wt%)制备而成。
96.本实施例的多功能水凝胶的制备方法,包括以下步骤:
97.(1)、制备醛基化普鲁兰多糖(pu-cho)
98.将1g普鲁兰多糖(pu)溶于100ml蒸馏水中,加入855mg高碘酸钠(naio4)于室温下避光反应3h。反应结束后,加入500μl乙二醇淬灭反应。然后,将反应液用截留分子量14000的透析袋在蒸馏水中透析3天,冷冻干燥即得到醛基化普鲁兰多糖(pu-cho)(产率80%)。
99.(2)、制备季戊四醇-对甲苯磺酸酯(醇-ots)
100.同实施例3步骤(2)。
101.(3)、制备季戊四醇-聚赖氨酸聚合物(tepl)
102.同实施例3步骤(3)。
103.(4)、制备水凝胶(gad5)
104.将5μl tepl聚合物(20wt%)溶液和5μl dtph水溶液(5wt%)混匀后,加入90μl pu-cho水溶液(10wt%)中,混合均匀后室温放置10min,即成为凝胶状态,得到本实施例的gad5水凝胶。
105.以5μl水替代dtph水溶液,制备的样品ga5为对照组。
106.实施例6多功能水凝胶及其制备方法
107.本实施例的多功能水凝胶,其是包括由5μl醇类-阳离子聚合物水溶液(聚乙二醇-羧甲基壳聚糖聚合物pcs,10wt%)、90μl醛基化生物医用高分子水溶液(醛基化普鲁兰多糖pu-cho,10wt%)和5μl dtph(3,3'-二硫代双(丙酰肼))水溶液(6wt%)制备而成。
108.本实施例的多功能水凝胶的制备方法,包括以下步骤:
109.(1)、制备醛基化普鲁兰多糖(pu-cho)
110.同实施例5步骤(1)。
111.(2)、制备聚乙二醇-对甲苯磺酸酯(peg-ots)
112.同实施例2步骤(3)。
113.(3)、制备聚乙二醇-羧甲基壳聚糖聚合物(pcs)
114.同实施例4步骤(3)。
115.(4)、制备水凝胶(gad6)
116.将5μl pcs聚合物(10wt%)溶液和5μl dtph水溶液(6wt%)混匀后,加入90μl pu-cho水溶液(10wt%)中,混合均匀后室温放置20min,即成为凝胶状态,得到本实施例的gad6水凝胶。
117.以5μl水替代dtph水溶液,制备的样品ga6为对照组。
118.实施例7多功能水凝胶及其制备方法
119.本实施例的多功能水凝胶,其是包括由20μl醇类-阳离子聚合物水溶液(聚乙二醇-聚赖氨酸聚合物pepl,10wt%)、90μl醛基化生物医用高分子水溶液(醛基化葡聚糖dex-cho,10wt%)和15μl dtph(3,3'-二硫代双(丙酰肼))水溶液(5wt%)制备而成。
120.本实施例的多功能水凝胶的制备方法,包括以下步骤:
121.(1)、制备醛基化葡聚糖(dex-cho)
122.将1g葡聚糖(dex)溶于100ml蒸馏水中,加入991mg高碘酸钠(naio4)于室温下避光反应3h。反应结束后,加入500μl乙二醇淬灭反应。然后,将反应液用截留分子量14000的透析袋在蒸馏水中透析3天,冷冻干燥即得到醛基化葡聚糖(dex-cho)(产率87%)。
123.(2)、制备聚乙二醇-对甲苯磺酸酯(peg-ots)
124.同实施例2步骤(3)。
125.(3)、制备聚乙二醇-聚赖氨酸聚合物(pepl)
126.同实施例2步骤(4)。
127.(4)、制备水凝胶(gad7)
128.将20μl pepl聚合物(10wt%)溶液和15μl dtph水溶液(5wt%)混匀后,加入90μl dex-cho水溶液(10wt%)中,混合均匀后室温放置40min,即成为凝胶状态,得到本实施例的gad7水凝胶。
129.以15μl水替代dtph水溶液,制备的样品ga7为对照组。
130.实施例8多功能水凝胶及其制备方法
131.本实施例的多功能水凝胶,其是包括由10μl醇类-阳离子聚合物水溶液(丙三醇-羧甲基壳聚糖聚合物gcs,10wt%)、80μl醛基化生物医用高分子水溶液(醛基化葡聚糖dex-cho,10wt%)和10μl dtph(3,3'-二硫代双(丙酰肼))水溶液(5wt%)制备而成。
132.本实施例的多功能水凝胶的制备方法,包括以下步骤:
133.(1)、制备醛基化葡聚糖(dex-cho)
134.同实施例7步骤(1)。
135.(2)、制备丙三醇-对甲苯磺酸酯(丙三醇-ots)
136.同实施例1步骤(3)。
137.(3)、制备丙三醇-羧甲基壳聚糖聚合物(gcs)
138.将0.5g丙三醇-ots和1.5g羧甲基壳聚糖溶于60ml水中,于60℃下反应72h。反应结束后,用截留分子量为10000的透析袋在蒸馏水中透析3天,冷冻干燥即得到gcs聚合物。
139.(4)、制备水凝胶(gad8)
140.将10μl gcs聚合物(10wt%)溶液和10μl dtph水溶液(5wt%)混匀后,加入80μl dex-cho水溶液(10wt%)中,混合均匀后室温放置20min,即成为凝胶状态,得到本实施例的gad8水凝胶。
141.以10μl水替代dtph水溶液,制备的样品ga8为对照组。
142.试验例 实施例1~8制备得到的水凝胶gad的性能测试
143.对实施例1~8制备得到的水凝胶gad进行了性能测试。
144.对实施例1制备得到的水凝胶gad1做了氧化还原响应性试验和自愈合能力测试。对实施例2制备得到的水凝胶gad2做了组织粘附性测试。对实施例3制备得到的水凝胶gad3做了细胞毒性试验。对实施例4制备得到的水凝胶gad4做了抗菌性试验。对实施例5制备得到的水凝胶gad5做了抗菌、止血、生物被膜中gsh消耗能力和促进皮肤创面愈合的试验。
145.1、氧化还原响应性
146.将还原剂二硫苏糖醇(dtt)加入gad1水凝胶中2min,观察gad1水凝胶的氧化还原响应性。结果如图5所示。
147.从图5可知,将还原剂二硫苏糖醇(dtt)加入gad1水凝胶后,因dtt破坏了凝胶网络中的二硫键,导致gad1变成溶液状态;当加入氧化剂双氧水(h2o2)后,被破坏的二硫键又重新氧化形成,gad1又变回凝胶状态,证明gad1具有氧化还原响应性。
148.2、自愈合能力
149.观察gad1水凝胶的自愈合过程。结果如图6所示。
150.从图6可知,随着时间延长,凝胶中的小孔逐渐变小,直至消失,证明gad1可以自愈合。
151.3、组织粘附性能力
152.用新鲜猪皮检测水凝胶对皮肤的粘附性能。步骤如下:先将猪皮洗净并去除多余
脂肪后,切成两个小正方形(10mm
×
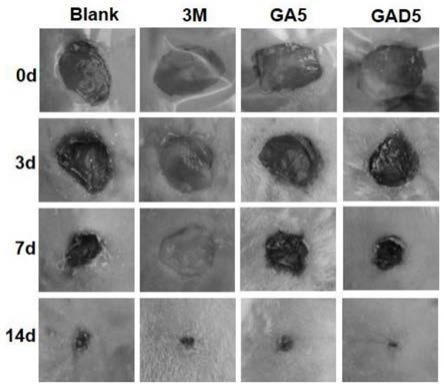
10mm)。然后将两块猪皮用双面胶分别固定在流变仪的检测台和平行板上,间隙为500μm。将100μl gad2水凝胶或对照组ga2、fcho分别添加到两个猪皮的间隙。随后,将加材料后的两块猪皮在37℃下压2分钟,并通过ta流变仪(dhr-2)测量拉伸时各组的反向应力变化,以此评估支架的组织粘附性。
153.图7是gad2及各对照组的粘附性测定结果,由图可知,与对照组ga2和fcho相比,gad2对新鲜猪皮的反向应力最大,说明其组织粘附性最强。
154.4、细胞毒性试验
155.图8是不同浓度的gad3及各组分在l929细胞中孵育24h后的细胞毒性结果,由图8可知,在l929细胞中,gad3及各组分的细胞毒性都较小,即使在浓度为25μg/ml时,其细胞活力均在80%以上,说明gad3水凝胶具有较好的生物相容性。
156.5、抗菌性试验
157.gad水凝胶的抗菌性能通过测量大肠杆菌(e.coli)、金黄色葡萄球菌(s.aureus)和耐甲氧西林金黄色葡萄球菌(mrsa)在水凝胶表面上孵育2小时后的活力来评估。具体步骤如下:
158.将e.coli,s.aureus和mrsa分别接种在mhb培养基里并置于37℃摇床(200rpm)上培养至细菌的对数生长期。在24孔板中制备400μl gad4水凝胶。以ga4、hcho和氨苄青霉素为对照。然后,将稀释后的菌液(10μl,106cfu ml-1
)分别滴加到gad4和对照组的表面。在37℃下培养2小时后,取菌液用pbs稀释100倍,然后取出10μl悬浮液接种在lb琼脂(sigma)上再培养18小时。拍照记录每个培养皿中的菌落数量。gad4及对照组的抗菌性能以各培养皿中细菌数量的相对大小(bacterial viability%)表示。
159.gad5的抗菌实验以万古霉素为阳性对照,步骤同上。
160.图9是gad4(a)水凝胶及对照组和gad5(b)及对照组对大肠杆菌(e,coli)、金黄色葡萄球菌(s,aureus)和甲氧西林耐药的金黄色葡萄球菌(mrsa)的抗菌结果,由图可知,gad4、ga4、gad5和ga5在上述三种细菌中均显示出较高的抗菌性能,其抗菌能力达到95%以上,说明本发明制备的gad水凝胶具有较强的抗感染能力。
161.6.止血能力测定实验
162.采用小鼠出血肝模型(昆明小鼠,20-30g,雌性)测定gad水凝胶的止血能力。步骤如下:
163.首先将麻醉后的小鼠腹部切开,暴露肝脏,去除肝脏周围的组织液。然后将肝脏置于预先称重的滤纸(w0)上,并用18g针头刺穿肝脏放血。随后,立即将50μl gad5覆盖在出血部位。分别在0、5、15、30和60s拍照记录肝脏出血点的出血情况,以未处理出血部位的小鼠为对照。结果如图10所示。
164.从图10可知,对照组的出血量随着时间的延长而明显增加。用gad5水凝胶处理5s后,肝脏出血部位的出血得到迅速控制。
165.7、生物被膜中gsh消耗能力测定
166.将mrsa(100μl,108cfu ml-1
)接种在加了mhb培养液的96孔板里并置于37℃培养箱中孵育24h,然后每隔24h用新鲜的mhb替换旧的培养液,换液两次后,继续孵育24h即得到mrsa生物被膜。将pbs、ga5和gad5(100ul)加入mrsa生物被膜,孵育1h,参照说明书用gsh检测试剂盒测定各组的gsh浓度。结果如图11所示。
167.从图11可知,与对照组相比,gad5组的gsh浓度最低,说明生物膜微环境中的gsh因dtph的存在而被消耗了。
168.8、促进皮肤创面愈合试验
169.在小鼠全层皮肤伤口细菌生物被膜感染模型中测定gad水凝胶的体内抗菌性能及对感染性皮肤伤口的愈合能力。步骤如下:
170.将balb/c雌性小鼠(25-30g)麻醉并将其背部剃毛。碘伏消毒后用皮肤切口器在小鼠后背部制造圆形的全厚度伤口(直径:7mm),并在伤口部位滴加10μl mrsa(1
×
106cfu ml-1
)菌液构建mrsa生物被膜感染皮肤伤口模型。将小鼠随机分为以下四组(n=6):对照组(空白)、ga5组、gad5组和商业化伤口辅料tegaderm
3m
组。然后,将ga5和gad5(50μl)分别涂于伤口处,再将中空的tegaderm
3m
膜贴于缺损部位以防伤口皱缩。所有操作均在无菌条件下进行,分别在0、3、7和14天拍照记录各组的皮肤修复情况。结果如图12所示。
171.从图12可知,随着时间延长,各组的皮肤缺损面积逐渐减小。与对照组和商业化的伤口辅料(3m)相比,gad5组显示出更为优异的创面修复效果,说明gad5水凝胶能促进感染性创面愈合。
172.试验例结果说明:本发明的gad水凝胶具有氧化还原响应性、可自愈合、组织粘附性强,而且水凝胶及各组分的细胞毒性都较低,还能促进细胞增殖,可快速止血。此外,gad水凝胶对大肠杆菌、金黄色葡萄球菌和甲氧西林耐药的金黄色葡萄菌均有较强的抗菌性能,能有效抵抗细菌生物被膜,消耗生物被膜中的gsh,有效促进感染性皮肤创面愈合。
173.以上所述实施例的各技术特征可以进行任意的组合,为使描述简洁,未对上述实施例中的各个技术特征所有可能的组合都进行描述,然而,只要这些技术特征的组合不存在矛盾,都应当认为是本说明书记载的范围。
174.以上所述实施例仅表达了本发明的几种实施方式,其描述较为具体和详细,但并不能因此而理解为对发明专利范围的限制。应当指出的是,对于本领域的普通技术人员来说,在不脱离本发明构思的前提下,还可以做出若干变形和改进,这些都属于本发明的保护范围。因此,本发明专利的保护范围应以所附权利要求为准。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1