PI3K抑制剂单用或联合EGFR抑制剂在制备治疗头颈癌或胃癌的药物中的用途的制作方法
pi3k抑制剂单用或联合egfr抑制剂在制备治疗头颈癌或胃癌的药物中的用途
技术领域
1.本技术属于医药领域,涉及一种pi3k抑制剂单用或联合egfr抑制剂在制备治疗头颈癌或胃癌的药物中的用途。
背景技术:
2.头颈部肿瘤为上消化道、唾液腺、甲状腺异质性恶性肿瘤的合称。全球每年发病率为830,000,为第六大常见肿瘤类型,死亡率为430,000,具有发病率高、致死率高特点。在中国,头颈部肿瘤每年发病率为75,000,占全球的9%,是发病率最高的发展中国家。
3.在头颈部肿瘤患者中,90%表现为头颈部鳞状细胞癌(hnscc),75%的头颈鳞癌发病与烟草、酒精暴露相关,少数与人乳头瘤病毒(hpv)相关。由于头颈部解剖结构特殊且复杂多样,患者易出现基本生理功能(咀嚼、吞咽、呼吸等)、感觉功能(味觉、嗅觉、听觉)、语言功能破坏,严重降低患者生活质量。目前头颈鳞癌常规诊疗方案有手术、放疗、化疗、靶向治疗、免疫治疗,对患者的局部控制率和生活质量有所提高,但5年生存期仍低于50%,治愈率低。并且对于复发或转移头颈鳞癌,常规治疗方案反应差、患者获益率低,头颈鳞癌中仍存在大量临床需求未被满足。
4.磷脂酰肌醇3-激酶(pi3k)属于脂激酶家族,根据结构与功能,可分为i类、ii类、iii类,i类与肿瘤发生发展最为密切。i类pi3k蛋白为异源二聚体,由p85调节亚基和p-110催化亚基构成,根据差异可细分为pi3kα、pi3kβ、pi3kγ、pi3kδ亚型。pi3kα与pi3kβ亚型活性较高,主要参与葡萄糖代谢、血管生成,与肿瘤发生发展相关。pi3kγ、pi3kδ则主要在淋巴细胞中表达,在免疫反应、炎症反应中发挥作用。
5.pik3ca基因所编码的p110α蛋白为pi3k的催化亚基,参与pi3k蛋白活化。活化的pi3k可催化pip2转化为pip3激活下游信号,传导生长因子、信号传导复合物所引起的细胞信号转导级联反应,从而调控细胞一系列重要生命活动。如代谢、增殖、分化、蛋白质合成等。有研究表明,pi3k/mtor信号通路易在病理条件下出现失调,与癌症、糖尿病、心血管疾病、神经系统等疾病相关,尤其在肿瘤广泛存在,如乳腺癌、头颈癌、白血病、淋巴瘤、多发性骨髓瘤、前列腺癌、肺癌、卵巢癌、肾癌。常见pi3k/mtor信号通路失调形式包括:pik3ca基因发生活性增强性点突变、基因拷贝数增加,以及pten基因出现部分缺失、点突变都将引起。其中pik3ca基因变化在乳腺癌、头颈鳞癌、胃癌、结直肠癌、卵巢癌、肺癌中比例高。
6.egfr属于跨膜蛋白酪氨酸激酶erbb受体家族,可以与其配体形成同源二聚体;或与家族中其他受体(如erbb2,erbb3,或erbb4)形成异源二聚体,从而激活细胞内多个下游的信号通路,参与细胞增殖、生存及抗凋亡活动。针对egfr靶点所开发的anti-egfr治疗可通过阻遏上皮生长因子受体,抑制肿瘤细胞的增殖、分化、侵袭活动,提高复发或转移性头颈鳞癌患者的缓解率、无进展生存期(pfs)和总生存期(os)。
7.在我国胃癌中,pik3ca基因突变的比例约为10%,并与胃癌不良预后强相关。胃癌一线疗法以化疗为主,对于her2阳性患者加用曲妥珠单抗,但对于携带有pik3ca突变胃癌
患者,对曲妥珠单抗反应较差,并易产生耐药性,因此pi3k抑制剂对携带pik3ca突变患者有潜在治疗效果。
8.而目前,针对一线治疗中存在的一系列问题并没有好的临床治疗方案。因此,提高现有治疗方案的临床疗效,或者改善pi3k抑制剂目前一线治疗中存在的不良反应或者耐药性问题,并为hbv阳性患者提供治疗选择,进一步扩大头颈鳞癌患者临床获益。
技术实现要素:
9.本发申请供一种pi3k抑制剂单用或联合egfr抑制剂在制备治疗头颈癌或胃癌的药物中的用途。
10.在本发明优选的实施方案中,所述头颈癌或胃癌优选pik3ca基因突变的头颈癌或胃癌。
11.在本发明优选的实施方案中,头颈癌选自鳞状细胞癌或非鳞状细胞癌,优选鳞状细胞癌。
12.在本发明进一步优选的实施方案中,所述pik3ca突变体为pik3ca h1047r突变体、pik3ca h1047l突变体、pik3ca e545k突变体、pik3ca e545d突变体、pik3ca e545a突变体、pik3ca e453k突变体或pik3ca e542k突变体,或其任意组合。
13.在本发明优选的实施方案中,pi3k抑制剂为选择性pi3k抑制剂,选自(s)-2-((2-((r)-4-(二氟甲基)-2-羰基噻唑烷-3-基)-5,6-二氢苯并[f]咪唑并[1,2-d][1,4]噁吖庚英-9-基)氨基)-3-甲氧基丙酰胺,或其药理学上可接受的盐。
[0014]
在本发明进一步优选的实施方案中,化合物药理学上可接受的盐选自硫酸、磷酸、苯磺酸、肉桂酸、酒石酸、乙烷-1,2-二磺酸、乙烷磺酸、富马酸或甲磺酸,优选硫酸、酒石酸、乙烷-1,2-二磺酸、乙烷磺酸、富马酸或甲磺酸,更优选硫酸、乙烷-1,2-二磺酸、乙烷磺酸或甲磺酸,进一步优选乙烷磺酸。
[0015]
在本发明进一步优选的实施方案中,pi3k抑制剂为(s)-2-((2-((r)-4-(二氟甲基)-2-羰基噻唑烷-3-基)-5,6-二氢苯并[f]咪唑并[1,2-d][1,4]噁吖庚英-9-基)氨基)丙酰胺或其药理学上可接受的盐;优选乙烷磺酸,其结构如下所示:
[0016][0017]
在本发明优选的实施方案中,egfr抑制剂选自igg单克隆抗体;igg单克隆抗体优选耐昔妥珠单抗或西妥昔单抗,更优选西妥昔单抗。
[0018]
在本发明进一步优选的实施方案中,pi3k抑制剂的单次给药剂量范围选自0.1-1000mg/kg;优选1-50mg/kg;更优选3-10mg/kg;进一步优选3mg/kg、5mg/kg或10mg/kg。剂量范围具体可选0.1mg、0.2mg、0.3mg、0.4mg、0.5mg、0.6mg、0.7mg、0.8mg、0.9mg、1.0mg、2mg、3mg、4mg、5mg、6mg、7mg、8mg、9mg、10mg、11mg、12mg、13mg、14mg、15mg、16mg、17mg、18mg、19mg、20mg、21mg、22mg、23mg、24mg、25mg、26mg、27mg、28mg、29mg、30mg、31mg、32mg、33mg、34mg、35mg、36mg、37mg、38mg、39mg、40mg、41mg、42mg、43mg、44mg、45mg、46mg、47mg、48mg、
49mg、50mg。
[0019]
在本发明优选的实施方案中,pi3k抑制剂的单次给药剂量范围选自0.1-1000mg/kg;优选1-10mg/kg;更优选3mg/kg。示例性的剂量选自0.1mg、0.2mg、0.3mg、0.4mg、0.5mg、0.6mg、0.7mg、0.8mg、0.9mg、1.0mg、2mg、3mg、4mg、5mg、6mg、7mg、8mg、9mg、10mg、11mg、12mg、13mg、14mg、15mg、16mg、17mg、18mg、19mg、20mg、21mg、22mg、23mg、24mg、25mg、26mg、27mg、28mg、29mg、30mg、31mg、32mg、33mg、34mg、35mg、36mg、37mg、38mg、39mg、40mg、41mg、42mg、43mg、44mg、45mg、46mg、47mg、48mg、49mg、50mg、51mg、52mg、53mg、54mg、55mg、56mg、57mg、58mg、59mg、60mg、61mg、62mg、63mg、64mg、65mg、66mg、67mg、68mg、69mg、70mg、71mg、72mg、73mg、74mg、75mg、76mg、77mg、78mg、79mg、80mg、81mg、82mg、83mg、84mg、85mg、86mg、87mg、88mg、89mg、90mg、91mg、92mg、93mg、94mg、95mg、96mg、97mg、98mg、99mg、100mg。
[0020]
在本发明进一步优选的实施方案中,pi3k抑制剂的给药频次为一日一次、一日二次或一日三次。
[0021]
在本发明进一步优选的实施方案中,pi3k抑制剂一日一次给药,单次给药剂量选自3mg/kg、5mg/kg或10mg/kg。
[0022]
在本发明优选的实施方案中,pi3k抑制剂一日一次给药,单次给药剂量为3mg/kg。
[0023]
在本发明优选的实施方案中,egfr抑制剂的单次给药剂量范围选自1-1000mg/kg;优选10-50mg/kg;更优选30mg/kg。示例性的剂量选自1mg、2.5mg、5mg、7.5mg、10mg、12.5mg、15mg、17.5mg、20mg、22.5mg、25mg、27.5mg、30mg、32.5mg、35mg、37.5mg、40mg、42.5mg、45mg、47.5mg、50mg、52.5mg、55mg、60mg、65mg、70mg、75mg、80mg、85mg、90mg、95mg、100mg、105mg、110mg、120mg、130mg、140mg、150mg、160mg、170mg、180mg、190mg、200mg、210mg、220mg、230mg、240mg、250mg、260mg、270mg、280mg、290mg、300mg、350mg、400mg、450mg、500mg、550mg、600mg、650mg、700mg、750mg、800mg、850mg、900mg、950mg、1000mg。
[0024]
在本发明优选的实施方案中,egfr抑制剂的给药频次为一周一次,一周两次,一周三次或两周一次。
[0025]
在本发明优选的实施方案中,egfr抑制剂一周两次给药,单次给药剂量为30mg/kg。
[0026]
在本发明优选的实施方案中,pi3k抑制剂与egfr抑制剂同时、并行、独立或按顺序地应用。
[0027]
在本发明优选的实施方案中pi3k抑制剂的单位剂量为0.1-200mg,优选0.1-100mg,更优选1-100mg,进一步优选5-80mg,更进一步优选10-80mg,最优选约10mg、15mg、20mg、25mg、30mg、35mg、40mg、45mg、50mg、55mg、60mg、65mg、70mg、75mg、80mg。
[0028]
本技术所述的给药途径选自经口给药、胃肠外给药、经皮给药,所述胃肠外给药包括但不限于静脉注射、皮下注射、肌肉注射,优选口服给药。
[0029]
本发明所述的方案中,所述的pi3k抑制剂任选的还包含其他组分,所述其他组分包括但不限于其他治疗肿瘤疾病的药物中的用途。
[0030]
本发明所述的方案中,所述的联合任选的还包含其他组分,所述其他组分包括但不限于其他治疗肿瘤疾病的药物中的用途。
[0031]
本发明还提供了一种治疗肿瘤疾病的方法,包括向患者施用有效量上述pi3k抑制剂。
[0032]
本技术还涉及一种上述pi3k抑制剂以及一种或多种药用载体、赋形剂、稀释剂的药物组合物。
[0033]
所述药物组合物可以制成药学上可接受的任一剂型。例如,可以配制为片剂、胶囊剂、丸剂、颗粒剂、溶液剂、混悬剂、糖浆剂、注射剂(包括注射液、注射用无菌粉末与注射用浓溶液)、栓剂、吸入剂或喷雾剂。
[0034]
本技术所述的含pi3k抑制剂的药物组合物,可以单独给药,或者与一种或多种治疗剂联合使用。
[0035]
本发明还提供一种联合制剂,其包含:
[0036]
(a)一个或多个pi3k抑制剂;
[0037]
(b)一个或多个egfr抑制剂。
[0038]
在本发明优选的实施方案中,联合制剂包含:
[0039]
(a)(s)-2-((2-((r)-4-(二氟甲基)-2-羰基噻唑烷-3-基)-5,6-二氢苯并[f]咪唑并[1,2-d][1,4]噁吖庚英-9-基)氨基)丙酰胺或其药理学上可接受的盐;
[0040]
(b)igg单克隆抗体;
[0041]
所述igg单克隆抗体选自耐昔妥珠单抗或西妥昔单抗;优选西妥昔单抗。
[0042]
在本发明优选的实施方案中,联合制剂包含:
[0043]
(a)(s)-2-((2-((r)-4-(二氟甲基)-2-羰基噻唑烷-3-基)-5,6-二氢苯并[f]咪唑并[1,2-d][1,4]噁吖庚英-9-基)氨基)丙酰胺乙磺酸盐;
[0044]
(b)西妥昔单抗。
[0045]
在本发明优选的实施方案中,该联合制剂用于治疗肿瘤疾病。
[0046]
在本发明优选的实施方案中,该联合制剂用于治疗乳腺癌、卵巢癌、前列腺癌、黑色素瘤、脑瘤、食管癌、胃癌、肝癌、胰腺癌、结肠直肠癌、肺癌、肾癌、皮肤癌、成胶质细胞瘤、神经母细胞瘤、肉瘤、脂肪肉瘤、骨软骨瘤、骨瘤、骨肉瘤、精原细胞瘤、睾丸肿瘤、子宫癌、头颈癌、多发性骨髓瘤、恶性淋巴瘤、真性红细胞增多症、白血病、甲状腺肿瘤、输尿管肿瘤、膀胱肿瘤、胆囊癌、胆管癌或绒毛膜上皮癌,优选头颈癌;头颈癌选自鳞状细胞癌或非鳞状细胞癌,优选鳞状细胞癌;进一步优选pik3ca基因突变的头颈癌;pik3ca突变体为pik3ca h1047r突变体、pik3ca h1047l突变体、pik3ca e545k突变体、pik3ca e545d突变体、pik3ca e545a突变体、pik3ca e453k突变体或pik3ca e542k突变体,或其任意组合。
[0047]
在本发明优选的实施方案中pi3k抑制剂的单位剂量为0.1-200mg,优选0.1-100mg,更优选0.1-50mg,进一步优选5-30mg,更进一步优选10-30mg,最优选约20mg。
[0048]
在本发明优选的实施方案中,egfr抑制剂单位剂量为0.1-1000mg,优选1-500mg,更优选50-500mg,进一步优选100-400mg,更进一步优选150-250mg,最优选约200mg。
[0049]
本发明还提供了一种治疗肿瘤疾病的方法,包括向患者施用包括施用有效剂量的下列化合物的组合:
[0050]
(a)pi3k抑制剂;
[0051]
(b)egfr抑制剂;
[0052]
pi3k抑制剂与egfr抑制剂同时、并行、独立或按顺序地应用。
[0053]
在本发明优选的实施方案中,治疗肿瘤疾病的方法,包括向患者施用包括施用有效剂量的下列化合物的组合:
[0054]
(a)(s)-2-((2-((r)-4-(二氟甲基)-2-羰基噻唑烷-3-基)-5,6-二氢苯并[f]咪唑并[1,2-d][1,4]噁吖庚英-9-基)氨基)丙酰胺或其药理学上可接受的盐;
[0055][0056]
(b)igg单克隆抗体;
[0057]
所述igg单克隆抗体选自耐昔妥珠单抗或西妥昔单抗;优选西妥昔单抗。
[0058]
本技术还涉及一种上述pi3k抑制剂与egfr抑制剂,以及一种或多种药用载体、赋形剂或稀释剂的药物组合物。
[0059]
所述药物组合物可以制成药学上可接受的任一剂型。例如,可以配制为片剂、胶囊剂、丸剂、颗粒剂、溶液剂、混悬剂、糖浆剂、注射剂(包括注射液、注射用无菌粉末与注射用浓溶液)、栓剂、吸入剂或喷雾剂。
[0060]
本技术所述的含pi3k抑制剂与egfr抑制剂的药物组合物,可以单独给药,或者与一种或多种治疗剂联合使用。
[0061]
本技术还提供了一种用于治疗肿瘤疾病的药物中的用途的药物试剂盒,其中包装有本技术所述的pi3k抑制剂与egfr抑制剂的药物组合物。
[0062]
本技术将pi3k抑制剂与egfr抑制剂联合给药,从而增强了肿瘤疾病的药物中的用途,以及改善了治疗效果。
[0063]
本技术中所述的“联合”是一种给药方式,是指在一定时间期限内给予至少一种剂量的选择性pi3k抑制剂和至少一种剂量的egfr抑制剂,其中两种物质都显示药理学作用。所述的时间期限可以是一个给药周期内,优选4周内,3周内,2周内,1周内,或24小时以内。可以同时或依次给予多靶点酪氨酸激酶抑制剂和egfr抑制剂。这种期限包括这样的治疗,其中通过相同给药途径或不同给药途径给予选择性pi3k抑制剂和egfr抑制剂。
[0064]
术语“有效量”指在哺乳动物中有效治疗疾病或病症的药物量。在癌症的情况中,治疗有效量的药物可减少癌细胞的数目;缩小肿瘤的尺寸;抑制(即一定程度的减缓和优选阻止)癌细胞浸润到周围器官中;抑制(即一定程度的减缓和优选阻止)肿瘤转移;一定程度的抑制肿瘤生长;和/或一定程度的减轻一种或多种与该病症有关的症状。根据药物可阻止现有癌细胞生长和/或杀死现有癌细胞的程度,它可以是细胞抑制性的和/或细胞毒性的。对于癌症治疗,可通过评估存活持续时间、无进展存活(pfs)持续时间、响应率(rr)、响应持续时间和/或生活质量来测量体内功效。
[0065]
本发明的选择性pi3k抑制剂,对野生型、突变型的pi3k-α均有高抑制活性,能通过抑制pi3k/mtor信号通路发挥抗肿瘤效用,对伴随有pik3ca基因突变肿瘤有显著抑制作用。目前正在开展在实体瘤临床实验phase i,对pik3ca基因突变发生率较高的乳腺癌、头颈鳞癌、胃癌有潜在治疗效应。
[0066]
由于在头颈鳞癌中,egfr过表达与pik3ca基因突变共同存在,pi3k选择性抑制剂联合西妥昔单抗对头颈鳞癌细胞有明显协同效果。药物a-1联合西妥昔单抗,对于头颈鳞癌有潜在治疗效果,二者联合可改善目前一线治疗中存在不良反应、耐药性问题,并为hpv阳性患者提供治疗选择,进一步扩大头颈鳞癌患者临床获益。
附图说明
[0067]
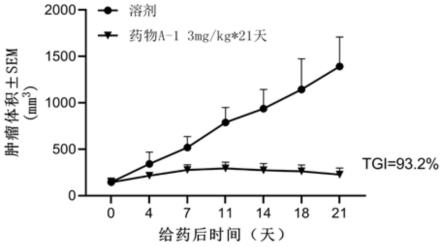
图1为药物a-1对人头颈鳞癌pdx模型hn0626裸小鼠皮下移植瘤的药效;
[0068]
图2为药物a-1对人头颈鳞癌pdx模型hn3474裸小鼠皮下移植瘤的疗效;
[0069]
图3为药物a-1对人头颈鳞癌pdx模型hn3504裸小鼠皮下移植瘤的疗效;
[0070]
图4为药物a-1对人胃癌pdx模型ga0098裸小鼠皮下移植瘤的疗效;
[0071]
图5为药物a-1对人胃癌pdx模型ga6209裸小鼠皮下移植瘤的疗效;
[0072]
图6为药物a-1对人头颈癌cal-33裸小鼠皮下移植瘤的疗效;
[0073]
图7为药物a-1对人头颈癌cal-33裸小鼠体重的影响;
[0074]
图8为药物a-1、药物b单用或二者合用对人头颈癌cal-33裸小鼠皮下移植瘤的疗效;
[0075]
图9为药物a-1、药物b单用或二者合用对人头颈癌cal-33裸小鼠体重的影响。
具体实施方式
[0076]
以下将结合实施例更详细地解释本技术,本技术的实施例仅用于说明本技术的技术方案,并非限定本技术的实质和范围。
[0077]
生物评价方法
[0078]
测试例1、本发明化合物对pi3kα/β/γ/δ激酶活性抑制作用的测定
[0079]
1.实验目的:
[0080]
测试化合物(s)-2-((2-((r)-4-(二氟甲基)-2-羰基噻唑烷-3-基)-5,6-二氢苯并[f]咪唑并[1,2-d][1,4]噁吖庚英-9-基)氨基)丙酰胺对pi3kα/β/γ/δ激酶活性抑制的活性。
[0081]
2.实验仪器和试剂:
[0082]
离心机(5810r)购自eppendorf公司;
[0083]
移液器购自eppendorf或mettler toledo(rainin品牌)公司;
[0084]
酶标仪购自美国biotek公司,型号为synergyh1全功能酶标仪;
[0085]
化合物(s)-2-((2-((r)-4-(二氟甲基)-2-羰基噻唑烷-3-基)-5,6-二氢苯并[f]咪唑并[1,2-d][1,4]噁吖庚英-9-基)氨基)丙酰胺,制备方法参考专利wo2019228341;
[0086]
实验所使用的酶的具体信息如下表所示:
[0087]
[0088][0089]
3.实验方法:
[0090]
本实验采用promega公司的adp-glo脂质激酶测定方法(promega#v9102),脂质激酶pi3kα/β/γ/δ在底物pip2:3ps和atp存在的条件下发生催化反应,atp生成adp,通过测定反应中adp的含量来表征脂质激酶的活性,并得出化合物对pi3kα/β/γ/δ激酶活性抑制的半数抑制浓度ic
50
。
[0091]
具体实验操作如下:
[0092]
激酶反应在白色384孔板(perkin elmer#6007299)中进行,每孔加入2μl用含1%dmso的ddh2o稀释的不同浓度的化合物(s)-2-((2-((r)-4-(二氟甲基)-2-羰基噻唑烷-3-基)-5,6-二氢苯并[f]咪唑并[1,2-d][1,4]噁吖庚英-9-基)氨基)丙酰胺,阳性对照孔加入2μl含1%dmso的ddh2o,然后每孔加入2μl用5
×
激酶缓冲液(hepes 250mm,mgcl
2 3mm,nacl 250mm,bsa 0.05%)稀释的0.1~2nm pi3k激酶溶液,阴性对照孔加入2μl的5
×
激酶缓冲液,所有孔加入4μl用10
×
dilution buffer和ddh2o配制的50μm底物pip2:3ps(promega#v1701),最后加入2μl用水稀释的50~100μm atp溶液启动反应,室温反应90~120分钟后,每孔加入10μl adp-glo reagent(含10mm mgcl2)室温反应60分钟以去除反应中多余的atp,后每孔加入20μl kinase detection reagent,室温避光反应20分钟后用biotek synergy h1酶标仪检测化学发光值。
[0093]
4.实验数据处理方法:
[0094]
通过于板上阳性对照孔(dmso对照孔)和阴性对照孔(不添加激酶)计算使用化合物处理的孔的百分比抑制数据{%抑制率=100-[(测试化合物值-阴性对照值)]/(阳性对照值-阴性对照值)
×
100}。使用graphpad prism拟合不同浓度和相应百分比抑制率数据至4参数非线性逻辑公式计算出ic
50
值。
[0095]
5.实验结果:
[0096]
表1本发明化合物对pi3kα/γ/β/δ体外酶学活性的ic
50
结果
[0097]
[0098][0099]
注:数据以“平均值
±
标准误差”表示。
[0100]
6.实验结论:
[0101]
通过以上数据可知本发明化合物(s)-2-((2-((r)-4-(二氟甲基)-2-羰基噻唑烷-3-基)-5,6-二氢苯并[f]咪唑并[1,2-d][1,4]噁吖庚英-9-基)氨基)丙酰胺对pi3kα/β/γ/δ激酶均具有一定的抑制作用,且对pi3kα激酶抑制作用更明显。
[0102]
测试例2、本发明化合物对pi3kα突变型癌症细胞的增殖抑制作用的测定
[0103]
1.实验目的:
[0104]
测试化合物(s)-2-((2-((r)-4-(二氟甲基)-2-羰基噻唑烷-3-基)-5,6-二氢苯并[f]咪唑并[1,2-d][1,4]噁吖庚英-9-基)氨基)丙酰胺对pi3kα突变型人胃癌细胞株mkn1、hgc-27、ags以及人头颈鳞癌细胞株cal-33、detroit 562的增殖抑制的活性。
[0105]
2.实验仪器:
[0106]
离心机(5702r)购自eppendorf公司;
[0107]
二氧化碳培养箱购自thermo公司;
[0108]
生物安全柜购自上海博讯公司;
[0109]
移液器购自eppendorf或mettler toledo(rainin品牌)公司;
[0110]
酶标仪购自美国biotek公司,型号为synergyh1全功能酶标仪;
[0111]
pi3kα突变型人胃癌细胞株mkn1(南京科佰生物科技有限公司);
[0112]
pi3kα突变型人胃癌细胞株hgc-27(中国科学院上海细胞库);
[0113]
pi3kα突变型人胃癌细胞株ags(南京科佰生物科技有限公司);
[0114]
pi3kα突变型人头颈鳞癌细胞株cal-33(南京科佰生物科技有限公司);
[0115]
pi3kα突变型人头颈鳞癌细胞株detroit 562(南京科佰生物科技有限公司)。
[0116]
化合物(s)-2-((2-((r)-4-(二氟甲基)-2-羰基噻唑烷-3-基)-5,6-二氢苯并[f]咪唑并[1,2-d][1,4]噁吖庚英-9-基)氨基)丙酰胺,制备方法参考专利wo2019228341。
[0117]
3.实验方法:
[0118]
采用cell titer-glo的方法检测了化合物(s)-2-((2-((r)-4-(二氟甲基)-2-羰基噻唑烷-3-基)-5,6-二氢苯并[f]咪唑并[1,2-d][1,4]噁吖庚英-9-基)氨基)丙酰胺对pi3kα突变型人胃癌细胞株mkn1、hgc-27、ags以及人头颈鳞癌细胞株cal-33、detroit 562的增殖抑制作用。细胞株培养在含10%fbs(gibco#10099-141c)的rpmi 1640培养基(gibco#22400089)中,在37℃,5%co2的条件下培养。实验前收集细胞,细胞计数后调整细胞密度,将细胞以1000-10000细胞/孔的密度种于白色96孔板(corning#3610),放入37℃,5%co2培养箱培养过夜后加入配制好的不同浓度的化合物溶液,同时设相应的溶媒对照,继续放入37℃,5%co2培养箱培养48-96小时后,将细胞板及其内容物平衡至室温,每孔加入20-100μl cell titer-glo溶液(promega#g7573),振荡混匀后室温避光孵育5~30分钟,用biotek的synergyh1酶标仪检测化学发光值。
[0119]
4.实验数据处理方法:
[0120]
通过于板上溶媒对照孔计算使用化合物处理的孔的百分比抑制数据{%抑制率=100-(测试化合物值/溶媒对照值)
×
100}。使用graphpad prism拟合不同浓度和相应百分比抑制率数据至4参数非线性逻辑公式计算出ic
50
值。
[0121]
5.实验结果:
[0122]
表2体外培养肿瘤细胞增殖抑制的ic
50
结果
[0123]
细胞种类细胞类型pik3ca突变类型ic
50
(nm)mkn1人胃癌e545k37
±
6.4hgc-27人胃癌e542k29
±
4.2ags人胃癌e545a e453k8.1
±
0.86cal-33人头颈鳞癌h1047r5.5
±
1.6detroit 562人头颈鳞癌h1047r27
±
12
[0124]
注:数据以“平均值
±
标准误差”表示。
[0125]
6.实验结论:
[0126]
通过以上数据可知本发明化合物(s)-2-((2-((r)-4-(二氟甲基)-2-羰基噻唑烷-3-基)-5,6-二氢苯并[f]咪唑并[1,2-d][1,4]噁吖庚英-9-基)氨基)丙酰胺对pi3kα突变型人胃癌细胞株mkn1、hgc-27、ags以及人头颈鳞癌细胞株cal-33、detroit 562的增殖抑制的活性试验中均显示出一定的抑制作用。
[0127]
测试例3、药物a-1对人头颈鳞癌pdx在balb/c裸小鼠皮下异种移植瘤模型中的体内药效研究
[0128]
1.实验目的
[0129]
为进一步确认与评价药物a-1在人头颈鳞癌中药效,选取pik3ca突变的人头颈鳞癌pdx模型开展异种移植瘤体内药效研究。
[0130]
2.实验材料
[0131]
药物a-1为(s)-2-((2-((r)-4-(二氟甲基)-2-羰基噻唑烷-3-基)-5,6-二氢苯并[f]咪唑并[1,2-d][1,4]噁吖庚英-9-基)氨基)丙酰胺的乙烷磺酸盐,制备方法参考pct/cn2020/130035,药物配置用0.5%hpmc;
[0132]
人头颈鳞癌pdx模型hn0626、hn3504、hn3474由中美冠科生物技术(太仓)有限公司提供。hn0626模型为pik3ca h1047l突变,hn3504模型为pik3ca h1047r突变,hn3474模型为pik3ca e545k突变;
[0133]
balb/c裸小鼠,接种时小鼠周龄为4-9周,
♀
,江苏集萃药康生物科技有限公司。
[0134]
3.实验方法
[0135]
从头颈鳞癌异种移植模型hn0626,hn3474,hn3504荷瘤小鼠收取肿瘤组织,切成直径为2-3mm的瘤块接种于balb/c裸小鼠右前肩胛处皮下。当荷瘤鼠平均肿瘤体积到达约150~200mm3时,将小鼠按照表1设计随机分组,各组内的肿瘤体积的变异系数(cv)用公式cv=sd/mtv
×
100%计算,应小于30%。分组当天开始给药,分组当天定义为第0天,具体给药方式、给药剂量详见表3。每周2次测量肿瘤体积,称重小鼠体重,并记录数据。
[0136]
表3人头颈鳞癌pdx肿瘤模型中的给药途径、剂量及方案
[0137][0138]
注:给药体积为10μl/g
[0139]
4.实验数据收集与统计分析
[0140]
本实验过程中动物实验的实验方案均通过crownbio iacuc委员会审核并批准通过。实验过程中,动物实验操作均根据aaalac(国际实验动物评估和认可委员会)的要求。肿瘤接种后,常规监测包括了肿瘤生长及治疗对动物正常行为的影响,具体内容有实验动物的活动性,摄食和饮水情况,体重增加或降低情况,眼睛、被毛及其它异常情况。实验过程中观察到的临床症状均记录在原始数据中。肿瘤体积计算公式:肿瘤体积(mm3)=1/2
×
(a
×
b2)(其中a表示长径,b表示短径)。实验中使用studydirectortm(版本号3.1.399.19,供应商studylog system,inc.,s.san francisco,ca,usa)软件收集数据,包括肿瘤的长短径的测量和动物体重的称量。原始数据由天平和游标卡尺测量后直接导入软件,数据的任何变动都将被记录在此软件中。
[0141]
所有实验结果以平均瘤体积
±
sem(平均标准误差)表示。实验指标为考察药物对肿瘤生长的影响,具体指标为t/c%或抑瘤率tgi(%)。
[0142]
t/c(%)=(t-t0)/(c-c0)
×
100其中t、c为实验结束时的肿瘤体积,t0、c0为实验开始时的肿瘤体积。
[0143]
抑瘤率(tgi)%=100-t/c(%)。当肿瘤出现消退时,抑瘤率(tgi)(%)=100-(t-t0)/t0×
100。如果肿瘤比起始体积缩小,即t《t0或c《c0时,即定义为肿瘤部分消退(pr);如果肿瘤完全消失,即定义为肿瘤完全消退(cr)。
[0144]
实验结束(day20)达到实验终点,或肿瘤体积达到2000mm3,co2麻醉处死物,随后解剖取瘤并拍照。
[0145]
5.实验结果
[0146]
表4药物a-1在头颈鳞癌各模型中的药效分析结果
[0147][0148]
注:数据以“平均值
±
标准误差”表示;
[0149]
肿瘤体积数据中,括号内为相应的溶剂对照组(溶媒组)的数据。
[0150]
药物a-1对人头颈鳞癌pdx模型hn0626、hn3474和hn3504裸小鼠皮下移植瘤的药效分别如图1、2和3所示。
[0151]
hn0626、hn3474及hn3504三个模型在治疗期间,无小鼠出现明显体重下降,耐受良好。
[0152]
6.实验结论
[0153]
以上药效实验结果显示,药物a-1在人头颈鳞癌hn0626、hn3474和hn3504模型中均能显著降低异种移植瘤生长,并耐受良好。
[0154]
综上所述,表明药物a-1对pik3ca突变头颈鳞癌有一定治疗效果。
[0155]
测试例4、药物a-1对人胃癌pdx在balb/c裸小鼠皮下异种移植瘤模型中的体内药效研究
[0156]
1.实验目的
[0157]
为进一步确认与评价药物a-1在人胃癌中药效,选取pik3ca突变的人胃癌pdx模型开展异种移植瘤体内药效研究。
[0158]
2.实验材料
[0159]
药物a-1为(s)-2-((2-((r)-4-(二氟甲基)-2-羰基噻唑烷-3-基)-5,6-二氢苯并[f]咪唑并[1,2-d][1,4]噁吖庚英-9-基)氨基)丙酰胺的乙烷磺酸盐,制备方法参考pct/cn2020/130035,药物配置用0.5%hpmc;
[0160]
人胃癌pdx模型ga0098、ga6209由中美冠科生物技术(太仓)有限公司提供。ga0098模型为pik3ca e545k突变,ga6209为pik3ca h1047r突变。
[0161]
balb/c裸小鼠,接种时小鼠周龄为5-8周,
♀
,江苏集萃药康生物科技有限公司。
[0162]
3.实验方法
[0163]
从胃癌异种移植模型ga0098和ga6209荷瘤小鼠收取肿瘤组织,切成直径为2-3mm的瘤块接种于balb/c裸小鼠右前肩胛处皮下。当荷瘤鼠平均肿瘤体积到达约150~200mm3时,将小鼠按照表格5设计随机分组,各组内的肿瘤体积的变异系数(cv)用公式cv=sd/mtv
×
100%计算,应小于30%。分组当天开始给药,分组当天定义为第0天,具体给药方式、给药剂量详见表5。每周2次测量肿瘤体积,称重小鼠体重,并记录数据。
[0164]
表5人胃癌pdx肿瘤模型中的给药途径、剂量及方案
[0165][0166]
注:给药体积为10μl/g。
[0167]
4.实验数据收集与统计分析
[0168]
本实验过程中动物实验的实验方案均通过crownbio iacuc委员会审核并批准通过。实验过程中,动物实验操作均根据aaalac(国际实验动物评估和认可委员会)的要求。肿瘤接种后,常规监测包括了肿瘤生长及治疗对动物正常行为的影响,具体内容有实验动物的活动性,摄食和饮水情况,体重增加或降低情况,眼睛、被毛及其它异常情况。实验过程中观察到的临床症状均记录在原始数据中。肿瘤体积计算公式:肿瘤体积(mm3)=1/2
×
(a
×
b2)(其中a表示长径,b表示短径)。实验中使用studydirectortm(版本号3.1.399.19,供应商studylog system,inc.,s.san francisco,ca,usa)软件收集数据,包括肿瘤的长短径的测量和动物体重的称量。原始数据由天平和游标卡尺测量后直接导入软件,数据的任何变动都将被记录在此软件中。
[0169]
所有实验结果以平均瘤体积
±
sem(平均标准误差)表示。实验指标为考察药物对肿瘤生长的影响,具体指标为t/c%或抑瘤率tgi(%)。
[0170]
t/c(%)=(t-t0)/(c-c0)
×
100,其中t、c为实验结束时的肿瘤体积,t0、c0为实验开始时的肿瘤体积。
[0171]
抑瘤率(tgi)(%)=100-t/c(%)。当肿瘤出现消退时,抑瘤率(tgi)(%)=100-(t-t0)/t0×
100。如果肿瘤比起始体积缩小,即t《t0或c《c0时,即定义为肿瘤部分消退(pr);如果肿瘤完全消失,即定义为肿瘤完全消退(cr)。
[0172]
实验结束(day20)达到实验终点,或肿瘤体积达到2000mm3,co2麻醉处死物,随后解剖取瘤并拍照。
[0173]
所有实验结果以平均瘤体积
±
sem(平均标准误差)表示。
[0174]
5.实验结果
[0175]
表6药物a-1在胃癌pdx各模型中的药效分析结果
[0176][0177]
注:肿瘤体积数据中,括号内为相应的溶剂对照组(溶媒组)的数据。
[0178]
药物a-1对人胃癌pdx模型ga0098和ga6209裸小鼠皮下移植瘤的疗效分别如图4和
5所示。
[0179]
6.实验结论
[0180]
以上药效实验结果显示,药物a-1在人胃癌ga0098、ga6209模型中能显著降低异种移植瘤生长,并耐受良好。并且在ga0098模型中,药物a-1 10mg/kg
×
21days治疗组异种移植瘤表现出消退,抑瘤作用明显。
[0181]
综上所述,表明药物a-1对pik3ca突变胃癌有一定治疗效果。
[0182]
测试例5、药物a-1对人头颈鳞癌细胞cal-33在balb/c裸小鼠皮下异种移植瘤模型中的体内药效研究
[0183]
1.实验目的
[0184]
评价药物a-1对人头颈鳞癌cal-33细胞裸小鼠皮下移植瘤的疗效
[0185]
2.实验材料
[0186]
药物a-1为(s)-2-((2-((r)-4-(二氟甲基)-2-羰基噻唑烷-3-基)-5,6-二氢苯并[f]咪唑并[1,2-d][1,4]噁吖庚英-9-基)氨基)丙酰胺的乙烷磺酸盐,制备方法参考pct/cn2020/130035,药物配置用0.5%hpmc;
[0187]
cal-33细胞购自南京科佰生物科技有限公司。用150cm2培养瓶贴壁培养,培养条件为dmem培养基中加10%胎牛血清以及1%链霉素/青霉素,于37℃、含5%co2空气的培养箱中培养。一周2次传代,当细胞呈指数生长期时,胰酶消化、收集细胞,计数,接种。
[0188]
balb/c裸小鼠,6-7周,
♀
,购自上海西普尔-必凯实验动物有限公司。
[0189]
1.实验方法
[0190]
裸小鼠皮下接种人头颈鳞癌cal-33细胞,待肿瘤生长至100-150mm3后,根据肿瘤体积将动物分组(d0),分组当天未给药,第二天开始小鼠灌胃给药(p.o),每日1次(qd),或腹腔注射(i.p),每周2次(biw);给药体积10ml/kg;溶剂组给予相同体积的“溶剂”(0.5%hpmc);具体给药剂量和给药方案见表7。每周测2次肿瘤体积,称小鼠体重,记录数据。
[0191]
实验指标为考察药物对肿瘤生长的影响,具体指标为t/c%或抑瘤率tgi(%)。每周二次用游标卡尺测量肿瘤直径,肿瘤体积(v)计算公式为:
[0192]
v=1/2
×a×
b2其中a、b分别表示长、宽。
[0193]
t/c(%)=(t-t0)/(c-c0)
×
100其中t、c为实验结束时的肿瘤体积,t0、c0为实验开始时的肿瘤体积。
[0194]
抑瘤率(tgi)(%)=100-t/c(%)。
[0195]
当肿瘤出现消退时,抑瘤率(tgi)(%)=100-(t-t0)/t0×
100
[0196]
如果肿瘤比起始体积缩小,即t《t0或c《c0时,即定义为肿瘤部分消退(pr);如果肿瘤完全消失,即定义为肿瘤完全消退(cr)。
[0197]
实验结束(d21)、达到实验终点、或肿瘤体积达到2000mm3,co2麻醉处死物,随后解剖取瘤并拍照。
[0198]
实验数据用graphpad prism 6.0分析、作图。
[0199]
表7给药途径、剂量及方案
[0200]
组别给药剂量给药周期给药途径溶剂组
‑‑
qd*21次p.o药物a-13mg/kgqd*21次p.o
[0201]
3.实验结果
[0202]
表8对人头颈鳞癌cal-33裸小鼠皮下移植瘤的疗效实验结果
[0203][0204]
注:d0:第一次给药前一天时间;
[0205]
药物a-1对人头颈鳞癌cal-33裸小鼠皮下移植瘤的疗效见图6;
[0206]
药物a-1对人头颈鳞癌cal-33裸小鼠体重的影响见附图7;
[0207]
药物a-1(3mg/kg,p.o.,qd
×
21次)对cal-33皮下移植瘤的抑瘤率为93.27%;荷瘤小鼠对药物能很好的耐受,没有明显体重减轻等症状发生。
[0208]
4.实验结论:
[0209]
根据上述数据可知,本发明药物a-1可抑制人头颈癌cal-33裸小鼠皮下移植瘤的生长,荷瘤小鼠对单药的剂量能很好的耐受。
[0210]
测试例6、药物a-1联合药物b对人头颈鳞癌细胞cal-33在balb/c裸小鼠皮下异种移植瘤模型中的体内药效研究
[0211]
1.实验目的
[0212]
评价药物a-1、药物b二者联用对人头颈鳞癌cal-33细胞裸小鼠皮下移植瘤的疗效。
[0213]
2.实验材料
[0214]
药物a-1为(s)-2-((2-((r)-4-(二氟甲基)-2-羰基噻唑烷-3-基)-5,6-二氢苯并[f]咪唑并[1,2-d][1,4]噁吖庚英-9-基)氨基)丙酰胺的乙烷磺酸盐,制备方法参考pct/cn2020/130035,药物配置用0.5%hpmc;
[0215]
药物b为西妥昔单抗,购于广州市恒金堂大药房有限公司,生产商为mreck kgaa,药物稀释用注射用水。
[0216]
cal-33细胞购自南京科佰生物科技有限公司。用150cm2培养瓶贴壁培养,培养条件为dmem培养基中加10%胎牛血清以及1%链霉素/青霉素,于37℃、含5%co2空气的培养箱中培养。一周2次传代,当细胞呈指数生长期时,胰酶消化、收集细胞,计数,接种。
[0217]
balb/c裸小鼠,6-7周,
♀
,购自上海西普尔-必凯实验动物有限公司。
[0218]
2.实验方法
[0219]
裸小鼠皮下接种人头颈鳞癌cal-33细胞,待肿瘤生长至100-150mm3后,根据肿瘤体积将动物分组(d0),分组当天未给药,第二天开始小鼠灌胃给药(p.o),每日1次(qd),或腹腔注射(i.p),每周2次(biw);给药体积10ml/kg;溶剂组给予相同体积的“溶剂”(0.5%hpmc);具体给药剂量和给药方案见表1。每周测2次肿瘤体积,称小鼠体重,记录数据。
[0220]
实验指标为考察药物对肿瘤生长的影响,具体指标为t/c%或抑瘤率tgi(%)。每周二次用游标卡尺测量肿瘤直径,肿瘤体积(v)计算公式为:
[0221]
v=1/2
×a×
b2其中a、b分别表示长、宽。
[0222]
t/c(%)=(t-t0)/(c-c0)
×
100其中t、c为实验结束时的肿瘤体积,t0、c0为实验开
始时的肿瘤体积。
[0223]
抑瘤率(tgi)(%)=100-t/c(%)。
[0224]
当肿瘤出现消退时,抑瘤率(tgi)(%)=100-(t-t0)/t0×
100
[0225]
如果肿瘤比起始体积缩小,即t《t0或c《c0时,即定义为肿瘤部分消退(pr);如果肿瘤完全消失,即定义为肿瘤完全消退(cr)。
[0226]
实验结束(d21)、达到实验终点、或肿瘤体积达到2000mm3,co2麻醉处死物,随后解剖取瘤并拍照。
[0227]
实验数据用graphpad prism 6.0分析、作图。二组肿瘤体积之间比较采用双尾t检验。三组或多组间比较用one-way anova repeated measure,如果f值有显著性差异,应在anova分析之后使用dunnett’s进行多重比较。p《0.05定义为差异有统计学显著性。
[0228]
表9.给药途径、剂量及方案
[0229]
组别分组给药途径1溶剂qd*21次p.o2药物a-1 3mg/kgqd*21次p.o3药物b 30mg/kgbiw*6次i.p4药物a-1 3mg/kg+药物b 30mg/kgqd*21次+biw*6次p.o+i.p
[0230]
3.实验结果
[0231]
表10.对人头颈鳞癌cal-33裸小鼠皮下移植瘤的疗效实验结果
[0232][0233]
注:
[0234]
d0:第一次给药前一天时间;
[0235]
p值为与溶剂对照组相比所得数值;
[0236]
$
为与药物a 3mg/kg组比较,p《0.05;
[0237]
#
为与药物b 30mg/kg组比较,p《0.01。
[0238]
药物a-1、药物b单用或二者联用对人头颈鳞癌cal-33裸小鼠皮下移植瘤的疗效见图8。
[0239]
药物a-1、药物b单用或二者联用对人头颈鳞癌cal-33裸小鼠体重的影响见附图9。
[0240]
药物a-1(3mg/kg,p.o.,qd
×
21次)对cal-33皮下移植瘤的抑瘤率为93.27%;药物b(30mg/kg,i.p,biw
×
6次)与药物a-1(3mg/kg,p.o.,qd
×
21次)联用抑瘤率提高到171.07%,显著强于单药疗效(p《0.05,与单药比较),且联用组有5/5肿瘤部分消退;荷瘤小
鼠对以上药物均能很好耐受,没有明显体重减轻等症状发生。
[0241]
4.实验结论:
[0242]
根据上述数据可知,本发明药物a-1可抑制人头颈癌cal-33裸小鼠皮下移植瘤的生长,与药物b联用可显著协同增强抑瘤效果。荷瘤小鼠对单药或联合用药的剂量均能很好耐受。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1