ATXN1蛋白作为靶点在制备治疗、预防或诊断髓母细胞瘤的药物或试剂盒中的应用
atxn1蛋白作为靶点在制备治疗、预防或诊断髓母细胞瘤的药物或试剂盒中的应用
技术领域
1.本发明属于生物技术领域,具体涉及atxn1蛋白作为靶点在治疗、预防或诊断髓母细胞瘤的试剂或药物中的应用。
背景技术:
2.髓母细胞瘤(mb)是儿童最常见的恶性脑肿瘤,因其细胞形态类似于胚胎期的髓母细胞而得名。髓母细胞是一种很原始的无极细胞,在人胚胎中仅见于后髓帆,髓母细胞瘤亦为颅内恶性程度最高的胶质瘤。髓母细胞瘤的高度恶性主要表现在以下三方面:(1)生长极其迅速;(2)手术不易全部切除;(3)肿瘤细胞有沿脑脊液产生播散性种植的倾向。髓母细胞瘤主要发生于14岁以下儿童,少数见于20岁以上者。多伦多和费城儿童医院皆报道,髓母细胞瘤的发病率仅次于小脑星形细胞瘤,居于儿童后颅窝肿瘤的第二位。
3.目前,对于髓母细胞瘤患者的治疗手段包括最大程度的安全切除、整个大脑和脊髓的放射治疗、化疗等。髓母细胞瘤治疗方案的进步使标准风险患者的5年生存率提高到约70%-80%,高危患者的生存率提高到55%-76%。近些年来,髓母细胞瘤患者的治愈率有所提高,然而,幸存者仍遭受严重的治疗相关副作用。许多幸存的儿童有长期的认知和/或神经内分泌不良反应,包括发育、神经、神经内分泌和心理社会缺陷。
技术实现要素:
4.有鉴于此,本发明的目的在于提供共济失调蛋白-1(atxn1)作为药物靶点或诊断靶点在制备预防、诊断或治疗髓母细胞瘤药物或试剂中的应用。
5.为实现上述目的,本发明的技术方案为:
6.atxn1蛋白作为靶点在治疗、预防或诊断髓母细胞瘤的试剂或药物中的应用。
7.进一步,所述髓母细胞瘤为wnt亚型髓母细胞瘤、shh亚型髓母细胞瘤、group3亚型髓母细胞瘤或group4亚型髓母细胞瘤。
8.进一步,所述髓母细胞瘤为shh亚型髓母细胞瘤。
9.进一步,所述药物是指降低atxn1蛋白表达水平的药物。
10.进一步,所述试剂盒是指检测atxn1蛋白表达水平的试剂盒。
11.本发明的目的还在于保护atxn1基因作为药物靶点或诊断靶点在制备预防、诊断或治疗髓母细胞瘤的药物或试剂盒中的应用。
12.本发明的目的还在于保护atxn1蛋白的抑制剂在制备治疗或预防髓母细胞瘤中的应用。
13.本发明的目的还在于保护atxn1基因在构建髓母细胞瘤动物模型中的应用。
14.本发明的有益效果在于:
15.本发明将atxn1蛋白作为药物靶点或诊断靶点制备预防、诊断或治疗髓母细胞瘤的药物或试剂盒,通过检测atxn1蛋白的表达水平,从而能够对atxn1蛋白进行预防或早期
干预,降低了髓母细胞瘤的发生率,对髓母细胞瘤的预防和治疗具有重要临床应用价值。
附图说明
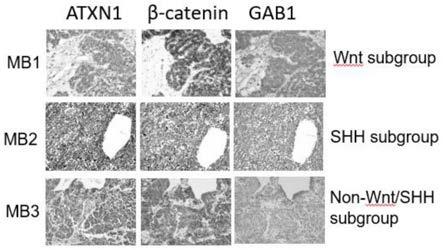
16.图1为免疫组化实验结果,其中,wnt subgroup为wnt亚型髓母细胞瘤,shh subgroup为shh亚型髓母细胞瘤,non-wnt/shh subgroup为非wnt/shh亚型髓母细胞瘤;
17.图2为生存分析检测结果;
18.图3为流式检测结果;
19.图4为成球培养试验检测结果;
20.图5为斑马鱼模型异种移植实验检测结果;
21.图6为蛋白表达试验检测结果;
22.图7为荧光素酶基因检测试验检测结果,其中,a为daoy细胞gli1基因的荧光检测结果,b为mb726细胞gli1基因的荧光检测结果;
23.图8为免疫共沉淀试验检测结果;
24.图9为小鼠原位移植模型检测结果。
具体实施方式
25.所举实施例是为了更好地对本发明的内容进行说明,但并不是本发明的内容仅限于所举实施例。所以熟悉本领域的技术人员根据上述发明内容对实施方案进行非本质的改进和调整,仍属于本发明的保护范围。
26.实施例1
27.免疫组织化学染色,具体步骤为:
28.1.切片:所有的石蜡标本统一编号后,放入-20℃冰箱预冷冻、接着进行切片、摊片及风干;其中,切片的厚度均为3μm。
29.2.脱蜡:将石蜡切片放置到铁架子上,于60℃烤箱内烘烤45min,随后迅速放于二甲苯内浸泡15min,接着放于另一缸二甲苯内浸泡15min;然后置于100%酒精浸泡10min,随后置于95%(体积百分含量)酒精溶液中浸泡5min,接着置于85%(体积百分含量)酒精溶液中浸泡5min,然后置于75%(体积百分含量)酒精溶液中浸泡5min,再用自来水浸泡5min,随后用pbs溶液浸泡5min。
30.3.抗原修复:用pbs溶液润洗3次,每次5min;将切片放于装有修复液的高压锅中,加热至100℃后盖上盖子,高压作用2min30s;接着自来水冲洗降温高压锅,取出架子装入盛有修复液的修复盒中,自然冷却到室温。
31.4.内源性过氧化氢酶的灭活:取出浸泡在修复液中的切片,用pbs溶液润洗3次,每次5min,加入3%(质量百分含量)h2o2溶液,37℃下处理30min。
32.5.封闭:取出灭活的切片,pbs润洗3次,每次5min;随后取出切片放于湿盒中,切片组织上滴加山羊封闭血清,盖上湿盒盖。37℃烤箱中处理30min。
33.6.一抗孵育:切片轻轻地甩掉封闭血清,在组织切片上滴加稀释好的抗体,盖上湿盒盖,4℃冰箱内孵育过夜。
34.7.二抗孵育:取出湿盒放于37℃烤箱中复温15min;将切片放于修复盒中用pbs溶液润洗3次,每次5min。而后取出切片放于湿盒中,切片上滴加辣根过氧化物酶(3,3
’‑
diaminobenzidine,dab)标记的二抗,盖上湿盒盖;37℃烤箱中处理30min。
35.8.显色:取出湿盒,将切片放于修复盒中用pbs溶液浸洗3次,每次5min。而后取出切片放于显微镜下,滴加dab显色液。当显色到合适的程度立刻放到水中终止反应。
36.9.复染:自来水润洗3次,将切片浸入苏木精溶液内染色20s,然后用自来水充分漂洗,再浸入盐酸酒精分化液内作用1s后取出,在流动的自来水中浸泡返蓝。
37.10.脱水、透明及封固:将复染的切片置于75%酒精(体积百分含量)溶液中浸泡5min,随后置于85%酒精(体积百分含量)溶液中浸泡5min,接着用95%酒精(体积百分含量)溶液浸泡5min,然后用100%酒精浸泡10min;随后放于二甲苯内浸泡15min,接着放于另一罐二甲苯内浸泡15min;取出切片,放于通风橱中自然风干,随后滴加中性树胶50μl,用盖玻片封片,37℃烤箱中除去气泡后扫描保存。
38.免疫组织评分
39.采用image-pro plus 5.0软件进行免疫组化的评分,具体步骤如下:
40.1.图片采集
41.所有的图片采集都在同一台显微镜、同一个亮度、同样的放大倍数及同样的软件参数设定下进行。每一个样本的切片都在调至清晰视野下随机采集五张图片。
42.2.软件分析
43.(1)校正图片光密度:点击files按钮打开要计算的图片,在measure按钮下点击calibration,在intensity窗口里点new,然后选择std option density。options里更改incident level为230,不要关闭窗口。
44.(2)选色:在measure中选择count/size,点击select colors,使用hsi模式,将h值设定为0-30,s值设定为0-255,i值设定为0-230,然后点file-save,保存这个选色设置,以后计算每张图片的评分都加载这个选色设置文件。
45.(3)选择测量参数:count/size界面点击measure,选择select measurement,选择iod和area这两个参数。
46.(4)测定:用irregular工具画出测量区域,点count按纽。在view statistics窗口中读取测量数据iod sum数值,作为这张照片的累积光密度值。再次点击edit下的covert aoi(s)to obiect(s),再点count按纽,在view statistics窗口中读取测量数据area sum数值,作为这张照片的面积值。
47.(5)计算:每张照片的相对光密度为iod sum除以area sum的值,5个相对光密度的平均值即为这例标本的免疫组化评分值。
48.流式检测:
49.1.待检测细胞用胰酶消化,500
×
g离心5min,去掉多余上清。
50.2.沉淀用适量无钙镁的pbs重悬。
51.3.待检测细胞中加入notch2-apc和igg-apc抗体,冰上孵育1h,用无钙镁的pbs
52.洗一次,500g离心5min,重悬。
53.4.重悬后使用bd aria ii流式细胞分选仪器进行检测。
54.胞浆胞核蛋白提取
55.1.贴壁细胞胰酶消化后,500
×
g,离心5min收集细胞。
56.2.收集好的细胞用pbs洗两次。
57.3.将5
×
106的细胞转移到收集管中,500
×
g离心2-3min,去掉多余上清。
58.4.加入冷的cer i到细胞沉淀中,以最高速度剧烈的重悬细胞沉淀,在冰上放置10min
59.5.加入预冷的cer ii到裂解液中。
60.6.剧烈涡旋离心管5s,在冰上放置1min,以最高速度剧烈涡旋5s,紧接着16000
×
g离心5min。
61.7.立即转移胞浆蛋白到新的离心管中,备用。
62.8.用预冷的ner裂解液重悬上一步的细胞沉淀。
63.9.剧烈涡旋细胞核沉淀,每次15s,然后将样品放置冰上10min,接着重复此步骤四次,充分裂解细胞核,16,000
×
g离心10min。
64.10.立即转移上清到新的预冷离心管中,测浓度,western-blot备用。
65.细胞膜蛋白提取
66.1.用细胞刮棒将细胞从平板表面刮下,将5
×
106个细胞重悬在生长培养基中。将得到的细胞悬液以300
×
g的速度离心5min。
67.2.用3ml细胞清洗液清洗细胞沉淀,300
×
g离心5min。
68.3.小心移除并丢弃上清液。将细胞重悬在1.5ml的细胞清洗液中并转移到2ml的离心管中。300
×
g离心5min并丢弃上清液。
69.4.加入0.75ml透化缓冲液到细胞沉淀中。短暂涡旋以获得均质的细胞悬液。在持续混匀条件下在4℃孵育10min。
70.5.将透化后的细胞以16000
×
g的速度离心15min。小心去掉含有胞质蛋白的上清液并转移到一个新的离心管中。
71.6.加0.5ml增溶缓冲液到沉淀中并用移液管上下抽吸进行重悬。在持续混匀条件下在4℃孵育30min。
72.7.在4℃下,以16000
×
g的速度将管子离心15min,将含有可溶性膜蛋白和膜相关蛋白的上清液转移到一个新的离心管中。
73.western blot实验
74.1.样品裂解
75.(1)细胞样品弃去培养基,使用预冷的pbs冲洗3次,直接用预冷的pbs洗涤3次,离心去除pbs留下细胞沉淀,放置于冰上备用。
76.(2)加入适量细胞裂解液并充分混匀,放置于冰上,每10min后吹打一次,作用30min,4℃,14000
×
g离心15min,吸取上清液至新的ep离心管中。
77.(3)bca蛋白浓度检测试剂盒测定样品浓度,加入适量蛋白上样缓冲液将所有的样品调至相同的浓度,100℃放置5min使蛋白充分变性,冷却至室温,离心备用。
78.2.电泳检测
79.(1)使用微量注射器上样,每个泳道上样总蛋白为20μg,蛋白marker与1
×
loading buffer混合后等样品体积加入相应的孔中。
80.(2)以溴酚蓝为指示,恒压电泳,蛋白样本在上层胶时使用80v电压,当蛋白样本被压缩得很细并到达下层胶时,调整电压为120v,当溴酚蓝电泳到胶底端时结束电泳。
81.3.电转湿转:取大小合适的pvdf膜,甲醇活化后转移至转膜缓冲液中。按照滤纸、
膜、胶、滤纸的顺序放置,充分去除气泡,将所有转膜转备置于冰水中,200ma恒流转膜2h。
82.4.封闭:电转结束后,取出膜放入已配好的封闭液中,室温封闭2h。
83.5.一抗孵育:封闭结束后,用镊子小心夹出pvdf膜,剪去多余的边角,放置于配置好的一抗中,4℃孵育过夜。
84.6.洗膜及二抗孵育:第二天取出pvdf膜,pbst摇床上晃动洗涤3次,每次15min。将膜转移至相应种属的二抗液体中,pbst摇床上晃动孵育2h,然后使用pbst洗涤3次,每次15min。
85.7.图像采集:使用thermo公司显影液显影。
86.双萤光素酶实验
87.双萤光素酶实验的具体步骤如下:
88.1、报告基因质粒的构建。将目的片段插入到荧光素酶表达的报告基因载体上,。
89.2、转染细胞。将报告基因质粒和内参共转染细胞,根据需要对细胞进行处理。共转染时,由于内参具有很强的启动子,因此报告基因质粒:内参转染量一般为10:1~50:1。
90.luciferase活性测定:
91.⑴
初次使用时,配制lar ii,即firefly luciferase的底物。将lar ii溶解在lar ii buffer中,并分装-80℃避光保存。
92.⑵
加入1x plb,室温裂解细胞15min。
93.⑶
配制stop&glo,即renilla luciferase的底物,能够终止lar ii的反应。
94.⑷
测定荧光值。向40ul的lar ii中加入10ul细胞裂解液,吹打混匀后,检测读数,即为firefly luciferase的值。加入40ul stop&glo,再次读数,即为renilla luciferase的值。
95.⑸
数据处理。首先计算出每管的firefly luciferase/renillaluciferase的比值,再以control组的比值为单位1,即可得到不同处理组的相对luciferase活性,也就是该处理组基因转录的调控活性。
96.免疫共沉淀
97.免疫共沉淀实验采用thermo公司的co-ip试剂盒,具体操作步骤如下:
98.1.抗体与树脂交联
99.(1)取交联树脂轻轻混匀,吸取80μl加入层析柱中,1000
×
g离心1min,coupling buffer洗涤2次。
100.(2)10μg一抗或对应的igg、10μl氰基硼氢化钠和适量体积的coupling buffer混合为200μl的抗体交联混合液,封闭层析柱底部,将混合液加到层析柱中,4℃旋转交联2-4h:
101.2.细胞的收集、裂解及预清除
102.(1)髓母过表达kir2.1的细胞培养至汇合度达进行80%时,去除培养基,用预冷pbs润洗3次,细胞刮收集细胞于15ml离心管中,1000
×
g离心5min,随后将细胞转移至1.5ml的ep管中,离心后去除多余的pbs。
103.(2)收集的细胞中加入含有蛋白酶抑制剂的ip裂解液,充分吹散细胞,至沉淀消失,放置冰上裂解30min,每10min吹打一次。
104.(3)吸取80μl对照用交联树脂加入层析柱中,1000
×
g离心1min,coupling buffer
洗涤2次。
105.(4)细胞裂解液经过16000
×
g离心15min后取上清加入到预清除的离心柱中,4℃涡旋混合1h。
106.3.抗体第二次交联
107.(1)移除离心柱底部的塞子,1000
×
g离心1min,coupling buffer洗涤1次,淬灭缓冲液洗涤2次。
108.(2)10μl氰基硼氢化钠与200μl的淬灭缓冲液混合,加入到离心柱中,封闭底部,4℃涡旋混合15min。
109.4.抗体与蛋白交联
110.(1)移除抗体交联离心柱底部的塞子,1000
×
g离心1min,coupling buffer洗涤2次,wash buffer洗涤6次,裂解液2次,封闭底部。
111.(2)移除蛋白离心柱底部的塞子,1000
×
g离心1min,收集流出液加入到抗体交联离心柱中,4℃涡旋混合过夜。
112.5.蛋白洗脱及变性
113.(1)移除离心柱底部的塞子,1000
×
g离心1min,裂解液洗涤5次,wash buffer洗涤6次,细胞裂解液洗涤2次。
114.(2)更换收集管,加入200μlelution buffer,100
×
g离心1min,再加入50μl elution buffer,作用5min,1000
×
g离心1min。将50μl的收集液再加入到离心管中作用5min,1000
×
g离心1min。
115.(3)加入50μl的5
×
上样缓冲液,100℃煮5min,马上放冰上,12000rpm离心2min,随后进行western blot实验。
116.髓母原位移植瘤小鼠模型的建立
117.1.实验动物:4-6周龄雄性nod/scid小鼠购自湖南斯莱克景达,接种移植瘤后继续饲养于该中心,采用标准无病原菌条件。
118.2.动物麻醉:使用0.8%的水合氯醛溶液,按50mg/kg体重腹腔注射麻醉nod/scid小鼠。
119.3.接种的细胞数量为每只nod/scid小鼠接种5
×
104个细胞,用10μl无血清的dmem基础培养基重悬;每组各10只。
120.4.颅内移植瘤接种方法:选择前囟点右侧2mm,冠状缝之前0.5mm作为进针点,用75%酒精消毒,充分暴露进针部位。使用灭菌的20μl进样器进行注射进针深度约1mm-2mm并有突破感,缓慢间歇推注,注射时长为1min;完成注射后,进样器停留1min后缓慢退出;用75%乙醇溶液消毒进针口。
121.5.将nod/scid小鼠分组为:对照组、对照-vismodegib给药组、atxn1敲低组、atxn1敲低组-vismodegib给药组。自移植瘤种植7后开始给药,对照-vismodegib给药组和atxn1敲低组-vismodegib给药组的给药(将3.75mg vismodegib溶于50μl dmso溶液里,取其中50μl加入300μl peg300,混匀澄清后加入100μl tween80,混匀澄清后加入550μl ddh2o,混匀澄清),剂量为25mg/kg/day,对照组和atxn1敲低组给予相应剂量安慰剂(50μl dmso溶液,取其中50μl加入300μl peg300,混匀澄清后加入100μl tween80,混匀澄清后加入550μl ddh2o,混匀澄清),每星期连续给药5天,持续两个星期。
122.6.于移植瘤种植第7天、14天、21天和28天进行小动物活体成像,即每只小鼠腹腔注射200μl荧光素酶底物,使用异氟烷麻醉后于ivis活体成像仪中进行拍照观察;
123.7.nod-scid小鼠出现较重神经系统症状后,对其进行安乐死并统计生存期。
124.免疫组化实验结果如图1所示,生存分析检测结果如图2所示,流式分选检测结果如图3所示,成球培养检测结果如图4所示,斑马鱼模型异种移植实验检测结果如图5所示,蛋白表达试验检测结果如图6所示,荧光素酶基因检测试验检测结果如图7所示,免疫共沉淀试验检测结果如图8所示,小鼠原位移植模型检测结果如图9所示。
125.由图1可知,atxn1蛋白在所有亚型髓母细胞瘤中均高度表达,尤其是在shh亚型髓母细胞瘤患者中。
126.由图2可知,与atxn1蛋白表达较高的患者相比,atxn1蛋白表达较低的患者的总生存时间得到了显著延长。
127.由图3可知,与cd133阴性细胞相比,cd133阳性细胞中atxn1表达量更高。
128.由图4可知,与单层细胞相比,后发现成球后细胞中的atxn1更多。由此表明,atxn1增强了髓母细胞瘤细胞的干性。
129.由图5可知,对照组斑马鱼模型的后尾鳍中出现转移灶,而atxn1敲低组则未出现转移灶。
130.由图6可知,过表达atxn1之后,gli1入核增加,但总量不变。
131.由图7可知,过表达atxn1之后,gli1的荧光量增加。
132.由图8可知,txn1和sufu存在相互作用的关系,而gli1和sufu是hh信号通路中smo下游的关键分子,被确定为atxn1功能的主要因素。由此表明,atxn1破坏了gli1与其抑制剂sufu之间的相互作用,从而导致了mb中shh信号的激活。
133.由图9可知,通过hedgehog通路抑制剂vismodegib治疗和敲低atxn1发现,单用都能延长小鼠的生存期,减少小鼠肿瘤大小,联用之后效果更好。
134.此外,应当理解,虽然本说明书按照实施方式加以描述,但并非每个实施方式仅包含一个独立的技术方案,说明书的这种叙述方式仅仅是为清楚起见,本领域技术人员应当将说明书作为一个整体,各实施例中的技术方案也可以经适当组合,形成本领域技术人员可以理解的其他实施方式。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1