一种用于腺病毒载体疫苗免疫增强的蛋白质纳米递送载体
1.本发明公开了一种纳米载体,属于纳米材料技术领域。
背景技术:
2.腺病毒是核酸和蛋白质自组装形成的生物大分子,可被看作是粒径90-100nm、表面带负电的天然纳米颗粒。腺病毒载体疫苗安全性高,单次接种即可产生高效的免疫反应,已成功用于埃博拉病毒、新型肺炎冠状病毒等新发突发传染病防控。类似于其他病毒类载体疫苗,腺病毒载体疫苗同样存在预存免疫效应,即野生型病毒暴露感染产生的预存抗体会降低疫苗的免疫效力。以人5型腺病毒载体(ad5)为例,流行病学研究表明全球人群ad5血清阳性比例可达61.3%-94%。重组腺病毒载体埃博拉疫苗i期临床试验表明,预存免疫能够降低腺病毒载体疫苗免疫原性。
3.通过传统生物学手段,目前有两种思路解决腺病毒载体预存免疫效应:(1)开发稀有血清型病毒载体,包括26型、35型人腺病毒载体、黑猩猩腺病毒载体等,但由于其野生型病毒的感染性不高,基于这类病毒的载体疫苗能够激活的免疫反应往往也不够理想;(2)针对高预存抗体人群调整疫苗接种策略,单剂次增加接种剂量或多剂次加强免疫,在预存免疫屏障存在的条件下提高疫苗诱导产生的免疫反应,但会间接提高疫苗的使用成本。
4.聚焦学科交叉优势,理性设计新型纳米递送载体,降低预存抗体对腺病毒载体的识别,是突破预存免疫效应的重要研究方向,如通过化学方法在腺病毒载体表面偶联peg等高分子材料,或者使用脂质体纳米颗粒包裹。但目前的方法还存在若干不足:(1)共价修饰改变结构蛋白天然构象,影响腺病毒载体入胞效率;(2)脂质体纳米颗粒制备复杂,且自组装过程降低腺病毒载体活性。
技术实现要素:
5.针对现有技术缺陷,本发明的目的就是提供一种新型纳米递送载体,用于增强腺病毒载体疫苗免疫原性。该纳米递送载体基于蛋白质分子骨架设计,通过非共价相互作用,能够优化腺病毒载体表面性质并提高其入胞效率,提升靶基因表达水平并增强特异性抗体反应。
6.基于上述发明目的,本发明首先提供了一种蛋白质纳米递送载体,所述载体是由携带有可以用于化学偶联的伯氨基(-nh2)活性基团的蛋白质、n-丙烯酰氧基琥珀酰亚胺、丙烯酰胺、n-(3-氨基丙基)甲基丙烯酰胺盐、甲叉双丙烯酰胺经过硫酸铵和四甲基乙二胺引发自由基聚合反应制备而成。
7.在一个优选的实施方案中,所述携带有可以用于化学偶联的伯氨基(-nh2)活性基团的蛋白质为人血清白蛋白。
8.在一个更为优选的实施方案中,所述人血清白蛋白、n-丙烯酰氧基琥珀酰亚胺、丙烯酰胺、n-(3-氨基丙基)甲基丙烯酰胺盐、甲叉双丙烯酰胺的比例为1:20:3000:100-1000:400。
9.在一个更为优选的实施方案中,所述人血清白蛋白、n-丙烯酰氧基琥珀酰亚胺、丙烯酰胺、n-(3-氨基丙基)甲基丙烯酰胺盐、甲叉双丙烯酰胺的比例为1:20:3000:400:400。
10.本发明通过化学偶联对蛋白质进行表面重塑,蛋白质粒径由小变大,优选为15至50nm,表面电位由负变正,优选为+2至+20mv。偶联试剂可选用含有含氮胺基基团的正电小分子和中性小分子,并可通过调节中性小分子和正电小分子的比例调控递送载体表面电位。
11.在一个更为优选的实施方案中,为降低递送载体本身的免疫原性,所述蛋白质为人源蛋白,优选为人血清白蛋白,其他种类蛋白质在制备纳米递送载体的过程中具有相同作用。
12.其次,本发明提供了上述的蛋白质纳米递送载体的制备方法,所述方法包括以下步骤:
13.(1)将携带有可以用于化学偶联的伯氨基(-nh2)活性基团的蛋白质稀释于50mm硼酸盐缓冲液(ph 8.5),与n-丙烯酰氧基琥珀酰亚胺(nas)在室温共温育2小时,蛋白与nas摩尔比为1:20;
14.(2)加入丙烯酰胺(aam)、n-(3-氨基丙基)甲基丙烯酰胺盐(apm)、甲叉双丙烯酰胺(bis),蛋白与aam、apm、bis的摩尔比为1:3000:100-1000:400,再加入适量过硫酸铵(aps)和四甲基乙二胺(temed),蛋白与aps、temed的摩尔比为1:250:1000,引发自由基聚合反应,室温反应1小时;
15.(3)通过离子交换层析色谱除去未修饰蛋白,获得产物。
16.在一个优选的实施方案中,所述携带有可以用于化学偶联的伯氨基(-nh2)活性基团的蛋白质为人血清白蛋白。
17.在一个更为优选的实施方案中,所述方法步骤(2)中蛋白与aam、apm、bis的摩尔比为1:3000:400:400。
18.第三,本发明提供了上述的蛋白质纳米递送载体与腺病毒载体自组装而成的复合物。
19.在一个优选的实施方案中,所述腺病毒载体为人5型腺病毒载体。
20.在一个更为优选的实施方案中,蛋白质纳米递送载体与腺病毒载体自组装的摩尔比例为10
3-105:1。
21.第四,本发明提供了上述的蛋白质纳米递送载体与腺病毒载体自组装而成的复合物的制备方法,所述方法包括以下步骤:
22.(1)蛋白质纳米递送载体与腺病毒载体在室温下孵育10分钟;
23.(2)静电相互作用下自组装形成复合物。
24.通过本发明提供的蛋白质纳米递送载体与腺病毒载体自组装成复合物的方法,带正电的纳米递送载体与腺病毒载体共孵育,在非共价静电相互作用下,该递送载体在腺病毒载体表面能够形成刺突状微观结构。
25.第四,本发明提供了上述的蛋白质纳米递送载体与腺病毒载体自组装而成的复合物在制备腺病毒载体靶基因表达调节剂中的应用。本发明发现蛋白质纳米递送载体与腺病毒载体自组装复合物能够增强腺病毒载体靶基因表达,在靶基因作为治疗性蛋白或治疗性抗体编码基因应用时,本应用可以在基因治疗或抗体治疗中得到应用。
26.在一个优选的实施方案中,所述靶基因为治疗性蛋白或者治疗性抗体的编码基因。
27.最后,本发明提供了上述的蛋白质纳米递送载体与腺病毒载体自组装而成的复合物在制备用于腺病毒载体疫苗中的应用。
28.在一个优选的实施方案中,所述腺病毒载体疫苗为埃博拉病毒病腺病毒载体疫苗或新型冠状病毒肺炎腺病毒载体疫苗。
29.本发明提供的纳米递送载体能够提高腺病毒载体颗粒入胞效率,并能够显著增强腺病毒载体在肺组织高效表达靶基因,能够用于基因治疗、抗体治疗等技术领域。
30.在应用中,上述递送载体能够增强重组腺病毒载体埃博拉疫苗和新冠疫苗抗体反应,在本发明的一个优选应用方式中,可以经滴鼻递送,能够同时增强体液免疫和黏膜免疫水平。表明上述递送载体对腺病毒载体疫苗具有通用的免疫增强作用。
31.本发明还证实上述递送载体与腺病毒载体的自组装复合物具有良好的生物相容性,细胞水平未体现细胞毒性,体内水平未体现肾毒性、肝毒性、红细胞毒性和肺组织损伤。
附图说明
32.图1.蛋白质纳米递送载体细胞内吞活性检测;
33.图2.蛋白质纳米递送载体细胞毒性检测;
34.图3.动态光散射检测蛋白质纳米递送载体粒径;
35.图4.高效液相色谱层析检测蛋白质纳米递送载体;
36.图5.动态光散射检测蛋白质纳米递送载体表面电位;
37.图6.透射电镜检测腺病毒载体与纳米递送载体自组装复合物微观结构;
38.图7.动态光散射检测腺病毒载体与纳米递送载体自组装复合物粒径;
39.图8.细胞水平检测蛋白质纳米递送载体与腺病毒载体自组装复合物的生物相容性;
40.图9.细胞水平检测纳米递送载体对腺病毒载体靶基因(ad5-luc)表达的增强效应;
41.图10.细胞水平检测纳米递送载体对腺病毒载体靶基因(ad5-gfp)表达的增强效应;
42.图11.细胞水平检测纳米递送载体对腺病毒载体靶基因表达增强的剂量依赖效应;
43.图12.活体成像检测单次滴鼻给药后纳米递送载体对腺病毒载体靶基因表达的增强效应;
44.图13.单次滴鼻给药后纳米递送载体增强腺病毒载体肺脏靶基因表达动力学变化曲线;
45.图14.单次滴鼻给药后10天检测纳米递送载体增强腺病毒载体靶基因表达的表面电位依赖效应;
46.图15.单次滴鼻免疫后10天检测纳米递送载体增强腺病毒载体靶基因表达的剂量依赖效应;
47.图16.不同剂量单次滴鼻免疫ad5-ebov后血清中埃博拉gp蛋白igg抗体水平对比;
48.图17.单次滴鼻接种ad5空载体4周后检测血清ad5预存igg抗体水平;
49.图18.高预存抗体模型中单次滴鼻免疫ad5-ebov后血清中埃博拉gp蛋白igg抗体水平对比;
50.图19.高预存抗体模型中单次滴鼻免疫ad5-ebov后14周肺灌洗液中埃博拉gp蛋白igg抗体水平对比;
51.图20.高预存抗体模型中单次滴鼻免疫ad5-ncov后血清中新冠s蛋白igg抗体水平对比;
52.图21.高预存抗体模型中滴鼻免疫ad5-ncov后12周肺灌洗液中新冠s蛋白iga抗体水平对比;
53.图22.高预存抗体模型中滴鼻免疫ad5-ncov后4周新冠假病毒血清中和抗体水平对比;
54.图23.单次滴鼻免疫7天后腺病毒载体与纳米递送载体自组装复合物的血生化、血常规检测
55.图24.单次滴鼻免疫7天后腺病毒载体与纳米递送载体自组装复合物的肺组织病例检测
具体实施方式
56.下面结合具体实施例来进一步描述本发明,本发明的优点和特点将会随着描述而更为清楚。但这些实施例仅是范例性的,并不对本发明的权利要求所限定的保护范围构成任何限制。
57.实施例1
58.1.蛋白质纳米递送载体与腺病毒载体自组装形成复合物
59.通过表面性质重塑,对蛋白质进行粒径和表面电位的优化,制备出正电蛋白质纳米颗粒,能够与带负电的腺病毒载体自组装,并增强其生物学活性。
60.(1)蛋白质纳米递送载体制备
61.蛋白质表面性质优化可通过化学偶联和融合蛋白生物合成实现。化学偶联法对蛋白质性质无特定要求,仅需要蛋白质表面含有赖氨酸,包含能够用于化学偶联的伯氨基(-nh2)活性基团。可选蛋白质种类包括重组蛋白和天然提取蛋白,优选人源蛋白质,作为递送载体具有良好的生物相容性和较低的免疫原性。进一步优选人血清白蛋白,安全性高,可规模化制备,已作为药物载体用于上市药物和
62.以下以化学偶联和人血清白蛋白为例,介绍蛋白质纳米递送载体的一种制备方法:
63.人血清白蛋白(hsa)稀释于50mm硼酸盐缓冲液(ph 8.5),与n-丙烯酰氧基琥珀酰亚胺(nas)在室温共温育2小时,蛋白与nas摩尔比为1:20。随后加入丙烯酰胺(aam)、n-(3-氨基丙基)甲基丙烯酰胺盐(apm)、甲叉双丙烯酰胺(bis),蛋白与aam、apm、bis的摩尔比为1:3000:100-1000(具体可为1:100、1:200、1:300、1:400、1:500、1:1000):400,再加入适量过硫酸铵(aps)和四甲基乙二胺(temed),蛋白与aps、temed的摩尔比为1:250:1000,引发自由基聚合反应,室温反应1小时后透析换液。通过离子交换层析色谱除去未修饰蛋白。基于上述化学偶联方法,通过调节合成过程中添加的正电单体(apm)含量,制备出(+)hsanp-1、
(+)hsanp-2、(+)hsanp-3、(+)hsanp-4、(+)hsanp-5和(+)hsanp-6(hsa与apm的摩尔比分别为1:100、1:200、1:300、1:400、1:500和1:1000),
64.(2)蛋白质纳米递送载体细胞内吞活性
65.对(+)hsanp纳米递送载体进行fitc荧光分子标记,pbs(ph 7.4)缓冲液中,1mg(+)hsanp加入fitc分子(摩尔比1:4),室温避光反应1小时后,超滤换液纯化。96孔板培养a549、3t3、cho、hela和j774常用细胞系,每孔1x104个细胞(100ul/孔),共孵育fitc荧光标记的(+)hsanp纳米递送载体(终浓度2ug/ml),24小时后加入hoechst 33258进行细胞核染色(终浓度5ug/ml,孵育10min),pbs清洗后荧光成像并定量分析细胞荧光强度。结果表明上述(+)hsanp具有高效的细胞递送活性,以(+)hsanp-4为例,其细胞内吞荧光强度在a549、3t3、cho、hela和j774细胞中,分别达到空白对照组的64、58、36、46和18倍(图1中,0为空白对照,1-6分别为(+)hsanp-1、(+)hsanp-2、(+)hsanp-3、(+)hsanp-4、(+)hsanp-5和(+)hsanp-6)。随着(+)hsanp中apm含量的增高,细胞内吞效率整体呈现先升高后降低的趋势。
66.(3)蛋白质纳米递送载体细胞毒性检测
67.96孔板培养a549、3t3、cho、hela和j774细胞,每孔1x104个细胞(100ul/孔),加入不同含量的(+)hsanp纳米递送载体(终浓度分别为0、0.25、1、2、4、10ug/ml),共孵育24小时后使用cck-8试剂盒检测细胞毒性。结果(图2)表明(+)hsanp-1、(+)hsanp-2、(+)hsanp-3和(+)hsanp-4在各个细胞均表现出良好的安全性,在10ug/ml的高剂量仍具有与空白对照组相当的细胞存活率。而对于(+)hsanp-5和(+)hsanp-6,在j774细胞中,剂量大于2ug/ml时表现出明显的细胞毒性,10ug/ml时细胞生存率降为20%左右。表明(+)hsanp纳米载体中正电小分子(apm)的含量,即纳米载体表面电位的高低,对细胞毒性具有重要影响。基于上述安全性考虑,后续仅针对(+)hsanp-1、(+)hsanp-2、(+)hsanp-3和(+)hsanp-4开展研究。
68.(4)蛋白质纳米递送载体理化性质表征
69.动态光散射(图3)和高效液相色谱层析(hplc)(图4)表明,与天然白蛋白相比,蛋白质纳米递送载体(+)hsanp具有更大的尺寸,直径约为20nm。动态光散射测得hsa蛋白质的zeta电位为-5.68mv,而(+)hsanp-1、(+)hsanp-2、(+)hsanp-3和(+)hsanp-4的zeta电位分别为+5.47mv、+9.75mv、+15.2mv和+16.6mv(图5中,0为hsa,1-4分别为(+)hsanp-1、(+)hsanp-2、(+)hsanp-3和(+)hsanp-4)。表明相对于天然蛋白质,制备出的蛋白质纳米递送载体可实现蛋白质的表面电位翻转,并可通过调节正电小分子含量,精确调控纳米递送载体的表面电位大小。
70.(5)蛋白质纳米递送载体与腺病毒载体自组装效应
71.腺病毒是二十面体(粒径90-100nm)、无包膜结构、表面带负电的天然纳米颗粒。在静电相互作用下,蛋白质纳米递送载体能够与腺病毒载体发生自组装,并形成复合物。以(+)hsanp-4(+16.6mv)和ad5型重组腺病毒载体埃博拉疫苗(ad5-ebov)为例,ad5-ebov制备方法详见本技术人前期专利(一种以人复制缺陷腺病毒为载体的埃博拉病毒病疫苗,zl201610067289.8)。在pbs缓冲液(ph 7.4)中,总体积10ul,3
×
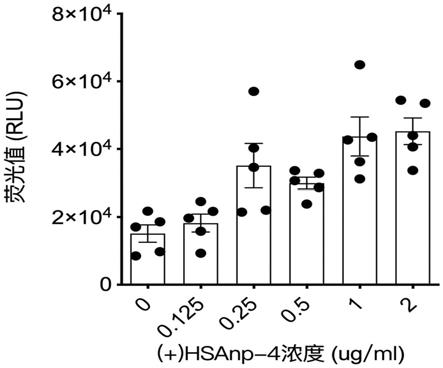
109个ad5-ebov病毒颗粒与(+)hsanp-4室温共孵育(摩尔比1:10
3-105)5-30分钟,即可形成自组装复合物。以ad5-ebov和(+)hsanp-4的摩尔比为1:1.5
×
103为例,透射电镜检测可在病毒衣壳表面观察到类刺突状微观结构(图6)。动态光散射检测ad5/(+)hsanp-4自组装复合物的直径为160.4nm,比ad5直径(115.3nm)大45nm,约为(+)hsanp-4的2倍直径(图7中,1为ad5,2为ad5/(+)hsanp-4)。
纳米递送载体的表面电位对与ad5自组装形成复合物的结构具有重要影响,较低表面电位的(+)hsanp,如(+)hsanp-1(+5.47mv),与ad5共孵育后易产生聚集体,透射电镜和动态光散射难以检测到颗粒度均一的复合物。
72.(6)蛋白质纳米递送载体与腺病毒载体自组装复合物的细胞毒性检测
73.96孔板培养a549、hela和3t3细胞,每孔1x104个细胞(100ul/孔)。以编码萤火虫荧光素酶的5型腺病毒载体ad5-luc为例,ad5-luc购自汉恒生物,扩增纯化方法参考申请人前期专利(一种以人复制缺陷腺病毒为载体的埃博拉病毒病疫苗,zl201610067289.8)。ad5-luc病毒颗粒分别与(+)hsanp-1、(+)hsanp-2、(+)hsanp-3和(+)hsanp-4室温共孵育10分钟形成自组装复合物(ad5-luc与各(+)hsanp摩尔比为1:6x104),加入细胞孔,ad5-luc终浓度为106ifu/ml,(+)hsanp纳米递送载体终浓度为1ug/ml。24小时后使用cck-8试剂盒检测细胞毒性,结果(图8)表明自组装复合物对3种细胞均无明显的细胞毒性,细胞生存率与ad5-luc单独孵育时相当。
74.实施例2.蛋白质纳米递送载体与腺病毒载体自组装复合物增强靶基因表达
75.(1)细胞水平增强靶基因(荧光素酶报告基因)表达
76.96孔板培养a549、3t3、cho、hela和thp-1细胞,每孔1x104个细胞。(+)hsanp与ad5-luc室温共孵育10min形成自组装复合物后加入细胞,(+)hsanp终浓度为1ug/ml,ad5-luc终浓度为106ifu/ml,ad5-luc与各(+)hsanp摩尔比为1:6x104,终体积100ul。细胞培养24小时后用试剂盒(promega,e1501)检测荧光素酶表达量。结果(图9)表明在不同细胞系中,经统计分析(graphpad prism 8软件,ordinary one way anova with dunnett's multiple comparisons test),(+)hsanp显著增强ad5-luc靶基因表达。以ad5-luc/(+)hsanp-4自组装复合物为例,对于3t3、cho、hela和thp-1细胞,自组装复合物将ad5-luc的表达量分别增加至9.8倍、2.4倍、1.6倍和3.4倍。此外,荧光素酶靶基因表达增强存在纳米递送载体表面电位依赖效应,以3t3细胞为例,(+)hsanp-1、(+)hsanp-2、(+)hsanp-3和(+)hsanp-4,分别增强ad5-luc表达量1.0倍、5.4倍、8.3倍和9.8倍,其中(+)hsanp-4与ad5-gfp自组装形成的复合物表达量最高。
77.(2)细胞水平增强靶基因(绿色荧光蛋白报告基因)表达
78.除了能够增强上述荧光素酶报告基因的表达(ad5-luc),蛋白质纳米递送载体与腺病毒载体的自组装复合物也能够增强绿色荧光蛋白(gfp)的表达。ad5-gfp购自汉恒生物,扩增纯化方法参考申请人前期专利(一种以人复制缺陷腺病毒为载体的埃博拉病毒病疫苗,zl201610067289.8)。96孔板培养hela细胞,每孔1x104个细胞。(+)hsanp与ad5-gfp室温共孵育10min后加入细胞,(+)hsanp终浓度为1ug/ml,ad5-gfp终浓度为106ifu/ml,ad5-gfp与各(+)hsanp摩尔比为1:3.8x104,终体积100ul。细胞培养24小时后荧光成像并定量分析细胞gfp荧光强度。结果(图10)表明,经统计分析(graphpad prism 8软件,ordinary one way anova with dunnett's multiple comparisons test),(+)hsanp显著增强gfp阳性细胞百分比和胞内gfp荧光强度。以ad5-gfp/(+)hsanp-4自组装复合物为例,相对于对照组ad5-gfp,阳性细胞百分比从58%增加至85%,胞内gfp荧光强度增加至3.3倍。此外,gfp表达增强存在纳米递送载体表面电位依赖效应,(+)hsanp-1、(+)hsanp-2、(+)hsanp-3和(+)hsanp-4,分别增强ad5-gfp表达量1.2倍、2.3倍、2.6倍和3.3倍,其中(+)hsanp-4与ad5-gfp自组装形成的复合物表达量最高。
79.(3)细胞水平检测靶基因表达增强对纳米递送载体剂量的依赖效应
80.96孔板培养hela细胞,每孔1x104个细胞。不同含量的(+)hsanp分别与ad5-luc室温共孵育10min后加入细胞,(+)hsanp-4的终浓度为0.125、0.25、0.5、1、2ug/ml,ad5-luc终浓度为106ifu/ml,ad5-luc与(+)hsanp-4的摩尔比分别为1:7.5x103、1:1.5x104、1:3x104,1:6x104和1:1.2x105。细胞培养24小时后检测荧光素酶表达量。结果(图11)表明,随着(+)hsanp-4含量的增长,ad5-luc/(+)hsanp-4自组装复合物相比ad5-luc对照,荧光素酶表达量分别增强1.2倍、2.3倍、2.0倍、2.9倍和3.0倍,其中ad5-luc与(+)hsanp-4摩尔比达到1:6x104时表达量达到最高值。
81.(4)活体成像检测靶基因表达增强的生物分布及动力学变化
82.5-6周龄balb/c雌小鼠(购自维通利华)分为5组(5只/组),每组或单次滴鼻ad5-luc对照组(5x10
6 ifu/只),或单次滴鼻ad5-luc与递送载体的自组装复合物(室温共孵育10分钟形成),包括ad5-luc/(+)hsanp-1、ad5-luc/(+)hsanp-2、ad5-luc/(+)hsanp-3或ad5-luc/(+)hsanp-4,其中ad5-luc剂量为5x10
6 ifu/只,(+)hsanp剂量为1ug/只,ad5-luc与(+)hsanp摩尔比为1:1.2x104。分别在滴鼻1、5、10、30、60、120天后,体内活体成像检测荧光素酶表达水平。
83.活体成像生物分布(图12)定性分析表明,单次滴鼻给药后,ad5-luc对照组主要在滴鼻部位表达靶基因,而ad5-luc/(+)hsanp-3和ad5-luc/(+)hsanp-4自组装复合物能够在小鼠肺脏表达靶基因,相比对照组靶基因整体表达量得到显著增强。对活体成像进行定量分析(图13),以ad5-luc/(+)hsanp-4为例,给药后1天即可观测到ad5-luc/(+)hsanp-4自组装复合物在肺脏的靶基因表达,给药后10天表达量达到最大值,随后逐渐降低至120天仍高于对照ad5-luc。
84.(5)活体成像检测靶基因表达增强对纳米递送载体表面电位和剂量的依赖效应
85.与体外结果一致,体内靶基因表达增强同样存在纳米递送载体表面电位和剂量依赖效应。重复上述活体成像动物实验,在单次滴鼻给药后10天解剖小鼠,取出肺组织进行荧光成像,定量分析肺组织荧光表达量。结果(图14)表明随着(+)hsanp表面电位增高,ad5-luc/(+)hsanp自组装复合物靶基因表达量也随之增高,ad5-luc/(+)hsanp-1、ad5-luc/(+)hsanp-2、ad5-luc/(+)hsanp-3和ad5-luc/(+)hsanp-4肺脏靶基因表达量分别为ad5-luc对照组的0.8倍、4.8倍、84.2倍和226.9倍,其中ad5-luc与(+)hsanp-4形成的自组装复合物体内表达量最高。
86.5-6周龄balb/c雌小鼠(购自维通利华)分为6组(5只/组),每组单次滴鼻ad5-luc,或ad5-luc与(+)hsanp-4自组装复合物(室温共孵育10分钟形成),其中ad5-luc剂量固定为5x10
6 ifu/只,(+)hsanp-4剂量分别为0.25、0.5、1、2或5ug/只,ad5-luc与(+)hsanp-4摩尔比分别为1:3x103、1:6x103、1:1.2x104、1:2.4x104、1:6x104。给药后10天解剖小鼠,取出肺组织荧光成像,并定量分析肺组织荧光表达量。结果(图15)表明随着(+)hsanp-4给药剂量的增高,ad5-luc/(+)hsanp-4自组装复合物靶基因表达量先升高后降低,0.25、0.5、1、2和5ug/只剂量的(+)hsanp-4,荧光表达量分别是对照组的18.2倍、83.3倍、155.9倍、132.8倍和94.2倍,其中ad5-luc与(+)hsanp-4摩尔比达到1:1.2x104时体内表达量达到最高值。
87.实施例3.蛋白质纳米递送载体与腺病毒载体自组装复合物增强疫苗免疫原性
88.(1)单次滴鼻增强重组腺病毒载体埃博拉疫苗抗体反应
ncov免疫后2、4、8、12周取血清,elisa检测新冠s蛋白特异性抗体水平。经统计分析(prism软件,ordinary two-way anova with dunnett's multiple comparisons test),结果(图20)表明在预存免疫模型中,ad5-ncov和(+)hsanp-4自组装复合物能够显著提升ad5-ncov抗体反应,在免疫后2、4、8、12周,血清igg抗体含量是对照组ad5-ncov的1.5倍、2.3倍、1.9倍和1.3倍。免疫后12周安乐死小鼠,elisa检测肺灌洗液中s特异性抗体,经统计分析(graphpad prism 8软件,unpaired t test),结果(图21)表明ad5-ncov和(+)hsanp-4自组装复合物显著提升ad5-ncov黏膜免疫反应,iga抗体水平是对照组ad5-ncov的1.7倍。
95.对ad5-ncov免疫后4周血清进行假病毒中和抗体检测,sars-cov-2假病毒自行制备(制备方法参考文献:lu l,liu q,zhu y,chan k-h,qin l,li y,et al.structure-based discovery of middle east respiratory syndrome coronavirus fusion inhibitor.2014;5(1):1-12.),梯度稀释的血清与新冠假病毒共孵育后加入细胞,假病毒被抗体中和后无法进入细胞表达荧光。通过数据处理(graphpad prism 8软件),将荧光信号转换为ed
50
(中和50%假病毒的血清稀释倍数)。经统计分析(graphpad prism 8软件,unpaired t test),结果(图22)表明ad5-ncov和(+)hsanp-4自组装复合物显著提升ad5-ncov中和抗体水平,ed
50
值为263,是对照组的2.2倍。
96.实施例4.蛋白质纳米递送载体与腺病毒载体自组装复合物体内安全性检测
97.5-6周龄balb/c雌小鼠(购自维通利华),每组5只,共4组,分别单次滴鼻pbs(空白对照)、(+)hsanp-4(纳米递送载体对照)、ad5-ebov(腺病毒载体疫苗对照)和ad5-ebov/(+)hsanp-4自组装复合物,其中(+)hsanp-4剂量为1ug/只,ad5-ebov剂量为5x106ifu/只。单次滴鼻后7天取血清,进行血常规和血生化检测,cr(肌酐)、bun(尿素氮)和ua(尿酸)指标用于检测肾功能,ast(天门冬氨酸氨基转移酶)、alt(谷丙转氨酶)和alp(碱性磷酸酶)指标用于检测肝功能,rbc(红细胞数)、hgb(血红蛋白)和mch(平均红细胞血红蛋白量)指标用于检测红细胞功能。经统计分析(prism软件,ordinary two-way anova with dunnett's multiple comparisons test),结果(图23)表明单次滴鼻7天后,ad5-ebov/(+)hsanp-4自组装复合物实验组小鼠的以上各项指标都处于正常范围,与空白对照组、纳米递送载体对照和疫苗对照组无统计差异。滴鼻后7天对小鼠实施安乐死,解剖取肺组织,酒精梯度脱水,石蜡包埋切片,苏木素/伊红染色后显微镜镜检。病理切片结果(图24)表明,ad5-ebov/(+)hsanp-4自组装复合物未产生肺损伤,肺组织结构与对照组无差别。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1