一种厚壳贻贝免疫活性六肽脂质体的制备方法
1.本发明属于生物医药技术领域,具体涉及一种厚壳贻贝免疫活性六肽脂质体的制备方法。
背景技术:
2.厚壳贻贝(mytilus coruscus),属软体动物门(mollusca)、瓣鳃纲(lamellibranchia)、异柱目(anisomyaria)、贻贝科(mytilidae),富产于浙江省嵊泗列岛周围海域,是一种高蛋白、低脂肪、富含多种营养成分的双壳类海洋软体动物。作为传统的滋补食疗品,贻贝素有“海中鸡蛋”的美誉。现代科学研究表明,贻贝具有极高的营养价值,干贻贝含50~70%的蛋白质,6~15%的脂肪,8~14%糖类,并富含多种维生素及钙、磷、铁、碘等营养成分。贻贝还有很高的药用价值和食疗功效,据《本草纲目》记载,贻贝肉能治“虚劳伤惫,精血衰少,吐血久痢,肠鸣腰痛”。《大明日华子本草》:“煮熟食之,能补五脏,益阳事,理腰脚气,消宿食,除腹中冷气”。现代临床试验表明,长期食用贻贝,对肝肾不足、眩晕盗汗、肾阳虚弱、 腰痛、小腹冷痛以及高血压、动脉血管硬化等均有一定疗效。
3.脂质体是由磷脂等双亲性分子在水相溶液中形成的具有细胞膜类似结构的优良载体,可以包裹亲水、亲脂和两亲性的药物和营养因子,既可保护药物和营养因子,降低其毒副作用,达到缓释目的,又可提高药物的靶向性和生物利用度。脂质体的制备方法主要有薄膜分散法、超声分散法、乙醇注入法、超临界法等。目前广泛使用的方法为薄膜分散法和超声分散法。薄膜分散法是将磷脂和胆固醇等类脂溶于有机溶剂,然后将溶液置于圆底烧瓶中,旋转减压蒸干有机溶剂,从而在烧瓶内壁上挂上一层类脂分子膜;随后加入缓冲溶液,充分震荡烧瓶使脂质膜水化脱落得到脂质体。
4.当前厚壳贻贝活性物质研究相对较少,根据中国传统中医药学典籍记载贻贝具有促进机体的免疫能力增强的功能,并且得到相应活性的多肽;但对该种类多肽脂质体的研究还少之又少。
技术实现要素:
5.本发明的目的在于提供一种厚壳贻贝免疫活性六肽脂质体的制备方法,该制备方法制得的脂质体具有更加优异的包封率,稳定性也得到了显著的改善;同时,该脂质体的药物缓释性能更佳,且具有良好的透皮吸收能力。
6.本发明为实现上述目的所采取的技术方案为:一种厚壳贻贝免疫活性六肽脂质体的制备方法,包括:上述厚壳贻贝免疫活性六肽脂质体采用薄膜分散法制备得到;上述脂质体原料至少包括卵磷脂、胆固醇;上述厚壳贻贝免疫活性六肽的氨基酸序列为leu-val-val-leu-gly-his。脂质体能够增强药物的溶解性、实现靶向给药、降低药物毒副作用、实现缓释和长效给药、提高药物的稳定性、提高药物的跨膜转运、提高生物利用度等,具有极强的实用价值。本发明采用
薄膜分散法制备得到脂质体,其作为药物载体与厚壳贻贝免疫活性六肽复混的大厚壳贻贝免疫活性六肽脂质体,能够有效延长药物的作用时间,促进药物的吸收,提高生物利用度,且无毒性和刺激性。
7.具体地,上述厚壳贻贝免疫活性六肽脂质体的制备方法,包括:取卵磷脂、胆固醇,转移至圆底烧瓶中,在磁力搅拌器上边搅拌边加入乙醚溶解;取出搅拌子,减压旋转蒸发去除乙醚,形成均匀薄膜;常温下在磁力搅拌器上边搅拌边用注射器缓慢滴入浓度为0.04~0.06g/ml的厚壳贻贝免疫活性六肽水溶液,随后加入含吐温-80的ph 7~7.5的磷酸盐缓冲液旋转水合,至薄膜完全脱离形成乳白色液体,超声30~40min;混悬液用0.45μm微孔滤膜过滤,得厚壳贻贝活性肽脂质体,于2~4℃下保存备用。
8.对本发明而言,卵磷脂、胆固醇的质量比为4~6:1。
9.对本发明而言,卵磷脂与乙醚的固液比为0.04~0.06g:1ml;吐温-80加入量为磷酸盐缓冲液体积的0.6~0.8%;磷酸盐缓冲液与厚壳贻贝免疫活性六肽水溶液的体积比为1.4~1.6:1。
10.对本发明而言,厚壳贻贝免疫活性六肽脂质体的包封率≥68.3%。
11.对本发明而言,厚壳贻贝免疫活性六肽脂质体的平均粒径为475~520nm。
12.优选地,胆固醇由改性胆固醇替代;上述改性胆固醇为壳寡糖衍生物-胆固醇接枝物。本发明采用金盏花苷e改性壳寡糖得到其衍生物,然后再通过壳寡糖衍生物对胆固醇进行化学修饰,得到壳寡糖衍生物-胆固醇接枝物,然后作为脂质体制备原料,制备得到厚壳贻贝免疫活性六肽脂质体,明显改善了脂质体的包封效果,其包封率显著增加;并且脂质体的稳定性也得到有效改善。同时,脂质体的体外缓释行为明显提升,能够有效延长药物的作用时间;且脂质体的透皮吸收能力得到增强,有效促进药物的吸收,进一步提高生物利用度。
13.优选地,厚壳贻贝免疫活性六肽脂质体的制备过程中采用海参素替代20~40wt%量的胆固醇或壳寡糖衍生物-胆固醇接枝物。本发明在脂质体的制备过程中加入海参素,与胆固醇或壳寡糖衍生物-胆固醇接枝物复配使用,均能够对脂质体缓释行为产生有益的影响;并且海参素与壳寡糖衍生物-胆固醇接枝物同时使用,还能够进一步提升脂质体的包封率。
14.对本发明而言,壳寡糖衍生物由金盏花苷e酰氯化后对壳寡糖衍生物结构中的羟基进行修饰得到。
15.上述壳寡糖衍生物的制备方法,具体包括:取壳寡糖,冰浴条件下加入甲烷磺酸溶解,浓度为0.8~1.5g/ml;反应30~60min后得到带保护的壳寡糖;取金盏花苷e,按照固液比0.2~0.3g:1ml的比例加入socl2,55~70℃下反应5~8h,整个反应过程中严格控制干燥条件;反应结束后冷却至室温,旋蒸除去未反应的socl2,然后加入少量无水甲苯继续旋蒸,并重复操作2~3次,得到酰氯化金盏花苷e;取酰氯化金盏花苷e,缓慢滴加带保护的壳寡糖,置于室温下反应4~6h,然后置于-15~-20℃下过夜,之后加入到过量丙酮中,得到大量沉淀,离心,沉淀用丙酮沉淀3~5次得到带保护的壳寡糖衍生物;取带保护的壳寡糖衍生物,加入去离子水使其完全溶解,然后用氨水调节ph至8.0~8.5,析出褐色沉淀,离心,沉淀用丙酮洗涤3~5遍,然后再用无水乙醇索氏抽提48~52h,真
空干燥得到壳寡糖衍生物。
16.对本发明而言,金盏花苷e与socl2的固液比为0.2~0.3g:1ml。
17.对本发明而言,带保护的壳寡糖与酰氯化金盏花苷e的体积比为1:0.3~0.5。
18.上述壳寡糖衍生物-胆固醇接枝物的制备方法,包括:壳寡糖衍生物与胆固醇在催化剂的作用下发生酰胺化反应制备的到壳寡糖衍生物-胆固醇接枝物。
19.具体地,上述壳寡糖衍生物-胆固醇接枝物的制备方法,包括:壳寡糖衍生物-胆固醇的制备,取胆固醇、edc、nhs混合,加入适量dmso溶解,置于50~60℃加热反应1.5~2h;然后缓慢滴入溶解于dmso中的壳寡糖衍生物,继续搅拌反应48~54h;之后将反应应液移至透析袋装中进行透析,每隔6~8h换一次水,透析54~72h;取透析后的上清液冻干得到壳寡糖衍生物-胆固醇接枝物。
20.对本发明而言,胆固醇、edc、nhs的质量比为1:1.9~2.1:0.8~1;壳聚糖衍生物与胆固醇的质量比为10~15:1。
21.本发明又公开了上述制备方法制得的壳寡糖衍生物-胆固醇接枝物。
22.本发明还公开了上述壳寡糖衍生物-胆固醇接枝物在制备脂质体中的用途。
23.本发明还公开了上述制备方法制得的厚壳贻贝免疫活性六肽脂质体在制备药物制剂中的用途。
24.本发明的又一目的在于,提供了厚壳贻贝免疫活性六肽在制备调节体内免疫活性药物中的用途。
25.相比于现有技术,本发明具有如下有益效果:本发明采用薄膜分散法制备得到脂质体,其作为药物载体与厚壳贻贝免疫活性六肽复混的大厚壳贻贝免疫活性六肽脂质体,能够有效延长药物的作用时间,促进药物的吸收,提高生物利用度,且无毒性和刺激性。此外,采用金盏花苷e改性壳寡糖得到其衍生物,然后再对胆固醇进行化学修饰作为脂质体制备原料之一,明显改善了脂质体的包封效果,其稳定性明显增加,且脂质体的体外缓释效果得到有效改善,透皮吸收能力显著提升,有效促进药物的吸收。同时,在脂质体的制备过程中加入海参素,与胆固醇或壳寡糖衍生物-胆固醇接枝物复配使用,均能够对脂质体缓释行为产生有益的影响;并且海参素与壳寡糖衍生物-胆固醇接枝物同时使用,进一步提升了脂质体的包封率。
26.因此,本发明提供了一种厚壳贻贝免疫活性六肽脂质体的制备方法,该制备方法制得的脂质体具有更加优异的包封率,稳定性也得到了显著的改善;同时,该脂质体的药物缓释性能更佳,且具有良好的透皮吸收能力。
附图说明
27.图1为本发明不同浓度各合成肽对raw 264.7相对细胞增殖率的影响;图2为本发明不同浓度各合成肽对raw 264.7的no分泌的影响;图3本发明厚壳贻贝免疫活性六肽的高效液相色谱图;图4为本发明厚壳贻贝免疫活性六肽的质谱图;图5为本发明试验例1中壳寡糖及其衍生物的红外光谱测试结果;图6为本发明实施例1制备的脂质体的实物图;图7为本发明实施例1制备的脂质体的洗脱曲线;
图8为本发明试验例2中脂质体体外缓释行为测试结果。
具体实施方式
28.以下结合具体实施方式和附图对本发明的技术方案作进一步详细描述:本发明实施例所用壳寡糖购自浙江金科药业有限公司,相对分子质量为1.5kda。所用海参素购自西安立环生物科技有限公司。
29.本发明实施例所用厚壳贻贝免疫活性六肽的氨基酸序列为leu-val-val-leu-gly-his。其制备过程如下:1.1厚壳贻贝活性肽的制备厚壳贻贝肉去除足丝后流水洗净,放入组织匀浆机中绞碎;将碎肉与异丙醇按1:4(g/ml)的比例混合,搅拌均匀后于55℃脱脂2h,重复两次;脱脂结束后,弃去上清液,将剩下的厚壳贻贝肉用纯水洗至无醇味,收集沉淀;以料液比1:12加入纯水,用0.1mol/l hcl或0.1mol/l naoh调节ph为6,以2000u/g加入胰蛋白酶,在37℃水浴搅拌酶解6h,随后将酶解液煮沸15min灭活;冷却后,于4℃预冷条件下,5000g离心10min获取上清液;所得上清液经tff cogent μscale系统超滤,最终得到《1kda的酶解液,经旋转蒸发冷冻干燥后得到厚壳贻贝粗肽(mcp)。
30.1.2厚壳贻贝活性肽的分离纯化1.2.1 sephadex g-25凝胶柱分离纯化将预先处理的sephadex g-25凝胶装柱,装柱体积5.0
×
45cm,先用1.0ml/min的超纯水作为流动相平衡4个柱体积。将冻干的厚壳贻贝粗肽配制成浓度为0.2g/ml的溶液,上样量2ml,上样前先用0.22μm的滤膜过滤,用1.0ml/min的超纯水洗脱,每管收集时间间隔3min,在280 nm处测定各管吸光度。以管数为横坐标,吸光度为纵坐标绘制组分曲线,收集各峰冷冻干燥,进行mtt实验,筛选出对巨噬细胞raw 264.7相对增殖率最高的峰进一步分离纯化。
31.分离纯化结果分析:经sephadex g-25凝胶柱分离后,于280nm出测定各管吸光值得2个洗脱峰。收集各洗脱峰,冷冻干燥后进行mtt实验,测定不同组分的相对增殖率,mcp粗肽作为对比,选择对raw 264.7细胞的相对增殖率最高的组分,用rp-hplc进一步分离纯化。
32.1.2.2 rp-hplc分离纯化将1.2.1中相对增殖率最高的峰的组分用hplc进一步分离纯化。选用zorbax sb-c18分析型色谱柱(5μm 9.4
×
250mm),柱温25℃,进样量为10μl,以超纯水为流动相a、乙腈为流动相b,洗脱条件为:0-5min 10% b洗脱、5-15min 10%-50% b洗脱、15-25min 50% b洗脱、25-30min 50%-100% b洗脱、30-35min 100% b洗脱;洗脱流速为0.5ml/min,并于280nm处检测收集峰。选择最高峰冻干后进行测序。
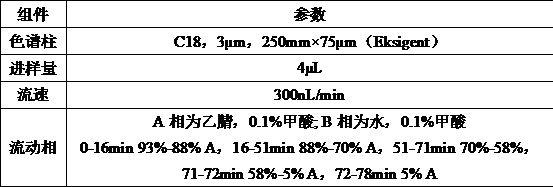
33.1.2.3 lc-ms/ms检测取1.2.2中最高峰冻干样品配制1 mg/ml溶液,用0.22μm滤膜过滤后上样进行lc-ms/ms分析,所得结果用peaks软件进行de-novo检索及数据库检索。数据处理过程中,首先根据每张ms/ms谱图中的碎片的分子量信息计算出可能的氨基酸组合,然后再比对到样本来源的蛋白数据库中。样本采用ncbi中mytilus物种的蛋白数据库。色谱条件如表1所示:表1 色谱条件
质谱仪器为 orbitrap fusion lumos (thermofisher),检测条件:正离子检测模式,一级分辨率为120000,agc设置为3e6,扫描范围300-1400m/z。1张ms谱中选10个强度最高的离子进行ms/ms分析,二级分辨率为15000,agc设置为2e4,分离窗口1.6m/z。
34.结果分析:经lc-ms/ms检测后,通过置信度以及uniprot蛋白数据库中mytilus物种的蛋白数据的比对结果,筛选出6条肽序列,如表2所示:表2 mcp中选择的6种合成肽的理化性质1.2.4最佳肽序列的筛选根据测序结果肽序列的置信度以及uniprot蛋白数据库中mytilus物种的蛋白数据的比对结果,筛选出6条肽序列对raw 264.7进行相对细胞增殖率及no含量测定,选择效果最好的肽序列。
35.结果分析:将1.2.3中选出的6条肽序列fggggf、lvvlgh、fvlpr、lltdy、llal、flfer分别编号
①
、
②
、
③
、
④
、
⑤
、
⑥
,测定不同浓度(50、100、200μg/ml)的肽序列对raw 264.7相对细胞增殖率及no分泌的影响,结果如图1-2。由图可知,
②
号肽lvvlgh(lh-6)对raw 264.7的相对增殖作用及促no合成的能力最高,故选择lh-6进行后续实验。
36.lh-6的高效液相色谱表征和质谱表征如图3-4所示。
37.实施例1:一种厚壳贻贝免疫活性六肽脂质体的制备:按照质量比5:1的比例取卵磷脂、胆固醇,转移至圆底烧瓶中,在磁力搅拌器上边搅拌边加入乙醚溶解,卵磷脂与乙醚的固液比为0.05g:1ml;取出搅拌子,减压旋转蒸发去除乙醚,形成均匀薄膜;常温下在磁力搅拌器上边搅拌边用注射器缓慢滴入浓度为0.052g/ml的厚壳贻贝免疫活性六肽水溶液,随后加入含吐温-80(加入量为磷酸盐缓冲液体积的0.72%)的ph 7.2的磷酸盐缓冲液(与厚壳贻贝免疫活性六肽水溶液的体积比为1.5:1)旋转水合,至薄膜完全脱离形成乳白色液体,超声35min;混悬液用0.45μm微孔滤膜过滤,得厚壳
贻贝活性肽脂质体(实物图如图6所示),于4℃下保存备用。其中,厚壳贻贝活性肽脂质体的平均粒径499.8
±
20.13nm,pdi为0.655
±
0.044。
38.实施例2:一种厚壳贻贝免疫活性六肽脂质体的制备与实施例1的区别在:卵磷脂、胆固醇的质量比为5.6:1。
39.实施例3:壳寡糖衍生物的制备:取壳寡糖,冰浴条件下加入甲烷磺酸溶解,浓度为1.2g/ml;反应45min后得到带保护的壳寡糖;取金盏花苷e,按照固液比0.24g:1ml的比例加入socl2,64℃下反应6h,整个反应过程中严格控制干燥条件;反应结束后冷却至室温,旋蒸除去未反应的socl2,然后加入少量无水甲苯继续旋蒸,并重复操作3次,得到酰氯化金盏花苷e;取酰氯化金盏花苷e,缓慢滴加带保护的壳寡糖(与酰氯化金盏花苷e的体积比为1:0.4),置于室温下反应5h,然后置于-18℃下过夜,之后加入到过量丙酮中,得到大量沉淀,离心,沉淀用丙酮沉淀5次得到带保护的壳寡糖衍生物;取带保护的壳寡糖衍生物,加入去离子水使其完全溶解,然后用氨水调节ph至8.3析出褐色沉淀,离心,沉淀用丙酮洗涤4遍,然后再用无水乙醇索氏抽提52h,真空干燥得到壳寡糖衍生物。
40.壳寡糖衍生物-胆固醇接枝物的制备:壳寡糖衍生物-胆固醇的制备,按照质量比为1:2:0.92的比例取胆固醇、edc、nhs混合,加入适量dmso溶解,置于55℃加热反应h;然后缓慢滴入溶解于dmso中的壳寡糖衍生物(与胆固醇的质量比为12.6:1),继续搅拌反应48h;之后将反应液移至透析袋装(mwco=1kda)中进行透析,每隔6h换一次水,透析72h;取透析后的上清液冻干得到壳寡糖衍生物-胆固醇接枝物。
41.一种厚壳贻贝免疫活性六肽脂质体的制备与实施例1的区别在:采用壳寡糖衍生物-胆固醇接枝物替代胆固醇。
42.实施例4:壳寡糖衍生物的制备与实施例3的区别在:金盏花苷e与socl2的固液比为0.27g:1ml;带保护的壳寡糖与酰氯化金盏花苷e的体积比为1:0.46。
43.壳寡糖衍生物-胆固醇接枝物的制备与实施例3的区别在:壳聚糖衍生物与胆固醇的质量比为11.8:1。
44.一种厚壳贻贝免疫活性六肽脂质体的制备与实施例3的区别在:壳寡糖衍生物-胆固醇接枝物为本实施例制备的。
45.实施例5:壳寡糖衍生物的制备与实施例3的区别在:金盏花苷e与socl2的固液比为0.22g:1ml;带保护的壳寡糖与酰氯化金盏花苷e的体积比为1:0.32。
46.壳寡糖衍生物-胆固醇接枝物的制备与实施例3的区别在:壳聚糖衍生物与胆固醇的质量比为14.5:1。
47.一种厚壳贻贝免疫活性六肽脂质体的制备与实施例1的区别在:壳寡糖衍生物-胆
固醇接枝物为本实施例制备的。
48.实施例6:一种厚壳贻贝免疫活性六肽脂质体的制备与实施例1的区别在:厚壳贻贝免疫活性六肽脂质体的制备过程中采用海参素替代30wt%的胆固醇。
49.实施例7:壳寡糖衍生物的制备与实施例3相同。
50.壳寡糖衍生物-胆固醇接枝物的制备与实施例3相同。
51.一种厚壳贻贝免疫活性六肽脂质体的制备与实施例3的区别在:厚壳贻贝免疫活性六肽脂质体的制备过程中采用海参素替代30wt%的壳寡糖衍生物-胆固醇接枝物。
52.实施例8:壳寡糖衍生物-胆固醇的制备与实施例3的区别在:采用壳寡糖替代壳寡糖衍生物。
53.一种厚壳贻贝免疫活性六肽脂质体的制备与实施例3的区别在:壳寡糖衍生物-胆固醇接枝物为本实施例制备的。
54.试验例1:1、红外光谱表征样品的傅里叶变换红外光谱采用溴化钾压片法测定,波长范围4000~500cm-1
,分辨率4cm-1
。
55.对壳寡糖和实施例3制备的壳寡糖衍生物进行上述测试,结果如图5所示。从图中分析可知,相比于壳寡糖的红外光谱,实施例3制备得到的壳寡糖衍生物的红外图谱中,在1743cm-1
附近出现c=o键的特征吸收峰;在1672cm-1
附近出现c=c键的特征吸收峰;以上结果表明实施例3中壳寡糖衍生物成功制备。
56.2、包封率测定标准曲线的制备:依次精密量取配制好的厚壳贻贝活性肽液,得质量浓度分别为0.02、0.04、0.06、0.08、0.1mg/ml的肽溶液,在220nm处测量吸光度,并绘制标准曲线;得到的标准曲线方程为:y=11.67x+0.0222,r=0.9995。
57.包封率的测定:精密量取2ml厚壳贻贝活性肽脂质体于处理好的sephadex g-25凝胶柱上,用磷酸盐缓冲溶液(ph 7.2)进行洗脱。每管间隔3min收集洗脱液,于220nm处测定吸光度。分别以管数和吸光度为横坐标和纵坐标,绘制洗脱曲线。收集脂质体于50ml容量瓶中,加入适量的甲醇在超声条件下破乳,定容,测定吸光度,对比标准曲线可知药物含量。根据下列公式计算包封率:包封率%=被包封药物含量/(被包封药物含量+游离药物含量)
×
100%对实施例1~8制备的脂质体进行上述测试,其中实施例1制得脂质体的洗脱曲线如图7所示,各脂质体的包封率测试结果如表3所示:表3 包封率测试结果样品包封率/%实施例168.3实施例267.9实施例378.1
实施例477.5实施例577.8实施例668.6实施例781.2实施例872.9从表3中数据分析可知,实施例3制备得到的脂质体的包封率明显高于实施例1和实施例8的,表明采用金盏花苷e修饰壳寡糖得到其衍生物,再对胆固醇进行改性得到壳寡糖衍生物-胆固醇接枝物,作为脂质体的原料之一,能够显著提升脂质体的包封率。实施例6的效果与实施例1相当,实施例7的效果显著好于实施例3,表明脂质体制备过程中海参素的加入,与壳寡糖衍生物-胆固醇接枝物复配使用,对脂质体包封率的提升具有增益效果。
58.3、稳定性测定对取脂质体样品置于4℃条件下,放置一定时间,并采用马尔文激光纳米粒径仪对其粒径进行考察,直至粒径出现较大波动(平均粒径变化超出10%),记录其稳定时间。具体的,粒径测定操作为:取脂质体用pbs稀释10倍,吹打混匀后转移至粒径专用杯中,保证无气泡,测量其粒径。
59.对实施例1~8制备的脂质体进行上述测试,结果如表4所示:表4 稳定性测试结果样品时间/d实施例130实施例229实施例339实施例440实施例538实施例631实施例740实施例835从表4中数据分析可知,实施例3制备得到的脂质体的稳定时间明显高于实施例1和实施例8的,表明采用金盏花苷e修饰壳寡糖得到其衍生物,再对胆固醇进行改性得到壳寡糖衍生物-胆固醇接枝物,作为脂质体的原料之一,能够显著提升脂质体的稳定性。实施例6的效果与实施例1相当,实施例7的效果与实施例3相当,表明脂质体制备过程中海参素的加入,与胆固醇或壳寡糖衍生物-胆固醇接枝物复配使用,对脂质体稳定性不产生消极影响。
60.试验例2:体外缓释效果测定取脂质体样品2m,加入透析袋中,用夹子夹好两端封口,施加压力并保证不漏液;将透析袋完全放入释放介质(0.5%的pbs,30ml)中,7℃水浴、100rpm振摇,分别于0、0.25、0.5、1、2、4、6、8、12、16、24h取样1ml,同时加补1ml缓释介质,hplc上样分析,绘制缓释曲线。
61.对实施例1、实施例3、实施例6和实施例7制备得到的脂质体进行上述测试,结果如图8所示。从图中分析可知,实施例3制备得到的脂质体在24h的累积释放量要高于实施例1,
且缓释效果好于实施例1,表明采用金盏花苷e修饰壳寡糖得到其衍生物,再对胆固醇进行改性得到壳寡糖衍生物-胆固醇接枝物,作为脂质体的原料之一,能够有效改善脂质体的缓释行为,增加其释放量。实施例6的效果稍好于实施例1,实施例7的效果明显好于实施例3,表明海参素的加入,与胆固醇或壳寡糖衍生物-胆固醇接枝物复配使用,均能够对脂质体缓释行为产生有益的影响。
62.试验例3:脂质体凝胶透皮吸收效果的测定脂质体凝胶的制备:称取卡波姆940加水配制质量分数为0.4%,放置过夜,使之充分溶解溶胀,用三乙醇胺适量调节ph 6.5,得空白凝胶基质;然后将处方量脂质体加至空白凝胶基质中,并加入少许甘油研和均匀,即得脂质体凝胶。其中,药物(厚壳贻贝免疫活性六肽)质量分数2%。
63.实验方法鼠皮的制备:取小鼠处死后,放入8%硫酸钠酒精溶液中,等毛发变为浅黄色时取出,用生理盐水清洗,并从腹部剪开剥离皮肤,剔除皮下组织和脂肪,漂洗干净后4℃存储待用。
64.离体透皮试验:取鼠皮,真皮层面向接受池固定,其有效面积为6.8cm2,接收室体积为28ml;在接受池内注满生理盐水,将凝胶适量加入供给池中,并使之紧贴于鼠皮角质层面,在37℃恒温水浴、200r/min条件下搅拌,于12h从接收池中取出全部接收液置于水浴上蒸干,然后加乙醇定容至5ml,采用hplc进样测定厚壳贻贝免疫活性六肽含量,计算皮肤累积透过量。
65.对实施例1~8制备的脂质体进行上述测试,结果如表5所示:表5 皮肤累积透过量测试结果样品皮肤累积透过率/%实施例113.6实施例213.2实施例316.9实施例417.1实施例517.0实施例613.8实施例717.5实施例813.9从表5中数据分析可知,实施例3制备得到的脂质体的皮肤透过率明显高于实施例1和实施例8的,表明采用金盏花苷e修饰壳寡糖得到其衍生物,再对胆固醇进行改性得到壳寡糖衍生物-胆固醇接枝物,作为脂质体的原料之一,能够明显增强脂质体的皮肤透过率。实施例6的效果与实施例1相当,实施例7的效果与实施例3相当,表明脂质体制备过程中海参素的加入,与胆固醇或壳寡糖衍生物-胆固醇接枝物复配使用,对脂质体透皮吸收不产生消极影响。
66.上述实施例中的常规技术为本领域技术人员所知晓的现有技术,故在此不再详细赘述。
67.以上所述,仅为本发明的具体实施方式,但本发明的保护范围并不局限于此,任何熟悉本技术领域的技术人员在本发明揭露的技术范围内,可轻易想到变化或替换,都应涵盖在本发明的保护范围之内。因此,本发明的保护范围应以所述权利要求的保护范围为准。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1