一种负载中药的多功能缓释微球及其制备方法和应用
1.本发明涉及生物材料技术领域,尤其涉及一种负载中药的多功能缓释微球及其制备方法和应用。
背景技术:
2.微载体作为一种具有生物功能的新型球状细胞支架,在组织工程领域引起广泛关注。与其他支架形式相比,微载体可以担载药物、为细胞生长提供较大的比表面积,能装载足够量的细胞,此外微载体还可以作为一种可注射物来使用。根据表面特性,微载体还可以进一步分为固体微载体和多孔微载体,多孔微载体因为其开放的孔隙结构,可以提供更大的比表面积和更大的体积,利于细胞粘附、增殖和生长,更利于氧气和营养物质的转移。到目前为止,制备聚合物微载体主要有乳化-凝固、挤压、喷雾干燥、静电滴注等方法。在制备过程中,可以添加一些材料作为制孔剂,以形成孔隙结构。复乳法是指将致孔剂(水溶性)溶液均化到油溶性聚合物溶液中形成w/o单一乳液。然后,将该单乳液重新乳化到水溶液中,形成w1/o/w2双乳剂。该双乳液进一步搅拌,使溶剂蒸发以除去挥发性有机溶剂。最后,在去除致孔剂后,产生了具有多孔结构的微球。这种方法中,搅拌速度、乳化速度、致孔剂类型和致孔剂用量等制备条件会影响不同的微载体的特性。例如,搅拌速度会显著影响微载体的粒度分布,而致孔剂类型和剂量影响微载体的孔径大小和孔隙度。总而言之,可以通过改变制备条件来控制微载体的微观结构。
技术实现要素:
3.有鉴于此,本发明要解决的技术问题在于提供一种负载中药的多功能缓释微球及其制备方法和应用,制备的微球具有良好的药物控释作用,且为组织再生提供了仿生微环境。
4.本发明提供了一种负载中药的多功能缓释微球的制备方法,包括以下步骤:
5.s1)将明胶溶于水中形成明胶水溶液,记为内水相;
6.将羟基磷灰石粉末和pgcl在氯仿中混合,形成均相溶液,记为油相;
7.将pva溶于水中形成pva水溶液,记为外水相;
8.s2)将内水相、油相和淫羊藿苷粉末混合,形成乳化液,得到初乳;
9.s3)将初乳和外水相混合,得到复乳,除去溶剂后得到载药微球;
10.s4)将上述载药微球和大鼠骨髓间充质干细胞共培养,得到负载中药的多功能缓释微球。
11.本发明优选的,所述明胶水溶液的浓度为5wt%~10wt%,更优选为7wt%。
12.本发明优选的,所述油相中,羟基磷灰石粉末的浓度为0.3%~1%(w/v);更优选为0.5%(w/v);pgcl的浓度为3%~10%(w/v);更优选为4.5%(w/v)。
13.本发明优选的,所述pgcl为羟基乙酸(ga)和己内酯(cl)的共聚物,其中cl和ga的摩尔比为7:3,8:2,9:1;更优选为9:1;所述pgcl的分子量为5~15万da;更优选为1
×
105。所
述分子量指数均分子量。
14.本发明优选的,所述制备油相具体为:
15.将羟基磷灰石粉末悬浮于氯仿中,超声使其分散均匀,将pgcl按一定质量比溶于氯仿,制成均相溶液。
16.本发明优选的,所述pva水溶液的浓度为2wt%~5wt%;更优选为3wt%。
17.然后将内水相和油相混合,再加入淫羊藿苷粉末,形成乳化液,得到包覆淫羊藿苷和羟基磷灰石的油包水结构。本发明优选的,所述形成乳化液的方法为用超声细胞粉粹仪超声。
18.所述pgcl与羟基磷灰石和淫羊藿苷粉末的质量比优选为90:10:0.32。
19.本发明将水溶性较差的药物共混入聚合物溶液,可以利于控制药物缓释。
20.本发明优选的,所述步骤s3)具体为:
21.将初乳缓慢加入到1200rpm下搅拌的外水相中,得到复乳,500rpm搅拌至有机溶剂挥发,离心收集,冷冻干燥得到载药微球。该载药微球为pgcl微球包覆明胶小球的复合结构,pgcl相中包覆有羟基磷灰石粉末和淫羊藿苷。
22.然后在微球表面修饰ecm,本发明优选的,所述步骤s4)具体为:
23.将上述载药微球和大鼠骨髓间充质干细胞共培养7天,收集微球至pbs溶液中,-80℃冷冻10min,37℃恒温摇床60rpm震荡20min,-80℃冷冻过夜,干燥后得到负载中药的多功能缓释微球。
24.本发明另一方面提供了一种负载中药的多功能缓释微球,为表面修饰有ecm的pgcl包覆明胶的结构,其中,pgcl相内包覆有淫羊藿苷粉末和羟基磷灰石粉末。
25.本发明采用脱细胞ecm修饰载药微球,从仿生学角度模拟了成骨过程;载药微球在生理环境下由于明胶溶解原位制孔,既可增加细胞粘附性,又可控制药物释放。
26.基于此,本发明提供了上述制备方法制备的负载中药的多功能缓释微球,或上述负载中药的多功能缓释微球,在制备骨损伤修复产品中的应用。
27.与现有技术相比,本发明提供了一种负载中药的多功能缓释微球的制备方法,包括以下步骤:s1)将明胶溶于水中形成明胶水溶液,记为内水相;将羟基磷灰石粉末和pgcl在氯仿中混合,形成均相溶液,记为油相;将pva溶于水中形成pva水溶液,记为外水相;s2)将内水相、油相和淫羊藿苷粉末混合,形成乳化液,得到初乳;s3)将初乳和外水相混合,得到复乳,除去溶剂后得到载药微球;s4)将上述载药微球和大鼠骨髓间充质干细胞共培养,得到负载中药的多功能缓释微球。
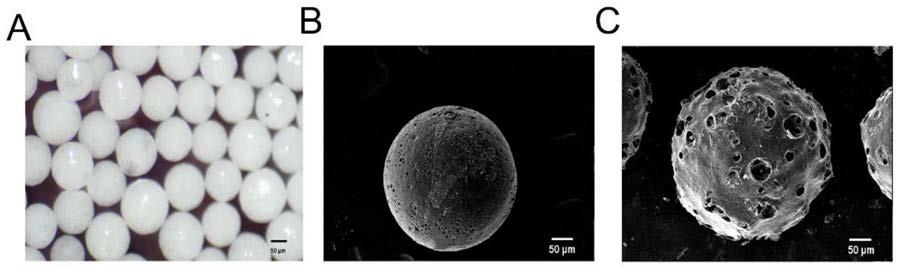
28.本发明通过乳液法,制备了球形度良好、表面包被脱细胞ecm的pgcl载药多孔微载体,并且用微载体担载天然植物分子淫羊藿苷,使微载体具备骨缺损的修复功能。与传统载药微载体相比,该产品具有以下优势:
29.1、可以通过明胶在生理条件下易溶解的特性使微载体在体内原位制孔,既增加了微载体表面的细胞黏附性又可防止药物在非生理环境下无效释放;此外明胶可增加微球表面细胞黏附性,利于后续ecm修饰微球;
30.2、微载体表面覆盖骨髓间充质干细胞来源的脱细胞ecm,使载药微球包含许多生物活性肽和生长因子,可招募体内间充质干细胞并携带生长因子及其他信号分子,从仿生学角度模拟了成骨过程,为组织再生提供了一个良好的微环境;
31.3、微球形成孔径较大的多孔结构,增大了可供细胞生长的比表面积,利于氧气和营养物质的流通,同时增加了药物释放的比表面积;
32.4、制备简便,球形度好,机械性好,有较强的药物担载与控释能力。
附图说明
33.图1为本发明制备的微球的大体外观图和sem图;
34.图2为担载淫羊藿苷的微载体体外药物释放曲线;
35.图3为微球修饰ecm后的alp染色和定量图;
36.图4为微球修饰ecm后的ars染色和钙定量图。
具体实施方式
37.为了进一步说明本发明,下面结合实施例对本发明提供的负载中药的多功能缓释微球及其制备方法和应用进行详细描述。
38.实施例1
39.1)制备内水相:将明胶溶于蒸馏水中加热搅拌,制成7wt%明胶水溶液;
40.2)制备油相:将羟基磷灰石粉末悬浮于氯仿中,超声使其分散均匀,将pgcl(cl:ga=9:1,mn:1
×
105)按一定质量比溶于氯仿,制成5%(w/v)均相溶液;
41.3)制备外水相:将pva(cas:9002-89-5)溶于蒸馏水中,制成3wt%溶液,磁力搅拌;
42.4)制备初乳:将内水相与油相混合,加入淫羊藿苷粉末,使淫羊藿苷与pgcl和羟基磷灰石的质量比约为90:10:0.32,用超声细胞粉粹仪超声得到乳化液;
43.5)制备复乳:将初乳缓慢加入到1200rpm下搅拌的外水相中,得到复乳,500rpm搅拌至有机溶剂挥发,离心收集,冷冻干燥得载药微球。
44.6)制备ecm涂层:将载药微球与大鼠骨髓间充质干细胞在完全培养基中共培养7天后,收集微球至pbs溶液中,-80℃冷冻10min,37℃恒温摇床60rpm震荡20min,-80℃冷冻过夜,干燥后得脱细胞ecm修饰的载药多孔微载体。
45.对制备的微球形貌进行表征,结果如图1所示,其中,a为体视显微镜下载药微球的sem图;b为扫描电镜下载药微球的sem图;c为扫描电镜下脱细胞ecm修饰的载药微球的sem图;由图1可以看出,所制备的微球尺寸为150~250微米,微球表面粗糙。种植骨髓间充质干细胞并脱细胞后,微球表面覆盖一层ecm,并且因为明胶的溶解,在微球表面形成了微米级孔道。
46.对微球进行药物缓释测定,结果如图2所示,图2是担载淫羊藿苷的微载体体外药物释放曲线,可以看出,载药微球对对担载的淫羊藿苷具有缓释作用。
47.对微球进行促mc-3t3-e1细胞成骨分化能力(碱性磷酸酶活性)测定,结果如图3所示,图3是各组分微载体上播种大鼠骨髓间充质干细胞,体外培养7天后,alp染色和定量(mcs:空白pgcl/ha/gel微载体;m-ica:担载淫羊藿苷的pgcl/ha/gel微载体;m-ica@ecm:表面包被成骨细胞外基质的淫羊藿苷载药微载体)。
48.对微球进行促mc-3t3-e1细胞生物矿化能力测定,结果如图4所示,图4是各组分微载体上播种大鼠骨髓间充质干细胞,体外培养7天后,ars染色和钙定量(mcs:空白pgcl/ha/gel微载体;m-ica:担载淫羊藿苷的pgcl/ha/gel微载体;m-ica@ecm:表面包被成骨细胞外
基质的淫羊藿苷载药微载体)。
49.以上实施例表明通过所述方法,制备的载淫羊藿苷缓释微球表面粗糙,且具有多孔结构,并能够有效的控制了淫羊藿苷的释放。细胞实验表明,该微球能够有效的促进mc-3t3-e1细胞的成骨分化和生物矿化,可以用于骨组织损伤修复。
50.以上实施例的说明只是用于帮助理解本发明的方法及其核心思想。应当指出,对于本技术领域的普通技术人员来说,在不脱离本发明原理的前提下,还可以对本发明进行若干改进和修饰,这些改进和修饰也落入本发明权利要求的保护范围内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1