多西他赛制剂的制作方法
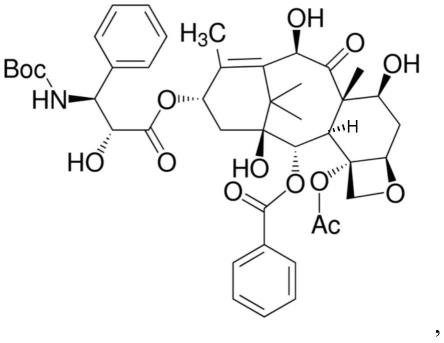
多西他赛制剂
1.相关申请的交叉引用
2.本技术要求2020年2月4日提交的美国专利申请号62/970,055;2020年3月3日提交的美国专利申请号62/984,465;以及2021年1月28日提交的美国专利申请序列号63/142,811的优先权,上述的每一个申请都通过引用整体并入本文。
技术领域
3.本发明涉及用于治疗增殖性疾病的制剂,更具体地涉及包含多西他赛或其药学上可接受的盐和人血清白蛋白的制剂,更具体地涉及包含多西他赛或其药学上可接受的盐、人血清白蛋白和乙醇的制剂。
背景技术:
4.许多肠胃外使用的药物不溶于水,因此采用向患者施用时具有刺激性、过敏性或毒性的增溶剂、表面活性剂、溶剂和/或乳化剂配制。参见,例如briggs et al.,anesthesis 37,1099(1982),和waugh et al.,am.j.hosp.pharmacists,48,1520(1991)。此外,许多这些药物,尤其是那些静脉内施用的药物,会引起不希望的副作用,例如静脉刺激、静脉炎、注射时灼痛和疼痛、静脉血栓形成、外渗和其他与施用相关的副作用。此外,存在于制剂中的常见游离药物在施用时会引起疼痛或刺激。
5.紫杉烷在各种实体瘤的治疗中发挥着重要作用。作为第二代半合成的紫杉烷衍生物,多西他赛抑制微管解聚的效力是紫杉醇的大约两倍,并且具有改变某类微管的独特能力,这与目前临床上使用的大多数纺锤体毒素不同。但是,多西他赛的水溶性非常差。市售多西他赛的临床静脉施用采用每毫升含40mg多西他赛和1040mg聚山梨醇酯80的高浓度溶液配制。这种浓溶液在施用前必须用溶剂(含13%乙醇的盐水溶液)小心稀释,并且由于其稳定性有限,必须在4小时内使用。这些属性限制了多西他赛的施用。此外,据报道,多西他赛的施用与无法预测的(急性)超敏反应和累积液体潴留的发生有关。参见,例如,trudeau me et al.,j clin oncol 1996;14:422-8,piccart mj et al.,j natl cancer inst 1995;87:676-81,bruno r et al.,j clin oncol 1998;16:187-96。这些副作用部分归因于聚山梨醇酯80的存在。
6.us 2005/0282734描述了紫杉醇和白蛋白的复合物。该专利中描述的成功制剂要求ph值呈酸性。wo 2014/121033描述了喜树碱和白蛋白的复合物。us 2012/0076862描述了紫杉烷和白蛋白的纳米颗粒。us 2010/0076008描述了与人血清白蛋白非共价结合的紫杉醇。wo2016/187147描述了多西他赛和人血清白蛋白的复合物和组合物。wo 2018/081520描述了多西他赛和人血清白蛋白的中性ph组合物。wo 2018/204386描述了多西他赛和人血清白蛋白的制剂和组合物。wo 2019/200084描述了多西他赛、人血清白蛋白和氨基酸的制剂和组合物。
7.本领域还需要具有更好的安全性并且更便于临床使用的多西他赛制剂。本技术中描述的组合物和方法有助于满足这种需要。
技术实现要素:
8.目前,市场上的泰索帝(taxotere)制剂包括单瓶制剂或双瓶制剂(注射剂和稀释剂)。单瓶制剂含有溶于聚山梨醇酯80和乙醇中的多西他赛溶液。双瓶制剂含有溶于聚山梨醇酯80中的多西他赛溶液和含有乙醇水溶液的溶剂瓶。
9.在向患者施用前,双瓶制剂需要进行两次稀释。在双瓶制剂中,在使用前,药物瓶中的药物需要用溶剂瓶中的溶剂重构,确保聚山梨醇酯80被适当地重构而不会明显起泡。通过将适量的溶液注射到输液袋中,进一步稀释重构的溶液。单瓶制剂在单个小瓶中含有已知浓度的药物溶液。使用前将药物溶液从小瓶中取出并注射到输液袋中。小瓶在使用前不需要重构和均质化。因此,对于单瓶制剂,不存在起泡风险,使用更方便。
10.然而,目前市场上的泰索帝双瓶和单瓶制剂均含有聚山梨醇酯80,这可能对一些患者造成严重的超敏反应。因此非常需要开发不含聚山梨醇酯80但又方便临床使用可以替代的多西他赛制剂。
11.本技术人现在惊奇地发现,在将药物溶液注射到输液袋中之前,通过将人血清白蛋白溶液添加到含有肠胃外可接受的载体(例如生理盐水、葡萄糖溶液等)的输液袋或输液瓶中,则在本发明的多西他赛制剂中无需使用到聚山梨醇酯80,其使用方式与目前市场上的泰索帝单瓶制剂的使用方式类似,可方便地用于临床。
12.在本发明中,本文提供了多西他赛或其药学上可接受的盐的药物制剂,其包含在输注或施用至患者之前混合的两种组合物,所述两种组合物包括:(a)包含多西他赛或其药学上可接受的盐以及乙醇的第一液体组合物,和(b)包含人血清白蛋白和肠胃外可接受的载体的第二水性组合物,其中所述药物制剂不含有聚山梨醇酯80。在一些实施方案中,这两种组合物在输注或施用至患者之前,少于24小时内混合。在一些实施方案中,这两种组合物的混合在输液袋或输液瓶中进行。在一些实施方案中,这两种组合物在输注或施用至患者之前,少于8小时内混合。在一些实施方案中,这两种组合物在输注或施用至患者之前,少于4小时内混合。在一些实施方案中,这两种组合物在输注或施用至患者之前,少于1小时内混合。在一些实施方案中,混合在输液袋或输液瓶中进行。在一些实施方案中,所述第二水性组合物包含在输液袋或输液瓶中。在一些实施方案中,将第一液体组合物注射到包含第二水性组合物的输液袋或输液瓶中。
13.在一些实施方案中,所述药物制剂不包含脂质(例如大豆油)。在一些实施方案中,第一液体组合物不包含脂质(例如大豆油)。在一些实施方案中,脂质是大豆油。
14.在一些实施方案中,所述药物制剂不包含表面活性剂。在一些实施方案中,第一液体组合物不包含表面活性剂。在一些实施方案中,第二水性组合物不包含表面活性剂。
15.在一些实施方案中,第一液体组合物包含多西他赛或其药学上可接受的盐、乙醇和其他有机溶剂(例如丙二醇、聚乙二醇300等)。在一些实施方案中,第一液体组合物包含多西他赛、乙醇和丙二醇。在一些实施方案中,第一液体组合物包含多西他赛、乙醇和聚乙二醇300。在一些实施方案中,第一液体组合物还包含酸。在一些实施方案中,第一液体组合物包含多西他赛、乙醇和有机酸。根据本发明,使用的最优选的酸是柠檬酸。在一些实施方案中,第一液体组合物包含多西他赛或其药学上可接受的盐、乙醇和柠檬酸。在一些实施方案中,第一液体组合物包含多西他赛或其药学上可接受的盐、乙醇、丙二醇和柠檬酸。在一些实施方案中,第一液体组合物是含有多西他赛或其药学上可接受的盐的乙醇溶液。在一
些实施方案中,第一液体组合物是含有多西他赛或其药学上可接受的盐和柠檬酸的乙醇溶液。在一些实施方案中,第一液体组合物是含有多西他赛或其药学上可接受的盐和柠檬酸的乙醇/丙二醇溶液。在一些实施方案中,第一液体组合物中,多西他赛或其药学上可接受的盐与柠檬酸的重量比是大约5000:1至大约1:1。在一些实施方案中,第一液体组合物中,多西他赛或其药学上可接受的盐与柠檬酸的重量比是大约2000:1至大约1:1。在一些实施方案中,第一液体组合物中,多西他赛或其药学上可接受的盐与柠檬酸的重量比是大约1000:1至大约1:1。在一些实施方案中,第一液体组合物中,多西他赛或其药学上可接受的盐与柠檬酸的重量比是大约500:1至大约1:1。在一些实施方案中,第一液体组合物中,多西他赛或其药学上可接受的盐与柠檬酸的重量比是大约5000:1至大约5:1。在一些实施方案中,第一液体组合物中,多西他赛或其药学上可接受的盐与柠檬酸的重量比是大约2000:1至大约5:1。在一些实施方案中,第一液体组合物中,多西他赛或其药学上可接受的盐与柠檬酸的重量比是大约1000:1至大约5:1。在一些实施方案中,第一液体组合物中,多西他赛或其药学上可接受的盐与柠檬酸的重量比是大约500:1至大约5:1。在一些实施方案中,第一液体组合物中,多西他赛或其药学上可接受的盐与柠檬酸的重量比是大约5000:1至大约10:1。在一些实施方案中,第一液体组合物中,多西他赛或其药学上可接受的盐与柠檬酸的重量比是大约2000:1至大约10:1。在一些实施方案中,第一液体组合物中,多西他赛或其药学上可接受的盐与柠檬酸的重量比是大约1000:1至大约10:1。在一些实施方案中,第一液体组合物中,多西他赛或其药学上可接受的盐与柠檬酸的重量比是大约500:1至大约10:1。在一些实施方案中,第一液体组合物中,多西他赛或其药学上可接受的盐与柠檬酸的重量比是大约2000:1至大约100:1。在一些实施方案中,第一液体组合物中,多西他赛或其药学上可接受的盐与柠檬酸的重量比是大约1000:1至大约100:1。在一些实施方案中,第一液体组合物中,多西他赛或其药学上可接受的盐与柠檬酸的重量比是大约500:1至大约100:1。在一些实施方案中,第一液体组合物中,多西他赛或其药学上可接受的盐与柠檬酸的重量比是大约5:1至大约20:1。在一些实施方案中,第一液体组合物中,多西他赛或其药学上可接受的盐与柠檬酸的重量比是大约5:1、大约10:1、大约15:1或大约20:1。在一些实施方案中,第一液体组合物中,柠檬酸的浓度是大约0.005mg/ml至大约10mg/ml。在一些实施方案中,第一液体组合物中,柠檬酸的浓度是大约0.01mg/ml至大约2mg/ml。在一些实施方案中,第一液体组合物中,柠檬酸的浓度是大约0.01mg/ml至大约1mg/ml。在一些实施方案中,第一液体组合物中,柠檬酸的浓度是大约0.02mg/ml至大约0.5mg/ml。在一些实施方案中,第一液体组合物中,柠檬酸的浓度是大约0.02mg/ml至大约0.2mg/ml。
16.在一些实施方案中,第一液体组合物包含多西他赛或其药学上可接受的盐,以及包括乙醇的溶剂,其中多西他赛或其药学上可接受的盐溶解在溶剂中。在一些实施方案中,第一液体组合物包含多西他赛或其药学上可接受的盐、酸以及包括乙醇的溶剂,其中多西他赛或其药学上可接受的盐和酸溶解在溶剂中。在一些实施方案中,第一液体组合物包含多西他赛或其药学上可接受的盐、有机酸以及包括乙醇的溶剂,其中多西他赛或其药学上可接受的盐和有机酸溶解在溶剂中。在一些实施方案中,第一液体组合物包含多西他赛或其药学上可接受的盐、柠檬酸以及包括乙醇的溶剂,其中多西他赛或其药学上可接受的盐和柠檬酸溶解在溶剂中。在一些实施方案中,第一液体组合物包含多西他赛或其药学上可接受的盐,以及乙醇,其中多西他赛或其药学上可接受的盐溶解在乙醇中。在一些实施方案
中,第一液体组合物包含多西他赛或其药学上可接受的盐、柠檬酸以及乙醇,其中多西他赛或其药学上可接受的盐和柠檬酸溶解在乙醇中。在一些实施方案中,第一液体组合物包含多西他赛或其药学上可接受的盐,以及无水乙醇,其中多西他赛或其药学上可接受的盐溶解在无水乙醇中。在一些实施方案中,第一液体组合物包含多西他赛或其药学上可接受的盐、柠檬酸以及无水乙醇,其中多西他赛或其药学上可接受的盐和柠檬酸溶解在无水乙醇中。
17.在一些实施方案中,通过将多西他赛或其药学上可接受的盐溶解在醇(例如乙醇)中制备第一液体组合物。在一些实施方案中,通过将多西他赛或其药学上可接受的盐和柠檬酸溶解在醇(例如乙醇)中制备第一液体组合物。在一些实施方案中,通过将多西他赛或其药学上可接受的盐溶解在乙醇和丙二醇中制备第一液体组合物。在一些实施方案中,通过将多西他赛或其药学上可接受的盐和柠檬酸溶解在乙醇和丙二醇中制备第一液体组合物。在一些实施方案中,醇(例如乙醇和/或丙二醇)中的多西他赛的浓度是大约10mg/ml至大约30mg/ml。在一些实施方案中,醇(例如乙醇和/或丙二醇)中的多西他赛的浓度是大约10mg/ml、大约20mg/ml或大约30mg/ml。
18.在一些实施方案中,通过将人血清白蛋白溶液添加到肠胃外可接受的载体中制备第二水性组合物。在一些实施方案中,通过将人血清白蛋白溶液添加到含有肠胃外可接受的载体的输液袋或输液瓶中制备第二水性组合物。在一些实施方案中,通过将人血清白蛋白溶液添加到生理盐水或葡萄糖溶液中制备第二水性组合物。在一些实施方案中,通过将人血清白蛋白溶液添加到装有生理盐水或葡萄糖溶液的输液袋或输液瓶中制备第二水性组合物。在一些实施方案中,通过将输注用人血清白蛋白溶液添加到生理盐水或葡萄糖溶液中制备第二水性组合物。在一些实施方案中,通过将输注用人血清白蛋白溶液添加到生理盐水或葡萄糖溶液中制备第二水性组合物。在一些实施方案中,通过将输注用20%(w/v)的人血清白蛋白溶液添加到生理盐水或葡萄糖溶液中制备第二水性组合物。在一些实施方案中,通过将输注用25%(w/v)的人血清白蛋白溶液添加到生理盐水或葡萄糖溶液中制备第二水性组合物。在一些实施方案中,通过将输注用5%(w/v)的人血清白蛋白溶液添加到生理盐水或葡萄糖溶液中制备第二水性组合物。在一些实施方案中,通过将输注用人血清白蛋白溶液添加到装有生理盐水或葡萄糖溶液的输液袋或输液瓶中制备第二水性组合物。在一些实施方案中,通过将输注用人血清白蛋白溶液添加到装有生理盐水或葡萄糖溶液的输液袋或输液瓶中制备第二水性组合物。在一些实施方案中,通过将输注用20%(w/v)的人血清白蛋白溶液添加到装有生理盐水或葡萄糖溶液的输液袋或输液瓶中制备第二水性组合物。在一些实施方案中,通过将输注用25%(w/v)的人血清白蛋白溶液添加到装有生理盐水或葡萄糖溶液的输液袋或输液瓶中制备第二水性组合物。在一些实施方案中,通过将输注用5%(w/v)的人血清白蛋白溶液添加到装有生理盐水或葡萄糖溶液的输液袋或输液瓶中制备第二水性组合物。在一些实施方案中,第二水性组合物中,人血清白蛋白的浓度是大约0.1%至大约20%(w/v)。在一些实施方案中,第二水性组合物中,人血清白蛋白的浓度是大约0.5%至大约10%(w/v)。在一些实施方案中,第二水性组合物中,人血清白蛋白的浓度是0.5%至5%(w/v)。在一些实施方案中,第二水性组合物中,人血清白蛋白的浓度是1%至3%(w/v)。在一些实施方案中,第二水性组合物包含大约1g至大约50g人血清白蛋白。在一些实施方案中,第二水性组合物包含大约2g至大约20g人血清白蛋白。
19.此外,本文提供澄明无沉淀的多西他赛或其药学上可接受的盐的肠胃外输注组合物,其包括包含在肠胃外可接受的载体中的人血清白蛋白和所述多西他赛或其药学上可接受的盐,其中多西他赛的浓度是大约0.05mg/ml至大约1mg/ml,其中所述该肠胃外输注溶液通过将包含有多西他赛或其药学上可接受的盐和乙醇的第一液体组合物注射到装有第二水性组合物的输液袋或输液瓶中制备得到,其中所述第二水性组合物包括包含在肠胃外可接受的载体中的人血清白蛋白,其中在注射过程中不需要搅拌或搅动,并且其中所述多西他赛输注溶液不含有聚山梨醇酯80。在一些实施方案中,肠胃外可接受的载体是生理盐水或葡萄糖溶液。
20.在一些实施方案中,所述多西他赛或其药学上可接受的盐的肠胃外输注组合物不包含脂质(例如大豆油)。在一些实施方案中,第一液体组合物不包含脂质(例如大豆油)。在一些实施方案中,脂质是大豆油。
21.在一些实施方案中,所述多西他赛或其药学上可接受的盐的肠胃外输注组合物不包含表面活性剂。在一些实施方案中,第一液体组合物不包含表面活性剂。在一些实施方案中,第二水性组合物不包含表面活性剂。
22.在一些实施方案中,所述多西他赛或其药学上可接受的盐的肠胃外输注组合物在输注或施用至患者前,少于24小时制备。在一些实施方案中,所述多西他赛或其药学上可接受的盐的肠胃外输注组合物在输注或施用至患者前,少于8小时制备。在一些实施方案中,所述多西他赛或其药学上可接受的盐的肠胃外输注组合物在输注或施用至患者前,少于6小时制备。在一些实施方案中,所述多西他赛或其药学上可接受的盐的肠胃外输注组合物在输注或施用至患者前,少于4小时制备。在一些实施方案中,所述多西他赛或其药学上可接受的盐的肠胃外输注组合物在输注或施用至患者前,少于1小时制备。
23.在一些实施方案中,在肠胃外输注组合物中,多西他赛或其药学上可接受的盐的浓度是大约0.1mg/ml至大约0.8mg/ml。在一些实施方案中,在肠胃外输注组合物中,多西他赛或其药学上可接受的盐的浓度是大约0.1mg/ml至大约0.5mg/ml。在一些实施方案中,在肠胃外输注组合物中,多西他赛或其药学上可接受的盐的浓度是大约0.2mg/ml至大约0.4mg/ml。在一些实施方案中,在肠胃外输注组合物中,多西他赛或其药学上可接受的盐的浓度是大约0.25mg/ml至大约0.35mg/ml。在一些实施方案中,人血清白蛋白与多西他赛或其药学上可接受的盐的重量比是大约20:1至大约200:1。在一些实施方案中,人血清白蛋白与多西他赛或其药学上可接受的盐的重量比是大约20:1、大约30:1、约40:1、大约50:1、大约80:1、大约90:1、大约95:1、大约100:1或大约150:1。
24.在一些实施方案中,第一液体组合物包含多西他赛或其药学上可接受的盐、乙醇和其他有机溶剂(例如醇,如丙二醇或聚乙二醇300等)。在一些实施方案中,第一液体组合物包含多西他赛或其药学上可接受的盐、乙醇和丙二醇。在一些实施方案中,第一液体组合物包含多西他赛或其药学上可接受的盐、乙醇和聚乙二醇300。在一些实施方案中,第一液体组合物还包含酸。在一些实施方案中,第一液体组合物包含多西他赛或其药学上可接受的盐、乙醇和有机酸。根据本发明,使用的最优选的酸是柠檬酸。在一些实施方案中,第一液体组合物包含多西他赛或其药学上可接受的盐、乙醇和柠檬酸。在一些实施方案中,第一液体组合物包含多西他赛或其药学上可接受的盐、乙醇、丙二醇和柠檬酸。在一些实施方案中,第一液体组合物是含有多西他赛或其药学上可接受的盐的乙醇溶液。在一些实施方案
中,第一液体组合物是含有多西他赛或其药学上可接受的盐和柠檬酸的乙醇溶液。在一些实施方案中,第一液体组合物是含有多西他赛和柠檬酸的乙醇/丙二醇溶液。在一些实施方案中,第一液体组合物中,多西他赛或其药学上可接受的盐与柠檬酸的重量比是大约5000:1至大约1:1。在一些实施方案中,第一液体组合物中,多西他赛或其药学上可接受的盐与柠檬酸的重量比是大约2000:1至大约1:1。在一些实施方案中,第一液体组合物中,多西他赛或其药学上可接受的盐与柠檬酸的重量比是大约1000:1至大约1:1。在一些实施方案中,第一液体组合物中,多西他赛或其药学上可接受的盐与柠檬酸的重量比是大约500:1至大约1:1。在一些实施方案中,第一液体组合物中,多西他赛或其药学上可接受的盐与柠檬酸的重量比是大约5000:1至大约5:1。在一些实施方案中,第一液体组合物中,多西他赛或其药学上可接受的盐与柠檬酸的重量比是大约2000:1至大约5:1。在一些实施方案中,第一液体组合物中,多西他赛或其药学上可接受的盐与柠檬酸的重量比是大约1000:1至大约5:1。在一些实施方案中,第一液体组合物中,多西他赛或其药学上可接受的盐与柠檬酸的重量比是大约500:1至大约5:1。在一些实施方案中,第一液体组合物中,多西他赛或其药学上可接受的盐与柠檬酸的重量比是大约5000:1至大约10:1。在一些实施方案中,第一液体组合物中,多西他赛或其药学上可接受的盐与柠檬酸的重量比是大约2000:1至大约10:1。在一些实施方案中,第一液体组合物中,多西他赛或其药学上可接受的盐与柠檬酸的重量比是大约1000:1至大约10:1。在一些实施方案中,第一液体组合物中,多西他赛或其药学上可接受的盐与柠檬酸的重量比是大约500:1至大约10:1。在一些实施方案中,第一液体组合物中,多西他赛或其药学上可接受的盐与柠檬酸的重量比是大约2000:1至大约100:1。在一些实施方案中,第一液体组合物中,多西他赛或其药学上可接受的盐与柠檬酸的重量比是大约1000:1至大约100:1。在一些实施方案中,第一液体组合物中,多西他赛或其药学上可接受的盐与柠檬酸的重量比是大约500:1至大约100:1。在一些实施方案中,第一液体组合物中,多西他赛或其药学上可接受的盐与柠檬酸的重量比是大约5:1至大约20:1。在一些实施方案中,第一液体组合物中,多西他赛或其药学上可接受的盐与柠檬酸的重量比是大约5:1、大约10:1、大约15:1或大约20:1。在一些实施方案中,第一液体组合物中,柠檬酸的浓度是大约0.005mg/ml至大约10mg/ml。在一些实施方案中,第一液体组合物中,柠檬酸的浓度是大约0.01mg/ml至大约2mg/ml。在一些实施方案中,第一液体组合物中,柠檬酸的浓度是大约0.01mg/ml至大约1mg/ml。在一些实施方案中,第一液体组合物中,柠檬酸的浓度是大约0.02mg/ml至大约0.5mg/ml。在一些实施方案中,第一液体组合物中,柠檬酸的浓度是大约0.02mg/ml至大约0.2mg/ml。
25.在一些实施方案中,通过将多西他赛或其药学上可接受的盐溶解在醇(例如乙醇)中制备第一液体组合物。在一些实施方案中,通过将多西他赛或其药学上可接受的盐和柠檬酸溶解在乙醇中制备第一液体组合物。在一些实施方案中,通过将多西他赛或其药学上可接受的盐溶解在乙醇和丙二醇中制备第一液体组合物。在一些实施方案中,通过将多西他赛或其药学上可接受的盐和柠檬酸溶解在乙醇和丙二醇中制备第一液体组合物。
26.在一些实施方案中,通过将人血清白蛋白溶液添加到肠胃外可接受的载体中制备第二水性组合物。在一些实施方案中,通过将人血清白蛋白溶液添加到生理盐水或葡萄糖溶液中制备第二水性组合物。在一些实施方案中,通过将输注用人血清白蛋白溶液添加到生理盐水或葡萄糖溶液中制备第二水性组合物。在一些实施方案中,通过将输注用20%(w/
v)的人血清白蛋白溶液添加到生理盐水或葡萄糖溶液中制备第二水性组合物。在一些实施方案中,通过将输注用25%(w/v)的人血清白蛋白溶液添加到生理盐水或葡萄糖溶液中制备第二水性组合物。在一些实施方案中,通过将输注用5%(w/v)的人血清白蛋白溶液添加到生理盐水或葡萄糖溶液中制备第二水性组合物。在一些实施方案中,第二水性组合物中的人血清白蛋白的浓度是大约0.1%至大约20%(w/v)。在一些实施方案中,第二水性组合物中的人血清白蛋白的浓度是大约0.5%至大约10%(w/v)。在一些实施方案中,第二水性组合物中的人血清白蛋白的浓度是0.5%至5%(w/v)。在一些实施方案中,第二水性组合物中的人血清白蛋白的浓度是1%至3%(w/v)。在一些实施方案中,第二水性组合物包含大约1g至大约50g人血清白蛋白。在一些实施方案中,第二水性组合物包含大约2g至大约20g人血清白蛋白。
27.将第一液体组合物注射到装有第二水性组合物的输液袋或输液瓶中时间是快速的。在一些实施方案中,注射时间不超过60秒。在一些实施方案中,注射时间不超过30秒。在一些实施方案中,注射时间不超过15秒。在一些实施方案中,注射时间不超过10秒。在一些实施方案中,注射时间不超过5秒。
28.在将第一液体组合物注射到装有第二水性组合物的输液袋或输液瓶内的过程中,不需要搅拌或搅动。将第一液体组合物注射到输液袋或输液瓶中后,将第一液体组合物和第二水性组合物充分混合(例如用手轻轻正反倒转含有这些组合物的输液袋),得到澄明无沉淀的输注溶液。在一些实施方案中,装有第二水性组合物的输液袋或输液瓶在注射过程中保持静止。在一些实施方案中,在注射过程中,将第一液体组合物注射到第二水性组合物的液体表面下方。在一些实施方案中,在注射完成后,将输液袋或输液瓶反复轻轻正反倒转,以充分混合第一液体组合物和第二水性组合物。在一些实施方案中,注射完成后,将输液袋或输液瓶轻轻正反倒转,直到得到澄明无沉淀的溶液。在一些实施方案中,注射完成后,将输液袋或输液瓶轻轻正反倒转大约5秒至大约10分钟。在一些实施方案中,注射完成后,将输液袋或输液瓶轻轻正反倒转大约10秒至大约5分钟。在一些实施方案中,注射完成后,将输液袋或输液瓶轻轻正反倒转大约0.5分钟至大约3分钟。在一些实施方案中,注射完成后,将第一液体组合物和第二水性组合物充分混合,直到得到澄明无沉淀的输注溶液。
29.将第一液体组合物注射到装有第二水性组合物的输液袋或输液瓶中,然后将第一液体组合物和第二含水组合物充分混合,得到包含在肠胃外可接受的载体中的人血清白蛋白、多西他赛或其药学上可接受的盐,以及乙醇的澄明无沉淀的输注溶液。在一些实施方案中,澄明输注溶液还包含柠檬酸。在一些实施方案中,肠胃外可接受的载体是生理盐水或葡萄糖溶液。在一些实施方案中,澄明输注溶液至少1小时内保持澄明无沉淀。在一些实施方案中,澄明输注溶液至少2小时内保持澄明无沉淀。在一些实施方案中,澄明输注溶液至少3小时内保持澄明无沉淀。在一些实施方案中,澄明输注溶液至少4小时内保持澄明无沉淀。在一些实施方案中,澄明输注溶液至少6小时内保持澄明无沉淀。在一些实施方案中,澄明输注溶液至少8小时内保持澄明无沉淀。在一些实施方案中,当将澄明溶液保持在大约20-25℃时,澄明输注溶液至少在1小时、2小时、3小时、4小时或6小时内保持澄明无沉淀。在一些实施方案中,当将澄明溶液保持在大约2-8℃时,澄明溶液至少在2小时、4小时、6小时、8小时或12小时内保持澄明无沉淀。
30.此外,本文提供用于制备肠胃外输注溶液的试剂盒,包括:第一容器,其含有包含
多西他赛或其药学上可接受的盐的组合物;和第二容器,其含有包含人血清白蛋白的组合物。在一些实施方案中,试剂盒包括第一容器,其含有包含多西他赛或其药学上可接受的盐的液体组合物;和第二容器,其含有包含人血清白蛋白的液体组合物。
31.在一些实施方案中,第一容器不包含脂质(例如大豆油)。在一些实施方案中,脂质是大豆油。在一些实施方案中,第一容器不包含表面活性剂。在一些实施方案中,第二容器不包含表面活性剂。
32.在一些实施方案中,第一容器含有包含多西他赛或其药学上可接受的盐和乙醇的液体组合物。在一些实施方案中,第一容器含有包含多西他赛或其药学上可接受的盐、酸或其药学上可接受的盐、以及乙醇的液体组合物。在一些实施方案中,第一容器含有包含多西他赛或其药学上可接受的盐、有机酸和乙醇的液体组合物。在一些实施方案中,第一容器含有包含多西他赛或其药学上可接受的盐、乙醇和其他有机溶剂(例如醇,如丙二醇、聚乙二醇300等)的液体组合物。在一些实施方案中,第一容器含有包含多西他赛或其药学上可接受的盐、乙醇和丙二醇的液体组合物。在一些实施方案中,第一容器含有包含多西他赛或其药学上可接受的盐、乙醇和聚乙二醇300的液体组合物。在一些实施方案中,第一容器含有包含多西他赛或其药学上可接受的盐和柠檬酸的液体组合物。在一些实施方案中,第一容器含有包含多西他赛或其药学上可接受的盐、柠檬酸和乙醇的液体组合物。在一些实施方案中,第一容器含有包含多西他赛或其药学上可接受的盐、柠檬酸、乙醇和丙二醇的液体组合物。在一些实施方案中,第一容器含有包含多西他赛或其药学上可接受的盐的乙醇溶液。在一些实施方案中,第一容器含有包含多西他赛或其药学上可接受的盐和柠檬酸的乙醇溶液。在一些实施方案中,第一容器含有包含多西他赛或其药学上可接受的盐和柠檬酸的乙醇/丙二醇溶液。在一些实施方案中,第一容器中,多西他赛或其药学上可接受的盐与柠檬酸的重量比是大约5000:1至大约1:1。在一些实施方案中,第一容器中,多西他赛或其药学上可接受的盐与柠檬酸的重量比是大约2000:1至大约1:1。在一些实施方案中,第一容器中,多西他赛或其药学上可接受的盐与柠檬酸的重量比是大约1000:1至大约1:1。在一些实施方案中,第一容器中,多西他赛或其药学上可接受的盐与柠檬酸的重量比是大约500:1至大约1:1。在一些实施方案中,第一容器中,多西他赛或其药学上可接受的盐与柠檬酸的重量比是大约5000:1至大约5:1。在一些实施方案中,第一容器中,多西他赛或其药学上可接受的盐与柠檬酸的重量比是大约2000:1至大约5:1。在一些实施方案中,第一容器中,多西他赛或其药学上可接受的盐与柠檬酸的重量比是大约1000:1至大约5:1。在一些实施方案中,第一容器中,多西他赛或其药学上可接受的盐与柠檬酸的重量比是大约500:1至大约5:1。在一些实施方案中,第一容器中,多西他赛或其药学上可接受的盐与柠檬酸的重量比是大约5000:1至大约10:1。在一些实施方案中,第一容器中,多西他赛或其药学上可接受的盐与柠檬酸的重量比是大约2000:1至大约10:1。在一些实施方案中,第一容器中,多西他赛或其药学上可接受的盐与柠檬酸的重量比是大约1000:1至大约10:1。在一些实施方案中,第一容器中,多西他赛或其药学上可接受的盐与柠檬酸的重量比是大约500:1至大约10:1。在一些实施方案中,第一容器中,多西他赛或其药学上可接受的盐与柠檬酸的重量比是大约2000:1至大约100:1。在一些实施方案中,第一容器中,多西他赛或其药学上可接受的盐与柠檬酸的重量比是大约1000:1至大约100:1。在一些实施方案中,第一容器中,多西他赛或其药学上可接受的盐与柠檬酸的重量比是大约500:1至大约100:1。在一些实施方案中,第
一容器中,柠檬酸的浓度是大约0.005mg/ml至大约10mg/ml。在一些实施方案中,第一容器中,柠檬酸的浓度是大约0.01mg/ml至大约2mg/ml。在一些实施方案中,第一容器中,柠檬酸的浓度是大约0.01mg/ml至大约1mg/ml。在一些实施方案中,第一容器中,柠檬酸的浓度是大约0.02mg/ml至大约0.5mg/ml。在一些实施方案中,第一容器中,柠檬酸的浓度是大约0.02mg/ml至大约0.2mg/ml。
33.在一些实施方案中,第一容器中含有的多西他赛的含量是大约10mg至大约300mg多西他赛。在一些实施方案中,第一容器中含有的多西他赛的含量是大约20mg至大约200mg多西他赛。在一些实施方案中,第一容器中含有的多西他赛的含量是大约20mg、大约40mg、大约60mg、大约80mg、大约100mg、大约120mg或大约160mg多西他赛。在一些实施方案中,第一容器中含有的多西他赛的含量是大约80mg多西他赛。在一些实施方案中,第一容器含有中的多西他赛的含量是大约100mg多西他赛。在一些实施方案中,第一容器中含有的乙醇的含量是大约0.5ml至大约50ml乙醇。在一些实施方案中,第一容器中含有的乙醇的含量是大约1ml至大约20ml乙醇。在一些实施方案中,第一容器中含有的乙醇的含量是大约1ml至大约10ml乙醇。在一些实施方案中,第一容器中含有的乙醇的含量是大约3ml至大约6ml乙醇。在一些实施方案中,第一容器中,多西他赛或其药学上可接受的盐的浓度是大约1mg/ml至大约200mg/ml。在一些实施方案中,第一容器中,多西他赛或其药学上可接受的盐的浓度是大约5mg/ml至大约100mg/ml。在一些实施方案中,第一容器中,多西他赛或其药学上可接受的盐的浓度是大约10mg/ml至大约50mg/ml。在一些实施方案中,第一容器中,多西他赛的浓度是大约20mg/ml。在一些实施方案中,第一容器中,醇中的多西他赛或其药学上可接受的盐的浓度是大约10mg/ml至大约30mg/ml。在一些实施方案中,第一容器中,醇中的多西他赛的浓度是大约10mg/ml、大约20mg/ml或大约30mg/ml。
34.在一些实施方案中,第一容器含有包含多西他赛或其药学上可接受的盐的固体组合物。在一些实施方案中,第一容器含有包含多西他赛或其药学上可接受的盐和有机酸的固体组合物。在一些实施方案中,第一容器含有包含多西他赛或其药学上可接受的盐和柠檬酸的固体组合物。
35.在一些实施方案中,第二容器含有包含人血清白蛋白的液体组合物。在一些实施方案中,第二容器含有人血清白蛋白溶液。在一些实施方案中,第二容器含有人血清白蛋白溶液,溶液中的人血清白蛋白的浓度是大约1%至大约25%(w/v)。在一些实施方案中,第二容器含有人血清白蛋白溶液,溶液中的人血清白蛋白的浓度是大约5%至大约25%(w/v)。在一些实施方案中,第二容器含有输注用人血清白蛋白溶液。在一些实施方案中,第二容器含有输注用20%人血清白蛋白溶液。在一些实施方案中,第二容器含有输注用25%人血清白蛋白溶液。在一些实施方案中,第二容器含有输注用5%人血清白蛋白溶液。在一些实施方案中,第二容器含有包含大约1g至大约50g人血清白蛋白的液体组合物。在一些实施方案中,第二容器含有包含大约1g至大约30g人血清白蛋白的液体组合物。在一些实施方案中,第二容器含有包含大约1g至大约20g人血清白蛋白的液体组合物。在一些实施方案中,第二容器含有包含大约2g、大约4g、大约6g、大约8g、大约10g、大约12g或大约16g人血清白蛋白的液体组合物。
36.在一些实施方案中,试剂盒还包括将包含多西他赛或其药学上可接受的盐的组合物添加到包含人血清白蛋白的组合物中的说明书。
37.此外,本文提供肠胃外药物制剂,包含在输注或施用至患者之前混合的两种组合物,所述两种组合物包含:(a)包含基本上不溶于水的药物活性剂或其药学上可接受的盐的第一液体组合物,和(b)包含人血清白蛋白和肠胃外可接受的载体的第二水性组合物,并且其中所述基本上不溶于水的药物活性剂或其药学上可接受的盐是所述肠胃外药物制剂的api(活性药物成分)。
38.在一些实施方案中,所述药物制剂不包含脂质(例如大豆油)。在一些实施方案中,第一液体组合物不包含脂质(例如大豆油)。在一些实施方案中,脂质是大豆油。
39.在一些实施方案中,所述药物制剂不包含表面活性剂。在一些实施方案中,第一液体组合物不包含表面活性剂。在一些实施方案中,第二水性组合物不包含表面活性剂。
附图说明
40.图1a是示出多西他赛输注溶液的dls测试结果的线条图。
41.图1b是示出白蛋白盐水溶液的dls测试结果的线条图。
具体实施方式
42.本文提供了多西他赛或其药学上可接受的盐的药物制剂,其包含输注或施用至患者之前混合的组合物,所述组合物包含:(a)包含多西他赛或其药学上可接受的盐及醇(例如乙醇)的第一液体组合物,和(b)包含人血清白蛋白和肠胃外可接受的载体的第二水性组合物,其中所述药物制剂不含有聚山梨醇酯80。在一些实施方案中,第一液体组合物包含多西他赛或其药学上可接受的盐、柠檬酸和醇(例如乙醇)。在一些实施方案中,这两种组合物在输注或施用至患者之前,少于24小时内混合。在一些实施方案中,这两种组合物的混合在输液袋或输液瓶中完成。在一些实施方案中,这两种组合物在输注或施用至患者之前,少于12小时内混合。在一些实施方案中,这两种组合物在输注或施用至患者之前,少于8小时内混合。在一些实施方案中,这两种组合物在输注或施用至患者之前,少于4小时内混合。在一些实施方案中,这两种组合物在输注或施用至患者之前,少于1小时内混合。在一些实施方案中,混合在输液袋或输液瓶中完成。在一些实施方案中,第二水性组合物包含在输液袋或输液瓶中。在一些实施方案中,将第一液体组合物注射到装有第二水性组合物的输液袋或输液瓶中。在一些实施方案中,第一液体组合物和第二水性组合物都是无菌溶液。在一些实施方案中,第一液体组合物是无菌溶液。在一些实施方案中,第二水性组合物是无菌溶液。在一些实施方案中,在输注或施用至患者之前,第一液体组合物和第二水性组合物的混合在医院或诊所中完成。
43.在一些实施方案中,所述药物制剂不包含脂质(例如大豆油)。在一些实施方案中,第一液体组合物不包含脂质(例如大豆油)。在一些实施方案中,脂质是大豆油。
44.在一些实施方案中,所述药物制剂不包含表面活性剂。在一些实施方案中,第一液体组合物不包含表面活性剂。在一些实施方案中,第二水性组合物不包含表面活性剂。
45.在一些实施方案中,第一液体组合物和第二水性组合物的混合包括两个步骤。在第一步中,将第一液体组合物注射到含有第二水性组合物的输液袋或输液瓶中。在注射过程中,输液袋或输液瓶保持静止,无需进行搅拌或搅动。在第二步中,注射完成后,立即将输液袋或输液瓶正反倒转,直到得到澄明无沉淀的输注溶液。
46.在将第一液体组合物注射到含有第二水性组合物的输液袋或输液瓶内的过程中,在注射过程中,输液袋或输液瓶保持静止,不需要搅拌或搅动。我们惊奇地发现,在注射后,仅仅通过反复正反倒转输液袋或输液瓶(例如5-30次),即可得到澄明无沉淀的输注溶液。
47.在一些实施方案中,在第一液体组合物和第二水性组合物混合后,制剂中的多西他赛或其药学上可接受的盐的浓度是大约0.05mg/ml至大约1mg/ml。在一些实施方案中,在第一液体组合物和第二水性组合物混合后,制剂中的多西他赛或其药学上可接受的盐的浓度是大约0.1mg/ml至大约0.5mg/ml。在一些实施方案中,在第一液体组合物和第二水性组合物混合后,制剂中的多西他赛或其药学上可接受的盐的浓度是大约0.15mg/ml至大约0.4mg/ml。在一些实施方案中,在第一液体组合物和第二含水组合物混合后,制剂中的多西他赛或其药学上可接受的盐的浓度是大约0.2mg/ml至大约0.3mg/ml。
48.在本发明中,第一液体组合物和第二水性组合物混合后,得到的制剂是澄明的输注溶液,而不是纳米颗粒悬浮液。在一些实施方案中,制剂(澄明输注溶液)中的至少30%的多西他赛是游离的(未结合的)多西他赛。在一些实施方案中,制剂(澄明输注溶液)中的至少40%的多西他赛是游离的(未结合的)多西他赛。在一些实施方案中,制剂(澄明输注溶液)中的至少50%的多西他赛是游离的(未结合的)多西他赛。在一些实施方案中,制剂(澄明输注溶液)中的至少60%的多西他赛是游离的(未结合的)多西他赛。在一些实施方案中,制剂(澄明输注溶液)中的至少70%的多西他赛是游离的(未结合的)多西他赛。游离的(未结合的)多西他赛是指输注组合物(溶液)中不与人血清白蛋白结合的多西他赛部分。肠胃外输注组合物(溶液)中的游离的(未结合的)多西他赛的浓度使用30-kda膜通过超滤测量得到。游离的(未结合的)多西他赛测量的详细实验情况在实施例部分描述。
49.在一些实施方案中,多西他赛或其药学上可接受的盐的药物制剂,包含在输注或施用至患者之前混合的两种组合物,所述两种组合物包含:(a)第一液体组合物,包含溶解在醇(例如乙醇)中的大约20mg至大约200mg多西他赛或其药学上可接受的盐,和(b)第二水性组合物,包含在肠胃外可接受的载体中的大约0.5g至大约20g人血清白蛋白。在一些实施方案中,多西他赛或其药学上可接受的盐的药物制剂,包含在输注或施用至患者之前混合的两种组合物,所述两种组合物包含:(a)第一液体组合物,包含溶解在醇(例如乙醇)中的大约20mg至大约200mg多西他赛或其药学上可接受的盐及柠檬酸,和(b)第二水性组合物,包含在肠胃外可接受的载体中的大约0.5g至大约20g人血清白蛋白。在一些实施方案中,多西他赛或其药学上可接受的盐的药物制剂,包含在输注或施用至患者之前混合的两种组合物,所述两种组合物包含:(a)第一液体组合物,包含溶解在醇(例如乙醇)中的大约20mg至大约200mg多西他赛或其药学上可接受的盐,和(b)第二水性组合物,包含在肠胃外可接受的载体中的大约1g至大约10g人血清白蛋白。在一些实施方案中,多西他赛或其药学上可接受的盐的药物制剂,包含在输注或施用至患者之前混合的两种组合物,所述两种组合物包含:(a)第一液体组合物,包含溶解在醇(例如乙醇)中的大约20mg至大约200mg多西他赛或其药学上可接受的盐及柠檬酸,和(b)第二水性组合物,包含在肠胃外可接受的载体中的大约1g至大约10g人血清白蛋白。在一些实施方案中,药物制剂不包含脂质(例如大豆油)。在一些实施方案中,药物制剂不包含表面活性剂。
50.在一些实施方案中,第一液体组合物中的乙醇是无水乙醇。在一些实施方案中,第一液体组合物包含多西他赛或其药学上可接受的盐、乙醇和其他有机溶剂(例如醇,如丙二
醇、聚乙二醇300等)。在一些实施方案中,第一液体组合物包含多西他赛或其药学上可接受的盐、乙醇和丙二醇。在一些实施方案中,第一液体组合物包含多西他赛或其药学上可接受的盐、乙醇和聚乙二醇300。在一些实施方案中,第一液体组合物还包含酸。在一些实施方案中,第一液体组合物包含多西他赛或其药学上可接受的盐、乙醇和有机酸。优选地,有机酸选自由柠檬酸、乙酸、甲酸、抗坏血酸、苯甲酸、酒石酸、乳酸、马来酸和琥珀酸,或它们的药学上可接受的盐组成的组。有机酸不包括天冬氨酸和谷氨酸。根据本发明,使用的最优选的酸是柠檬酸。在一些实施方案中,柠檬酸是无水柠檬酸。在一些实施方案中,第一液体组合物包含多西他赛或其药学上可接受的盐、乙醇和柠檬酸。在一些实施方案中,第一液体组合物包含多西他赛或其药学上可接受的盐、乙醇、丙二醇和柠檬酸。在一些实施方案中,第一液体组合物是含有多西他赛或其药学上可接受的盐的乙醇溶液。在一些实施方案中,第一液体组合物是含有多西他赛或其药学上可接受的盐和柠檬酸的乙醇溶液。在一些实施方案中,第一液体组合物是含有多西他赛或其药学上可接受的盐和柠檬酸的乙醇/丙二醇溶液。在一些实施方案中,第一液体组合物是含有多西他赛或其药学上可接受的盐和柠檬酸的无水乙醇溶液。在一些实施方案中,第一液体组合物中,多西他赛或其药学上可接受的盐与柠檬酸的重量比是大约5000:1至大约1:1。在一些实施方案中,第一液体组合物中,多西他赛或其药学上可接受的盐与柠檬酸的重量比是大约2000:1至大约1:1。在一些实施方案中,第一液体组合物中,多西他赛或其药学上可接受的盐与柠檬酸的重量比是大约1000:1至大约1:1。在一些实施方案中,第一液体组合物中,多西他赛或其药学上可接受的盐与柠檬酸的重量比是大约500:1至大约1:1。在一些实施方案中,第一液体组合物中,多西他赛或其药学上可接受的盐与柠檬酸的重量比是大约5000:1至大约5:1。在一些实施方案中,第一液体组合物中,多西他赛或其药学上可接受的盐与柠檬酸的重量比是大约2000:1至大约5:1。在一些实施方案中,第一液体组合物中,多西他赛或其药学上可接受的盐与柠檬酸的重量比是大约1000:1至大约5:1。在一些实施方案中,第一液体组合物中,多西他赛或其药学上可接受的盐与柠檬酸的重量比是大约500:1至大约5:1。在一些实施方案中,第一液体组合物中,多西他赛或其药学上可接受的盐与柠檬酸的重量比是大约5000:1至大约10:1。在一些实施方案中,第一液体组合物中,多西他赛或其药学上可接受的盐与柠檬酸的重量比是大约2000:1至大约10:1。在一些实施方案中,第一液体组合物中,多西他赛或其药学上可接受的盐与柠檬酸的重量比是大约1000:1至大约10:1。在一些实施方案中,第一液体组合物中,多西他赛或其药学上可接受的盐与柠檬酸的重量比是大约500:1至大约10:1。在一些实施方案中,第一液体组合物中,多西他赛或其药学上可接受的盐与柠檬酸的重量比是大约2000:1至大约100:1。在一些实施方案中,第一液体组合物中,多西他赛或其药学上可接受的盐与柠檬酸的重量比是大约1000:1至大约100:1。在一些实施方案中,第一液体组合物中,多西他赛或其药学上可接受的盐与柠檬酸的重量比是大约500:1至大约100:1。在一些实施方案中,第一液体组合物中,柠檬酸的浓度是大约0.005mg/ml至大约10mg/ml。在一些实施方案中,第一液体组合物中,柠檬酸的浓度是大约0.01mg/ml至大约2mg/ml。在一些实施方案中,第一液体组合物中,柠檬酸的浓度是大约0.01mg/ml至大约1mg/ml。在一些实施方案中,第一液体组合物中,柠檬酸的浓度是大约0.02mg/ml至大约0.5mg/ml。在一些实施方案中,第一液体组合物中,柠檬酸的浓度是大约0.02mg/ml至大约0.2mg/ml。在一些实施方案中,第一液体组合物中,多西他赛或其药学上可接受的盐的浓度是大约1mg/ml至大约200mg/ml。
在一些实施方案中,第一液体组合物中,多西他赛或其药学上可接受的盐的浓度是大约5mg/ml至大约100mg/ml。在一些实施方案中,第一液体组合物中,多西他赛或其药学上可接受的盐的浓度是大约10mg/ml至大约50mg/ml。在一些实施方案中,第一液体组合物中,多西他赛或其药学上可接受的盐的浓度是大约20mg/ml。在一些实施方案中,第一液体组合物中,多西他赛或其药学上可接受的盐的浓度是大约10mg/ml至大约30mg/ml。在一些实施方案中,第一液体组合物中,多西他赛或其药学上可接受的盐的浓度是大约10mg/ml、大约20mg/ml或大约30mg/ml。
51.在一些实施方案中,第一液体组合物包含多西他赛或其药学上可接受的盐,以及包含乙醇的溶剂,其中多西他赛或其药学上可接受的盐溶解在溶剂中。在一些实施方案中,第一液体组合物包含多西他赛或其药学上可接受的盐、酸以及包含乙醇的溶剂,其中多西他赛或其药学上可接受的盐和酸溶解在溶剂中。在一些实施方案中,第一液体组合物包含多西他赛或其药学上可接受的盐、有机酸以及包括乙醇的溶剂,其中多西他赛或其药学上可接受的盐和有机酸溶解在溶剂中。在一些实施方案中,第一液体组合物包含多西他赛或其药学上可接受的盐、柠檬酸以及包含乙醇的溶剂,其中多西他赛或其药学上可接受的盐和柠檬酸溶解在溶剂中。在一些实施方案中,第一液体组合物包含多西他赛或其药学上可接受的盐,以及乙醇,其中多西他赛或其药学上可接受的盐溶解在乙醇中。在一些实施方案中,第一液体组合物包含多西他赛或其药学上可接受的盐、柠檬酸以及乙醇,其中多西他赛或其药学上可接受的盐和柠檬酸溶解在乙醇中。在一些实施方案中,第一液体组合物包含多西他赛或其药学上可接受的盐,以及无水乙醇,其中多西他赛或其药学上可接受的盐溶解在无水乙醇中。在一些实施方案中,第一液体组合物包含多西他赛或其药学上可接受的盐、柠檬酸以及无水乙醇,其中多西他赛或其药学上可接受的盐和柠檬酸溶解在无水乙醇中。在一些实施方案中,第一液体组合物不包含脂质(例如大豆油)或表面活性剂。
52.在一些实施方案中,通过将多西他赛或其药学上可接受的盐溶解在乙醇中制备第一液体组合物。在一些实施方案中,通过将多西他赛或其药学上可接受的盐和柠檬酸溶解在乙醇中制备第一液体组合物。在一些实施方案中,通过将多西他赛或其药学上可接受的盐溶解在乙醇和丙二醇中制备第一液体组合物。在一些实施方案中,通过将多西他赛或其药学上可接受的盐和柠檬酸溶解在乙醇和丙二醇中制备第一液体组合物。
53.在一些实施方案中,通过将人血清白蛋白溶液添加到肠胃外可接受的载体中制备第二水性组合物。在一些实施方案中,通过将人血清白蛋白溶液添加到装有肠胃外可接受的载体的输液袋或输液瓶中制备第二水性组合物。在一些实施方案中,通过将人血清白蛋白溶液添加到生理盐水或葡萄糖溶液中制备第二水性组合物。在一些实施方案中,通过将人血清白蛋白溶液添加到装有生理盐水或葡萄糖溶液的输液袋或输液瓶中制备第二水性组合物。在一些实施方案中,通过将输注用人血清白蛋白溶液添加到肠胃外可接受的载体中制备第二水性组合物。在一些实施方案中,通过将输注用人血清白蛋白溶液添加到生理盐水或葡萄糖溶液中制备第二水性组合物。在一些实施方案中,通过将输注用20%(w/v)的人血清白蛋白溶液添加到生理盐水或葡萄糖溶液中制备第二水性组合物。在一些实施方案中,通过将输注用25%(w/v)的人血清白蛋白溶液添加到生理盐水或葡萄糖溶液中制备第二水性组合物。在一些实施方案中,通过将输注用5%(w/v)的人血清白蛋白溶液添加到生理盐水或葡萄糖溶液中制备第二水性组合物。在一些实施方案中,通过将输注用人血清白
蛋白溶液添加到装有生理盐水或葡萄糖溶液的输液袋或输液瓶中制备第二水性组合物。在一些实施方案中,通过将输注用人血清白蛋白溶液添加到装有生理盐水或葡萄糖溶液的输液袋或输液瓶中制备第二水性组合物。在一些实施方案中,通过将输注用20%(w/v)的人血清白蛋白溶液添加到装有生理盐水或葡萄糖溶液的输液袋或输液瓶中制备第二水性组合物。在一些实施方案中,通过将输注用25%(w/v)的人血清白蛋白溶液添加到装有生理盐水或葡萄糖溶液的输液袋或输液瓶中制备第二水性组合物。在一些实施方案中,通过将输注用5%(w/v)的人血清白蛋白溶液添加到装有生理盐水或葡萄糖溶液的输液袋或输液瓶中制备第二水性组合物。在一些实施方案中,第二水性组合物中的人血清白蛋白的浓度是大约0.1%至大约20%(w/v)。在一些实施方案中,第二水性组合物中的人血清白蛋白的浓度是大约0.5%至大约15%(w/v)。在一些实施方案中,第二水性组合物中的人血清白蛋白的浓度是大约0.5%至大约10%(w/v)。在一些实施方案中,第二水性组合物中的人血清白蛋白的浓度是0.5%至5%(w/v)。在一些实施方案中,第二水性组合物中的人血清白蛋白的浓度是大约1%至大约10%(w/v)。在一些实施方案中,第二水性组合物中的人血清白蛋白的浓度是1%至3%(w/v)。在一些实施方案中,第二水性组合物包含大约1g至大约50g人血清白蛋白。在一些实施方案中,第二水性组合物包含大约1g至大约20g人血清白蛋白。在一些实施方案中,第二水性组合物包含大约2g至大约10g人血清白蛋白。在一些实施方案中,第二水性组合物的体积是大约100ml至大约1l。在一些实施方案中,第二水性组合物的体积是大约250ml至大约1l。在一些实施方案中,第二水性组合物的体积是大约250ml至大约500ml。
54.如本文所使用的,术语“多西他赛”是指cas号为114977-28-5和具有以下化学结构的化合物:
[0055][0056]
或其药学上可接受的盐。
[0057]
多西他赛是一种白色至近乎白色的粉末。它具有高度亲脂性,几乎不溶于水。
[0058]
此外,多西他赛是一种微管抑制剂,适用于乳腺癌、非小细胞肺癌、激素难治性前列腺癌、胃腺癌和头颈癌的鳞状细胞癌。
[0059]
如本文所使用的,术语“药学上可接受的盐”是指保留主题化合物所需生物活性且表现出最小的不希望的毒理学作用的盐。这些药学上可接受的盐可以在化合物最终分离和纯化过程中原位制备,或者通过使纯化的化合物以其游离酸或游离碱形式分别与合适的碱或酸分别反应制备。在一些实施方案中,药学上可接受的盐可能比各自的游离碱或游离酸
更好,因为所述盐赋予分子更大的稳定性或溶解度,从而有助于将制剂制成剂型。碱性化合物通常能够通过采用合适的酸处理来形成药学上可接受的酸加成盐。合适的酸包括药学上可接受的无机酸和药学上可接受的有机酸。代表性的药学上可接受的酸加成盐包括盐酸盐、氢溴酸盐、硝酸盐、甲基硝酸盐、硫酸盐、硫酸氢盐、氨基磺酸盐、磷酸盐、乙酸盐、羟基乙酸盐、苯乙酸盐、丙酸盐、丁酸盐、异丁酸盐、戊酸盐、马来酸盐、羟基马来酸盐、丙烯酸盐、富马酸盐、苹果酸盐、酒石酸盐、柠檬酸盐、水杨酸盐、对氨基水杨酸盐、乙醇酸盐、乳酸盐、庚酸盐、邻苯二甲酸盐、草酸盐、琥珀酸盐、苯甲酸盐、邻乙酰氧基苯甲酸盐、氯苯甲酸盐、甲基苯甲酸盐、二硝基苯甲酸盐、羟基苯甲酸盐、甲氧基苯甲酸盐、扁桃酸盐、鞣酸盐、甲酸盐、硬脂酸盐、抗坏血酸盐、棕榈酸盐、油酸盐、丙酮酸盐、双羟萘酸盐、丙二酸盐、月桂酸盐、戊二酸盐、谷氨酸盐、丙酸酯十二烷基硫酸盐(estolate)、甲基磺酸盐(甲磺酸盐)、乙基磺酸盐(乙磺酸盐)、2-羟基乙磺酸盐、苯磺酸盐(benzenesulfonate)(苯磺酸盐(besylate))、对氨基苯磺酸盐、对甲苯磺酸盐(甲苯磺酸盐)、萘-2-磺酸盐、乙二磺酸盐、二硫化氢、酒石酸氢盐、葡萄糖酸盐、葡萄糖醛酸盐、对溴苯磺酸盐、碳酸盐、焦硫酸盐、亚硫酸盐、亚硫酸氢盐、磷酸一氢盐、磷酸二氢盐、偏磷酸盐、焦磷酸盐、氯化物、溴化物、碘化物、癸酸盐(decanoate)、辛酸盐、癸酸盐(caprate)、丙炔酸盐、辛二酸盐、癸二酸盐、丁炔-1,4-二酸盐、己炔-1,6-二酸盐、对苯二甲酸盐、磺酸盐、二甲苯磺酸盐、苯丙酸盐、苯丁酸盐、β-羟基丁酸盐、乙醇酸盐、丙磺酸盐、萘-1-磺酸盐、萘-2-磺酸盐和2,5-二羟基苯甲酸盐。合适的碱包括药学上可接受的无机碱和药学上可接受的有机碱。代表性的药学上可接受的碱加成盐包括碱金属(包括钠、钾和锂)的氢氧化物;碱土金属(例如钙和镁)的氢氧化物;其他金属(例如铝和锌)的氢氧化物;氨,有机胺,例如未取代或羟基取代的单烷基胺、二烷基胺或三烷基胺,二环己胺;三丁胺;吡啶;n-甲胺,n-乙胺;二乙胺;三乙胺;单-、双-或三-(2-oh-(c
1-c6)-烷基胺),例如n,n-二甲基-n-(2-羟乙基)胺或三-(2-羟乙基)胺;n-甲基-d-葡糖胺;吗啉;硫代吗啉;哌啶;吡咯烷;以及精氨酸、赖氨酸等氨基酸。
[0060]
在一些实施方案中,多西他赛或其药学上可接受的盐可以是具有1、2或3当量水溶剂化物的多西他赛。在一些实施方案中,多西他赛或其药学上可接受的盐可以是具有3当量水溶剂化物的多西他赛。在一些实施方案中,多西他赛是多西他赛三水合物或其药学上可接受的盐。在一些实施方案中,多西他赛是多西他赛单水合物或其药学上可接受的盐。在一些实施方案中,多西他赛是无水多西他赛或其药学上可接受的盐。在一些实施方案中,多西他赛可以是具有一当量丙酮溶剂化物的多西他赛。在一些实施方案中,多西他赛可以是例如wo2010091650或us2012007167中公开的任何一种多西他赛溶剂化物,或其药学上可接受的盐,这两篇专利的公开内容通过引用而整体并入本文。
[0061]
在一些实施方案中,多西他赛或其药学上可接受的盐是晶体。在一些实施方案中,多西他赛或其药学上可接受的盐是例如wo2012115402、us8410294、us20100197944、us20100099897、us8357811、us20100160653或us20070142457中公开的任何一种晶形,这些专利的公开内容通过引用而整体并入本文。
[0062]
在一些实施方案中,多西他赛或其药学上可接受的盐是无定形的。在一些实施方案中,多西他赛是例如wo2008102374中公开的任何一种无定形形式,或其药学上可接受的盐,该专利的公开内容通过引用而整体并入本文。
[0063]
如本文所使用的,术语“人血清白蛋白”是指天然人血清白蛋白和重组人血清白蛋
白。在一些实施方案中,人血清白蛋白是天然人血清白蛋白。在一些实施方案中,人血清白蛋白是重组人血清白蛋白。
[0064]
合适的人血清白蛋白溶液包括但不限于市售的输注用人血清白蛋白溶液。市售的输注用人血清白蛋白溶液包含药学上可接受的赋形剂,例如n-乙酰色氨酸钠、辛酸钠、氯化钠、碳酸氢钠、氢氧化钠或乙酸等或它们的混合物。在一些实施方案中,可以采用肠胃外可接受的载体稀释市售的输注用人血清白蛋白溶液来制备人血清白蛋白溶液。
[0065]
或者,可以通过将人血清白蛋白粉末与可在市售白蛋白产品中提供的其他药学上可接受的赋形剂在水中混合来制备人血清白蛋白溶液。
[0066]
在一些实施方案中,人血清白蛋白溶液是市售输注用人血清白蛋白usp溶液。在一些实施方案中,输注用人血清白蛋白溶液是市售输注用人血清白蛋白usp溶液。在一些实施方案中,人血清白蛋白溶液包括市售输注用人血清白蛋白usp溶液。在一些实施方案中,市售输注用人血清白蛋白usp溶液用作人血清白蛋白溶液的来源。在一些实施方案中,输注用人血清白蛋白溶液是5%(w/v)的人血清白蛋白usp溶液。在一些实施方案中,输注用人血清白蛋白溶液是20%(w/v)的人血清白蛋白usp溶液。在一些实施方案中,输注用人血清白蛋白溶液是25%(w/v)的人血清白蛋白usp溶液。在一些实施方案中,人血清白蛋白溶液是通过稀释市售输注用人血清白蛋白溶液而制备的水溶液。
[0067]
术语“肠胃外”是指选自皮下(sc)、静脉内(iv)、肌内(im)、皮内(id)、腹膜内(ip)等的途径。
[0068]
此外,本文提供澄明无沉淀的多西他赛或其药学上可接受的盐的肠胃外输注组合物,其包括包含在肠胃外可接受的载体中的人血清白蛋白和所述多西他赛或其药学上可接受的盐,其中多西他赛的浓度是大约0.05mg/ml至大约1mg/ml,其中所述该肠胃外输注溶液通过将包含有多西他赛或其药学上可接受的盐和乙醇的第一液体组合物注射到装有第二水性组合物的输液袋或输液瓶中制备得到,其中所述第二水性组合物包括包含在肠胃外可接受的载体中的人血清白蛋白,其中在注射过程中不需要搅拌或搅动,并且其中所述输注溶液不含聚山梨醇酯80。在一些实施方案中,肠胃外可接受的载体是生理盐水或葡萄糖溶液。
[0069]
在一些实施方案中,所述多西他赛或其药学上可接受的盐的肠胃外输注组合物不包含脂质(例如大豆油)。在一些实施方案中,第一液体组合物不包含脂质(例如大豆油)。在一些实施方案中,脂质是大豆油。
[0070]
在一些实施方案中,所述多西他赛或其药学上可接受的盐的肠胃外输注组合物不包含表面活性剂。在一些实施方案中,第一液体组合物不包含表面活性剂。在一些实施方案中,第二水性组合物不包含表面活性剂。
[0071]
在本发明中,多西他赛或其药学上可接受的盐的肠胃外输注组合物是澄明溶液,而不是纳米颗粒悬浮液。通过动态光散射(dls)测量,与相关的人血清白蛋白盐水溶液相比,肠胃外输注组合物(溶液)具有几乎相同的dls特性。详细的dls数据在实施例部分中描述。在一些实施方案中,肠胃外输注组合物(溶液)中,至少30%的多西他赛是游离的(未结合的)多西他赛。在一些实施方案中,肠胃外输注组合物(溶液)中,至少40%的多西他赛是游离的(未结合的)多西他赛。在一些实施方案中,肠胃外输注组合物(溶液)中,至少50%的多西他赛是游离的(未结合的)多西他赛。在一些实施方案中,肠胃外输注组合物(溶液)中,
至少60%的多西他赛是游离的(未结合的)多西他赛。在一些实施方案中,肠胃外输注组合物(溶液)中,至少70%的多西他赛是游离的(未结合的)多西他赛。游离的(未结合的)多西他赛是指肠胃外输注组合物(溶液)中不与人血清白蛋白结合的多西他赛部分。肠胃外输注组合物(溶液)中的游离的(未结合的)多西他赛的浓度使用30-kda膜通过超滤测量得到。游离的(未结合的)多西他赛测量的详细实验情况在实施例部分描述。
[0072]
在一些实施方案中,多西他赛或其药学上可接受的盐的肠胃外输注组合物中,乙醇的含量不超过10%(v/v)。在一些实施方案中,多西他赛或其药学上可接受的盐的肠胃外输注组合物中,乙醇的含量不超过5%(v/v)。在一些实施方案中,多西他赛或其药学上可接受的盐的肠胃外输注组合物中,乙醇的含量不超过2%(v/v)。在一些实施方案中,多西他赛或其药学上可接受的盐的肠胃外输注组合物中,乙醇的含量不超过1.75%(v/v)。在一些实施方案中,多西他赛或其药学上可接受的盐的肠胃外输注组合物中,乙醇的含量不超过1.6%(v/v)。在一些实施方案中,多西他赛或其药学上可接受的盐的肠胃外输注组合物中,乙醇的含量不超过1.5%(v/v)。在一些实施方案中,多西他赛或其药学上可接受的盐的肠胃外输注组合物中,乙醇的含量不超过1.4%(v/v)。在一些实施方案中,多西他赛或其药学上可接受的盐的肠胃外输注组合物中,乙醇的含量不超过30ml。在一些实施方案中,多西他赛或其药学上可接受的盐的肠胃外输注组合物中,乙醇的含量不超过20ml。在一些实施方案中,多西他赛或其药学上可接受的盐的肠胃外输注组合物中,乙醇的含量不超过15ml。在一些实施方案中,多西他赛或其药学上可接受的盐的肠胃外输注组合物中,乙醇的含量不超过10ml。在一些实施方案中,多西他赛或其药学上可接受的盐的肠胃外输注组合物中,乙醇的含量不超过8ml。在一些实施方案中,多西他赛或其药学上可接受的盐的肠胃外输注组合物中,乙醇的含量不超过5ml。
[0073]
在一些实施方案中,所述多西他赛或其药学上可接受的盐的肠胃外输注组合物在输注或施用至患者前,少于大约24小时内制备。在一些实施方案中,所述多西他赛或其药学上可接受的盐的肠胃外输注组合物在输注或施用至患者前,少于大约12小时内制备。在一些实施方案中,所述多西他赛或其药学上可接受的盐的肠胃外输注组合物在输注或施用至患者前,少于大约8小时内制备。在一些实施方案中,所述多西他赛或其药学上可接受的盐的肠胃外输注组合物在输注或施用至患者前,少于大约6小时内制备。在一些实施方案中,所述多西他赛或其药学上可接受的盐的肠胃外输注组合物在输注或施用至患者前,少于大约4小时内制备。在一些实施方案中,所述多西他赛或其药学上可接受的盐的肠胃外输注组合物在输注或施用至患者前,少于大约1小时内制备。
[0074]
在一些实施方案中,肠胃外输注组合物的ph值是大约4至大约9.5。在一些实施方案中,肠胃外输注组合物的ph值是大约5至大约9。在一些实施方案中,肠胃外输注组合物的ph值是大约6至大约8。在一些实施方案中,肠胃外输注组合物的ph值是大约6.5至大约7.5。在一些实施方案中,肠胃外输注组合物的ph值是大约4至大约9。在一些实施方案中,肠胃外输注组合物的ph值是大约5至大约8.5。在一些实施方案中,肠胃外输注组合物的ph值是大约6至大约7.5。
[0075]
在一些实施方案中,1ml的肠胃外输注组合物包含不超过50个尺寸大于10μm的颗粒。在一些实施方案中,1ml的肠胃外输注组合物包含不超过100个尺寸大于10μm的颗粒。在一些实施方案中,1ml的肠胃外输注组合物包含不超过150个尺寸大于10μm的颗粒。在一些
实施方案中,1ml的肠胃外输注组合物包含不超过200个尺寸大于10μm的颗粒。
[0076]
在一些实施方案中,1ml的肠胃外输注组合物包含不超过5个尺寸大于25μm的颗粒。在一些实施方案中,1ml的肠胃外输注组合物包含不超过10个尺寸大于25μm的颗粒。在一些实施方案中,1ml的肠胃外输注组合物包含不超过5个尺寸大于15μm的颗粒。在一些实施方案中,1ml的肠胃外输注组合物包含不超过20个尺寸大于25μm的颗粒。
[0077]
在一些实施方案中,在肠胃外输注组合物中,多西他赛或其药学上可接受的盐的浓度是大约0.1mg/ml至大约0.8mg/ml。在一些实施方案中,在肠胃外输注组合物中,多西他赛或其药学上可接受的盐的浓度是大约0.1mg/ml至大约0.5mg/ml。在一些实施方案中,在肠胃外输注组合物中,多西他赛或其药学上可接受的盐的浓度是大约0.15mg/ml至大约0.4mg/ml。在一些实施方案中,在肠胃外输注组合物中,多西他赛或其药学上可接受的盐的浓度是大约0.2mg/ml至大约0.35mg/ml。在一些实施方案中,在肠胃外输注组合物中,多西他赛或其药学上可接受的盐的浓度是大约0.1mg/ml至大约0.3mg/ml。在一些实施方案中,在肠胃外输注组合物中,多西他赛或其药学上可接受的盐的浓度是大约0.2mg/ml至大约0.3mg/ml。在一些实施方案中,在肠胃外输注组合物中,多西他赛或其药学上可接受的盐的浓度是大约0.25mg/ml。在一些实施方案中,人血清白蛋白与多西他赛或其药学上可接受的盐的重量比是大约20:1至大约200:1。在一些实施方案中,人血清白蛋白与多西他赛或其药学上可接受的盐的重量比是大约20:1至大约100:1。在一些实施方案中,人血清白蛋白与多西他赛或其药学上可接受的盐的重量比是大约20:1、大约30:1、大约40:1、大约50:1、大约60:1、大约70:1、大约80:1、大约90:1、大约95:1、大约100:1或大约150:1。在一些实施方案中,在肠胃外输注组合物中,人血清白蛋白的浓度是大约0.1%至大约20%(w/v)。在一些实施方案中,在肠胃外输注组合物中,人血清白蛋白的浓度是大约0.5%至大约20%(w/v)。在一些实施方案中,在肠胃外输注组合物中,人血清白蛋白的浓度是大约0.5%至大约10%(w/v)。在一些实施方案中,在肠胃外输注组合物中,人血清白蛋白的浓度是大约0.5%至大约5%(w/v)。在一些实施方案中,在肠胃外输注组合物中,人血清白蛋白的浓度是大约1%至大约10%(w/v)。在一些实施方案中,在肠胃外输注组合物中,人血清白蛋白的浓度是大约1%至大约5%(w/v)。在一些实施方案中,在肠胃外输注组合物中,人血清白蛋白的浓度是大约0.5%至大约3%(w/v)。在一些实施方案中,在肠胃外输注组合物中,人血清白蛋白的浓度是大约1%至大约3%(w/v)。
[0078]
在一些实施方案中,第一液体组合物中的乙醇是无水乙醇。在一些实施方案中,第一液体组合物包含多西他赛或其药学上可接受的盐、乙醇和其他有机溶剂(例如醇,如丙二醇或聚乙二醇300等)。在一些实施方案中,第一液体组合物包含多西他赛或其药学上可接受的盐、乙醇和丙二醇。在一些实施方案中,第一液体组合物包含多西他赛或其药学上可接受的盐、乙醇和聚乙二醇300。在一些实施方案中,第一液体组合物还包含酸。在一些实施方案中,第一液体组合物包含多西他赛或其药学上可接受的盐、乙醇和有机酸。根据本发明,使用的最优选的酸是柠檬酸。在一些实施方案中,柠檬酸是无水柠檬酸。在一些实施方案中,乙醇是无水乙醇。在一些实施方案中,第一液体组合物包含多西他赛或其药学上可接受的盐、乙醇和柠檬酸。在一些实施方案中,第一液体组合物包含多西他赛或其药学上可接受的盐、乙醇、丙二醇和柠檬酸。在一些实施方案中,第一液体组合物是含有多西他赛或其药学上可接受的盐的乙醇溶液。在一些实施方案中,第一液体组合物是含有多西他赛或其药
学上可接受的盐和柠檬酸的乙醇溶液。在一些实施方案中,第一液体组合物是含有多西他赛或其药学上可接受的盐和柠檬酸的乙醇/丙二醇溶液。在一些实施方案中,第一液体组合物中,多西他赛或其药学上可接受的盐与柠檬酸的重量比是大约5000:1至大约1:1。在一些实施方案中,第一液体组合物中,多西他赛或其药学上可接受的盐与柠檬酸的重量比是大约2000:1至大约1:1。在一些实施方案中,第一液体组合物中,多西他赛或其药学上可接受的盐与柠檬酸的重量比是大约1000:1至大约1:1。在一些实施方案中,第一液体组合物中,多西他赛或其药学上可接受的盐与柠檬酸的重量比是大约500:1至大约1:1。在一些实施方案中,第一液体组合物中,多西他赛或其药学上可接受的盐与柠檬酸的重量比是大约5000:1至大约5:1。在一些实施方案中,第一液体组合物中,多西他赛或其药学上可接受的盐与柠檬酸的重量比是大约2000:1至大约5:1。在一些实施方案中,第一液体组合物中,多西他赛或其药学上可接受的盐与柠檬酸的重量比是大约1000:1至大约5:1。在一些实施方案中,第一液体组合物中,多西他赛或其药学上可接受的盐与柠檬酸的重量比是大约500:1至大约5:1。在一些实施方案中,第一液体组合物中,多西他赛或其药学上可接受的盐与柠檬酸的重量比是大约5000:1至大约10:1。在一些实施方案中,第一液体组合物中,多西他赛或其药学上可接受的盐与柠檬酸的重量比是大约2000:1至大约10:1。在一些实施方案中,第一液体组合物中,多西他赛或其药学上可接受的盐与柠檬酸的重量比是大约1000:1至大约10:1。在一些实施方案中,第一液体组合物中,多西他赛或其药学上可接受的盐与柠檬酸的重量比是大约500:1至大约10:1。在一些实施方案中,第一液体组合物中,多西他赛或其药学上可接受的盐与柠檬酸的重量比是大约2000:1至大约100:1。在一些实施方案中,第一液体组合物中,多西他赛或其药学上可接受的盐与柠檬酸的重量比是大约1000:1至大约100:1。在一些实施方案中,第一液体组合物中,多西他赛或其药学上可接受的盐与柠檬酸的重量比是大约500:1至大约100:1。在一些实施方案中,第一液体组合物中,多西他赛或其药学上可接受的盐与柠檬酸的重量比是大约5:1至大约20:1。在一些实施方案中,第一液体组合物中,多西他赛或其药学上可接受的盐与柠檬酸的重量比是大约5:1、大约10:1、大约15:1或大约20:1。在一些实施方案中,第一液体组合物中,柠檬酸的浓度是大约0.005mg/ml至大约10mg/ml。在一些实施方案中,第一液体组合物中,柠檬酸的浓度是大约0.01mg/ml至大约2mg/ml。在一些实施方案中,第一液体组合物中,柠檬酸的浓度是大约0.01mg/ml至大约1mg/ml。在一些实施方案中,第一液体组合物中,柠檬酸的浓度是大约0.02mg/ml至大约0.5mg/ml。在一些实施方案中,第一液体组合物中,柠檬酸的浓度是大约0.02mg/ml至大约0.2mg/ml。在一些实施方案中,第一液体组合物中,多西他赛或其药学上可接受的盐的浓度是大约1mg/ml至大约200mg/ml。在一些实施方案中,第一液体组合物中,多西他赛或其药学上可接受的盐的浓度是大约5mg/ml至大约100mg/ml。在一些实施方案中,第一液体组合物中,多西他赛或其药学上可接受的盐的浓度是大约10mg/ml至大约50mg/ml。在一些实施方案中,第一液体组合物中,多西他赛或其药学上可接受的盐的浓度是大约20mg/ml。在一些实施方案中,第一液体组合物中,多西他赛或其药学上可接受的盐的浓度是大约10mg/ml至大约30mg/ml。在一些实施方案中,第一液体组合物中,多西他赛或其药学上可接受的盐的浓度是大约10mg/ml、大约20mg/ml或大约30mg/ml。
[0079]
在一些实施方案中,通过将多西他赛或其药学上可接受的盐溶解在乙醇中制备第一液体组合物。在一些实施方案中,通过将多西他赛或其药学上可接受的盐和柠檬酸溶解
在乙醇中制备第一液体组合物。在一些实施方案中,通过将多西他赛或其药学上可接受的盐溶解在乙醇和丙二醇中制备第一液体组合物。在一些实施方案中,通过将多西他赛或其药学上可接受的盐和柠檬酸溶解在乙醇和丙二醇中制备第一液体组合物。
[0080]
在一些实施方案中,通过将人血清白蛋白溶液添加到肠胃外可接受的载体中制备第二水性组合物。在一些实施方案中,通过将人血清白蛋白溶液添加到生理盐水或葡萄糖溶液中制备第二水性组合物。在一些实施方案中,通过将输注用人血清白蛋白溶液添加到肠胃外可接受的载体中制备第二水性组合物。在一些实施方案中,通过将输注用人血清白蛋白溶液添加到生理盐水或葡萄糖溶液中制备第二水性组合物。在一些实施方案中,通过将输注用20%(w/v)的人血清白蛋白溶液添加到生理盐水或葡萄糖溶液中制备第二水性组合物。在一些实施方案中,通过将输注用25%(w/v)的人血清白蛋白溶液添加到生理盐水或葡萄糖溶液中制备第二水性组合物。在一些实施方案中,通过将输注用5%(w/v)的人血清白蛋白溶液添加到生理盐水或葡萄糖溶液中制备第二水性组合物。在一些实施方案中,第二水性组合物中的人血清白蛋白的浓度是大约0.1%至大约20%(w/v)。在一些实施方案中,第二水性组合物中的人血清白蛋白的浓度是大约0.5%至大约10%(w/v)。在一些实施方案中,第二水性组合物中的人血清白蛋白的浓度是0.5%至5%(w/v)。在一些实施方案中,第二水性组合物中的人血清白蛋白的浓度是1%至3%(w/v)。在一些实施方案中,第二水性组合物包含大约1g至大约50g人血清白蛋白。在一些实施方案中,第二水性组合物包含大约1g至大约20g人血清白蛋白。在一些实施方案中,第二水性组合物包含大约2g至大约10g人血清白蛋白。
[0081]
将第一液体组合物注射到装有第二水性组合物的输液袋或输液瓶中时间是快速的。在一些实施方案中,注射时间不超过60秒。在一些实施方案中,注射时间不超过30秒。在一些实施方案中,注射时间不超过15秒。在一些实施方案中,注射时间不超过10秒。在一些实施方案中,注射时间不超过5秒。在一些实施方案中,注射时间不超过3秒。在一些实施方案中,将第一液体组合物注射到含有第二水性组合物的输液袋或输液瓶中是在大约15℃至大约30℃的温度下进行。在一些实施方案中,将第一液体组合物注射到含有第二水性组合物的输液袋或输液瓶中是在大约15℃至大约25℃的温度下进行。在一些实施方案中,将第一液体组合物注射到含有第二水性组合物的输液袋或输液瓶中是在大约18℃至大约25℃的温度下进行。在一些实施方案中,将第一液体组合物注射到含有第二水性组合物的输液袋或输液瓶中是在大约20℃至大约25℃的温度下进行。
[0082]
在将第一液体组合物注射到含有第二水性组合物的输液袋或输液瓶内的过程中,不需要搅拌(例如,手动搅拌,例如使用搅拌器)或搅动。将第一液体组合物注射到输液袋或输液瓶中完成后,将第一液体组合物和第二水性组合物充分混合(例如用手轻轻正反倒转含有这些组合物的输液袋),得到澄明无沉淀的输注溶液。在一些实施方案中,含有第二水性组合物的输液袋或输液瓶在注射过程中保持静止。在一些实施方案中,在注射过程中将第一液体组合物注射到第二水性组合物的液体表面下方。在一些实施方案中,在注射完成后,将输液袋或输液瓶反复轻轻正反倒转,以充分混合第一液体组合物和第二水性组合物。在一些实施方案中,注射完成后,将输液袋或输液瓶轻轻正反倒转,直到得到澄明无沉淀的溶液。在一些实施方案中,注射完成后,将输液袋或输液瓶轻轻正反倒转大约5秒至大约10分钟。在一些实施方案中,注射完成后,将输液袋或输液瓶轻轻正反倒转大约10秒至大约5
分钟。在一些实施方案中,注射完成后,将输液袋或输液瓶轻轻正反倒转大约0.5分钟至大约3分钟。在一些实施方案中,注射完成后,将第一液体组合物和第二水性组合物充分混合均匀,直到得到澄明无沉淀的输注溶液。
[0083]
在将第一液体组合物注射到包含第二水性组合物的输液袋或输液瓶中,然后将第一液体组合物和第二水性组合物充分混合,得到包括包含在肠胃外可接受的载体中的人血清白蛋白、多西他赛或其药学上可接受的盐,以及乙醇的澄明无沉淀输注溶液。在一些实施方案中,澄明输注溶液还包含柠檬酸。在一些实施方案中,肠胃外可接受的载体是生理盐水或葡萄糖溶液。在一些实施方案中,澄明输注溶液至少1小时内保持澄明无沉淀。在一些实施方案中,澄明输注溶液至少2小时内保持澄明无沉淀。在一些实施方案中,澄明输注溶液至少3小时内保持澄明无沉淀。在一些实施方案中,澄明输注溶液至少4小时内保持澄明无沉淀。在一些实施方案中,澄明输注溶液至少6小时内保持澄明无沉淀。在一些实施方案中,澄明输注溶液至少8小时内保持澄明无沉淀。在一些实施方案中,当澄明输注溶液保持在大约18℃至大约25℃时,澄明输注溶液至少在1小时、2小时、3小时、4小时或6小时内保持澄明无沉淀。在一些实施方案中,当澄明输注溶液保持在大约20℃至大约25℃时,澄明输注溶液至少在1小时、2小时、3小时、4小时或6小时内保持澄明无沉淀。在一些实施方案中,当澄明溶液保持在大约2-8℃时,澄明溶液至少在2小时、4小时、6小时、8小时或12小时内保持澄明无沉淀。
[0084]
在一些实施方案中,本发明提供制备本文所述的澄明无沉淀的多西他赛肠胃外输注组合物的方法。非限制性的优选方法如下。
[0085]
1)将多西他赛与酸(例如柠檬酸)溶解在乙醇或包含乙醇的混合溶剂(例如乙醇与peg300的混合溶剂,或乙醇与peg400的混合溶剂)中,制备第一液体组合物;
[0086]
2)将人血清白蛋白溶液(例如临床使用的输注用20%、25%或5%(w/v)人血清白蛋白溶液)添加到含有肠胃外可接受的载体(例如生理盐水或葡萄糖溶液)的输液袋或输液瓶中,制备第二水性组合物;
[0087]
3)将第一液体组合物注射到含有第二水性组合物的输液袋或输液瓶中;在注射过程中,输液袋或输液瓶保持静止,不需要搅拌或搅动;
[0088]
4)将第一液体组合物注射到输液袋或输液瓶中后,将第一液体组合物和第二水性组合物充分混合(例如用手轻轻正反倒转含有这些组合物的输液袋或输液瓶),得到澄明无沉淀的输注溶液。
[0089]
该方法的一个实施方案如下,例如,该方法包括:
[0090]
1)将多西他赛和酸(例如柠檬酸)溶解在乙醇或包含乙醇的混合溶剂(例如乙醇和peg300的混合溶剂,或乙醇和peg400的混合溶剂)中,制备第一液体组合物(例如,该方法包括得到包含在乙醇中或在包含乙醇的混合溶剂中的多西他赛和酸溶液的第一液体组合物);
[0091]
2)将人血清白蛋白溶液(例如临床使用的输注用20%、25%或5%(w/v)人血清白蛋白溶液)添加到含有肠胃外可接受的载体(例如生理盐水或葡萄糖溶液)的输液袋或输液瓶中,制备第二水性组合物(例如,该方法包括得到包含第二水性组合物的输液袋或输液瓶,所述第二水性组合物含有hsa溶液和肠胃外可接受的载体);
[0092]
3)将第一液体组合物注射到含有第二水性组合物的输液袋或输液瓶中;在注射过
程中,输液袋或输液瓶保持静止,不需要搅拌或搅动(例如,该方法包括通过将第一液体组合物注射到包含第二水性组合物的输液袋或输液瓶中,来将第一液体组合物和第二水性组合物进行混合,而在这过程中并不需要搅拌这些组合物与/或不需要搅动输液袋或输液瓶(例如,保持输液袋或输液瓶静止);及
[0093]
4)将第一液体组合物注射到输液袋或输液瓶后,将第一液体组合物和第二水性组合物充分混合(例如用手轻轻正反倒转含有这些组合物的输液袋或输液瓶),得到澄明无沉淀的输注溶液(例如,该方法包括搅动含有这些组合物的输液袋或输液瓶,得到澄明的输注溶液)。
[0094]
制备的第一步和第二步可以同时或以任何不同的顺序进行。
[0095]
此外,本文提供用于制备肠胃外输注溶液的试剂盒,包括:第一容器,其含有包含多西他赛或其药学上可接受的盐的组合物;和第二容器,其含有包含人血清白蛋白的组合物。在一些实施方案中,试剂盒包括:第一容器,其含有包含多西他赛或其药学上可接受的盐的液体组合物;和第二容器,其含有包含人血清白蛋白的液体组合物。在一些实施方案中,试剂盒包括:第一容器,其含有包含多西他赛或其药学上可接受的盐和乙醇的液体组合物;和第二容器,其含有包含人血清白蛋白的液体组合物。在一些实施方案中,试剂盒包括:第一容器,其含有包含多西他赛或其药学上可接受的盐、柠檬酸和乙醇的液体组合物;和第二容器,其含有包含人血清白蛋白的液体组合物。在一些实施方案中,试剂盒包括:第一容器,其含有包含多西他赛或其药学上可接受的盐、柠檬酸和无水乙醇的液体组合物;和第二容器,其含有包含人血清白蛋白的液体组合物。在一些实施方案中,试剂盒包括:第一容器,其含有包含多西他赛或其药学上可接受的盐、柠檬酸和乙醇的液体组合物;和第二容器,其含有输注用人血清白蛋白溶液(例如,20%、25%或5%(w/v))。
[0096]
在一些实施方案中,第一容器不包含脂质(例如大豆油)。在一些实施方案中,脂质是大豆油。在一些实施方案中,第一容器不包含表面活性剂。在一些实施方案中,第二容器不包含表面活性剂。
[0097]
在一些实施方案中,第一容器中含有的乙醇是无水乙醇。在一些实施方案中,第一容器含有包含多西他赛或其药学上可接受的盐和乙醇的液体组合物。在一些实施方案中,第一容器含有包含多西他赛或其药学上可接受的盐、酸和乙醇的液体组合物。在一些实施方案中,第一容器含有包含多西他赛或其药学上可接受的盐、有机酸和乙醇的液体组合物。在一些实施方案中,第一容器含有包含多西他赛或其药学上可接受的盐、乙醇和其他有机溶剂(例如醇,如丙二醇或聚乙二醇300等)的液体组合物。在一些实施方案中,第一容器含有包含多西他赛或其药学上可接受的盐、乙醇和丙二醇的液体组合物。在一些实施方案中,第一容器含有包含多西他赛或其药学上可接受的盐、乙醇和聚乙二醇300的液体组合物。在一些实施方案中,第一容器含有包含多西他赛或其药学上可接受的盐和柠檬酸的液体组合物。在一些实施方案中,第一容器含有包含多西他赛或其药学上可接受的盐、柠檬酸和乙醇的液体组合物。在一些实施方案中,第一容器含有包含多西他赛或其药学上可接受的盐、柠檬酸和无水乙醇的液体组合物。在一些实施方案中,第一容器含有包含多西他赛或其药学上可接受的盐、柠檬酸、乙醇和丙二醇的液体组合物。在一些实施方案中,第一容器中的乙醇是无水乙醇。在一些实施方案中,第一容器含有包含多西他赛或其药学上可接受的盐的乙醇溶液。在一些实施方案中,第一容器含有包含多西他赛或其药学上可接受的盐和柠檬
酸的乙醇溶液。在一些实施方案中,第一容器含有包含多西他赛或其药学上可接受的盐和柠檬酸的无水乙醇溶液。在一些实施方案中,第一容器含有包含多西他赛或其药学上可接受的盐和柠檬酸的乙醇/丙二醇溶液。在一些实施方案中,第一容器中,多西他赛或其药学上可接受的盐与柠檬酸的重量比是大约5000:1至大约1:1。在一些实施方案中,第一容器中,多西他赛或其药学上可接受的盐与柠檬酸的重量比是大约2000:1至大约1:1。在一些实施方案中,第一容器中,多西他赛或其药学上可接受的盐与柠檬酸的重量比是大约1000:1至大约1:1。在一些实施方案中,第一容器中,多西他赛或其药学上可接受的盐与柠檬酸的重量比是大约500:1至大约1:1。在一些实施方案中,第一容器中,多西他赛或其药学上可接受的盐与柠檬酸的重量比是大约5000:1至大约5:1。在一些实施方案中,第一容器中,多西他赛或其药学上可接受的盐与柠檬酸的重量比是大约2000:1至大约5:1。在一些实施方案中,第一容器中,多西他赛或其药学上可接受的盐与柠檬酸的重量比是大约1000:1至大约5:1。在一些实施方案中,第一容器中,多西他赛或其药学上可接受的盐与柠檬酸的重量比是大约500:1至大约5:1。在一些实施方案中,第一容器中,多西他赛或其药学上可接受的盐与柠檬酸的重量比是大约5000:1至大约10:1。在一些实施方案中,第一容器中,多西他赛或其药学上可接受的盐与柠檬酸的重量比是大约2000:1至大约10:1。在一些实施方案中,第一容器中,多西他赛或其药学上可接受的盐与柠檬酸的重量比是大约1000:1至大约10:1。在一些实施方案中,第一容器中,多西他赛或其药学上可接受的盐与柠檬酸的重量比是大约500:1至大约10:1。在一些实施方案中,第一容器中,多西他赛或其药学上可接受的盐与柠檬酸的重量比是大约2000:1至大约100:1。在一些实施方案中,第一容器中,多西他赛或其药学上可接受的盐与柠檬酸的重量比是大约1000:1至大约100:1。在一些实施方案中,第一容器中,多西他赛或其药学上可接受的盐与柠檬酸的重量比是大约500:1至大约100:1。在一些实施方案中,第一容器中,多西他赛或其药学上可接受的盐与柠檬酸的重量比是大约5:1至大约20:1。在一些实施方案中,第一容器中,多西他赛或其药学上可接受的盐与柠檬酸的重量比是大约5:1、大约10:1、大约15:1或大约20:1。在一些实施方案中,第一容器中,柠檬酸或其药学上可接受的盐的浓度是大约0.005mg/ml至大约10mg/ml。在一些实施方案中,第一容器中,柠檬酸的浓度是大约0.01mg/ml至大约2mg/ml。在一些实施方案中,第一容器中,柠檬酸的浓度是大约0.01mg/ml至大约1mg/ml。在一些实施方案中,第一容器中,柠檬酸的浓度是大约0.02mg/ml至大约0.5mg/ml。在一些实施方案中,第一容器中,柠檬酸的浓度是大约0.02mg/ml至大约0.2mg/ml。
[0098]
在一些实施方案中,第一容器中含有的多西他赛的含量是大约10mg至大约300mg多西他赛。在一些实施方案中,第一容器中含有的多西他赛的含量是大约20mg至大约200mg多西他赛。在一些实施方案中,第一容器中含有的的多西他赛的含量是大约20mg、大约40mg、大约60mg、大约80mg、大约100mg、大约120mg或大约160mg多西他赛。在一些实施方案中,第一容器中含有的多西他赛的含量是大约80mg或大约100mg多西他赛。在一些实施方案中,第一容器中含有的乙醇的含量是大约0.5ml至大约50ml乙醇。在一些实施方案中,第一容器中含有的乙醇的含量是大约1ml至大约20ml乙醇。在一些实施方案中,第一容器中含有的乙醇的含量是大约1ml至大约10ml乙醇。在一些实施方案中,第一容器中含有的乙醇的含量是大约3ml至大约6ml乙醇。在一些实施方案中,第一容器中含有的乙醇的含量是大约1ml至大约5ml乙醇。在一些实施方案中,第一容器中含有的乙醇的含量是大约5ml至大约10ml
乙醇。在一些实施方案中,第一容器中的多西他赛的浓度是大约1mg/ml至大约200mg/ml。在一些实施方案中,第一容器中的多西他赛的浓度是大约5mg/ml至大约100mg/ml。在一些实施方案中,第一容器中的多西他赛的浓度是大约10mg/ml至大约50mg/ml。在一些实施方案中,第一容器中的多西他赛的浓度是大约20mg/ml。在一些实施方案中,第一容器中的多西他赛的浓度是大约10mg/ml至大约30mg/ml。在一些实施方案中,第一容器中的多西他赛的浓度是大约10mg/ml、大约20mg/ml或大约30mg/ml。
[0099]
在一些实施方案中,第一容器含有包含多西他赛或其药学上可接受的盐的固体组合物。在一些实施方案中,第一容器含有包含多西他赛或其药学上可接受的盐和有机酸的固体组合物。在一些实施方案中,第一容器含有包含多西他赛或其药学上可接受的盐和柠檬酸的固体组合物。
[0100]
在一些实施方案中,第二容器含有包含人血清白蛋白的液体组合物。在一些实施方案中,第二容器含有人血清白蛋白溶液。在一些实施方案中,第二容器含有输注用人血清白蛋白溶液。在一些实施方案中,第二容器含有人血清白蛋白溶液,溶液中的人血清白蛋白的浓度是大约1%至大约25%(w/v)。在一些实施方案中,第二容器含有人血清白蛋白溶液,溶液中的人血清白蛋白的浓度是大约5%至大约25%(w/v)。在一些实施方案中,第二容器含有输注用人血清白蛋白溶液。在一些实施方案中,第二容器含有输注用20%人血清白蛋白溶液。在一些实施方案中,第二容器含有输注用25%人血清白蛋白溶液。在一些实施方案中,第二容器含有输注用5%人血清白蛋白溶液。在一些实施方案中,第二容器含有包含大约1g至大约50g人血清白蛋白的液体组合物。在一些实施方案中,第二容器含有包含大约1g至大约30g人血清白蛋白的液体组合物。在一些实施方案中,第二容器含有包含大约1g至大约20g人血清白蛋白的液体组合物。在一些实施方案中,第二容器含有包含大约1g至大约10g人血清白蛋白的液体组合物。在一些实施方案中,第二容器含有包含大约2g至大约6g人血清白蛋白的液体组合物。在一些实施方案中,第二容器含有包含大约2g、大约4g、大约6g、大约8g、大约10g、大约12g或大约16g人血清白蛋白的液体组合物。
[0101]
在一些实施方案中,第一容器包含大约80mg多西他赛。在一些实施方案中,第一容器包含大约4ml乙醇。在一些实施方案中,第一容器包含大约80mg多西他赛和大约4ml乙醇。
[0102]
在一些实施方案中,试剂盒包含含大约80mg多西他赛的第一容器和含大约2g至大约8g人血清白蛋白的第二容器。在一些实施方案中,试剂盒包含含大约80mg多西他赛的第一容器和含大约3g至大约6g人血清白蛋白的第二容器。在一些实施方案中,试剂盒包含含大约80mg多西他赛的第一容器和含大约4g至大约5g人血清白蛋白的第二容器。
[0103]
在一些实施方案中,试剂盒还包括将包含多西他赛或其药学上可接受的盐的组合物添加到包含人血清白蛋白的组合物中的说明书。
[0104]
目前市售的泰索帝(taxotere)的制剂中包含聚山梨醇酯80和乙醇。目前,美国市场上的其他所有多西他赛注射液也含有聚山梨醇酯80和乙醇。美国销售多西他赛注射液的公司包括但不限于hospira inc.、sun pharma、accord hlthcare、sandoz、江苏恒瑞医药、actavis llc、dr.reddys labs ltd、teikoku pharma、dfb oncology ltd、ingenus phams llc、mylan labs inc、shilpa medcare ltd和amneal等。本技术人惊奇地发现,使用本发明中公开的技术方法(例如,在将多西他赛注射液添加(注射)到输液袋/输液瓶用于制备输注溶液之前,在输液袋/输液瓶中添加/混合临床上使用的输注用人血清白蛋白溶液与生理盐
水),实际上不需要在多西他赛注射液制剂中添加聚山梨醇酯80。在临床使用中,目前市场上的多西他赛注射液每次输注都输入给患者大量的聚山梨醇酯80(大约3-5g)。聚山梨醇酯80会使某些患者引起严重的超敏反应,包括致命的过敏反应。因此,不含聚山梨醇酯80的多西他赛注射液在安全性方面比目前市场上的采用聚山梨醇酯80配制的多西他赛注射液具有显著的临床优势。
[0105]
此外,本文提供可注射的药物组合物,其包含多西他赛或其药学上可接受的盐和乙醇,其中所述可注射的药物组合物包含大约5mg至500mg多西他赛或其药学上可接受的盐,其中所述可注射的药物组合物不含有聚山梨醇酯80,并且其中该可注射的药物组合物在输注或施用至患者之前,所述可注射的药物组合物进一步与包含人血清白蛋白的水性组合物混合,形成肠胃外输注溶液。在一些实施方案中,可注射的药物组合物还包含柠檬酸。在一些实施方案中,可注射的药物组合物与包含人血清白蛋白的水性组合物的混合在输液袋或输液瓶中进行。
[0106]
在一些实施方案中,可注射的药物组合物与包含人血清白蛋白的水性组合物的混合包括两个步骤。在第一步中,将可注射的药物组合物注射到含有包含人血清白蛋白的水性组合物的输液袋或输液瓶中。在注射过程中,输液袋或输液瓶保持静止,无需搅拌或搅动。在第二步中,将可注射的药物组合物注射到输液袋或输液瓶中后,将可注射的药物组合物和水性组合物充分混合(例如用手轻轻正反倒转含有这些组合物的输液袋或输液瓶),得到澄明无沉淀的输注溶液。
[0107]
在将可注射的药物组合物注射到含有包含人血清白蛋白的水性组合物的输液袋或输液瓶内的过程中,在注射过程中,输液袋或输液瓶保持静止,不需要搅拌或搅动。我们惊奇地发现,仅仅通过轻轻地正反倒转输液袋或输液瓶(例如5-30次),即可得到澄明无沉淀的输注溶液。
[0108]
在一些实施方案中,多西他赛或其药学上可接受的盐的肠胃外输注溶液是澄明溶液,而不是纳米颗粒悬浮液。在一些实施方案中,肠胃外输注溶液中,至少30%的多西他赛是游离的(未结合的)多西他赛。在一些实施方案中,肠胃外输注溶液中,至少40%的多西他赛是游离的(未结合的)多西他赛。在一些实施方案中,肠胃外输注溶液中,至少50%的多西他赛是游离的(未结合的)多西他赛。在一些实施方案中,肠胃外输注溶液中,至少60%的多西他赛是游离的(未结合的)多西他赛。在一些实施方案中,肠胃外输注溶液中,至少70%的多西他赛是游离的(未结合的)多西他赛。游离的(未结合的)多西他赛是指在肠胃外输注溶液中不与人血清白蛋白结合的多西他赛部分。肠胃外输注溶液中的游离的(未结合的)多西他赛的浓度使用30-kda膜通过超滤测量得到。游离的(未结合的)多西他赛测量的详细实验情况在实施例部分描述。
[0109]
在一些实施方案中,本文提供的是包含多西他赛和乙醇的无聚山梨醇酯80的多西他赛注射液。在一些实施方案中,本文提供的是包含多西他赛、柠檬酸和乙醇的无聚山梨醇酯80的多西他赛注射液。在一些实施方案中,本文提供的是基本上由多西他赛、柠檬酸和乙醇组成的无聚山梨醇酯80的多西他赛注射液。
[0110]
在一些实施方案中,可注射的药物组合物包含大约10mg至大约300mg多西他赛或其药学上可接受的盐。在一些实施方案中,可注射的药物组合物包含大约20mg至大约200mg多西他赛或其药学上可接受的盐。在一些实施方案中,可注射的药物组合物包含20mg、
40mg、80mg、120mg或160mg多西他赛。在一些实施方案中,可注射的药物组合物包含大约20mg、大约40mg、大约80mg、大约120mg或大约160mg多西他赛。
[0111]
在一些实施方案中,可注射的药物组合物不包含脂质(例如大豆油)。在一些实施方案中,可注射的药物组合物不包含表面活性剂。在一些实施方案中,除了乙醇之外,可注射的药物组合物还含有一种或多种其他有机溶剂(例如丙二醇、聚乙二醇300、聚乙二醇400等)。在一些实施方案中,可注射的药物组合物含有大于50%的乙醇(v/v)。在一些实施方案中,可注射的药物组合物含有大于70%的乙醇(v/v)。在一些实施方案中,可注射的药物组合物含有大于80%的乙醇(v/v)。
[0112]
在一些实施方案中,可注射的药物组合物中的多西他赛或其药学上可接受的盐的浓度是大约5mg/ml至大约40mg/ml。在一些实施方案中,可注射的药物组合物中的多西他赛或其药学上可接受的盐的浓度是大约10mg/ml至大约20mg/ml。在一些实施方案中,可注射的药物组合物中的多西他赛或其药学上可接受的盐的浓度是大约10mg/ml、大约15mg/ml或大约20mg/ml。
[0113]
在一些实施方案中,可注射的药物组合物还包含酸。在一些实施方案中,酸是有机酸。根据本发明,使用的最优选的酸是柠檬酸。
[0114]
在一些实施方案中,可注射的药物组合物的ph值是大约3至大约9。在一些实施方案中,可注射的药物组合物的ph值是大约3至大约8。在一些实施方案中,可注射的药物组合物的ph值是大约3至大约7。在一些实施方案中,可注射的药物组合物的ph值是大约3至大约6.5。在一些实施方案中,可注射的药物组合物的ph值是大约3.5至大约6.5。在一些实施方案中,可注射的药物组合物的ph值是大约3.5至大约6。在一些实施方案中,可注射的药物组合物的ph值是大约3.5至大约5.5。在一些实施方案中,可注射的药物组合物的ph值是大约4至大约5。为了测定可注射的药物剂型的ph值,将可注射的药物剂型与生理盐水以1:1的比例(v/v)混合,得到水溶液,然后测定该水溶液的ph值。
[0115]
根据另一个实施方案,多西他赛的可注射的药物组合物被配制成可注射的药物剂型。在一些实施方案中,可注射的药物剂型包含大约20mg、大约40mg、大约80mg、大约120mg或大约160mg多西他赛或其药学上可接受的盐、柠檬酸和乙醇,其中可注射的药物剂型中的多西他赛或其药学上可接受的盐的浓度是大约5mg/ml至40mg/ml(例如,大约20mg/ml、大约10mg/ml)。在一些实施方案中,可注射的药物剂型的ph值是大约3至大约6.5。可注射的药物剂型的优选ph值是大约3.5至大约5.5。
[0116]
此外,本文提供治疗癌症的方法,所述方法包括向有需要的受试者施用治疗有效剂量的本文所述的任何组合物或制剂。在一些实施方案中,所述方法包括向有需要的受试者肠胃外施用治疗有效剂量的本发明的液体输注组合物。
[0117]
在一些实施方案中,癌症选自由膀胱癌、脑癌、乳腺癌、结肠直肠癌、宫颈癌、胃肠癌、泌尿生殖系统癌、头颈癌、肺癌、卵巢癌、胰腺癌、前列腺癌、肾癌、皮肤癌和睾丸癌组成的组。
[0118]
在一些实施方案中,癌症选自肉瘤、血管肉瘤、纤维肉瘤、横纹肌肉瘤、脂肪肉瘤、粘液瘤、横纹肌瘤、纤维瘤、脂肪瘤、畸胎瘤、非小细胞肺癌(nsclc)、支气管鳞状细胞癌、未分化小细胞癌、未分化大细胞癌、腺癌、肺泡细支气管癌、支气管腺瘤、肉瘤、淋巴瘤、软骨瘤性错构瘤、间皮瘤、胃肠癌、食道癌、鳞状细胞癌、腺癌、平滑肌肉瘤、淋巴瘤、胃癌、恶性上皮
肿瘤、淋巴瘤、平滑肌肉瘤、胰腺癌、导管腺癌、胰岛素瘤、胰高血糖素瘤、胃泌素瘤、类癌瘤、舒血管肠肽瘤、小肠癌、腺癌、淋巴瘤、类癌瘤、卡波西肉瘤、平滑肌瘤、血管瘤、脂肪瘤、神经纤维瘤、纤维瘤、大肠或结肠癌、管状腺瘤、绒毛状腺瘤、错构瘤、平滑肌瘤、泌尿生殖道癌、肾腺癌、wilm瘤(肾母细胞瘤)、淋巴瘤、白血病、膀胱癌、尿道癌、鳞状细胞癌、移行细胞癌、前列腺癌、睾丸癌、精原细胞瘤、畸胎瘤、胚胎癌、畸胎癌、绒毛膜癌、肉瘤、间质细胞癌、纤维瘤、纤维腺瘤、腺瘤样瘤、脂肪瘤、肝癌、肝细胞癌、胆管癌、肝母细胞瘤、血管肉瘤、肝细胞腺瘤、血管瘤、骨癌、成骨肉瘤(骨肉瘤)、纤维肉瘤、恶性纤维组织细胞瘤、软骨肉瘤、尤文氏肉瘤、恶性淋巴瘤(网状细胞肉瘤)、多发性骨髓瘤、恶性巨细胞瘤、脊索瘤、骨软骨瘤(骨软骨性外生骨疣)、良性软骨瘤、软骨母细胞瘤、软骨粘液样纤维瘤、骨样骨瘤巨细胞瘤、神经系统癌、颅骨癌、脑壳瘤、血管瘤、肉芽瘤、黄色瘤、畸形性骨炎、脑膜癌、脑膜瘤、脑膜肉瘤、神经胶质瘤病、脑癌、星形细胞瘤、髓母细胞瘤、神经胶质瘤、室管膜瘤、生殖细胞瘤(松果体瘤)、多形性胶质母细胞瘤、少突神经胶质细胞瘤、神经鞘瘤、视网膜母细胞瘤、先天性肿瘤、脊髓癌、神经纤维瘤、脑膜瘤、神经胶质瘤、肉瘤、妇科癌症、子宫癌、子宫内膜癌、宫颈癌、肿瘤前宫颈非典型增生、卵巢癌症、卵巢癌、浆液性囊腺癌、粘液性囊腺癌、未分类癌、颗粒泡膜细胞瘤、卵巢支持-间质细胞瘤、无性细胞瘤、恶性畸胎瘤、外阴癌、鳞状细胞癌、上皮内癌、腺癌、纤维肉瘤、黑色素瘤、阴道癌、透明细胞癌、鳞状细胞癌、葡萄状肉瘤、胚胎性横纹肌肉瘤、输卵管癌、血液癌症、血液癌症、急性髓性白血病(aml)、慢性髓性白血病(cml)、急性淋巴细胞性白血病(all)、慢性淋巴细胞性白血病、慢性淋巴细胞性白血病、骨髓增生性疾病、多发性骨髓瘤、骨髓增生异常综合征、霍奇金淋巴瘤、非霍奇金淋巴瘤(恶性淋巴瘤)、华氏巨球蛋白血症、皮肤癌、恶性黑色素瘤、基底细胞癌、鳞状细胞癌、卡波西肉瘤、痣发育不良痣、脂肪瘤、血管瘤、皮肤纤维瘤、瘢瘤、牛皮癣、肾上腺癌和神经母细胞瘤。
[0119]
在一些实施方案中,癌症选自乳腺癌、非小细胞肺癌、激素难治性前列腺癌、胃腺癌和头颈癌的鳞状细胞癌。
[0120]
此外,本文提供一种肠胃外药物制剂,包含在输注或施用至患者之前混合的两种组合物,所述两种组合物包括:(a)包含基本上不溶于水的药物活性剂或其药学上可接受的盐的第一液体组合物,和(b)包含人血清白蛋白和肠胃外可接受的载体的第二水性组合物,并且其中所述基本上不溶于水的药物活性剂是所述肠胃外药物制剂的api(活性药物成分)。在一些实施方案中,第一液体组合物包含基本上不溶于水的药物活性剂或其药学上可接受的盐,以及有机溶剂(例如,醇或任何其他合适的溶剂,例如dmso)。在一些实施方案中,第一液体组合物包含基本上不溶于水的药物活性剂或其药学上可接受的盐,以及醇。在一些实施方案中,第一液体组合物包含基本上不溶于水的药物活性剂或其药学上可接受的盐,以及乙醇。在一些实施方案中,第一液体组合物和第二水性组合物的混合在输液袋或输液瓶中进行。在一些实施方案中,第二水性组合物包含在输液袋或输液瓶中。在一些实施方案中,将第一液体组合物注射到含有第二水性组合物的输液袋或输液瓶中。在一些实施方案中,第一液体组合物和第二水性组合物的混合在输注或施用至患者之前在医院或诊所中进行。
[0121]
如本文所使用的,术语“不溶于水”是指药物活性剂或其药学上可接受的盐在水溶液(例如水、生理盐水、可注射的葡萄糖溶液等)中的溶解度有限。美国药典/国家处方集(united states pharmacoepia/national formulary)(usp/nf)通常以特定温度下溶解1
克药物活性剂所需的溶剂的体积来表示溶解度(例如,25℃时,1克阿司匹林溶于300ml水或5ml乙醇)。其他参考文献可能使用更主观的术语来描述溶解度,例如下表1给出的来自remington's pharmaceutical sciences,mack publishing co.,easton,pa.,by joseph remington and alfonso gennaro:mack publishing,1995中的那些术语:
[0122]
表1
[0123][0124][0125]
如本文所使用的,术语“基本上不溶于水的药物活性剂”是指根据上表1中提供的溶解度定义,难溶、微溶或极微溶,或几乎不溶或不溶的那些试剂,或在水中的溶解度小于1mg/ml的那些试剂。例如,基本上不溶于水的药物活性剂可以是多西他赛或紫杉醇,或它们药学上可接受的盐。
[0126]
在一些实施方案中,基本上不溶于水的药物活性剂或其药学上可接受的盐的溶解度小于大约1mg/ml、大约0.9mg/ml、大约0.8mg/ml、大约0.7mg/ml、大约0.6mg/ml、大约0.5mg/ml、大约0.4mg/ml、大约0.3mg/ml、大约0.2mg/ml、大约0.1mg/ml、大约0.09mg/ml、大约0.08mg/ml、大约0.07mg/ml、大约0.06mg/ml、大约0.05mg/ml、大约0.04mg/ml、大约0.03mg/ml、大约0.02mg/ml,或小于大约0.01mg/ml。
[0127]
在一些实施方案中,所述药物制剂不包含脂质(例如大豆油)。在一些实施方案中,第一液体组合物不包含脂质(例如大豆油)。在一些实施方案中,脂质是大豆油。
[0128]
在一些实施方案中,所述药物制剂不包含表面活性剂。在一些实施方案中,第一液体组合物不包含表面活性剂。在一些实施方案中,第二水性组合物不包含表面活性剂。
[0129]
实施例
[0130]
实施例1:
[0131]
将300.8mg多西他赛和60.9mg柠檬酸溶解在15ml无水乙醇中,得到多西他赛api溶液。将25ml 20%输注用人血清白蛋白溶液加入到含有150ml生理盐水(0.5%nacl溶液)的250ml输液瓶中。白蛋白溶液与生理盐水充分混合后,将输液瓶在水平位置保持静止,将2.5ml多西他赛api溶液快速注射到输液瓶中。然后将溶液充分混合,得到澄明无沉淀的溶液。所得澄明溶液的ph值是6.78。还测定了该澄明溶液的颗粒物。1ml澄明溶液含有大约44个尺寸大于10μm的颗粒和大约3个尺寸大于25μm的颗粒。然后将溶液分成两部分。将一部分澄明溶液保持在20℃至25℃,其在3小时内保持呈澄明无沉淀的溶液。将另一部分澄明溶液在2℃至8℃保持2小时,其保持呈澄明无沉淀的溶液。2小时后,将该溶液保持在20℃至25
℃,其在额外的2小时内保持呈澄明无沉淀的溶液。
[0132]
将30ml 20%输注用人血清白蛋白溶液加入到含有180ml生理盐水(0.5%nacl溶液)的250ml输液瓶中。白蛋白溶液与生理盐水充分混合后,将输液瓶在水平位置保持静止,将3ml多西他赛api溶液快速注射到输液瓶中。然后将溶液充分混合,得到澄明无沉淀的溶液。所得澄明溶液的ph值是6.77。还测定了1ml澄明溶液的颗粒物。该澄明溶液含有大约86个尺寸大于10μm的颗粒和大约5个尺寸大于25μm的颗粒。然后将溶液分成两部分。将一部分澄明溶液保持在20℃至25℃,其在3小时内保持呈澄明无沉淀的溶液。将另一部分澄明溶液在2℃至8℃保持2小时,其保持呈澄明无沉淀的溶液。2小时后,将该溶液保持在20℃至25℃,其在额外的2小时内保持呈澄明无沉淀的溶液。
[0133]
实施例2:
[0134]
将300.8mg多西他赛和59.6mg柠檬酸溶解在15ml无水乙醇中,得到多西他赛api溶液。将20ml 20%输注用人血清白蛋白溶液加入到含有120ml生理盐水(0.5%nacl溶液)的250ml输液瓶中。白蛋白溶液与生理盐水充分混合后,将输液瓶在水平位置保持静止,将2ml多西他赛api溶液快速注射到输液瓶中。然后将溶液充分混合,得到澄明无沉淀的溶液。还测定了该澄明溶液的颗粒物。1ml澄明溶液含有大约96个尺寸大于10μm的颗粒和大约6个尺寸大于25μm的颗粒。然后将溶液分成两部分。将一部分澄明溶液保持在20℃至25℃,其在2小时内保持呈澄明无沉淀的溶液。将另一部分澄明溶液在2℃至8℃保持4小时,其保持呈澄明无沉淀的溶液。4小时后,将该溶液保持在20℃至25℃,其在额外的2小时内保持呈澄明无沉淀的溶液。
[0135]
将15ml 20%输注用人血清白蛋白溶液加入到含有90ml生理盐水(0.5%nacl溶液)的250ml输液瓶中。白蛋白溶液与生理盐水充分混合后,将输液瓶在水平位置保持静止,将1.5ml多西他赛api溶液快速注射到输液瓶中。然后将溶液充分混合,得到澄明无沉淀的溶液。测定了1ml澄明溶液的颗粒物。该澄明溶液含有大约49个尺寸大于10μm的颗粒和大约2个尺寸大于25μm的颗粒。然后将溶液分成两部分。将一部分澄明溶液保持在20℃至25℃,其在4小时内保持呈澄明无沉淀的溶液。将另一部分澄明溶液在2℃至8℃保持2小时,其保持呈澄明无沉淀的溶液。2小时后,将该溶液保持在20℃至25℃,其在额外的1小时内保持呈澄明无沉淀的溶液。
[0136]
实施例3:
[0137]
将1.0005g多西他赛和199.8mg柠檬酸溶解在50ml无水乙醇中,得到多西他赛api溶液。将50ml 20%输注用人血清白蛋白溶液加入到含有300ml生理盐水(0.5%nacl溶液)的500ml输液瓶中。白蛋白溶液与生理盐水充分混合后,将输液瓶在水平位置保持静止,将5ml多西他赛api溶液快速注射到输液瓶中。然后将溶液充分混合,得到澄明无沉淀的溶液。测定了该澄明溶液的颗粒物。1ml澄明溶液含有大约39个尺寸大于10μm的颗粒和大约2个尺寸大于25μm的颗粒。然后将溶液分成三部分。将一部分澄明溶液保持在20℃至25℃,其在4小时内保持呈澄明无沉淀的溶液。将第二部分澄明溶液在2℃至8℃保持7小时,其保持呈澄明无沉淀的溶液。将第三部分澄明溶液在2℃至8℃保持4小时,其保持呈澄明无沉淀的溶液。4小时后,将该溶液保持在20℃至25℃,其在额外的2.5小时内保持呈澄明无沉淀的溶液。
[0138]
实施例4:
[0139]
将300mg多西他赛和59.5mg柠檬酸溶解在15ml无水乙醇中,得到多西他赛api溶液。将65ml 20%输注用人血清白蛋白溶液加入到含有390ml生理盐水(0.5%nacl溶液)的500ml输液瓶中。白蛋白溶液与生理盐水充分混合后,将输液瓶在水平位置保持静止,将6.5ml多西他赛api溶液快速注射到输液瓶中。然后将溶液充分混合,得到澄明无沉淀的溶液。所得澄明溶液的ph值是6.78。还测定了该澄明溶液的颗粒物。1ml澄明溶液含有大约53个尺寸大于10μm的颗粒和大约5个尺寸大于25μm的颗粒。然后将溶液分成三部分。将一部分澄明溶液保持在20℃至25℃,其在2小时内保持呈澄明无沉淀的溶液。将第二部分澄明溶液在2℃至8℃保持3小时,其保持呈澄明无沉淀的溶液。3小时后,将该澄明溶液保持在20℃至25℃,其在额外的1.5小时内保持呈澄明无沉淀的溶液。将第三部分澄明溶液在2℃至8℃保持4小时,其保持呈澄明无沉淀的溶液。4小时后,将该溶液保持在20℃至25℃,其在额外的2小时内保持呈澄明无沉淀的溶液。
[0140]
实施例5:
[0141]
将300.2mg多西他赛和30.1mg柠檬酸溶解在15ml无水乙醇中,得到多西他赛api溶液。将19ml 20%输注用人血清白蛋白溶液加入到含有120ml生理盐水(0.5%nacl溶液)的250ml输液瓶中。白蛋白溶液与生理盐水充分混合后,将输液瓶在水平位置保持静止,将2ml多西他赛api溶液快速注射到输液瓶中。然后将溶液充分混合,得到澄明无沉淀的溶液。测定了该澄明溶液的颗粒物。1ml澄明溶液含有大约64个尺寸大于10μm的颗粒和大约2个尺寸大于25μm的颗粒。然后将溶液分成两部分。将一部分澄明溶液保持在20℃至25℃,其在3.5小时内保持呈澄明无沉淀的溶液。将另一部分澄明溶液在2℃至8℃保持4小时,其保持呈澄明无沉淀的溶液。4小时后,将该溶液保持在20℃至25℃,其在额外的1.5小时内保持呈澄明无沉淀的溶液。
[0142]
将18ml 20%输注用人血清白蛋白溶液加入到含有120ml生理盐水(0.5%nacl溶液)的250ml输液瓶中。白蛋白溶液与生理盐水充分混合后,将输液瓶在水平位置保持静止,将2ml多西他赛api溶液快速注射到输液瓶中。然后将溶液充分混合,得到澄明无沉淀的溶液。测定了1ml澄明溶液的颗粒物。该澄明溶液含有大约102个尺寸大于10μm的颗粒和大约2个尺寸大于25μm的颗粒。然后将溶液分成两部分。将一部分澄明溶液保持在20℃至25℃,其在1.5小时内保持呈澄明无沉淀的溶液。将另一部分澄明溶液在2℃至8℃保持4小时,其保持呈澄明无沉淀的溶液。4小时后,将该溶液保持在20℃至25℃,其在额外的2小时内保持呈澄明无沉淀的溶液。
[0143]
将65ml 20%输注用人血清白蛋白溶液加入到含有390ml生理盐水(0.5%nacl溶液)的500ml输液瓶中。白蛋白溶液与生理盐水充分混合后,将输液瓶在水平位置保持静止,将6.5ml多西他赛api溶液快速注射到输液瓶中。然后将溶液充分混合,得到澄明无沉淀的溶液。测定了该澄明溶液的颗粒物。1ml澄明溶液含有大约51个尺寸大于10μm的颗粒和大约2个尺寸大于25μm的颗粒。然后将溶液分成三部分。将一部分澄明溶液保持在20℃至25℃,其在3小时内保持呈澄明无沉淀的溶液。将第二部分澄明溶液在2℃至8℃保持4小时,其保持呈澄明无沉淀的溶液。4小时后,将该澄明溶液保持在20℃至25℃,其在额外的3小时内保持呈澄明无沉淀的溶液。将第三部分澄明溶液在2℃至8℃保持6小时,其保持呈澄明无沉淀的溶液。6小时后,将该溶液保持在20℃至25℃,其在额外的2小时内保持呈澄明无沉淀的溶液。
[0144]
实施例6:
[0145]
将100.3mg多西他赛和5.1mg柠檬酸溶解在5ml无水乙醇中,得到多西他赛api溶液。将20ml 20%输注用人血清白蛋白溶液加入到含有120ml生理盐水(0.5%nacl溶液)的250ml输液瓶中。白蛋白溶液与生理盐水充分混合后,将输液瓶在水平位置保持静止,将2ml多西他赛api溶液快速注射到输液瓶中。然后将溶液充分混合,得到澄明无沉淀的溶液。测定了该澄明溶液的颗粒物。1ml澄明溶液含有大约63个尺寸大于10μm的颗粒和大约1个尺寸大于25μm的颗粒。然后将溶液分成两部分。将一部分澄明溶液保持在20℃至25℃,其在4.5小时内保持呈澄明无沉淀的溶液。将另一部分澄明溶液在2℃至8℃保持6小时,其保持呈澄明无沉淀的溶液。6小时后,将该溶液保持在20℃至25℃,其在额外的1.5小时内保持澄明呈无沉淀的溶液。
[0146]
实施例7:
[0147]
将20mg柠檬酸溶解在20ml无水乙醇中,得到柠檬酸溶液(1mg/ml)。将100.4mg多西他赛溶解在3ml无水乙醇中,然后加入2ml柠檬酸溶液(1mg/ml),得到多西他赛api溶液。将19ml 20%输注用人血清白蛋白溶液加入到含有120ml生理盐水(0.5%nacl溶液)的250ml输液袋中。白蛋白溶液与生理盐水充分混合后,将输液袋在水平位置保持静止,将2ml多西他赛api溶液快速注射到输液袋中。然后将溶液充分混合,得到澄明无沉淀的溶液。所得澄明溶液的ph值是7.05。还测定了该澄明溶液的颗粒物。1ml澄明溶液含有大约66个尺寸大于10μm的颗粒和大约1个尺寸大于25μm的颗粒。然后将溶液分成两部分。将一部分澄明溶液保持在20℃至25℃,其在3小时内保持呈澄明无沉淀的溶液。将另一部分澄明溶液在2℃至8℃保持4小时,其保持呈澄明无沉淀的溶液。4小时后,将该溶液保持在20℃至25℃,其最初保持呈澄明溶液,并在大约1小时后变混浊并出现沉淀。
[0148]
实施例8:
[0149]
将19.8mg柠檬酸溶解在20ml无水乙醇中,得到柠檬酸溶液。将200mg多西他赛溶解在9ml无水乙醇中,然后加入1ml配制的柠檬酸溶液,得到多西他赛api溶液。将65ml 20%输注用人血清白蛋白溶液加入到含有390ml生理盐水(0.5%nacl溶液)的500ml输液袋中。白蛋白溶液与生理盐水充分混合后,将输液袋在水平位置保持静止,将6.5ml多西他赛api溶液快速注射到输液袋中。然后将溶液充分混合,得到澄明无沉淀的溶液。所得澄明溶液的ph值是6.95。还测定了该澄明溶液的颗粒物。1ml澄明溶液含有大约29个尺寸大于10μm的颗粒和大约2个尺寸大于25μm的颗粒。然后将溶液分成三部分。将一部分澄明溶液保持在20℃至25℃,其在3小时内保持呈澄明无沉淀的溶液。将第二部分澄明溶液在2℃至8℃保持4小时,其保持呈澄明无沉淀的溶液。4小时后,将该澄明溶液保持在20℃至25℃,其在额外的0.5小时内保持呈澄明无沉淀的溶液。将第三部分澄明溶液在2℃至8℃保持6小时,其保持澄明呈无沉淀的溶液。6小时后,将该溶液保持在20℃至25℃,其在额外的1.5小时内保持呈澄明无沉淀的溶液。
[0150]
将100.1mg多西他赛溶解在2.5ml无水乙醇中,然后加入0.5ml配制的柠檬酸溶液,得到多西他赛api溶液。将20ml 20%输注用人血清白蛋白溶液加入到含有120ml生理盐水(0.5%nacl溶液)的250ml输液袋中。白蛋白溶液与生理盐水充分混合后,将输液袋在水平位置保持静止,将1.2ml多西他赛api溶液快速注射到输液袋中。然后将溶液充分混合,得到澄明无沉淀的溶液。所得澄明溶液的ph值是6.99。还测定了该澄明溶液的颗粒物。1ml澄明
溶液含有大约64个尺寸大于10μm的颗粒和大约1个尺寸大于25μm的颗粒。然后将溶液分成两部分。将一部分澄明溶液保持在20℃至25℃,其在4小时内保持呈澄明无沉淀的溶液。将另一部分澄明溶液在2℃至8℃保持6小时,其保持呈澄明无沉淀的溶液。6小时后,将该溶液保持在20℃至25℃,其最初保持呈澄明溶液,并在大约0.5小时后变混浊并出现沉淀。
[0151]
将100.4mg多西他赛溶解在3.5ml无水乙醇中,然后加入0.5ml配制的柠檬酸溶液和1ml丙二醇,得到多西他赛api溶液。将20ml 20%输注用人血清白蛋白溶液加入到含有120ml生理盐水(0.5%nacl溶液)的250ml输液袋中。白蛋白溶液与生理盐水充分混合后,将输液袋在水平位置保持静止,将2ml多西他赛api溶液快速注射到输液袋中。然后将溶液充分混合,得到澄明无沉淀的溶液。测定了该澄明溶液的颗粒物。1ml澄明溶液含有大约32个尺寸大于10μm的颗粒和大约1个尺寸大于25μm的颗粒。然后将溶液分成两部分。将一部分澄明溶液保持在20℃至25℃,其在5小时内保持呈澄明无沉淀的溶液。将另一部分澄明溶液在2℃至8℃保持6小时,其保持呈澄明无沉淀的溶液。6小时后,将该溶液保持在20℃至25℃,其在额外的2小时内保持呈澄明无沉淀的溶液。
[0152]
实施例9:
[0153]
将20mg柠檬酸溶解在20ml无水乙醇中,得到柠檬酸溶液。将300.9mg多西他赛溶解在14.4ml无水乙醇中,然后加入0.6ml配制的柠檬酸溶液,得到多西他赛api溶液。将18ml20%输注用人血清白蛋白溶液加入到含有120ml生理盐水(0.5%nacl溶液)的250ml输液袋中。白蛋白溶液与生理盐水充分混合后,将输液袋在水平位置保持静止,将2ml多西他赛api溶液快速注射到输液袋中。然后将溶液充分混合,得到澄明无沉淀的溶液。所得澄明溶液的ph值是6.96。还测定了该澄明溶液的颗粒物。1ml澄明溶液含有大约49个尺寸大于10μm的颗粒和大约6个尺寸大于25μm的颗粒。然后将溶液分成两部分。将一部分澄明溶液保持在20℃至25℃,其在4.5小时内保持呈澄明无沉淀的溶液。将另一部分澄明溶液在2℃至8℃保持6小时,其保持呈澄明无沉淀的溶液。6小时后,将该溶液保持在20℃至25℃,其在额外的1小时内保持呈澄明无沉淀的溶液。
[0154]
将20ml 20%输注用人血清白蛋白溶液加入到含有120ml生理盐水(0.5%nacl溶液)的250ml输液袋中。白蛋白溶液与生理盐水充分混合后,将输液袋在水平位置保持静止,将2ml多西他赛api溶液快速注射到输液袋中。然后将溶液充分混合,得到澄明无沉淀的溶液。所得澄明溶液的ph值是6.96。还测定了该澄明溶液的颗粒物。1ml澄明溶液含有大约55个尺寸大于10μm的颗粒和大约3个尺寸大于25μm的颗粒。然后将溶液分成两部分。将一部分澄明溶液保持在20℃至25℃,其在4小时内保持澄明呈无沉淀的溶液。将另一部分澄明溶液在2℃至8℃保持6小时,其保持呈澄明无沉淀的溶液。6小时后,将该溶液保持在20℃至25℃,其最初保持呈澄明溶液,并在大约0.5小时后变混浊并出现沉淀。
[0155]
将35ml 20%输注用人血清白蛋白溶液加入到含有210ml生理盐水(0.5%nacl溶液)的500ml输液袋中。白蛋白溶液与生理盐水充分混合后,将输液袋在水平位置保持静止,将3.5ml多西他赛api溶液快速注射到输液袋中。然后将溶液充分混合,得到澄明无沉淀的溶液。所得澄明溶液的ph值是6.96。还测定了该澄明溶液的颗粒物。1ml澄明溶液含有大约83个尺寸大于10μm的颗粒和大约7个尺寸大于25μm的颗粒。然后将溶液分成三部分。将一部分澄明溶液保持在20℃至25℃,其在3.5小时内保持呈澄明无沉淀的溶液。将第二部分澄明溶液在2℃至8℃保持4小时,其保持呈澄明无沉淀的溶液。4小时后,将该澄明溶液保持在20
℃至25℃,其在额外的1小时内保持呈澄明无沉淀的溶液。将第三部分澄明溶液在2℃至8℃保持6小时,其保持呈澄明无沉淀的溶液。6小时后,将该溶液保持在20℃至25℃,其在额外的1小时内保持呈澄明无沉淀的溶液。
[0156]
将50ml 20%输注用人血清白蛋白溶液加入到含有300ml生理盐水(0.5%nacl溶液)的500ml输液袋中。白蛋白溶液与生理盐水充分混合后,将输液袋在水平位置保持静止,将5ml多西他赛api溶液快速注射到输液袋中。然后将溶液充分混合,得到澄明无沉淀的溶液。所得澄明溶液的ph值是6.96。还测定了该澄明溶液的颗粒物。1ml澄明溶液含有大约95个尺寸大于10μm的颗粒和大约3个尺寸大于25μm的颗粒。然后将溶液分成三部分。将一部分澄明溶液保持在20℃至25℃,其在4小时内保持呈澄明无沉淀的溶液。将第二部分澄明溶液在2℃至8℃保持4小时,其保持呈澄明无沉淀的溶液。4小时后,将该澄明溶液保持在20℃至25℃,其在额外的1小时内保持呈澄明无沉淀的溶液。将第三部分澄明溶液在2℃至8℃保持6小时,其保持呈澄明无沉淀的溶液。6小时后,将该溶液保持在20℃至25℃,其在额外的1.5小时内保持呈澄明无沉淀的溶液。
[0157]
实施例10:
[0158]
将19.8mg柠檬酸溶解在20ml无水乙醇中,得到柠檬酸溶液。将299.5mg多西他赛溶解在14.4ml无水乙醇中,然后加入0.6ml配制的柠檬酸溶液,得到多西他赛api溶液。将17.5ml 20%输注用人血清白蛋白溶液加入到含有105ml生理盐水(0.5%nacl溶液)的250ml输液袋中。白蛋白溶液与生理盐水充分混合后,将输液袋在水平位置保持静止,将1.75ml多西他赛api溶液快速注射到输液袋中。然后将溶液充分混合,得到澄明无沉淀的溶液。所得澄明溶液的ph值是6.96。还测定了该澄明溶液的颗粒物。1ml澄明溶液含有大约57个尺寸大于10μm的颗粒和大约1个尺寸大于25μm的颗粒。将该澄明溶液保持在20℃至25℃,其在4.5小时内保持呈澄明无沉淀的溶液。
[0159]
将30ml 20%输注用人血清白蛋白溶液加入到含有180ml生理盐水(0.5%nacl溶液)的250ml输液袋中。白蛋白溶液与生理盐水充分混合后,将输液袋在水平位置保持静止,将3ml多西他赛api溶液快速注射到输液袋中。然后将溶液充分混合,得到澄明无沉淀的溶液。所得澄明溶液的ph值是6.97。还测定了该澄明溶液的颗粒物。1ml澄明溶液含有大约29个尺寸大于10μm的颗粒和大约0个尺寸大于25μm的颗粒。将该澄明溶液保持在20℃至25℃,其在3.5小时内保持呈澄明无沉淀的溶液。
[0160]
实施例11:
[0161]
将20.9mg柠檬酸溶解在20ml无水乙醇中,得到柠檬酸溶液。将100.3mg多西他赛溶解在4.5ml无水乙醇中,然后加入0.5ml配制的柠檬酸溶液,得到多西他赛api溶液。将9.5ml20%输注用人血清白蛋白溶液加入到含有60ml生理盐水(0.5%nacl溶液)的100ml小瓶中。白蛋白溶液与生理盐水充分混合后,将小瓶在水平位置保持静止,将1ml多西他赛api溶液快速注射到小瓶中。然后将溶液充分混合,得到澄明无沉淀的溶液。所得澄明溶液的ph值是6.96。还测定了该澄明溶液的颗粒物。1ml澄明溶液含有大约42个尺寸大于10μm的颗粒和大约1个尺寸大于25μm的颗粒。将该澄明溶液保持在20℃至25℃,其在4小时内保持呈澄明无沉淀的溶液。
[0162]
将9ml 20%输注用人血清白蛋白溶液加入到含有60ml生理盐水(0.5%nacl溶液)的100ml小瓶中。白蛋白溶液与生理盐水充分混合后,将小瓶在水平位置保持静止,将1ml多
西他赛api溶液快速注射到小瓶中。然后将溶液充分混合,得到澄明无沉淀的溶液。所得澄明溶液的ph值是6.96。还测定了该澄明溶液的颗粒物。1ml澄明溶液含有大约101个尺寸大于10μm的颗粒和大约3个尺寸大于25μm的颗粒。将该澄明溶液保持在20℃至25℃,其在2.5小时内保持呈澄明无沉淀的溶液。
[0163]
将8.5ml 20%输注用人血清白蛋白溶液加入到含有60ml生理盐水(0.5%nacl溶液)的100ml小瓶中。白蛋白溶液与生理盐水充分混合后,将小瓶在水平位置保持静止,将1ml多西他赛api溶液快速注射到小瓶中。然后将溶液充分混合,得到澄明无沉淀的溶液。所得澄明溶液的ph值是6.95。还测定了该澄明溶液的颗粒物。1ml澄明溶液含有大约17个尺寸大于10μm的颗粒和大约1个尺寸大于25μm的颗粒。将该澄明溶液保持在20℃至25℃,其在2小时内保持呈澄明无沉淀的溶液。
[0164]
实施例12:
[0165]
将19.4mg柠檬酸溶解在20ml无水乙醇中,得到柠檬酸溶液。将200.5mg多西他赛溶解在9.6ml无水乙醇中,然后加入0.4ml配制的柠檬酸溶液,得到多西他赛api溶液。将25ml20%输注用人血清白蛋白溶液加入到含有150ml生理盐水(0.5%nacl溶液)的250ml输液袋中。白蛋白溶液与生理盐水充分混合后,将输液袋在水平位置保持静止,通过注射到白蛋白溶液的液面下方,将2.5ml多西他赛api溶液快速注射到输液袋中(注射过程大约需要1-2秒)。然后立即将输液袋轻轻正反倒转20-30次左右,充分混合溶液,得到澄明无沉淀的溶液。所得澄明溶液的ph值是6.98。还测定了该澄明溶液的颗粒物。1ml澄明溶液含有大约161个尺寸大于10μm的颗粒和大约13个尺寸大于25μm的颗粒。然后将溶液分成两部分。将一部分澄明溶液保持在20℃至25℃,其在2小时内保持呈澄明无沉淀的溶液。将另一部分澄明溶液在2℃至8℃保持4小时,其保持呈澄明无沉淀的溶液。4小时后,将该溶液保持在20℃至25℃,其在额外的1.5小时内保持呈澄明无沉淀的溶液。
[0166]
将17.5ml 20%输注用人血清白蛋白溶液加入到含有105ml生理盐水(0.5%nacl溶液)的250ml输液袋中。白蛋白溶液与生理盐水充分混合后,将输液袋在水平位置保持静止,通过注射到白蛋白溶液的液面下方,将1.75ml多西他赛api溶液快速注射到输液袋中(注射过程大约需要2秒)。然后立即将输液袋轻轻正反倒转20-30次左右,充分混合溶液,得到澄明无沉淀的溶液。测定了该澄明溶液的颗粒物。1ml澄明溶液含有大约81个尺寸大于10μm的颗粒和大约1个尺寸大于25μm的颗粒。然后将溶液分成两部分。将一部分澄明溶液保持在20℃至25℃,其在5小时内保持呈澄明无沉淀的溶液。将另一部分澄明溶液在2℃至8℃保持4小时,其保持呈澄明无沉淀的溶液。4小时后,将该溶液保持在20℃至25℃,其最初保持呈澄明溶液,并在大约0.5小时后变混浊。
[0167]
实施例13:
[0168]
将100.3mg多西他赛溶解在5ml无水乙醇中,得到多西他赛api溶液。将35ml生理盐水(0.5%nacl溶液)加入到50ml小瓶中后,将小瓶在水平位置保持静止,通过注射到生理盐水的液面下方,将0.5ml多西他赛api溶液快速注射到小瓶中(注射过程大约需要2秒)。然后立即将小瓶轻轻正反倒转大约10次,最初得到澄明溶液。大约10分钟后,溶液中出现沉淀。
[0169]
将5ml 20%输注用人血清白蛋白溶液加入到含有30ml生理盐水(0.5%nacl溶液)的50ml小瓶中。白蛋白溶液与生理盐水充分混合后,将小瓶在水平位置保持静止,通过注射到白蛋白溶液的液面下方,将0.5ml多西他赛api溶液快速注射到小瓶中(注射过程大约需
要2秒)。然后立即将小瓶轻轻正反倒转10次左右,充分混合溶液,得到澄明无沉淀的溶液。该溶液在4.5小时内保持呈澄明无沉淀的溶液。
[0170]
将4ml 20%输注用人血清白蛋白溶液加入到含有31ml生理盐水(0.5%nacl溶液)的50ml小瓶中。白蛋白溶液与生理盐水充分混合后,将小瓶在水平位置保持静止,通过注射到白蛋白溶液的液面下方,将0.5ml多西他赛api溶液快速注射到小瓶中(注射过程大约需要2秒)。然后立即将小瓶轻轻正反倒转10次左右,充分混合溶液,得到澄明无沉淀的溶液。该溶液在4.5小时内保持呈澄明无沉淀的溶液。
[0171]
将2.5ml 20%输注用人血清白蛋白溶液加入到含有32.5ml生理盐水(0.5%nacl溶液)的50ml小瓶中。白蛋白溶液与生理盐水充分混合后,将小瓶在水平位置保持静止,通过注射到白蛋白溶液的液面下方,将0.5ml多西他赛api溶液快速注射到小瓶中(注射过程大约需要2秒)。然后立即将小瓶轻轻正反倒转10次左右,充分混合溶液,得到澄明无沉淀的溶液。该溶液在3.5小时内保持呈澄明无沉淀的溶液。
[0172]
实施例14:
[0173]
将100.3mg多西他赛溶解在5ml无水乙醇中,得到多西他赛api溶液。将15ml 20%输注用人血清白蛋白溶液加入到含有90ml生理盐水(0.5%nacl溶液)的250ml输液袋中。白蛋白溶液与生理盐水充分混合后,将输液袋在水平位置保持静止,通过注射到白蛋白溶液的液面下方,将1.5ml多西他赛api溶液快速注射到输液袋中(注射过程大约需要3秒)。然后立即将输液袋轻轻正反倒转20次左右,充分混合溶液,得到澄明无沉淀的溶液。测定了该澄明溶液的颗粒物。1ml澄明溶液含有大约78个尺寸大于10μm的颗粒和大约3个尺寸大于25μm的颗粒。该溶液在3小时内保持呈澄明无沉淀的溶液。
[0174]
将12ml 20%输注用人血清白蛋白溶液加入到含有93ml生理盐水(0.5%nacl溶液)的250ml输液袋中。白蛋白溶液与生理盐水充分混合后,将输液袋在水平位置保持静止,通过注射到白蛋白溶液的液面下方,将1.5ml多西他赛api溶液快速注射到输液袋中(注射过程大约需要3秒)。然后立即将输液袋轻轻正反倒转20次左右,充分混合溶液,得到澄明无沉淀的溶液。测定了该澄明溶液的颗粒物。1ml澄明溶液含有大约90个尺寸大于10μm的颗粒和大约4个尺寸大于25μm的颗粒。该溶液在3.5小时内保持呈澄明无沉淀的溶液。
[0175]
将7.5ml 20%输注用人血清白蛋白溶液加入到含有97.5ml生理盐水(0.5%nacl溶液)的250ml输液袋中。白蛋白溶液与生理盐水充分混合后,将输液袋在水平位置保持静止,通过注射到白蛋白溶液的液面下方,将1.5ml多西他赛api溶液快速注射到输液袋中(注射过程大约需要3秒)。然后立即将输液袋轻轻正反倒转20次左右,充分混合溶液,得到澄明无沉淀的溶液。测定了该澄明溶液的颗粒物。1ml澄明溶液含有大约63个尺寸大于10μm的颗粒和大约2个尺寸大于25μm的颗粒。该溶液在3小时内保持呈澄明无沉淀的溶液。
[0176]
实施例15:
[0177]
将20.1mg柠檬酸溶解在20ml无水乙醇中,得到柠檬酸溶液。将300.7mg多西他赛溶解在14.4ml无水乙醇中,然后加入0.6ml配制的柠檬酸溶液,得到多西他赛api溶液。将7.5ml 20%输注用人血清白蛋白溶液加入到含有97.5ml生理盐水(0.5%nacl溶液)的250ml输液瓶中。白蛋白溶液与生理盐水充分混合后,将输液瓶在水平位置保持静止,通过注射到白蛋白溶液的液面下方,将1.5ml多西他赛api溶液快速注射到输液瓶中(注射过程大约需要2秒)。然后立即将输液瓶轻轻正反倒转20次左右,充分混合溶液,得到澄明无沉淀
的溶液。测定了该澄明溶液的颗粒物。1ml澄明溶液含有大约88个尺寸大于10μm的颗粒和大约8个尺寸大于25μm的颗粒。该溶液在2.5小时内保持呈澄明无沉淀的溶液。
[0178]
将6ml 20%输注用人血清白蛋白溶液加入到含有99ml生理盐水(0.5%nacl溶液)的250ml输液瓶中。白蛋白溶液与生理盐水充分混合后,将输液瓶在水平位置保持静止,通过注射到白蛋白溶液的液面下方,将1.5ml多西他赛api溶液快速注射到输液瓶中(注射过程大约需要2秒)。然后立即将输液瓶轻轻正反倒转20次左右,充分混合溶液,得到澄明无沉淀的溶液。测定了该澄明溶液的颗粒物。1ml澄明溶液含有大约37个尺寸大于10μm的颗粒和大约0个尺寸大于25μm的颗粒。该溶液在3小时内保持呈澄明无沉淀的溶液。
[0179]
将4.5ml 20%输注用人血清白蛋白溶液加入到含有100.5ml生理盐水(0.5%nacl溶液)的250ml输液瓶中。白蛋白溶液与生理盐水充分混合后,将输液瓶在水平位置保持静止,通过注射到白蛋白溶液的液面下方,将1.5ml多西他赛api溶液快速注射到输液瓶中(注射过程大约需要2秒)。然后立即将输液瓶轻轻正反倒转20次左右,充分混合溶液,得到澄明无沉淀的溶液。测定了该澄明溶液的颗粒物。1ml澄明溶液含有大约65个尺寸大于10μm的颗粒和大约2个尺寸大于25μm的颗粒。该溶液在3小时内保持呈澄明无沉淀的溶液。
[0180]
将30ml 20%输注用人血清白蛋白溶液加入到含有390ml生理盐水(0.5%nacl溶液)的500ml输液瓶中。白蛋白溶液与生理盐水充分混合后,将输液瓶在水平位置保持静止,通过注射到白蛋白溶液的液面下方,将6ml多西他赛api溶液快速注射到输液瓶中(注射过程大约需要2秒)。然后立即将输液瓶轻轻正反倒转20-30次左右,充分混合溶液,得到澄明无沉淀的溶液。测定了该澄明溶液的颗粒物。1ml澄明溶液含有大约60个尺寸大于10μm的颗粒和大约4个尺寸大于25μm的颗粒。然后将溶液分成三部分。将一部分澄明溶液保持在20℃至25℃,其在5.5小时内保持呈澄明无沉淀的溶液。将第二部分澄明溶液保持在2℃至8℃,其在7小时内保持呈澄明无沉淀的溶液。将第三部分澄明溶液在2℃至8℃保持5小时,其保持呈澄明无沉淀的溶液。5小时后,将该溶液保持在20℃至25℃,其在额外的1.5小时内保持呈澄明无沉淀的溶液。
[0181]
实施例16:
[0182]
称取44.84g多西他赛并溶解在2升烧杯中的671.98g无水乙醇中,然后将多西他赛溶液转移到5升烧杯中。将822.63g无水乙醇分成3份用于冲洗该2升烧杯,将冲洗后的乙醇也转移到5升烧杯中。在100ml烧杯中,将87.7mg柠檬酸溶解在42.05g无水乙醇中。然后,在搅拌5升烧杯中的多西他赛溶液时,将柠檬酸溶液转移到5升烧杯中。将92.56g g无水乙醇分成3份用于冲洗该100ml烧杯,将冲洗后的乙醇也转移到5升烧杯中。将得到的5升烧杯中的多西他赛溶液再搅拌大约1分钟,然后通过0.22μm过滤器过滤。使用自动灌装机将过滤的多西他赛溶液灌装到10ml玻璃小瓶中。共装470个小瓶,其中每个10ml小瓶中含有4.4ml多西他赛溶液(10%过量灌装)。所得多西他赛溶液(多西他赛产品)的稳定性测试分别在长期条件(2~8℃)和加速条件(25
±
2℃/60%
±
5%rh)下进行。稳定性测试结果在表1和表2中示出。稳定性测试数据表明,得到的多西他赛溶液在长期条件和加速条件下都稳定。
[0183]
表1 2-8℃下的稳定性测试结果
[0184][0185]
表2 25
±
2℃/60%
±
5%rh下的稳定性测试结果
[0186][0187]
实施例17:
[0188]
将多西他赛和柠檬酸溶解在无水乙醇中,配制4种不同的多西他赛溶液制剂。这4种制剂的组成如下:制剂a(20mg/ml多西他赛和0.01mg/ml柠檬酸)、制剂b(20mg/ml多西他赛和0.02mg/ml柠檬酸)、制剂c(20mg/ml多西他赛和0.1mg/ml柠檬酸)和制剂d(20mg/ml多西他赛和0.2mg/ml柠檬酸)。测量4种多西他赛溶液制剂的ph值以及实施例16中获得的多西他赛溶液(制剂e:20mg/ml多西他赛和0.04mg/ml柠檬酸)的ph值。ph值测试结果在表3中示出。
[0189]
表3多西他赛溶液制剂的ph值
[0190][0191]
实施例18:
[0192]
按照实施例16中描述的相同的制造工艺和步骤,得到一批具有在脱水乙醇(4.4ml)中的多西他赛(88mg)和柠檬酸(0.176mg)的多西他赛注射液(88mg/4.4ml)。按照以下步骤制备多西他赛的重构肠胃外输注溶液(160ml)。先将15ml 20%人白蛋白输注溶液与143ml0.9%注射用氯化钠在输液瓶中混合,然后将2ml多西他赛注射液(40mg/多西他赛)快速注射到输液瓶内的白蛋白盐水溶液中,并与白蛋白盐水溶液充分混合,得到呈澄明溶液的多西他赛输注溶液。使用动态光散射(dls)测试所得多西他赛输注溶液的粒度分布。为了比较,还使用dls测试了白蛋白盐水溶液的粒度分布。白蛋白盐水溶液的制备与多西他赛输注溶液的制备步骤相同,只是在制备的最后一步中使用(注射)等量(2ml)无水乙醇代替2ml多西他赛注射液。多西他赛输注溶液和白蛋白盐水溶液的dls测试结果见图1。与白蛋白盐水溶液相比,多西他赛输注溶液具有几乎相同的粒度分布曲线。dls数据表明,多西他赛输注溶液是一种与白蛋白盐水溶液相同的简单溶液。参见图1a和图1b。
[0193]
实施例19:
[0194]
测定了使用实施例16中得到的多西他赛注射液(88mg/4.4ml)制备的重构多西他赛输注溶液中的游离(未结合)的多西他赛的百分含量。使用实施例18中描述的相同步骤制备多西他赛输注溶液。采用30-kda膜,通过超滤测定多西他赛输注溶液中的游离的(未结合的)多西他赛的百分含量。多西他赛输注溶液中的游离的(未结合的)多西他赛的百分含量在62.8%-67%的范围内。重构多西他赛输注溶液中的游离的(未结合的)多西他赛的百分含量结果见表4。
[0195]
表4重构多西他赛输注溶液中的游离的(未结合的)多西他赛和白蛋白结合的多西他赛
[0196][0197][0198]
实施例20:
[0199]
通过改变多西他赛输注溶液中的人血清白蛋白的含量,研究两种重构多西他赛输注溶液中的游离的(未结合的)多西他赛的百分含量。制备与实施例19中的多西他赛输注溶液相比,白蛋白含量更低的多西他赛输注溶液-a和白蛋白含量更高的多西他赛输注溶液-b。
[0200]
多西他赛输注溶液-a的制备:先将5ml 20%人白蛋白输注溶液与74ml 0.9%注射用氯化钠在输液瓶中混合,然后将1ml(20mg)多西他赛注射液(实施例16制备)快速注射到输液瓶内的白蛋白盐水溶液中,并与白蛋白盐水溶液充分混合,得到呈澄明溶液的多西他赛输注溶液-a。
[0201]
多西他赛输注溶液-b的制备:先将10ml 20%人白蛋白输注溶液与69ml 0.9%注射用氯化钠在输液瓶中混合,然后将1ml(20mg)多西他赛注射液(实施例16制备)快速注射到输液瓶内的白蛋白盐水溶液中,并与白蛋白盐水溶液充分混合,得到呈澄明溶液的多西他赛输注溶液-b。
[0202]
采用30-kda膜,通过超滤测定多西他赛输注溶液-a和多西他赛输注溶液-b中的游离的(未结合的)多西他赛的百分含量。重构多西他赛输注溶液中的游离的(未结合的)多西他赛的百分含量结果见表5。
[0203]
表5重构多西他赛输注溶液-a和重构多西他赛输注溶液-b中的游离的(未结合的)多西他赛和白蛋白结合的多西他赛
[0204]
测试溶液游离的多西他赛白蛋白结合的多西他赛多西他赛输注溶液-a66.8%33.2%多西他赛输注溶液-b61.2%38.8%
[0205]
实施例21:
[0206]
先将10ml 20%人白蛋白输注溶液与148ml 0.9%注射用氯化钠在250ml输液瓶中混合,然后将2ml(40mg)多西他赛注射液(实施例16制备)快速注射到输液瓶内的白蛋白盐水溶液中,正反倒转输液瓶,与白蛋白盐水溶液充分混合,得到澄明的输注溶液。输注溶液在6小时内保持澄明无沉淀。
[0207]
实施例22:
[0208]
含有聚山梨醇酯80的多西他赛注射液的制备:将201.5mg多西他赛溶解在5ml无水乙醇中,然后将5ml聚山梨醇酯80加入溶液中,得到呈澄明溶液的聚山梨醇酯80配制的多西他赛注射液。先在500ml输液瓶中配制295.5ml 0.9%注射用氯化钠,然后将聚山梨醇酯80和乙醇(1:1,v/v)(如上配制)配制的4.5ml多西他赛注射液快速注射到输液瓶内的生理盐水中,将输液瓶正反倒转并与生理盐水充分混合,得到澄明的输注溶液。输注溶液在6小时内保持澄明无沉淀。
[0209]
实施例23:
[0210]
按照实施例16中描述的相同的制造工艺和步骤,得到一批具有在脱水乙醇(4.4ml)中的多西他赛(88mg)和柠檬酸(0.176mg)的多西他赛注射液(88mg/4.4ml)。
[0211]
先将37.5ml 20%人白蛋白输注溶液与357.5ml 0.9%注射用氯化钠在500ml输液瓶中混合,然后将5ml多西他赛注射液(如上制备)快速注射到输液瓶内的白蛋白盐水溶液中,同时保持输液瓶静止。将输液瓶正反倒转20次左右,充分混合溶液后,得到澄明输注溶液。输注溶液在7小时内保持澄明无沉淀。
[0212]
先将22.5ml 20%人白蛋白输注溶液与214.5ml 0.9%注射用氯化钠在250ml输液瓶中混合,然后将3ml多西他赛注射液(如上制备)快速注射到输液瓶内的白蛋白盐水溶液中,同时保持输液瓶静止。将输液瓶正反倒转30次左右,充分混合溶液后,得到澄明输注溶液。输注溶液在8小时内保持澄明无沉淀。
[0213]
其它实施方案
[0214]
应当理解的是,虽然已经结合其详细说明描述了本发明,但前面的说明旨在阐明而不是限制本发明的范围,本发明的范围由所附权利要求的范围限定。其他方面、优点和修改都属于以下权利要求的范围。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1