具有减少的杂质的持续释放药物递送系统及相关方法与流程
具有减少的杂质的持续释放药物递送系统及相关方法
1.相关申请的交叉引用
2.本技术要求于2020年1月13日提交的美国临时专利申请第62/960,565序列号的优先权,该申请的公开内容通过引用并入本文。
技术领域
3.本技术一般涉及持续释放药物递送系统。
背景技术:
4.用于药物递送的生物可降解载体是有用的,因为它们避免了移除药物耗尽装置的需要。可生物降解的药物递送系统的实例包括美国专利第8,846,072号和第10,213,510号中公开的用于活性药剂例如局部麻醉剂的控制递送的系统,将其全部内容通过引用并入本文。
5.然而,仍然需要改善的药物递送系统以及施用和储存方法。例如,仍然需要具有改善的储存稳定性和使用安全性的药物递送系统。
技术实现要素:
6.本发明人已经确定,还需要含有少量杂质如2,6-二甲基苯胺、布比卡因n-氧化物、水、过氧化物、乙酸苄酯、异丁酸苄酯和/或少量金属的持续释放递送系统。
7.本技术提供了具有减少的杂质的改善的药物递送系统。本技术提供了具有改善的稳定性和/或安全性的改善的药物递送系统。本发明的其它特征和优点将在随后的发明描述中阐述,并且部分地将从描述中显而易见,或者可以通过本发明的实践而获知。本发明将通过在书面描述及其权利要求中特别指出的组合物和方法来实现和获得。
8.以下编号的方面,尽管是非限制性的,但是为本技术的某些方面的示例:
9.1.一种组合物,其包含:
10.活性药剂;
11.高粘度液体载体材料(hvlcm)和聚原酸酯中的至少一种;
12.有机溶剂;以及
13.2,6-二甲基苯胺,
14.其中2,6-二甲基苯胺以小于500ppm的水平存在于组合物中。
15.2.方面1的组合物,其中2,6-二甲基苯胺以小于300ppm的水平存在于组合物中。
16.3.方面1的组合物,其中2,6-二甲基苯胺以小于200ppm的水平存在于组合物中。
17.4.方面1的组合物,其中2,6-二甲基苯胺以小于100ppm的水平存在于组合物中。
18.5.方面1的组合物,其中2,6-二甲基苯胺以小于15ppm、小于12ppm、小于10ppm或小于5ppm的水平存在于组合物中。
19.6.方面1的组合物,其中2,6-二甲基苯胺以0.2ppm至500ppm的水平存在于组合物中。
20.7.方面1的组合物,其中2,6-二甲基苯胺以0.3ppm至200ppm的水平存在于组合物中。
21.8.方面1的组合物,其中2,6-二甲基苯胺以0.4ppm至100ppm的水平存在于组合物中。
22.9.方面1的组合物,其中2,6-二甲基苯胺以0.5ppm至10ppm或2ppm至8ppm的水平存在于组合物中。
23.10.一种组合物,其包含:
24.活性药剂;
25.高粘度液体载体材料(hvlcm)和聚原酸酯中的至少一种;
26.有机溶剂;以及
27.活性药剂的n-氧化物,
28.其中活性药剂的n-氧化物以基于组合物的重量计小于1重量%的水平存在于组合物中。
29.11.方面10的组合物,其中活性药剂的n-氧化物以基于组合物的重量计小于0.7重量%或小于0.5重量%的水平存在于组合物中。
30.12.方面10的组合物,其中活性药剂的n-氧化物以基于组合物的重量计小于0.4重量%的水平存在于组合物中。
31.13.方面10的组合物,其中活性药剂的n-氧化物以基于组合物的重量计0.01重量%至1重量%的水平存在于组合物中。
32.14.方面10的组合物,其中活性药剂的n-氧化物以基于组合物的重量计0.05重量%至0.4重量%或0.1重量%至0.4重量%的水平存在于组合物中。
33.15.方面10的组合物,其中活性药剂的n-氧化物以基于组合物的重量计0.1重量%至0.2重量%的水平存在于组合物中。
34.16.一种组合物,其包含:
35.活性药剂;
36.高粘度液体载体材料(hvlcm)和聚原酸酯中的至少一种;
37.有机溶剂;以及
38.金属,
39.其中金属以小于5ppm的水平存在于组合物中。
40.17.方面16的组合物,其中金属以小于4ppm的水平存在于组合物中。
41.18.方面16的组合物,其中金属以小于3ppm的水平存在于组合物中。
42.19.方面16的组合物,其中金属以0.01ppm至4ppm的水平存在于组合物中。
43.20.方面16的组合物,其中金属以0.05ppm至3ppm的水平存在于组合物中。
44.21.方面16的组合物,其中金属以0.1ppm至2ppm的水平存在于组合物中。
45.22.一种组合物,其包含:
46.活性药剂;
47.高粘度液体载体材料(hvlcm)和聚原酸酯中的至少一种;
48.有机溶剂;以及
49.水,
50.其中水以基于组合物的重量计小于0.5重量%的水平存在。
51.23.方面22的组合物,其中水以基于组合物的重量计小于0.4重量%的水平存在于组合物中。
52.24.方面22的组合物,其中水以基于组合物的重量计小于0.3重量%的水平存在于组合物中。
53.25.方面22的组合物,其中水以基于组合物的重量计0.03重量%至0.4重量%的水平存在于组合物中。
54.26.方面22的组合物,其中水以基于组合物的重量计0.05重量%至0.35重量%的水平存在于组合物中。
55.27.方面22的组合物,其中水以基于组合物的重量计0.08重量%至0.3重量%的水平存在于组合物中。
56.28.一种组合物,其包含:
57.活性药剂;
58.包含乙酸异丁酸蔗糖酯的高粘度液体载体材料(hvlcm);
59.包含苯甲醇的有机溶剂;以及
60.乙酸苄酯,
61.其中乙酸苄酯以小于100mg/ml的水平存在于组合物中。
62.29.方面28的组合物,其中乙酸苄酯以小于50mg/ml的水平存在于组合物中。
63.30.方面28的组合物,其中乙酸苄酯以小于20mg/ml或小于15mg/ml的水平存在于组合物中。
64.31.方面28的组合物,其中乙酸苄酯以0.1mg/ml至80mg/ml的水平存在于组合物中。
65.32.方面28的组合物,其中乙酸苄酯以0.5mg/ml至40mg/ml的水平存在于组合物中。
66.33.方面28的组合物,其中乙酸苄酯以1mg/ml至20mg/ml或1mg/ml至15mg/ml的水平存在于组合物中。
67.34.一种组合物,其包含:
68.活性药剂;
69.包含乙酸异丁酸蔗糖酯的高粘度液体载体材料(hvlcm);
70.包含苯甲醇的有机溶剂;以及
71.异丁酸苄酯,
72.其中异丁酸苄酯以小于50mg/ml的水平存在于组合物中。
73.35.方面34的组合物,其中异丁酸苄酯以小于30mg/ml的水平存在于组合物中。
74.36.方面34的组合物,其中异丁酸苄酯以小于10mg/ml或小于8mg/ml的水平存在于组合物中。
75.37.方面34的组合物,其中异丁酸苄酯以0.1mg/ml至40mg/ml的水平存在于组合物中。
76.38.方面34的组合物,其中异丁酸苄酯以0.5mg/ml至30mg/ml的水平存在于组合物中。
77.39.方面34的组合物,其中异丁酸苄酯以1mg/ml至10mg/ml或1mg/ml至8mg/ml的水平存在于组合物中。
78.40.一种组合物,其通过组合以下物质制备:
79.活性药剂;
80.高粘度液体载体材料(hvlcm),其包含乙酸异丁酸蔗糖酯,其具有以小于200ppm的水平存在的过氧化物;以及
81.有机溶剂。
82.41.方面40的组合物,其中乙酸异丁酸蔗糖酯具有以小于100ppm的水平存在的过氧化物。
83.42.方面40的组合物,其中乙酸异丁酸蔗糖酯具有以小于80ppm或小于60ppm的水平存在的过氧化物。
84.43.方面40的组合物,其中乙酸异丁酸蔗糖酯具有以1ppm至100ppm的水平存在的过氧化物。
85.44.方面40的组合物,其中乙酸异丁酸蔗糖酯具有以2ppm至80ppm的水平存在的过氧化物。
86.45.方面40的组合物,其中乙酸异丁酸蔗糖酯具有以3ppm至60ppm的水平存在的过氧化物。
87.46.一种组合物,其通过组合以下物质制备:
88.活性药剂;
89.高粘度液体载体材料(hvlcm)和聚原酸酯中的至少一种;以及
90.有机溶剂,其具有以小于100ppm的水平存在的过氧化物,有机溶剂任选地包含苯甲醇、二甲亚砜和三醋精中的至少一种。
91.47.方面46的组合物,其中有机溶剂具有以小于85ppm的水平存在的过氧化物。
92.48.方面46的组合物,其中有机溶剂具有以小于10ppm的水平存在的过氧化物。
93.49.方面46的组合物,其中有机溶剂具有以1ppm至90ppm的水平存在的过氧化物。
94.50.方面46的组合物,其中有机溶剂具有以2ppm至85ppm的水平存在的过氧化物。
95.51.方面46的组合物,其中有机溶剂具有以3ppm至10ppm的水平存在的过氧化物。
96.52.一种组合物,其包含:
97.活性药剂;
98.高粘度液体载体材料(hvlcm),其包含以基于组合物的重量计30重量%至80重量%的水平存在的乙酸异丁酸蔗糖酯;以及
99.有机溶剂。
100.53.方面52的组合物,其中乙酸异丁酸蔗糖酯以基于组合物的重量计40重量%至70重量%、50重量%至70重量%、60重量%至70重量%、61重量%至69重量%的水平存在于组合物中。
101.54.方面52的组合物,其中乙酸异丁酸蔗糖酯以基于组合物的重量计62重量%至68重量%的水平存在于组合物中。
102.55.方面52的组合物,其中乙酸异丁酸蔗糖酯以基于组合物的重量计63重量%至67重量%的水平存在于组合物中。
103.56.一种组合物,其包含:
104.活性药剂;
105.高粘度液体载体材料(hvlcm)和聚原酸酯中的至少一种,所述hvlcm任选包含以基于组合物的重量计30重量%至80重量%的水平存在的乙酸异丁酸蔗糖酯,并且任选地使用具有以小于200ppm的水平存在的过氧化物的乙酸异丁酸蔗糖酯制备所述组合物;
106.有机溶剂,所述有机溶剂任选地包含苯甲醇、二甲亚砜和三醋精中的至少一种,并且任选地所述组合物使用具有以小于100ppm的水平存在的过氧化物的有机溶剂制备;以及
107.以下中的至少一个:
108.2,6-二甲基苯胺,其中2,6-二甲基苯胺以小于500ppm的水平存在于组合物中,
109.活性药剂的n-氧化物,其中活性药剂的n-氧化物以基于组合物的重量计小于1重量%的水平存在于组合物中,
110.金属,其中所述金属以小于5ppm的水平存在于组合物中,水,其中水以基于组合物的重量计小于0.5重量%的水平存在,
111.乙酸苄酯,其中乙酸苄酯以小于100mg/ml的水平存在于组合物中,和
112.异丁酸苄酯,其中异丁酸苄酯以小于50mg/ml的水平存在于组合物中。
113.57.方面1至56中任一项的组合物,其中活性药剂包含局部麻醉剂。
114.58.方面1至56中任一项的组合物,其中活性药剂包含至少一种选自布比卡因、利多卡因、罗哌卡因、依替卡因、甲哌卡因、吡咯卡因及其盐的成分。
115.59.方面1至56中任一项的组合物,其中活性药剂包含布比卡因或其盐。
116.60.方面1至59中任一项的组合物,其中活性药剂以基于组合物的重量计1重量%至25重量%的量存在于组合物中。
117.61.方面1至59中任一项的组合物,其中活性药剂以基于组合物的重量计5重量%至20重量%的量存在于组合物中。
118.62.方面1至59中任一项的组合物,其中活性药剂以基于组合物的重量计10重量%至15重量%的量存在于组合物中。
119.63.方面1至59中任一项的组合物,其中活性药剂以基于组合物的重量约12重量%的量存在于组合物中。
120.64.方面1至63中任一项的组合物,其中有机溶剂包含至少一种选自苯甲醇、苯甲酸苄酯、二甲亚砜、乙醇、n-甲基吡咯烷酮和三醋精中的成分。
121.65.方面1至63中任一项的组合物,其中有机溶剂包含苯甲醇。
122.66.方面1至63中任一项的组合物,其中有机溶剂包含三醋精。
123.67.方面1至63中任一项的组合物,其中有机溶剂包含二甲亚砜。
124.68.方面1至67中任一项的组合物,其中有机溶剂以足以将活性药剂溶解在组合物中的量存在于组合物中,或有机溶剂以基于组合物的重量计至少5重量%的量存在于组合物中。
125.69.方面1至68中任一项的组合物,其中有机溶剂以基于组合物的重量计至少10重量%的量存在于组合物中。
126.70.方面1至68中任一项的组合物,其中有机溶剂以基于组合物的重量计至少15重量%的量存在于组合物中。
127.71.方面1至68中任一项的组合物,其中有机溶剂以基于组合物的重量计至少20重量%的量存在于组合物中。
128.72.方面1至68中任一项的组合物,其中有机溶剂以基于组合物的重量计5重量%至45重量%的量存在于组合物中。
129.73.方面1至68中任一项的组合物,其中有机溶剂以基于组合物的重量计10重量%至35重量%的量存在于组合物中。
130.74.方面1至68中任一项的组合物,其中有机溶剂以基于组合物的重量计15重量%至30重量%的量存在于组合物中。
131.75.方面1至68中任一项的组合物,其中有机溶剂以基于组合物的重量计20重量%至25重量%的量存在于组合物中。
132.76.方面1至68中任一项的组合物,其中有机溶剂以基于组合物的重量计约22重量%的量存在于组合物中。
133.77.方面1至76中任一项的组合物,其中组合物包含hvlcm,该hvlcm含有乙酸异丁酸蔗糖酯。
134.78.方面1至76中任一项的组合物,其中组合物包含hvlcm,其以足以提供活性药剂从组合物中的持续释放,如约72小时的持续释放的量存在于组合物中,或组合物包含以基于组合物的重量计50重量%至80重量%的量存在于组合物中的hvlcm。
135.79.方面1至76中任一项的组合物,其中组合物包含以基于组合物的重量计55重量%至75重量%的量存在于组合物中的hvlcm。
136.80.方面1至76中任一项的组合物,其中组合物包含以基于组合物的重量计60重量%至70重量%的量存在于组合物中的hvlcm。
137.81.方面1至76中任一项的组合物,其中组合物包含以基于组合物的重量计约66重量%的量存在于组合物中的hvlcm。
138.82.方面1至81中任一项的组合物,其中组合物包含聚原酸酯。
139.83.方面1至81中任一项的组合物,其中组合物包含重均分子量为1000道尔顿至10,000道尔顿的聚原酸酯。
140.84.方面1至81中任一项的组合物,其中组合物包含以基于组合物的重量计40重量%至70重量%的量存在的聚原酸酯。
141.85.方面1至84中任一项的组合物,其进一步包含美洛昔康。
142.86.方面1至85中任一项的组合物,其中组合物已在15℃至30℃的温度下储存。
143.87.方面1至85中任一项的组合物,其中组合物已在20℃至25℃的温度下储存。
144.88.方面1至9和56至87中任一项的组合物,其中当组合物在密封的直立透明玻璃小瓶中在25℃/60%rh下储存20个月时,2,6-二甲基苯胺以一定水平存在,例如当组合物在密封的直立透明玻璃小瓶中在25℃/60%rh下储存20个月时,2,6-二甲基苯胺可以小于500ppm的水平存在。
145.89.方面1至9和56至87中任一项的组合物,其中当组合物在密封的直立透明玻璃小瓶中在25℃/60%rh下储存36个月时,2,6-二甲基苯胺以该水平存在。
146.90.方面1至9和56至87中任一项的组合物,其中当组合物在密封的直立透明玻璃小瓶中在40℃/75%rh下储存20个月时,2,6-二甲基苯胺以该水平存在。
147.91.方面1至9和56至87中任一项的组合物,其中当组合物在密封的直立透明玻璃小瓶中在40℃/75%rh下储存36个月时,2,6-二甲基苯胺以该水平存在。
148.92.方面10至15和56至87中任一项的组合物,其中当组合物在密封的直立透明玻璃小瓶中在25℃/60%rh下储存20个月时,活性药剂的n-氧化物以该水平存在。
149.93.方面10至15和56至87中任一项的组合物,其中当组合物在密封的直立透明玻璃小瓶中在25℃/60%rh下储存36个月时,活性药剂的n-氧化物以该水平存在。
150.94.方面10至15和56至87中任一项的组合物,其中当组合物在密封的直立透明玻璃小瓶中在40℃/75%rh下储存20个月时,活性药剂的n-氧化物以该水平存在。
151.95.方面10至15和56至87中任一项的组合物,其中当组合物在密封的直立透明玻璃小瓶中在40℃/75%rh下储存36个月时,活性药剂的n-氧化物以该水平存在。
152.96.方面16至21和56至87中任一项的组合物,其中当组合物在密封的直立透明玻璃小瓶中在25℃/60%rh下储存20个月时,金属以该水平存在。
153.97.方面16至21和56至87中任一项的组合物,其中当组合物在密封的直立透明玻璃小瓶中在25℃/60%rh下储存36个月时,金属以该水平存在。
154.98.方面16至21和56至87中任一项的组合物,其中当组合物在密封的直立透明玻璃小瓶中在40℃/75%rh下储存20个月时,金属以该水平存在。
155.99.方面16至21和56至87中任一项的组合物,其中当组合物在密封的直立透明玻璃小瓶中在40℃/75%rh下储存36个月时,金属以该水平存在。
156.100.方面22至27和56至87中任一项的组合物,其中当组合物在密封的直立透明玻璃小瓶中在25℃/60%rh下储存20个月时,水以该水平存在。
157.101.方面22至27和56至87中任一项的组合物,其中当组合物在密封的直立透明玻璃小瓶中在25℃/60%rh下储存36个月时,水以该水平存在。
158.102.方面22至27和56至87中任一项的组合物,其中当组合物在密封的直立透明玻璃小瓶中在40℃/75%rh下储存20个月时,水以该水平存在。
159.103.方面22至27和56至87中任一项的组合物,其中当组合物在密封的直立透明玻璃小瓶中在40℃/75%rh下储存36个月时,水以该水平存在。
160.104.方面28至33和56至87中任一项的组合物,其中当组合物在密封的直立透明玻璃小瓶中在25℃/60%rh下储存20个月时,乙酸苄酯以该水平存在。
161.105.方面28至33和56至87中任一项的组合物,其中当组合物在密封的直立透明玻璃小瓶中在25℃/60%rh下储存36个月时,乙酸苄酯以该水平存在。
162.106.方面28至33和56至87中任一项的组合物,其中当组合物在密封的直立透明玻璃小瓶中在40℃/75%rh下储存20个月时,乙酸苄酯以该水平存在。
163.107.方面28至33和56至87中任一项的组合物,其中当组合物在密封的直立透明玻璃小瓶中在40℃/75%rh下储存36个月时,乙酸苄酯以该水平存在。
164.108.方面34至39和56至87中任一项的组合物,其中当组合物在密封的直立透明玻璃小瓶中在25℃/60%rh下储存20个月时,异丁酸苄酯以该水平存在。
165.109.方面34至39和56至87中任一项的组合物,其中当组合物在密封的直立透明玻璃小瓶中在25℃/60%rh下储存36个月时,异丁酸苄酯以该水平存在。
166.110.方面34至39和56至87中任一项的组合物,其中当组合物在密封的直立透明玻
璃小瓶中在40℃/75%rh下储存20个月时,异丁酸苄酯以该水平存在。
167.111.方面34至39和56至87中任一项的组合物,其中当组合物在密封的直立透明玻璃小瓶中在40℃/75%rh下储存36个月时,异丁酸苄酯以该水平存在。
168.112.方面52至87中任一项的组合物,其中当组合物在密封的直立透明玻璃小瓶中在25℃/60%rh下储存20个月时,乙酸异丁酸蔗糖酯以该水平存在。
169.113.方面52至87中任一项的组合物,其中当组合物在密封的直立透明玻璃小瓶中在25℃/60%rh下储存36个月时,乙酸异丁酸蔗糖酯以该水平存在。
170.114.方面52至87中任一项的组合物,其中当组合物在密封的直立透明玻璃小瓶中在40℃/75%rh下储存20个月时,乙酸异丁酸蔗糖酯以该水平存在。
171.115.方面52至87中任一项的组合物,其中当将所述组合物在密封的直立透明玻璃小瓶中在40℃/75%rh下储存36个月时,乙酸异丁酸蔗糖酯以该水平存在。
172.116.一种剂量系统,包括:
173.包含第一惰性材料的容器;
174.能够封闭所述容器的封闭件,所述封闭件包含第二惰性材料;以及
175.方面1至115中任一项的组合物,其包含在所述容器内。
176.117.方面116的剂量系统,其中所述剂量系统不包含硅油。
177.118.方面116和117中任一项的剂量系统,其中第二惰性材料包含碳氟化合物。
178.119.方面116至118中任一项的剂量系统,其中第二惰性材料包含四氟乙烯。
179.120.方面116至119中任一项的剂量系统,其中第二惰性材料包含氟化聚合物。
180.121.方面116至120中任一项的剂量系统,其中所述封闭件包括碳氟化合物涂覆的塞。
181.122.方面110至121中任一项的剂量系统,其中第一惰性材料包含玻璃。
182.123.方面122的剂量系统,其中所述玻璃包括透明玻璃。
183.124.方面122和123中任一项的剂量系统,其中玻璃对可见光是透明的。
184.125.方面122至124中任一项的剂量系统,其中所述玻璃对400nm至600nm的光波长具有1或更小的光密度。
185.126.方面122至125中任一项的剂量系统,其中玻璃对100nm至250nm的光波长具有大于1的光密度。
186.127.方面122至126中任一项的剂量系统,其中所述玻璃不含铁。
187.128.方面122至126中任一项的剂量系统,其中所述玻璃包括不含铁的硼硅酸盐玻璃。
188.129.方面122至128中任一项的剂量系统,其中玻璃包括不含铁的派热克斯玻璃。
189.130.方面116至129中任一项的剂量系统,其中容器包括小瓶。
190.131.一种剂量系统,包括:
191.第一容器;
192.在所述第一容器内的第二容器,所述第二容器包含第一惰性材料,并且所述第一容器减少环境可见光照射到所述第二容器上;以及
193.方面1至115中任一项的组合物,其在第二容器内。
194.132.方面131的剂量系统,其中第一容器包括盒或纸板盒,任选地第一容器是1单
元至25单元的盒或纸板盒,诸如10单元的盒或纸板盒,任选地第二容器中的十个在第一容器中,任选地第一容器在第二盒中。
195.133.方面131和132中任一项的剂量系统,其中第一容器包含聚合物。
196.134.方面131至133中任一项的剂量系统,其中第一容器包含热塑性塑料。
197.135.方面131至134中任一项的剂量系统,其中第一容器包含纤维素。
198.136.方面131至135中任一项的剂量系统,其中第一容器包含粘土。
199.137.方面131至136中任一项的剂量系统,其中第一容器包含厚度为至少0.5mm或0.4mm至3mm,例如0.5mm至2.5mm、0.5mm至1mm、0.6mm至0.9mm或0.7mm至0.8mm的材料。
200.138.方面116至137中任一项的剂量系统,还包括包含在容器内的气体,该容器包含组合物,该气体具有小于10摩尔%或小于10重量%的氧含量。
201.139.方面138的剂量系统,其中气体具有1摩尔%至10摩尔%或1重量%至10重量%的氧含量。
202.140.根据方面138所述的剂量系统,其中气体填充包含组合物的容器内的顶空。
203.141.方面116至140中任一项的剂量系统,其中包含组合物的容器包含降低光透射的层。
204.142.一种方法,包括:
205.过滤方面1至115中任一项的组合物;以及
206.无菌处理该组合物。
207.143.方面142的方法,其中过滤包括将组合物加热至25℃至50℃。
208.144.方面142的方法,其中过滤包括将组合物加热至25℃至45℃。
209.145.方面142的方法,其中过滤包括将组合物加热至30℃至35℃。
210.146.方面142至145中任一项的方法,其中所述无菌处理包括将所述组合物填充到容器中。
211.147.方面146中任一项的方法,其中填充在包含惰性气体的气氛下进行。
212.148.方面147的方法,其中惰性气体包含选自氮、氦、氖、氩、氪、氙和二氧化碳的至少一种。
213.149.方面147的方法,其中惰性气体包含氮气。
214.150.方面142至149中任一项的方法,其中无菌处理所述组合物包括制备剂量系统,所述剂量系统包括:包含第一惰性材料的容器;用于封闭所述容器的封闭件,所述封闭件包含第二惰性材料;和包含在容器内的组合物;该方法包括将组合物填充到容器中。
215.151.方面150的方法,其中剂量系统不包含硅油。
216.152.方面150和151中任一项的方法,其中第二惰性材料包含碳氟化合物。
217.153.方面150至152中任一项的方法,其中第二惰性材料包含四氟乙烯。
218.154.方面150至153中任一项的方法,其中第二惰性材料包含氟化聚合物。
219.155.方面150至154中任一项的方法,其中所述封闭件包括碳氟化合物涂覆的塞。
220.156.方面150至155中任一项的方法,其中第一惰性材料包括玻璃。
221.157.方面156的方法,其中玻璃包括透明玻璃。
222.158.方面156和157中任一项的方法,其中玻璃对可见光是透明的。
223.159.方面156至158中任一项的方法,其中所述玻璃对400nm至600nm的光波长具有
1或更小的光密度。
224.160.方面156至159中任一项的方法,其中所述玻璃对100nm至250nm的光波长具有大于1的光密度。
225.161.方面156至160中任一项的方法,其中所述玻璃不含铁。
226.162.方面156至161中任一项的方法,其中所述玻璃包括不含铁的硼硅酸盐玻璃。
227.163.方面156至162中任一项的方法,其中所述玻璃包括不含铁的派热克斯玻璃。
228.164.方面150至163中任一项的方法,其中所述容器包括小瓶。
229.165.根据方面142至149中任一项的方法,其中无菌处理所述组合物包括制备剂量系统,所述剂量系统包括:第一容器;在所述第一容器内的第二容器,所述第二容器包含第一惰性材料,并且所述第一容器防止环境可见光照射到所述第二容器上;和第二容器内的组合物;该方法包括将组合物填充到第二容器中。
230.166.方面165的方法,其中第一容器包括盒。
231.167.方面165和166中任一项的方法,其中第一容器包含聚合物。
232.168.方面165至167中任一项的方法,其中第一容器包含热塑性塑料。
233.169.方面165至168中任一项的方法,其中第一容器包含纤维素。
234.170.方面165至168中任一项的方法,其中第一容器包含粘土。
235.171.方面165至170中任一项的方法,其中第一容器具有至少0.5mm的厚度。
236.172.方面150至171中任一项的方法,其进一步包括包含在容器内的气体,该容器包含所述组合物,所述气体具有小于10摩尔%或小于10重量%的氧含量。
237.173.根据方面172所述的方法,其中所述气体具有1摩尔%至10摩尔%或1重量%至10重量%的氧含量。
238.174.方面172的方法,其中气体填充包含组合物的容器内的顶空。
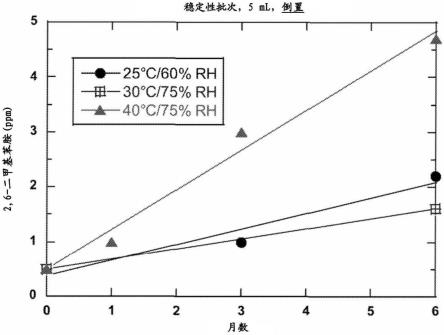
239.175.方面150至172中任一项的方法,其中包含组合物的容器包含降低光透射的层。
240.176.一种治疗或预防性治疗疼痛的方法,其包括向有需要的受试者施用有效量的方面1至175中任一项的组合物。
附图说明
241.图1显示了制剂a样品的含水量和着色。
242.图2显示了拟合成saib过氧化物含量数据对布比卡因n-氧化物水平的线性回归线。
243.图3显示了在36个月的时间内,4个第一批(5ml)和4个第二批(7.5ml)制剂a样品的标签规格(label strength)。
244.图4显示了在36个月的时间内,4个第一批(5ml)和4个第二批(7.5ml)制剂a样品中布比卡因n-氧化物的变化(以布比卡因n-氧化物%计)。
245.图5显示在18个月的时间(第18-36个月)内,4个第一批(5ml)和4个第二批(7.5ml)制剂a样品中2,6-二甲基苯胺的存在(以ppm计)。
246.图6显示了在3个不同温度(25℃、30℃和40℃)和2个不同的相对湿度(60%rh、75%rh)下储存6个月的时间的制剂a样品中2,6-二甲基苯胺的存在。
247.图7显示在36个月的时间内,在4个第一批(5ml)和4个第二批(7.5ml)制剂a样品中乙酸苄酯的存在(以mg/ml计)。
248.图8显示在3个不同温度(25℃、30℃和40℃)和2个不同相对湿度(60%rh、75%rh)下储存6个月的制剂a样品中乙酸苄酯的存在。
249.图9显示在36个月的时间内,在4个第一批(5ml)和4个第二批(7.5ml)制剂a样品中异丁酸苄酯的存在(以mg/ml计)。
250.图10显示在3个不同温度(25℃、30℃和40℃)和2个不同的相对湿度(60%rh、75%rh)下储存6个月的时间的制剂a样品中异丁酸苄酯的存在。
251.图11显示在36个月的时间内,在4个第一批(5ml)和4个第二批(7.5ml)制剂a样品中saib百分比的变化。
252.图12显示对照制剂(n=4)、-30%saib制剂(n=3)、-40%saib制剂(n=3)、-50%saib制剂(n=4)、-70%saib制剂(n=3)和-90%saib制剂(n=3)的平均累积释放。
253.图13显示对照制剂(n=12)、+20%saib制剂(n=12)、-20%saib制剂(n=12)和-70%saib制剂(n=12)的平均累积释放。
254.图14显示对照制剂(n=12)和热应激的saib制剂(n=12)的平均累积释放。
255.图15显示了意向治疗(itt)群体随时间的运动时疼痛强度(pi)。
256.图16显示在施用制剂a或标准布比卡因后,根据布比卡因浓度的几何平均总布比卡因血浆浓度和游离布比卡因血浆浓度。
257.图17显示制剂a的所有个体的游离布比卡因血浆浓度相对于总布比卡因血浆浓度的相关性。
258.图18显示了使用ancova的治疗组之间的疼痛强度归一化auc,其中治疗组和试验地点作为因素,年龄作为协变量。
259.图19a显示了在施用后的时间点与施用安慰剂的受试者相比,施用制剂a的改良意向治疗(mitt)组中的受试者的平均运动时疼痛强度。
260.图19b描绘了在施用后的时间点与施用安慰剂的受试者相比,在施用制剂a的符合实验方案(pp)组中受试者平均运动时疼痛强度。
261.图20显示了在使用ancova的治疗组之间比较的累积吗啡当量剂量,其中治疗组和试验地点作为因素,年龄作为协变量。
262.图21描绘了在施用后的时间点与施用安慰剂的受试者相比,施用制剂a的mitt组中的累积吗啡当量剂量。
263.图22显示了分别对队列1和队列2分析的随时间变化的平均pi运动。
264.图23显示了具有最小或没有盂肱病理的受试者亚组中随时间的pi
运动
。
265.图24-26显示了每个队列中平均运动时疼痛强度
±
平均值标准误差(sem)对疼痛评估的预定时间的线图。
266.图27至29显示了治疗后血浆布比卡因浓度对时间的图。
267.图30显示从plga组合物中的释放显示出比从poe组合物中的释放更大的可变性,如较大的误差条(标准偏差)所示。
268.图31还显示了从plga组合物中的释放比从poe组合物中的释放的可变性更大,其显示了每种制剂的六次重复中的每一次的个体释放曲线。
具体实施方式
269.在详细描述本发明之前,应当理解,本发明不限于具体例示的载体材料或工艺参数,因为这些当然可以变化。还应理解,本文所用的术语仅出于描述本发明的特定实施方案的目的,而不是意图限制。
270.本文引用的所有出版物、专利和专利申请,无论是上文还是下文,均通过引用整体并入本文。
271.必须注意,如本说明书和所附权利要求书中所用,单数形式“一”、“一个”和“该”包括复数指代物,除非内容另有明确规定。因此,例如,“溶剂”包括两种或更多种这样的载体的混合物,提及“麻醉剂”包括两种或更多种这样的试剂的混合物,等等。
272.本文所用的以一定水平“存在”是指给定组分,例如2,6-二甲基苯胺,以大于零的水平存在。
273.本技术涉及改善持续释放药物递送制剂的稳定性和安全性的多种策略。这些策略包括改善的灭菌、防止光诱导的降解、惰性容器封闭和低金属含量。
274.在一些方面,本技术涉及具有低量的2,6-二甲基苯胺(式i)的持续释放药物递送制剂:
[0275][0276]
在一些情况下,2,6-二甲基苯胺在药物递送制剂中以小于500ppm,例如小于300ppm、小于200ppm、小于100ppm、小于15ppm、小于12ppm、小于10ppm或小于5ppm的水平存在。在一些情况下,2,6-二甲基苯胺在药物递送制剂中以0.2ppm至500ppm,例如0.3ppm至200ppm、0.4ppm至100ppm、0.5ppm至10ppm或2ppm至8ppm的水平存在。
[0277]
在一些情况下,本技术涉及具有低量的活性药剂的n-氧化物的组合物。例如,活性药剂的n-氧化物在组合物中的水平可以基于组合物的重量计小于1重量%,例如小于0.7重量%、小于0.5重量%或小于0.4重量%。在一些情况下,活性药剂的n-氧化物以基于组合物的重量计0.01重量%至1重量%,例如0.05重量%至0.4重量%、0.1重量%至0.4重量%或0.1重量%至0.2重量%的水平存在于组合物中。
[0278]
在一些方面,本技术涉及缓释药物递送制剂,其具有低量的布比卡因n-氧化物(式ii):
[0279][0280]
在一些情况下,布比卡因n-氧化物以基于组合物的重量计小于1重量%,例如小于0.7重量%,或小于0.4重量%的水平存在于组合物中。在一些情况下,布比卡因n-氧化物以基于组合物的重量计0.01重量%至1重量%,诸如0.05重量%至0.4重量%,或0.1重量%至
0.2重量%的水平存在于组合物中。
[0281]
在一些情况下,组合物由具有低水平过氧化物的成分制成。例如,所述组合物可以通过组合以下物质来制备:活性药剂;高粘度液体载体材料(hvlcm),其包含具有以小于200ppm的水平存在的过氧化物的乙酸异丁酸蔗糖酯;和有机溶剂。在一些情况下,乙酸异丁酸蔗糖酯具有以小于100ppm,例如小于80ppm或小于60ppm的水平存在的过氧化物。在一些情况下,乙酸异丁酸蔗糖酯具有以1ppm至100ppm,例如2ppm至80ppm或3ppm至60ppm的水平存在的过氧化物。
[0282]
在一些情况下,组合物可以通过组合以下物质来制备:活性药剂;高粘度液体载体材料(hvlcm)和聚原酸酯中的至少一种;和具有以小于100ppm的水平存在的过氧化物的有机溶剂,所述有机溶剂任选地包含苯甲醇、二甲亚砜和三醋精中的至少一种。在一些情况下,有机溶剂具有以小于85ppm,例如小于10ppm的水平存在的过氧化物。在一些情况下,有机溶剂具有以1ppm至90ppm,例如2ppm至85ppm或3ppm至10ppm的水平存在的过氧化物。
[0283]
在一些情况下,可通过hplc和uv检测来测量主题组合物中降解产物(例如2,6-二甲基苯胺、布比卡因n-氧化物)的量。在其它情况下,2,6-二甲基苯胺的量通过核磁共振(nmr)光谱测定。在一些情况下,2,6-二甲基苯胺的量通过气相色谱法(例如气相色谱-质谱,gcms)测定。在一些情况下,2,6-二甲基苯胺的量通过液相色谱法(例如液相色谱-质谱,lcms)测定。除非另有说明,权利要求中所述的2,6-二甲基苯胺的量通过lcms测定。在一些情况下,2,6-二甲基苯胺的量可以通过电化学检测来测量,如fijalek等,journal of pharmaceutical and biomedical analysis,37:913-918(2005)中所述,其全文以引用方式并入本文。
[0284]
在一些情况下,过氧化物的量通过电位滴定,例如碘量滴定来测量。其它测量过氧化物的量的技术包括伏安法、分光光度法(例如,使用碳酸氢钴(cobalt bicarbonate),其吸光度在400nm处测量,草酸钛,其吸光度在260nm处测量,或过氧化物酶,其吸光度在596nm处测量)、荧光测定法、荧光相关光谱法(fcs)、化学发光、电化学、离子色谱法(ic)和共振光散射(rls)。除非另有说明,权利要求中所述的过氧化物的量是使用碳酸氢钴通过分光光度法测定的,其中在400nm处测量吸光度。
[0285]
在一个方面,本技术涉及对持续释放药物递送制剂进行灭菌而不形成不可接受水平的降解产物,包括遗传毒性杂质。
[0286]
发现在一些情况下,γ辐射不是可接受的灭菌方法,因为γ辐射显著增加了降解产物的水平,包括已知的遗传毒性降解物2,6-二甲基苯胺。
[0287]
使用由12重量%布比卡因、66重量%乙酸异丁酸蔗糖酯(saib)和22重量%苯甲醇组成的示例性制剂(“制剂a”)进行替代灭菌技术的评价。灭菌技术包括:干热灭菌、蒸汽灭菌和过滤灭菌,然后进行无菌处理。评价结论是:
[0288]
·
在一些情况下,使用干热灭菌是不可接受的,因为干热灭菌温度高于产品的闪点,并且要求产品长时间暴露于升高的温度下。制剂a的闪点为116℃(闭杯);典型的灭菌周期为170℃不少于2小时。尽管可以采取预防措施将产品加热到该温度,但是人员和工厂的安全性没有证明该风险是合理的。此外,在一些情况下,碳氟化合物涂覆的塞不能经受典型的干热灭菌(例如250℃持续≥30分钟)。
[0289]
·
使用蒸汽对制剂a进行灭菌是不可接受的,因为制剂是非水性的。蒸汽灭菌使用
高压饱和蒸汽使细胞变性。小瓶中的水性产品使用制剂中的水在容器的顶空内产生蒸汽和压力,从而对内容物进行灭菌。另外,蒸汽灭菌温度高于产品的闪点,产生与干热灭菌所述的相同的安全问题。
[0290]
·
使用过滤灭菌,接着无菌处理制剂a是可接受的,因为它为产品提供了大于10-3
的无菌保证水平,而不损害产品。此外,制剂a的固有抗微生物活性确保过滤前生物负荷始终较低,从而确保安全的过滤灭菌结果。
[0291]
因此,用于制备示例性制剂的最佳灭菌方法是过滤灭菌,然后进行无菌处理。如本文所用,“无菌处理”是指在无菌条件下处理。无菌处理消除了产品降解和毒性的风险,如果产品经受足以符合当前iso要求(例如,20kgy至25kgy的γ辐射)的剂量的电离辐射,则将出现所述风险。
[0292]
除了作为灭菌技术的选择而最终确定无菌处理之外,进行了工艺研究,其确定了在制备期间使2,6-二甲基苯胺的形成最小化的最佳配混和填充温度。
[0293]
在一些情况下,本技术的方法包括处理主题组合物。根据某些情况处理主题组合物的方法包括过滤具有一种或多种活性剂(例如,如下所述的麻醉剂、nsaid等)的组合物,并无菌处理该组合物。在一些情况下,可以使用孔径在0.1nm至1000nm,例如0.5nm至950nm,例如1nm至900nm,例如10nm至800nm,例如25nm至750nm,例如50nm至500nm范围内变化的过滤器过滤组合物(如下文更详细描述的),并且包括使用孔径为100nm至400nm的过滤器过滤。可在正压、负压或大气压下过滤组合物。可以在加热组合物的同时过滤组合物。在一些情况下,在过滤期间将组合物加热1℃或更高,例如2℃或更高,例如3℃或更高,例如4℃或更高,例如5℃或更高,例如10℃或更高,例如15℃或更高,例如20℃或更高,并且包括25℃或更高。在一些情况下,在过滤期间将组合物加热至10℃至75℃的温度,例如15℃至70℃,例如20℃至65℃,例如25℃至60℃,例如30℃至55℃并且包括40℃至50℃。
[0294]
在一些情况下,组合物的无菌处理包括在气体气氛下将组合物填充到容器中。在一些情况下,所述气体气氛包括惰性气体。关注的惰性气体可以包括但不限于氮、氦、氖、氩、氪、氙和二氧化碳或其组合。在一些情况下,气体的量足以填充容器的顶空。术语“顶空”在本文中以其常规意义使用,是指容器中在组合物的界面与容器的开口之间或在封闭件的界面处(例如,当容器用塞密封时)的体积。容器顶空中的惰性气体气氛的气体压力可以是0.001托或更高,例如0.005托或更高,例如0.01托或更高,例如0.05托或更高,例如0.1托或更高,例如0.5托或更高,例如1托或更高,例如5托或更高,例如10托或更高,例如25托或更高,例如50托或更高,例如100托或更高,例如250托或更高,例如500托或更高,例如760托或更高,并且包括1000托或更高。
[0295]
在一些情况下,组合物的无菌处理包括用封闭件封闭容器。在一些情况下,所述封闭件由对主题组合物的组分惰性的化合物形成(或用其涂覆)(如下文更详细地描述)。在一些情况下,封闭件与容器形成流体密封。在一些情况下,封闭件与容器形成流体和气体密封。
[0296]
发现在一些情况下,暴露于光(例如,模拟日光、uv光和可见光)可导致在持续释放药物递送制剂中形成降解产物。
[0297]
还发现在一些情况下,在琥珀色玻璃器皿中储存持续释放药物递送制剂导致2,6-二甲基苯胺的水平较高。
[0298]
在一些情况下,通过将产品储存在适当的耐光纸板盒中来防止光诱导的降解。
[0299]
在一些情况下,药物递送制剂储存在耐光容器中。在一些情况下,所述耐光容器包括保护性耐光涂层,例如ray-涂层。在一些情况下,主题耐光容器被配置成通过防止主题组合物暴露于具有200nm至800nm,例如225nm至775nm,例如250nm至750nm,例如275nm至725nm,例如300nm至700nm,例如325nm至675nm,例如350nm至650nm,例如375nm至625nm并且包括400nm至600nm范围内的波长的光来减少或消除光诱导的降解。在某些情况下,所述耐光容器在其中期望减少光暴露的波长下具有0.5或更大的光密度,例如1或更大,例如1.5或更大,例如2.0或更大,例如2.5或更大,例如3.0或更大,例如3.5或更大,例如4.0或更大,例如4.5或更大,例如5.0或更大,例如5.5或更大,例如6.0或更大,例如6.5或更大,并且包括7.0或更大的光密度。在一些情况下,在期望减少光暴露的情况下,该耐光容器对于光波长是完全不透明的(即,没有光穿过容器的壁)。
[0300]
发现在一些情况下,硅化塞将硅油浸出到缓释药物递送制剂中。在一些情况下,将主题组合物的剂量单位储存(例如装载、分配)在具有封闭件(例如塞、盖或帽)的容器中,所述封闭件对于组合物的组分,例如对于组合物中存在的有机溶剂(例如苯甲醇)基本上是惰性的。如本文所用,“基本上惰性”是指主题组合物不从封闭件浸出或与封闭件反应(即,组合物与封闭件之间的接触不导致在组合物中降解或不期望的副产物的形成或存在)。在一些情况下,即使当接触1小时或更长时间,例如2小时或更长时间,例如6小时或更长时间,例如12小时或更长时间,例如24小时或更长时间,例如1周或更长时间,例如1个月或更长时间,例如6个月或更长时间,例如1年或更长时间并且包括10年或更长时间时,封闭件也未表现出与组合物的反应性。在一些情况下,关注的封闭件包括氟化聚合物。在一些情况下,闭合件由氟化聚合物形成。在一些情况下,封闭件涂覆有氟化聚合物。关注的氟化聚合物可包括但不限于由一种或多种单体形成的含氟聚合物,所述单体选自乙烯-四氟乙烯、全氟环烯烃(pfca)、乙烯基氟(氟乙烯,vf1)、偏二氟乙烯(1,1-二氟乙烯,vdf,vf2)、四氟乙烯(tfe)、氯三氟乙烯(ctfe)、六氟丙烯(hfp)、全氟丙基乙烯基醚(ppve)、全氟甲基乙烯基醚(pmve)。例如,封闭件可以由聚氟乙烯(pvf)、聚偏二氟乙烯(pvdf)、聚四氟乙烯(ptfe)、聚氯三氟乙烯(pctfe)、全氟烷氧基聚合物(pfa)、氟化乙烯-丙烯(fep)、聚乙烯四氟乙烯(etfe)、聚乙烯氯三氟乙烯(ectfe)、全氟化弹性体(ffpm/ffkm)、氟碳氯三氟乙烯偏二氟乙烯(fpm)、氟弹性体四氟乙烯-丙烯(fepm)、全氟聚醚(pfpe)或全氟磺酸(pfsa)形成。在一些情况下,该封闭件不包含硅。
[0301]
在一些情况下,塞与玻璃容器(例如玻璃小瓶)例如10ml usp i型玻璃小瓶配对。在一些情况下,玻璃小瓶是派热克斯玻璃、硼硅玻璃或其它类型的玻璃。在一些情况下,玻璃小瓶由不含铁的玻璃材料形成。
[0302]
在一些情况下,有机溶剂例如22重量%苯甲醇的存在使得有必要选择化学上耐有机溶剂的塞。
[0303]
在一些情况下,本技术提供了不含硅油的剂量系统。
[0304]
在一些情况下,本技术提供了当暴露于γ辐射时可释放氟离子的氟碳化合物涂覆的塞。因此,在一些情况下,剂量系统不暴露于γ辐射。
[0305]
在一些情况下,本技术涉及控制持续释放药物递送制剂中的金属含量。
[0306]
从原料来源到配混、填充和储存在容器(例如,具有塞子的玻璃小瓶)中,持续释放
药物递送制剂的制备可以以使最终产品中的金属最小化的方式进行。在一些情况下,通过使用钢配混罐使金属含量最小化。在一些情况下,通过使用硅胶管使金属含量最小化。在一些情况下,通过使用碳氟化合物涂覆的塞使金属含量最小化。
[0307]
在一些情况下,组合物包含以小于5ppm,例如小于4ppm,或小于3ppm的水平存在的金属。在一些情况下,组合物包含以0.1ppm至4ppm,例如0.05ppm至3ppm或0.1ppm至2ppm的水平存在的金属。本领域技术人员将理解,金属内容物包括任何形式的金属,包括元素或离子化形式的金属。
[0308]
在一些情况下,本技术涉及具有低含水量的组合物。例如,水可以以基于组合物的重量计小于0.5重量%,例如基于组合物的重量计小于0.4重量%,或小于0.3重量%的水平存在。水可以以基于组合物的重量计0.03重量%至0.4重量%,例如0.05重量%至0.35重量%,0.08重量%至0.3重量%的水平存在于组合物中。
[0309]
虽然不希望受理论的束缚,但在一些情况下,据信含水量影响组合物中发生的水解的量。在一些情况下,乙酸异丁酸蔗糖酯和苯甲醇经历水解反应以形成乙酸苄酯和/或异丁酸苄酯。据信保持低含水量减少乙酸苄酯和异丁酸苄酯的形成。可以通过几种技术将含水量保持在低水平,例如使用具有低含水量的成分,将成分储存在密闭容器中,以及在配混时使用氮气顶空。
[0310]
鉴于上述情况,在一些情况下,本技术涉及具有低乙酸苄酯含量的组合物。例如,乙酸苄酯可以以低于100mg/ml的水平存在,例如低于90mg/ml、低于80mg/ml、低于70mg/ml、低于60mg/ml、低于50mg/ml、低于40mg/ml、低于30mg/ml、低于20mg/ml、低于15mg/ml或低于10mg/ml。乙酸苄酯可以以0.1mg/ml至80mg/ml,例如0.5mg/ml至40mg/ml、1mg/ml至20mg/ml或1mg/ml至15mg/ml的水平存在于组合物中。在一些情况下,乙酸苄酯以下述量存在于组合物中:1mg/ml、2mg/ml、3mg/ml、4mg/ml、5mg/ml、6mg/ml、7mg/ml、8mg/ml、9mg/ml、10mg/ml、11mg/ml、12mg/ml、13mg/ml、14mg/ml、15mg/ml、16mg/ml、17mg/ml、18mg/ml、19mg/ml、20mg/ml、21mg/ml、22mg/ml、23mg/ml、24mg/ml、25mg/ml、26mg/ml、27mg/ml、28mg/ml、29mg/ml、30mg/ml、31mg/ml、32mg/ml、33mg/ml、34mg/ml、35mg/ml、36mg/ml、37mg/ml、38mg/ml、39mg/ml、40mg/ml、41mg/ml、42mg/ml、43mg/ml、44mg/ml、45mg/ml、46mg/ml、47mg/ml、48mg/ml、49mg/ml、50mg/ml、51mg/ml、52mg/ml、53mg/ml、54mg/ml、55mg/ml、56mg/ml、57mg/ml、58mg/ml、59mg/ml、60mg/ml、61mg/ml、62mg/ml、63mg/ml、64mg/ml、65mg/ml、66mg/ml、67mg/ml、68mg/ml、69mg/ml、70mg/ml、71mg/ml、72mg/ml、73mg/ml、74mg/ml、75mg/ml、76mg/ml、77mg/ml、78mg/ml、79mg/ml、80mg/ml、81mg/ml、82mg/ml、83mg/ml、84mg/ml、85mg/ml、86mg/ml、87mg/ml、88mg/ml、89mg/ml、90mg/ml、91mg/ml、92mg/ml、93mg/ml、94mg/ml、95mg/ml、96mg/ml、97mg/ml、98mg/ml、99mg/ml或100mg/ml。
[0311]
在一些情况下,本技术涉及具有低异丁酸苄酯含量的组合物。例如,异丁酸苄酯可以以低于50mg/ml的水平存在,例如低于40mg/ml、低于30mg/ml、低于20mg/ml、低于30mg/ml、低于10mg/ml,或低于8mg/ml。异丁酸苄酯可以以0.1mg/ml至40mg/ml,例如0.5mg/ml至30mg/ml、1mg/ml至10mg/ml或1mg/ml至8mg/ml的水平存在于组合物中。在一些情况下,异丁酸苄酯以下述量存在于组合物中:1mg/ml、2mg/ml、3mg/ml、4mg/ml、5mg/ml、6mg/ml、7mg/ml、8mg/ml、9mg/ml、10mg/ml、11mg/ml、12mg/ml、13mg/ml、14mg/ml、15mg/ml、16mg/ml、17mg/ml、18mg/ml、19mg/ml、20mg/ml、21mg/ml、22mg/ml、23mg/ml、24mg/ml、25mg/ml、26mg/
ml、27mg/ml、28mg/ml、29mg/ml、30mg/ml、31mg/ml、32mg/ml、33mg/ml、34mg/ml、35mg/ml、36mg/ml、37mg/ml、38mg/ml、39mg/ml、40mg/ml、41mg/ml、42mg/ml、43mg/ml、44mg/ml、45mg/ml、46mg/ml、47mg/ml、48mg/ml、49mg/ml或50mg/ml。
[0312]
虽然不希望受理论的束缚,但在一些情况下,据信组合物中过氧化物的量可影响n-氧化物形成的量。减少过氧化物的量被认为减少了n-氧化物形成的量。组合物中过氧化物的量可通过几种技术保持在低水平,例如使用具有低过氧化物含量的成分,保护组合物免受光照,使包含组合物的容器中的顶空最小化,和在低温下(例如室温下)储存组合物。
[0313]
在一些情况下,本发明的组合物用具有低过氧化物含量的hvlcm(例如乙酸异丁酸蔗糖酯)制备。例如,hvlcm可以具有以小于200ppm,如小于100ppm、小于80ppm或小于60ppm的水平存在的过氧化物。在一些情况下,hvlcm具有以1ppm至100ppm,例如2ppm至80ppm或3ppm至60ppm的水平存在的过氧化物。
[0314]
在一些情况下,本发明的组合物是用具有低过氧化物含量的有机溶剂(例如,苯甲醇)制备的。例如,有机溶剂可以具有以小于100ppm,例如小于85ppm或小于10ppm的水平存在的过氧化物。在一些情况下,有机溶剂具有以1ppm至90ppm,例如2ppm至85ppm或3ppm至10ppm的水平存在的过氧化物。
[0315]
在一些方面,本技术涉及具有很少或没有颗粒物质的活性剂组合物(例如,布比卡因组合物)。在一些情况下,颗粒物质在组合物中以低于100ppm、低于95ppm、低于90ppm、低于85ppm、低于80ppm、低于75ppm、低于70ppm、低于65ppm、低于60ppm、低于55ppm并包括低于50ppm的水平存在。例如,颗粒物质可以下述水平存在于组合物中:1ppm、2ppm、3ppm、4ppm、5ppm、6ppm、7ppm、8ppm、9ppm、10ppm、11ppm、12ppm、13ppm、14ppm、15ppm、16ppm、17ppm、18ppm、19ppm、20ppm、21ppm、22ppm、23ppm、24ppm、25ppm、26ppm、27ppm、28ppm、29ppm、30ppm、31ppm、32ppm、33ppm、34ppm、35ppm、36ppm、37ppm、38ppm、39ppm、40ppm、41ppm、42ppm、43ppm、44ppm、45ppm、46ppm、47ppm、48ppm、49ppm、50ppm、51ppm、52ppm、53ppm、54ppm、55ppm、56ppm、57ppm、58ppm、59ppm、60ppm、61ppm、62ppm、63ppm、64ppm、65ppm、66ppm、67ppm、68ppm、69ppm、70ppm、71ppm、72ppm、73ppm、74ppm、75ppm、76ppm、77ppm、78ppm、79ppm、80ppm、81ppm、82ppm、83ppm、84ppm、85ppm、86ppm、87ppm、88ppm、89ppm、90ppm、91ppm、92ppm、93ppm、94ppm、95ppm、96ppm、97ppm、98ppm、99ppm、100ppm。在某些情况下,组合物不含颗粒物质,即0ppm颗粒物质。
[0316]
制剂的稳定性也取决于储存条件。高温储存通常增加降解。在一些情况下,低温储存可引起沉淀。因此,本技术的组合物通常储存在15℃至30℃,例如20℃至25℃的温度下。
[0317]
在一些情况下,当组合物在密封的直立透明玻璃小瓶中在25℃/60%rh下储存20个月或36个月时,2,6-二甲基苯胺以本文公开的水平存在,例如,当组合物在密封的直立透明玻璃小瓶中在25℃/60%rh下储存20个月或36个月时,2,6-二甲基苯胺可以以小于500ppm的水平存在。在一些情况下,当组合物在密封的直立透明玻璃小瓶中在25℃/60%rh下储存20个月或36个月时,2,6-二甲基苯胺以相对于储存前的初始水平小于100倍,例如小于50倍、小于20倍、小于10倍、小于8倍、小于6倍、小于4倍或小于2倍的水平存在,例如以相对于储存前的初始水平为1倍至20倍,例如2倍至10倍或2倍至4倍的水平存在。
[0318]
在一些情况下,当组合物在密封的直立透明玻璃小瓶中在40℃/75%rh下储存20个月或36个月时,2,6-二甲基苯胺以本文公开的水平存在。在一些情况下,当组合物在密封
的直立透明玻璃小瓶中在40℃/75%rh下储存20个月或36个月时,2,6-二甲基苯胺以相对于储存前的初始水平小于100倍,例如小于50倍、小于20倍、小于10倍、小于8倍、小于6倍、小于4倍或小于2倍的水平存在,例如以相对于储存前的初始水平为1倍至20倍,例如2倍至10倍或2倍至4倍的水平存在。
[0319]
在一些情况下,当组合物在密封的直立透明玻璃小瓶中在25℃/60%rh下储存20个月或36个月时,活性药剂的n-氧化物以本文所公开的水平存在,例如以基于组合物的重量计小于1重量%的水平存在。在一些情况下,当组合物在密封的直立透明玻璃小瓶中在25℃/60%rh下储存20个月或36个月时,活性药剂的n-氧化物以相对于储存前的初始水平小于10倍,例如小于5倍、小于2倍或小于1.5倍的水平存在,例如以相对于储存前的初始水平为1倍至5倍或1倍至2倍的水平存在。
[0320]
在一些情况下,当组合物在密封的直立透明玻璃小瓶中在40℃/75%rh下储存20个月或36个月时,活性药剂的n-氧化物以本文所公开的水平存在,例如以基于组合物的重量计小于1重量%的水平存在。在一些情况下,当组合物在密封的直立透明玻璃小瓶中在40℃/75%rh下储存20个月或36个月时,活性药剂的n-氧化物以相对于储存前的初始水平小于10倍,例如小于5倍、小于2倍或小于1.5倍的水平存在,例如以相对于储存前的初始水平为1倍至5倍或1倍至2倍的水平存在。
[0321]
在一些情况下,当组合物在密封的直立透明玻璃小瓶中在25℃/60%rh下储存20个月或36个月时,金属以本文所公开的水平存在,例如以小于5ppm的水平存在。在一些情况下,当组合物在密封的直立透明玻璃小瓶中在40℃/75%rh下储存20个月或36个月时,金属以本文所公开的水平存在。
[0322]
在一些情况下,当组合物在密封的直立透明玻璃小瓶中在25℃/60%rh下储存20个月或36个月时,水以本文所公开的水平存在,例如以基于组合物的重量计小于0.5重量%的水平存在。在一些情况下,当组合物在密封的直立透明玻璃小瓶中在40℃/75%rh下储存20个月或36个月时,水以本文所公开的水平存在。
[0323]
在一些情况下,当组合物在密封的直立透明玻璃小瓶中在25℃/60%rh下储存20个月或36个月时,乙酸苄酯以本文所公开的水平存在,例如以小于100mg/ml的水平存在。在一些情况下,当组合物在密封的直立透明玻璃小瓶中在25℃/60%rh下储存20个月或36个月时,乙酸苄酯以相对于储存前的初始水平小于20倍或小于15倍的水平存在,例如以相对于储存前的初始水平为1倍至20倍或2倍至15倍的水平存在。
[0324]
在一些情况下,当组合物在密封的直立透明玻璃小瓶中在40℃/75%rh下储存20个月或36个月时,乙酸苄酯以本文所公开的水平存在,例如以小于100mg/ml的水平存在。在一些情况下,当组合物在密封的直立透明玻璃小瓶中在40℃/75%rh下储存20个月或36个月时,乙酸苄酯以相对于储存前的初始水平小于20倍或小于15倍的水平存在,例如以相对于储存前的初始水平为1倍至20倍或2倍至15倍的水平存在。
[0325]
在一些情况下,当组合物在密封的直立透明玻璃小瓶中在25℃/60%rh下储存20个月或36个月时,异丁酸苄酯以本文所公开的水平存在,例如以小于50mg/ml的水平存在。在一些情况下,当组合物在密封的直立透明玻璃小瓶中在25℃/60%rh下储存20个月或36个月时,异丁酸苄酯以相对于储存前的初始水平小于20倍,例如小于10倍,或小于8倍的水平存在,例如以相对于储存前的初始水平为1倍至10倍或2倍至8倍的水平存在。
[0326]
在一些情况下,当组合物在密封的直立透明玻璃小瓶中在40℃/75%rh下储存20个月时,异丁酸苄酯以本文所公开的水平存在,例如以小于50mg/ml的水平存在。在一些情况下,当组合物在密封的直立透明玻璃小瓶中在40℃/75%rh下储存20个月时,异丁酸苄酯以相对于储存前的初始水平小于20倍,例如小于10倍,或小于8倍的水平存在,例如以相对于储存前的初始水平为1倍至10倍或2倍至8倍的水平存在。
[0327]
在一些情况下,当组合物在密封的直立透明玻璃小瓶中在25℃/60%rh下储存20个月或36个月时,乙酸异丁酸蔗糖酯以本文所公开的水平存在,例如以基于组合物的重量计30重量%至80重量%的水平存在。在一些情况下,当组合物在密封的直立透明玻璃小瓶中在40℃/75%rh下储存20个月时,乙酸异丁酸蔗糖酯以本文公开的水平存在,例如,以基于组合物的重量计30重量%至80重量%的水平存在。
[0328]
合适的药剂包括局部或全身作用的药物活性剂,其可以通过局部或病灶内施用(包括例如施用于擦伤的皮肤、撕裂伤、穿刺伤等,以及外科伤口或切口中)或通过注射,例如皮下、皮内、肌内、眼内或关节内注射施用于受试者。合适的药剂包括多糖、dna和其它多核苷酸、反义寡核苷酸、抗原、抗体、疫苗、维生素、酶、蛋白质、天然存在的或生物工程改造的物质等、抗感染药(包括抗生素、抗病毒药、杀真菌剂、杀疥螨剂或灭虱剂)、防腐剂(例如苯扎氯铵、苄索氯铵、葡萄糖酸氯己定、醋酸磺胺米隆、甲苄索氯铵、呋喃西林、硝甲酚汞等)、类固醇(例如雌激素、孕激素、雄激素、肾上腺皮质激素等)、阿片类药物(例如丁丙诺啡、布托啡诺、地佐辛、美普他酚、纳布啡、羟吗啡酮和喷他佐辛)、治疗多肽(例如胰岛素、促红细胞生成素、形态发生蛋白如骨形态发生蛋白等)、镇痛药和抗炎药(例如阿司匹林、布洛芬、萘普生、酮咯酸、cox-1抑制剂、cox-2抑制剂等)、抗精神病药(例如吩噻嗪类,包括氯丙嗪、三氟丙嗪、美索达嗪、哌西他嗪和硫利达嗪;噻吨类,包括氯普噻吨等)、抗血管生成剂(例如康普瑞汀(combresiatin)、康托他汀(contortrostatin)、抗vegf等)、抗焦虑剂(例如苯二氮类,包括地西泮、阿普唑仑、氯硝西泮、奥沙西泮;和巴比妥类)、抗抑郁药(包括三环类抗抑郁药和单胺氧化酶抑制剂,包括丙咪嗪、阿米替林、多塞平、去甲替林、阿莫沙平、反苯环丙胺、苯乙肼等)、兴奋剂(例如哌醋甲酯、多沙普仑、尼可刹米等)、麻醉剂(例如丁丙诺啡、吗啡、哌替啶、可待因等)、镇痛解热剂和抗炎剂(例如阿司匹林、布洛芬、萘普生等)、局部麻醉剂(例如酰胺类或酰苯胺类局部麻醉剂,如布比卡因、左布比卡因、地布卡因、甲哌卡因、普鲁卡因、利多卡因、丁卡因、罗哌卡因等)、生育控制剂、化学治疗剂和抗肿瘤剂(例如氮芥、环磷酰胺、5-氟尿嘧啶、硫鸟嘌呤、卡莫司汀、洛莫司汀、美法仑、苯丁酸氮芥、链脲佐菌素、甲氨蝶呤、长春新碱、博来霉素、长春碱、长春地辛、放线菌素、柔红霉素、多柔比星、他莫昔芬等)、心血管和抗高血压药(例如普鲁卡因胺、亚硝酸戊酯、硝酸甘油、普萘洛尔、美托洛尔、哌唑嗪、酚妥拉明、咪噻吩、卡托普利、依那普利等)、用于治疗肺部疾病的药物、抗癫痫药(例如苯妥英、乙妥英等)、止汗剂、角质促成剂、色素沉着剂或润肤剂、止吐剂(例如昂丹司琼、格拉司琼、托烷司琼、甲氧氯普胺、多潘立酮、东莨菪碱、帕洛诺司琼等)。本技术的组合物还可应用于其他局部作用活性剂,例如收敛剂、止汗剂、刺激剂、发红剂、起疱剂、硬化剂、腐蚀剂、苛性剂、角质层分离剂、防晒剂和多种皮肤病药,包括美白祛斑剂和止痒剂.
[0329]
在一些情况下,活性药剂以按组合物重量计0.5至20%、1至8%、2至6%、2至5%或1至5%的量存在。在一些情况下,活性药剂以基于组合物的重量计1重量%至25重量%,例
如5重量%至20重量%、10重量%至15重量%或约12重量%的量存在于组合物中。
[0330]
在一些情况下,所述组合物包括“卡因(caine)”类别的酰胺-或酰苯胺类局部麻醉剂和非甾体抗炎药(nsaid),以及相关方法,例如用于治疗术后疼痛或用于预防性治疗疼痛的方法。
[0331]
如本文所用,术语“麻醉剂”意指提供可逆的局部麻痹、疼痛缓解、阻断沿着神经轴和其它可兴奋膜的冲动传导,例如疼痛路径(传入和/或传出)的局部阻断、痛觉缺失和/或麻醉的任何试剂。参见,例如strichartz,g.r.(编)local anesthetics,handbook of experimental pharmacology,第81卷,springer,berlin/new york,(1987)。该术语还包括当局部施用时提供感官知觉和/或运动功能d局部(区域性)完全或部分抑制的任何试剂。适合用作麻醉剂的常用药剂的实例包括但不限于安布卡因、阿莫拉酮、戊卡因、丁氧普鲁卡因、苯甲醇、苯佐卡因、贝托卡因、苯柳胺酯、布比卡因、布他卡因、氨苯丁酯、布坦卡因、丁胺卡因、丁氧卡因(butoxycaine)、卡替卡因、氯普鲁卡因、可卡乙碱、可卡因、环甲卡因、地布卡因、奎尼卡因、二甲卡因、地哌冬、达克罗宁、芽子定(ecogonidine)、芽子碱(ecogonine)、依替卡因、尤普罗辛、非那可明、福莫卡因、己卡因、羟基丁卡因、异布宁(isobuanine)、对氨基苯甲酸异丁酯、亮氨卡因、左布比卡因、左沙屈尔、利多卡因、甲哌卡因、美普卡因、美布卡因、氯甲烷、桃金娘卡因、纳依卡因、奥他卡因、奥索卡因、羟乙卡因、parenthoxycaine、非那卡因、苯酚、哌罗卡因、匹多卡因、聚多卡醇、丙吗卡因、丙胺卡因、普鲁卡因、丙泮卡因、丙美卡因、丙哌卡因、丙氧卡因、假可卡因、吡咯卡因、罗哌卡因、水杨醇、丁卡因、托利卡因、美索卡因、赛罗卡因、佐拉敏,其麻醉活性衍生物、类似物和任何药学上可接受的盐,以及它们的任何混合物。
[0332]
本文优选使用酰胺和酯类局部麻醉剂。酰胺类局部麻醉剂的特征在于具有酰胺官能团,而酯类局部麻醉剂含有酯官能团。优选的酰胺类局部麻醉剂包括利多卡因、布比卡因、丙胺卡因、甲哌卡因、依替卡因、罗哌卡因和地布卡因。优选的酯类局部麻醉剂包括丁卡因、普鲁卡因、苯佐卡因和氯普鲁卡因。在一种情况下,酰胺类局部麻醉剂选自布比卡因、罗哌卡因、左布比卡因、地布卡因、甲哌卡因、普鲁卡因、利多卡因和丁卡因。最优选的局部麻醉剂是布比卡因。
[0333]
在一些情况下,活性药剂的降解可以导致2,6-二甲基苯胺的形成。例如,活性药剂可以是选自布比卡因、利多卡因、罗哌卡因、依替卡因、甲哌卡因、吡咯卡因或其盐中的至少一种。
[0334]
麻醉剂以中性形式、游离碱形式或药学上可接受的盐形式提供在组合物中。如本文所用,术语“药学上可接受的盐”是指保留中性麻醉剂的生物有效性和特性并且在其它方面不是药学用途不可接受的那些盐。药学上可接受的盐包括酸性或碱性基团的盐,所述基团可以存在于麻醉剂中。那些本质上为碱性的麻醉剂能够与各种无机酸和有机酸形成各种盐。适用于本发明的碱性麻醉剂的药学上可接受的酸加成盐是形成无毒酸加成盐的那些,即包含药理学上可接受的阴离子的盐,例如盐酸盐、氢溴酸盐、氢碘酸盐、硝酸盐、硫酸盐、硫酸氢盐、磷酸盐、酸式磷酸盐、异烟酸盐、乙酸盐、乳酸盐、水杨酸盐、柠檬酸盐、酒石酸盐、泛酸盐、酒石酸氢盐、抗坏血酸盐、琥珀酸盐、马来酸盐、龙胆酸盐、富马酸盐、葡糖酸盐、葡糖二酸盐(glucaronate)、蔗糖酸盐、甲酸盐、苯甲酸盐、谷氨酸盐、甲磺酸盐、乙磺酸盐、苯磺酸盐、对甲苯磺酸盐和双羟萘酸盐(即,1,1'-亚甲基-双-(2-羟基-3-萘甲酸盐))。除了上
述酸之外,包括氨基部分的麻醉剂可以与各种氨基酸形成药学上可接受的盐。合适的碱盐可由形成无毒盐的碱形成,例如铝、钙、锂、镁、钾、钠、锌和二乙醇胺盐。参见,例如,berge等(1977)j.pharm.sci.66:1-19。
[0335]
麻醉剂提供持续局部麻醉状态的能力是指主题药剂建立局部(区域性)完全或部分抑制感官知觉和/或运动功能的可评价状态的能力。本领域技术人员将容易想到用于进行这种评估的许多方法和工具。对于非人动物受试者,这些方法包括测量测试大鼠的自发运动(使用例如可商购获得的设备和软件,来自med associates inc.,st.albans,vt),其中可以收集测试受试者的总移动距离、走动计数、刻板动作、饲养、在各种运动中花费的时间和在静止时花费的时间的数据;大鼠针刺反应的可视化;和大鼠热板缩足模型,例如根据iacuc第9511-2199号中详细描述的方法。
[0336]
关于特定麻醉剂的选择,技术人员还将认识到,每种候选药剂的药理学性质将例如关于麻醉作用的起效和强度、持续时间等变化。某些药剂可以提供温和的麻醉作用,具有相当快的活性起效,但是持续时间短。这样的药剂可以与组合物一起使用,以便提供“初始麻醉作用”,其中它们通常与提供“持续局部麻醉”的不同麻醉剂配对,其特征在于更平缓的活性起效,但是更强的作用和更长的持续时间之一。可用于提供初始麻醉作用的麻醉剂的实例是苯甲醇。可用于提供持续局部麻醉的麻醉剂的实例是布比卡因。可用于提供初始麻醉作用的其它药剂可包括通常用作溶剂和/或渗透剂的有机材料,例如乙醇、二甲亚砜、n-甲基吡咯烷酮、聚乙二醇和某些脂肪酸酯。这些和其它类似的药剂可以提供非常温和的初始麻醉作用,例如,当应用时,它们可以使组织部位冷却或以其它方式使组织部位不敏感/麻木,从而部分地抑制该部位处的感官知觉。每当使用药剂以提供初始麻醉效果时,以足以提供主题效果的量在合适的组合物中提供药剂,并且以使得药剂能够从组合物快速释放以提供预期效果的方式提供药剂。当与本说明书提供的指导和教导结合时,这种合适的组合物(含有提供初始麻醉作用的药剂)的组装在本领域技术人员的能力范围内。
[0337]
在某些情况下,提供了一种组合物,其包括两种麻醉剂,第一麻醉剂和第二麻醉剂,其中所述第二麻醉剂是所述第一麻醉剂的溶剂。在这些特定组合物中,第二麻醉剂通常用于提供初始麻醉作用,并且第一麻醉剂用于提供特征为持续局部麻醉的后续麻醉作用,其在施用于受试者的2小时内起效而没有初始突释,并且在施用后持续至少24小时或甚至更长。在某些优选的情况下,所述第一麻醉剂提供在施用的1至2小时内起效的持续局部麻醉,并且在其他优选的情况下,所述第一麻醉剂提供在施用的30分钟至1小时内起效的持续局部麻醉。在某些其它情况下,第二麻醉剂也是持续释放载体系统的溶剂。
[0338]
组合物中麻醉剂的浓度还将取决于该特定药剂的吸收、失活和排泄速率,以及本领域技术人员已知的其它因素。应当注意,剂量值也将随着待缓解的病症的严重性而变化。还应理解,对于任何特定的受试者,应根据个体需要和施用或监督组合物施用的人员的专业判断随时间调整具体的剂量方案,并且本文所述的浓度范围仅是示例性的,并且不旨在限制要求保护的组合物的范围或实践。该组合物可以以一个剂量施用,或者可以分成多个较小剂量以在不同的时间间隔顺序或同时施用。
[0339]
相对于组合物的总重量(重量%),一种或多种麻醉剂通常以0.1至99.5重量%、0.5至70重量%或1%至50重量%的范围存在于组合物中。然而,可以使用具有低至40%、30%、20%或10%的上限的范围,也可以使用具有高至5%、3%或2%的下限的范围。对于非
常具活性的麻醉剂,该范围可以小于1重量%,并且可能小于0.0001%。
[0340]
在组合物的制备中,当一种麻醉剂至少部分溶解于另一种溶剂药剂中时,该麻醉剂将充当本文另一种麻醉剂的溶剂。此外,麻醉剂溶剂以足以提供初始麻醉作用和至少部分溶解其它麻醉剂的量存在于组合物中。在某些情况下,第二麻醉剂因此以相对于组合物的总重量(重量%)的95至1重量%的量存在,或以75至10重量%的量存在,或以50至15重量%的量存在。
[0341]
可以使用许多合适的麻醉剂,其也充当其它麻醉剂的溶剂。合适的试剂包括芳族醇、酸和酸衍生物,以及它们的组合。可用作另外的麻醉剂的溶剂的特别优选的麻醉剂是苯甲醇。
[0342]
在一些情况下,本技术的组合物中使用的持续释放载体系统被归类为非聚合物载体。药学上可接受的非聚合物载体通常是生物相容的,优选是可生物降解的、可生物侵蚀的或生物可吸收的。如果一种物质及其任何降解产物在施用于活组织时不产生显著的、有害的或不利的作用,也不引起实质性的组织刺激或坏死,则该物质是生物相容的。本文可互换使用的“生物可降解的”或“生物可侵蚀的”是指主题非聚合材料将在体内降解或侵蚀以形成较小的化学物质,其中这种降解可由例如酶促、化学和物理过程引起。“生物可吸收的”是指给定的非聚合物材料可以在动物受试者体内被分解和吸收,例如被细胞、组织等分解和吸收。
[0343]
在一些情况下,非聚合物载体材料用于以这种方式控制至少一种麻醉剂从组合物中的释放,以提供持续的局部麻醉,其在施用的2小时内开始并且持续至少24小时或更长。在一些情况下,非聚合物载体材料包含hvlcm(例如乙酸异丁酸蔗糖酯),其以足以提供活性药剂从组合物中的持续释放,例如约72小时的持续释放的量存在于组合物中。在一些组合物中,非聚合物载体材料足以提供至少一种麻醉剂的一级持续释放曲线或假零级释放曲线。因此,相对于组合物的总重量(重量%),非聚合物载体以99.5至1重量%的量,或以95至10重量%的量,或以75至25重量%的量存在于组合物中。在一些情况下,非聚合物载体包含高粘度液体载体材料(hvlcm),例如乙酸异丁酸蔗糖酯,其基于组合物的重量计以30重量%至80重量%,例如40重量%至70重量%、50重量%至70重量%、60重量%至70重量%、61重量%至69重量%、62重量%至68重量%、或63重量%至67重量%的水平存在。
[0344]
使用本技术和说明书提供的教导和指导,合适的非聚合物载体的选择在本领域的一般技术范围内。例如,本领域技术人员可以获得许多药学上可接受的非聚合物载体系统,以制备液体、喷雾剂、乳膏剂、洗剂、软膏剂、凝胶、浆液、油、乳剂、微乳剂、固体、硬膏剂、薄膜、颗粒、微粒、粉末或其它合适形式的药物组合物。这些和其它载体系统描述于例如remington's pharmaceutical sciences,第16版,1980和第17版,1985,二者均由mack publishing company,easton,pa出版。
[0345]
组合物可进一步包括一种或多种另外的组分,例如药学上可接受的赋形剂材料,其可充当分散剂、填充剂、粘合剂、载体、稳定剂、助流剂、抗氧化剂、ph调节剂、抗刺激剂、增稠剂、流变改性剂、乳化剂、防腐剂等。技术人员将理解,某些赋形剂材料可以在任何特定制剂中起到上述功能中的几种。因此,任何数量的合适的赋形剂材料可以与组合物混合或掺入组合物中,以提供膨胀性质,改变活性剂释放速率,增加或阻止水吸收,控制ph,提供结构支持,促进制备过程和本领域技术人员已知的其它用途。术语“赋形剂”通常指无毒且不以
有害方式与组合物的其它组分相互作用的基本上惰性的材料。特定赋形剂可存在于组合物中的比例取决于提供赋形剂的目的和赋形剂的特性。
[0346]
例如,也可以充当活性剂的稳定剂的合适赋形剂包括药物级的右旋糖、蔗糖、乳糖、海藻糖、甘露醇、山梨醇、肌醇、葡聚糖等。因此,这种稳定剂可以是糖类,例如单糖、二糖、多糖或糖醇。其它合适的赋形剂包括淀粉、纤维素、磷酸钠或磷酸钙、硫酸钙、柠檬酸、酒石酸、甘氨酸及其组合。可以加入以减慢水合和溶解动力学的疏水性赋形剂的实例包括脂肪酸及其药学上可接受的盐(例如,硬脂酸镁、硬脂酸、硬脂酸锌、棕榈酸和棕榈酸钠)。
[0347]
在组合物中使用带电脂质和/或洗涤剂赋形剂也是有用的。合适的带电脂质包括但不限于磷脂酰胆碱(卵磷脂)等。洗涤剂通常为非离子、阴离子、阳离子或两性表面活性剂。合适的表面活性剂的实例包括,例如,和表面活性剂(union carbide chemicals and plastics);聚氧乙烯山梨糖醇酐,例如表面活性剂(atlas chemical industries);聚山梨酸酯;聚氧乙烯醚,例如brij;药学上可接受的脂肪酸酯,例如月桂基硫酸酯及其盐;两亲性表面活性剂(甘油酯等);以及类似的材料。
[0348]
可以加入其它赋形剂材料以改变孔隙度,例如,诸如蔗糖、右旋糖、氯化钠、山梨醇、乳糖、聚乙二醇、甘露醇、果糖、聚乙烯吡咯烷酮或其适当组合的材料。另外,麻醉剂或药剂可以用油(例如芝麻油、玉米油、植物油、大豆油、蓖麻油、花生油)或其与磷脂(例如卵磷脂)或中链脂肪酸甘油三酯(例如miglyol 812)的混合物分散以提供油性悬浮液。
[0349]
可掺入到组合物中的其它赋形剂材料包括各种缓冲液含量的稀释剂(例如tris-hcl、乙酸盐);ph和离子强度改变剂;添加剂,例如抗氧化剂(例如抗坏血酸、谷胱甘肽、焦亚硫酸钠);防腐剂(例如,硫柳汞(thimersol)、苯甲醇、对羟基苯甲酸甲酯、对羟基苯甲酸丙酯);和分散剂,例如水溶性多糖(例如甘露醇、乳糖、葡萄糖、淀粉)、透明质酸、甘氨酸、纤维蛋白、胶原和无机盐(例如氯化钠)。
[0350]
在一些情况下,非聚合物载体基本上不溶于水或含水生物系统。示例性的这种非聚合物载体材料包括但不限于:甾醇,例如胆固醇、豆甾醇、β-谷甾醇和雌二醇;胆固醇酯,例如硬脂酸胆固醇酯;c
12-c
24
脂肪酸,例如月桂酸、肉豆蔻酸、棕榈酸、硬脂酸、花生酸、山嵛酸和二十四烷酸;c
18-c
36
单、二和三酰基甘油酯,例如单油酸甘油酯、单亚油酸甘油酯、单月桂酸甘油酯、单二十二烷酸甘油酯、单肉豆蔻酸甘油酯、单癸烯酸甘油酯(glyceryl monodicenoate)、二棕榈酸甘油酯、二(二十二烷酸)甘油酯、二肉豆蔻酸甘油酯、二癸烯酸甘油酯、三(二十二烷酸)甘油酯、三肉豆蔻酸甘油酯、三癸烯酸甘油酯、三硬脂酸甘油酯及其混合物;蔗糖脂肪酸酯,例如蔗糖二硬脂酸酯和蔗糖棕榈酸酯;脱水山梨糖醇脂肪酸酯,例如脱水山梨糖醇单硬脂酸酯、脱水山梨糖醇单棕榈酸酯和脱水山梨糖醇三硬脂酸酯;c
16-c
18
脂肪醇,例如鲸蜡醇、肉豆蔻醇、硬脂醇和鲸蜡硬脂醇;脂肪醇和脂肪酸的酯,例如棕榈酸鲸蜡醇酯和棕榈酸鲸蜡硬脂醇酯;脂肪酸的酸酐,例如硬脂酸酐;磷脂,包括磷脂酰胆碱(卵磷脂)、磷脂酰丝氨酸、磷脂酰乙醇胺、磷脂酰肌醇及其溶血衍生物;鞘氨醇及其衍生物;鞘磷脂,例如硬脂基、棕榈酰基和二十三碳酰基鞘磷脂;神经酰胺,例如硬脂基神经酰胺和棕榈酰神经酰胺;鞘糖脂;羊毛脂和羊毛脂醇;以及它们的组合和混合物。某些优选的非聚合物载体包括胆固醇、单硬脂酸甘油酯、三硬脂酸甘油酯、硬脂酸、硬脂酸酐、单油酸甘油酯、单亚油酸甘油酯和乙酰化单甘油酯。
[0351]
如果选择上述非聚合物载体材料之一用于组合物中,则通常将其与载体材料的相
容且合适的有机溶剂组合以形成稠度从水状到粘稠到可涂抹油灰或糊的组合物。组合物的稠度将根据诸如非聚合物载体在溶剂中的溶解度、非聚合物载体的浓度、麻醉剂的浓度和/或另外的麻醉剂、添加剂和赋形剂的存在等因素而变化。非聚合物载体在特定溶剂中的溶解度将根据诸如其结晶度、亲水性、离子特性和亲油性等因素而变化。因此,可以调节溶剂中非聚合物载体的离子特性和浓度以获得期望的溶解度。优选的非聚合物载体材料是具有低结晶度、非极性特性并且更疏水的那些。
[0352]
用于组合物的合适的有机溶剂通常是生物相容的、药学上可接受的并且将至少部分溶解非聚合物载体的那些。有机溶剂还具有从混溶到可溶到可分散的在水中的溶解度。在某些情况下,选择溶剂以使得其能够在水性系统中从组合物原位扩散、分散或浸出,并且进入施用部位处存在的流体中,从而形成固体植入物。优选地,该溶剂的希尔德布兰德溶解度参数为9-13(cal/cm3)
1/2
。优选地,该溶剂的极性程度有效地提供至少5%的水溶解度。
[0353]
因此,合适的有机溶剂包括但不限于:取代的杂环化合物,例如n-甲基-2-吡咯烷酮(nmp)和2-吡咯烷酮(2-pyrol);碳酸和烷基醇的酯,例如碳酸丙二醇酯、碳酸乙烯酯和碳酸二甲酯;脂肪酸,例如乙酸、乳酸和庚酸;单、二和三羧酸的烷基酯,例如乙酸2-乙氧基乙酯、乙酸乙酯、乙酸甲酯、乳酸乙酯、丁酸乙酯、丙二酸二乙酯、戊二酸二乙酯、柠檬酸三丁酯、琥珀酸二乙酯、三丁酸甘油酯、肉豆蔻酸异丙酯、己二酸二甲酯、琥珀酸二甲酯、草酸二甲酯、柠檬酸三甲酯、柠檬酸三乙酯、柠檬酸乙酰基三丁酯、三乙酸甘油酯;烷基酮,例如丙酮和甲基乙基酮;醚醇,例如2-乙氧基乙醇、乙二醇二甲醚、四氢呋喃聚乙二醇醚和甘油缩甲醛;醇,例如乙醇和丙醇;多羟基醇,例如丙二醇、聚乙二醇(peg)、甘油(丙三醇)、1,3-丁二醇和异亚丙基二醇(2,2-二甲基-1,3-二氧杂环戊二烯酮-4-甲醇);丙酮缩甘油(solketal);二烷基酰胺,例如二甲基甲酰胺、二甲基乙酰胺;二甲亚砜(dmso)和二甲基砜;四氢呋喃;内酯,例如ε-己内酯和丁内酯;环烷基酰胺如己内酰胺;芳香酰胺,例如n,n-二甲基-间甲苯甲酰胺和1-十二烷基氮杂环庚烷-2-酮;等等;以及它们的混合物和组合。优选的溶剂包括n-甲基-2-吡咯烷酮、2-吡咯烷酮、二甲基亚砜、乳酸乙酯、碳酸丙二醇酯、四氢呋喃聚乙二醇醚、甘油缩甲醛和异丙二醇。
[0354]
在一些情况下,有机溶剂以足以将活性药剂溶解在组合物中的量存在。例如,有机溶剂可以以基于组合物的重量计至少5重量%,如至少10重量%,至少15重量%,或至少20重量%的量存在于组合物中。有机溶剂可以以基于组合物的重量计5重量%至45重量%,例如10重量%至35重量%、15重量%至30重量%、20重量%至25重量%或约22重量%的量存在于组合物中。相对于组合物的总重量(重量%),有机溶剂可以以99.5至1重量%的量、以95至10重量%的量、以75至25重量%的量或以60至40重量%的量提供在组合物中,这取决于组合物中使用的所选非聚合物载体、有机溶剂、麻醉剂、添加剂和/或赋形剂。在某些情况下,当放置在生物系统中时,有机溶剂从组合物中扩散或浸出到水性介质中,由此非聚合物载体材料凝结形成固体基质。在某些情况下,当放置在生物系统中时,有机溶剂从组合物中扩散或浸出到水性介质中,由此非聚合物载体材料凝结形成半固体或凝胶。优选地,非聚合物载体在施用(植入)后1至5天内,优选1至3天内,优选2小时内原位固化以形成固体基质。
[0355]
在一些情况下,甘油三酯粘度降低剂以组合物的10重量%至50重量%、10重量%至35重量%、15重量%至30重量%、或20重量%至25重量%,或约15重量%、16重量%、17重量%、18重量%、19重量%、20重量%、21重量%、22重量%、23重量%、24重量%、25重量%、
27重量%、28重量%、29重量%、30重量%、31重量%、32重量%、33重量%、34重量%或35重量%的量存在。
[0356]
在一些情况下,非质子溶剂以组合物的10重量%至35重量%、10重量%至30重量%、10重量%至20重量%、10重量%至15重量%、或约2重量%、3重量%、4重量%、5重量%、6重量%、7重量%、8重量%、9重量%、10重量%、11重量%、12重量%、13重量%、14重量%,15重量%、16重量%、17重量%、18重量%、19重量%或20重量%的量存在。
[0357]
在一些情况下,提供了组合物,其中所述非聚合物载体为液体。液体非聚合物载体优选为非水溶性的高粘度液体载体材料(“hvlcm”),并且在37℃下具有至少5,000cp(和任选至少10,000、15,000、20,000、25,000或甚至50,000cp)的粘度,其在环境或生理条件下在纯净情况下(neat)不结晶。术语“非水溶性”是指在环境条件下可溶于水的程度小于1重量%的材料。术语“非聚合的”是指在酯的酸部分中基本上没有重复单元的酯或混合酯,以及具有酸部分的酯或混合酯,其中酸部分中的官能单元重复少量次数(即低聚物)。通常,在酯的酸部分中具有多于五个相同且相邻的重复单元或单体的材料被本文所用的术语“非聚合物”排除在外,但包含二聚体、三聚体、四聚体或五聚体的材料包括在该术语的范围内。当酯由可进一步酯化的含羟基羧酸部分如乳酸或乙醇酸形成时,重复单元的数目基于丙交酯或乙交酯部分的数目而不是基于乳酸或乙醇酸部分的数目计算,其中丙交酯重复单元含有被其相应的羟基和羧基部分酯化的两个乳酸部分,并且其中乙交酯重复单元含有被其相应的羟基和羧基部分酯化的两个乙醇酸部分。当该术语在本文所用时,在其醇部分中具有1至20个醚化的多元醇,或在其醇部分中具有1至10个甘油部分的酯被认为是非聚合的。
[0358]
在一种特定情况下,当与溶剂混合形成可使用标准医疗装置施用的低粘度液体载体材料(“lvlcm”)时,hvlcm的粘度降低,在一些情况下明显降低。lvlcm组合物通常比hvlcm组合物更容易置于体内,因为它更容易流入和流出注射器或其它植入装置。它也可以容易地配制成乳液。lvlcm可具有任何所需的粘度,但其粘度通常低于相应的hvlcm。例如,小于约6,000cp、小于约4,000cp、小于约1,000cp或小于200cp的lvlcm的粘度范围通常可用于体内应用。
[0359]
用于组合物中的特定hvlcm可以是一种或多种不同材料。合适的材料包括一种或多种羧酸的非聚合酯或混合酯。在特定情况下,酯由羧酸形成,所述羧酸用具有2至20个羟基部分的多元醇酯化,并且其可以包括1至20个醚化的多元醇。用于形成hvlcm的酯的酸部分的特别合适的羧酸包括具有一个或多个羟基的羧酸,例如通过内酯或环状碳酸酯的开环醇解或通过羧酸酐的醇解获得的那些。氨基酸也适于与多元醇形成酯。在特定情况下,酯或混合酯包含具有一个或多个末端羟基部分的醇部分,所述末端羟基部分已被通过羧酸酐如环酐的醇解获得的一种或多种羧酸酯化。
[0360]
可被酯化形成hvlcm的合适羧酸的非限制性实例包括乙醇酸、乳酸、ε-羟基己酸、丝氨酸和任何相应的内酯或内酰胺、三亚甲基碳酸酯和二氧杂环己酮。含羟基的酸本身可以通过其羟基部分与另外的羧酸的反应而进一步酯化,所述另外的羧酸可以与材料中的其它羧酸部分相同或不同。合适的内酯包括但不限于乙交酯、丙交酯、ε-己内酯、丁内酯和戊内酯。合适的碳酸酯包括但不限于三亚甲基碳酸酯和碳酸丙二醇酯。
[0361]
酯或混合酯的醇部分可衍生自具有2至20个羟基的多羟基醇,并且如上所述,可通过醚化1至20个多元醇分子形成。合适的醇部分包括通过从以下物质中除去一个或多个氢
原子而衍生的那些:单官能c
1-c
20
醇、双官能c
1-c
20
醇、三官能醇、含羟基的羧酸、含羟基的氨基酸、含磷酸酯的醇、四官能醇、糖醇、单糖和二糖、糖酸和聚醚多元醇。更具体地,醇部分可以包括以下中的一种或多种:十二烷醇、己二醇(更特别地1,6-己二醇)、甘油、乙醇酸、乳酸、羟基丁酸、羟基戊酸、羟基己酸、丝氨酸、atp、季戊四醇、甘露醇、山梨醇、葡萄糖、果糖、蔗糖、葡糖醛酸、含有1-10个甘油单元的聚甘油醚、含有1-20个乙二醇单元的聚乙二醇。
[0362]
在特定情况下,hvlcm的酯或混合酯的至少一个羧酸部分包含至少一个氧基部分,在甚至更特定的情况下,每个羧酸部分包含至少一个氧基部分。
[0363]
在另一特定情况下,酯或混合酯的羧酸部分中的至少一个含有2至4个碳原子。在甚至更特别的情况下,酯或混合酯的羧酸部分各自含有2-4个碳原子。
[0364]
在另一更特别的情况下,酯或混合酯的羧酸部分中的至少一个具有2-4个碳原子并含有至少一个氧基部分。在另一更特别的情况下,酯或混合酯的羧酸部分各自具有2-4个碳原子并含有至少一个氧基部分。
[0365]
在特定情况下,hvlcm可以是乙酸异丁酸蔗糖酯(saib)或糖醇部分与一个或多个链烷酸部分的一些其它酯。
[0366]
在特定情况下,hvlcm具有选自以下的结构:
[0367]
i:
[0368][0369]
其中r1、r2、r3、r4、r5、r6、r7和r8独立地选自氢、烷酰基、羟基取代的烷酰基和酰氧基取代的烷酰基;
[0370]
其中r1、r2、r3、r4、r5、r6、r7和r8中的至少三个不是氢;和
[0371]
其中当r1、r2、r3、r4、r5、r6、r7和r8选自乙酰基和异丁酰基时,r1、r2、r3、r4、r5、r6、r7和r8中的至少三个是乙酰基;
[0372]
ii:
[0373][0374]
其中r1、r2和r3独立地选自氢、烷酰基、羟基取代的烷酰基和酰氧基取代的烷酰基并且其中n在1和20之间;
[0375]
iii:
[0376]r1-o-(ch2)
n-o-r2[0377]
其中n是4至8之间的整数,并且r1和r2独立地选自氢、烷酰基、羟基取代的烷酰基和酰氧基取代的烷酰基;
[0378]
iv:
[0379][0380]
v:
[0381][0382]
其中在式iv和v中,r1、r2、r3、r4和r5独立地选自氢、烷酰基、羟基取代的烷酰基和酰氧基取代的烷酰基;
[0383]
vi:
[0384][0385]
vii:
[0386][0387]
其中在式vi和vii中,r1、r2、r3、r4、r5和r6独立地选自氢、烷酰基、羟基取代的烷酰基和酰氧基取代的烷酰基;
[0388]
viii:
[0389][0390]
其中r1、r2、r3和r4独立地选自氢、烷酰基、羟基取代的烷酰基和酰氧基取代的烷酰基。
[0391]
在式i至viii的每一个中,烷酰基、羟基取代的烷酰基和酰氧基取代的烷酰基中的一个或多个可以包含具有2至6个碳原子的烷酰基部分,包括羰基碳。此外,在另一种更具体的情况下,式i至viii中的每一个都包含至少一个羟基取代或酰氧基取代的烷酰基部分。在甚至更具体的情况下,这些羟基取代或酰氧基取代的烷酰基部分中的至少一个包含具有2至6个碳原子的烷酰基部分,包括羰基碳。
[0392]
根据术语“酰基”的普遍接受的定义,形成hvlcm的酰氧基取代基的酰基可以是衍生自羧酸的任何部分。更具体地,组合物的酰基可以是r9co-形式,其中r9是2-6个碳原子的任选氧基取代的烷基。这种氧基取代可以采取羟基取代的形式,或用另外的酰基部分取代。例如,r9可以是氧基取代的羧酸的低聚物,通过一种酸的羟基和另一种酸的羧基之间的酯键连接。在一个更具体的实例中,r9可以包含1至5个丙交酯或乙交酯单元,其中丙交酯单元包含两个一起酯化的乳酸部分,乙交酯单元包含两个一起酯化的乙醇酸部分。供选择地,r9可以含有混合的丙交酯和乙交酯单元,或者在丙交酯或乙交酯单元不存在的情况下可以含有混合的乳酸和乙醇酸。
[0393]
具体的hvlcm材料包括根据式ii或iii的组分,其中r1、r2和r3独立地是乳酰基、聚乳酰基、ε-己酰基、羟基乙酰基或多羟基乙酰基,特别是聚乳酰基和ε-己酰基,或聚乳酰基和聚羟基乙酰基。
[0394]
在酯或混合酯中使用相对较小的链(2-6个碳原子)、氧基取代的羧酸部分是有利的。当这些酸部分以低聚酯的形式存在时(即,通过随后的羧基与之前的氧基的酯化,随后的酸部分与之前的酸部分连接),材料的水解比具有多于6个碳原子的低聚物明显更容易,因为材料更亲水。通常,对于药物递送,期望hvlcm为水不溶性的,但其可具有一定程度的亲水性。通常,预期用更亲水的单元(由更高的o:c比决定)合成的hvlcm会更快地吸收水,并更快地降解。例如,通过将4摩尔乙交酯共价连接到一摩尔甘油而制备的hvlcm将预期比通过将2摩尔乙交酯和2摩尔丙交酯共价连接到一摩尔甘油而制备的hvlcm更快地吸收水并更快地降解。基于自由体积论,对于更柔性的分子和对于更支化的球形分子,可预期类似的增加。使用柔性和支化分子还可具有降低lvlcm粘度的益处。使用具有不同链长的羧酸和/或多元醇以及使用具有氧基取代的羧酸允许精确控制所得酯的亲水性程度和溶解度。这些材料在体内足够耐溶解,使得它们能够使携带的麻醉剂持续释放到体内,伴随或随后氧键在体内水解。
[0395]
在甚至更特别的情况下,hvlcm不包括乙酸酯和异丁酸酯比例为2:6的蔗糖的乙酸酯和异丁酸酯。然而,乙酸酯与异丁酸酯部分的比例为2:6的乙酸异丁酸蔗糖酯包括在用于气溶胶制剂的范围内。该材料可以根据美国专利第2,931,802号中描述的程序制备。
[0396]
通常,合适的hvlcm酯可通过将形成所得酯的醇部分的一种或多种醇,特别是一种或多种多元醇与将形成所得酯的酸部分的一种或多种羧酸、内酯、内酰胺、碳酸酯或羧酸的酸酐反应制备。酯化反应可简单地通过加热进行,但在一些情况下可添加强酸或强碱酯化催化剂。供选择地,可以使用酯化催化剂如2-乙基己酸亚锡。在催化剂的存在或不存在下,在搅拌下加热加热的反应混合物,然后例如在真空下干燥,以除去任何未反应的起始材料并产生液体产物。乙酸异丁酸蔗糖酯可以通过遵循美国专利第2,931,802号中描述的程序制备。
[0397]
在这方面,多元醇可以被视为低聚引发剂,在这个意义上它提供羧酸酯化的底物,特别是丙交酯、乙交酯或其它酯化的羟基取代的羧酸的低聚物酯化的底物。
[0398]
在一些情况下,hvlcm可与降低粘度的溶剂混合形成较低粘度的液体载体材料(lvlcm),然后可在施用前将其与一种或多种待递送的麻醉剂混合。这些溶剂可以是水溶性的、非水溶性的或水可混溶的,并且可以包括丙酮、苯甲醇、苯甲酸苄酯、n-(β羟乙基)乳酰胺丁二醇、己内酰胺、己内酯、玉米油、癸基甲基亚砜、二甲醚、二甲亚砜、1-十二烷基氮杂环庚-2-酮、乙醇、乙酸乙酯、乳酸乙酯、油酸乙酯、甘油、四氢呋喃聚乙二醇醚(四甘醇)、肉豆蔻酸异丙酯、乙酸甲酯、甲基乙基酮、n-甲基-2-吡咯烷酮、(辛酸和/或癸酸与甘油或亚烷基二醇的酯,例如810或812(辛酸/癸酸甘油三酯)、818(辛酸/癸酸/亚油酸甘油三酯)、829(辛酸/癸酸/琥珀酸甘油三酯)、840(丙二醇二辛酸酯/癸酸酯))、油酸、花生油、聚乙二醇、碳酸丙二醇酯、2-吡咯烷酮、芝麻油、丙酮缩甘油(solketal)([
±
]-2,2-二甲基-1,3-二氧杂环戊烷-4-甲醇)、四氢呋喃、(二乙二醇单乙醚,卡必醇)、三醋精、柠檬酸三乙酯、邻苯二甲酸二苯酯及其组合。另外,如果组合物以气雾剂形式施用,例如用于局部施用,则溶剂可以是或可以包括一种或多种抛射剂,如cfc抛射剂如三氯氟甲烷和二氯氟甲烷,非cfc抛射剂如四氟乙烷(r-134a)、1,1,1,2,3,3,3-七氟丙烷(r-227)、二甲醚、丙烷和丁烷。
[0399]
特别合适的溶剂和/或抛射剂包括苯甲酸苄酯、苯甲醇、三醋精、柠檬酸三乙酯、二甲亚砜、乙醇、乳酸乙酯、甘油、四氢呋喃聚乙二醇醚(四甘醇)、n-甲基-2-吡咯烷酮、810、聚乙二醇、碳酸丙二醇酯、2-吡咯烷酮和四氟乙烷。
[0400]
其它可能的溶剂包括全氟萘烷、全氟三丁胺、甲氧氟烷、甘油缩甲醛、四氢糠醇、二甘醇二甲醚和二甲基异山梨醇。
[0401]
当组合物用作lvlcm以施用麻醉剂时,它应含有hvlcm可溶于其中的溶剂。在一些情况下,麻醉剂也可溶于溶剂中。在更进一步的情况下,所述溶剂是第一麻醉剂可溶于其中的第二麻醉剂。溶剂优选是无毒的,并且在另外的方面是生物相容的。
[0402]
在某些情况下,溶剂至少是水溶性的,以便其在施用时将迅速扩散到体液或其它水性环境中,导致组合物凝结和/或变得更粘稠。在一些情况下,溶剂不能与水或体液完全混溶,从而减慢了溶剂从组合物中扩散以及组合物粘度的相应增加。至少在某种程度上具有这种性质的合适溶剂包括苯甲酸苄酯、810、苯甲醇和柠檬酸三乙酯。苯甲醇是特别合适的,因为它也是麻醉剂。
[0403]
当1,6-己二醇或甘油的酯用作hvlcm时,一些可能的溶剂是乙醇、n-甲基吡咯烷
酮、碳酸异丙烯酯和peg 400。
[0404]
相对于组合物的总重量(重量%),溶剂通常以99.7重量%至0.5重量%、95重量%至1重量%、75重量%至10重量%、或50重量%至15重量%的量加入组合物中。溶剂通常以55重量%至10重量%的量存在于组合物中。
[0405]
在其它情况下,组合物包括与hvlcm不混溶的材料,以使当与hvlcm单独组合或与hvlcm的溶剂组合时,所得组合物形成乳液。这种乳液可以在分散相中包含hvlcm,例如在水或甘油中乳化的saib/混合物的情况下,或者它们可以包含hvlcm作为连续相的组分,例如在hvlcm中乳化的水溶液或hvlcm在水不混溶溶剂中的溶液的情况下。
[0406]
在一些情况下,递送溶媒或系统含有聚原酸酯聚合物和极性非质子溶剂。还公开了用于活性剂施用的低粘度递送系统。在一些情况下,低粘度递送系统包含聚原酸酯聚合物、极性非质子溶剂和含有甘油三酯粘度降低剂的溶剂。
[0407]
可用于本文提供的组合物的聚原酸酯通常由双烯酮缩醛和二醇的反应产生的交替残基组成,其中双烯酮缩醛衍生的每对相邻残基被反应的二醇的残基分开。聚原酸酯可以包含含α-羟基酸的亚单位,即衍生自α-羟基酸或其环二酯的亚单元,例如包含乙交酯、丙交酯或其组合的亚单元,即聚(丙交酯-共-乙交酯),包括丙交酯与乙交酯的所有比率,例如75:25、65:35、50:50等。这样的亚单元也称为潜在酸亚单元;这些潜在酸亚单元由于其末端羟基也属于本文所用的更通用的“二醇”分类。聚原酸酯可以按照例如美国专利第4,549,010号和第5,968,543号中所述制备。适用于本文提供的组合物的示例性聚原酸酯描述于美国专利第8,252,304号中。聚原酸酯可以是美国专利第8,252,305号和第10,213,510号中所述的类型和/或如其所述制备,这些专利通过引用整体并入本文。
[0408]
含α-羟基酸的亚单元r.sup.1的摩尔百分比通常为总二醇组分(如下提供的r.sup.1和r.sup.3)的0-20摩尔%。在一种或多种情况下,在聚原酸酯制剂中含α-羟基酸的亚单元的摩尔百分比为至少0.01摩尔%。在所述聚合物中含α-羟基酸的亚单元的示例性百分比为0至50摩尔%,或0至25摩尔%,或0.05至30摩尔%,或0.1至25摩尔%。例如,在一种情况下,在聚合物中含α-羟基酸的亚单元的百分比为0-50摩尔%。在另一种情况下,在聚合物中含α-羟基酸的亚单元的百分比为0-25摩尔%。在又一特定情况下,在聚合物中含α-羟基酸的亚单元的百分比为0.05-30摩尔%。在又一种情况下,在聚合物中含α-羟基酸的亚单元的百分比为0.1-25摩尔%。作为说明,含α-羟基酸的亚单元的百分比可以是0、1、2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、21、22、23、24、26、27、28、29或30摩尔%,包括其中的任何和所有范围,所述范围通过任何一个较低摩尔百分数与任何较高摩尔百分数的组合形成。
[0409]
示例性聚原酸酯具有1000da至200,000da的重均分子量,例如2,500da至100,000da或3,500da至20,000da或4,000da至10,000da或5,000da至8,000da。以da计的示例性的分子量为2500、5000、5500、6000、6500、7000、7500、8000、8500、9000、9500、10,000、20,000、30,000、40,000、50,000、60,000、70,000、80,000、90,000、100,000、120,000、150,000、175,000和200,000,以及其中的范围,其中示例性范围包括通过将如上所述的任何一种较低分子量与如上提供的任何一种相对于所选较低分子量更高的分子量组合而形成的那些。
[0410]
在与递送系统中的聚原酸酯相关的一个具体情况下,聚原酸酯的分子量为2,500道尔顿至10,000道尔顿。
[0411]
在一些情况下,聚原酸酯占组合物的40重量%至75重量%、40重量%至60重量%、45重量%至55重量%、65重量%至75重量%,或约40重量%、45重量%、50重量%、55重量%、60重量%、65重量%、70重量%或75重量%。
[0412]
在一些情况下,持续释放递送溶媒是半固体聚合物制剂形式的聚合物制剂,其包含聚原酸酯、酰胺类局部麻醉剂和非甾体抗炎药(nsaid)。在一些情况下,非甾体抗炎药(nsaid)是烯醇-酸nsaid。示例性烯醇-酸nsaid包括美洛昔康、吡罗昔康、替诺昔康、屈昔康、氯诺昔康和伊索昔康。在具体情况下,烯醇-酸nsaid是美洛昔康。
[0413]
在一些情况下,组合物包含:
[0414]-1-5重量%的布比卡因;
[0415]-0.005-0.125重量%美洛昔康;
[0416]-任选地,马来酸;
[0417]-5-12重量%二甲亚砜或n-甲基吡咯烷酮;
[0418]-10-40重量%的三醋精;以及
[0419]-55-67重量%聚原酸酯(例如,具有mw 2.5-10kda)。
[0420]
组合物中可以包含许多合适的添加剂,以赋予组合物选定的特性。例如,它们可以包含少量的可生物降解的热塑性聚合物,例如聚丙交酯、聚己酸内酯、聚乙交酯或其共聚物,以便提供更具粘附性的固体植入物或具有更大粘度的组合物,从而在其固化时将其保持在适当位置。这种热塑性聚合物公开于dunn等人的美国专利第4,938,763号中。
[0421]
任选地,成孔剂可以包含在组合物中。成孔剂可以是任何有机或无机的药学上可接受的物质,其基本上可溶于水或体液,并将在植入部位从非聚合物载体材料和/或植入物的固体基质消散到周围体液中。成孔剂优选不溶于有机溶剂中,以与非聚合物载体材料形成均匀的混合物。成孔剂还可以是快速降解成水溶性物质的水不混溶性物质。在某些组合物中,成孔剂与非聚合物载体和有机溶剂以混合物的形式组合。可用于该组合物的合适的成孔剂包括例如糖,如蔗糖和葡萄糖;盐,如氯化钠和碳酸钠;聚合物如羟丙基纤维素、羧甲基纤维素、聚乙二醇和聚乙烯吡咯烷酮等。优选提供确定孔径的固体晶体,例如盐或糖。
[0422]
如上所述,可以任选地将各种添加剂加入到组合物中以改变其性质,特别是改变组合物关于其中所含麻醉剂的释放性质。添加剂可以以足以赋予组合物期望特性的任何量存在。添加剂的用量通常取决于添加剂的性质和要实现的效果,并且可以由技术人员容易地确定。合适的添加剂描述于美国专利第5,747,058号中,其全部内容通过引用并入本文。更特别地,合适的添加剂包括水、可生物降解的聚合物、不可生物降解的聚合物、天然油、合成油、碳水化合物或碳水化合物衍生物、无机盐、bsa(牛血清白蛋白)、表面活性剂、有机化合物如糖和有机盐如柠檬酸钠。通常,与不含添加剂的相同组合物相比,添加剂的水溶性越低,即亲脂性越大,麻醉剂的释放速率将降低得越多。此外,可能需要包含提高组合物的性能如强度或孔隙率的添加剂。
[0423]
添加剂的加入也可用于延长麻醉剂的递送时间,使得组合物适用于需要或响应于长期施用的医学应用。在这方面,合适的添加剂包括美国专利第5,747,058号和第5,736,152号中公开的那些。特别地,用于该目的合适添加剂包括聚合物添加剂,例如纤维素聚合物和可生物降解的聚合物。合适的纤维素聚合物包括乙酸纤维素、纤维素醚和乙酸丁酸纤维素。合适的可生物降解的聚合物包括聚内酯、聚酸酐和聚原酸酯,特别是聚乳酸、聚乙醇
酸、聚己内酯及其共聚物。
[0424]
当存在时,添加剂通常以相对于组合物的总重量0.01重量%至20重量%,更特别地0.1重量%至20重量%的量存在于组合物中,并且更通常地以1、2或5重量%至10重量%的量存在于组合物中。某些添加剂,例如缓冲剂,在组合物中仅以少量存在。
[0425]
以下类别是可用于组合物中的添加剂类别的非限制性实例。
[0426]
一类添加剂是可生物降解的聚合物和低聚物。聚合物可用于改变待递送的麻醉剂的释放曲线,以增加组合物的完整性,或以其它方式改变组合物的性质。合适的可生物降解的聚合物和低聚物的非限制性实例包括:聚(丙交酯)、聚(丙交酯-共-乙交酯)、聚(乙交酯)、聚(己内酯)、聚酰胺、聚酸酐、聚氨基酸、聚原酸酯、聚氰基丙烯酸酯、聚(膦嗪)、聚(磷酸酯)、聚酯酰胺、聚二氧杂环己酮、聚缩醛、聚缩酮、聚碳酸酯、聚原碳酸酯、可降解的聚氨酯、聚羟基丁酸酯、聚羟基戊酸酯、聚亚烷基草酸酯、聚亚烷基琥珀酸酯、聚(苹果酸)、壳多糖、壳聚糖,以及上述材料的共聚物、三元共聚物、氧化纤维素或其组合或混合物。
[0427]
聚(α-羟基酸)的实例包括聚(乙醇酸)、聚(dl-乳酸)和聚(l-乳酸)以及它们的共聚物。聚内酯的实例包括聚(ε-己内酯)、聚(δ-戊内酯)和聚(γ-丁内酯)。
[0428]
虽然不希望受任何理论的束缚,但据信当组合物包含可生物降解的聚合物时,一部分聚合物可在组合物的表面沉淀或凝结,因为任何包含的溶剂在施用于受试者后扩散离开材料。因此,聚合物可以作为释放调节剂加入,以影响一种或多种麻醉剂的释放,或者可以作为含有预先形成的微球、植入物或磨碎的聚合物颗粒的组合物的一部分加入。聚合物的沉淀或凝结形成至少部分地包围这种组合物的液体芯(core)的外壳(skin)。该外壳是多孔的,并且允许溶剂继续扩散通过它进入周围组织。溶剂释放的速率和外壳形成的程度以及其孔隙率可以通过组合物中所用溶剂和聚合物的量和类型来控制。
[0429]
用于本发明组合物的其它添加剂是不可生物降解的聚合物。可用作添加剂的非侵蚀性聚合物的非限制性实例包括:聚丙烯酸酯、乙烯-乙酸乙烯酯聚合物、纤维素和纤维素衍生物、酰基取代的乙酸纤维素及其衍生物、非侵蚀性聚氨酯、聚苯乙烯、聚氯乙烯、聚氟乙烯、聚乙烯基(咪唑)、氯磺化聚烯烃、聚环氧乙烷和聚乙烯。
[0430]
优选的不可生物降解的聚合物包括聚乙烯吡咯烷酮、乙烯乙酸乙烯酯、聚乙二醇、乙酸丁酸纤维素(“cab”)和乙酸丙酸纤维素(“cap”)。
[0431]
可用于本发明组合物的另一类添加剂是天然和合成油和脂肪。源自动物或坚果的植物种子的油通常包括脂肪酸的甘油酯,主要是油酸、棕榈酸、硬脂酸和亚油酸。通常,分子中含有的氢越多,油就越稠。
[0432]
合适的天然和合成油的非限制性实例包括粗制或精制的植物油、花生油、中链甘油三酯、大豆油、杏仁油、橄榄油、芝麻油、茴香油、山茶油、玉米油、蓖麻油、棉籽油和大豆油,以及中链脂肪酸甘油三酯。
[0433]
脂肪通常是高级脂肪酸如硬脂酸和棕榈酸的甘油酯。这些酯及其混合物在室温下为固体,并显示晶体结构。猪油和牛油是实例。通常,油和脂肪增加非聚合物载体系统的疏水性,减慢降解和水吸收。
[0434]
任何上述持续释放递送系统可以配制成液体、喷雾剂、乳膏剂、洗剂、软膏剂、凝胶、浆液、油、乳剂、微乳剂、固体、硬膏剂、薄膜、颗粒、微粒、粉末或其它适合用于所述方法的适合形式的药物组合物。在这样的组合物中,麻醉剂(例如,第一麻醉剂)以足以向待治疗
的受试者递送有效量以实现期望的效果的量被包含。加入组合物中的麻醉剂的量取决于最终期望的释放持续时间和曲线,以及达到预期效果所需的麻醉剂浓度。
[0435]
可溶性和不溶性麻醉剂都可以使用非聚合物载体材料进行分布以用于持续递送。此外,组合物可以进一步与聚合物赋形剂一起配制,以提供具有改变的性质的递送基质,例如更快或更慢的降解速率。根据本领域已知的技术,所得组合物可以形成微球,或形成肉眼可见的植入物,或其它几何形状和尺寸。供选择地,可以将其中掺入了一种或多种麻醉剂的预成型微球、植入物或聚合物颗粒与非聚合物载体组合。
[0436]
微球可通过本领域已知的多种方法以及美国专利第6,291,013号和第6,440,493号中描述的方法制备。聚合物颗粒可以使用熔融挤出、制粒、溶剂混合、吸收等技术形成,或者麻醉剂可以被吸附到聚合物基质如离子交换树脂上。当与合适的非聚合物载体材料组合时,所得材料可以胃肠外施用。在其它情况下,麻醉剂可与非聚合材料如磷酸钙或蔗糖组合,以提供延长降解的分层/阻隔性质。然后非聚合物载体将形成第二屏障以提供增强的递送特性。根据所选应用的具体要求,非聚合物载体相可以含有或不含其它生物活性物质。这些其它生物活性剂可以是任何合适的治疗和/或预防药物,条件是加入的物质适于根据本领域已知的技术掺入微球或植入物中。
[0437]
所有上述组合物可用于本技术的方法中以在目标部位提供持续的局部麻醉。特别地,组合物可以配制成液体、喷雾剂、乳膏剂、洗剂、软膏剂、凝胶、浆液、油、乳剂、微乳剂、固体、硬膏剂、薄膜、颗粒、微粒、粉末或任何其它合适的药物组合物形式,然后通过局部、经眼、透皮、肠胃外(例如注射、植入等)或类似的递送技术施用于受试者。含有麻醉剂和药学上可接受的非聚合物载体的组合物用于提供麻醉作用,其特征在于在施用于受试者后的持续局部麻醉而没有初始突释,并且在施用后持续至少24小时,优选在施用后持续36至48小时,更优选在施用后持续48至72小时。在某些情况下,局部麻醉的开始发生在施用于受试者2小时内,优选在施用1小时内,并且在一些情况下在施用于受试者30分钟内。
[0438]
如本文所用,术语“受试者”是指期望提供局部麻醉状态的任何脊椎动物。因此,该术语广泛地指用本技术的组合物治疗的任何动物,例如鸟类、鱼类和哺乳动物,包括人。在一些情况下,只要长期的局部麻醉状态是方便的或期望的,本技术的方法就适于在兽医实践和畜牧业例如鸟类和哺乳动物中提供持续麻醉。在某些情况下,所述组合物特别适用于伴侣动物,例如狗或猫,并且另外可以用于马。在优选的情况下,术语“受试者”使指人类受试者。此外,术语“受试者”不表示特定年龄,并且因此组合物适合用于任何年龄的受试者,例如婴儿、青少年、成人和老年受试者。
[0439]
在优选的情况下,本技术的组合物特别适用于伤口的治疗。非聚合物载体系统允许使用非常简单的施用技术,例如将液体、喷雾剂、乳膏剂、洗剂、软膏、凝胶、浆液、油、乳液、微乳液、柔软的固体或硬膏剂、薄膜、颗粒、微粒或粉末组合物滴加、喷雾、涂抹、铺展、成型或以其它方式手动操纵进入伤口中,将一种或多种麻醉剂容易地施用到伤口(直接施用到伤口内和/或施用到伤口附近)。因此,该组合物可以用于任何大小或形状的伤口,并且将提供一种或多种麻醉剂在伤口的整个区域上的均匀分布,以便更好地保留和有效。可以使用这样的方法治疗的伤口可以从最浅表到深处、从表面到切口以及从外科手术(或其它考虑的)到意外的范围。如果要注射组合物,可以使用尾随注射(trailing injection)沿着伤口旁边在所有侧面或外边界将其施用于皮下间隙。也可采用组合方法,例如其中组合物既
直接置于伤口中,例如在手术闭合伤口之前,以及另外沿伤口放置。在特别优选的情况下,本技术的方法涉及使用本发明的组合物作为局部麻醉剂用于治疗术后切口疼痛。以这种方式使用本发明的组合物可以避免或至少减轻提供辅助治疗的必要性,例如施用全身麻醉性镇痛药以治疗这种术后疼痛。因此,所述组合物可以用于治疗伴随所有类型的医疗程序的术后疼痛,所述医疗程序例如大手术(例如开胸术、主动脉修复、肠切除术)、中型手术(例如剖腹产术、子宫切除术和阑尾切除术)和小手术(腹腔镜检查、关节镜检查和活检程序),否则所述疼痛可能使人虚弱并且可能需要在手术后3至5天进行疼痛治疗。在一些情况下,方法在经历关节镜肩峰下减压手术、腹腔镜手术、关节镜手术、活检手术、骨手术、整形手术、胸外科手术、软组织手术、胆囊切除手术、结肠直肠手术、结肠切除术、子宫切除术、阑尾切除术、囊炎切除术、痔切除术、剖腹产手术、全膝关节置换术、腹壁成形术、神经阻滞、疝修补术、疝气手术、腹股沟疝修补术、肝切除术、小肠切除术、胃切除术、脾切除术、胆囊切除术和结肠切除术中的至少一种的受试者中产生镇痛。
[0440]
因此,本文所述的组合物可以在本发明方法的实践中使用多种方法施用。例如,组合物可以局部、经眼、系统(例如,经粘膜(口服、直肠、阴道或鼻)、胃肠外(静脉内、皮下、肌内或腹膜内)等施用。组合物可以通过注射、灌注、喷雾浸渍、气溶胶或涂布涂药器施用。组合物的气溶胶或气雾可以使用气溶胶抛射剂施用,例如用于局部施用,或使用合适的喷雾器,例如用于鼻或口腔粘膜施用。
[0441]
优选地,组合物作为液体通过注射施用,或以气雾剂、糊剂或乳剂施用。当用于气雾剂时,气雾剂溶液中存在的任何溶剂通常在施用时蒸发,从而允许组合物作为薄膜形成。供选择地,可以在没有溶剂的情况下制备气雾剂或乳剂。在这种情况下,气溶胶抛射剂也可以用作溶剂。气雾剂或乳剂的形成可以使用本领域技术人员已知的技术来实现。参见例如,ansel,h.c.等,pharmaceutical doseforms and drug delivery systems,第六版(1995)。
[0442]
除了上述用途之外,本发明的组合物可以通过渗透泵施用。在一种情况下,装置被设计成植入受试者的组织中,并且被设计成随时间实现持续释放。
[0443]
也可以使用多孔或无孔的管来施用组合物,所述管理想地由挤出的可生物降解的聚合物制成。根据组合物的特性和期望的释放特征,可以制备具有不同程度的孔隙率的管。将组合物插入管中,管的末端可以保持开放,使生物活性化合物从管的末端扩散出来,或者可以用另外的多孔或无孔聚合物封闭。多孔端帽和多孔管允许活性化合物随着时间推移通过孔扩散。无孔端帽以及无孔管允许可溶于聚合物中的麻醉剂扩散通过它并进入周围组织。不是麻醉剂的溶剂但可生物降解的无孔材料在充分降解时将释放麻醉剂。组合物可以制备和储存为多组分体系,直到准备施用。不同组分的数目将部分取决于组合物的特性。在施用前,将各组分合并且混合,例如,以获得均匀的组合物,然后可以将其施用于受试者。溶剂或添加剂可以加入到一种或所有组分中,或者可以形成单独的组分,其在施用前也与其它组分混合。将组合物分离成多组分混合物允许优化每种组分的储存条件,并且使组分之间随时间的任何有害相互作用最小化。结果是提高了储存稳定性。
[0444]
实施例
[0445]
提供以下实施例仅用于说明性目的,而不是以任何方式限制本发明的范围。
[0446]
实施例1
[0447]
进行γ辐射剂量递增研究,其中遗传毒性降解物2,6-二甲基苯胺的水平作为辐射
剂量的函数增加。将制剂暴露于0、10、20或35kgy。制剂由12重量%布比卡因、66重量%saib和22重量%苯甲醇组成(“制剂a”)。
[0448]
如下所述,即使对产物进行低水平的辐射(10kgy)也会产生显著量的2,6-二甲基苯胺。
[0449]
摘要
[0450]
在10、20和35kgy的标称暴露下通过γ辐射最终灭菌后,制剂a显示颜色变化(浅黄色至黄色),主要降解物布比卡因n-氧化物从0.27%增加至0.43-0.53%,降解物2,6-二甲基苯胺(2,6-dma)从未检测到的水平增加至0.02-0.08%(或百万分之75-302,或75-302ppm),未知的药物相关降解物峰从2个峰增加至4-12个峰,而效力从98.9%降低至96.1-97.1%,如通过反相hplc所测定的。
[0451]
在25℃/60%rh和40℃/75%rh下监测制剂a在0、10、20和35kgy下的稳定性长达20个月。在25℃/60%rh下,制剂颜色继续从黄色变深到棕色,而在40℃/75%rh下变为更深的棕色。在25℃/60%rh下20个月后,不同照射组的hplc数据显示与相应的初始t=0时间点相比效力没有显著降低,布比卡因n-氧化物轻微增加(0.09-0.19%),2,6-dma无显著增加,降解物总量少量增加(0.09-0.17%)。与暴露在20和35kgy的制剂相比,对照制剂和暴露在10kgy中的制剂显示未知的检测到的峰数目略有增加。
[0452]
目的
[0453]
本研究的目的是评价不同暴露水平的γ辐射对制剂a稳定性的影响。γ辐射的目标标称剂量水平为10、20和35kgy,其中对照未被辐射(0kgy)。
[0454]
背景和介绍
[0455]
制剂a的组成是布比卡因碱/乙酸异丁酸蔗糖酯(saib)/苯甲醇(ba),比率分别为12/66/22%w/w。将未过滤的批次填充到200个小瓶中,用非硅化的teflon塞封盖,并用铝卷边密封件密封。将200个小瓶进一步分成四组,每组50个小瓶。一组不进行照射,其余三组分别通过γ辐射以10、20和35kgy最终灭菌。所有四组在直立位置下在25℃/60%rh和40℃/75%rh下稳定放置。暴露于与活性批次相似的γ辐射条件的安慰剂批次用于确定与赋形剂相关的那些杂质,因此将其排除在药物相关的降解物计算之外。
[0456]
通过目视方法和ep(欧洲药典)2.2.2(着色度)和通过hplc评价γ辐射剂量递增的效果。在25℃/60%rh下6和20个月,以及在40℃/75%rh下3和20个月,对稳定性样品进行测试。布比卡因/乙酸异丁酸蔗糖酯/苯甲醇的组合物在γ辐射之前显示浅黄色着色。通过ep2.2.2进行目视检查和表征,以评价组合物形成更深的黄色至棕色着色的程度。
[0457]
2,6-dma是潜在的遗传毒性降解物,其由原料药或药物产品通过布比卡因中酰胺键的水解而降解产生。由于2,6-dma表现出与布比卡因不同的响应因子(rf),因此应用其来自系统适应性(sys)溶液进样的相对响应因子(rrf)以通过峰面积归一化将2,6-dma%值转化成以相对于布比卡因碱的ppm表示的2,6-dma。
[0458]
范围
[0459]
在暴露于0kgy(对照)、10kgy(9.1
min-10.1
max
)、20kgy(19.2
min-22.0
max
)和35kgy(31.7
min-36.0
max
)水平的γ辐射后,产生制剂a的物理和化学稳定性数据。在25℃/60%rh和40℃/75%rh下测定未辐射和γ辐射的制剂a样品的稳定性,持续最长20个月。表征产物的视觉外观、视觉颜色、效力和降解产物。安慰剂小瓶在与活性物质相同的条件下储存并测
试,以确定可能在活性制剂a中形成的潜在赋形剂相关降解物。这些安慰剂赋形剂降解物被排除在制剂a的降解产物计算之外。
[0460]
设备、材料和分析方法
[0461]
本研究中所用的设备和材料列于下表1.1中。
[0462]
表1.1
[0463][0464]
结果和讨论
[0465]
外观(透明)
[0466]
在t=0和在25℃/60%rh和40℃/75%rh储存最长达20个月时,未照射和照射过的制剂a的溶液澄清度没有明显变化。
[0467]
着色度
[0468]
将制剂a暴露于不同的目标辐射水平(0、10、20和35kgy)。表1.2总结了由于γ辐射过程,以及在25℃/60%rh和40℃/75%rh下储存最长达20个月后制剂颜色变化的结果。
[0469]
表1.2.使用ep 2.2.2,暴露于0、10、20和35kgy的标称γ辐射水平,在25℃/60%rh
和40℃/75%rh下储存最长达20个月的制剂a的着色度目视检查
[0470][0471]1ep标准by系列颜色等级:by1(黄色)>by2(黄色)>by3(浅黄色)
[0472]2来自fluka的非compendias标准:bo=棕黄色,bx=深棕色。bx是比bo更深的颜色。
[0473]3将1个月的数据结果作为初始数据。
[0474]4经辐射的制剂a的颜色等级(by1):by1
35kgy
》by1
20kgy
》by1
10kgy
[0475]5在将小瓶取出并在环境温度下储存约2个月后进行。
[0476]
γ-辐射的影响
[0477]
结果表明,γ辐射使制剂中的颜色从浅黄色(未辐射制剂)增加到黄色(暴露于辐射),其中每种较高水平的辐射导致更深的黄色。
[0478]
在25℃/60%rh和40℃/75%rh下储存的效果
[0479]
对于所有4组制剂,在两种储存条件下着色度随时间增加,并且加速条件(40℃/75%rh)比在25℃/60%rh下更快地使制剂颜色变深。
[0480]
在储存20个月后:
[0481]
·
未辐射的制剂在25℃/60%rh下从浅黄色(by3)变成深黄色(>by1),在40℃/75%rh下变成深棕色(<bx)。
[0482]
·
10kgy暴露的制剂颜色在25℃/60%rh下从黄色(by1)变为棕色(<bo),在40℃/75%rh下变为深棕色(bx)。
[0483]
·
20kgy暴露的制剂的颜色在25℃/60%rh下从深黄色(>by1)变为棕色(<bo),在40℃/75%rh下变为深棕色(bx)。
[0484]
·
35kgy暴露的制剂在25℃/60%rh下从深黄色(>by1)变成棕色(bo),在40℃/75%rh下变成深棕色(bx)。
[0485]
效力
[0486]
γ辐射对制剂a稳定性的影响
[0487]
如表1.3所示,制剂a在t=0时的效力(ls%)受γ辐射影响。在0、10、20和35kgy的目标照射后,制剂a的ls%分别为98.9%、97.1%、96.1%和96.2%。
[0488]
表1.3.暴露于0、10、20和35kgy的标称γ辐射水平并通过hplc分析的制剂a的效力和降解产物稳定性测试
[0489][0490][0491]1标称的10kgy暴露的实际剂量范围为9.1至11.1kgy,标称的20kgy暴露为19.2至22.0kgy,标称的35kgy暴露为31.7至36.0kgy。
[0492]2ppm 2,6-dma的计算=%2,6-dma(通过面积归一化)
×
10000/相对响应因子(2.65)。测定hplc的该相对响应因子。注意该表中的结果以“ppm(相对于布比卡因)”表示。考虑到制剂a包含12重量%的布比卡因,为了从“ppm(对布比卡因)”换算为相对于总制剂的ppm,上述数值应乘以0.12。
[0493]
在25℃/60%rh和40℃/75%rh下的稳定性
[0494]
在25℃/60%rh下储存20个月后,与它们相应的t=0的ls%值相比较,未辐射的制剂a和三组辐射的制剂没有观察到ls%的显著变化。在40℃/75%rh下20个月后(商业产品将不在这些条件下储存),未辐射的制剂效力从98.9%降低至97.3%,而γ辐射的组没有显著的效力变化。
[0495]
降解产物
[0496]
t=0时对制剂a的辐射作用
[0497]
主要的降解物布比卡因n-氧化物是由布比卡因中的胺基的氧化形成的。表1.3列出了2,6-dma和布比卡因n-氧化物的量,以及对于所有四个制剂组由γ辐射过程产生的未知的检测到的峰的总数。
[0498]
2,6-dma
[0499]
结果显示对于未辐射的制剂a样品,通过hplc没有检测到2,6-dma。然而,随着辐射水平增加,平均2,6-dma%在10kgy暴露下增加至0.02%(75ppm),在20kgy暴露下增加至0.05%(189ppm),在35kgy暴露下增加至0.08%(302ppm)。
[0500]
布比卡因n-氧化物
[0501]
对于暴露于10、20和35kgy的样品,t=0时的辐射过程也使布比卡因n-氧化物%从0.27%分别提高到0.43%、0.51%和0.53%。通过将保留时间与真实物质进行匹配来确认布比卡因n-氧化物的存在。
[0502]
未知的检测到的峰的总数
[0503]
辐射过程将未知降解峰的总数(每个≤0.1%)从0kgy的2个峰分别增加至10、20和35kgy的4、9和12个峰。
[0504]
总降解产物
[0505]
辐射过程将总降解产物%从0.33%(未辐射的)增加到0.61%(10kgy暴露)、0.87%(20kgy暴露)和0.94%(35kgy暴露)。
[0506]
在25℃/60%rh下对制剂a稳定性的辐射作用
[0507]
2,6-dma
[0508]
在25℃/60%rh下最长达20个月,未在未辐射制剂a样品中检测到2,6-dma(表1.3)。在25℃/60%rh下稳定性研究最长达20个月的过程中,经辐射的样品中2,6-dma的水平没有显著变化。
[0509]
布比卡因n-氧化物
[0510]
在25℃/60%rh下储存20个月后,每组的布比卡因n-氧化物略微增加约0.1至0.2%(表1.3)。
[0511]
总降解产物
[0512]
在25℃/60%rh下20个月后,与t=0时的相应值相比,四组中每组的降解产物总量有约0.1至0.2%的不显著的增加。
[0513]
在40℃/75%rh下对制剂a稳定性的辐射作用
[0514]
2,6-dma
[0515]
在40℃/75%rh下3个月后,未辐射的制剂a样品没有可检测量的2,6-dma(表1.3)。在40℃/75%rh下20个月后,未辐射的样品具有0.01%(38ppm)的2,6-dma。对于三个经辐射的样品组,在40℃/75%rh下储存期间,2,6-dma比其相应的t=0值略微增加(0.01至
0.02%)。在40℃/75%rh下20个月后,2,6-dma的最终水平在暴露于10kgy的样品中为0.04%(151ppm),在暴露于20kgy的样品中为0.07%(264ppm),在暴露于35kgy的样品中为0.09%(340ppm)。
[0516]
布比卡因n-氧化物
[0517]
在40℃/75%rh下储存20个月后,主要降解物布比卡因n-氧化物在未照射样品中从0.27%增加至0.79%,并且在10kgy暴露样品中从0.43%增加至0.72%(表1.3)。在40℃/75%rh下20个月后,20和35kgy辐射的样品的布比卡因n-氧化物水平没有显著变化。
[0518]
总降解产物
[0519]
数据表明,在40℃/75%rh下20个月后,未辐射样品的总降解物%从0.33%增加到0.99%,10kgy辐射样品的总降解物%从0.61%增加到1.01%。在40℃/75%rh下20个月后,20kgy辐射的样品的总降解物保持相同,并且35kgy辐射的样品的总降解物似乎略有降低。
[0520]
20个月时的效力和降解产物
[0521]
还通过hplc分析在25℃/60%rh和40℃/75%rh下储存20个月的所有四组制剂a样品的效力和降解产物。通过hplc观察到四组制剂a中的ls布比卡因%、2,6-dma%、布比卡因n-氧化物%和总降解物%的类似趋势。
[0522]
结论
[0523]
γ辐射暴露水平和储存条件(温度和时间)影响了溶液着色度和制剂a的化学稳定性,制剂颜色从浅黄色(辐射前)变为黄色(辐射范围10-35kgy)和变为棕色/深棕色(在典型的稳定性储存条件下)。对于未辐射和辐射的样品,在25℃/60%rh和40℃/75%rh下在最长达20个月内观察到可接受的布比卡因效力稳定性(ls%)。γ辐射过程诱导潜在的遗传毒性降解物2,6-dma。
[0524]
实施例2
[0525]
通过以下方法无菌制备制剂a:
[0526]
1.将苯甲醇加入混合罐中并加热至40℃(不超过55℃)。
[0527]
2.在轻微涡旋下混合苯甲醇的同时,加入预先称重的布比卡因碱。
[0528]
3.混合时间不少于15分钟。
[0529]
4.将saib加热至约60℃(不超过93℃)。
[0530]
5.对saib称重。
[0531]
6.混合不少于45分钟。
[0532]
7.进行过程中效能和生物负荷测试。
[0533]
8.用氮气给罐加压,迫使混合物通过双串联的30
″
、0.22flm的灭菌级过滤器。
[0534]
9.将产物填充到10ml玻璃小瓶中。
[0535]
10.在氮气环境下用20mm塞子塞住小瓶。
[0536]
11.用20mm铝卷边帽盖住小瓶。
[0537]
12.检查每个小瓶。
[0538]
13.视情况进行标签和包装。
[0539]
如表2.1和表2.2所示,两批所得的制剂具有良好的稳定性。
[0540]
表2.1:稳定性数据
[0541]
制剂a,在25℃/60%rh和40℃/75%rh下储存(批号2.1,7.5ml)
[0542][0543][0544]
1.t=0时的数据是重复样品组的平均值。所有其它时间点是一组样本的平均值。
[0545]
2.报告平均值和单个测定值。
[0546]
3.报告降解物的平均值。赋形剂相关的降解产物(乙酸苄酯和异丁酸苄酯)未在该表中报告。未检测到(n.d.)。
[0547]
4.总降解产物基于所有单独降解物的总和为0.1%或更高。报告平均值。
[0548]
5.报告数值范围。
[0549]
表2.2:稳定性数据
[0550]
在25℃/60%rh和40℃/75%rh下储存的制剂a(批号2.2,5ml填充)
[0551][0552]
1.进行颗粒物质的重复测试,并报告单个值
[0553]
2.报告平均值和单个测定值。
[0554]
3.总降解产物基于所有单独降解物的总和为0.1%或更高。报告平均值。
[0555]
4.从10个小瓶报告数值范围。
[0556]
实施例3
[0557]
在氮气气氛下将制剂a填充到玻璃小瓶中。测试小瓶中顶空的氧含量。
[0558]
数据在lighthouse instruments顶空氧分析仪fms-760型上收集。数据的总结呈现在下表3.1中,其显示了每批的平均值、标准偏差和rsd%(以氧的重量%计)。bor是运行开始,mor是运行中间,eor是运行结束,指示在填充运行期间何时取出小瓶进行分析。
[0559]
表3.1
[0560][0561]
实施例4
[0562]
根据ich q1b工业指南“新原料药和产品的光稳定性测试”进行研究以确定制剂a的外观、液体的着色度和形成的降解产物,包括2,6-二甲基苯胺。
[0563]
实验
[0564]
遵循ich q1b指南的选项2用于加速光条件。选项2规定相同的样品应当暴露于冷白色荧光灯和近紫外灯。受控光源是:冷白色荧光灯,其设计成产生与iso 10977(1993)中所规定的类似的输出;和近uv荧光灯,其具有320nm至400nm的光谱分布,最大能量发射在350nm和370nm之间;相当大比例的uv应当在320-360nm和360-400nm的两个波段内。将样品暴露于光,提供不小于120万勒克斯小时的总照度和不小于200瓦小时/平方米的综合近紫外能量。将来自各批次的三组样品(各自彼此并排放置)暴露于以下加速光条件:
[0565]
1)未保护的小瓶,直接照射。
[0566]
2)保护的小瓶,用铝箔包裹。这些用作暗对照以评价热诱导变化对总观察变化的贡献。
[0567]
3)受保护的小瓶在二级容器或纸板盒中。这些纸板盒装有10个小瓶(2
×
5布局,具有分隔两排的塑料分隔物),并且由大约尺寸为2.25
×
2.25
×
5.625英寸、厚度为0.020英寸
的涂覆有白色粘土的刨花板构成。这些纸板盒来自royal paper box company,montebello,ca,该公司使用它们的candesce cis资本从clearwater paper corporation,spokane,w获得纸板材料。
[0568]
样品相对于光源水平放置。
[0569]
稳定性结果
[0570]
表4.1和4.2显示了两种不同批次的制剂a的光稳定性结果。表4.1和4.2中的数据显示,在未保护的小瓶中2,6-二甲基苯胺的量为36.1至54.1ppm,远超过10ppm的规格限度。用铝箔包裹的小瓶中含有0.4-0.6ppm的2,6-二甲基苯胺。纸板盒中的保护的小瓶含有1.4-1.7ppm的2,6-二甲基苯胺。
[0571]
在未保护的小瓶中布比卡因n-氧化物降解产物增加到0.2%,但在铝箔包装的和纸板储存的小瓶中保持低于定量限。
[0572]
在纸板盒中储存的小瓶中的平均布比卡因测定值比未保护的小瓶高1.0至1.2%。
[0573]
表4.1和4.2中的结果显示纸板盒能充分保护制剂a免受光诱导的降解,因此药物产品保持在规格内。
[0574]
表4.1.制剂a的光稳定性数据,批号4.1外观、液体着色度、测定、降解产物和2,6-二甲基苯胺测试结果
[0575]
[0576]
1.在开发期间改变接受标准。
[0577]
表4.2.制剂a的光稳定性数据,批号4.2外观、液体着色度、测定、降解产物和2,6-二甲基苯胺测试结果
[0578][0579]
制剂a应当避光,因为根据ich q1b的光稳定性测试已经显示2,6-二甲基苯胺增加。产品被包装在纸板盒中以提供避光保护。
[0580]
实施例5
[0581]
通过电化学检测测试制剂a的2,6-二甲基苯胺。为了分析,用含水缓冲液/甲醇/乙腈稀释剂将制剂的等分试样稀释250倍。在样品溶解后,将小等分试样转移至hplc小瓶中,以使用电化学检测器进行分析。
[0582]
进行了一系列实验,检查了琥珀色和红色玻璃器皿对2,6-二甲基苯胺参比标准稳定性的影响,使用电化学检测,在缓冲液/甲醇水溶液中浓度为3ng/ml。
[0583]
在实验1中,在透明无色玻璃100ml容量瓶中制备浓度为3ng/ml的2,6-二甲基苯胺。将等分试样转移到透明的hplc玻璃小瓶中,并对照外部标准进行测定。2,6-二甲基苯胺的3次进样始终接近3ng/ml。
[0584]
在实验2中,将在透明无色玻璃100ml容量瓶中制备的3ng/ml的2,6-二甲基苯胺溶液转移到琥珀色hplc小瓶中。从琥珀色玻璃hplc小瓶中进样的4个样品的2,6-二甲基苯胺含量比实验1的结果高大约8-12倍。
[0585]
在实验3中,在具有用于避光的ray-涂层的红色玻璃100ml容量瓶中制备浓度为3ng/ml的2,6-二甲基苯胺。将等分试样转移到透明的hplc玻璃小瓶中,并对照外部标准品进行测定。样品进样与实验1具有相同的2,6-二甲基苯胺的浓度值。
[0586]
在实验4中,将在涂有ray-的100ml红色玻璃容量瓶中制备的3ng/ml的
2,6-二甲基苯胺溶液转移到琥珀色hplc小瓶中。从琥珀色玻璃hplc小瓶中进样的样品具有比实验1和实验3中的结果高大约5倍的2,6-二甲基苯胺含量。
[0587]
这些实验的结论是,琥珀色玻璃hplc小瓶中有一些组分与2,6-二甲基苯胺反应,产生比2,6-二甲基苯胺溶液储存在透明玻璃hplc小瓶中时更高浓度的2,6-二甲基苯胺。
[0588]
表5.1.不同颜色玻璃器皿中储存的2,6-二甲基苯胺标准品的浓度
[0589][0590]1透明,无色,kimble玻璃容量瓶,目录号28014,由“33膨胀”低析出硼硅酸盐玻璃制造,符合usp 1型和astm e438 1型a类要求。
[0591]2透明,无色hplc小瓶来自thermo fisher scientific,目录号c40115w。
[0592]3琥珀色hplc小瓶来自agilent technologies,部件号:5182-0545。琥珀色hplc小瓶通过向透明无色玻璃中加入金属氧化物来制备。琥珀色和透明玻璃的典型组成参见表5.2。
[0593]4红色kimble玻璃容量瓶,目录号28016,由“33膨胀”低析出硼硅酸盐玻璃制造,符合usp 1型和astm e438 1型a类要求,然后ray-加工,这是一种提供用于光保护的一致、耐用和均匀涂层的专有技术。
[0594]
表5.2列出了来自waters corporation的透明和琥珀色玻璃hplc小瓶的典型组成。使用金属氧化物,特别是氧化铁和氧化钛,赋予玻璃琥珀色。琥珀色玻璃hplc小瓶中存在这些金属是分析测量的2,6-二甲基苯胺的量在琥珀色hplc小瓶中显著高于透明无色瓶的可能原因(表5.1中的实验2和4)。该实验的结果表明,保护产品避光(以减少杂质/降解物)的最好方式是将制剂填充到包装在盒子或纸板盒中的透明小瓶中,而不是将制剂填充到琥珀色玻璃小瓶中。
[0595]
表5.2.化学组成(主要成分以近似重量%表示)
[0596][0597]
实施例6
[0598]
发明内容
[0599]
本研究的目的是评价制剂a与来自west pharmaceutical services(west)的三种不同类型的涂层血清(coated serum)20mm,4432/50灰色氯丁基橡胶塞的相容性。本研究的结果支持选择在顶面和底面上涂覆的塞子,west部件号19700038(图号ws-792)。
[0600]
背景
[0601]
将制剂a填充到来自west(部件号10144806)的小瓶中,该小瓶用20mm teflon面4432/50灰色氯丁基橡胶血清塞(serum stopper)塞住,作为主要封闭系统的一部分。teflon面与制剂接触。制造过程是小规模的,并且塞子被手动插入小瓶中并卷边密封。这种塞子需要硅化以允许在商业设施的高速填充生产线中使用,因为塞子的顶部和边缘没有润滑。塞子的标准硅化工艺会将可萃取的硅油引入成品中,因为硅油很容易溶于制剂a。因此,评价了三种其它类型的来自west的耐化学塞子,它们更适合用于商业设备,并且由于它们在顶面和底面上具有各种涂层,因此不需要硅化。
[0602]
选择用于研究的第一个血清塞在两个表面上都涂有flurotec,west部件编号19700038(20mm,4432/50灰色氯丁基橡胶;图号ws-792)。在塞子的模制过程中,将flurotec膜施加到塞子的顶部(凸缘)和底部(插塞)表面上。flurotec膜提供了针对有机和无机塞子可析出物的有效屏障,以使药物制剂和封闭件之间的相互作用最小化。由改性的乙烯-四氟乙烯(etfe)共聚物制成的专有碳氟化合物膜也降低了药物产品的吸附。此外,flurotec膜的低表面能提供了足够的润滑性,使得不需要塞子的硅化,从而消除了潜在的污染源。
[0603]
本研究中使用的第二种和第三种血清塞子具有另一种可从west获得的涂层,称为b2涂层。b2涂层是施加到橡胶塞表面的可交联的高分子量聚二甲基硅氧烷涂层。b2涂层工艺使硅油向药物溶液中的转移最小化。它还消除了对常规硅化的需要以有利于产品的制备。在本研究中评估的b2涂覆塞子仅具有涂覆到最大水平(水平4)的顶面,而底面没有涂覆(水平0)。在本研究中用于描述施加到塞子上的涂层种类的west命名法是b2-40,将该b2-40涂层施加到底部(插塞)表面上具有teflon或flurotec涂层的塞子上。teflon和flurotec涂层是类似的,但不是相同的氟化共聚物。顶部具有b2-40、底部具有teflon的塞子是west部件号10144942(20mm,4432/50灰色氯丁基橡胶,图号ws-577),顶部具有b2-40、底部具有flurotec的塞子是west部件号19700022(20mm,4432/50灰色氯丁基橡胶,图号ws-791)。尽管可析出的硅油的量在b2工艺中显著降低,但仍有可测量的可析出物。因为塞子被批量洗涤和消毒,所以塞子顶部的b2-40涂层与其它塞子的底部随机接触。因此,硅油有可能转移到这些b2-40涂覆的塞子的flurotec和teflon插塞面上,并因此转移到产品内。
[0604]
实验方法
[0605]
制剂组合物和容器/封闭系统
[0606]
制剂a是用12%w/w的布比卡因碱、66%w/w的saib和22%w/w的苯甲醇制备的。将该批产物过滤并填充(各约8ml)到约600个1型110ml玻璃小瓶(schott为west制造,部件号68000320)中。
[0607]
用来自west的三种不同种类的20mm塞中的每一种塞住约200个小瓶。表6.1总结了每组包装产品的批次信息。铝卷边密封(west部件号54202059,durect代码3094,批号g0050和g0106)用于密封产品。为了模拟预期的无菌制造过程,没有通过γ辐射对填充的、带塞的小瓶进行最终灭菌。
[0608]
表6.1.制剂a包装批次和包装信息
[0609][0610]
稳定性程序
[0611]
每种塞子的九十三(93)个产品填充的小瓶被贴标签并包装在第二容器(瓦楞纸板盒)中,并在25℃/60%rh和40℃/75%rh下以倒置位置稳定放置。
[0612]
稳定性研究的分析测试包括外观、鉴定、效力和有关物质/降解产物。仅在初始时间点进行鉴定测试。
[0613]
在初始时间点,使用两个小瓶而不是三个小瓶进行测定和降解物测试。这不影响本研究中的数据质量。
[0614]
尽管本研究意图在25℃/60%rh下进行长达12个月的测试,但在分析6个月稳定性样品后停止该研究。在25℃/60%rh和40℃/75%rh下最长达6个月的稳定性数据被认为足以得出制剂a与三种不同塞子的相容性的结论。
[0615]
视觉外观测试仅在初始和1个月时进行,并且颗粒物质测试(usp《788》)仅在1和3个月时进行。在制备测定样品期间的实践是视觉上确认澄清溶液,不含颗粒。这些观察没有记录,因为它们是如预期的。
[0616]
在初始和1个月(25℃/60%rh和40℃/75%rh)加入使用棕黄色的ep 2.2.2颜色标准(by系列,来自fluka的2ml安瓿,部件号83952)的视觉颜色评估试验。1个月后停止该测试,因为样品颜色比在该组中最深的by1更深。由一个分析人员进行测试,由第二个分析人员确认视觉颜色评估。为了进行测试,将1ml制剂转移到1.8ml透明hplc玻璃安瓿中,并在环境实验室照明下在2ml玻璃安瓿中对照商业颜色标准进行测量。2ml标准品的安瓿的内径或光路长度(9.53mm)基本上与用于样品的1.8ml玻璃小瓶的内径或光路长度(10.03mm)相同。
[0617]
结果和讨论
[0618]
表6.2和6.3列出了三种不同类型的塞子的结果。测试包括视觉外观、ep 2.2.2(棕黄色,by系列)的溶液颜色、hplc的分析和降解物、显微镜检查的颗粒物质(usp《788》)。为了易于比较塞子数据,表6.4总结了平均ls布比卡因%、相对于初始值的剩余布比卡因%、布比卡因n-氧化物%和总降解物%。
[0619]
表6.2:制剂a的塞子在25℃/60%rh的稳定性数据
[0620][0621][0622]1澄清液体,不含颗粒物质,黄色至棕色。除了视觉外观测试之外,还使用by系列的ep颜色标准进行视觉颜色评估,并由第二分析人员验证。颜色结果仅供参考。
[0623]2a值<10表明没有检测到颗粒。
[0624]
表6.3.制剂a的塞子在40℃/75%rh的稳定性数据
[0625]
[0626]
[0627][0628]1澄清液体,不含颗粒物质,黄色至棕色。除了视觉外观测试之外,还使用by系列的ep颜色标准进行视觉颜色评估,并由第二分析人员验证。颜色结果仅供参考。
[0629]2来自3号小瓶的初始值是92.6%。由于这种偏离趋势的结果,从相同的小瓶准备另一个样品,得到98.1%的值。在3号小瓶的再测试期间,对两个新的小瓶取样并测试。因此总共测试了五个小瓶,其中两个样品来自3号小瓶。报告了来自五个小瓶的所有六个测定值,并且所得平均值为98.0%。
[0630]3a值<10表明没有检测到颗粒。
[0631]
表6.4.用三种不同种类的塞子包装的制剂a在25℃/60%rh和40℃/75%rh下长达6个月的化学相容性
[0632][0633]
外观和溶液颜色
[0634]
具有不同类型塞子的所有样品的视觉外观在初始时为“透明浅黄色液体”,在1个月时对于25℃/60%rh为“透明棕黄色液体”,在1个月时对于40℃/75%rh为“透明棕黄色液体”。使用ep 2.2.2by颜色标准(颜色从by7增加至by1),所有样品在初始时比by5深,在25℃/60%rh下1个月时它们是by3,并且在40℃/75%rh下1个月时它们是by2。产品的颜色作为储存温度和时间的函数而增加。不同类型的塞子不影响产品的视觉外观。
[0635]
颗粒物质
[0636]
通过显微镜方法(usp《788》)测试颗粒物质,在25℃/60%rh下3和6个月(表6.2)和在40℃/75%rh下1、3和6个月(表6.3)时的三种类型的塞子之间的数据是相似的。数据显著低于以下小体积肠胃外规格:≥10μm:≤3000个颗粒/小瓶,且≥25μm:≤300个颗粒/小瓶。
[0637]
分析和降解物
[0638]
在25℃/60%rh和40℃/75%rh下6个月后,每种类型的塞子的ls布比卡因%数据是相似的。对于每种塞子,布比卡因n-氧化物(主要产物降解物)在25℃/60%rh和40℃/
75%rh下随时间推移表现出类似的微小增加。在25℃/60%rh和40℃/75%rh下经过6个月,在rrt 0.24、0.28和0.30时的未知降解物分布对于所有三种类型的塞子都是相同的。
[0639]
总结于表6.4中的数据的综述表明,在塞子之间没有制剂稳定性的差异。
[0640]
结论
[0641]
总之,这三种塞子与制剂a具有相似的物理和化学性能。尽管b2-40方法是一种比常规硅化施加更受控、更少量的硅酮的方法,但是由于苯甲醇的存在,一些可析出的硅酮仍可能溶解在制剂中。因此,推荐采用flurotec/flurotec塞子,因为这将避免使用任何类型的硅酮,包括b2。
[0642]
实施例7
[0643]
如下测试乙酸异丁酸蔗糖酯的金属含量。样品是通过将0.1g称重的部分与2ml硝酸和0.5ml盐酸混合1小时,在设定为110℃的块消解器(block digestor)上制备的。冷却后,加入0.5ml的30%过氧化氢,继续消解30分钟(材料出现溶解)。冷却后,加入内标溶液,用纯水稀释至20g,得到icp-ms分析用溶液。
[0644]
结果如下所示:
[0645][0646]
[0647]
使用钢配混罐配混制剂a。用硅胶管转移制剂a。将制剂a填充到玻璃小瓶中,然后用碳氟化合物涂覆的塞子密封。
[0648]
如下测试制剂a的金属含量。样品用0.2g称重的部分与2ml硝酸、1ml盐酸和1ml氢氟酸混合制备,然后在密闭容器微波系统中消解(材料表现为溶解的)。冷却后,加入内标溶液,用纯水稀释至50g,得到用于icp-ms分析的溶液。
[0649]
结果如下所示:
[0650]
[0651][0652]
实施例8
[0653]
评价制剂a和安慰剂组合物的含水量。如上所述,本研究中的制剂a包括12%w/w布比卡因、66%w/w乙酸异丁酸蔗糖酯(saib)和22%w/w苯甲醇。安慰剂组合物由75%w/w乙酸异丁酸蔗糖酯(saib)和25%w/w苯甲醇组成。
[0654]
在制剂a和安慰剂组合物的无菌制备过程中使用的过滤器可包括残余含水量,导致组合物具有可检测量的水。为了确保所制备的布比卡因组合物中的含水量最小化或完全不存在,在无菌制备期间使用的过滤器是:1)通过用加压的无菌注射用水测量过滤器的泡点来测试完整性;2)用氮气在50psi下吹扫不少于5分钟以除去过滤器中的任何残余水;和3)布比卡因组合物(例如,含有12%w/w布比卡因或安慰剂组合物的制剂a)被冲洗通过过滤器,并弃去滤液。在本实施例中,在将样品组合物收集到小瓶中之前,将不少于6升的制剂a冲洗通过过滤器。
[0655]
评价在收集过程开始、中间和结束时收集的样品小瓶中的含水量。将收集的样品小瓶的含水量与通过过滤器冲洗的滤液中的布比卡因组合物的含水量进行比较。还比较了在之前的样品制备运行期间收集的来自样品小瓶的历史含水量。
[0656]
方法
[0657]
材料
[0658]
1)安慰剂组合物
[0659]
制备过滤器冲洗液(1l、2l、3l、4l、5l和6l)和来自运行开始、中间和结束的小瓶
[0660]
2)制剂a-样品1
[0661]
制备过滤器冲洗液(1l、2l、3l、4l、5l和6l)和来自运行开始、中间和结束的小瓶
[0662]
3)制剂a-样品2
[0663]
制备过滤器冲洗液(1l、2l、3l、4l、5l、6l、7l、8l、9l和10l);和来自运行开始、中间和结束的小瓶
[0664]
4)来自制剂a的小瓶:a1、b1、c1、d1、e1、f1、g1和h1以及i1。
[0665]
5)来自安慰剂组合物a的小瓶
[0666]
含水量测试
[0667]
样品按照usp《921》,方法1c,使用em science aquastar c3000库仑滴定仪进行测试。由于制剂的高粘度,样品在引入库仑滴定器之前需要用甲醇稀释。将约0.5g制剂a或安
慰剂组合物准确称量到10ml小瓶中。加入大约等量的甲醇,精确记录重量。如果已知诸如生产线冲洗液的样品具有大量的水,则按比例将更多的甲醇与样品混合。然后密封每个小瓶并剧烈摇动至少30秒。
[0668]
通过液体进样将约0.5g样品/甲醇混合物输送到库仑滴定器中。在进样之前和之后对用于输送样品的注射器称重以确定测定的量。
[0669]
结果
[0670]
安慰剂组合物
[0671]
表8.1总结了安慰剂组合物的6次1升制备过滤器冲洗液的含水量结果。通常1升冲洗液测试两次;结果非常一致。第一升产品冲洗液基本上全部是水。随后的冲洗液在第6升之前稳定地将含水量降低到大约0.58%。表8.2显示了从填充过程开始、中间和结束时收集的小瓶中的安慰剂组合物成品的含水量。每个小瓶均重复测定,结果非常一致。表8.2中的平均小瓶含水量结果在填充开始时为约0.35%,在填充中间时为0.19%,在填充结束时为0.30%。
[0672]
表8.1.通过卡尔-费歇尔滴定法测定的安慰剂组合物的制备过滤器冲洗液中的含水量
[0673][0674]
表8.2.通过卡尔-费歇尔滴定法测定安慰剂组合物样品中的含水量
[0675][0676]
制剂a-样品1
[0677]
表8.3总结了制剂a的6次1升制备过滤器冲洗液的含水量结果。测试以与安慰剂组合物相同的方式进行。第1升产品冲洗液基本上全部是水。随后的冲洗液在第6升之前稳定地将含水量降低到大约1.06%。表8.4显示了从填充过程的开始、中间和结束时收集的小瓶中的成品的含水量。表8.4中的平均小瓶含水量结果在填充开始时为约0.35%,在填充中间时为0.11%,在填充结束时为0.11%。
[0678]
表8.3.通过卡尔-费歇尔滴定法测定的布比卡因组合物-样品1的制备过滤器冲洗液中的含水量
[0679][0680]
表8.4.通过卡尔-费歇尔滴定法测定的持续释放的布比卡因组合物样品-样品1中
的含水量
[0681][0682][0683]
制剂a-样品2
[0684]
评估的目的是检查在最后一升冲洗液之间的含水量是否可以与来自填充过程开始时的小瓶中获得的值更一致。对于制剂a,样品2,氮气压力从50psi增加到55psi,并吹过过滤器不少于5分钟。另外,10升制剂冲洗通过过滤器,而不是如前面批次中的6升。
[0685]
制剂a,样品2的这10升冲洗液的含水量示于表8.5中。第1升冲洗液从大约2.41%的水开始。这与安慰剂组合物和制剂a样品1(分别为表8.1和8.3)的大于99%的水相反。样品2的过滤器的氮气吹扫步骤的增加的压力导致在将产物冲洗通过过滤器之前,在过滤器中的水更少。含水量随着冲洗次数稳定地降低,在第10次1升冲洗中检测到0.39%的水。表8.6显示了从填充过程的开始、中间和结束时收集的小瓶中的成品的平均含水量分别为0.20%、0.08%和0.06%。
[0686]
表8.5.通过卡尔-费歇尔滴定法测定的安慰剂组合物-样品2的制备过滤器冲洗液中的含水量
[0687][0688][0689]
表8.6.通过卡尔-费歇尔滴定法测定的制剂a-样品2中的含水量
[0690][0691]
尽管数据显示制备过程中的变化(增加的氮气压力和更大体积的产品冲洗液)在降低制剂a中的含水量方面是有效的,但是填充的小瓶的结果似乎实际上与先前的干燥过程没有不同。
[0692]
ich和先前临床批次的制剂a
[0693]
表8.7总结了先前制备的4个ich批次(每批5ml和7.5ml的填充量)和2个临床批次(制剂a和安慰剂)的含水量结果。这些批次是在50psi下用氮气吹扫过滤器不少于5分钟,用不少于6l的产物冲洗液制备的。测试来自每批的两个或四个小瓶。对于在测试时大约3-4年的这些历史批次,含水量%范围为大约0.13%至0.34%。
[0694]
表8.7.通过卡尔-费歇尔滴定法测定制剂a和安慰剂组合物中的含水量
[0695][0696]
结论
[0697]
为了降低或完全消除制剂a中的含水量,氮气吹扫压力可以从50psi增加至55psi,持续不少于5分钟,或直到不再观察到水。在小瓶填充步骤之前,冲洗通过过滤器的组合物的总量推荐保持不小于6升。
[0698]
实施例9
[0699]
将制剂a的主要稳定性和支持稳定性批次在36个月、25
°
/60%rh下的着色度与生产日期后约52个月时测定的含水量进行比较,以观察这两个参数之间是否存在相关性。此外,将临床批次的制剂a在36个月、25
°
/60%rh时的着色度与生产后34个月测定的其含水量进行比较。
[0700]
方法
[0701]
材料
[0702]
1)制剂a-主要稳定性样品:ps-a,ps-b,ps-c和ps-d(5ml填充)
[0703]
2)制剂a-支持稳定性样品:ss-a,ss-b,ss-c和ss-d(7.5ml填充)
[0704]
3)制剂a-临床样品:cs-a
[0705]
含水量测试
[0706]
样品按照usp《921》,方法1c,使用em science aquastar c3000库仑滴定仪进行测试。由于制剂的高粘度,样品在引入库仑滴定器之前需要用甲醇稀释。将大约0.5g制剂a准确称入10ml小瓶中。加入大约等量的甲醇,精确记录重量。然后密封每个小瓶并剧烈摇动至少30秒。通过液体进样将约0.5g样品/甲醇混合物输送到库仑滴定器中。在进样之前和之后对用于输送样品的注射器称重以确定测定的量。每个ich稳定性批次测试两个小瓶的含水量,同时测试来自制剂a临床样品cs-a的四个小瓶。
[0707]
液体的着色度
[0708]
在36个月时间点对制剂a的主要稳定性样品组合物、制剂a的支持稳定性样品组合物和制剂a的临床样品组合物进行样品测试。测定直立和倒置储存的样品的颜色。制剂a临床样品cs-a的小瓶仅倒置储存。
[0709]
结果
[0710]
表9.1总结了持续释放布比卡因组合物在36个月时间点时的液体着色度结果,这些样品以倒置和直立方向在25℃/60%rh下储存。还包括仅以倒置方向存储36个月时的样品cs-a的颜色数据。组合物之间的颜色结果是类似的,其中大多数结果在5x by1和6x by1之间。制剂a的颜色结果表明,小瓶在储存期间的方向对颜色没有影响。制剂a临床样品cs-a描述为6
×
by1。
[0711]
表9.1包括在36个月稳定性时间点进行颜色评价后约16个月测量的制剂a的组合物的含水量。制剂a的组合物的含水量范围为约0.13%至0.34%。此外,在36个月时间点测定颜色之前大约2个月,测量制剂a临床样品cs-a的含水量。制剂a临床样品cs-a具有约0.13%的水。
[0712]
图1描述了表9.1中每个样品的含水量和着色。如图1所示,在大约0.15%的水下,颜色范围从4x-5x by1到6x by1;在大约0.23%的水下,颜色范围从5
×
by1到6
×
by1;以及在大约0.34%的水下,颜色范围从5x by到5x-6x by1。
[0713]
基于图1所示和表9.1中总结的结果,制剂a的颜色随着含水量在约0.13%至0.34%的范围内增加而不变深。
[0714]
表9.1.在25℃/60%rh下倒置和直立储存36个月时通过卡尔-费歇尔滴定法测定制剂a中的含水量和液体着色度数据
[0715][0716][0717]
实施例10
[0718]
评价来自乙酸异丁酸蔗糖酯或苯甲醇的过氧化物对制剂a和安慰剂组合物的作用。本研究中的制剂a包含12%w/w布比卡因、66%w/w乙酸异丁酸蔗糖酯(saib)和22%w/w苯甲醇,如上所述。安慰剂组合物由75%w/w乙酸异丁酸蔗糖酯(saib)和25%w/w苯甲醇组成。在缓慢释放布比卡因组合物中的布比卡因n-氧化物可以通过布比卡因和过氧化物之间的氧化反应形成。
[0719]
方法
[0720]
通过涉及碘量滴定的电位滴定法测定几批乙酸异丁酸蔗糖酯的过氧化物含量。制剂a样品中的布比卡因n-氧化物水平是使用hplc以及uv检测来测定的。初步稳定性样品组合物、临床样品和制剂a的两种优化样品组合物以150l的规模制备。用于加热研究的样品以2.5l的规模制备。加热研究评估制备期间温度的影响。
[0721]
结果
[0722]
表10.1列出了在25℃/60%rh下稳定性的制剂a中的布比卡因n-氧化物的水平和用于制备制剂a样品的saib组合物中的过氧化物含量。表10.1中的布比卡因n-氧化物数据是每组样品的最长可用稳定性时间点。这些范围从制剂a和制剂a的临床样品的两个优化批次的3个月到四个主要稳定性样品(每个填充到5ml和7.5ml)的36个月。
[0723]
表10.1.用于制备制剂a样品和n-氧化布比卡因的saib中过氧化物含量的相关性
[0724][0725][0726]
表10.2总结了来自评价制备期间温度影响的加热研究的过氧化物含量的结果。
[0727]
表10.2.在优化批次和加热研究中的用于制备制剂a样品的saib的过氧化物含量和布比卡因n-氧化物
[0728][0729]
图2说明拟合成saib过氧化物含量数据对布比卡因n-氧化物水平数据的线性回归线。基于线性回归方程,估计布比卡因n-氧化物的1.0%规格极限对应于saib中296.4ppm过氧化物。为了确保布比卡因n-氧化物不超过1.0%的限度,可以将目标过氧化物含量调节至对应于0.8%布比卡因n-氧化物的值。使用图2中的等式计算出该过氧化物含量值为232.5ppm。
[0730]
为了测定可能由苯甲醇中的过氧化物杂质产生的布比卡因n-氧化物的分数,检查了用于制备表10.3中所列的制剂a的样品的苯甲醇批次。表10.3列出了苯甲醇组合物及其测定的过氧化值(pv)。所有苯甲醇组合物的过氧化值均小于0.5。通过pv乘以17,可以将过氧化值转化为以过氧化氢表示的过氧化物含量。这导致所有苯甲醇批次的过氧化物含量数据<8.5ppm。由于制剂a的样品含有比例为1:3w/w的苯甲醇和saib,因此有助于将布比卡因氧化成布比卡因n-氧化物的苯甲醇的有效过氧化物含量为saib的过氧化物含量的三分之一。通过这种计算,表10.3中所列制剂a样品中所用的每批苯甲醇对布比卡因n-氧化物形成的贡献实际上<2.8ppm(8.5ppm除以3等于2.8ppm)。苯甲醇对过氧化物含量的最大贡献是85ppm除以3,或28ppm。
[0731]
表10.3.用于制备制剂a样品的苯甲醇的过氧化物含量
[0732][0733]
实施例11
[0734]
研究了不同批次的制剂a的稳定性。这些示例性批次的结果总结在表11.1和11.2以及图3-11中。使用hplc和uv检测测定本研究中制剂a的样品的稳定性。
[0735]
检测制剂a(5ml)样品的光稳定性。表11.1和11.2中表征并总结了制剂a的四个不同的样品批次(11a-11c)。在三种不同条件下研究制剂a的每一种样品的光稳定性:1)未光保护;2)使用箔进行光保护;和3)光保护和包装。每个测试样品所显示的颜色以及样品的着色度总结在表11.1和11.2中。此外,表11.1和11.2总结了标签规格以及测试样品中乙酸苄酯和异丁酸苄酯的存在。
[0736]
图3描绘了在36个月的时间内,4个第一批(5ml)和4个第二批(7.5ml)制剂a样品的标签规格。在25℃的温度和60%相对湿度下测量每个样品的标签规格。
[0737]
图4描绘了在36个月的时间内,制剂a的4个第一批(5ml)和4个第二批(7.5ml)样品中,布比卡因n-氧化物的存在的变化(以布比卡因n-氧化物%计)。在25℃的温度和60%相对湿度下测量每个样品中布比卡因n-氧化物的量。
[0738]
图5描绘了在18个月的时间(18-36个月)内,制剂a的4个第一批(5ml)和4个第二批(7.5ml)样品中2,6-二甲基苯胺的存在(以ppm计)。对在25℃的温度和60%相对湿度下储存的每个样品测量样品中2,6-二甲基苯胺的量。图6描绘了在3个不同温度(25℃、30℃和40℃)和2个不同相对湿度(60%rh、75%rh)下储存6个月的制剂a样品中2,6-二甲基苯胺的存在。
[0739]
图7描绘了在36个月的时间内,在4个第一批(5ml)和4个第二批(7.5ml)制剂a样品
中乙酸苄酯的存在(以mg/ml计)。对在25℃的温度和60%相对湿度下储存的每个样品测量样品中乙酸苄酯的量。图8描绘了在3个不同温度(25℃、30℃和40℃)和2个不同相对湿度(60%rh、75%rh)下储存6个月的时间的制剂a样品中乙酸苄酯的存在。
[0740]
图9描绘了在36个月的时间内,在制剂a的4个第一批(5ml)和4个第二批(7.5ml)样品中异丁酸苄酯的存在(以mg/ml计)。对于在25℃的温度和60%相对湿度下储存的每个样品,测量样品中异丁酸苄酯的量。图10描述了在3个不同的温度(25℃、30℃和40℃)和2个不同的相对湿度(60%rh、75%rh)下储存6个月的时间的制剂a样品中异丁酸苄酯的存在。
[0741]
图11描述了在36个月的时间内,制剂a的4个第一批(5ml)和4个第二批(7.5ml)样品中saib百分比的变化。对于在25℃温度和60%相对湿度下储存的每个样品,测量制剂a样品的saib百分比的变化。
[0742]
表11.1制剂a-样品1的稳定性结果-光稳定性研究,5ml
[0743][0744][0745]1报告的平均(单个)结果
[0746]2光储存=加速光储存条件
[0747]3通过=透明的,基本上不含颗粒物
[0748]
表11.2制剂a的稳定性结果-样品2-5ml的光稳定性研究
[0749][0750][0751]1报告的平均(单个)结果
[0752]2光储存=加速光储存条件
[0753]3通过=透明的,基本上不含颗粒物
[0754]
实施例12
[0755]
具有不同量的saib和溶剂的布比卡因制剂的体外溶出曲线的比较(n=3或4)
[0756]
为了比较溶出曲线,如以下方法和材料中所述制备具有12%w/w布比卡因但具有不同的乙酸异丁酸蔗糖酯(saib)/溶剂比率的制剂,并进行测试。表12.1是所测试的制剂的
组成的总结。
[0757]
表12.1:每种测试制剂的布比卡因/saib/ba(目标%w/w)组合物
[0758][0759]
按照下列方法和材料中所述的方法,评价表12.1所示制剂的布比卡因体外释放。图12显示对照制剂(n=4)、-30%saib制剂(n=3)、-40%saib制剂(n=3)、-50%saib制剂(n=4)、-70%saib制剂(n=3)和-90%saib制剂(n=3)的平均累积释放。
[0760]
图12显示对照的累积释放曲线类似于-30%、-40%和-50%saib制剂的累积释放曲线。对照的累积释放曲线比-70%和-90%saib制剂的累积释放曲线更快。使用来自对照的平均溶出数据作为参照,计算-30%、-40%、-50%、-70%和-90%saib制剂的相似因子f2和差异因子f1。参见下文关于f1和f2因子的解释。如表12.2所示,-30%、-40%和-50%saib制剂具有f1和f2因子,表明它们相对于对照没有不同。
[0761]
表12.2:制剂相对于对照的差异(f1)和相似(f2)因子
[0762][0763]
具有不同量的saib和溶剂的布比卡因制剂的体外溶出曲线的比较(n=12)
[0764]
为了比较溶出曲线,如以下所述制备具有12%w/w布比卡因但具有不同的乙酸异丁酸蔗糖酯(saib)/溶剂比率的制剂,并进行测试。表12.3是所测试的制剂的组成的总结。
[0765]
表12.3:每种测试制剂的布比卡因/saib/ba(目标%w/w)组合物
[0766][0767]
按照下列方法和材料中所述的方法,评价表12.3所示制剂的布比卡因体外释放。图13显示对照制剂(n=12)、+20%saib制剂(n=12)、-20%saib制剂(n=12)和-70%saib制剂(n=12)的平均累积释放。
[0768]
图13显示对照的释放曲线与+20%和-20%saib制剂的释放曲线类似。对照的累积释放曲线比-70%saib制剂的累积释放曲线更快。使用来自对照的平均溶出数据作为参照,计算+20%、-20%和-70%saib制剂的相似因子f2和差异因子f1。参见下文关于f1和f2因子的解释。如表12.4所示,+20%和-20%saib制剂具有f1和f2因子,表明它们相对于对照没有不同。
[0769]
表12.4:制剂相对于对照的差异(f1)和相似(f2)因子
[0770][0771]
用可变加热制备的布比卡因制剂的体外溶出曲线的比较
[0772]
为了比较溶出曲线,按照以下方法和材料制备对照制剂和热应激saib制剂,并进行测试。对照和热应激saib制剂标称由12%w/w布比卡因、22%w/w苯甲醇和66%w/w saib组成。
[0773]
根据下述方法评价上述制剂的布比卡因的体外释放。图14显示对照制剂(n=12)和热应激saib制剂(n=12)的平均累积释放。
[0774]
图14中热应激saib制剂与对照的比较显示,两种制剂从1至18小时相似。从24小时开始,热应激saib制剂的释放曲线趋于稳定,在72小时达到约66%的药物释放。
[0775]
方法和材料
[0776]
布比卡因的体外累积释放
[0777]
布比卡因从制剂中的体外累积释放如下测定。
[0778]
材料
[0779]
除了热应激的制剂之外,布比卡因制剂通过将适量的布比卡因溶解在适量的苯甲醇(ba)中,加入适量的乙酸异丁酸蔗糖酯(saib),并在约35℃下搅拌不少于45分钟来制备,对于热应激的saib制剂,遵循相同的方法,除了在使用前将saib在225℃的烘箱中预热4小时。测试一部分预热的saib,发现剩余98%的saib。
[0780]
溶出度测试
[0781]
使用usp仪器ii测量溶出度。将约0.5ml的每种制剂通过套管负载,并注射到900ml
±
5ml的37
±
0.5℃溶出介质(ph 7.4
±
0.05的磷酸盐缓冲液,含有0.03%十二烷基硫酸钠)中。usp装置ii设定为50rpm,并在1、4、8、12、18、24、36、48和72小时收集样品。每个时间点每个样品的重复次数(n)如上所述变化。通过hplc测定收集的样品中布比卡因的含量。
[0782]
统计分析
[0783]
使用差异因子(f1)和相似因子(f2)方法(fda工业指南“立即释放固体口服剂型的溶出试验”1997年8月)进行溶出曲线比较。差异因子计算在每个时间点的两条曲线之间的百分比差异,并且是两条曲线之间的相对误差的度量,如等式1所示:
[0784]
f1={[∑
t=1n
│rt-t
t
│
]/[∑
t=1n r
t
]}x100
ꢀꢀꢀ
(1)
[0785]
在等式1中,r
t
和t
t
代表在每个溶出时间点t分别从参考和测试批次获得的平均溶出结果,而n代表溶出时间点的数目。
[0786]
相似因子(f2)是平方误差和的对数倒数平方根变换,并且是两条曲线之间的溶出百分比的相似性的量度,如等式2所示。
[0787]
f2=50 x log{[1+(1/n)∑
t=1n
(r
t-t
t
)2]-0.5
x100}
ꢀꢀꢀ
(2)
[0788]
等式2中的项如等式1中所定义。f2的值可在0至100的范围内,其中更大的f2表示参考与测试品之间的更大相似性。f2值为50对应于在每个时间点的10%的平均差异。
[0789]
对于被认为是相似的两条曲线,f1值应该接近0,并且f2值应该接近100。通常,0-15的f1值和50-100的f2值确保两条曲线的相同或等同,并因此确保测试和参考产品的性能相同或等同。
[0790]
实施例13
[0791]
进行随机、双盲、活性剂和安慰剂对照研究,以评价用于关节镜肩部手术后患者术后疼痛控制的制剂a的功效和安全性。
[0792]
目的
[0793]
目的是基于功效、药代动力学(pk)和安全性评价,确定用于术后疼痛控制的制剂a的最佳剂量,该制剂a施用于接受选择性关节镜肩部手术的患者的肩峰下间隙。
[0794]
方法
[0795]
该研究是制剂a的平行组、随机、双盲、活性剂和安慰剂对照的剂量反应试验,其中在经历选择性关节镜肩部手术的患者中进行疼痛强度(pi)、pk、安全性和健康经济学的术后评估,包括最长达14天的筛选期、7天的术后期、在第14天的eot访问和六个月后的随访。
[0796][0797][0798]
在手术前1至14天对患者进行筛选,此时获得知情同意。在第0天进行手术并施用试验药物,计划将试验分成两个连续队列,每个队列具有三个治疗组(a、b和c)。筛选后,第一名患者以2:1:1随机分配到队列1中的治疗组:1a)5ml制剂a(660mg布比卡因)肩峰下施用;1b)5ml安慰剂舌下施用;和1c)20ml标准盐酸布比卡因(hcl)0.25%w/v(50mg布比卡因)肩峰下施用。在队列1完成后,分析数据,并基于该临床试验报告(ctr)中呈现的效力、安全性和pk结果,作出关于是否将开始第二队列(队列2)以及是否将招募新患者并以更高剂量的制剂a治疗的决定:2a)7.5ml制剂a(990mg布比卡因)经肩峰下施用;2b)7.5ml安慰剂经肩峰下施用;和2c)20ml标准盐酸布比卡因(50mg布比卡因)经肩峰下施用。数据审查委员会推荐将剂量增加到7.5ml制剂a,预期不会提供临床上显著的功效改善。因此,该试验不包括7.5ml队列2。
[0799]
所有患者接受对乙酰氨基酚(4克/天;体重<66kg的前72小时2克/天)作为背景治疗。在没有获得足够的疼痛缓解的情况下,允许患者以静脉内或口服施用吗啡的形式服用救援药物,其包括每隔1小时口服吗啡10mg,或者如果不能耐受口服,以5分钟间隔静脉内(iv)施用吗啡2g。72小时后,根据需要给予受试者扑热息痛和口服吗啡。患者在电子日记(ediary)中记录疼痛强度以及救援药物。
[0800]
诊断和纳入/排除的主要标准:
[0801]
患有肩峰下撞击综合征和具有通过磁共振成像(mri)确定的完整肩袖并且适于全身麻醉的受试者有资格被纳入。排除具有其它肩部病理学的患者或具有严重医学病症的患者或不能耐受研究药物的患者。
[0802]
制剂a、剂量和施用方式:
[0803]
每瓶9.0ml制剂a(132mg布比卡因/ml)。手术后,通过关节镜入口之一或为了确认针尖在肩峰下间隙内的位置,通过在关节镜直视下穿过完整皮肤注射,将5ml制剂a(660mg布比卡因)(队列1)施用于肩峰下间隙。仅在手术完成后施用制剂a一次。
[0804]
参考组合物、剂量和施用模式:
[0805]
该试验是安慰剂对照的,具有活性比较臂(arm)。安慰剂(5ml)的施用方法与制剂a相同。活性比较物是标准盐酸布比卡因(20ml,2.5mg/ml),以单剂量肩峰下施用。
[0806]
评价标准
[0807]
功效
[0808]
主要:该研究具有两个主要终点。主要功效终点为:在手术后1至72小时的时间段内运动时pi的曲线下的面积auc,通过11点数值评定量表(nrs)测量;以及在手术后0至72小时,使用阿片类药物救援镇痛剂的总量。对于要满足的主要终点,需要显示运动时pi相对于安慰剂的非劣性以及阿片类药物镇痛的总应用的优势。通过治疗组和时间,使用连续变量的描述统计学,总结了nrs量表上报告的“运动时”pi。
[0809]
次要:首次使用阿片类救援药物的时间;手术后0至7天的阿片类药物相关症状窘迫量表(orsds)评分;在手术后1至72小时的静止时pi的auc;患者在手术后第4天的疼痛治疗满意度评分;在手术后第1、2、3、4和7天可出院的患者比例(根据麻醉后出院评分系统[pads]);以及到术后第14天恢复工作的患者的比例。首次使用阿片样救援药物的时间定义为施用试验药物的时间和首次使用阿片类药物的时间之间的持续时间。
[0810]
药代动力学
[0811]
测量制剂a和标准盐酸布比卡因组的总布比卡因血浆浓度和游离布比卡因血浆浓度,以评价布比卡因pk,包括布比卡因的最大浓度。另外,测量这两组中的α1酸性糖蛋白(aag)血浆浓度,以与游离布比卡因浓度相关联。
[0812]
作为中枢神经系统(cns)毒性监测和心脏监测的一部分,评价药代动力学/药效学(pk/pd)关系。对于未选择进行pk分析的患者,如果发生的心脏或cns事件满足严重不良事件(sae)或严重非sae的标准,则尽可能在接近事件时采集血样进行pk分析。
[0813]
安全性
[0814]
不良事件(ae)的发生率;布比卡因相关的cns副作用的发生率;临床实验室检验;生命体征;12-导联ecg;和身体检查。
[0815]
其他评估
[0816]
在第7天和第14天以及在6个月随访时,研究者对手术伤口处的伤口愈合和组织状况进行评价。在6个月随访时进行肩部mri以及使用constant-murley评分对肩部进行功能评估。
[0817]
结果
[0818]
主要功效终点
[0819]
在手术后1至72小时的时间段内平均运动时pi的auc(itt群体)总结在表13.1中。在术后1至72小时的时间段内,制剂a组显示出在统计学上超过安慰剂(p-值:0.012)。itt群体随时间推移的运动时pi示于图15中。
[0820]
表13.1:运动时疼痛强度,平均auc(locf)(itt群体)
[0821][0822][0823]
n=有可用数据的患者的数目;sd=标准偏差;ci=置信区间;auc=曲线下面积;locf=末次观察结转;itt=意向治疗。
[0824]
ls平均差异和标准误差表示治疗差异。来自模型中治疗组和试验地点的anova的p值。
[0825]
与安慰剂相比,用制剂a治疗的受试者服用显著更少的阿片类救援药物(表13.2)。治疗后0至72小时的阿片类药物的中值累积iv吗啡当量剂量对于制剂a组为4.0mg,对于安慰剂组为12.0mg(p=0.0130)。盐酸布比卡因组的中值累积剂量为8.0mg。对术后阿片类救援药物的使用进行非参数分析,因为它不符合预先指定的正态假设。在手术后72小时内保持无阿片类药物的受试者的百分比在制剂a组中也显著高于安慰剂组:39.6%对16.0%(p=0.027)。盐酸布比卡因组中阿片类药物的戒断百分比为27.6%。
[0826]
表13.2:手术后0-72小时服用的总iv吗啡当量剂量的阿片类救援药物,itt群体
[0827][0828][0829]
ci,置信区间;itt,意向治疗;iv,静脉
[0830]
[1]hodges-lehmann中值差异估计值
[0831]
[2]wilcoxon秩和检验
[0832]
次要功效变量
[0833]
与安慰剂相比,用制剂a治疗显著延长了手术后首次使用阿片类救援药物的时间(表13.3)。制剂a组的第一次使用的中值时间为12.4小时,安慰剂组的第一次使用中值时间为1.2小时(p=0.0137)。对于盐酸布比卡因组,首次使用的中值时间是1.4小时。
[0834]
表13.3.首次使用阿片类救援药物的时间,itt群体
[0835][0836]
ci,置信区间;itt,意向治疗;min,最小值;max,最大值
[0837]
注意:在研究期间未使用阿片类救援药物的受试者在其最后一次研究访问时接受审查。
[0838]
[1]基于kaplan-meier存活估计,从研究治疗到施用阿片类药物的中值时间报告为伴随药物。
[0839]
[2]对数秩检验。
[0840]
比较第0天至第7天的or-sds评分,没有揭示治疗组(制剂a与安慰剂相比,制剂a与标准盐酸布比卡因相比)之间的任何统计学显著差异。
[0841]
总体而言,81名患者(itt群体中75.7%的患者)在第0至3天的时间内经历了至少一种阿片类药物相关的副作用,经历所有阿片类药物相关的副作用的患者的频率和数目在所有治疗组中是相似的。困倦、疲劳和头晕是在第0至3天期间对总(itt)群体记录的最常见的阿片类药物相关症状。
[0842]
表13.4总结了itt群体在手术后1-72小时静止时pi的归一化auc。与运动时pi一样,制剂a与安慰剂相比在72小时内显著降低pi。制剂a和盐酸布比卡因之间的差异不明显。
[0843]
表13.4.静止时疼痛强度归一化auc 1-72小时,itt群体
[0844][0845]
在第4天,大多数患者对他们接受的手术的疼痛治疗是满意的(59.8%的患者)或非常满意的(27.1%的患者)。仅一位患者对其疼痛治疗非常不满意(在制剂a组中),四位患者不满意(制剂a组中有三名,标准盐酸布比卡因组中有一名)。
[0846]
在治疗组之间,患者的疼痛满意度评分(在进行手术后第4天)没有统计学显著差异;制剂a相对于安慰剂(p值:0.995)和制剂a相对于标准盐酸布比卡因(p值:0.699)。
[0847]
对于在任一天患者的回家准备就绪(home-readiness),治疗组之间没有统计学显著差异。制剂a与安慰剂的成对比较和制剂a与标准盐酸布比卡因的成对比较的优势比在第1天(下午)为1.894(ci:0.693;5.177,p值:0.213)和1.240(ci:0.457;3.366,p值0.673)以及在第2天(下午)为2.654(ci:0.948;7.428,p值:0.063)和1.137(ci:0.419;3.089,p值0.801)。
[0848]
在14天后恢复工作的患者的数目方面,治疗组之间也没有统计学显著性差异。制剂a与安慰剂的成对比较和制剂a与盐酸布比卡因标准的成对比较的优势比是1.210(ci:0.325;4.498,p-值:0.776)和1.505(ci:0.358;6.329,p-值0.577)。
[0849]
药代动力学
[0850]
在施用5.0ml制剂a(660mg布比卡因)或施用20ml标准盐酸布比卡因(50mg布比卡因)后,测量接受关节镜下肩峰减压术的患者中的总布比卡因血浆浓度和游离(未结合的)布比卡因血浆浓度。使用非隔室法,由每种化合物的血浆浓度计算下列pk参数:血浆浓度对
时间曲线下面积直至最后测量的浓度(auc
t
),血浆浓度对时间曲线下面积外推直至无穷大(auc
inf
),最大浓度(c
max
),其出现时间(t
max
)和表观终点消除半衰期(t
1/2
)。由于制剂a的延长释放特性,布比卡因血浆浓度相对缓慢地增加,并且观察到总布比卡因和游离布比卡因的延长曲线。在给药后96小时,制剂a组的大多数患者中仍然存在可测量的血浆浓度。在所有时间点,盐酸布比卡因血浆浓度都显著低于制剂a组。布比卡因的平均血浆蛋白结合约为5.2%;游离布比卡因血浆浓度通常与总布比卡因的血浆浓度相当。总布比卡因和游离布比卡因的c
max
在个体间存在大的变异性。总布比卡因和游离布比卡因最高个体c
max
值分别是1.320mg/l和0.074mg/l。注意:表13.5显示了c
max
的几何平均值,
±
68%,而不是绝对min、max。
[0851]
本研究中布比卡因的平均c
max
和auc比历史研究中预期的低得多。在施用和伤口闭合之间,施用剂量的可变量可能已经从伤口逸出,可能导致对布比卡因的暴露显著减少。
[0852]
总布比卡因或游离布比卡因对任何心血管参数(qtcf、qtcb和qrs)没有明显影响,即使在观察到的最高布比卡因血浆浓度下也是如此。所报告的少数cns副作用与游离布比卡因的c
max
或t
max
不相关。在制剂a或标准布比卡因后,根据布比卡因浓度的几何平均总布比卡因血浆浓度和游离布比卡因血浆浓度呈现于图16中。
[0853]
图17显示制剂a的所有个体的游离布比卡因血浆浓度相对于总布比卡因血浆浓度的相关性。游离布比卡因的血浆浓度与总布比卡因浓度成比例地增加。回归线的斜率表示所有时间点和所有患者的平均游离分数(5.2%)。该图还显示布比卡因游离部分的个体间高度可变性,这意味着布比卡因总浓度高不一定意指布比卡因游离浓度高,反之亦然。表13.5列出了制剂a或标准布比卡因后总的和游离的布比卡因的血浆pk参数的总结。
[0854]
表13.5:在施用制剂a或标准盐酸布比卡因后总布比卡因和游离布比卡因的血浆pk-参数:
[0855][0856]
安全性
[0857]
在该试验中没有死亡,并且六位患者经历了一次sae(一个妊娠病例报告为sae)。认为一个sae(肺动脉高压,用制剂a治疗后113天报告)与试验药物相关。总之,37名患者(34.6%)经历了至少一种teae(总共报告了65种teae),其中大多数是轻度或中度强度。九位患者(8.4%)报告了被认为与治疗相关的teae,在治疗组之间没有显著差异。最常报告的teae(参见表13.6)在下列系统器官类别(soc)内:神经系统障碍;研究;和胃肠道障碍。最常报告的事件(首选项)是恶心、头痛和肌肉骨骼痛(各4.7%的患者)。没有患者由于teae而退出。在第0天和第3天之间,安全群体中的三名患者报告了六种cns teae。
[0858]
每个治疗组中的大多数患者具有正常或异常的血液学和临床化学参数值,但在整个试验中没有临床意义。对四名患者报告了临床上显著的临床化学异常(安慰剂组有两名,制剂a和标准盐酸布比卡因组各有一名);绝大多数增加或减少与在进行手术损伤后所预期的一致。它们被评估为没有重大安全性问题。
[0859]
从筛选到第7天的任何一天,平均和中值血压和心率没有重要的差异。制剂a对ecg参数没有显著的影响。
[0860]
手术部位愈合和/或局部组织状况如在第7天、eot时和6个月随访时检查的所有患者中所预期的。在整个试验中没有患者被记录为经历意料之外的手术部位愈合。
[0861]
对于绝大多数被分析的患者,来自在6个月随访时进行的mri扫描的mri结果反映了从基线的变化与外科手术损伤注射一致;制剂a组和标准布比卡因组之间没有显著的差异。
[0862]
表13.6:teae的总结按照主要soc(>2%总量)(首选项)和治疗组(安全性人群)
[0863][0864]
[0865]
主要soc以递减频率呈现。
[0866]
首选项基于meddra以递减的总频率在主要soc中排序。在一次治疗下多次出现teae的患者在该治疗的首选项中仅计数一次。在汇总行中,在主要soc中具有多个teae的患者仅计数一次。
[0867]
meddra=监管活动医学词典;n=治疗组中的患者数目;n=具有该类别中的至少一个事件的患者的数目;%=具有基于n的类别中的至少一个事件的患者的百分比;soc=系统器官类别;teae=治疗中出现的不良事件。
[0868]
结论
[0869]
功效
[0870]
·
对于术后1至72小时的平均运动时pi,显示制剂a优于安慰剂。没有达到优于标准盐酸布比卡因的优势。
[0871]
·
制剂a治疗组在0-72小时的救援镇痛的总使用在统计学上优于安慰剂,但标准盐酸布比卡因则没有。相对于盐酸布比卡因缺乏统计学显著性可能是研究规模小以及背景和救援镇痛作用的结果。盐酸布比卡因组的受试者使用的阿片类救援药物是制剂a组的两倍(基于中值量)。
[0872]
·
制剂a总体证明了相对于安慰剂的镇痛和阿片类药物节约作用。
[0873]
·
次要功效终点,除了术后1至72小时的静止时pi外,没有达到统计学显著性。次要功效分析支持了主要终点分析的结果。
[0874]
药代动力学
[0875]
·
pk曲线支持制剂a的延长释放特性,提供了长效血浆浓度,其中值t
max
为给药后约6小时。相比之下,在所有时间点,标准布比卡因后的血浆浓度都比制剂a中低得多。未结合的布比卡因的平均百分比与从文献中已知的用于同类研究的值相似。
[0876]
·
总布比卡因和游离布比卡因的最高个体血浆浓度显著低于所报告的潜在cns和/或心血管副作用发作的浓度。aag血浆浓度如手术后预期的那样增加,导致未结合的布比卡因的百分比略微降低。
[0877]
·
总布比卡因或游离布比卡因对任何心血管参数(qtcf、qtcb和qrs)没有明显影响,即使在观察到的最高的布比卡因血浆浓度下也是如此。
[0878]
安全性
[0879]
·
所有治疗组的治疗中出现的不良事件的发生率和严重性是相似的,并且在6个月随访时没有注意到功能或放射照相的差异。
[0880]
·
制剂a是安全的和良好耐受的,在6个月随访时没有观察到长期安全信号。
[0881]
·
没有死亡,并且在该试验中sae的发生率低;一个sae被认为与试验药物相关(在制剂a组中)。
[0882]
·
就全身安全性而言,制剂a、标准盐酸布比卡因和安慰剂通常是安全的并且耐受性良好。治疗组之间在布比卡因相关的副作用方面没有显著差异。这表明游离布比卡因的浓度保持在低于或处于所报告的cns毒性阈值水平的低端。另外,所报告的cns副作用与游离布比卡因的c
max
或t
max
不相关。
[0883]
·
制剂a对ecg参数没有影响。
[0884]
·
治疗组之间在肩部功能测试(constant-murley评分)从基线到6个月随访的变
化方面没有临床上有意义的差异。
[0885]
·
治疗组之间关于伤口愈合和局部组织状况没有差异。
[0886]
实施例14
[0887]
进行临床试验以研究5.0ml制剂a施用到接受关节镜肩峰下减压术的患者的肩峰下间隙的治疗益处。该试验进一步研究了制剂a与安慰剂相比在患者中的全身和局部安全性,所述患者根据常规临床实践将需要接受口服阿片类药物的镇痛补充剂。
[0888]
目的
[0889]
主要目的-探索镇痛效果并表征与安慰剂相比,制剂a在整形外科手术模型中的安全性特征。
[0890]
次要目的-探索与安慰剂相比,在整形外科手术模型中制剂a引起的阿片类药物相关不良事件(ae)的频率降低。
[0891]
方法
[0892]
该研究是在进行关节镜肩部手术的受试者中进行的单剂量5.0ml制剂a的随机、双盲、多中心、安慰剂对照、平行组试验。评估受试者记录的疼痛和补充镇痛(功效终点)和ae、手术部位愈合、局部组织状况、实验室检验、体检和生命体征(安全终点)。
[0893][0894]
受试者数:本研究招募60名受试者。该研究招募的所有60名受试者接受制剂a的剂量的至少一部分或安慰剂,并且已经包括在改良意向治疗(mitt)群体和安全性群体中。五十八名受试者包括在符合方案的群体中(受试者接受制剂a或安慰剂的完全施用,满足手术和麻醉要求,成功地经历外科手术并且记录了至少一个施用后疼痛强度)。
[0895]
诊断和纳入标准:以下受试者有资格参与研究:男性和女性受试者,年龄为18至65岁,临床症状为肩峰下撞击,并且计划进行关节镜肩部手术;基于病史、体检、12导联心电图(ecg)和实验室检验,具有美国麻醉学会(asa)身体状态分类p1或p2;收缩压≤139mmhg,舒张压≤89mmhg;愿意使用医学上可接受的避孕方法,并避免剧烈活动和提供书面同意。
[0896]
排除标准:根据研究者,以下是不适合的:患有盂肱关节炎的受试者;通过磁共振成像(mri)诊断为主要或全厚度肩袖撕裂;先前在研究肩部进行过关节镜手术或开放手术;需要连续使用皮质类固醇》三个月的慢性疼痛病症;纤维肌痛;类风湿性关节炎;血清阴性
炎性关节病;计算的肌酸酐清除率<30ml/min;怀孕或哺乳;在手术的七天内,每天接受20mg以上的氢可酮(或相当的剂量),持续三天或更多天;阿片类药物耐受;在手术24小时内需要使用非甾体抗炎药(nsaid);定期使用抗惊厥药、抗癫痫药、抗抑郁药或单胺氧化酶抑制剂;在手术后7天或药物半衰期的5倍(以较长者为准)内定期使用已知可延长qtc间期的药物;已知的对酰胺类或吗啡或其它阿片类的局部麻醉剂的超敏反应;禁止使用阿片类药物的条件;已知或疑似滥用阿片类药物、违禁药物或酒精滥用;在手术30天内参与另一试验。
[0897]
手术要求:如果不满足以下要求,则受试者将不接受研究产品:指标手术是关节镜下进行的肩峰下减压;其它手术包括盂肱关节检查、滑膜切除术、游离体摘除、关节软骨小清创、肩袖小清创或小修复、锁骨远端切除、滑囊切除术、喙肩韧带和肩峰下骨刺切除术;应避免肩峰下间隙和盂肱关节之间的任何导管,这些导管会使研究产品渗漏和截留在关节囊中;不允许进行肩部不稳定手术;不允许进行二头肌肌腱固定术或肌腱切断术。
[0898]
麻醉要求:在用静脉内(iv)芬太尼或等效物通过丙泊酚诱导的全身麻醉下进行肩部关节镜手术;在肩部手术期间不允许使用局部麻醉剂用于伤口灌注或神经阻滞;在肩部手术期间不允许使用nsaids;肾上腺素可用于灌注液中以减少出血;在全身麻醉期间使用的短效阿片类药物不受限制,不允许针对疼痛预防性给予的术后阿片类药物;用于全身麻醉的止吐药物没有限制,没有预防性给予术后止吐药物。
[0899]
制剂a:在完成关节镜肩部手术时,将单剂量的5.0ml制剂a(132mg/ml,660mg布比卡因)注射到肩峰下间隙中。该制剂包含3种组分(66重量%的乙酸异丁酸蔗糖酯,22.0重量%的苯甲醇,和12.0重量%的布比卡因碱),它们作为无菌溶液一起施用。
[0900]
参考疗法、剂量和施用方式:在完成关节镜肩部手术时,将单剂量的5.0ml安慰剂组合物注射到肩峰下间隙。
[0901]
治疗持续时间:预期该研究的持续时间为每个受试者约4周。这包括;14天筛选期,在手术当天单剂量施用,和14天随访期。
[0902]
评价标准:
[0903]
功效评估:“运动时”肩部疼痛强度;使用补充镇痛剂用于手术后疼痛缓解。
[0904]
安全性评价:ae的频率和严重程度;手术部位愈合和局部组织状况评估;实验室检验(化学、血液学和尿分析);身体检查、ecg和生命体征。
[0905]
统计方法:
[0906]
随机化:患者将随机(2比1的比例)给予制剂a或安慰剂。
[0907]
共同主要功效终点:
[0908]
在给药后0至72小时的时间段内平均运动时疼痛强度归一化曲线下面积(auc)和给药后0至72小时的时间段内的平均总iv吗啡当量剂量。
[0909]
结果
[0910]
功效结果:
[0911]
给药后0-72小时内疼痛强度归一化auc
[0912]
使用ancova,以治疗组和试验地点作为因素,以年龄作为协变量,比较治疗组之间在0-72小时内的疼痛强度归一化auc。尽管没有统计学显著性,但在0-72小时内疼痛强度归一化auc中有朝向制剂a组的趋势。制剂a组的ls平均值为5.33,安慰剂组的为5.97。制剂a组
的疼痛评分始终低于安慰剂组,各组之间的平均差异在前24小时最显著(下表14.1)。
[0913]
表14.1:通过治疗呈现的在预定评估中的疼痛强度归一化auc(mitt受试者组)
[0914][0915]1使用以治疗组和研究地点为因素的anova模型估计的最小二乘均值
[0916]
给药后0-72小时内的累积iv吗啡当量剂量
[0917]
阿片类药物救援镇痛累积iv吗啡当量剂量通过治疗呈现于下表14.2中。使用ancova,以治疗组和试验地点作为因素,以年龄作为协变量,比较治疗组之间0-72小时内的累积吗啡当量剂量。尽管没有统计学上的显著性,但在0-72小时内累积iv吗啡当量剂量中有朝向5.0ml制剂a组的趋势。5.0ml制剂a组的ls平均值为44.27,安慰剂组为54.51。
[0918]
表14.2:通过治疗呈现的阿片类药物救援镇痛累积iv吗啡当量剂量(mg)(mitt受试者组)
[0919][0920]1使用以治疗组和研究地点为因素的anova模型估计的最小二乘均值
[0921]
对于次要研究终点,在两个治疗组之间观察到运动时疼痛强度归一化auc(0-48小时)、平均总iv吗啡当量阿片类药物剂量(0-48小时)和距离第一次阿片类药物剂量的时间。在0-48小时内疼痛强度归一化auc中,有朝向5.0ml制剂a组的趋势。在0-24小时、0-48小时、第0-14天和24-48小时内的吗啡累积当量剂量在所有时间点都显示出朝向5.0ml制剂a组的趋势。
[0922]
运动时疼痛强度
[0923]
在0-48小时、0-最后一小时、0-24小时、0-36小时、0-96小时、24-48小时、36-72小时、48-72小时和72-96小时内进行疼痛强度归一化auc的分析。使用ancova,以治疗组和试验地点作为因素,以年龄作为协变量,比较治疗组之间的疼痛强度归一化auc(图18)。尽管在统计学上不显著,但在所有时间点,在疼痛强度归一化auc中存在朝向5.0ml制剂a组的趋势。对于mitt受试者组,在所有时间点,5.0ml制剂a组的ls平均值都低于安慰剂组。图19a描绘了与在给药后的时间点施用安慰剂的受试者相比,施用制剂a的mitt组中的受试者的平均运动时疼痛强度。图19b描绘了在给药后的时间点,与施用安慰剂的受试者相比,施用制剂a的pp组的受试者的平均运动时疼痛强度。
[0924]
累积吗啡当量剂量
[0925]
在0-48小时、第0-14天、0-24小时、24-48小时和48-72小时进行累积吗啡当量剂量的分析。使用ancova比较治疗组之间的累积吗啡当量剂量,其中治疗组和试验地点作为因素,年龄作为协变量(图20)。尽管没有统计学上的显著性,但在所有时间点,在累积吗啡当量剂量中,存在朝向5.0ml制剂a组的趋势。
[0926]
对于mitt受试者组,除了48-72小时外,在所有其它时间点,5.0ml制剂a组的ls平均值低于安慰剂组。对于pp受试者组,5.0ml制剂a组的ls平均值在0-72小时、0-48小时和0-24小时低于安慰剂组的ls平均值。
[0927]
距离第一次使用阿片类药物的时间
[0928]
使用对数秩检验分析距离第一次使用阿片类药物的时间以比较两个治疗组。mitt受试者组(制剂a 5.0ml为0.43小时,而安慰剂为0.48小时)和pp受试者组(制剂a 5.0ml为0.42小时,而安慰剂为0.50小时)的距离首次使用阿片类药物的中值时间在统计学上不显著。图21描绘了与在给药后时间点施用安慰剂的受试者相比,施用制剂a的mitt组中的累积吗啡当量剂量。
[0929]
功效结论
[0930]
对于主要研究终点,尽管在本研究中没有观察到统计学显著的治疗效果,但是与安慰剂相比,在5.0ml制剂a组中有疼痛评分和阿片类药物使用的降低的迹象。给药后0至72小时内ls平均运动时疼痛强度auc在5.0ml制剂a组中为5.33,而对于安慰剂为5.97。该差异低于在样本量计算中使用的估计值(与估计的平均值1.9相比,观察到的平均差异为0.64)。然而,统计分析的推论方面在本研究中不是最重要的,因为该研究旨在具有探索性。治疗组之间累积吗啡当量剂量的差异在统计学上不显著。5.0ml制剂a组在0-72小时内的平均累积吗啡当量ls为44.27,安慰剂组为54.51。对于两个主要终点,与安慰剂相比的差异在手术后的前6-10小时期间最显著。
[0931]
对于第二研究终点,运动时疼痛强度归一化auc(0-48小时)、平均总吗啡当量阿片类药物剂量(0-48小时)和距离第一次阿片类药物剂量的时间在两个治疗组之间没有观察到统计学显著的差异。在0-48小时内在疼痛强度归一化auc中有朝向5.0ml制剂a组的趋势。在0-24小时、0-48小时、第0-14天、24-48小时和48-72小时内的累积吗啡当量剂量在统计学上不显著,但在所有时间点都有朝向5.0ml制剂a组的趋势。距离第一次使用阿片类药物的中值时间在统计学上不显著。
[0932]
安全性结果:
[0933]
所有60名受试者接受其分配治疗的至少一部分并包括在安全性分析中。相同比例
的受试者经历了至少一次ae-5.0ml制剂a组中的38名(95.0%)受试者和安慰剂组中的19名(95.0%)受试者。与安慰剂组中的七名(35.0%)受试者相比,5.0ml制剂a组中的十七名(42.5%)受试者经历了具有最大相关关系的至少一次ae。大多数ae的强度是轻度或中度的。与安慰剂组中的5名(25.0%)受试者相比,5.0ml制剂a组中的八名(20.0%)受试者经历至少一次具有最大严重程度的ae。所报告的teae的严重程度在两个治疗组之间是相似的。5.0ml制剂a组中最常见的ae是便秘、恶心、呕吐、头晕、感觉异常(panesthesia)和嗜睡。在安慰剂组中,最常见的ae是便秘、恶心、头晕和嗜睡。通常,在两个治疗组之间,以高频率表示的teae是相似的。在研究的任何时间点,阿片类药物相关的teae(便秘、头晕、困倦、恶心、呼吸抑制、尿潴留或呕吐)的频率没有统计学上的显著差异或趋势。在研究期间仅报告了一次sae。该事件是发热,并由受试者03-007在5.0ml制剂a组中报告。该事件被认为是轻微的,并且不可能与研究药物相关。基于对血液学、生物化学和尿分析数据的回顾、生命体征评估和体检结果以及伴随的药物使用的评估,5.0ml制剂a的施用是安全的并且耐受性良好。所有受试者在第14天具有如预期的手术部位愈合和局部组织状况。根据系统、器官、类别和首选项划分的teae按照系统器官类别总结在下表14.3中。
[0934]
表14.3:按系统、器官、类别划分的teae
[0935][0936][0937]
按首选项和治疗组划分的由>7.5%的受试者经历的teae总结呈现在下表14.4中。选择7.5%来检查teae的频率,因为这包括较小治疗组中至少两个受试者经历的teae。
5.0ml制剂a组中最常见的ae是便秘、恶心、呕吐、头晕、感觉异常和嗜睡。在安慰剂组中,最常见的ae是便秘、恶心、头晕和嗜睡。通常,在两个治疗组之间,以高频率表示的teae是相似的。
[0938]
表14.4:按治疗组划分的频率>7.5%的teae
[0939][0940]
结论
[0941]
本研究中的功效数据显示,与安慰剂相比,随机接受5.0ml制剂a的受试者的疼痛评分(如通过平均运动时疼痛强度auc、曲线下归一化的时间,在手术后0至72小时期间测量)持续降低。与安慰剂相比,随机接受5.0ml制剂a的受试者中阿片类药物的使用也减少(通过术后三天中所摄取的阿片类药物的量来测量)。这些降低在统计学上不显著。与疼痛评分和阿片类药物使用相关的发现在手术后的前6-10小时期间最突出。ae的发生率、生命体征和实验室异常表明5.0ml制剂a的施用是安全的,并且缺少退出和ae的轻度性质表明5.0ml制剂a的施用在该患者群体中是良好耐受的。
[0942]
实施例15
[0943]
进行临床试验以研究在经历关节镜肩峰下减压的患者中布比卡因组合物的肩峰下间隙中的施用。该研究进一步研究了患者中布比卡因组合物与安慰剂相比的全身和局部安全性。
[0944]
在这些研究中使用的布比卡因组合物(制剂a)是澄清的、浅黄色至棕色的液体,意图在各种外科手术之后用作术后镇痛剂。布比卡因组合物包含在由完全酯化的糖衍生物组
成的持续释放基质中的布比卡因碱。在该研究中,制剂a的目的是通过在几天的时间内提供布比卡因的持续局部释放来提供有效的术后局部镇痛。该制剂包括3种组分(66重量%的乙酸异丁酸蔗糖酯,22.0重量%的苯甲醇,和12.0重量%的布比卡因碱),它们作为无菌溶液一起施用。
[0945][0946][0947]
目的
[0948]
主要目的-确定在经历涉及肩峰下减压的选择性关节镜肩部手术的受试者中皮下施用或施用到肩峰下间隙中的制剂a(布比卡因、苯甲醇、乙酸异丁酸蔗糖酯)的功效。
[0949]
次要目的-确定在经历涉及肩峰下减压的选择性关节镜肩部手术的受试者中皮下施用或施用到肩峰下间隙中的制剂a(布比卡因、苯甲醇、乙酸异丁酸蔗糖酯)的安全性和耐受性。
[0950]
研究目的是针对队列1和队列2中的每一个而专门定义的。
[0951]
方法
[0952]
该研究是对正在经历肩袖修复的患者进行皮下或肩峰下布比卡因的功效和安全性的随机双盲安慰剂对照研究,并且评价制剂a(布比卡因、苯甲醇、乙酸异丁酸蔗糖酯)作为递送系统的安全性和耐受性。根据标准当地实践,在局部或全身麻醉下对所有受试者进行手术。
[0953]
在2个单独的和连续的队列(队列1和队列2)中进行研究。将大约相等数量的受试者按顺序招募到每个队列。研究持续时间最长达21天,包括筛选、入院和手术(第0天)、术后评估、出院以及到第14天的随访。
[0954]
在诊所或在家的第1和2天、在诊所的第3天和手术和治疗后的第4至7天通过电话评价受试者。受试者在第14天返回进行随访评估和血浆收集。受试者从第0天到第7天在日记卡上记录疼痛强度(pi)、伴随药物、不良事件(ae)和救援镇痛。受试者还记录了直到第14
天的ae和伴随药物。
[0955]
队列1:
[0956]
在即将进行手术之前,以1:1:1的比例随机分配45个受试者(治疗组1、治疗组2、治疗组3)以接受以下治疗之一:
[0957]
治疗组1:在伤口闭合之前,将5.0ml安慰剂组合物注射到肩峰下间隙。伤口闭合后,沿切口线每侧以2次尾随皮下注射的方式施用总体积为5.0ml的制剂a。布比卡因的总量为660毫克。
[0958]
治疗组2:在伤口闭合前,将5.0ml制剂a注射到肩峰下间隙。伤口闭合后,沿切口线每侧以2次尾随皮下注射的方式施用总体积为5.0ml的安慰剂组合物。布比卡因的总量为660毫克。
[0959]
治疗组3:在伤口闭合之前,将5.0ml安慰剂组合物注射入肩峰下间隙。伤口闭合后,沿切口线每侧以2次尾随皮下注射的方式施用总体积为5.0ml的安慰剂组合物。(安慰剂组合物的总递送体积为10.0ml)
[0960]
对于所有治疗组,如果手术是在关节镜下进行的,则研究药物的皮下剂量在所有关节镜入口周围均匀施用。
[0961]
队列2:
[0962]
在完成队列1后,开始将受试者招募到队列2中。在手术之前即刻以1:1的招募比例随机分配45名受试者(治疗组4和治疗组5)以接受以下治疗之一:
[0963]
治疗组4:在伤口闭合期间,将5.0ml安慰剂组合物注射到肩峰下间隙。
[0964]
治疗组5:在伤口闭合期间,将5.0ml制剂a注射到肩峰下间隙。
[0965]
在研究期间,在队列2中施用的药物量从7.5ml(990mg布比卡因)变为5.0ml(660mg布比卡因)。然而,4名受试者被施用治疗4a(7.5ml安慰剂组合物),3名受试者被施用治疗5a(7.5ml制剂a)
[0966]
九名受试者在1个参与中心随机接受安慰剂组合物或5.0ml制剂a,以便在本研究的双盲部分获得pk(药代动力学)测量值。在这9名受试者中,4名接受5.0ml制剂a,5名接受安慰剂组合物。在完成研究的双盲部分后,实施补充pk子研究方案以招募至多14名另外的pk受试者以在肩峰下接收5.0ml开放标签制剂a。接受5.0ml制剂a的18个pk受试者的总体pk结果将在下面更详细地讨论。
[0967]
用于施用的研究药物的制备:
[0968]
研究药物用5ml注射器施用,该注射器用于从制剂a或安慰剂组合物的10.0ml小瓶中抽取5.0ml的研究药物。
[0969]
术后救援镇痛
[0970]
根据要求开具术后救援镇痛。在整个研究期间,所有受试者在纸质或电子日记上记录所有救援镇痛的时间、名称和剂量。区分用于外科伤口疼痛的那些镇痛剂和用于其它适应症的那些镇痛剂。在每次受试者要求救援镇痛药之前立即完成疼痛强度(pi)评价。
[0971]
受试者标准
[0972]
受试者数:计划招募90名受试者,以确保至少有72名可评估受试者(每个队列中有约36名受试者,队列1的每个治疗组中有12名受试者,且队列2的每个治疗组中有18名受试者)。总共40名受试者被招募到队列1;14名进入治疗1,10名进入治疗2,和16名进入治疗3。
所有40名受试者完成队列1。总共52名受试者被招募到队列2;4名进入治疗4a,24名进入治疗4,3名进入治疗5a,且21名进入治疗5。五十名受试者完成队列2;1名治疗4中的受试者和1名治疗5a中的受试者自愿退出。
[0973]
在完成研究的双盲部分后,实施补充pk子研究方案,其招募14名另外的pk受试者以在肩峰下接受5.0ml开放标签制剂a。
[0974]
诊断和主要纳入标准:经历选择性肩袖修复的18岁及以上男性和女性处于良好的一般健康状态,并且满足所有纳入和排除标准,有资格参与研究。
[0975]
治疗持续时间:受试者接受单剂量的研究药物。研究持续时间最长达21天,包括筛选、入院和手术(第0天)、术后评估、出院和随访直至第14天。
[0976]
评价标准:
[0977]
功效:
[0978]
使用受试者对pi的自评和在受试者日记中收集的疼痛控制(第0至7天)、改良的简短疼痛清单(第1至7天)和受试者使用伴随的救援镇痛药物(第0至14天)来评价功效。
[0979]
主要功效终点是在第0天至第7天收集的运动时pi,静止时pi,以及疼痛控制:差(1)、一般(2)、良好(3)、非常好(4)、优秀(5),次要功效终点是最严重和最轻的疼痛评分、救援镇痛使用、功能、总体治疗满意度以及随时间的个体pi。
[0980]
安全性:
[0981]
安全性评价包括ae;实验室检验的评估,例如化学、血液学和尿分析;血清妊娠试验(如果适用);生命体征的定期监测;12导联心电图(ecg);伴随药物;和身体检查。评价还包括手术部位愈合和局部组织状况。
[0982]
统计方法:
[0983]
除非另有说明,所有统计学检验均使用5%显著性水平的双向检验进行。没有对任何分析进行多重性调整。符合方案(pp)的群体包括成功接受外科手术、接受研究药物并在1个或更多个术后时间点记录疼痛评估的术后数据的所有受试者。所有功效终点的总结表和统计分析基于pp群体。安全性总结基于安全性群体,其包括接受任何量的研究药物的所有随机受试者。
[0984]
测定以下治疗组的数据:
[0985]
·
治疗1(制剂a皮下)
[0986]
·
治疗2(制剂a肩峰下)
[0987]
·
治疗5(制剂a-肩峰)
[0988]
·
制剂a(治疗2和5)
[0989]
·
治疗5a(7.5ml制剂a)
[0990]
·
合并安慰剂,其包含:
[0991]
·
治疗3(10.0ml安慰剂组合物)
[0992]
·
治疗4(5.0ml安慰剂组合物)
[0993]
·
治疗4a(7.5ml安慰剂组合物)
[0994]
主要关注的比较是在治疗5和合并安慰剂之间。还确定了制剂a、治疗2和治疗1与合并安慰剂之间比较的显著性。
[0995]
根据监管活动医学词典(meddra)8.0版系统器官类别和首选项,确定每个治疗组
的治疗中出现的ae的发生率(数量和百分比)。测定第0天发作的ae的单独的总发病率,还测定了ae的最严重的严重程度和它们与研究药物的关系。
[0996]
如在受试者日记上检查的,确定预期事件的单独的总发生率:恶心/呕吐、困倦、瘙痒、便秘、头晕、耳鸣、味觉障碍和感觉异常。
[0997]
按研究日和治疗将改良的短暂疼痛清单的具体安全性评价制成表。所有研究日的发病率也通过治疗确定。
[0998]
总结了手术部位愈合和局部组织状况评价并按每个治疗组随时间的受试者发生率(数量和百分比)来制成表。
[0999]
确定了筛选体检结果的异常或变化。在每个收集时间点,描述性地列出每个治疗组的生命体征。对于每种治疗和预定的间隔,总结了从基线(给药前)生命体征的变化。使用筛选和非预定的ecg。
[1000]
结果
[1001]
功效结果:
[1002]
运动和静止期间的主要终点pi评分(auc/120小时)分别按治疗组总结在表15.1和表15.2中。制剂a治疗组的平均pi
运动
值为5.47、3.27和5.12(分别为治疗1、2和5),而合并安慰剂组为5.22。治疗2具有最低的平均值(最小的疼痛)。与合并安慰剂组的比较表明,治疗2显著优于合并安慰剂(治疗差异=-1.95,95%ci=-3.59至-0.31,p=0.02)。制剂a组在数值上优于合并安慰剂(治疗差异=-1.03,95%ci=-2.14到0.09);这种差异没有达到统计学显著性(p=0.072)。对于静止期间的平均pi,治疗2、治疗5和制剂a在数值上优于合并安慰剂;这些差异没有达到统计学显著性。
[1003]
表15.1运动期间疼痛强度时间加权平均评分(auc/120)的总结,pp群体
[1004][1005]
治疗(5.0ml):
[1006]
1=制剂a皮下
[1007]
2=制剂a肩峰下
[1008]
3=安慰剂
[1009]
4=安慰剂
[1010]
5=制剂a
[1011]
治疗4a和5a与治疗4和5相同,但使用7.5ml
[1012]
制剂a=治疗2和5
[1013]
合并安慰剂=治疗3、4a和4
[1014]
表15.2静止期间疼痛强度时间加权平均评分(auc/120)的总结,pp群体
[1015][1016]
治疗(5.0ml):
[1017]
1=制剂a皮下
[1018]
2=制剂a肩峰下
[1019]
3=安慰剂
[1020]
4=安慰剂
[1021]
5=制剂a
[1022]
治疗4a和5a与治疗4和5相同,但使用7.5ml
[1023]
制剂a=治疗2和5
[1024]
合并安慰剂=治疗3、4a和4
[1025]
另一个主要功效变量是研究日和治疗的疼痛控制,使用pp群体的数值评分(1=差,5=优秀)进行评估。在表15.3中总结了治疗组第1天至第7天的平均疼痛控制评分。统计学比较限于制剂a与合并安慰剂。观察到的唯一统计学显著差异是在第1天(p=0.008),其中制剂a和合并安慰剂治疗组分别具有3.3和2.5的平均疼痛控制评分;在研究的其余时间(第2天至第7天)没有观察到疼痛控制的统计学显著差异。
[1026]
表15.3按治疗划分的研究第1-7天的疼痛控制,pp群体
[1027][1028][1029]
治疗(5.0ml):
[1030]
1=制剂a皮下
[1031]
2=制剂a肩峰下
[1032]
3=安慰剂
[1033]
4=安慰剂
[1034]
5=制剂a
[1035]
治疗4a和5a与治疗4和5相同,但使用7.5ml
[1036]
制剂a=治疗2和5
[1037]
合并安慰剂=治疗3、4a和4
[1038]
表15.4总结了第0-5天的阿片类救援药物(以累积iv吗啡当量剂量表示)。在制剂a治疗组中阿片类药物救援镇痛累积吗啡当量剂量的平均值为70.30、24.96和42.74(分别为治疗1、2和5),相比之下,在合并安慰剂组中为55.27。治疗2具有最低的平均值(最小累积吗啡当量剂量)。与合并安慰剂组相比,治疗2在数值上优于合并安慰剂;差异没有达到统计学显著性(p=0.147)。
[1039]
表15.4通过治疗划分的阿片类药物救援镇痛累积(第0天至第5天)iv吗啡当量剂量(单位/单位),pp群体
[1040][1041]
治疗(5.0ml):
[1042]
1=制剂a皮下
[1043]
2=制剂a肩峰下
[1044]
3=安慰剂
[1045]
4=安慰剂
[1046]
5=制剂a
[1047]
治疗4a和5a与治疗4和5相同,但使用7.5ml
[1048]
制剂a=治疗2和5
[1049]
合并安慰剂=治疗3、4a和4
[1050]
在制剂a治疗组(治疗1、2和5)以及在合并安慰剂组中,所有受试者需要救援镇痛。
[1051]
所有其它次要终点(最差和最小疼痛评分、功能、总体治疗满意度和个体pi随时间的变化未显示任何显著结果。
[1052]
分别对2个队列进行随时间的pi事后分析。在队列1中,制剂a肩峰下治疗组(治疗2)与安慰剂组(治疗3)相比具有较低的运动时pi,并且在制剂a皮下治疗组(治疗1)和安慰剂组(治疗3)之间没有观察到差异。在队列2中,没有观察到制剂a肩峰下的治疗组(治疗5)相对于安慰剂(治疗4)的运动时pi的降低。在队列1和队列2的治疗组之间没有观察到阿片类药物救援镇痛用途的差异。
[1053]
图22显示了分别对队列1和队列2分析的随时间变化的平均pi
运动
。该图证明了对于队列1,治疗2(5.0ml制剂a肩峰下)的平均运动时pi评分低于安慰剂(治疗3)的平均运动时pi评分。在治疗1(5.0ml制剂a皮下)和安慰剂(治疗3)之间,没有观察到运动时pi评分的差异。在队列2中,没有观察到治疗4(制剂a肩峰下)相对于安慰剂(治疗5)的运动时pi的降低。
[1054]
对来自两个队列的具有最小或没有盂肱病理的受试者进行亚组分析。使用包括研究中心和治疗组作为因素的预先指定的anova模型,测试合并的肩峰下活性治疗组和合并的安慰剂之间的差异。活性剂和安慰剂的平均运动时疼痛强度auc(在72小时期间)分别为3.6和6.1。平均运动时疼痛强度auc(在72小时期间,活性剂-安慰剂)的相应差异为-2.6(95%ci:(-4.1,-1.1))。该结果是统计学显著的(p=0.0012),支持有利于活性肩峰下治疗的镇痛益处,显示疼痛减少41.8%(而itt分析显示减少16.5%)。
[1055]
图23显示具有最小或没有盂肱病理的受试者亚组中pi
运动
随时间的变化。其显示与安慰剂(治疗3和4)相比,在使用肩峰下施用的制剂a的那些治疗组(治疗2和5)中镇痛增加。与安慰剂(治疗3和4)相比,使用皮下施用的制剂a的治疗1没有显示出pi
运动
的降低。
[1056]
活性剂和安慰剂的平均总吗啡当量剂量分别为33.5和56.9。(安慰剂-活性物)之间的平均值的相应差异为23.4(95%ci:(-1.1,47.9))。该结果表示阿片类药物使用减少41.1%(而itt分析显示16.1%),有利于活性肩峰下治疗,但不是统计学显著的。
[1057]
安全性结果:
[1058]
治疗组之间ae的总频率相似。最常报告的治疗中出现的ae是恶心、嗜睡、瘙痒和便秘。大多数治疗中出现的ae具有轻度或中度严重程度。没有由于ae导致的死亡或停止。一次严重的ae发生在治疗组4中(术后疼痛),其强度严重,并且研究者认为与研究药物无关。对关注的特定安全性评价的分析没有显示任何阿片类药物相关的安全性问题。
[1059]
按治疗划分的治疗中出现的不良事件(teae)的总结示于表15.5中。
[1060]
表15.5在第0-7天观察到的特定安全性评价(安全性群体)
[1061][1062]
治疗(5.0ml):
[1063]
1=制剂a皮下
[1064]
2=制剂a肩峰下
[1065]
3=安慰剂
[1066]
4=安慰剂
[1067]
5=制剂a
[1068]
治疗4a和5a与治疗4和5相同,但使用7.5ml
[1069]
制剂a=治疗2和5
[1070]
合并安慰剂=治疗3、4a和4
[1071]
结论
[1072]
制剂a是一种可注射溶液,特别配制成延长局部术后镇痛作用,并在各种外科手术之后用作术后镇痛剂。每毫升制剂a含有12重量%布比卡因,代表132mg/ml布比卡因。pi
运动
的主要功效终点在治疗2(制剂a肩峰下)中显示明显优于合并安慰剂组(治疗3、4a和4),并且在治疗1(制剂a皮下)、治疗5(制剂a)和制剂a(治疗2和5,分别为制剂a肩峰下和制剂a)中没有明显优于合并安慰剂组(治疗3、4a和4)。队列1中事后分析的结果显示制剂a肩峰下治疗组(治疗2)与安慰剂组(治疗3)相比具有较低的运动时pi,并且在制剂a皮下治疗组(治疗1)和安慰剂组(治疗3)之间未观察到差异。在对来自两个队列的具有最小或没有盂肱病理的受试者进行的亚分析中,使用肩峰下施用的制剂a的那些治疗组(治疗2和5)与安慰剂(治疗3和4)相比具有较低的运动时pi。与安慰剂相比,使用皮下施用的制剂a的治疗1没有显示出运动时pi的降低。治疗组之间ae的总频率相似。
[1073]
实施例16
[1074]
进行随机、平行组、双盲、盐水安慰剂对照和盐酸布比卡因活性剂对照临床试验,评价5ml制剂a在接受选择性门诊腹腔镜胆囊切除术的受试者中的安全性和功效。在本研究中,如上所述制备制剂a,其包含作为无菌溶液一起施用的3种组分(66重量%乙酸异丁酸蔗糖酯、22.0重量%苯甲醇和12.0重量%布比卡因碱)。
[1075]
方法
[1076]
试验包括:1)随机、平行组、双盲、安慰剂对照研究(部分1)和随机、平行组、双盲、盐酸布比卡因活性剂对照研究(部分2)。该试验评价了制剂a(布比卡因、苯甲醇、乙酸异丁酸蔗糖酯)作为递送系统在经历选择性门诊腹腔镜胆囊切除术的受试者中的功效和安全性。
[1077]
在部分1中,受试者以标称1:1的比例随机接受2种治疗中的1种,制剂a或盐水安慰剂。在部分2中,受试者以1:1的比例随机接受2种治疗中的1种,制剂a或盐酸布比卡因。
[1078]
该研究以2个单独的部分(部分1和部分2)进行。对于部分1,92名受试者被随机化,并通过在手术结束时用钝头涂药器将5ml制剂a或盐水安慰剂直接滴注到腹腔镜端口切口中来治疗。对于部分2,受试者以1:1的比例随机接受5ml制剂a,用钝头涂药器直接滴注到腹腔镜端口切口中,或用22号针头将0.5%盐酸布比卡因15ml(75mg)浸润到端口切口边缘。
[1079]
受试者在第1天接受手术,期间在手术结束时给予单剂量的制剂a、安慰剂或盐酸布比卡因,同时仍然处于麻醉状态。
[1080]
所有受试者通过使用救援药物获得足够的疼痛缓解。当在麻醉后护理单元(pacu)中时,受试者在突发性疼痛而要求时,静脉施用12.5-25μg芬太尼。出院后,向受试者提供对乙酰氨基酚500mg片剂用于轻度至中度疼痛,并提供羟考酮5mg速释片剂的处方用于中度至重度疼痛。受试者根据现场调查员或研究人员提供的书面给药说明,根据需要自行施用这些药物。
[1081]
向受试者发布电子日记(logpad)以记录手术后的具体数据。
[1082]
在研究的部分1中,总共92名患者被施用制剂a或盐水安慰剂。45名患者被施用5ml制剂a,47名患者接受安慰剂。对于研究的部分2,用制剂a或活性对照盐酸布比卡因治疗296名患者。148名患者被施用5ml制剂a,148名患者接受活性对照盐酸布比卡因。
[1083]
制剂a、剂量和施用方式:
[1084]
在部分1和部分2中,随机分配到试验产品的受试者通过直接滴注到手术切口中施
用5ml制剂a(132mg/ml布比卡因碱,共660mg)。根据方案规定的给药方案,将5ml制剂a分配到4个端口之间,以覆盖所有手术切口。在滴注制剂a之前,根据需要闭合筋膜,在皮肤闭合之前,通过钝头注射器尖端涂药器将制剂a滴注到切口中。施用后,用表皮下缝合线和氰基丙烯酸酯皮肤粘合剂或steri-strips
tm
以标准方式闭合皮肤。
[1085]
参考比较器、剂量和施用方式:
[1086]
部分1:
[1087]
在部分1中,随机分配到盐水-安慰剂的受试者通过直接滴注到手术切口中而施用5ml无菌生理盐水(0.9%氯化钠注射液,usp)。根据方案规定的给药方案,将5ml安慰剂在4个端口之间分配,以覆盖所有手术切口。在滴注安慰剂组合物之前,根据需要闭合筋膜。在皮肤闭合前,通过钝头注射器尖端涂药器将安慰剂组合物滴注到切口中。施用后,用表皮下缝合线和氰基丙烯酸酯皮肤粘合剂或steri-strips
tm
以标准方式闭合皮肤。
[1088]
部分2:
[1089]
在部分2中,随机分配到活性剂对照的受试者通过用22号针头浸润到手术切口边缘而施用0.5%的盐酸布比卡因15ml(75mg;不含肾上腺素)。根据方案规定的给药方案,将15ml盐酸布比卡因组合物分配到4个端口之间,以覆盖所有手术切口。在施用盐酸布比卡因活性对照组合物之前,根据需要闭合筋膜。浸润后,用表皮下缝合线和氰基丙烯酸酯皮肤粘合剂或steri-strips
tm
以标准方式闭合皮肤。
[1090]
功效分析
[1091]
主要
[1092]
部分1和部分2的主要功效终点如下:
[1093]
部分1:运动时疼痛强度在施用试验药物后0至72小时的预定时间点测量,针对先前的救援药物使用进行调整,并通过重复测量的混合效应anova模型(mmrm)进行分析。
[1094]
部分2:运动时疼痛强度在施用试验药物后0-48小时的预定时间点测量,针对先前的救援药物使用进行调整,并通过重复测量的混合效应anova模型(mmrm)进行分析。
[1095]
结果
[1096]
功效结果:
[1097]
主要终点
[1098]
主要功效终点是在施用测试组合物后0-72小时(部分1)和0-48小时(部分2)的预定时间点测量的运动时疼痛强度,针对先前的救援药物使用进行调整。对于部分1,比较在制剂a(仅部分1的受试者)和盐水安慰剂之间进行,对于部分2,比较在制剂a(仅部分2的受试者)和盐酸布比卡因之间进行。主要终点分析的结果总结在下表16.1中。
[1099]
表16.1:研究部分的主要结果:治疗后0-72小时(部分1)和治疗后0-48小时(部分2)的运动时疼痛强度
[1100][1101]
ci=置信区间;se=标准误差;ls=最小二乘;wocf=最坏观察结转
[1102]
安全性结果:
[1103]
在该试验中没有死亡。九名治疗的受试者(6名制剂a和3名盐酸布比卡因)经历了治疗时出现的严重不良事件(sae),所有这些都被认为与研究药物施用无关。表16.2总结了安全性数据。
[1104]
表16.2:治疗时出现的不良事件的整体总结(安全性群体)
安慰剂5ml,比例为3:2。该队列包括因结肠癌、憩室炎或息肉而接受腹腔镜辅助结肠切除术的患者,没有计划形成或关闭的造口。使用气腹和体内方法探查腹部,移动结肠,确定关键结构,并结扎血管蒂用于左侧和乙状结肠切除术。
[1114]
活性剂对照、剂量和施用方式:
[1115]
在活性比较物治疗组(队列1和2)中;施用30ml 0.5%的盐酸布比卡因溶液(5mg/ml,150mg布比卡因),通过用皮下注射针头浸润到切口周围组织。
[1116]
制剂a、剂量和施用方式:
[1117]
对于制剂a(132mg/ml,660mg如上所述的布比卡因)和溶媒安慰剂治疗组,吸取5ml的每种组合物,并使用norm-5ml luer lock注射器施用,该注射器与具有luer lock配件的tunneltip
tm
冲洗导管连接。提供的tunneltip冲洗导管是柔性的,15cm长,直径2mm,具有光滑的圆形尖端和用于伤口长度测量及控制滴注的厘米刻度标记。考虑到导管中的无效空间(dead space),指示各地点在具有所提供的16号针头的注射器中吸取5.5ml的研究产品。一旦连接,指示各地点从注射器和导管中清除过量的空气和研究产品,以确保施用5ml的每种组合物。注射器、针和导管是无菌供应的并且单独包装。
[1118]
对于腹腔镜入口,通过冲洗导管和/或通过注射器尖端将每种组合物直接施用到开放端口切口中。然后在给药后用缝合线闭合端口切口。对于线性切口,在腹膜闭合并在确保皮下间隙止血后,将冲洗导管放置到伤口中,并用皮下缝线将皮肤层缝合在导管上。然后将含有每种组合物的注射器连接到导管上,逐渐注射测试药物,同时缓慢地抽出导管。以这种方式,每种组合物(例如制剂a或溶媒对照)沿切口长度均匀分布,药物渗漏最小。最后的缝合用于闭合导管被抽出的空间。基于使用冲洗导管上的厘米标记测量的切口长度计算每厘米伤口长度递送的体积。
[1119]
在队列1中,制剂a的全部5ml剂量均匀分布在剖腹术切口内。在队列2中,较大的端口切口比较小的端口切口接受更大体积的制剂a。在队列3中,通常存在5-10cm的线性切口,用于取出结肠以进行切除和吻合(手用端口)。使用冲洗导管方法将约80-90%的制剂a滴注到手用端口中。将剩余的10-20%的试验药物直接滴注到腹腔镜端口切口中。
[1120]
为了避免产品从伤口渗出,在用表皮下缝线(无钉)和steri-strip紧密闭合皮肤之后进行滴注。在研究产品放置区域中不放置引流管。
[1121]
结果
[1122]
功效
[1123]
选择两个共同主要终点来评价制剂a与对照相比的功效:1)在0-72小时内运动时疼痛强度的时间归一化auc和2)在0-72小时内服用的救援阿片类药物的总量,表示为iv吗啡当量。主要疼痛终点定义为在0-72小时内运动时疼痛的时间归一化auc。auc是使用预定的运动时疼痛强度评分(在logpad装置上电子记录)以及每次施用以缓解术后疼痛的救援阿片类药物时记录的疼痛评分,通过梯形法计算的。
[1124]
表17.1总结了0-72小时的主要终点auc以及0-48小时的次要终点auc。另外,显示每天的auc以评估治疗效果的持续时间。
[1125]
表17.1-按时间划分的运动时疼痛强度auc(包括log pad和阿片类药物疼痛评分)
[1126]
[1127][1128]
图24-26显示每个队列的平均运动时疼痛强度
±
平均值标准误差(sem)对疼痛评估的预定时间的线图。从这些图中可以看出,队列1和3的初始疼痛强度是相似的,因为两组都涉及结肠切除术或其它腹部大手术,疼痛评分范围为7至8,这被认为是重度疼痛。队列2具有较低的初始疼痛评分,范围为5至6,其被认为是中度至重度疼痛。在所有3个队列中,在术后3天期间,运动时平均疼痛强度降低2至3个单位,队列1和3达到中度疼痛水平,而队列2下降至轻度疼痛水平。队列1和2显示治疗组的早期分离,其在整个72小时期间保持。队列3几乎没有治疗组的分离,这与观察到的主要终点的相对小的治疗效果一致。
[1129]
运动时疼痛强度的预先指定的灵敏度分析
[1130]
预先指定的灵敏度分析是重复测量混合模型并总结于表17.2中。
[1131]
表17.2-仅基于logpad评分重复测量0-72小时的运动时疼痛强度(itt群体)
[1132][1133]
ancova=协方差分析,ci=置信区间,itt=意向治疗,ls=最小二乘,se=标准误差
[1134]
救援药物的使用
[1135]
第二个共同主要终点是在0-72小时内施用的阿片类药物的平均总量,使用标准转化因子将不同的阿片类药物转化为吗啡当量,表示为以毫克计的iv吗啡当量。
[1136]
表17.3总结了第二共同主要终点的结果。
[1137]
表17.3-按时期和队列划分的总吗啡当量阿片类药物使用(itt群体)
[1138][1139]
ci=置信区间,medd=吗啡的平均当量日剂量,itt=意向治疗,q=四分位数
[1140]
药代动力学
[1141]
仅分析血浆pk样品用于测定总布比卡因浓度,并且没有分析样品用于测定游离药物浓度。表17.4总结了所有三个队列的pk参数。血浆布比卡因浓度对治疗后时间的图示于图27至29中。
[1142]
表17.4按照队列划分的药代动力学参数-平均值[范围]
[1143][1144][1145]
安全性评价
[1146]
在整个试验过程中,在给药后持续3天用传统的ae评估、生命体征、常规实验室检
验和holter监测(即,连续记录心电图)小心地监测患者安全。心血管和神经学ae受到了特别的关注,因为布比卡因的毒性作用在这两个身体系统中都是明显的。此外,进行特殊评估以在试验的30天内监测手术伤口状况和愈合。
[1147]
表17.5总结了按队列划分的总体不良体验。
[1148]
表17.5治疗中出现的不良事件、严重不良事件和死亡的总体总结(安全性群体)
[1149][1150][1151]
对生命体征没有一致的治疗相关作用。血清化学和血液学参数的变化是大手术后预期的那些,在治疗组之间几乎没有一致的差异。从手术前约一小时开始,在给药后持续72小时使用holter监测仔细研究心脏安全性。此外,在筛查访问之后进行基线24小时动态holter监测。对holter数据和qtc间期与布比卡因血浆浓度的相关性的仔细分析没有揭示制剂a使qtc延长的任何证据。进一步分析holter的心律失常记录,并且在任何记录中均未检测到室性心动过速的情况。
[1152]
结论是当以5ml(660mg)的剂量滴注到各种腹部手术伤口时,制剂a耐受性良好,并且没有如通过ae、实验室检验和强化holter监测所评价的布比卡因全身毒性的证据。除了术后瘀伤的发生率增加之外,制剂a的组织耐受性与盐酸布比卡因相当。
[1153]
实施例18
[1154]
对直接滴注到接受开放性腹股沟疝修补术的患者的伤口中的制剂a进行双盲、安慰剂对照的药效学和药代动力学剂量反应研究。在本研究中,如上所述制备制剂a,其包含作为无菌溶液一起施用的3种组分(66重量%的乙酸异丁酸蔗糖酯、22.0重量%的苯甲醇和12.0重量%的布比卡因碱)。
[1155]
目的
[1156]
为了检查滴注到正接受开放性腹股沟疝修补术的患者的伤口中的制剂a的剂量反应功效、药代动力学、安全性和耐受性。
[1157]
方法
[1158]
研究设计
[1159]
这是一项ii期、多中心、随机、双盲、安慰剂对照、平行组、剂量探索研究。
[1160]
参与者
[1161]
患者是18至65岁的男性或女性,并且计划在全身麻醉下接受选择性开放性单侧无张力lichtenstein型腹股沟疝修补术。基于病史、身体检查、12导联心电图(ecg)和实验室检验,患者在参与研究之前处于良好的健康状态。所有患者必须具有≤160mmhg的收缩压(bp)和≤95mmhg的舒张压(bp),在整个研究期间和完成研究后1周使用医学上可接受的避孕方法,在整个研究期间避免剧烈的活动和在整个研究期间避免改变规定的锻炼水平,以及在进行任何研究特定过程之前阅读、理解、交流和自愿签署批准的知情同意书。
[1162]
以下患者被排除在外:怀孕或哺乳;以前曾进行过腹部手术,其疤痕组织将限制患者的参与能力;患有临床上显著的与所研究疾病无关的肝、胃肠道、肾、血液、泌尿系统、神经、呼吸、内分泌或心血管系统异常、精神障碍或急性感染;患有结缔组织疾病(系统性红斑狼疮、硬皮病、混合性结缔组织疾病);或已知对布比卡因或苯甲醇(ba)敏感。以下患者被排除在外:在研究入选前6个月内已知或疑似酒精滥用或使用非法药物,目前或定期使用镇痛药用于其它适应症,目前或定期使用曲替林(triptyline)或丙咪嗪抗抑郁药,或单胺氧化酶抑制剂;或在治疗前7天内和在整个研究中开始使用可能干扰研究结果的进行或解释的任何处方药物或非处方药物(避孕药除外),以及同时或在入选30天内参与另一项临床研究的患者和不愿意或不能遵守研究程序的患者。
[1163]
介入治疗
[1164]
腹股沟疝手术程序根据标准的当地实践在全身麻醉下进行。患者随机接受2.5ml或5.0ml制剂a(12.0重量%,132mg/ml布比卡因),或2.5ml或5.0ml安慰剂。所有治疗在伤口闭合期间施用,并且逐渐滴注到整个腹股沟管和腹壁层以覆盖伤口的所有创面,填充腱膜下和皮下间隙。
[1165]
结果测量
[1166]
在药物施用后第0天的第1、2、3、4、6、8、10和12小时,在第1至4天上午8:00、下午12:00、下午4:00和下午8:00,在第5天上午8:00和从第0到14天在给予任何救援药物之前,使用数字评分量表([nrs]0=无疼痛;10=可能的最严重疼痛)评估静止和运动时疼痛强
度。在第1至5天每天下午12:00完成一次改良的简要疼痛清单。根据建议的指南开具术后镇痛药,并在整个研究过程中记录急救药物的使用、伴随药物和不良事件(ae)。测量从手术到患者活动的时间、典型的排便模式、手术前最后一次排便和治疗后排便的次数。在第0天的-5分钟,和1、2、3、4、8和12小时,以及在第1至4和7天,在与第0天施用治疗大约相同的时间,收集最少32名患者的血样用于药代动力学分析,如果合适,在第1至4、7和14天,在随访时评价手术部位愈合和局部组织状况。作为改良的简短疼痛清单的一部分进行的具体安全性评价包括恶心/呕吐、困倦、瘙痒、便秘、头晕、耳鸣、味觉障碍和感觉异常。在筛选时,在治疗施用前的第0天和在治疗施用后即刻记录生命体征,此后每小时记录一次,直至8小时评价时间点或出院(以先发生的为准),以及在第1-3天和第14天记录。在筛选时和第14天进行身体检查和安全性实验室测定。在筛选时和当临床指示时进行12导联ecg,以评估和记录所有临床显著的异常(例如,心动过缓发作);2个研究中心在外科手术之后尽可能快地进行24小时的连续ecg监测,并且如果临床指示,则进行12导联ecg。患者返回诊所进行3个月和6个月的随访以进行身体检查、评估手术部位愈合和局部组织状况,以及收集不良事件和伴随的药物治疗数据。
[1167]
样本量
[1168]
将大约144名患者随机分配到研究中,以便产生共120名可评估患者(每个队列60名患者,3:1随机化,以有利于每个队列内的活性剂治疗)。基于1至72小时期间内平均运动时疼痛强度曲线下面积(auc),检测到0.67(在制剂a 5.0ml和制剂a 5.0ml组之间)的相对治疗效果,以80%的效力和5%的显著性水平。
[1169]
随机化
[1170]
在手术之前,将合格的患者随机分配接受以下4种治疗之一:制剂a 5.0ml(660mg布比卡因),制剂a 2.5ml(330mg布比卡因),安慰剂5.0ml,或安慰剂2.5ml。每个随机化的患者接收包含队列成员(队列1或队列2;如下文定义的每个队列60个随机化的患者)和治疗组(有利于活性剂治疗的3:1随机化)的随机化编号。事先合并安慰剂组(2.5ml和5.0ml)以潜在地提高统计分析功效。
[1171]
2个队列如下:
[1172]
·
队列1:患者随机接受2.5ml制剂a或2.5ml安慰剂;
[1173]
·
队列2:患者随机接受5.0ml制剂a或5.0ml安慰剂。
[1174]
该随机化方案产生3个不同的治疗组,如下:
[1175]
·
治疗组1:制剂a 2.5ml(330mg布比卡因);
[1176]
·
治疗组2:制剂a 5.0ml(660mg布比卡因);
[1177]
·
治疗组3:安慰剂2.5ml或5.0ml,随机分配。
[1178]
患者数量
[1179]
计划的患者数量
[1180]
招募了最多144名患者,获得了120名可评估的患者。
[1181]
分析的患者
[1182]
招募了135名患者,124名随机如下:制剂a 2.5ml,n=45;制剂a 5.0ml,n=47;安慰剂,n=32。四名患者停止了该研究(制剂a2.5ml,n=3;安慰剂,n=1);因此,120名患者完成了研究并包括功效可评估的群体:制剂a 2.5ml,n=42;制剂a 5.0ml,n=47;安慰剂,n=
31。安全性/符合方案(pp)群体包括123名患者(制剂a 2.5ml,n=44;制剂a 5.0ml,n=47;安慰剂,n=32),而意向治疗(itt)群体包括122名患者(制剂a 2.5ml,n=43;制剂a 5.0ml,n=47;安慰剂,n=32)。
[1183]
诊断和纳入的主要标准
[1184]
具有良好一般健康状况的18至65岁的男性和女性患者,他们计划在全身麻醉下接受选择性开放性单侧无张力lichtenstein型腹股沟疝修补术。
[1185]
治疗持续时间
[1186]
在手术当天(第0天)一次性施用治疗。
[1187]
评价标准
[1188]
功效
[1189]
有2个共同主要功效终点:在术后1至72小时的时间段内的平均运动时疼痛强度归一化auc,以及在研究期间接受阿片类救援药物的患者的比例。主要的零假设是治疗组之间在平均运动时疼痛强度归一化auc或阿片类救援药物方面没有差异。次要功效终点包括以下:术后1至48小时的时间段内的平均疼痛强度归一化auc、术后距离阿片类药物使用的时间、总体治疗满意度、研究期间转化为吗啡当量的用于救援镇痛的平均总阿片类药物剂量、和平均功能活动(第1至5天)。探索性分析包括计算1至24小时、1至96小时和1至120小时的归一化平均疼痛强度auc(运动和静止)(使用末次观察结转[locf]法)。
[1190]
药代动力学
[1191]
在一个选定的研究中心的患者子集中收集血浆样品用于药代动力学评估。
[1192]
安全性
[1193]
安全性结果包括ae、手术部位愈合和局部组织状况评估、ecg、实验室检验、生命体征和身体检查。
[1194]
统计方法
[1195]
主要终点
[1196]
使用方差分析(anova)模型比较治疗组之间的平均疼痛强度auc,所述方差分析模型包括治疗组和研究地点作为因素。使用dunnett检验进行安慰剂组(合计的)和两个制剂a剂量的成对比较。使用cochran-mantel-haenszel(cmh)检验分析接受阿片类救援药物的患者的比例。
[1197]
次要终点
[1198]
使用对数秩检验分析距离使用阿片类药物的时间。cox比例风险模型也用于估计风险比及其95%置信区间(ci)。
[1199]
剂量反应
[1200]
通过测试3个治疗组(安慰剂[合计],以及制剂a 2.5ml和5.0ml)之间的单调关系作为疼痛强度的函数来检查功效剂量反应的定量。使用递减方法来解决比较的多重性。
[1201]
结果
[1202]
功效结果
[1203]
主要运动时疼痛终点的功效结果总结在表18.1中。与安慰剂相比,制剂a的5ml剂量是高度显著的,而2.5ml制剂a没有达到显著性,但是疼痛强度auc低于安慰剂。观察到平均静止时疼痛强度归一化auc从1至72小时降低,这有利于制剂a的两个活性剂量与安慰剂
的对比,但统计学上是不显著的。
[1204]
表18.1运动时疼痛强度的归一化auc(1-72小时),itt
[1205][1206]
与安慰剂相比,制剂a在1至48小时的平均运动时疼痛强度归一化auc得到改善,在5.0ml制剂a(平均值[sem],2.52[0.19])和安慰剂(3.86[0.31])之间观察到统计学显著差异(p=0.0007),并且与安慰剂(p=0.0654)相比,2.5ml制剂a(3.18[0.24])具有显著性趋势。此外,与安慰剂相比,用5.0ml制剂a(平均值[sem],1.54[0.13]相对于2.18[0.23];p=0.0515)时,1至48小时的平均静止时疼痛强度归一化auc趋于显著改善,但2.5ml制剂a(2.15[0.22])与安慰剂之间的差异在统计学上不显著。
[1207]
在5.0ml制剂a组中,约53.2%(25/47;95%ci:38.1%,67.9%)的患者使用手术后的阿片类药物救援镇痛,在2.5ml制剂a组中,约72.1%(31/43;95%ci:56.3%,84.7%)的患者使用手术后的阿片类药物救援镇痛,在安慰剂组中约71.9%(23/32;95%ci:53.3%,86.3%)的患者使用手术后的阿片类药物救援镇痛;5.0ml制剂a和安慰剂之间的差异接近itt群体中的统计学显著性(p=0.0909)。
[1208]
5.0ml制剂a的距离第一次使用阿片类药物的中值时间最大(131.8小时;95%ci:31.9,未定义),接着是2.5ml制剂a(10.8小时;95%ci:1.1,52.7),然后是安慰剂(2.7小时;95%ci:1.1,25.3);5.0ml制剂a和安慰剂之间的差异是统计学显著的(p=0.0174)。
[1209]
治疗后0-72小时服用救援药物的iv吗啡当量剂量总结于表18.2中。与安慰剂相比,制剂a 5ml的援救药物使用显著较低,而2.5ml剂量的制剂没有达到统计学显著性。
[1210]
表18.2:0-72小时的iv吗啡当量使用(itt群体)
[1211]
[1212][1213]
[1]用于中值差异的hodges-lehmann估计
[1214]
[2][wilcoxon秩和检验
[1215]
每个治疗组中的大多数患者(>90%)是满意的或非常满意的,并且在所有3个治疗组中,每种功能活动的平均评分从第1天到第5天都有所改善。
[1216]
观察到从1小时至最后,5.0ml制剂a与安慰剂相比,平均运动时疼痛强度归一化auc有统计学显著的改善(平均值[sem],分别为2.27[0.18]相对于3.03[0.25],p=0.0211),但2.5ml制剂a(2.96[0.25])与安慰剂相比没有显著的改善。类似地,在1至24、1至96和1至120小时,5.0ml制剂a的运动时疼痛强度的归一化平均auc最低(分别为平均值[sem]、2.21[0.21]、2.37[0.18]和2.30[0.18]),接着是2.5ml制剂a(分别为2.85[0.25]、3.04[0.26]和2.93[0.26]),最后是安慰剂(分别为4.05[0.31]、3.31[0.29]和3.03[0.28])。
[1217]
药代动力学结果
[1218]
布比卡因的血浆浓度与施用剂量成比例地增加,并且在施用制剂a时没有观察到药物递送的突释。观察到的布比卡因平均(sem)药代动力学参数列于表18.3。
[1219]
表18.3
[1220][1221]
安全性结果
[1222]
本文报告的安全性结果是指安全性群体。安全性群体(n=123)中最常见的ae(至少1个治疗组中的发生率>10%)包括嗜睡、便秘、头晕、瘙痒、心动过缓、头痛、术后出血、术后伤口并发症、恶心和味觉障碍。在每个治疗组中报告了来自改良的短暂疼痛目录的不良事件(即恶心/呕吐、困倦、瘙痒、便秘、头晕、耳鸣、金属味和脚趾或手指的麻木或麻刺感)。所有可能与治疗相关的ae的发生率在2.5ml制剂a组中为18.2%(8/44),在5.0ml制剂a组中为27.7%(13/47),在安慰剂组中为28.1%(9/32),并且所有这些ae的严重程度都是轻度或中度。
[1223]
进行了两项安全性分析:原始分析将缺失的严重性数据归为轻度,而专门分析将缺失的严重性数据归结为重度。在两种分析中,大多数ae(原始分析>95%,专门分析>70%)的严重程度是轻度或中度的;在原始分析中,每个制剂a组中的2名患者和安慰剂组中没有患者经历或输入了严重的不良事件,在专门分析中,用制剂a治疗的21名患者和10名安
慰剂治疗的患者经历或输入了严重的不良事件。分别在6.8%(3/44)、4.3%(2/47)和3.1%(1/32)的制剂a 2.5-ml、制剂a 5.0-ml和安慰剂治疗的患者中报告了严重的不良事件;认为一个事件(血管迷走性晕厥)可能与制剂a治疗有关。严重的不良事件包括急性冠状动脉综合征、血管迷走性晕厥、晕厥和术后伤口并发症。没有死亡或其它显著的不良事件。
[1224]
分别在29名(66%)、25名(53%)和23名(72%)制剂a 2.5ml、制剂a 5.0ml和安慰剂治疗的患者中报告了神经系统不良事件。分别用2.5ml制剂a、5.0ml制剂a和安慰剂治疗的10名(23%)、15名(32%)和7名(22%)患者经历心脏不良事件。在所有剂量组(包括安慰剂)的患者中,在从全身麻醉恢复期间存在5次血管迷走神经性晕厥发作。排除了晕厥的心血管原因。
[1225]
临床显著的实验室异常是不常见的,包括在2.5ml制剂a组中进行筛选时的1例葡萄糖尿检阳性和在安慰剂组中在第14天的1例高肌酸激酶血液水平。在所有治疗组中,从筛查到第14天的心率(hr)、bp、呼吸速率、温度和身体检查(除了待修复的胃肠疝)结果是相似的。在所有评估的时间点,在每个治疗组中≥95%的患者中,手术部位如预期愈合,并且局部组织状况如预期/正常。
[1226]
对于ecg,制剂a没有导致hr、pr、qrs和针对hr持续时间校正的qt间期的任何临床相关变化。在常规的一组12导联ecg中的qtcf结果显示了相对于校正基线安慰剂的平均变化,在2.5ml制剂a剂量组中为+2ms,在5.0ml制剂a剂量组中为-8ms;该变化未表明制剂a影响心脏去极化或复极化的任何信号。然而,在ecg的遥测组中,从基线到12小时,2.5ml和5.0ml制剂a的qtcf持续时间的平均变化分别是+15和+9ms,从基线到24小时的qtcf持续时间的平均变化分别是+8和-11ms。这些数据显示qtcf持续时间的非剂量相关增加,可能是由于缺乏动力、伴随的全身麻醉和qtc持续时间的大的自发变异性,而不是制剂a的直接作用。
[1227]
在6个月的随访期间,与安慰剂组(42.3%)或2.5ml制剂a组(58.3%)相比,5.0ml制剂a组(35.7%)中的ae更少。大多数ae的严重程度是轻度或中度的。报告的严重ae发生率在2.5ml制剂a组中为11.1%,在安慰剂组中为7.7%;在5.0ml制剂a组中没有报告严重的ae。术后伤口并发症是在>10%的患者中报告的唯一ae,其发生在2.5ml制剂a组中的7名(19.4%)患者和安慰剂组中的3名(11.5%)患者中。手术部位愈合和局部组织状况在所有患者中在6个月时是如预期/正常的。
[1228]
结论
[1229]
直接滴注到伤口中的5.0ml制剂a(660mg布比卡因)在接受选择性开放性单侧无张力腹股沟疝气修补术的患者中的疼痛管理方面是安全和有效的。2.5ml制剂a(330mg布比卡因)没有被证明对腹股沟疝修补术中的疼痛管理足够有效。与安慰剂相比,5.0ml制剂a(660mg)在48和72小时内显著改善了术后平均运动时疼痛强度归一化auc。与安慰剂相比,用5.0ml制剂a(660mg)治疗的患者在手术后在48和72小时内需要显著更少的阿片类救援药物。在研究期间,与安慰剂相比,5.0ml制剂a(660mg)显著延长了距离第一次使用阿片类药物的时间。
[1230]
2.5ml制剂a(330mg)组中的功效终点在统计学上与安慰剂没有显著差异。然而,观察到1至48小时平均运动时疼痛强度归一化auc和第2天服用的medd相对于安慰剂的显著差异的趋势。在每个治疗组中观察到患者对总疼痛治疗的满意度,并且在整个研究期间持续。在所有治疗组中功能活性随时间推移而改善。观察到布比卡因的药代动力学与剂量成比
例,在施用制剂a后没有观察到药物释放突释。
[1231]
大多数ae的严重程度是轻度或中度,没有发生死亡或其它明显的ae。在6个月的随访期间,报告了在用2.5ml制剂a(330mg)和安慰剂治疗的患者中严重的ae的发生率相似,而在用5.0ml制剂a(660mg)治疗的患者中没有报告严重的ae。对心血管毒性的主动监测表明,在单次发作性暴露于制剂a和心脏事件之间不存在因果关联。与安慰剂相比,使用5.0ml制剂a(660mg)较少报告便秘、恶心、瘙痒、耳鸣、嗜睡、头晕、头痛、味觉障碍和感觉异常;然而,与安慰剂相比,使用5.0ml制剂a(660mg)更频繁地报告了术后出血、术后伤口并发症和心动过缓。
[1232]
与安慰剂相比,与5.0ml制剂a(660mg)相关的阿片类药物救援剂量的减少降低了阿片类相关的ae的发生率,包括头晕、恶心和呕吐,并且显著降低了便秘的发生率。生命体征或身体检查随时间的变化是最小的。在治疗组之间,异常或意外的手术部位愈合或组织评估或临床显著的实验室异常是不经常观察到的,并且发生率是相似的。对于ecg,制剂a没有显示出hr、pr、qrs或qtc持续时间的任何临床相关变化。然而,观察到qtcf延长,其不是剂量相关的,并且可能是由于样本量小、伴随的全身麻醉和qtc持续时间的自发变异性较大。该研究没有证明较低(2.5ml[330mg])或较高(5.0ml[660mg])剂量的制剂a的ecg效应明确且一致,表明较高剂量不会使患者暴露于更大的不利心血管效应风险。
[1233]
实施例19
[1234]
对患者进行盲法的ii期研究,以检查在接受选择性开放性腹股沟疝修补术的患者中直接滴注到伤口中的制剂a的药代动力学(pk)、安全性、耐受性和功效。手术过程在全身麻醉下进行。在本研究中,如上所述制备制剂a,其包含作为无菌溶液一起施用的3种组分(66重量%的乙酸异丁酸蔗糖酯、22.0重量%的苯甲醇和12.0重量%的布比卡因碱)。使用该制剂的目的是通过在几天的时间内缓慢释放布比卡因来提供延长的局部镇痛。
[1235]
目的
[1236]
主要目的-检查持续释放布比卡因组合物(即,如上所述的含有布比卡因、苯甲醇、乙酸异丁酸蔗糖酯的制剂a)的药代动力学,所述组合物直接滴注到接受选择性开放性腹股沟疝修补术的患者的伤口中。
[1237]
次要目的-检查直接滴注到接受选择性开放性腹股沟疝修补术的患者的伤口中的制剂a的安全性、功效和耐受性。
[1238]
方法
[1239]
该研究是一项试验性、患者盲法的ii期研究,以评价制剂a作为开放性腹股沟疝修补术患者的递送系统的药代动力学、安全性、耐受性和功效。该研究调查了将制剂a直接滴注到伤口中,其中患者被纳入两个治疗组:
[1240]
治疗组1-在伤口闭合期间,将2.5ml的制剂a以大约相等的体积局部放置到上部、中部和下部腱膜下间隙中。在外斜肌腱膜闭合后(和皮肤闭合前),将另外2.5ml制剂a沿缝合的外斜肌腱膜的长度局部放置。滴注到伤口中的制剂a的总递送体积为5.0ml。
[1241]
治疗组2-外斜肌腱膜闭合后(和皮肤闭合前),将5.0ml制剂a沿缝合的外斜肌腱膜的长度局部放置。滴注到伤口中的制剂a的总递送体积为5.0ml。
[1242]
患者数:计划的患者—最多12名患者,每组六个,以实现每组五个可评估的患者;进入的患者—12名患者,每个治疗组六个;完成的患者—12名患者,每个治疗组六个。
[1243]
诊断和将患者纳入研究的主要标准:研究群体包括在全身麻醉下进行腹股沟疝开放性修补术的男性和女性患者。
[1244]
治疗持续时间
[1245]
研究期持续至多21天。
[1246]
评价标准:
[1247]
功效:每日疼痛强度(数值评定量表)、每日阿片类药物救援镇痛和每日总镇痛。使用改良的简短疼痛清单来评价每日疼痛控制、最严重疼痛、最小疼痛、功能分析、治疗满意度和个体疼痛强度随时间的变化。
[1248]
安全性:副作用(ae)、伤口愈合和局部组织状况、实验室检验、身体检查和生命体征。改良的简短疼痛清单也记录了某些安全性评价,包括:恶心、呕吐、困倦、瘙痒、便秘、头晕、耳鸣、味觉障碍、感觉异常和注射研究药物后的排便次数。
[1249]
药代动力学:对所有患者数据进行非隔室pk分析,从这些患者中收集pk血样。
[1250]
统计方法:
[1251]
目标是每组中五名可评估的患者完成治疗,用作本研究的样本量计算。
[1252]
在每个时间点总结血浆布比卡因浓度,用winnonlin评估数据。使用线性梯形法则,将最大血浆浓度(cmax)、达到cmax所用的时间(tmax)和曲线下面积(auc)的参数按治疗组总结并使用线性通用方法比较。
[1253]
在预定时间点的平均疼痛强度评分的绘图用于同时评估两个治疗组。按治疗组总结了改良的简短疼痛清单数据,使用auc总结了疼痛控制、最严重的疼痛和最小疼痛。所有疼痛评估数据按治疗组总结。
[1254]
将所有含阿片类药物的药物编码成吗啡当量,并计算每天的总吗啡当量日剂量。计算在第0-5天、第6-14天和总体(第0-14天)每天服用的救援镇痛片剂的平均数量,并按治疗组总结。在第0-5天期间不需要救援镇痛的患者的比例按治疗组总结。
[1255]
治疗中出现的ae和严重不良事件(sae)的总发生率(数量和百分比)按治疗组总结。对于每种meddra系统器官类别和首选项,还在最大严重程度和与研究药物的关系方面评估ae的发生率。按治疗组总结了由改良的简短疼痛清单记录的报告每个常见安全性事件的患者的比例。手术部位愈合和局部组织状况数据按cc治疗组列出并总结。
[1256]
在每次访问时,按治疗组总结生命体征数据、从基线的变化以及在每个身体系统中具有异常发现的患者的数量和比例。总结关于典型排便的数据,并且按治疗组总结每24小时期间排便的次数。使用atc和who药品代码,按治疗组总结了所服用的伴随药物。
[1257]
列出实验室数据,与特定性别的正常范围比较,并计算从筛选到研究结束的任何变化。按治疗组总结观察到的数据和来自筛选的变化。按治疗组制作了从基线到治疗结束的异常低/正常/异常高值之间的血液学和生物化学参数的转移表。在治疗组之间比较具有被认为临床显著的异常值的患者的比例。
[1258]
结果
[1259]
功效结果
[1260]
在将制剂a滴注到腱膜下间隙中并沿着外斜肌腱膜滴注的治疗组1中,平均静止时疼痛强度评分在第0-1天内保持在相似水平,并在第2天开始下降。在仅沿着外斜肌腱膜滴注制剂a的治疗组2中,平均疼痛强度评分从第0天到第1天略微增加,随后在第2-3天疼痛水
平降低。总之,第2-5天的平均疼痛强度评分在治疗组2患者中始终高于治疗组1患者,并且疼痛强度auc也高于治疗组2的患者。(表19.1)
[1261]
表19.1-静止时疼痛强度评分(itt群体)
[1262][1263][1264]
sem=平均值的标准误差;ci=置信区间
[1265]
运动时疼痛强度评分也观察到类似的模式。大多数患者经历了良好、非常好的或优异的来自滴注到伤口中的制剂a的疼痛控制,而治疗组2中仅两个患者经历了一般的疼痛控制。当比较疼痛对照auc值时,在治疗组之间没有观察到显著的差异。在治疗组2中,在第1天最严重的疼痛评分较高,但到第2天,治疗组之间没有显著差异。在第1天,在治疗组2中,术后疼痛对行走能力、社会交往、保持睡眠和咳嗽的影响较高,但到第2天,对于大多数参
数,两组之间是相当的。大多数患者对制剂a治疗满意或非常满意,治疗组2中仅有两位患者(即,仅沿外斜肌腱膜滴注制剂a)对治疗相当不满意或仅一般满意。在评价的其它功效参数中,两组之间没有观察到差异。
[1266]
与将制剂a滴注到肌腱膜下间隙以及沿外斜肌腱膜滴注的治疗组1中的患者相比,在仅沿外斜肌腱膜滴注制剂a的治疗组2中的更多患者在第0-5天之间需要救援镇痛。然而,治疗组2中的患者仅在第0-5天需要救援镇痛,而治疗组1中的一个患者在第6-14天需要救援镇痛。
[1267]
表19.2-救援镇痛总日剂量(片剂,itt群体)
[1268][1269]
将研究期间所用的阿片类镇痛剂转化为静脉内吗啡当量日剂量(medd)单位,并将所得的补充阿片类镇痛剂的使用总结于下表中。在手术后的最初24小时,治疗组2中的患者比治疗组1中的患者需要更多的阿片类药物治疗。然而,在该24小时的时间后,治疗组2中的患者都不需要额外的阿片类镇痛,而治疗组1中的一些患者在第1-5天中需要阿片类镇痛。
[1270]
表19.3-阿片类药物镇痛使用的总结(medd,itt群体)
[1271][1272]
安全性结果
[1273]
治疗组之间的ae发生率是相当的。在每个治疗组中超过一个患者中报告的唯一ae是术后出血(六个患者中的三个)和恶心(六个患者中的两个)。两个治疗组在手术后的当天都经历恶心,而治疗组1的患者仅经历术后出血。个别患者在研究的前两天内报告了困倦和便秘。所有ae的严重程度都是轻度的(治疗组2中六位患者中的三位)或中度的(治疗组1中六位患者中的四位),并且都不被认为与研究治疗相关。
[1274]
在研究期间没有死亡或退出。在治疗组1的患者中,仅一位患者经历严重不良反应(sae),包括腹股沟疝的复发。认为sae与研究治疗无关,并且在研究过程中消退。
[1275]
以5.0ml的剂量将制剂a直接施用到伤口中没有引起对临床实验室、生命体征或身
体检查参数的安全性问题。此外,使用制剂a似乎不损害伤口愈合,尽管记录了12位患者中的三位患者的异常局部组织状况。将制剂a施用到腱膜下间隙并沿着外斜肌腱膜施用似乎与稍微更快地恢复正常排便有关。
[1276]
药代动力学结果
[1277]
在制剂a施用的1-4小时内观察到可定量的血浆布比卡因浓度,两个治疗组中的布比卡因浓度在约12-24小时内逐渐增加到最大浓度。通常维持持续水平(100-400ng/ml)48-72小时,然后浓度开始以单指数级下降。
[1278]
在本研究中,两个治疗组在施用方法方面不同,但两组施用的药物总体积为5.0ml。两组之间布比卡因的总体药代动力学参数是相似的,在组2中具有稍微更高的变异性(随着伤口浸润的总量)。
[1279]
在校正实际施用剂量并归一化为1ml剂量后,血浆布比卡因浓度似乎几乎是重叠的。
[1280]
结论
[1281]
在本研究中评价的两组之间布比卡因的药代动力学相似。该研究表明,以5.0ml的剂量滴注到腱膜下间隙并沿外斜肌腱膜滴注(治疗组1)或仅沿外斜肌腱膜滴注(治疗组2)的制剂a被良好地耐受,并且不会导致任何临床显著的ae。将制剂a滴注到腱膜下间隙中并沿着外斜肌腱膜滴注(治疗组1)显示出更好的功效,特别是在第1天,在疼痛强度评分以及疼痛干扰行走能力、社交互动、保持清醒和咳嗽的能力的时间量方面。与仅沿外斜肌腱膜滴注(治疗组2)相比,当将制剂a滴注到腱膜下间隙中并沿外斜肌腱膜滴注(治疗组1)时,患者对其总体疼痛控制和治疗满意度的评价更高。将制剂a滴注到腱膜下间隙中并沿外斜肌腱膜滴注(治疗组1)与在手术后的前几天中减少对补充性救援和阿片类药物镇痛的需要有关。
[1282]
实施例20
[1283]
进行随机双盲安慰剂对照研究以检查在经历选择性开放性腹股沟疝修补术的受试者中皮下施用或施用到腱膜下间隙中的制剂a的功效、耐受性和安全性。在本研究中,如上所述制备制剂a和安慰剂,并总结如下:
[1284]
组合物:制剂a-持续释放的布比卡因组合物活性成分:布比卡因碱非活性成分:乙酸异丁酸蔗糖酯,苯甲醇规格:132mg/ml,660mg布比卡因
[1285]
组合物安慰剂活性成分:不适用非活性成分:乙酸异丁酸蔗糖酯,苯甲醇
[1286]
目的
[1287]
主要目的-主要目的是确定在接受选择性开放性腹股沟疝修补术的受试者中皮下施用或施用到腱膜下间隙中的制剂a的功效。
[1288]
次要目的-次要目的是确定在接受选择性开放性腹股沟疝修补术的受试者中皮下施用或施用到腱膜下间隙中的制剂a的安全性和耐受性。
[1289]
由于施用方式在队列1和队列2之间不同,研究目标是针对每个队列专门定义的。
[1290]
方法
[1291]
这是一项随机、双盲、安慰剂对照的2期研究,以检查在整个腱膜下和皮下间隙滴注、通过注射施用到腱膜下间隙或皮下施用的制剂a在接受选择性开放性腹股沟疝修补术的受试者中的功效,并评估作为递送系统的制剂a的安全性和耐受性。
[1292]
在2个单独的和连续的队列(队列1和队列2,总结如下)中进行研究。将大约相等数量的受试者依次招募到每个队列。研究持续时间最长达21天,包括筛选、入院和手术(第0天)、术后评估、出院和随访至第14天。
[1293]
在第1、2、4和5天通过电话评价受试者,并在第3和14天返回诊所(随访)。受试者从第0天到第5天在日记卡上记录疼痛强度(pi)、伴随药物、不良事件(ae)和救援镇痛。受试者还记录了直到第14天的ae和伴随药物。
[1294]
队列1
[1295]
在即将进行手术之前,以1:1:1的比例随机分配45个受试者以接受以下治疗之一:
[1296]
治疗组1:在伤口闭合之前,将5.0ml安慰剂注射到上部、中部和下部腱膜下间隙。伤口闭合后,沿切口线(建议切口总长度为4-6cm)每侧以2次尾随皮下注射的方式施用制剂a。制剂a的总递送体积为5.0ml。
[1297]
治疗组2:在伤口闭合之前,将5.0ml制剂a(12.0重量%,132mg/ml布比卡因)注射到上部、中部和下部腱膜下间隙。伤口闭合后,沿切口线(建议切口总长度为4-6cm)每侧以2次尾随皮下注射的方式施用安慰剂。安慰剂的总递送体积为5.0ml。
[1298]
治疗组3:在伤口闭合之前,将5.0ml安慰剂注射到上部、中部和下部腱膜下间隙。伤口闭合后,沿切口线(建议切口总长度为4-6cm)每侧以2次尾随皮下注射的方式施用安慰剂。安慰剂的皮下总递送体积为5.0ml。安慰剂的总递送体积为10.0ml。
[1299]
队列2
[1300]
在手术之前即刻以1:1招募比例随机分配第二组的45名受试者以接受以下治疗之一:
[1301]
治疗组4:在伤口闭合期间,将5.0ml安慰剂逐渐滴注到整个腹股沟管和腹壁层以覆盖伤口的所有创面,填充腱膜下和皮下间隙。
[1302]
治疗组5:在伤口闭合期间,将5.0ml制剂a逐渐滴注到整个腹股沟管和腹壁层以覆盖伤口的所有创面,填充腱膜下和皮下间隙(7.5ml,指定用于包含治疗5a的队列2a)。
[1303]
受试者数量:计划招募90名受试者,以确保72名计划接受腹股沟疝非卧床(ambulatory)开放性修补术的可评估受试者。在每个队列中,90名受试者被均匀地分成每个队列45名受试者。
[1304]
最终目标是至少72名可评估受试者完成研究(每个队列36名受试者,队列1的每个治疗组12名受试者和队列2的每个治疗组18名受试者)。
[1305]
总共45名受试者被招募到队列1;13名进入治疗1,18名进入治疗2,和14名进入治疗3,所有45名受试者完成队列1。总共44名受试者被招募到队列2;21名进入治疗4,1名进入治疗5a,且22名进入治疗5。四十一名受试者完成队列2;1名治疗4中的受试者和2名治疗5中的受试者失去随访。
[1306]
诊断和将患者纳入研究的主要标准:研究群体包括计划接受腹股沟疝的非卧床开放性修补术的男性和女性受试者,需要4至6cm长的切口,健康状况良好,并且年龄在18岁以
上。
[1307]
试验产品、剂量和施用方式
[1308]
队列1
[1309]
治疗1:使用10.0-ml小瓶的制剂a(12.0重量%)来填充5.0-ml注射器,用于5.0ml皮下注射。
[1310]
治疗2:使用10.0-ml小瓶的制剂a(12.0重量%)来填充5.0-ml注射器,以将5.0ml注射到上部、中部和下部腱膜下间隙中。
[1311]
队列2
[1312]
治疗5a:使用10.0-ml小瓶的制剂a(12.0重量%)来填充10.0-ml注射器,以将7.5ml滴注到腱膜下和皮下间隙中。
[1313]
治疗5:使用10.0-ml小瓶的制剂a(12.0重量%)来填充10.0-ml注射器以将5.0ml滴注到腱膜下和皮下间隙中。
[1314]
参考疗法、剂量和施用模式
[1315]
队列1
[1316]
治疗1:用10.0ml小瓶的安慰剂用于抽取5.0ml注射器,用于将5.0ml注射到上部、中部和下部腱膜下间隙中。
[1317]
治疗2:10.0-ml小瓶的安慰剂用于抽取5.0-ml注射器以进行5.0-ml皮下注射。
[1318]
治疗3:用10.0-ml小瓶的安慰剂用于抽取5.0-ml注射器,用于进行5.0-ml皮下注射和将5.0ml注射到上部、中部和下部腱膜下间隙中。
[1319]
队列2
[1320]
治疗4:用10.0-ml小瓶的安慰剂(12.0重量%)抽取10.0-ml注射器,将5.0ml滴注到腱膜下和皮下间隙中。
[1321]
治疗持续时间
[1322]
受试者接受单剂量的制剂a。研究持续时间最长达21天,包括筛选、入院和手术(第0天)、术后评价、出院和随访至第14天。
[1323]
评价标准:
[1324]
功效:使用受试者对pi的自评和在受试者日记中收集的疼痛控制(第0至5天)、改良的简短疼痛清单(第1至5天)和受试者使用伴随的救援镇痛药物(第0至14天)来评价功效。主要功效终点是pi和疼痛控制。次要功效终点是随着时间的推移,最严重和最轻的疼痛评分、救援镇痛使用、功能、总体治疗满意度和个体pi评分。
[1325]
安全性:安全性评价包括ae;实验室检验的评估,例如化学、血液学和尿分析;血清妊娠试验(如果适用);生命体征的定期监测;12导联心电图(ecg);伴随药物;和身体检查。评价还包括手术部位愈合和局部组织状况。
[1326]
统计方法:
[1327]
使用sas 8.2版产生表和列表。病例报告表(crf)上收集的所有功效和安全性数据呈现在按治疗组、地点、受试者编号、日期和时间排序的列表中。呈现了治疗组的数据总结。对于连续变量,数据按治疗组以受试者的数量(n)、平均值、标准偏差(sd)、中值、最小值和最大值进行总结。对于分类变量,将数据与每个类别的受试者的数量和比例按治疗组制成表。
[1328]
使用双向检验在5%显著性水平进行统计学检验。由于该2期研究的探索性,对于任何分析都没有进行多重性调整。
[1329]
主要关注的比较是在治疗5和合并安慰剂之间。还报告了制剂a、治疗2和治疗1以及合并安慰剂之间比较的显著性。
[1330]
根据监管活动医学词典(meddra)8.0版系统器官类别和首选项,报告每个治疗组的治疗中出现的ae的发生率(数量和百分比)。对第0天发作的ae提供单独的总发病率总结。
[1331]
按照研究日和治疗将改良的短暂疼痛目录的具体安全性评价制成表。所有研究日的发生率也按照治疗总结。
[1332]
按每个治疗组的受试者随时间推移的发生率(n和百分比)总结手术部位愈合和局部组织状况评价并制成表。
[1333]
所有实验室检验结果按受试者、实验室小组和参数以及收集时间列出。
[1334]
筛查体检结果的异常或变化以列表形式呈现。
[1335]
在每个收集时间点,描述性地列出每个治疗组的生命体征。对于每种治疗和预定的间隔,总结了从基线(给药前)生命体征的变化。在这些总结中没有使用重复读数。
[1336]
筛选和计划外ecg在列表中呈现。
[1337]
结果
[1338]
功效结果:
[1339]
符合方案(pp)群体分析的结果显示,对于运动期间pi的主要终点,制剂a治疗组没有明显优于合并安慰剂组。治疗1(5.0ml制剂a,皮下)和2(5.0ml制剂a,腱膜下)在数值上优于安慰剂,但这些差异未达到统计学显著性。对于静止时pi的主要终点,观察到类似的结果。唯一的统计学显著差异代表与合并安慰剂相比在治疗5(5.0ml制剂a)中的较高pi值(p=0.014)。在次要终点的分析中,治疗2(5.0ml制剂a,腱膜下)的距离第一次救援镇痛的时间比合并的安慰剂(p=0.009)显著更长。
[1340]
分别对2个队列进行随时间的pi的事后分析。在队列1中,3个治疗组之间的疼痛评估没有显著差异。与安慰剂相比,在评价期间,制剂a腱膜下和皮下治疗组需要较少的阿片类药物使用。在队列2中,没有观察到制剂a治疗组与安慰剂相比总体累积阿片类救援药物使用的减少趋势。
[1341]
安全性结果:
[1342]
治疗组之间的总体不良反应(ae)频率相似。最常报告的治疗中出现的ae是恶心(总共46个事件;治疗1中6个,治疗2中10个,治疗5中12个,治疗5a中1个,和合并安慰剂中17个)、眩晕(总共42个事件;治疗1中4个,治疗2中5个,治疗5中13个,治疗5a中0个,和合并的安慰剂中20个)、便秘(总共40个事件;治疗1中5个,治疗2中7个,治疗5中15个,治疗5a中0个,和合并的安慰剂中13个)和嗜睡(总共38个事件;治疗1中4个,治疗2中2个,治疗5中13个,治疗5a中1个,和合并的安慰剂中18个)。大多数治疗中出现的ae具有轻度或中度的严重程度。没有由于ae导致的死亡或停止。发生三种严重不良作用(sae)(血管迷走性晕厥、直立性低血压和少尿);所有这些事件的强度都是中等的,并且研究者认为没有事件与研究药物相关。
[1343]
对关注的特定安全性评价的分析没有表明任何阿片类相关的安全性问题。所有治疗组中约50%的受试者报告恶心、嗜睡、眩晕和便秘。呕吐、耳鸣、瘙痒、味觉障碍和感觉异
常也以高频率发生。在制剂a和合并安慰剂治疗组之间,这些事件的发生频率存在若干差异:制剂a治疗组中有7名受试者(7/40,17.5%)出现呕吐,而安慰剂组中有3名受试者(3/35,8.6%)出现呕吐;制剂a治疗组有3名受试者(3/40,7.5%)出现味觉障碍,而安慰剂组有6名受试者(6/35,17.1%)出现味觉障碍;并且制剂a治疗组中有4名受试者(4/40,10.0%)出现感觉异常,而安慰剂组中7名受试者(7/35,20.0%)出现感觉异常。
[1344]
对关注的特定安全性评价的事后分析显示,在队列1中用制剂a治疗的阿片类药物相关副作用的发生率降低。与安慰剂相比,制剂a治疗组中眩晕和嗜睡的神经系统障碍的频率更低。具体地,安慰剂组的眩晕频率为64.3%,制剂a腱膜下治疗组(治疗2)的眩晕频率为27.8%,并且制剂a皮下治疗组(治疗1)的眩晕频率为30.8%。安慰剂组的嗜睡频率为50.0%,制剂a腱膜下治疗组(治疗2)的嗜睡频率为11.1%,并且制剂a皮下治疗组(治疗1)的嗜睡频率为30.8%。与安慰剂相比,这种阿片类药物相关副作用的发生率降低与制剂a治疗组中阿片类药物使用的减少相关。
[1345]
结论
[1346]
主要指定分析虽然在数值上优于安慰剂,但不能提供对功效的总体假设的统计学支持。队列1中事后分析的结果显示,与安慰剂相比,制剂a治疗组中阿片类相关副作用的频率降低,这对应于与安慰剂组相比,制剂a治疗组中阿片类药物使用的减少。此外,这些事后分析显示,与安慰剂组相比,制剂a腱膜下疼痛治疗组在术后第一天疼痛减轻,而在制剂a皮下治疗组和安慰剂组之间没有观察到疼痛评分的差异。
[1347]
实施例21
[1348]
比较了含有布比卡因游离碱、三醋精和聚(丙交酯-共-乙交酯)(plga)或聚原酸酯(poe)的制剂的溶出曲线。
[1349]
体外溶出曲线
[1350]
为了比较溶出曲线,制备具有相同重量百分比的布比卡因并具有相同聚合物/溶剂比的组合物,并如附件a(exhibit a)中所述进行测试。如下表21.1中所总结的,测试的组合物的不同之处在于具有重均分子量为16kda的聚(丙交酯-共-乙交酯)(plga)或重均分子量为5kda的聚原酸酯(poe)。
[1351]
表21.1:每种测试制剂的组成
[1352][1353][1354]
根据下述方法评价布比卡因从组合物中的体外释放。图30显示布比卡因从plga和poe组合物中的平均累积释放。
[1355]
从plga组合物中的释放显示出比从poe组合物中的释放更大的可变性,如图30中
的较大误差条(标准偏差)所示,更大的可变性也在图31中显而易见,其显示了每种制剂的六次重复中的每一次的个体释放曲线。涉及poe组合物的六次重复是poe1至poe6,涉及plga组合物的六次重复是plga1至plga6。
[1356]
布比卡因的体外累积释放
[1357]
布比卡因的体外累积释放如下测定。
[1358]
材料
[1359]
布比卡因-聚(丙交酯-共-乙交酯)(plga)组合物制备如下。将布比卡因碱分散在三醋精中。将plga(50:50l:g,mw=16kda,mn=8kda,用1-十二烷醇引发)加入到布比卡因-三醋精混合物中。将所得混合物均化。
[1360]
布比卡因-聚原酸酯(poe)组合物按如下方法制备。将poe(90:80:20detosu:teg:teg-digl,mw=5kda,mn=3kda)与三醋精混合。将混合物翻转4.5小时。将布比卡因碱加入到三醋精-poe混合物中。将所得混合物均化。
[1361]
溶出度测试
[1362]
使用usp仪器ii测量溶出度。通过套管装载约0.5ml的每种制剂,并注射到900ml的37
±
0.5℃的溶出介质(0.025m磷酸钠缓冲液,ph 7.4,含有0.03%十二烷基硫酸钠)中。usp装置ii设定为50rpm,在1、4、8、12、18、24、36、48和72小时以及之后每天收集样品。分别收集poe和plga组合物的样品,持续5天和14天。每种组合物获得六次重复。通过hplc分析收集的样品中布比卡因的含量。
[1363]
已经如此描述了本发明,对本领域技术人员显而易见的本发明的变化和修改将被理解为在所附权利要求的范围内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1