间变性淋巴瘤激酶嵌合抗原受体和使用方法与流程
间变性淋巴瘤激酶嵌合抗原受体和使用方法
1.[相关申请案的对照参考]
[0002]
本技术主张于2020年1月28日提出申请的美国临时专利申请案第62/966,748的号的优先权,其内容以参考方式全部并入本文。
背景技术:
[0003]
间变性淋巴瘤激酶(alk)是胰岛素受体超家族中的一种受体酪氨酸激酶,在大脑和神经系统的发育中起重要作用。alk由蛋白酶体加工成肽,通过与抗原加工-1和-2(tap1和tap2)相关的转运蛋白转运至内质网,并与hla i类分子结合。alk在成年期由正常组织最低限度地表达。然而,alk是由肿瘤异常表达,例如非小细胞肺癌(nsclc)、间变性大细胞淋巴瘤(alcl)和神经母细胞瘤。更罕见的是,alk是由b细胞淋巴瘤、甲状腺癌、结肠癌、乳腺癌、炎性成肌纤维细胞瘤(imt)、肾癌、食管癌和黑色素瘤所表达。因此,alk是跨不同类型癌症的理想共享抗原。alk可能通过与其他基因形成融合基因,通过获得额外的基因拷贝或通过基因突变而成为致癌物质。
[0004]
几种alk酪氨酸激酶抑制剂(tki)可用于治疗alk重排的nsclc,包括克唑替尼(crizotinib)、色瑞替尼(ceritinib)、阿来替尼(alectinib)、布格替尼(brigatinib)和劳拉替尼(lorlatinib)。不幸的是,通过多种机制,对这些药物的耐药性会在1至2年内发生。一旦患者对可用的alk抑制剂产生耐药性,由于这类人群对pd-1通路抑制剂的反应率非常低,他们通常会接受细胞毒性化学治疗而不是免疫治疗。尽管pd-1抑制剂如帕博利珠单抗(pembrolizumab,可瑞达)和纳武单抗(nivolumab,欧狄沃))已经彻底改变肺癌的治疗,尤其是与吸烟相关的癌症,但大多数alk阳性肺癌患者对这些免疫治疗没有反应。因此,显然需要在alk阳性癌症中开发额外的alk靶向治疗。
[0005]
[以参考方式并入]
[0006]
本说明书中所提及的所有出版物、专利和专利申请案均以参考方式并入本文,其程度与单独的出版物、专利或专利申请案被具体且单独地指示以参考方式并入的程度相同。除非另有说明,否则本说明书中所提及的出版物、专利和专利申请案整体是以参考方式并入本文。
技术实现要素:
[0007]
如下所述,本发明的特征在于间变性淋巴瘤激酶嵌合抗原受体(alk car)。本发明还提供包含alk car的工程化免疫细胞、编码alk car的多核苷酸、其药物组合物以及用于施用其的试剂盒。本发明还提供通过施用alk car、包含alk car的工程化免疫细胞或编码alk car的多核苷酸或其药物组合物来治疗患有疾病的受试者的方法。
[0008]
本发明的一个方面提供一种间变性淋巴瘤激酶嵌合抗原受体(alk car),包含:胞外结合域,其包含重链互补决定区1(hcdr1)、重链互补决定区2(hcdr2)和重链互补决定区3(hcdr3),其各自包含与表4中所述的抗alk抗体的hcdr1、hcdr2和hcdr3序列至少80%相同的氨基酸序列,其中,所述胞外结合域特异性结合至间变性淋巴瘤激酶(alk)多肽或其抗体
结合片段;跨膜域;和至少一个信号传送域。
[0009]
在一些实施方案中,所述胞外结合域包含表4中所述的抗alk抗体的hcdr1、hcdr2和hcdr3氨基酸序列。在一些实施方案中,所述胞外结合域还包含轻链互补决定区1(lcdr1)、轻链互补决定区2(lcdr2)和轻链互补决定区3(lcdr3),其各自包含与表3中所述的抗alk抗体的lcdr1、lcdr2和lcdr3序列至少80%相同的氨基酸序列。在一些实施方案中,所述胞外结合域包含表3中所述的抗alk抗体的lcdr1、lcdr2和lcdr3氨基酸序列。
[0010]
在另一方面,本发明提供一种间变性淋巴瘤激酶嵌合抗原受体(alk car),包含:胞外结合域,其包含重链可变区(vh),所述重链可变区(vh)包含与表2中所述的抗alk抗体的vh至少80%相同的氨基酸序列,其中,所述胞外结合域特异性结合至间变性淋巴瘤激酶(alk)多肽或其抗体结合片段;和跨膜域;和至少一个信号传送域。
[0011]
在一些实施方案中,所述胞外结合域包含表2中所述的抗alk抗体的vh。在一些实施方案中,所述胞外结合域还包含轻链可变区(vl),所述轻链可变区(vl)包含与表1中所述的抗alk抗体的vl至少80%相同的氨基酸序列。在一些实施方案中,所述胞外结合域包含表1中所述的抗alk抗体的vl。在一些实施方案中,所述vh包含人类框架区。在一些实施方案中,所述vl包含人类框架区。
[0012]
在一些实施方案中,alk car包含接头。在一些实施方案中,所述接头是柔性肽接头。在一些实施方案中,所述接头是(gly4ser)n。在一些实施方案中,所述alk car包含报导基因。在一些实施方案中,所述报导基因是绿色荧光蛋白(gfp)。在一些实施方案中,所述胞外结合域是scfv。
[0013]
在一些实施方案中,所述抗alk抗体包含vh cdr氨基酸序列sywmn、qiypgdgdtnyngkfkg和yyygskay,和vl cdr氨基酸序列raseniyysla、nansled、kqaydvpft。
[0014]
在一些实施方案中,所述抗alk抗体包含vh cdr氨基酸序列sywmh、ridpnsggtkynekfks和dyygssyrfay,和vl cdr氨基酸序列svsqgisnsln、ytsslhs和qqysklplt。
[0015]
在一些实施方案中,所述抗alk抗体包含vh cdr氨基酸序列nywmh、yinpssgytkynqkfkd和dyygssswfay,和vl cdr氨基酸序列kasqnvgtnva、sasyrys和qqynsypymyt。
[0016]
在一些实施方案中,所述抗alk抗体包含vh cdr氨基酸序列sywvn、qiypgdgdtnyngkfkg和srgyfygstyds,和vl cdr氨基酸序列rasesvdnygisfmn、aasnqgs和qqskevpwt。
[0017]
在一些实施方案中,所述抗alk抗体包含vh cdr氨基酸序列sywmh、yikpssgytkynqkfkd和dyygssswfay,和vl cdr氨基酸序列kasqnvgtnva、sasyrys和qqynsypymyt。
[0018]
在一些实施方案中,所述抗alk抗体包含vh cdr氨基酸序列syams、yissggdyiyyadtvkg和eriwlrrffdv,和vl cdr氨基酸序列kasqnvgtava、sasnrft和qqyssyplt。
[0019]
在一些实施方案中,所述抗alk抗体包含vh cdr氨基酸序列sywmh、yinpssgytkynqkfkd和dyygssswfay,和vl cdr氨基酸序列kasqnvgtnva、sasyrys和qrynsypymft。
[0020]
在一些实施方案中,所述抗alk抗体包含vh氨基酸序列qvqlqqsgaelvkpgasvkisckasgyafssywmnwvkqrpgkglewigqiypgdgdtnyngkfkgkatltadkssstaymqlssltsedsavyfcasyyygskaywgqgtlvtvsa,和vl氨基酸序列diqmtqspaslaasvgetvtitcraseniyyslawyqqkqgkspqlliynansledgvpsrfsgsgsgtqysmkinsmqpedtatyfckqaydvpftfgsgtkleikr。
[0021]
在一些实施方案中,所述抗alk抗体包含vh氨基酸序列qvqlqqpgaefvkpgasvklsckasgytftsywmhwvkqrpgrglewigridpnsggtkynekfkskatltvdkpsstaymqlssltsedsavyycardyygssyrfaywgqgtlvtvsa,和vl氨基酸序列aiqmtqttsslsaslgdrvtiscsvsqgisnslnwyqqkpdgtvklliyytsslhsgvpsrfsgsgsgtdysltisnlepediatyycqqysklpltfgagtklelkr。
[0022]
在一些实施方案中,所述抗alk抗体包含vh氨基酸序列qvqlqqsgaelakpgasvklsckasgytftnywmhwvkqrpgqglewigyinpssgytkynqkfkdkatltadkssstaymqlssltyedsavyycardyygssswfaywgqgtlvtvsa,和vl氨基酸序列divmtqsqrfmstsvgdrvsvtckasqnvgtnvawyqqkpgqspkaliysasyrysgvpdrftgsgsgtdftltvsnvqsedlaeyfcqqynsypymytfgggtkleikr。
[0023]
在一些实施方案中,所述抗alk抗体包含vh氨基酸序列qvqlqqsgaelvkpgasvkisckasgyafssywvnwvkqrpgkglewigqiypgdgdtnyngkfkgkatltadkssstaymqlssltsedsavyfcarsrgyfygstydswgqgttltvss,和vl氨基酸序列divltqspaslavslgqratiscrasesvdnygisfmnwfqqkpgqppklliyaasnqgsgvparfsgsgsgtdfslnihpmeeddtamyfcqqskevpwtfgggtkleikr。
[0024]
在一些实施方案中,所述抗alk抗体包含vh氨基酸序列qvqlqqsgaelakpgasvklsckasgytftsywmhwvkqrpgqglewigyikpssgytkynqkfkdkatltadkssstaymqlssltyedsavyycardyygssswfaywgqgtlvtvsa,和vl氨基酸序列divmtqsqrfmstsvgdrvsvtckasqnvgtnvawyqqkpgqspkaliysasyrysgvpdrftgsgsgtdftltisnvqsedlaeyfcqqynsypymytfgggtkleikr。
[0025]
在一些实施方案中,所述抗alk抗体包含vh氨基酸序列dvklvesgeglvkpggslklscaasgftfssyamswvrqtpekrlewvtyissggdyiyyadtvkgrftisrdnarntlylqmsslksedtamyyctreriwlrrffdvwgtgttvtvss,和vl氨基酸序列divmtqsqkfmstsvgdrvsitckasqnvgtavawyqlkpgqspklliysasnrftgvpdrftgsgsgtdftltisnmqsedladyfcqqyssypltfgsgtkleikr。
[0026]
在一些实施方案中,所述抗alk抗体包含vh氨基酸序列qvqlqqsgaelakpgasvklsckasgytftsywmhwvkqrpgqglewigyinpssgytkynqkfkdkatltadkssstaymqlssltfedsavyycardyygssswfaywgqgtlvtvsa,和vl氨基酸序列divmtqsqkfmstsvgdrvsvtckasqnvgtnvawyqqkpghspkaliysasyrysgvpdrftgsgsgtdftltisnvqsedlaeyfcqrynsypymftfgggtkleikr。
[0027]
在一些实施方案中,所述跨膜域是选自由cd8、cd137(4-1bb)和cd28所组成的群组。在一些实施方案中,所述跨膜域是cd8。在一些实施方案中,所述至少一个信号传送域是选自由cd8、cd28、cd134(ox40)、cd137(4-1bb)和cd3ζ所组成的群组。在一些实施方案中,所述至少一个信号传送域是cd28和cd3ζ。
[0028]
在一些实施方案中,所述alk car的结构5'至3'包含:所述胞外结合域、cd8跨膜域、cd28信号传送域和cd3ζ信号传送域。在一些实施方案中,所述alk car包含信号肽。在一些实施方案中,所述信号肽是mcd8、cd8α或gm-csf。在一些实施方案中,所述alk car包含剪接供体和/或剪接受体位点。在一些实施方案中,所述alk car包含包装信号。在一些实施方案中,所述alk car包含m1928z car的主链结构和域。在一些实施方案中,所述胞外结合域特异性结合至间变性淋巴瘤激酶(alk)多肽或其抗体结合片段的胞外结构域。
[0029]
本发明的一方面提供如本文所提供的一种编码alk car的多核苷酸。
[0030]
在另一方面,本发明提供如本文所提供的一种多核苷酸的载体。在一些实施方案中,所述载体是病毒载体。在一些实施方案中,所述载体是慢病毒、逆转录病毒、腺病毒、腺相关病毒(aav)、质粒、转座子和插入序列、或人工染色体载体。在一些实施方案中,所述载体包含启动子,所述启动子可操作地连接至编码所述alk car的所述多核苷酸序列。
[0031]
本发明的一方面,提供如本文所提供的一种在细胞表面膜表达alk car的工程化免疫细胞。
[0032]
在另一方面,本发明提供如本文所提供的一种通过用多核苷酸转化免疫细胞或用如本文所提供的载体转导所产生的工程化免疫细胞。在一些实施方案中,所述工程化免疫细胞是源自炎性t-淋巴细胞、细胞毒性t-淋巴细胞、调节性t-淋巴细胞、自然杀伤t(nkt)细胞、自然杀伤(nk)细胞或辅助性t淋巴细胞。在一些实施方案中,所述工程化免疫细胞进一步表达一种或多种细胞因子。在一些实施方案中,所述细胞因子是选自由以下所组成的群组:白细胞介素-1(il-1)、白细胞介素-2(il-2)、白细胞介素-4(il-4)、白细胞介素-6(il-6)、白细胞介素-7(il-7)、白细胞介素-12(il-12)、白细胞介素-15(il-15)、白细胞介素-21(il-21)、蛋白质记忆t细胞引诱剂“调节激活正常t细胞表达和分泌因子”(regulated on activation,normal t expressed and secreted,rantes)、粒细胞-巨噬细胞-集落刺激因子(gm-csf)、肿瘤坏死因子-α(tnf-α)或干扰素-γ(ifn-γ)、和巨噬细胞炎症蛋白1α(mip-1α)。在一些实施方案中,所述细胞因子是人类细胞因子。
[0033]
在一些实施方案中,所述工程化免疫细胞是用于alk-阳性癌症的治疗的用途。在一些实施方案中,所述alk-阳性癌症是选自由非小细胞肺癌(nsclc)、间变性大细胞淋巴瘤(alcl)、神经母细胞瘤、b细胞淋巴瘤、甲状腺癌、结肠癌、乳腺癌、炎性成肌纤维细胞瘤(imt)、肾癌、食管癌和黑色素瘤所组成的群组。在一些实施方案中,所述alk-阳性癌症是神经母细胞瘤或黑色素瘤。在一些实施方案中,所述alk-阳性癌症是神经母细胞瘤。在一些实施方案中,所述alk-阳性癌症具有alk
f1174l
活化点突变。
[0034]
本发明的一方面,提供一种工程改造免疫细胞的方法,包含:提供免疫细胞;和在所述免疫细胞的表面表达至少一种如本文所提供的alk car。
[0035]
在另一方面,本发明提供一种工程改造免疫细胞的方法,包含:提供免疫细胞;将如本文所提供的多核苷酸引入所述免疫细胞;和将所述多核苷酸表达于所述免疫细胞中。在一些实施方案中,所述免疫细胞是分离自受试者。在一些实施方案中,所述免疫细胞是选自炎性t-淋巴细胞、细胞毒性t-淋巴细胞、调节性t-淋巴细胞、自然杀伤t(nkt)细胞、自然杀伤(nk)细胞或辅助性t淋巴细胞。
[0036]
本发明的一方面,提供一种药物组合物,其包含如本文所提供的alk car、如本文所提供的多核苷酸或如本文所提供的工程化免疫细胞,和药学上可接受的载体、稀释剂或赋形剂。在一些实施方案中,所述组合物包含有效量的如本文所提供的alk car、如本文所提供的多核苷酸或如本文所提供的工程化免疫细胞。
[0037]
在另一方面,本发明提供一种治疗患有alk-阳性癌症的受试者的方法,包含将如本文所提供的药物组合物施用于受试者。
[0038]
在又一方面,本发明提供一种治疗患有alk-阳性癌症的受试者的方法,包含将如本文所提供的alk car、如本文所提供的多核苷酸或如本文所提供的工程化免疫细胞施用于受试者。
[0039]
在另一方面,本发明提供一种治疗患有alk-阳性癌症的受试者的方法,所述方法包含:将免疫细胞用如本文所提供的载体进行转化,以获得工程化免疫细胞,其中,所述免疫细胞包含如本文所提供的多核苷酸;和将有效量的工程化免疫细胞施用于所述受试者。在一些实施方案中,所述免疫细胞是来源于所述受试者。在一些实施方案中,所述免疫细胞是来源于供体。在一些实施方案中,所述方法包含将有效量的alk疫苗施用于所述受试者,其中,所述alk疫苗包含至少一种分离的alk多肽或多核苷酸。
[0040]
本发明的一方面,提供一种治疗患有alk-阳性癌症的受试者的方法,所述方法包含将含有alk car的有效量的工程化免疫细胞和含有至少一种分离的alk多肽或多核苷酸的有效量的alk疫苗施用于所述受试者。在一些实施方案中,所述工程化免疫细胞是与所述alk疫苗同时或依次施用于所述受试者。在一些实施方案中,所述alk多肽或多核苷酸是缀合至两亲体。在一些实施方案中,所述两亲体是n-羟基琥珀酰亚胺酯-末端-官能化的聚(乙二醇)-脂质(nhs-peg2kda-dspe)。在一些实施方案中,所述方法包含同时或依次将有效量的一种或多种的alk抑制剂、免疫检查点抑制剂和/或酪氨酸激酶抑制剂(tki)进行施用。在一些实施方案中,所述方法包含同时或依次将有效量的酪氨酸激酶抑制剂(tki)进行施用。在一些实施方案中,所述tki是劳拉替尼。在一些实施方案中,所述方法包含同时或依次将有效量的免疫抑制剂进行施用。在一些实施方案中,所述免疫抑制剂是环磷酰胺(ctx)。
[0041]
在一些实施方案中,所述受试者是哺乳动物。在一些实施方案中,所述受试者是人类或啮齿动物。在一些实施方案中,所述alk-阳性癌症是选自由非小细胞肺癌(nsclc)、间变性大细胞淋巴瘤(alcl)、神经母细胞瘤、b细胞淋巴瘤、甲状腺癌、结肠癌、乳腺癌、炎性成肌纤维细胞瘤(imt)、肾癌、食管癌和黑色素瘤所组成的群组。在一些实施方案中,所述alk-阳性癌症是神经母细胞瘤或黑色素瘤。在一些实施方案中,所述alk-阳性癌症具有alk
f1174l
活化点突变。
[0042]
本发明提供一种试剂盒,其包含用于施用至受试者的试剂。在一些实施方案中,所述试剂是如本文所提供的alk car、如本文所提供的多核苷酸、如本文所提供的工程化免疫细胞、如本文所提供的药物组合物或如本文所提供的载体。在一些实施方案中,所述试剂盒包含用于使用所述试剂盒的说明书。
[0043]
本发明所定义的组合物和制品是分离的或以其他方式结合下文所提供的实施例所制造的。本发明的其他特征和优点将从详细描述和权利要求书中显而易见。
[0044]
[定义]
[0045]
除非另有定义,否则本文使用的所有技术和科学术语均具有本发明所属或涉及的本领域技术人员所通常理解的含义。以下参考文献为技术人员提供了本发明中使用的许多术语的常规定义:singleton等人,dictionary of microbiology and molecular biology(2nd ed.1994);the cambridge dictionary of science and technology(walker ed.,1988);the glossary of genetics,5th ed.,r.rieger等人(eds.),springer verlag(1991);benjamin lewin,genes v,published by oxford university press,1994(isbn 0-19-854287-9);kendrew等人(eds.);the encyclopedia of molecular biology,published by blackwell science ltd.,1994(isbn 0-632-02182-9);molecular biology and biotechnology:a comprehensive desk reference,robert a.meyers(ed.),published by vch publishers,inc.,1995(isbn 1-56081-569-8);和hale&
marham,the harper collins dictionary of biology(1991)。如本文所用,除非另有说明,否则以下术语具有下文赋予它们的含义。
[0046]“佐剂”是指非特异性增强对抗原的免疫应答的物质或载体。佐剂可以包括吸附抗原的矿物质(例如,矾(alum)、氢氧化铝或磷酸盐)的悬浮液;或油包水乳剂,其中抗原溶液在矿物油(例如,弗氏不完全佐剂)中乳化,有时包含灭活的分枝杆菌(弗氏完全佐剂)以进一步增强抗原性。免疫刺激性寡核苷酸(诸如包括cpg基序的那些)也可以用作佐剂(参见,例如,美国专利案第6,194,388;6,207,646;6,214,806;6,218,371;6,239,116;6,339,068;6,406,705;和6,429,199号)。佐剂还包括生物分子,诸如共刺激分子。在一些实施方案中,生物佐剂包括细胞因子。示例性的生物佐剂包括但不限于白细胞介素-1(il-2)、蛋白质记忆t细胞引诱剂“调节激活正常t细胞表达和分泌因子”(rantes)、粒细胞-巨噬细胞-集落刺激因子(gm-csf)、肿瘤坏死因子-α(tnf-α)、干扰素-γ(ifn-γ)、粒细胞集落刺激因子(g-csf)、淋巴细胞功能相关抗原3(lfa-3,也称为cd58)、分化抗原72(cd72)的簇、(b细胞反应性的负调节剂)、外周膜蛋白、b7-1(b7-1,也称为cd80)、外周膜蛋白、b7-2(b7-2,也称为cd86)、tnf配体超家族成员4配体(ox40l)或属于tnf超家族(4-1bbl)的2型跨膜糖蛋白受体。在一些实施方案中,佐剂可缀合至两亲体,如h.liu等人,structure-based programming of lymph-node targeting in molecular vaccines.nature 507,5199522(2014)所述。在一些实施方案中,与佐剂缀合的两亲体是n-羟基琥珀酰亚胺酯-末端官能化的聚(乙二醇)-脂质(nhs-peg2kda-dspe)。
[0047]“施用”是指给予、供应或分配组合物、试剂、治疗剂等给受试者,或将组合物等应用或使之与受试者接触。施用或给药可以通过多种途径中的任一种来完成,诸如,例如,但不限于,局部、口服、皮下、肌内、腹膜内、静脉内(iv)、注射、鞘内、肌内、真皮、皮内、颅内、吸入、直肠、阴道内或眼内。
[0048]“过继细胞转移(adoptive cell transfer)”或“act”是指一种过程,其中免疫效应细胞(例如t细胞)被分离和工程改造以识别特定抗原(即,“工程化免疫细胞”),然后扩增并重新引入受试者。用于act的免疫效应细胞(例如,t细胞)可以是“自体的”,来源于待治疗的受试者,或是“同种异体的”(有时称为“同源的”),来源于供体受试者,其具有足够相似的免疫原性而不被接受act的受试者排斥。在一些实施方案中,要在act中转移的细胞是car-t细胞。
[0049]“试剂”是指任何小分子化合物、抗体、核酸分子、肽、多肽或其片段。
[0050]“间变性淋巴瘤激酶”或“alk”是指属于胰岛素受体超家族的受体酪氨酸激酶。
[0051]“alk抗体”或“抗alk抗体”是指特异性结合至alk多肽的抗体或其抗原结合部分。在一些实施方案中,抗alk抗体结合至鼠alk蛋白或其抗体结合部分。在一些实施方案中,抗alk抗体结合至人类alk蛋白或其抗体结合部分。在一些实施方案中,抗alk抗体结合至alk受体的胞外结构域的一部分。在一些实施方案中,抗alk抗体结合至鼠alk受体的胞外结构域的一部分。在一些实施方案中,抗alk抗体结合至人类alk受体的胞外结构域的一部分。在一些实施方案中,抗alk抗体是鼠抗体。在一些实施方案中,抗alk抗体是人类抗体。在一些实施方案中,抗alk抗体是人源化抗体。在一些实施方案中,抗alk抗体是嵌合抗体。在一些实施方案中,抗alk抗体调节alk活性(例如,alk信号传导)和/或alk表达。
[0052]
在一些实施方案中,抗alk抗体是选自alk抗体#1(alk#1)、alk抗体#2(alk#2)、alk
抗体#3(alk#3)、alk抗体#4(alk#4)、alk抗体#5(alk#5)、alk抗体#6(alk#6)或alk抗体#7(alk#7)。在一些实施方案中,抗alk抗体是alk#1。在一些实施方案中,抗alk抗体是alk#2。在一些实施方案中,抗alk抗体是alk#3。在一些实施方案中,抗alk抗体是alk#4。在一些实施方案中,抗alk抗体是alk#5。在一些实施方案中,抗alk抗体是alk#6。在一些实施方案中,抗alk抗体是alk#7。
[0053]“alk抑制剂”是指抑制或降低alk活性(例如alk酪氨酸激酶活性)的试剂。在一些实施方案中,alk抑制剂可以是小分子、蛋白质(例如,抗体)或核酸(例如,反义分子)。alk抑制剂可以抑制或降低配体(例如,多效蛋白(pleiotrophin))与alk的结合,从而降低alk酪氨酸激酶活性。alk抑制剂也可以直接抑制或降低alk酪氨酸激酶活性,例如,atp竞争性抑制剂(例如,克唑替尼(crizotinib))。降低或抑制alk表达的分子(例如,反义分子)也是alk抑制剂。除了抑制alk酪氨酸激酶活性之外,alk抑制剂也可以特异性抑制alk酪氨酸激酶活性或可以抑制其他受体酪氨酸激酶活性(例如,c-met/hgfr活性)。alk抑制剂的非限制性实例包括以下:克唑替尼、塞瑞替尼(ceritinib)、阿来替尼(alectinib)、布加替尼(brigatinib)和劳拉替尼(lorlatinib)。pki或其他影响alk的药物可能会使alk阳性癌症更容易受到抗alk抗体或表达car的alk特异性t细胞的免疫靶向作用的影响。
[0054]“alk多肽”、“alk肽”或“alk蛋白”是指间变性淋巴瘤激酶(alk)蛋白或其片段。全长alk蛋白包括胞外结构域、对应于单程跨膜区的疏水性段(hydrophobic stretch)和胞内激酶结构域。在一些实施方案中,alk多肽与全长alk蛋白具有至少85%、至少90%、至少95%、至少98%、至少99%或100%的同一性。在一些实施方案中,alk多肽与智人(homo sapiens)中的全长alk蛋白具有至少85%、至少90%、至少95%、至少98%、至少99%或100%同一性。在一些实施方案中,alk多肽与全长鼠alk蛋白具有至少85%、至少90%、至少95%、至少98%、至少99%或100%的同一性。在一些实施方案中,alk多肽包含alk胞外结构域。在一些实施方案中,alk多肽与智人中的alk胞外结构域具有至少85%、至少90%、至少95%、至少98%、至少99%或100%的同一性。在一些实施方案中,alk多肽与鼠alk胞外结构域具有至少85%、至少90%、至少95%、至少98%、至少99%或100%同一性。在一些实施方案中,alk多肽包含alk胞内结构域。在一些实施方案中,alk多肽与智人中的alk胞内结构域具有至少85%、至少90%、至少95%、至少98%、至少99%或100%的同一性。在一些实施方案中,alk多肽与鼠alk胞内结构域具有至少85%、至少90%、至少95%、至少98%、至少99%或100%的同一性。
[0055]
在一些实施方案中,alk多肽包含氨基酸序列,其与和genbank
tm
登录号:bad92714.1、acy79563、np_004295、aci47591或edl38401.1)相关的alk氨基酸序列具有至少85%、至少90%、至少95%、至少98%、至少99%或100%同一性。人类和鼠alk蛋白序列是公开的。本领域普通技术人员之一可鉴定额外的alk蛋白序列,包括alk变体。
[0056]
以下提供来自智人的示例性alk全长氨基酸序列(alk细胞质部分以粗体显示):
[0057][0058][0059]
以下提供来自智人的示例性全长alk氨基酸序列:
[0060]
[0061]
[0062]
[0063][0064]
以下提供源自genbank
tm
登录号np_004295的示例性智人alk氨基酸序列:
[0065]
[0066][0067]
以下提供源自uniprot登录号q9um73的示例性智人alk多肽序列(胞外结构域(氨基酸19-1038)以粗体提供):
[0068][0069]
[0070]
以下提供源自小家鼠(mus musculus)的示例性alk全长氨基酸序列:
[0071][0072]“alk多核苷酸”是指编码alk多肽或其片段(例如,抗原或抗原蛋白)的任何核酸分子。在一些实施方案中,alk多核苷酸与编码全长alk蛋白的多核苷酸具有至少85%、至少90%、至少95%、至少98%、至少99%或100%的同一性。在一些实施方案中,alk多核苷酸与智人中编码全长alk蛋白的多核苷酸具有至少85%、至少90%、至少95%、至少98%、至少99%或100%的同一性。在一些实施方案中,alk多核苷酸与编码全长鼠alk蛋白的多核苷酸具有至少85%、至少90%、至少95%、至少98%、至少99%或100%的同一性。在一些实施方案中,alk多核苷酸编码alk胞外结构域。在一些实施方案中,alk多核苷酸与在智人中编码alk胞外结构域的多肽具有至少85%、至少90%、至少95%、至少98%、至少99%或100%同一性。在一些实施方案中,alk多核苷酸与编码鼠alk胞外结构域的多肽具有至少85%、至少90%、至少95%、至少98%、至少99%或100%的同一性。在一些实施方案中,alk多核苷酸编码alk胞内结构域。在一些实施方案中,alk多核苷酸与在智人中编码alk胞内结构域的多核苷酸具有至少85%、至少90%、至少95%、至少98%、至少99%或100%的同一性。在一些实施方案中,alk多核苷酸与编码鼠alk胞内结构域的多核苷酸具有至少85%、至少90%、至少95%、至少98%、至少99%或100%的同一性。在一些实施方案中,alk多核苷酸与编码和genbank
tm
登录号:bad92714.1、acy79563、np_004295、edl38401.1或aci47591相关的alk氨基酸序列的多核苷酸具有至少85%、至少90%、至少95%、至少98%、至少99%或100%的同一性。人类和鼠alk多核苷酸序列是公开的。本领域普通技术人员可以鉴定另外的alk多核苷酸序列,包括alk变体。
[0073]
以下提供源自genbank
tm
登录号nm_004304的示例性智人alk氨基酸序列:
[0074]
[0075]
[0076]
[0077][0078]
以下提供来自智人的示例性全长alk核酸序列:
[0079]
[0080]
[0081][0082]
[0083]
以下提供源自genbank
tm
登录号nm_007439.2的示例性小家鼠(mus musculus)alk核酸序列:
[0084]
[0085]
[0086][0087][0088]“改变”是指通过诸如本文所述的那些标准的本领域已知方法所检测的基因或多肽的表达水平或活性的改变(增加或减少)。如本文所用,改变包括表达水平的5%变化、表达水平的10%变化、表达水平的优选25%变化、更优选40%变化和最优选50%或更大的变化。
[0089]“改善”是指下降、减少、延迟递减、抑制、减弱、阻止或稳定疾病或病理状况的发展或进展。
[0090]“抗体”是指由b淋巴细胞产生并具有特定氨基酸序列的免疫球蛋白(ig)分子,所述特定氨基酸序列具有特异性结合抗原的抗原结合位点。“抗体”在本文中可与“免疫球蛋白”或“ig”互换使用。抗体在受试者(例如,人类、哺乳动物或其他动物)暴露于特定抗原后被诱发或引发。能够产生针对特定抗原的抗体(即免疫应答)的受试者被称为具有免疫活性(immunocompetent)。
[0091]
通常,免疫球蛋白具有通过二硫键相互连接的重(h)链和轻(l)链。免疫球蛋白基因包括κ、λ、α、γ、δ、ε和μ恒定区基因,以及无数免疫球蛋白可变结构域基因。轻链的类型有两种,λ(lambda)和κ(kappa)。主要的重链有五种类别(或同种型),其决定抗体分子的功能活性:igm、igd、igg、iga和ige。
[0092]
重链和轻链各自包含恒定区(或恒定域)和可变区(或可变域)(参见,例如,kindt等人kuby immunology,6.sup.th ed.,w.h.freeman and co.,第91頁(2007))。在几个实施方案中,重链和轻链可变区结合,以特异性结合抗原(例如,alk蛋白或其片段)。提及“vh”是指抗体重链或其抗原结合片段的可变区,包括fv、scfv、dsfv或fab。提及“vl”是指抗体轻链或其抗原结合片段的可变结构域,包括fv、scfv、dsfv或fab。
[0093]
轻链和重链可变区包含被三个高变区(hypervariable region)中断的框架区(fr),也称为互补决定区(cdr)(参见,例如,kabat等人,sequences of proteins of immunological interest,u.s.department of health and human services,1991)。不同轻链或重链的框架区序列在一物种内是相对保守的。抗体的框架区,即组成轻链和重链的组合框架区,用于在三维空间中定位和对齐cdrs。在一些实施方案中,cdr和fr的空间定向(spatial orientation)如下,从n端到c端:fr1-cdr1-fr2-cdr2-fr3-cdr3-fr4。
[0094]
在一些实施方案中,可变区是灵长类动物(例如,人类或非人类灵长类动物)可变区。在一些实施方案中,可变区是人类可变区。在一些实施方案中,可变区包含鼠(例如,小鼠或大鼠)cdr和灵长类动物(例如,人类或非人类灵长类动物)框架区(fr)。在一些实施方案中,可变区包含鼠(例如,小鼠或大鼠)cdr和人类框架区(fr)。在一个实施方案中,本文所述的可变区通过将两个或更多个人类序列片段组装成复合人类序列而获得。
[0095]
在一些实施方案中,抗alk抗体或其抗原结合片段包含选自alk抗体#1(alk#1)、alk抗体#2(alk#2)、alk抗体#3(alk#3)、alk抗体#4(alk#4)、alk抗体#5(alk#5)、alk抗体#6(alk#6)或alk抗体#7(alk#7)的vl区。在一些实施方案中,抗alk抗体vl区选自alk#1。在一些实施方案中,抗alk抗体vl区选自alk#2。在一些实施方案中,抗alk抗体vl区选自alk#3。在一些实施方案中,抗alk抗体vl区选自alk#4。在一些实施方案中,抗alk抗体vl区选自alk#5。在一些实施方案中,抗alk抗体vl区选自alk#6。在一些实施方案中,抗alk抗体vl区选自alk#7。
[0096]
在一些实施方案中,抗alk抗体vl区与如以下所提供的示例性抗alk抗体vl氨基酸序列具有至少85%、至少90%、至少95%、至少98%、至少99%或100%的同一性:
[0097]
diqmtqspaslaasvgetvtitcraseniyyslawyqqkqgkspqlliynansledgvpsrfsgsgsgtqysmkinsmqpedtatyfckqaydvpftfgsgtkleikr
[0098]
在一些实施方案中,抗alk抗体vl区与如以下所提供的示例性抗alk抗体vl氨基酸序列具有至少85%、至少90%、至少95%、至少98%、至少99%或100%的同一性:
[0099]
aiqmtqttsslsaslgdrvtiscsvsqgisnslnwyqqkpdgtvklliyytsslhsgvpsrfsgsgsgt
dysltisnlepediatyycqqysklpltfgagtklelkr
[0100]
在一些实施方案中,抗alk抗体vl区与如以下所提供的示例性抗alk抗体vl氨基酸序列具有至少85%、至少90%、至少95%、至少98%、至少99%或100%的同一性:
[0101]
divmtqsqrfmstsvgdrvsvtckasqnvgtnvawyqqkpgqspkaliysasyrysgvpdrftgsgsgtdftltvsnvqsedlaeyfcqqynsypymytfgggtkleikr
[0102]
在一些实施方案中,抗alk抗体vl区与如以下所提供的示例性抗alk抗体vl氨基酸序列具有至少85%、至少90%、至少95%、至少98%、至少99%或100%的同一性:
[0103]
divltqspaslavslgqratiscrasesvdnygisfmnwfqqkpgqppklliyaasnqgsgvparfsgsgsgtdfslnihpmeeddtamyfcqqskevpwtfgggtkleikr
[0104]
在一些实施方案中,抗alk抗体vl区与如以下所提供的示例性抗alk抗体vl氨基酸序列具有至少85%、至少90%、至少95%、至少98%、至少99%或100%的同一性:
[0105]
divmtqsqrfmstsvgdrvsvtckasqnvgtnvawyqqkpgqspkaliysasyrysgvpdrftgsgsgtdftltisnvqsedlaeyfcqqynsypymytfgggtkleikr
[0106]
在一些实施方案中,抗alk抗体vl区与如以下所提供的示例性抗alk抗体vl氨基酸序列具有至少85%、至少90%、至少95%、至少98%、至少99%或100%的同一性:
[0107]
divmtqsqkfmstsvgdrvsitckasqnvgtavawyqlkpgqspklliysasnrftgvpdrftgsgsgtdftltisnmqsedladyfcqqyssypltfgsgtkleikr
[0108]
在一些实施方案中,抗alk抗体vl区与如以下所提供的示例性抗alk抗体vl氨基酸序列具有至少85%、至少90%、至少95%、至少98%、至少99%或100%的同一性:
[0109]
divmtqsqkfmstsvgdrvsvtckasqnvgtnvawyqqkpghspkaliysasyrysgvpdrftgsgsgtdftltisnvqsedlaeyfcqrynsypymftfgggtkleikr
[0110]
在一些实施方案中,抗alk抗体vl区是由与如以下所提供的示例性核酸序列具有至少85%、至少90%、至少95%、至少98%、至少99%或100%相同的多核苷酸所编码:
[0111][0112]
在一些实施方案中,抗alk抗体vl区是由与如以下所提供的示例性核酸序列具有至少85%、至少90%、至少95%、至少98%、至少99%或100%相同的多核苷酸所编码:
[0113][0114]
在一些实施方案中,抗alk抗体vl区是由与如以下所提供的示例性核酸序列具有至少85%、至少90%、至少95%、至少98%、至少99%或100%相同的多核苷酸所编码:
[0115][0116]
在一些实施方案中,抗alk抗体vl区是由与如以下所提供的示例性核酸序列具有至少85%、至少90%、至少95%、至少98%、至少99%或100%相同的多核苷酸所编码:
[0117][0118]
在一些实施方案中,抗alk抗体vl区是由与如以下所提供的示例性核酸序列具有至少85%、至少90%、至少95%、至少98%、至少99%或100%相同的多核苷酸所编码:
[0119][0120][0121]
在一些实施方案中,抗alk抗体vl区是由与如以下所提供的示例性核酸序列具有至少85%、至少90%、至少95%、至少98%、至少99%或100%相同的多核苷酸所编码:
[0122][0123]
在一些实施方案中,抗alk抗体vl区是由与如以下所提供的示例性核酸序列具有至少85%、至少90%、至少95%、至少98%、至少99%或100%相同的多核苷酸所编码:
[0124][0125]
在一些实施方案中,抗-alk抗体或其抗原结合片段包含选自alk抗体#1(alk#1)、alk抗体#2(alk#2)、alk抗体#3(alk#3)、alk抗体#4(alk#4)、alk抗体#5(alk#5)、alk抗体#6(alk#6)或alk抗体#7(alk#7)的vh区。在一些实施方案中,抗alk抗体vh区选自alk#1。在一些实施方案中,抗alk抗体vh区选自alk#2。在一些实施方案中,抗alk抗体vh区选自alk#3。
在一些实施方案中,抗alk抗体vh区选自alk#4。在一些实施方案中,抗alk抗体vh区选自alk#5。在一些实施方案中,抗alk抗体vh区选自alk#6。在一些实施方案中,抗alk抗体vh区选自alk#7。
[0126]
在一些实施方案中,抗alk抗体vh区是与以下所提供的示例性氨基酸序列具有至少85%、至少90%、至少95%、至少98%、至少99%或100%的同一性:
[0127]
qvqlqqsgaelvkpgasvkisckasgyafssywmnwvkqrpgkglewigqiypgdgdtnyngkfkgkatltadkssstaymqlssltsedsavyfcasyyygskaywgqgtlvtvsa
[0128]
在一些实施方案中,抗alk抗体vh区是与以下所提供的示例性氨基酸序列具有至少85%、至少90%、至少95%、至少98%、至少99%或100%的同一性:
[0129]
qvqlqqpgaefvkpgasvklsckasgytftsywmhwvkqrpgrglewigridpnsggtkynekfkskatltvdkpsstaymqlssltsedsavyycardyygssyrfaywgqgtlvtvsa
[0130]
在一些实施方案中,抗alk抗体vh区是与以下所提供的示例性氨基酸序列具有至少85%、至少90%、至少95%、至少98%、至少99%或100%的同一性:
[0131]
qvqlqqsgaelakpgasvklsckasgytftnywmhwvkqrpgqglewigyinpssgytkynqkfkdkatltadkssstaymqlssltyedsavyycardyygssswfaywgqgtlvtvsa
[0132]
在一些实施方案中,抗alk抗体vh区是与以下所提供的示例性氨基酸序列具有至少85%、至少90%、至少95%、至少98%、至少99%或100%的同一性:
[0133]
qvqlqqsgaelvkpgasvkisckasgyafssywvnwvkqrpgkglewigqiypgdgdtnyngkfkgkatltadkssstaymqlssltsedsavyfcarsrgyfygstydswgqgttltvss
[0134]
在一些实施方案中,抗alk抗体vh区是与以下所提供的示例性氨基酸序列具有至少85%、至少90%、至少95%、至少98%、至少99%或100%的同一性:
[0135]
qvqlqqsgaelakpgasvklsckasgytftsywmhwvkqrpgqglewigyikpssgytkynqkfkdkatltadkssstaymqlssltyedsavyycardyygssswfaywgqgtlvtvsa
[0136]
在一些实施方案中,抗alk抗体vh区是与以下所提供的示例性氨基酸序列具有至少85%、至少90%、至少95%、至少98%、至少99%或100%的同一性:
[0137]
dvklvesgeglvkpggslklscaasgftfssyamswvrqtpekrlewvtyissggdyiyyadtvkgrftisrdnarntlylqmsslksedtamyyctreriwlrrffdvwgtgttvtvss
[0138]
在一些实施方案中,抗alk抗体vh区是与以下所提供的示例性氨基酸序列具有至少85%、至少90%、至少95%、至少98%、至少99%或100%的同一性:
[0139]
qvqlqqsgaelakpgasvklsckasgytftsywmhwvkqrpgqglewigyinpssgytkynqkfkdkatltadkssstaymqlssltfedsavyycardyygssswfaywgqgtlvtvsa
[0140]
在一些实施方案中,抗alk抗体vh区是由与以下所提供的示例性核酸序列具有至少85%、至少90%、至少95%、至少98%、至少99%或100%的同一性的多核苷酸所编码:
[0141][0142]
在一些实施方案中,抗alk抗体vh区是由与以下所提供的示例性核酸序列具有至
少85%、至少90%、至少95%、至少98%、至少99%或100%的同一性的多核苷酸所编码:
[0143][0144]
在一些实施方案中,抗alk抗体vh区是由与以下所提供的示例性核酸序列具有至少85%、至少90%、至少95%、至少98%、至少99%或100%的同一性的多核苷酸所编码:
[0145][0146]
在一些实施方案中,抗alk抗体vh区是由与以下所提供的示例性核酸序列具有至少85%、至少90%、至少95%、至少98%、至少99%或100%的同一性的多核苷酸所编码:
[0147][0148][0149]
在一些实施方案中,抗alk抗体vh区是由与以下所提供的示例性核酸序列具有至少85%、至少90%、至少95%、至少98%、至少99%或100%的同一性的多核苷酸所编码:
[0150][0151]
在一些实施方案中,抗alk抗体vh区是由与以下所提供的示例性核酸序列具有至少85%、至少90%、至少95%、至少98%、至少99%或100%的同一性的多核苷酸所编码:
[0152][0153]
在一些实施方案中,抗alk抗体vh区是由与以下所提供的示例性核酸序列具有至少85%、至少90%、至少95%、至少98%、至少99%或100%的同一性的多核苷酸所编码:
[0154][0155]
在一些实施方案中,本文所提供的抗alk抗体或其抗原结合片段包含vl区和vh区,所述vl区和vh区与分别如表1和表2所提供的抗体alk#1、alk#2、alk#3、alk#4、alk#5、alk#6或alk#7中任一者的vl和vh氨基酸序列具有至少85%、至少90%、至少95%、至少98%至少99%或100%的同一性。在一些实施方案中,本文提供的抗alk抗体或其抗原结合片段包含分别如表1和表2所提供的抗体alk#1、alk#2、alk#3、alk#4、alk#5、alk#6或alk#7中任一者的vl区和vh区。
[0156]
cdr主要负责与抗原的表位结合。使用本领域已知的任何方法,包括kabat等人(“sequences of proteins of immunological interest,5th ed.public health service,national institutes of health,bethesda,md.,1991;“kabat'numbering scheme)、al-lazikani等人(jmb 273,927-948,1997:“chothia’numbering scheme)和lefranc等人(“imgt unique numbering for immunoglobulin and tcell receptor variable domains and ig superfamily v-like domains.”dev.comp.immunol.,27:55-77,2003:“imgt'numbering scheme)所述的那些方法,可以容易地确定给定cdr的氨基酸序列位置。链各自的cdr通常称为cdr1、cdr2和cdr3(从n端到c端),且通常由特定cdr所在的链标识。因此,在本文中,vh-cdr3是cdr3,所述cdr3来自发现它的抗体的重链的可变结构域,且vl-cdr1是cdr1,所述cdr1来自发现它的抗体的轻链的可变结构域。轻链cdr在本文中称为lcdr1、lcdr2和lcdr3。重链cdr在本文中称为hcdr1、hcdr2和hcdr3。
[0157]
在一些实施方案中,抗alk抗体的cdr特异性结合alk(例如,人类alk)。在一些实施方案中,抗alk抗体的cdr特异性结合alk的胞外结构域(ecd)(例如,人类alk ecd)。在一些实施方案中,抗alk抗体或其抗原结合片段包含vl区的一个或多个cdr,其选自alk抗体#1(alk#1)、alk抗体#2(alk#2)、alk抗体#3(alk#3)、alk抗体#4(alk#4)、alk抗体#5(alk#5)、alk抗体#6(alk#6)或alk抗体#7(alk#7)。在一些实施方案中,抗alk抗体包含选自alk#1的vl区的一个或多个cdr。在一些实施方案中,抗alk抗体包含选自alk#2的vl区的一个或多个cdr。在一些实施方案中,抗alk抗体包含选自alk#3的vl区的一个或多个cdr。在一些实施方案中,抗alk抗体包含选自alk#4的vl区的一个或多个cdr。在一些实施方案中,抗alk抗体包含选自alk#5的vl区的一个或多个cdr。在一些实施方案中,抗alk抗体包含选自alk#6的vl区的一个或多个cdr。在一些实施方案中,抗alk抗体包含选自alk#7的vl区的一个或多个cdr。
[0158]
在一些实施方案中,抗alk抗体lcdr1与如下提供的示例性氨基酸序列具有至少85%、至少90%、至少95%、至少98%、至少99%或100%的同一性:
[0159]
raseniyysla
[0160]
在一些实施方案中,抗alk抗体lcdr2与如下提供的示例性氨基酸序列具有至少85%、至少90%、至少95%、至少98%、至少99%或100%的同一性:
[0161]
nansled
[0162]
在一些实施方案中,抗alk抗体lcdr3与如下提供的示例性氨基酸序列具有至少85%、至少90%、至少95%、至少98%、至少99%或100%同一性:
[0163]
kqaydvpft
[0164]
在一些实施方案中,抗alk抗体lcdr1与如下提供的示例性氨基酸序列具有至少85%、至少90%、至少95%、至少98%、至少99%或100%的同一性:
[0165]
svsqgisnsln
[0166]
在一些实施方案中,抗alk抗体lcdr2与如下提供的示例性氨基酸序列具有至少85%、至少90%、至少95%、至少98%、至少99%或100%的同一性:
[0167]
ytsslhs
[0168]
在一些实施方案中,抗alk抗体lcdr3与如下提供的示例性氨基酸序列具有至少85%、至少90%、至少95%、至少98%、至少99%或100%同一性:
[0169]
qqysklplt
[0170]
在一些实施方案中,抗alk抗体lcdr1与如下提供的示例性氨基酸序列具有至少85%、至少90%、至少95%、至少98%、至少99%或100%的同一性:
[0171]
kasqnvgtnva
[0172]
在一些实施方案中,抗alk抗体lcdr2与如下提供的示例性氨基酸序列具有至少85%、至少90%、至少95%、至少98%、至少99%或100%的同一性:
[0173]
sasyrys
[0174]
在一些实施方案中,抗alk抗体lcdr3与如下提供的示例性氨基酸序列具有至少85%、至少90%、至少95%、至少98%、至少99%或100%同一性:
[0175]
qqynsypymyt
[0176]
在一些实施方案中,抗alk抗体lcdr1与如下提供的示例性氨基酸序列具有至少85%、至少90%、至少95%、至少98%、至少99%或100%的同一性:
[0177]
rasesvdnygisfmn
[0178]
在一些实施方案中,抗alk抗体lcdr2与如下提供的示例性氨基酸序列具有至少85%、至少90%、至少95%、至少98%、至少99%或100%的同一性:
[0179]
aasnqgs
[0180]
在一些实施方案中,抗alk抗体lcdr3与如下提供的示例性氨基酸序列具有至少85%、至少90%、至少95%、至少98%、至少99%或100%同一性:
[0181]
qqskevpwt
[0182]
在一些实施方案中,抗alk抗体lcdr1与如下提供的示例性氨基酸序列具有至少85%、至少90%、至少95%、至少98%、至少99%或100%的同一性:
[0183]
kasqnvgtava
[0184]
在一些实施方案中,抗alk抗体lcdr2与如下提供的示例性氨基酸序列具有至少85%、至少90%、至少95%、至少98%、至少99%或100%的同一性:
[0185]
sasnrft
[0186]
在一些实施方案中,抗alk抗体lcdr3与如下提供的示例性氨基酸序列具有至少85%、至少90%、至少95%、至少98%、至少99%或100%同一性:
[0187]
qqyssyplt
[0188]
在一些实施方案中,抗alk抗体lcdr3与如下提供的示例性氨基酸序列具有至少85%、至少90%、至少95%、至少98%、至少99%或100%同一性:
[0189]
qrynsypymft
[0190]
在一些实施方案中,抗alk抗体或其抗原结合片段包含选自alk抗体#1(alk#1)、alk抗体#2(alk#2)、alk抗体#3(alk#3)、alk抗体#4(alk#4)、alk抗体#5(alk#5)、alk抗体#6(alk#6)或alk抗体#7(alk#7)的vh区的一个或多个cdr。在一些实施方案中,抗alk抗体包含选自alk#1的vh区的一个或多个cdr。在一些实施方案中,抗alk抗体包含选自alk#2的vh区的一个或多个cdr。在一些实施方案中,抗alk抗体包含选自alk#3的vh区的一个或多个cdr。在一些实施方案中,抗alk抗体包含选自alk#4的vh区的一个或多个cdr。在一些实施方案中,抗alk抗体包含选自alk#5的vh区的一个或多个cdr。在一些实施方案中,抗alk抗体包含选自alk#6的vh区的一个或多个cdr。在一些实施方案中,抗alk抗体包含选自alk#7的vh区的一个或多个cdr。
[0191]
在一些实施方案中,抗alk抗体hcdr1与如下提供的示例性氨基酸序列具有至少85%、至少90%、至少95%、至少98%、至少99%或100%同一性:
[0192]
sywmn
[0193]
在一些实施方案中,抗alk抗体hcdr2与如下提供的示例性氨基酸序列具有至少85%、至少90%、至少95%、至少98%、至少99%或100%同一性:
[0194]
qiypgdgdtnyngkfkg
[0195]
在一些实施方案中,抗alk抗体hcdr3与如下提供的示例性氨基酸序列具有至少85%、至少90%、至少95%、至少98%、至少99%或100%同一性:
[0196]
yyygskay
[0197]
在一些实施方案中,抗alk抗体hcdr1与如下提供的示例性氨基酸序列具有至少85%、至少90%、至少95%、至少98%、至少99%或100%同一性:
[0198]
sywmh
[0199]
在一些实施方案中,抗alk抗体hcdr2与如下提供的示例性氨基酸序列具有至少85%、至少90%、至少95%、至少98%、至少99%或100%同一性:
[0200]
ridpnsggtkynekfks
[0201]
在一些实施方案中,抗alk抗体hcdr3与如下提供的示例性氨基酸序列具有至少85%、至少90%、至少95%、至少98%、至少99%或100%同一性:
[0202]
dyygssyrfay
[0203]
在一些实施方案中,抗alk抗体hcdr1与如下提供的示例性氨基酸序列具有至少85%、至少90%、至少95%、至少98%、至少99%或100%同一性:
[0204]
nywmh
[0205]
在一些实施方案中,抗alk抗体hcdr2与如下提供的示例性氨基酸序列具有至少85%、至少90%、至少95%、至少98%、至少99%或100%同一性:
[0206]
yinpssgytkynqkfkd
[0207]
在一些实施方案中,抗alk抗体hcdr3与如下提供的示例性氨基酸序列具有至少85%、至少90%、至少95%、至少98%、至少99%或100%同一性:
[0208]
dyygssswfay
[0209]
在一些实施方案中,抗alk抗体hcdr1与如下提供的示例性氨基酸序列具有至少85%、至少90%、至少95%、至少98%、至少99%或100%同一性:
[0210]
sywvn
[0211]
在一些实施方案中,抗alk抗体hcdr3与如下提供的示例性氨基酸序列具有至少85%、至少90%、至少95%、至少98%、至少99%或100%同一性:
[0212]
srgyfygstyds
[0213]
在一些实施方案中,抗alk抗体hcdr2与如下提供的示例性氨基酸序列具有至少85%、至少90%、至少95%、至少98%、至少99%或100%同一性:
[0214]
yikpssgytkynqkfkd
[0215]
在一些实施方案中,抗alk抗体hcdr1与如下提供的示例性氨基酸序列具有至少85%、至少90%、至少95%、至少98%、至少99%或100%同一性:
[0216]
syams
[0217]
在一些实施方案中,抗alk抗体hcdr2与如下提供的示例性氨基酸序列具有至少85%、至少90%、至少95%、至少98%、至少99%或100%同一性:
[0218]
yissggdyiyyadtvkg
[0219]
在一些实施方案中,抗alk抗体hcdr3与如下提供的示例性氨基酸序列具有至少85%、至少90%、至少95%、至少98%、至少99%或100%同一性:
[0220]
eriwlrrffdv
[0221]
在一些实施方案中,本文提供的抗alk抗体或其抗原结合片段包含与分别如表3和表4中提供的抗体alk#1、alk#2、alk#3、alk#4、alk#5、alk#6或alk#7中任一者的vl和vh氨基酸序列的cdr具有至少85%、至少90%、至少95%、至少98%、至少99%或100%的同一性的源自vl区的一个或多个cdr和源自vh区的一个或多个cdr。在一些实施方案中,本文提供的抗alk抗体或其抗原结合片段包含分别如表3和表4中提供的抗体alk#1、alk#2、alk#3、alk#4、alk#5、alk#6或alk#7中任一者的源自vl区的一个或多个cdr和源自vh区的一个或多个cdr。在一些实施方案中,本文提供的抗alk抗体或其抗原结合片段包含如表3中提供的抗体alk#1、alk#2、alk#3、alk#4、alk#5、alk#6或alk#7中任一者的源自vl区的三个cdr。在一些实施方案中,本文提供的抗alk抗体或其抗原结合片段包含如表4中提供的抗体alk#1、alk#2、alk#3、alk#4、alk#5、alk#6或alk#7中任一者的源自vh区的三个cdr。在一些实施方案中,本文提供的抗alk抗体或其抗原结合片段包含分别如表3和表4中提供的抗体alk#1、alk#2、alk#3、alk#4、alk#5、alk#6或alk#7中任一者的源自vl区的三个cdr和源自vh区的三个cdr。
[0222]
抗体可以包括,例如,单克隆抗体、重组产生的抗体、单特异性抗体、多特异性抗体(包括双特异性抗体)、人类抗体、人源化抗体,诸如复合人类抗体或去免疫抗体、鼠抗体(例如,小鼠或大鼠抗体)、嵌合抗体、合成抗体和包含两条重链和两条轻链分子的四聚体抗体。在具体实施方案中,抗体可包括,但不限于,抗体轻链单体、抗体重链单体、抗体轻链二聚体、抗体重链二聚体、抗体轻链/抗体重链对、抗体具有两条轻链/重链对(例如,相同的对)、抗体内、异源偶联抗体、单域抗体、单价抗体、二价抗体、单链抗体或单链fv(scfv)(例如,包括单特异性、双特异性等)、骆驼化抗体(camelized antibody)、和亲和体(affybody)。抗原结合片段可以包括抗原结合片段或表位结合片段,例如,但不限于,fab片段、f(ab')片段、f(ab')2片段、和二硫化物连接的(disulfide-linked)fv(sdfv)。在某些实施方案中,本文所
述的抗体是指多克隆抗体群。抗体可以是任何类型(例如,igg、ige、igm、igd、iga或igy)、任何类别(例如,igg1、igg2、igg3、igg4、igai或iga2)或任何子类别(例如,igg2a或igg2)的免疫球蛋白分子。在某些实施方案中,本文所述的抗体是igg抗体(例如,人类igg),或一类别(例如,人类igg1、igg2、igg3或igg4)或其子类别。
[0223]“引发抗体反应”是指抗原、免疫原或其他分子诱导抗体产生的能力。抗体属于不同的类别,例如igm、igg、iga、ige、igd和亚型或子类别,例如igg1、igg2、igg2a、igg2b、igg3、igg4。在受试者中引发的抗体/免疫球蛋白反应可以通过与试剂上的表位(抗原决定簇)结合并阻断或抑制试剂的活性和/或通过与从受试者的系统(例如,通过肝脏)中清除的试剂形成结合复合物来中和致病性(例如,引起疾病的)试剂。
[0224]“两亲体(amphiphile)”是指同时具有亲水性和亲油性的化合物。这种化合物称为两亲的(amphiphilic)或两亲性的(amphipathic)。两亲体可以通过促进溶解度的极性聚合物链与抗原或佐剂运货(cargo)缀合或连接。在一些实施方案中,两亲体与佐剂缀合或连接。在一些实施方案中,佐剂是弗氏佐剂(freund’s adjuvant)。在一些实施方案中,两亲体与alk多肽缀合或连接。在一些实施方案中,两亲体是亲脂性白蛋白结合尾端。在一些实施方案中,两亲体是n-羟基琥珀酰亚胺酯-末端官能化的聚(乙二醇)-脂质(nhs-peg2kda-dspe)。
[0225]“抗原”是指部分或分子(例如,多肽、肽),其包含抗体可特异性结合的表位。因此,抗原也由抗体特异性结合。在一个实施方案中,本文所述的抗体结合的抗原是间变性淋巴瘤激酶(alk)蛋白或其片段。在一个实施方案中,本文所述的抗体结合的抗原结合alk胞外结构域。在一些实施方案中,本文所述抗体结合的抗原是人类alk或人类alk胞外结构域。抗体对抗原的结合可以刺激受试者的免疫应答,包括注射或吸收到受试者中的组合物。在受试者中引发或刺激免疫应答的抗原称为“免疫原”。抗原与特异性体液或细胞免疫的产物发生反应,包括由异源免疫原诱导的产物。
[0226]“抗原结合片段”是指全长抗体的一部分,其保留特异性识别抗原(例如,alk蛋白)的能力,以及这些部分的各种组合。抗原结合片段的非限制性实例包括fv、fab、fab'、fab'-sh、f(ab')2;双特异抗体;线性抗体;单链抗体分子(例如,scfv);以及由抗体片段形成的多特异性抗体。可通过修饰完整抗体或使用重组dna方法从头合成的那些抗体来产生抗原结合片段(参见,例如,kontermann和dubel(ed),antibody engineering,vols.1-2,2"ed.,springer press,2010)。
[0227]“嵌合抗体”是一种抗体,其包括源自两种不同抗体的序列,所述两种不同抗体通常属于不同的物种。在一些实施方案中,嵌合抗体包括来自一种抗体的一个或多个cdr和/或框架区以及来自另一种抗体的cdr和/或框架区。例如,嵌合抗体可以包含融合至人类抗体恒定区的小鼠或大鼠单克隆抗体的可变区。产生嵌合抗体的方法是本领域已知的(参见,例如,morrison,1985,science 229:1202;oi等人,1986,biotechniques 4:214;gillies等人,1989,j.immunol.methods125:797-202;和美国专利案第5,807,715、4,816,567、4,816,397和6,331,415号)。
[0228]“嵌合抗原受体”或“car”是指一种工程化受体,包含连接到一个或多个细胞内信号传送域(例如,t细胞信号传送域)的细胞外抗原结合域(例如,scfv),所述细胞内信号传送域赋予免疫效应细胞抗原特异性。在一些实施方案中,car包括跨膜域。在一些实施方案
中,car构建体源自或包含m1928z car构建体,如davila等人,cd19car-targeted t cells induce long-term remission and b cell aplasia in an immunocompetent mouse model of b cell acute lymphoblastic leukemia,plos one(2013)所提供,其整体内容通过引用并入本文。在一些实施方案中,car是特异性结合至alk多肽或其抗体结合片段的间变性淋巴瘤激酶嵌合抗原受体(alk car)。
[0229]“嵌合抗原受体t细胞”或“car-t细胞”是指表达car的t细胞,其具有来源于car的抗体的靶向结构域确定的抗原特异性。如本文所用,“car-t细胞”包括t细胞或nk细胞。如本文所用,“car-t细胞”包括经工程改造以表达car或t细胞受体(tcr)的细胞。在一些实施方案中,car-t细胞可以是t辅助cd4+和/或t效应cd8+细胞,任选地以限定的比例。在一些实施方案中,car-t细胞可以包含总cd3+细胞。制造cars(例如,用于癌症的治疗)的方法是公开可用的(参见,例如,park等人,trends biotechnol.,29:550-557,2011;grupp等人,n engl j med.,368:1509-1518,2013;han等人,j.hematol oncol.6:47,2013;haso等人,(2013)blood,121,1165-1174;pct公开案第wo2012/079000、wo2013/059593号;和美国公开案第2012/0213783号,其全文各自以引用方式并入本文)。在一些实施方案中,car-t细胞表达alk car。
[0230]“密码子优化的(codon-optimized)”核酸(多核苷酸)是指已经改变的核酸序列,使得密码子对于在特定系统(例如物种群的特定物种)中的表达是最佳的。例如,可以优化核酸序列以在哺乳动物细胞中表达。密码子优化不会改变编码蛋白质的氨基酸序列。
[0231]
在本公开中,“包括(comprises)”、“包含(comprising)”、“含有(containing)”和“具有(having)”等可具有美国专利法中赋予它们的含义,且可表示“包括(includes)”、“包含(including)”等;“实质上由
……
组成(consisting essentially of)”或“实质上由
……
组成(consists essentially)”同样具有美国专利法中赋予的含义,且所述术语是开放式的,允许存在比所引用的更多的内容,只要所引用的内容具有基本或新颖的特征不因存在多于所列举的内容而改变,但不包括现有技术实施方案。
[0232]“检测”是指识别待检测的分析物、化合物、试剂或物质的存在、不存在或量。
[0233]“可检测标记”是指一种组合物,当连接至目标分子时,使后者可检测,例如,通过光谱、光化学、生物化学、免疫化学或化学手段。有用的可检测标记的非限制性实例包括放射性同位素、磁珠、金属珠、胶体颗粒、荧光染料、电子致密试剂、酶(例如,如elisa中常用的)、生物素、地高辛(digoxigenin)或半抗原。
[0234]“疾病”是指损害或干扰细胞、组织或器官的正常功能的任何病情、病症或病理学。疾病的例子包括那些由致癌alk基因融合、重排、重复或突变引起的疾病(例如,alk-阳性癌症)。在一些实施方案中,癌症是alk-阳性癌症。“alk-阳性癌症”是指表达alk蛋白的癌症或肿瘤。alk阳性癌症的非限制性实例包括非小细胞肺癌(nsclc)、间变性大细胞淋巴瘤(alcl)、神经母细胞瘤、b细胞淋巴瘤、甲状腺癌、结肠癌、乳腺癌、炎性成肌纤维细胞瘤(imt)、肾癌、食管癌和黑色素瘤。在一些实施方案中,alk-阳性癌症是神经母细胞瘤。
[0235]
alk-阳性癌症可由与其他基因形成融合基因而获得额外的基因拷贝、或发生基因突变这两者中的一者的致癌alk基因所引起的。在一些实施方案中,alk-阳性癌症是由编码alk融合蛋白的alk融合基因所引起的。在一些实施方案中,alk-阳性癌症是由alk基因和编码npm-alk融合蛋白的核仁磷蛋白(npm)基因之间的融合所引起的。在一些实施方案中,
alk-阳性癌症是由alk基因和编码elm4-alk融合蛋白的棘皮动物微管相关蛋白样4(eml4)基因之间的融合所引起的。在一些实施方案中,alk-阳性癌症是由点突变所引起的。在一些实施方案中,点突变是f1174l(alk
f1174l
)。在一些实施方案中,alk-阳性癌症是神经母细胞瘤。
[0236]“有效量”是指改进、减少、延迟、改善、废除、递减或消除与未经治疗的患者相关的疾病、病症或病理学的症状和/或影响所需的活性治疗剂、组合物、化合物、生物制品(例如,疫苗或治疗性肽、多肽或多核苷酸)的量。在一些实施方案中,alk肽的有效量是在用肽免疫的受试者中诱导alk特异性免疫应答所需的量。如用于实施疾病、病症或病理的治疗方法的免疫原或包含免疫原的组合物的有效量,取决于给药方式、受试者的年龄、体重和一般健康状况。最终,主治医师或兽医将决定适当的量和剂量方案。这类量称为“有效”量。
[0237]
本文的发明提供了许多可用于开发高度特异性药物以治疗由本文所述方法为特征的疾病或病症的靶标。此外,本发明的方法提供了一种简便的手段来鉴定在受试者中安全使用的疗法。此外,本发明的方法提供了一种途径,用于分析几乎任何数量的化合物对本文所述的具有高通量、高灵敏度和低复杂性的疾病的影响。
[0238]“治疗有效量”是指足以在用所述试剂治疗的受试者中达到所需效果的特定试剂的量。例如,这可以是用于在受试者中引发免疫应答、治疗和/或预防由致癌alk基因融合、重排、重复或突变引起的疾病(例如,alk-阳性癌症)。理想地,在本公开的上下文中,治疗有效量的alk特异性疫苗或免疫原性组合物的量是足以预防、改善、减少、延迟和/或治疗在受试者中由致癌alk基因融合、重排、重复或突变引起的疾病(例如,alk-阳性癌症),而不会在受试者中引起实质性的细胞毒性作用。可用于预防、延迟、改善、减少和/或治疗在受试者中由致癌alk基因融合、重排、重复或突变引起的疾病(例如,alk-阳性癌症)的有效量的alk特异性疫苗或免疫原性组合物,取决于,例如,被治疗的受试者、治疗组合物的给药方式和其他因素,如上文所述。
[0239]
如本文所用,“表位(epitope)”是指抗原决定簇(determinant)。表位是抗原分子的一部分,其结构决定了将识别并特异性结合以引发特异性免疫应答的特异性抗体分子。在一些实施方案中,公开的抗体特异性结合至alk上的表位。
[0240]“片段”是指多肽或核酸分子的一部分。这个部分优选地包含参考核酸分子或多肽全长的至少10%、20%、30%、40%、50%、60%、70%、80%或90%。一片段可包含3、4、5、6、7、8、9、10、20、30、40、50、60、70、80、90或100、200、300、400、500、600、700、800、900或1000个核苷酸或氨基酸。多肽的一部分或片段可为肽。在抗体或免疫球蛋白片段的情况下,所述片段通常结合至靶抗原。
[0241]“融合蛋白”是指通过核酸(多核苷酸)序列的表达而产生的蛋白质,所述序列由编码两种不同(异源)蛋白质或肽的至少一部分的核酸序列改造而成。为了产生融合蛋白,核酸序列必须在相同的开放阅读框中,且不包含内部终止密码子。可位于融合蛋白的氨基末端(n-末端)部分或羧基末端(c-末端)蛋白的蛋白质,从而分别形成氨基末端融合蛋白或羧基末端融合蛋白。
[0242]
举例而言,融合蛋白包括融合至异源蛋白的alk蛋白。在一些实施方案中,融合蛋白是与核仁磷蛋白(npm)蛋白融合的alk蛋白。在一些实施方案中,npm-alk融合蛋白与智人中的npm-alk融合蛋白具有至少85%、至少90%、至少95%、至少98%、至少99%或100%的
同一性。在一些实施方案中,npm-alk融合蛋白与如以下所提供的来自智人的示例性npm-alk融合蛋白氨基酸序列具有至少85%、至少90%、至少95%、至少98%、至少99%或100%的同一性(alk细胞质部分以粗体显示):
[0243][0244]
在一些实施方案中,npm-alk融合蛋白与如以下所提供的来自智人(genbank:aaa58698.1)的示例性npm-alk融合蛋白氨基酸序列具有至少85%、至少90%、至少95%、至少98%、至少99%或100%的同一性:
[0245][0246][0247]
在一些实施方案中,npm-alk融合蛋白与如以下所提供的来自智人的示例性npm-alk融合蛋白氨基酸序列具有至少85%、至少90%、至少95%、至少98%、至少99%或100%的同一性:
[0248][0249][0250]
在一些实施方案中,npm-alk融合蛋白是由与如以下所提供的来自智人的示例性核酸序列具有至少85%、至少90%、至少95%、至少98%、至少99%或100%同一性的核酸序列所编码:
[0251][0252][0253]
在一些实施方案中,融合蛋白是融合至棘皮动物微管相关蛋白样4(eml4)蛋白的alk蛋白。在一些实施方案中,elm4-alk融合蛋白与智人中的elm4-alk融合蛋白或其变体具有至少85%、至少90%、至少95%、至少98%、至少99%或100%的同一性。在一些实施方案中,elm4-alk融合蛋白与如以下所提供的来自智人(genbank:bam37627.1)的示例性elm4-alk融合蛋白氨基酸序列具有至少85%、至少90%、至少95%、至少98%、至少99%或100%的同一性:
[0254][0255][0256]
在一些实施方案中,elm4-alk融合蛋白是由与如以下所提供的来自智人(genbank:ab274722.1)的示例性核酸序列具有至少85%、至少90%、至少95%、至少98%、至少99%或100%的同一性的核酸序列所编码:
[0257]
[0258]
[0259][0260]
在一些实施方案中,elm4-alk融合蛋白与如以下所提供的来自智人(genbank:baf73611.1)的示例性elm4-alk变体1融合蛋白氨基酸序列具有至少85%、至少90%、至少95%、至少98%、至少99%或100%的同一性:
[0261][0262]“遗传疫苗(genetic vaccine)”是指包含编码抗原的多核苷酸的免疫原性组合物。
[0263]“人类抗体”是包括来自(或源自)人类基因组的序列的抗体,且不包括来自另一物种的序列。在一些实施方案中,人类抗体包括来自(或源自)人类基因组的cdr、框架区和(如果存在)fc区。可以使用基于源自人类基因组的序列产生抗体的技术来鉴定和分离人类抗体,例如通过噬菌体展示或使用转基因动物(参见,例如,barbas等人phage display:a laboratory manuel.1ed.new york:cold spring harbor laboratory press,2004.print.:lonberg,nat.biotech.,23:1117-1125,2005;lonenberg,curr.opin.immunol.20:450-459,2008)。
[0264]“人源化抗体”是指人类框架区和来自非人类(例如,小鼠、大鼠或合成的)抗体或抗原结合片段(例如,alk抗体或抗原结合片段)的一个或多个cdr。在一个实施方案中,alk人源化抗体的所有cdr都来自非人类(例如,小鼠、大鼠或合成的)抗体。在一些实施方案中,
人源化抗体还包含恒定区。在一些实施方案中,恒定区与人类免疫球蛋白恒定区为实质相同(例如,至少85%)。人源化抗体可使用本领域已知的多种技术来生产。
[0265]“杂交”是指互补核碱基之间的氢键,其可以是瓦特生-克里克(watson-crick)、胡斯坦(hoogsteen)或反向胡斯坦氢键。例如,在dna中,腺嘌呤和胸腺嘧啶以及胞嘧啶和鸟嘌呤分别是通过形成氢键配对的互补核碱基。“杂交”是指在各种严格条件下配对以在互补多核苷酸序列(例如,基因)或其部分之间形成双链分子。(参见,例如,wahl,g.m.和s.l.berger,(1987),methods enzymol.,152:399;kimmel,a.r.,(1987),methods enzymol.152:507)。
[0266]
作为示例,严格的盐浓度通常小于约750mm nacl和75mm柠檬酸三钠,优选小于约500mm nacl和50mm柠檬酸三钠,更优选小于约250mm nacl和25mm柠檬酸三钠。在不存在有机溶剂例如甲酰胺的情况下可获得低严格性杂交,而在存在至少约35%甲酰胺,更优选至少约50%甲酰胺的情况下可获得高严格性杂交。严格的温度条件通常包括至少约30℃,更优选至少约37℃,最优选至少约42℃的温度。改变附加参数,例如,杂交时间、例如十二烷基硫酸钠(sds)的去污剂的浓度以及载体dna的包含或排除,对于本领域技术人员来说是公知的。根据需要,通过组合这些不同的条件来实现不同级别的严格性。在一优选的实施方案中,杂交将在30℃在750mm nacl、75mm柠檬酸三钠和1%sds中发生。在一更优选的实施方案中,杂交将在37℃在500mm nacl、50mm柠檬酸三钠、1%sds、35%甲酰胺和100μg/ml变性鲑鱼精子dna(ssdna)中发生。在最优选的实施方案中,杂交将在42℃在250mm nacl、25mm柠檬酸三钠、1%sds、50%甲酰胺和200μg/ml ssdna中发生。这些条件的有用变化对本领域技术人员来说是显而易见的。
[0267]
对于大多数应用而言,杂交后的洗涤步骤的严格程度也会有所不同。洗涤严格条件可以通过盐浓度和温度来定义。如上所述,可以通过降低盐浓度或通过提高温度来增加洗涤严格性。例如,洗涤步骤的严格盐浓度将优选为小于约30mm nacl和3mm柠檬酸三钠,且最优选小于约15mm nacl和1.5mm柠檬酸三钠。洗涤步骤的严格温度条件通常包括至少约25℃、更优选至少约42℃、甚至更优选至少约68℃的温度。在一个优选的实施方案中,洗涤步骤将在25℃下在30mm nacl、3mm柠檬酸三钠和0.1%sds中进行。在一更优选的实施方案中,洗涤步骤将在42℃下在15mm nacl、1.5mm柠檬酸三钠和0.1%sds中进行。在一更优选的实施方案中,洗涤步骤将在68℃在15mm nacl、1.5mm柠檬酸三钠和0.1%sds中进行。这些条件的附加变化对本领域技术人员而言是显而易见的。杂交技术对本领域技术人员来说是公知的,且例如,在benton和davis(science 196:180,1977);grunstein and hogness(proc.natl.acad.sci.,usa 72:3961,1975);ausubel等人.(current protocols in molecular biology,wiley interscience,new york,2001);berger和kimmel(guide to molecular cloning techniques,1987,academic press,new york);和sambrook等人,molecular cloning:a laboratory manual,cold spring harbor laboratory press,new york中有所描述。
[0268]“免疫效应细胞”是指淋巴细胞,一旦被激活,就能够对靶细胞产生免疫应答。在一些实施方案中,免疫效应细胞是效应t细胞。在一些实施方案中,效应t细胞是初始cd8
+
t细胞、细胞毒性t细胞、自然杀伤t(nkt)细胞、自然杀伤(nk)细胞或调节性t(treg)细胞。在一些实施方案中,效应t细胞是胸腺细胞、未成熟t淋巴细胞、成熟t淋巴细胞、静息t淋
巴细胞或活化t淋巴细胞。在一些实施方案中,免疫效应细胞是cd4
+
cd8
+
t细胞或cd4-cd8-t细胞。在一些实施方案中,免疫效应细胞是t辅助细胞。在一些实施方案中,t辅助细胞是t辅助1(th1)、t辅助2(th2)细胞或表达cd4的辅助t细胞(cd4+t细胞)。
[0269]“免疫原”是指能够在适当条件下在动物体内引发或刺激免疫应答(例如产生t细胞应答)的试剂,包括注射或吸收到动物体内的组合物。如本文所用,“免疫原性组合物”是包含免疫原(如alk多肽)的组合物或包含免疫原(如alk多肽)的疫苗。如本领域技术人员将理解的,如果在受试者感染疾病或经历全面疾病之前给予有需要的受试者,则免疫原性组合物可以是预防性的并且导致受试者引发免疫应答,例如,细胞免疫应答,以预防疾病或预防更严重的疾病或病症和/或其症状。如果在受试者感染疾病后给予有需要的受试者,免疫原性组合物可以是治疗性的并且导致受试者引发免疫应答,例如细胞免疫应答,以治疗疾病,例如,通过减少、减弱、消除、改善或去除疾病和/或其症状。在一些实施方案中,免疫应答是b细胞反应,其导致产生针对包含抗原或抗原序列的免疫原或免疫原性组合物的抗体,例如,中和抗体。在一些实施方案中,免疫应答是t细胞应答,其导致t淋巴细胞的产生。以与前述类似的方式,在一些实施方案中,免疫原性组合物或疫苗可以是预防性的。在一些实施方案中,免疫原性组合物或疫苗可以是治疗性的。在一些实施方案中,所述疾病由致癌alk基因融合、重排、重复或突变(例如,alk-阳性癌症)引起。在一些实施方案中,癌症是alk-阳性癌症。在一些实施方案中,alk-阳性癌症是非小细胞肺癌(nsclc)、间变性大细胞淋巴瘤(alcl)、神经母细胞瘤、b细胞淋巴瘤、甲状腺癌、结肠癌、乳腺癌、炎性成肌纤维细胞瘤(imt)、肾癌、食管癌、黑色素瘤或其组合。
[0270]
术语“免疫应答”是指由免疫应答细胞介导的任何反应。在免疫应答的一个例子中,招募白细胞以响应暴露于抗原(例如,外来实体)而执行多种不同的特定功能。免疫应答是多因素过程,取决于所涉及的细胞类型而有所不同。免疫应答包括细胞介导的应答(例如,t细胞应答)、体液反应(b细胞/抗体应答)、先天应答及其组合。
[0271]“免疫原性组合物”是指包含抗原、抗原序列或免疫原的组合物,其中所述组合物在免疫受试者中引发免疫应答。
[0272]
术语“免疫(immunize)”(或免疫(immunization))是指使受试者免受由致癌alk基因融合、重排、重复或突变(例如,alk-阳性癌症)如通过接种疫苗所引起的疾病或病理学或其症状。
[0273]
术语“分离的(isolated)”、“纯化的”或“生物学上纯的”是指材料在不同程度上不含其在天然状态下通常伴随它的成份。“分离(isolate)”表示与原始来源或环境的分离程度。“净化”表示高于分离的分离程度。“纯化”或“生物学上纯”蛋白质充分不含其他物质,因此任何杂质不会对蛋白质的生物学特性造成实质性影响或导致其他不利后果。也就是说,如果核酸、蛋白质或肽在通过重组dna技术生产时,实质上不含细胞材料、碎片、不相关的病毒材料或培养基,或者在化学合成时实质上不含化学前体或其他化学物质,则核酸、蛋白质或肽是纯化的。通常使用标准纯化方法和分析化学技术,例如聚丙烯酰胺凝胶电泳或高效液相色谱,来确定纯度和均质性。术语“纯化的”可以表示核酸或蛋白质在电泳凝胶中产生实质上一条带。对于可以进行例如磷酸化或糖基化的修饰的蛋白质,不同的修饰可能会产生不同的分离的蛋白质,这些蛋白质可以单独纯化。术语“分离的”还包括重组核酸或蛋白质,以及化学合成的核酸或肽。
[0274]“分离的多核苷酸”是指在来源于本发明的核酸分子的生物体的天然存在的基因组中不含位于基因侧翼的基因的核酸(例如,dna分子)。所述术语包括,例如,掺入至载体中的重组dna;进入自主复制的质粒或病毒;进入原核生物或真核生物的基因组dna;或作为独立于其他序列的单独分子存在(例如,通过pcr或限制性内切酶消化产生的cdna或基因组或cdna片段)。此外,所述术语还包括从dna分子转录的rna分子,以及作为编码额外多肽序列的杂合基因的一部分的重组dna。
[0275]“分离的多肽”是指本发明的多肽已从天然伴随它的组分中分离。通常,当多肽按重量计至少40%、按重量计至少50%、按重量计至少60%不含与其天然结合的蛋白质和天然存在的有机分子时,多肽是分离的。优选地,分离的多肽制剂按重量计至少75%、更优选至少90%、最优选至少99%不含与其天然结合的蛋白质和天然存在的有机分子。例如,可通过从天然来源中提取;通过表达编码这种多肽的重组核酸;或通过化学合成蛋白质,来获得分离的多肽。可通过任何标准、适当的方法,例如柱层析、聚丙烯酰胺凝胶电泳或通过hplc分析,来测量纯度。分离的多肽可以指通过本文所述的方法产生的alk抗原或免疫原多肽。
[0276]“k
d”是指给定相互作用(例如,抗体抗原相互作用)的解离常数。例如,对于抗体或抗原结合片段(例如,alk抗体或其抗原结合片段)和抗原(例如,alk蛋白)的双分子相互作用,它是双分子相互作用的各个组分的浓度除以复合物的浓度。
[0277]“接头(linker)”是指连接两个分子或部分的键(例如,共价键)、化学基团或分子(例如,一个或多个氨基酸),例如,融合蛋白的两个结构域(例如,alk结构域和来自elm4或npm的结构域)或在上下文的嵌合抗原受体中,将抗体可变重(vh)区连接到恒定重(ch)区的接头。
[0278]
通常,接头位于两个基团、分子或其他部分之间或两侧,并通过共价键连接到各部分,从而连接两者。在一些实施方案中,接头是氨基酸或多个氨基酸(例如,肽或蛋白质)。在一些实施方案中,接头是有机分子、基团、聚合物或化学部分。在一些实施方案中,接头长度为5-100个氨基酸,例如,5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、25、35、45、50、55、60、60、65、70、70、75、80、85、90、90、95、100、101、102、103、104、105、110、120、130、140、150、160、175、180、190或200个氨基酸长度。也考虑更长或更短的接头。
[0279]
在一些实施方案中,接头连接融合蛋白的两个结构域,诸如,例如,alk结构域和来自elm4或npm的结构域。在一些实施方案中,接头将抗体可变重(vh)区连接到恒定重(ch)区。在一些实施方案中,嵌合抗原受体(car)包含至少一个接头。至少一个接头将可变重链(vh)区缀合或连接到嵌合抗原受体的胞外结合域的恒定重链(ch)区。接头还可以将可变轻(vl)区连接到胞外结合域的可变恒定(vc)区。
[0280]
在一些实施方案中,接头是柔性蛋白质接头。在一些实施方案中,接头是(gly4ser)n接头。在一些实施方案中,接头是(gly4ser1)3。
[0281]“标志物”是指在表达水平或活性方面具有与疾病、病症、病理学或病症相关的改变的任何蛋白质或多核苷酸。
[0282]“单克隆抗体”是指从同源或实质同源抗体群体中获得的抗体。单克隆抗体针对单一抗原表位具有高度特异性。在一些实施方案中,如本文所用,“单克隆抗体”是由单个细胞或细胞系产生的抗体,其中,如例如,通过elisa或本领域已知的其他抗原结合或竞争性结合所测定的,抗体特异性结合到alk表位(例如,alk的胞外结构域的表位)。在一些实施方案
中,单克隆抗体可以是嵌合抗体或人源化抗体。在一些实施方案中,单克隆抗体可以是人类抗体。
[0283]
术语“单克隆”不限于制备抗体的任何特定方法。通常,单克隆抗体群体可以由细胞、细胞群体或细胞系产生。产生单克隆抗体的方法包括但不限于杂交瘤技术、重组技术或噬菌体展示方法。在一些实施方案中,单克隆抗体分离自受试者。在一些实施方案中,单克隆抗体可由经工程改造以表达如此类抗体的轻链和/或重链的本文所述抗体(例如,包含分别如表3和4中提供的抗体alk#1、alk#2、alk#3、alk#4、alk#5、alk#6或alk#7中任一种的cdr的抗alk抗体)或其片段的宿主细胞重组产生。产生单克隆抗体的方法是已知的并且在本领域中有所描述。
[0284]
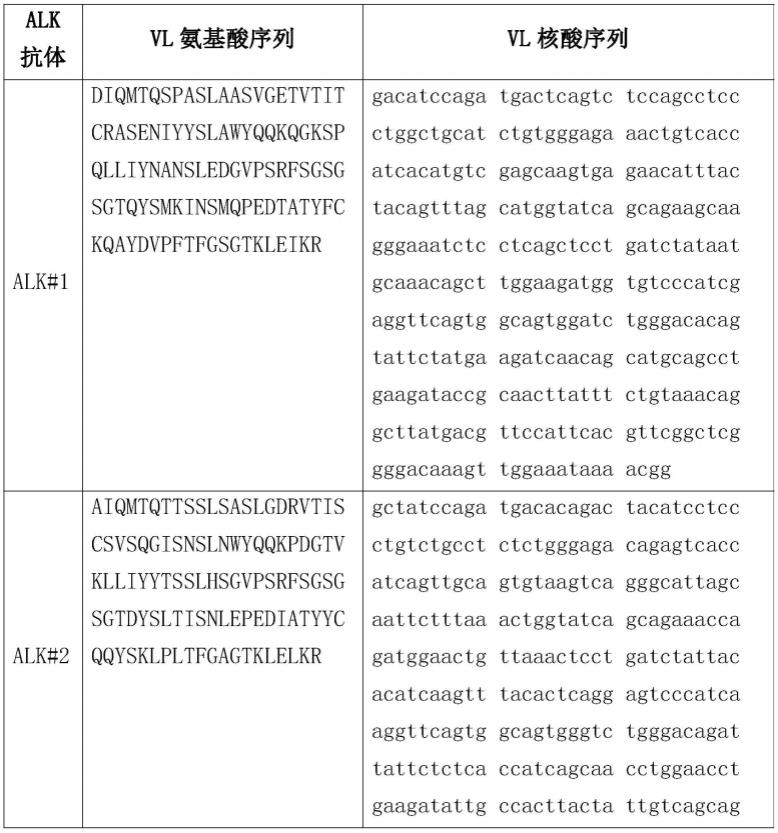
如本文所用,术语“突变”是指序列(例如核酸或氨基酸序列)内的残基被另一残基取代,或序列内一个或多个残基的缺失或插入。本文通常通过识别原始残基,然后是识别残基在序列内的位置以及新取代残基的同一性来描述突变。本文提供的用于使氨基酸取代(突变)的各种方法在本领域中是公知的,且通过例如green和sambrook,molecular cloning:a laboratory manual(4th ed.,cold spring harbor laboratory press,cold spring harbor,n.y.(2012))提供。
[0285]“瘤形成(neoplasia)”是指表现出异常生长或增殖的细胞或组织。术语瘤形成包括癌症和实体瘤。
[0286]“神经母细胞瘤”是指通常起源于腹部肾上腺组织的实体癌性肿瘤,但也可以起源于颈部、胸部、腹部和骨盆的神经组织。神经母细胞瘤来源于神经嵴,其特征在于显着的临床异质性(侵袭性、持续生长到自然缓解)。神经母细胞瘤可能转移到淋巴结、肝、肺、骨骼和骨髓。神经母细胞瘤是儿童早期最常见的异质性和恶性肿瘤,三分之二的神经母细胞瘤患者在5岁以下时被诊断出来。大约10%的神经母细胞瘤病例在alk蛋白(例如,alk
f1174l
)中有激活点突变。
[0287]
如本文所用,术语“核酸”和“核酸分子”是指包含核碱基和酸性部分的化合物,例如核苷、核苷酸或核苷酸的聚合物。通常,聚合核酸,例如包含三个或更多个核苷酸的核酸分子是线性分子,其中相邻的核苷酸通过磷酸二酯键相互连接。在一些实施方案中,“核酸”是指单个核酸残基(例如核苷酸和/或核苷)。在一些实施方案中,“核酸”是指包含三个或更多个单独的核苷酸残基的寡核苷酸链。如本文所用,术语“寡核苷酸”和“多核苷酸”可以互换使用,以指代核苷酸的聚合物(例如,至少三个核苷酸的串)。在一些实施方案中,“核酸”包括rna以及单链和/或双链dna。核酸可以例如在基因组、转录物、mrna、trna、rrna、sirna、snrna、质粒、粘粒、染色体、染色单体或其他天然存在的核酸分子的情况下是天然存在的。另一方面,核酸分子可以是非天然存在的分子,例如重组dna或rna、人工染色体、工程基因组或其片段,或合成dna、rna、dna/rna杂合体,或包括非天然存在的核苷酸或核苷。此外,术语“核酸”、“dna”、“rna”和/或类似术语包括核酸类似物,例如具有除磷酸二酯主链之外的类似物。核酸可以从天然来源纯化,使用重组表达系统产生,并且任选地纯化、化学合成等。在适当的情况下,例如,在化学合成分子的情况下,核酸可以包含核苷类似物,例如具有化学修饰的碱基的类似物或糖和主链修饰。除非另有说明,核酸序列以5'至3'方向呈现。在一些实施方案中,核酸是或包含天然核苷(例如腺苷、胸苷、鸟苷、胞苷、尿苷、脱氧腺苷、脱氧胸苷、脱氧鸟苷和脱氧胞苷);核苷类似物(例如,2-氨基腺苷、2-硫代嘧啶、肌苷、吡咯-嘧
啶、3-甲基腺苷、5-甲基胞苷、2-氨基腺苷、c5-溴尿苷、c5-氟尿苷、c5-碘尿苷、c5-丙炔基-尿苷、c5-丙炔基-胞苷、c5-甲基胞苷、2-氨基腺苷、7-脱氮腺苷、7-脱氮鸟苷、8-氧代腺苷、8-氧代鸟苷、o(6)-甲基鸟嘌呤和2-硫代胞苷);化学修饰的碱基;生物修饰碱基(例如甲基化碱基);插入碱基;修饰的糖(例如,2'-氟核糖、核糖、2'-脱氧核糖、阿拉伯糖和己糖);和/或修饰的磷酸基团(例如硫代磷酸酯和5'-n-亚磷酰胺键)。
[0288]
如本文所用,如“获得试剂”中的“获得”包括合成、分离、购买或以其他方式获得试剂。
[0289]
术语“可操作地连接”是指如本文所用的核酸序列。例如,当第一核酸序列与第二核酸序列处于功能关系时,第一核酸序列与第二核酸序列可操作地连接。例如,如果启动子影响(允许)编码序列的转录或表达,则启动子与编码序列可操作地连接。通常,可操作连接的dna序列是连续的,且在需要连接两个蛋白质编码区的情况下,位于相同的开放阅读框中。
[0290]
由所述方法产生的编码alk蛋白(抗原蛋白)的核酸序列,可使用本领域实践的程序和技术,通过密码子优化和rna优化(例如增加rna稳定性)来优化,以在哺乳动物细胞中表达。
[0291]“开放阅读框(orf)”是指一系列核苷酸三联体(密码子),它们编码没有任何终止密码子的氨基酸。这些序列通常可翻译成肽或多肽。
[0292]
术语“药学上可接受的载体”是指生理学和药学上可接受的常规载体(载体)和赋形剂,特别是在哺乳动物(例如人类)受试者中使用。此类药学上可接受的载体对于相关领域的技術人員来说是已知的,且可容易地在remington's pharmaceutical sciences,by e.w.martin,mack publishing co.,easton,pa.,15th edition(1975)及其更新版本中找到,其中描述了适用于一种或多种治疗性或免疫原性组合物的药物递送的组合物和制剂,例如一种或多种疫苗,以及另外的药物试剂。通常,药学上可接受的载体的性质取决于所采用的特定给药方式。例如,肠胃外制剂通常包含可注射的流体/液体,其包括药学和生理学上可接受的流体,例如水、生理盐水、平衡盐溶液、葡萄糖水溶液、甘油等作为载体。对于固体组合物(例如,粉末、丸剂、片剂或胶囊形式),常规的无毒固体载体可以包括,例如,药用级的甘露醇、乳糖、淀粉或硬脂酸镁,其通常稳定和/或增加组合物或药物的半衰期。除了生物中性载体之外,待施用的药物组合物可以包含少量无毒辅助物质,例如润湿剂或乳化剂、防腐剂和ph缓冲剂等,例如乙酸钠或脱水山梨糖醇单月桂酸酯。
[0293]“质粒”是指能够在宿主细胞中自主复制的环状核酸分子。
[0294]“多克隆抗体”是指从不同细胞谱系获得的抗体群,其包括特异性结合一个或多个抗原(例如,alk蛋白)内相同和/或不同表位的多种不同抗体。
[0295]
术语“蛋白质”、“肽”、“多肽”及其语法均等物在本文中可互换使用,且是指通过肽(酰胺)键连接在一起的氨基酸残基的聚合物。这些术语是指任何大小、结构或功能的蛋白质、肽或多肽。通常,蛋白质、肽或多肽的长度至少为三(3)个氨基酸。蛋白质、肽或多肽可以指单个蛋白质或蛋白质的集合。可以修饰蛋白质、肽或多肽中的一种或多种氨基酸,例如糖蛋白,例如通过添加化学实体例如碳水化合物基团、羟基、磷酸基团、法尼(farnesyl)基团、异法尼(isofarnesyl)基、脂肪酸基、用于缀合、功能化或其他修饰的接头等。蛋白质、肽或多肽也可以是单分子或可以是多分子复合物。蛋白质、肽或多肽可以只是天然存在的蛋白
质或肽的片段。蛋白质、肽或多肽可以是天然存在的、重组的或合成的,或其任何组合。
[0296]
在一些实施方案中,蛋白质包含蛋白质部分,例如,构成核酸结合结构域的氨基酸序列和有机化合物,例如,可以充当核酸切割剂的化合物。在一些实施方案中,蛋白质与核酸(例如,rna或dna)形成复合物或与核酸缔合。本文提供的任何蛋白质都可以通过本领域已知的任何方法产生。例如,本文提供的蛋白质可以通过重组蛋白质表达和纯化产生,这特别适用于包含肽接头的融合蛋白。用于重组蛋白表达和纯化的方法是公知的,且包括green和sambrook,molecular cloning:a laboratory manual(4th ed.,cold spring harbor laboratory press,cold spring harbor,n.y.(2012))中描述的那些,其全部内容以引用的方式并入本文。
[0297]
保守氨基酸取代是那些当被制造时对原始蛋白质的性质干扰最小的取代,即蛋白质的结构,特别是功能是保守的,且不会因这种取代而显着改变。保守氨基酸取代的实例是本领域已知的,例如,如美国公开案第2015/0030628号中所述的。保守取代通常保持(a)多肽主链在取代区中的结构,例如,作为片层或螺旋构象;(b)分子在靶位点的电荷或疏水性;和/或(c)侧链的大部分。
[0298]
通常预期会产生最大蛋白质性质变化的取代是非保守的,例如,其中(a)亲水残基,例如丝氨酰或苏氨酰,被(或由)疏水残基取代,例如,亮胺酸基、异亮胺酸基、苯丙氨酸基、缬氨酸基或丙氨酸基;(b)半胱氨酸或脯氨酸被(或由)任何其他残基取代;(c)具有正电侧链的残基,例如赖氨酸基、精氨酸基或组氨酸基,被(或由)电负性残基例如谷氨酸基或天冬氨酸基取代;或(d)具有大块侧链的残基,例如苯丙氨酸基,被(或由)不具有侧链的残基取代,例如甘氨酸。
[0299]“启动子”是指一系列核酸控制序列,其直接转录核酸。启动子包括靠近转录起始位点的必要核酸序列。启动子还任选地包括远端增强子或阻遏序列(repressor sequence)元件。“组成型启动子”是持续活性且不受外部信号或分子调节的启动子。相反,“诱导型启动子”的活性由外部信号或分子(例如,转录因子)调节。作为示例,启动子可以是cmv启动子。
[0300]
如本领域技术人员将理解的,术语“纯化的”不需要绝对纯度;反之,其旨在作为一相对术语。因此,例如,纯化的肽、蛋白质或其他活性化合物是从天然结合的蛋白质和其他污染物中完全或部分分离出来的。在某些实施方案中,术语“实质上纯化的”是指已从细胞、细胞培养基或其他粗制品中分离并经常规方法例如分离、层析或电泳分离的肽、蛋白质或其他活性化合物,以去除初始制剂的各种成分,如蛋白质、细胞碎片和其他成分。
[0301]“重组”核酸或蛋白质是具有序列的核酸或蛋白质,所述序列是非天然存在的序列或由两个分开的序列片段人工组合而成的序列。这种人工组合通常通过化学合成或通过人工操作分离的核酸片段来完成,例如通过基因工程技术。“非天然存在的”核酸或蛋白质是可以通过重组技术、人工操作或遗传或分子生物学工程程序和技术制备的核酸或蛋白质,例如本领域常用的那些。
[0302]“减少”是指至少5%、10%、25%、30%、40%、50%、75%、80%、85%、90%、95%、98%或100的负改变%。
[0303]“参考”是指标准或控制条件。
[0304]“参考序列”是用作序列比较基础的已定义序列。参考序列可以是指定序列的子集
或全部;例如,一段全长cdna或基因序列,或完整的cdna或基因序列。对于多肽,参考多肽序列的长度通常为至少约16个氨基酸,优选至少约20个氨基酸,更优选至少约25个氨基酸,甚至更优选约35个氨基酸、约50个氨基酸或约100个氨基酸。对于核酸,参考核酸序列的长度通常为至少约50个核苷酸,优选至少约60个核苷酸,更优选至少约75个核苷酸,甚至更优选约100个核苷酸或约300个核苷酸或其附近或之间的任何整数。
[0305]“单链抗体”或“scfv”是指含有一种或多种抗体的vh和vl结构域的基因工程分子,这些抗体通过合适的多肽接头作为基因融合的单链分子连接(参见,例如,bird等人,science,242:423-426,1988;huston等人,proc.natl.acad.sci.,85:5879-5883,1988:ahmad等人,clin.dev.immunol.,2012,doi:10.1155/2012/980250:marbry,idrugs,13:543-549,2010)。在一些实施方案中,分子内取向的vh-结构域和scfv中的vl-结构域是vh-结构域-接头结构域-vl-结构域。在一些实施方案中,分子内取向的vh-结构域和scfv中的vl-结构域是vl-结构域-接头结构域-vh-结构域。
[0306]“信号肽”或“领导肽”是指短氨基酸序列(例如,长度约为16-30个氨基酸),其将新合成的分泌蛋白或膜蛋白引导到膜(例如,内质网膜)。信号肽通常位于多肽的n端,且可以在多肽穿过膜后被信号肽酶去除。信号肽序列通常包含三个常见的结构特征:n端极性碱性区域(n-区)、疏水性核心和亲水性c-区)。在一些实施方案中,本发明的car包括信号肽序列(例如,n端到抗原结合域)。在一些实施方案中,信号肽序列是mcd8。在一些实施方案中,前导肽是cd8α。
[0307]“同时”或“同时地”是指大约同时。例如,术语“同时”或“同时地”包括在另一种试剂的几分钟或几小时内施用一种或多种试剂的情况。
[0308]“特异性结合”是指化合物、核酸分子、多肽、抗体或其复合物(例如,嵌合抗原受体),其识别和结合多肽(例如,alk多肽)或疫苗产物,但实质上不能识别和结合样品中的其他分子,例如生物样品,其天然包括本发明的多肽,例如alk多肽。例如,嵌合抗原受体细胞特异性结合在细胞表面上表达的特定标记(例如,alk多肽),但不结合细胞表面上的其他多肽、碳水化合物、脂质或任何其他化合物。
[0309]
在本文中描述的方法中有用的核酸分子包括编码所述多肽或其片段的任何核酸分子。此类核酸分子不需要与内源核酸序列100%相同,但通常会表现出实质同一性。与内源序列具有“实质同一性”的多核苷酸通常能够与双链核酸分子的至少一条链杂交。
[0310]“实质上相同”是指多肽或核酸分子表现出与参考氨基酸序列(例如,本文描述的任何一个氨基酸序列)或核酸序列(例如,本文中描述的任何一个核酸序列)至少50%的同一性。优选地,这样的序列在氨基酸水平或核酸水平上与用于比较的序列具有至少60%、或至少80%或85%、或至少或等于90%、95%、98%或甚至99%的同一性。
[0311]“序列同一性”是指氨基酸或核酸序列之间的相似性,即,以序列之间的相似性表示。序列同一性通常以同一性百分比(或相似性或同源性)来衡量;百分比越高,序列越相似。当使用标准方法比对时,给定基因或蛋白质的同源物或变体将具有相对高度的序列同一性。序列同一性通常使用序列分析软件(例如,遗传计算机组的序列分析软件包,university of wisconsin biotechnology center,1710university avenue,madison,wis.53705、blast、bestfit,gap或pileup/prettybox程序)。此类软件通过各种替换、缺失和/或其他修饰分配同源性程度来匹配相同或相似的序列。保守取代通常包括以下群组内
的取代:甘氨酸、丙氨酸;缬氨酸、异亮氨酸、亮氨酸;天冬氨酸、谷氨酸、天冬酰胺、谷氨酰胺;丝氨酸、苏氨酸;赖氨酸、精氨酸;和苯丙氨酸、酪氨酸。在确定同一性程度的示例性方法中,可以使用blast程序,其中e-3
和e-100
之间的概率分数表示密切相关的序列。此外,其他程序和对齐算法在例如smith和waterman,1981,adv.appl.math.2:482;needleman和wunsch,1970,j.mol.biol.48:443;pearson和lipman,1988,proc.natl.acad.sci.u.s.a.85:2444;higgins和sharp,1988,gene 73:237-244;higgins和sharp,1989,cabios 5:151-153;corpet等人,1988,nucleic acids research16:10881-10890;pearson和lipman,1988,proc.natl.acad.sci.u.s.a.85:2444;和altschul等人,1994,nature genet.6:119-129中有所描述。ncbi basic local alignment search tool(blast
tm
)(altschul等人.1990,j.mol.biol.215:403-410)可从多个来源轻松获得,包括国家生物技术信息中心(ncbi,bethesda,md)和网络上,用于与序列分析程序blastp、blastn、blastx、tblastn和tblastx结合使用。
[0312]“受试者”是指动物,例如哺乳动物,包括但不限于人类、非人类灵长类动物或非人类哺乳动物,例如牛、马、犬科动物、绵羊科动物或猫科动物哺乳动物,或绵羊、山羊、美洲驼、骆驼或啮齿动物(大鼠、小鼠)、沙鼠或仓鼠。在一非限制性实例中,受试者是指患有、处于发展风险中或易感由致癌alk基因融合、重排、重复或突变(例如,alk-阳性癌症)引起的疾病的人类。在如本文所述的特定方面,受试者是人类受试者,例如患者。
[0313]
本文提供的范围应理解为所述范围内所有值的简写,包括第一个和最后一个陈述的值。例如,1到50的范围被理解为包括任何选自由1、2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、21、22、23、24、25、26、27、28、29、30、31、32、33、34、35、36、37、38、39、40、41、42、43、44、45、46、47、48、49、50或更大,连续地,例如至100或更大的任意数字、数字组合或亚范围所组成的群组。
[0314]
如本文所用,术语“治疗(treat)”、“治疗(treating)”、“治疗(treatment)”等是指减少、递减、降低、延迟、消除、改善或去除疾病、病症、病症或病理学和/或与之相关的症状。尽管不旨在限制,“治疗(treating)”通常涉及在疾病、病情、病症或病理学和/或与其相关的症状已经开始发展以降低疾病的严重性等以及相关的体征和症状之后发生的治疗干预。应当理解,尽管不排除,治疗病症或病症不需要完全消除疾病、病症、病症、病理学或与其相关的症状。
[0315]
如本文所用,术语“预防(prevent)”、“预防(preventing)”、“预防(prevention)”、“预防性治疗”等是指抑制或阻断受试者的疾病状态,或在受试者中某种疾病的完全发展,或降低在受试者中发展疾病、病症或病情的概率,受试者不具有但有风险或易于发展成疾病、病症或病情。
[0316]“t细胞”是指对免疫应答至关重要的白细胞。t细胞包括但不限于cd4+t细胞和cd8+t细胞。cd4+t淋巴细胞是一种免疫细胞,其表面带有一种称为“分化簇4(cd4)”的标记。这些细胞,也称为辅助t细胞,有助于协调免疫应答,包括抗体反应和杀伤性t细胞反应。cd8+t细胞带有“分化簇8”(cd8)标记。在一个实施方案中,cd8+t细胞是细胞毒性t淋巴细胞。在另一个实施方案中,cd8+细胞是抑制性t细胞。t细胞的效应器功能是t细胞的特殊功能,例如溶细胞活性或辅助活性,包括细胞因子的分泌。
[0317]“t细胞信号传送域(signaling domain)”是指在t细胞中表达的蛋白质的胞内部
分,其转导t细胞效应器功能信号(例如,激活信号)并指导t细胞执行特化功能。许多因素可以诱导t细胞活化,包括同源抗原与t细胞表面上的t细胞受体的结合以及同源配体与t细胞表面上的共刺激分子的结合。t细胞共刺激分子是t细胞上的同源结合配偶体,其与共刺激配体特异性结合,从而介导t细胞的共刺激反应,例如但不限于增殖。共刺激分子包括但不限于mhc类i分子。t细胞的激活导致免疫应答,例如t细胞增殖和分化(参见,例如,smith-garvin等人,annu.rev.immunol.,27:591-619,2009)。示例性的t细胞信号传送域是本领域已知的。非限制性实例包括cd3ζ、cd8、cd28、cd27、cd154、gitr(tnfrsf18)、cd134(ox40)和cd137(4-1bb)信号传送域。
[0318]
在一些实施方案中,cd3ζ信号传送域与m1928z car构建体的cd3ζ信号传送域具有至少85%、至少90%、至少95%、至少98%、至少99%或100%的同一性(参见davila等人,plosone 2013)。
[0319]
在一些实施方案中,cd3ζ信号传送域与如下提供的示例性氨基酸序列具有至少85%、至少90%、至少95%、至少98%、至少99%或100%的同一性:
[0320]
rvkfsrsadapayqqgqnqlynelnlgrreeydvldkrrgrdpemggkprrknpqeglynelqkdkmaeayseigmkgerrrgkghdglyqglstatkdtydalhmqalppr
[0321]
在一些实施方案中,cd8信号传送域与m1928z car构建体的cd8信号传送域具有至少85%、至少90%、至少95%、至少98%、至少99%或100%的同一性(参见davila等人,plosone 2013)。
[0322]
在一些实施方案中,cd8信号传送域与如下提供的示例性氨基酸序列具有至少85%、至少90%、至少95%、至少98%、至少99%或100%的同一性:
[0323]
fvpvflparptttpaprpptpaptiasqplslrpeacrpaaggavhtrgldfacdiyiwaplagtcgvlllslvitlycnhrnr
[0324]
在一些实施方案中,cd28信号传送域与m1928z car构建体的cd28信号传送域具有至少85%、至少90%、至少95%、至少98%、至少99%或100%的同一性(参见davila等人,plosone 2013)。
[0325]
在一些实施方案中,cd28信号传送域与如下提供的示例性氨基酸序列具有至少85%、至少90%、至少95%、至少98%、至少99%或100%的同一性:
[0326]
skrsrllhsdymnmtprrpgptrkhyqpyapprdfaayrs
[0327]
在一些实施方案中,cd137(4-1bb)信号传送域与如下提供的示例性氨基酸序列具有至少85%、至少90%、至少95%、至少98%、至少99%或100%的同一性:
[0328]
krgrkkllyifkqpfmrpvqttqeedgcscrfpeeeeggcel
[0329]
在一些实施方案中,cd137(4-1bb)信号传送域与如下提供的示例性氨基酸序列具有至少85%、至少90%、至少95%、至少98%、至少99%或100%的同一性:
[0330]
rfsvvkrgrkkllyifkqpfmrpvqttqeedgcscrfpeeeeggcel
[0331]
在一些实施方案中,cd134(ox40)信号传送域与如下提供的示例性氨基酸序列具有至少85%、至少90%、至少95%、至少98%、至少99%或100%的同一性:
[0332]
r rrdqrlppdahkppgggsfrtpiqeeqadahstlaki
[0333]
如本文所述,“转化的”或“转染的”细胞是通过分子生物学技术已将核酸分子或多核苷酸序列引入其中的细胞。如本文所用,术语“转染”涵盖可将核酸分子或多核苷酸引入
此类细胞的所有技术,包括用病毒载体转染、用质粒载体转化和引入裸核酸(dna或rna)通过电穿孔、脂质转染和粒子枪加速。
[0334]“跨膜域(transmembrane domain)”是指插入脂质双层的氨基酸序列,例如细胞或病毒或病毒样颗粒的脂质双层。跨膜域可用于将感兴趣的蛋白质(例如,car)锚定到膜上。跨膜域可以来自天然来源或合成来源。在来源是天然的情况下,所述域可以源自任何膜结合或跨膜蛋白。用于所公开的car的跨膜域可以至少包括t细胞受体、cd28、cd3ε、cd45、cd4、cd5、cd8、cd9、cd16、cd22、cd33、cd37、cd64、cd80、cd86、cd134、cd137、cd154的α、β或ζ链的跨膜区。
[0335]
在一些实施方案中,cd28跨膜域与如下提供的示例性氨基酸序列具有至少85%、至少90%、至少95%、至少98%、至少99%或100%的同一性:
[0336]
ievmypppyldneksngtiihvkgkhlcpsplfpgpskpfwvlvvvggvlacysllvtvafiifwvr
[0337]
在一些实施方案中,cd8跨膜域与m1928z car构建体的cd8跨膜域具有至少85%、至少90%、至少95%、至少98%、至少99%或100%的同一性(参见davila等人,plosone 2013)。
[0338]
在一些实施方案中cd8跨膜域与如下提供的示例性氨基酸序列具有至少85%、至少90%、至少95%、至少98%、至少99%或100%同一性:
[0339]
tttpaprpptpaptiasqplslrpeacrpaaggavhtrgldfacdiyiwaplagtcgvlllslvitlyc
[0340]“疫苗”是指能够刺激(引发)免疫应答的免疫原性材料(例如蛋白质或核酸)的制剂,其被施用于受试者以治疗疾病、病症或病理学,或预防疾病、病症,或病理学(例如,alk-阳性癌症(例如,神经母细胞瘤))。免疫原性材料可以包括,例如,源自肿瘤或细胞系(例如,表达alk的肿瘤或细胞系)的抗原性蛋白质、肽或dna。在一些实施方案中,免疫原性材料是alk多肽或其片段。疫苗可能会在受试者中引发预防性(预防性)免疫应答;它们还可以在受试者中引发治疗反应免疫应答。疫苗施用的方法根据疫苗而不同,并且可以包括途径或方式,例如接种(静脉内或皮下注射)、摄取、吸入或其他形式的施用。接种可以通过任何数量的途径递送,包括肠胃外,例如静脉内、皮下或肌肉内。疫苗也可以与佐剂一起施用以增强免疫应答。
[0341]
如本文所用,“载体”是指可以插入外源核酸而不破坏载体在宿主细胞中复制和/或整合到宿主细胞中的能力的核酸(多核苷酸)分子。载体可以包括允许其在宿主细胞中复制的核酸序列,例如复制起点。插入载体能够将自身插入宿主核酸中。载体还可以包括一种或多种选择标记基因和其他遗传元件。表达载体是包含必要的调节序列的载体,以允许转录和翻译在宿主细胞中插入的一个或多个基因。在本公开的一些实施例中,载体编码alk car。在一些实施方案中,载体是ptr600表达载体(美国专利申请公开案第2002/0106798号;ross等人,2000,nat immunol.1(2):102-103;和green等人,2001,vaccine20:242-248)。在一些实施方案中,载体是病毒载体(例如,慢病毒载体)。
[0342]
除非特别说明或从上下文中显而易见,如本文所用,术语“或”被理解为具有包容性。除非特别说明或从上下文中显而易见,如本文所用,术语“一(a)”、“一(an)”和“所述(the)”被理解为单数或复数。类似地,除非上下文另有明确说明,否则“或”一词旨在包括“和”。因此,“包含a或b”是指包括a、或b、或a和b。还应理解,对于核酸或多肽给出的所有碱基大小或氨基酸大小以及所有分子量或分子量值都是近似值,仅供说明之用。
[0343]
除非特别说明或从上下文显而易见,如本文所用,术语“约”被理解为在本领域的正常公差范围内,例如在平均值的两(2)个标准偏差(sd)内。约可理解为在10%、9%、8%、7%、6%、5%、4%、3%、2%、1%、0.5%、0.1%、0.05%或0.01%以内规定的值。除非上下文另有明确说明,否则本文提供的所有数值均由术语约修改。
[0344]
在此对变量的任何定义中列举的化学基团包括将所述变量定义为任何单个基团或所列基团的组合。本文对变量或方面的一些实施例的叙述包括作为任何单个实施例或与任何其他实施例或其部分组合的所述实施例。
[0345]
本文提供的任何组合物或方法可以与本文提供的任何其他组合物和方法中的一种或多种组合。
附图说明
[0346]
图1a至图1c描绘了将间变性淋巴瘤激酶(alk)抗体的可变重链(vh)和可变轻链(vl)克隆到嵌合抗原受体(car)构建体中的策略。图1a提供了alk car的克隆策略示意图,使用重叠pct产生vdj-h,然后是mcd8信号肽和vjκ,然后是部分(gly4ser1)3接头序列。第二轮pcr后,mcd8sp、vdj-h、接头和vjκ可以融合。基因转移的功效可以通过gfp表达来评估。图1b提供了小鼠car-t构建体、用于gl-2a-m1928z的报导基因(gfp)和使用2a肽序列的car(m1928z)的示意图。描绘的是包装信号、剪接供体(sd)、剪接受体(sa)、alk scfv的vh和vl区域,以及细胞外(ec)、跨膜(tm)和胞质(c)区域。图1c提供了鼠cd19 car和alk-car构建体的示意图。
[0347]
图2提供了使用荧光激活细胞分选(facs)分析的具有alk car构建体(car-alk#1-#7)的t细胞的转导效率的图示。从脾脏中纯化小鼠t细胞,用抗cd3/cd28+il2激活,并用car逆转录病毒构建体转导。在病毒感染后48小时,通过gfp报导基因表达评估转导效率。活化的非转导t细胞用作阴性对照。以cd19为导向的car-t细胞用作阳性对照。
[0348]
图3a至图3c描绘alk car构建体释放细胞因子。由于人类神经母细胞瘤细胞不表达cd19,cd19 car-t细胞被用作阴性对照。图3a是测量alkcar-t细胞产生的ifnγ的图示。逆转录病毒转导的car-t细胞与靶细胞以1:1e:t比率(效应器=gfp+car-t细胞)孵育。使用的靶细胞是用编码全长alk受体或模拟载体的逆转录病毒载体转导的nih3t3和eμ-myc白血病细胞。elisa用于评估培养24小时后细胞上清液中ifnγ的产生。图3b是测量alkcar-t细胞产生的ifnγ的图示。逆转录病毒转导的car-t细胞与靶细胞以1:1e:t比率(效应器=gfp+car-t细胞)孵育。使用的靶细胞是人类神经母细胞瘤细胞sh-sy5y和sk-n-be。elisa用于评估培养24小时后细胞上清液中ifnγ的产生。误差棒表示来自5个独立实验的标准偏差。图3c是测量由alk car-t细胞产生的gm-csf的图示。逆转录病毒转导的car-t细胞与靶细胞以1:1e:t比率(效应器=gfp+car-t细胞)孵育。使用的靶细胞是人类神经母细胞瘤细胞sh-sy5y和sk-n-be。elisa用于评估培养24小时后细胞上清液中gm-csf的产生。误差棒表示来自5个独立实验的标准偏差。
[0349]
图4提供了测量alk car-t细胞构建体与cd19 car-19细胞相比的alk特异性溶细胞活性的图示。用cfse对表达eμ-myc的模拟载体或编码全长alk受体的载体进行染色,并以e:t=10:1的比例与效应car-t细胞一起孵育。基于用car构建体转导的gfp阳性细胞的百分比标准化car-t细胞的细胞数。18小时后,通过使用以下公式确定活靶细胞分数来计算溶细
胞活性:溶细胞活性=csfe+/cd19+活细胞的100
–
%。cd19 car-t细胞被用作黄金标准对照,因为它们有效地靶向cd19+eμ-myc细胞。eμ-myc载体(alk-)细胞用作对照以确定alk定向溶细胞活性的特异性。误差棒是来自5次独立实验的标准偏差。
[0350]
图5a至图5c描绘了将alk car-t细胞过继转移到具有eμ-myc/ak全身性肿瘤的小鼠中。图5a是用单独的细胞磷酰胺(ctx,100mg/kg)、细胞磷酰胺加car-cd19(15x106基于gfp+)和细胞磷酰胺加car-alk#5(15x106基于gfp+)处理的小鼠存活曲线的图示。未处理的小鼠用作阴性对照。图5b是facs分析的图形描述。在仅用ctx处理的一只小鼠中发现了cd19+/alk+细胞。在外周血中发现了循环的cd19+/alk+肿瘤细胞(左),在淋巴结附近分离出alk+肿瘤块(右)。图5c是对存活超过两个月的8只小鼠中的6只进行的facs分析的图示。外周血中未发现肿瘤细胞。
[0351]
图6a至图6d描绘了alk car-t细胞与alk antibody#5(alk#5)在神经母细胞瘤模型中的抗肿瘤活性。图6a是评估alk car-t细胞在皮下alk
f1174l
/mycn神经母细胞瘤模型中的抗肿瘤功效的实验设计的示意图。nsg小鼠在两侧被皮下移植1x10
6 alk
f1174l
/mycn细胞。图6b是由alk car-t细胞诱导的神经母细胞瘤生长延迟的图示,其中每天测量肿瘤体积(双尾p值《0.0001,非配对t检验)。图6c是用alk#5car-t细胞处理的荷有神经母细胞瘤的小鼠的存活曲线的图示。cd19 car-t细胞用作对照。图6d是用alk#5car-t细胞处理的荷有神经母细胞瘤的小鼠的存活曲线的图示。cd19 car-t细胞用作对照。
[0352]
图7a至图7c描绘了在转移性神经母细胞瘤的免疫活性模型中,与劳拉替尼相比,具有alk#5的alk car-t细胞的抗肿瘤活性。图7a是皮下移植到balb/c小鼠中的alk
f1174l
/mycn神经母细胞瘤的图示。alk#5car-t细胞或cd19car-t细胞由balb/c纯化的t细胞产生并每周静脉注射,持续三周。劳拉替尼通过口服管饲法(4mg/kg/天)给药三周。在第23天测量肿瘤体积。图7b描绘了用1x106alk
f1174l
/mycn神经母细胞瘤细胞静脉内注射以诱导多个转移性肿瘤形成并用cd19car-t细胞或alk car-t细胞治疗的免疫活性小鼠的mri图像。转移性肿瘤由虚线圆圈突出显示。图7c是用指定的car-t细胞或劳拉替尼治疗的神经母细胞瘤转移模型中免疫活性小鼠的存活曲线的图示。
[0353]
图8a至图8d描绘了人类alk car-t细胞的体外验证。图8a是通过流式细胞术分析转导后第4天人类t细胞中alk car表达的图示。图8b是人类t细胞在与人类神经母细胞瘤细胞imr-32共培养中以效应物:靶(e:t)细胞的指定比例释放的ifn-γ的图示。图8c是人类t细胞在与人类神经母细胞瘤细胞imr-32以指定比例的e:t细胞共培养时增殖的图示。图8d是量化alk car-t细胞的体外杀伤活性的图示,通过以指定比例共培养3天后残留的imr-32神经母细胞瘤细胞的数量评估。
[0354]
图9a和图9b描绘了靶向alk+细胞的nk细胞的产生。图9a描绘了用于产生nk细胞的halk#5car构建体的示意图。图9b是量化用halk car构建体转导的nk-92细胞在与表达人类alk受体的ht1080细胞温育24小时后的体外杀伤活性的图示。
[0355]
图10a和图10b描绘了劳拉替尼对神经母细胞瘤细胞中的alk活力和表达的影响。图10a是用增加劑量的劳拉替尼處理的幾種具有各種alk遺傳改變的增加几种具有各种alk基因(nb-1(alk wt扩增)、imr-32(alk wt)、nbl-s(alk wt)、sh-sy5y(突变的alkf1174l)、kelly(突变的alkf1174l))改变的神经母细胞瘤细胞系。在48小时测量活力。如图10b是测量的图形描述通过流式细胞术在用10nm劳拉替尼处理24小时的kelly和imr-32细胞上表达
表面alk在kelly和imr-32细胞上。
[0356]
图11a和图11b描绘了添加alk疫苗可提高神经母细胞瘤同基因模型的存活率。图11a描绘了用alk疫苗、alk car-t细胞和劳拉替尼的组合治疗的小鼠的给药方案的示意图。向balb/c小鼠皮下注射1x106个同源alk
f1174l
/mycn神经母细胞瘤细胞。小鼠接种alk疫苗并在指定时间注射alkcar-t细胞。alk tki劳拉替尼在指定时间内以4mg/kg bid给药。图11b是用alk疫苗、alk car-t细胞和劳拉替尼的组合或alk car-t细胞和劳拉替尼的组合处理的小鼠的存活曲线的图示。评估随访曲线,最长截止时间为34天。在alk car-t细胞中添加alk疫苗可进一步提高小鼠的存活率。
[0357]
图12a和图12b描述了halk car-t细胞的体外验证。图12a提供了显示alk在一组人类神经母细胞瘤细胞系(lan-1、sk-n-fi、ngp、sk-n-sh、sh-sy5y、kelly、lan-5、nbl-s、felix、imr-32和nb-1)中表达的蛋白质印迹。图12b是描绘halk car-t细胞对人类神经母细胞瘤细胞系(nbl-s、sk-n-fi、imr-32、ngp、nb-1、lan-5、sk-n-sh、kelly、sh-sy5y)。数据来自从两个独立供体获得的一式三份car-t细胞。cd19 car-t细胞和未转导的t细胞作为阴性对照,gd2 car-t细胞作为阳性对照。
[0358]
图13a至图13e描绘了alk car-t细胞缺乏毒性。图13a是描绘单独注射alk5 car-t细胞和与劳拉替尼联合注射的具有(左)和不具有(右)肿瘤的小鼠体重变化的图。cd19 car-t细胞与劳拉替尼、单独的劳拉替尼和未转导的t细胞联合用作对照。图13b是描绘单独注射alk5 car-t细胞和与劳拉替尼联合注射的具有(左)和没有肿瘤(右)的小鼠体温变化的图。cd19 car-t细胞与劳拉替尼、单独的劳拉替尼和未转导的t细胞联合用作对照。图13c是描绘单独注射alk5 car-t细胞(左/右)和与劳拉替尼组合(右)在有和没有肿瘤的小鼠中干扰素γ(ifnγ)产生(pg/ml)的图。cd19 car-t细胞、cd19 car-t细胞与劳拉替尼组合、劳拉替尼单独和未转导的t细胞用作对照。图13d是描绘在单独注射alk5 car-t细胞(左/右)和与劳拉替尼组合(右)后在有和没有肿瘤的小鼠中产生白细胞介素6(il-6)(pg/ml)的图。cd19 car-t细胞、cd19 car-t细胞与劳拉替尼组合、劳拉替尼单独和未转导的t细胞用作对照。图13e是描绘在单独注射alk5 car-t细胞(左/右)和与劳拉替尼组合(右)后在有和没有肿瘤的小鼠中血清淀粉样蛋白a 3(msaa3)产生(μg/ml)的图。cd19 car-t细胞、cd19car-t细胞与劳拉替尼组合、劳拉替尼单独和未转导的t细胞用作对照。
[0359]
图14a和14b描绘了人类alk car-t细胞对几种细胞系(nbl-s、sk-n-fi、imr-32、ngp、nb-1、lan5、sk-n-sh、kelly、sh-sy5y、raji)以1:1的肿瘤:car-t比率(图14a)或1:5的肿瘤:car-t比率(图14b)治疗人类神经母细胞瘤。cd19 car-t细胞和未转导的t细胞作为阴性对照,gd2 car-t细胞作为阳性对照。
[0360]
图15a至图15f描绘人类alkcar-t细胞联合alk抑制剂劳拉替尼的杀伤活性。图15a是描绘单独或与10nm和100nm的劳拉替尼组合通过人类alk car-t细胞的残余肿瘤细胞对人类神经母细胞瘤的kelly和sh-sy5y细胞系的杀伤活性的图。alkcar-t细胞与dmso、gd2 car-t细胞和未转导的t细胞组合用作对照。图15b是描绘单独或与10nm和100nm的劳拉替尼组合通过人类alk car-t细胞的残余肿瘤细胞对人类神经母细胞瘤的kelly和sh-sy5y细胞系的杀伤活性的图。cd19 car-t细胞、cd19 car-t细胞与10nm和100nm的劳拉替尼组合、alk car-t细胞与dmso、gd2 car-t细胞和未转导的t细胞用作对照。图15c是描绘通过人类alk car-t细胞的残余肿瘤细胞对人类神经母细胞瘤(lan5、sk-n-fi、imr-32和ngp)的几种细胞
系单独或与10nm的劳拉替尼组合的杀伤活性和100纳米。cd19 car-t细胞、cd19 car-t细胞与10nm和100nm的劳拉替尼组合、alk car-t细胞与dmso、gd2 car-t细胞和未转导的t细胞用作对照。图15d是描述alk抑制剂劳拉替尼增强alk在神经母细胞瘤细胞表面上的表达和增加alk car-t细胞靶向的机制的示意图。图15e是显示alk在具有alk基因突变(lan-5(r1275q)、sh-sy5y(f1174l)、sk-n-sh(f1174l)、ngp(d1529e)、nbl-s(wt)、imr-32(wt)、sk-n-fi(wt)、kelly(wt))的神经母细胞瘤细胞中的表达的蛋白质印迹。与10nm和100nm的劳拉替尼联合使用时。dmso处理和未转导的细胞用作对照。如图15f是描绘在24、48、72和96小时用10nm和100nm劳拉替尼处理后sh-sy5y神经母细胞瘤细胞中的相对alk mrna表达的图。dmso处理和未转导的细胞用作对照。
[0361]
图16a和16b描绘了人类alk car-t细胞对表达高水平alk的人类神经母细胞瘤细胞系nb-1的体内抗肿瘤活性。图16a是注射nb-1细胞然后用单次注射alk car-t细胞处理的nsg小鼠的热图图像。cd19car-t细胞和非转导(nt)细胞用作阴性对照,gd2 car-t细胞用作阳性对照。通过用ivis仪器检测的荧光素酶发光随时间监测肿瘤生长。图16b是描绘如图16a中所述治疗的小鼠的无治疗存活(tfs)的图。
[0362]
图17a至图17d描绘人类alkcar-t细胞对表达低水平突变alk的人类神经母细胞瘤细胞系sk-n-sh的体内抗肿瘤活性。图17a是描绘在nsg小鼠体内将alk car-t细胞与劳拉替尼结合的实验程序的示意图。图17b是描绘注射sk-n-sh细胞然后用单次注射alk car-t细胞治疗的nsg小鼠的热图图像。cd19 car-t细胞作为阴性对照,gd2 car-t细胞作为阳性对照。劳拉替尼根据图17a所示的程序给药。通过用ivis仪器检测的荧光素酶发光监测肿瘤生长。图17c是描绘注射人类神经母细胞瘤细胞系sk-n-sh并用根据图17b中所述的alk car-t细胞处理的小鼠的存活率的图。图17d是描绘注射人类神经母细胞瘤细胞系sk-n-sh并用alk car-t细胞联合根据图17b中所述的劳拉替尼治疗的小鼠的存活率的图。
[0363]
图18描绘了halk car-t构建体的示意图。描绘了5'和3'长末端重复(ltr)启动子、alk scfv、cd8α跨膜域(tmcd8α)、cd28信号传送域和cd3ζ信号传送域。
具体实施方式
[0364]
[发明的详细说明]
[0365]
如下所述,本发明的特征在于间变性淋巴瘤激酶嵌合抗原受体(alk car)和包含alk car的工程化免疫细胞(例如,alk car-t细胞)。本发明的alk car以特异性结合alk蛋白(例如,alk胞外结构域)的alk抗体序列为特征。本发明的特征还在于编码alk car的多核苷酸。alk car、编码alk car的多核苷酸或包含alk car的工程化免疫细胞可用于治疗和/或减轻受试者疾病(例如alk-阳性癌症(例如神经母细胞瘤))的方法。
[0366]
本文所述的alk car、编码alk car的多核苷酸或包含alk car的工程化免疫细胞也可用于治疗alk-阳性癌症(例如神经母细胞瘤)的药物组合物中,特别是向其施用药物组合物的人类受试者。本发明的alkcar、编码alk car的多核苷酸或包含alk car的工程化免疫细胞及其药物组合物,为对alk-阳性癌症的先前和传统疗法产生抗性或未能响应的患者提供了额外的治疗选择。
[0367]
a)间变性淋巴瘤激酶嵌合抗原受体(alk car)和car-t细胞
[0368]
本发明提供了一种间变性淋巴瘤激酶嵌合抗原受体(alk cars)和表达alk cars
的免疫效应细胞。表达嵌合抗原受体(car)的免疫效应细胞可以增强免疫效应细胞的免疫应答活性,其中car对抗原(例如,alk)上的表位具有亲和力,其中抗原与改变的适应度有关生物。例如,car可以对在肿瘤细胞(例如,alk-阳性癌症(例如,神经母细胞瘤)中表达的蛋白质上的表位)具有亲和力。由于car-t细胞可以独立于主要组织相容性复合体(mhc)发挥作用,因此激活的car-t细胞可以杀死表达抗原的肿瘤细胞。car-t细胞的直接作用避开了肿瘤细胞防御机制,这些机制是响应mhc将抗原呈递给免疫效应细胞而进化的。
[0369]
一些实施方案包括自体免疫效应细胞免疫治疗,其中免疫效应细胞从患有疾病或适应性改变的受试者获得,所述疾病或适应性改变的特征在于表达表面标志物的癌性或其他改变的细胞(例如,alk-阳性癌症(例如,神经母细胞瘤))。获得的免疫效应细胞经过基因修饰以表达car,并有效地针对特定抗原(例如,alk)重新定向。因此,在一些实施方案中,免疫效应细胞获自需要car-t免疫治疗的受试者。在一些实施方案中,这些自体免疫效应细胞在从受试者获得后不久进行培养和修饰。在其他实施方案中,获得自体细胞,然后储存以备将来使用。对于可能正在接受平行治疗的个体,这种做法可能是可取的,这将在未来减少免疫效应细胞计数。在同种异体免疫效应细胞免疫治疗中,免疫效应细胞可以从接受治疗的受试者以外的供体获得。在修饰以表达car后,将免疫效应细胞施用于受试者以治疗瘤形成(例如,alk-阳性癌症(例如,神经母细胞瘤))。在一些实施方案中,待修饰以表达car的免疫效应细胞可以从预先存在的免疫效应细胞原种培养物获得。
[0370]
可以使用本领域已知的标准技术从采集自受试者或供体的样品中分离或纯化免疫效应细胞。例如,可以通过裂解红细胞并通过离心除去外周单核血细胞从全血样品中分离或纯化免疫效应细胞。可以使用基于细胞特异性标记如cd25、cd3、cd4、cd8、cd28、cd45ra或cd45ro分离免疫效应细胞的选择性纯化方法进一步分离或纯化免疫效应细胞。另一种分离或纯化免疫效应细胞的技术是流式细胞术。在荧光激活细胞分选中,对免疫效应细胞标记物具有亲和力的荧光标记抗体用于标记样品中的免疫效应细胞。适用于表达标记的细胞的圈选策略(gating strategy)用于分离细胞。例如,可以通过使用例如对免疫效应细胞标记物(例如cd4、cd8、cd28、cd45)具有特异性的荧光标记抗体和相应的圈选策略将t淋巴细胞与样品中的其他细胞分离。在一个实施例中,采用了cd45圈选策略。在一些实施方案中,使用针对免疫效应细胞特异性的其他标志物的圈选策略来代替cd45圈选策略或与cd45圈选策略组合。
[0371]
在一些实施方案中,本发明考虑的免疫效应细胞是效应t细胞。在一些实施方案中,效应t细胞是初始cd8
+
t细胞、细胞毒性t细胞、自然杀伤t(nkt)细胞或调节性t(treg)细胞。在一些实施方案中,效应t细胞是胸腺细胞、未成熟t淋巴细胞、成熟t淋巴细胞、静息t淋巴细胞或活化t淋巴细胞。在一些实施方案中,免疫效应细胞是cd4
+
cd8
+
t细胞或cd4-cd8-t细胞。在一些实施方案中,免疫效应细胞是t辅助细胞。在一些实施方案中,t辅助细胞是t辅助1(th1)、t辅助2(th2)细胞或表达cd4的辅助t细胞(cd4+t细胞)。在一些实施方案中,免疫效应细胞是任何其他t细胞亚群。除了car之外,修饰的免疫效应细胞还可以表达外源性细胞因子、不同的嵌合受体或任何其他可以增强免疫效应细胞信号传导或功能的试剂。例如,嵌合抗原受体和细胞因子的共表达可以增强car-t细胞裂解靶细胞的能力。细胞因子的非限制性实例包括白细胞介素-1(il-1)、白细胞介素-2(il-2)、白细胞介素-4(il-4)、白细胞介素-6(il-6)、白细胞介素-7(il-7)、白细胞介素12(il-12)、白细胞介素15(il-15)、白细
胞介素21(il-21)、蛋白质记忆t细胞引诱剂“调节激活正常t细胞表达和分泌因子”(rantes)、粒细胞-巨噬细胞集落刺激因子(gm-csf)、肿瘤坏死因子-α(tnf-α)或干扰素-γ(ifn-γ)、巨噬细胞炎症蛋白1α(mip-1α)。在一些实施方案中,细胞因子是人类来源的(例如,hil-1、hil-2、hil-4、hil-6、hil-7、hil-12、hil-15、hil-21、hrantes、hgm-csf、htnf-α、htnf-α、hifnγ或hmip-1α)。
[0372]
本文公开的是人工构建的嵌合蛋白的alkcar,包括特异性结合alk的细胞外抗原结合域(例如,单链可变片段(scfv)),连接到跨膜域,连接到一个或多个细胞内t细胞信号传送域。所公开的alk car的特征包括,其以非mhc限制的方式将t细胞特异性和反应性重定向到alk表达细胞的能力。非mhc限制性alk识别使表达公开的car的t细胞能够独立于抗原加工识别抗原,从而绕过肿瘤逃逸的主要机制。抗原(例如,alk)与胞外结合域的结合可以激活car-t细胞并产生效应反应,包括car-t细胞增殖、细胞因子产生和其他导致抗原表达死亡的过程细胞。
[0373]
在一些实施方案中,alk car还包含接头。在一些实施方案中,alk car还包含信号肽。在一些实施方案中,alk car还包含报导基因(例如,绿色荧光蛋白(gfp))。在一些实施方案中,alk car还包含剪接供体和/或剪接受体序列(例如cmv和/或htlv剪接受体和供体序列)。在一些实施方案中,alk car还包含包装信号。
[0374]
本文提供了编码本文所述的alk car的核酸。在一些实施方案中,核酸是分离的或纯化的。可以使用本领域已知的方法完成核酸的离体递送。例如,从受试者(例如哺乳动物)获得的免疫效应细胞可以用编码car的核酸载体转化。然后所述载体可用于转化受体免疫效应细胞,以便这些细胞随后表达car。转化免疫效应细胞的有效方法包括转染和转导。这样的方法在本领域中是众所周知的。例如,用于递送编码嵌合抗原受体的核酸分子的适用方法可见于国际申请案第pct/us2009/040040号和美国专利案第8,450,112;9,132,153;和9,669,058号,其各自整体内容通过引用并入本文。
[0375]
alk car可以是任何长度,即可以包含任何数量的氨基酸(或编码氨基酸的核苷酸),条件是car保持其生物活性,例如特异性结合抗原(例如alk)的能力,检测哺乳动物中的病变细胞,或治疗或预防疾病(例如受试者(例如哺乳动物)中的alk阳性癌症(例如神经母细胞瘤)。在一些实施方案中,car长约50至约5000个氨基酸。在一些实施方案中,car的长度为约50、70、75、100、125、150、175、200、300、400、500、600、700、800、900、1000或更多个氨基酸。
[0376]
在一些实施方案中,car构建体源自或包含如davila等人,cd19car-targeted t cells induce long-term remission and b cell aplasia in an immunocompetent mouse model of b cell acute lymphoblastic leukemia,plos one(2013)提供的m1928z car构建体,其整体内容通过引用并入本文。
[0377]
胞外结合域
[0378]
本文考虑的alk car包括胞外结合域。本文考虑的alk car的胞外结合域包含对特定抗原(例如,alk)具有亲和力的抗体或其抗原结合片段的氨基酸序列。在一些实施方案中,alk car包含alk抗体的氨基酸序列。在一些实施方案中,alk car包含alk抗体的抗原结合片段的氨基酸序列。胞外结合域的alk抗体(或其片段)部分识别并结合抗原(例如,alk)的表位。在一些实施方案中,alk car受体的抗体片段部分是单链可变片段(scfv)。scfv包
含单克隆抗体的轻和重可变结构域。在其他实施方案中,alk car的抗体片段部分是多链可变片段,其可以包含多于一个胞外结合域并因此同时结合多于一种抗原。在多链可变片段实施方案中,铰链区可以分隔不同的可变片段,提供必要的空间排列和灵活性。
[0379]
在一些实施方案中,由胞外结构域识别和结合的抗原是蛋白质或肽、核酸、脂质或多糖(例如,alk蛋白)。抗原可以是异源的,例如在病原细菌或病毒中表达的那些。抗原也可以是合成的;例如,有些人类对合成乳胶极度过敏,接触这种抗原会导致极度的免疫应答。在一些实施方案中,抗原是自体的,并且在患病或改变的细胞上表达。例如,在一些实施方案中,抗原(例如,alk蛋白)在肿瘤细胞(例如,alk-阳性癌症(例如,神经母细胞瘤))中表达。在一些实施方案中,肿瘤细胞是alk-阳性癌症。在一些实施方案中,alk-阳性癌症是非小细胞肺癌(nsclc)、间变性大细胞淋巴瘤(alcl)、神经母细胞瘤、b细胞淋巴瘤、甲状腺癌、结肠癌、乳腺癌、炎性成肌纤维细胞瘤(imt)、肾癌、食管癌和黑色素瘤。在一些实施方案中,alk-阳性癌症是神经母细胞瘤。
[0380]
抗体-抗原相互作用是由氢键、静电或疏水相互作用或范德华力(van der waals force)引起的非共价相互作用。嵌合抗原受体的胞外结合域对抗原的亲和力可用下式计算:
[0381]
ka=[抗体-抗原]/[抗体][抗原],其中
[0382]
[ab]=抗体上未经占据的结合位点的摩尔浓度;
[0383]
[ag]=抗原上未经占据的结合位点的摩尔浓度;和
[0384]
[ab-ag]=抗体-抗原复合物的摩尔浓度。
[0385]
抗体-抗原相互作用还可基于抗原与抗体的解离来表征。解离常数(kd)是结合率与解离率的比值,与亲和常数成反比。因此,kd=1/ka。本领域技术人员将熟悉这些概念并且将知道传统方法,例如elisa测定,可用于计算这些常数。
[0386]
在一些实施方案中,alk car的抗体部分包含至少一条重链(h)。在一些实施方案中,alk car的抗体部分包含至少一条轻链(l)。在一些实施方案中,alk car的抗体部分包含至少一条重链(h)和至少一条轻链(l)。在一些实施方案中,alk car的抗体部分包含通过二硫键连接的两条重链和两条轻链,其中轻链各自通过二硫键连接至重链之一。在一些实施方案中,轻链包含恒定区(lc)和可变区(vl)。在一些实施方案中,重链包含恒定区(hc)和可变区(vh)。位于抗体可变区的互补决定区(cdr)负责抗体对特定抗原的亲和力。因此,识别不同抗原的抗体包含不同的cdr。cdr位于胞外结合域的可变结构域中,可变结构域(即vh和vl)可以与接头连接,或者在一些实施方案中,与二硫键连接。
[0387]
在一些实施方案中,alk car的胞外结合域包括来自抗alk抗体的序列。在一些实施方案中,alk car包括来自选自alk#1、alk#2、alk#3、alk#4、alk#5、alk#6或alk#7的抗alk抗体的序列。在一些实施方案中,胞外结合域包括来自抗alk抗体的vh和/或vl序列。在一些实施方案中,胞外结合域包括来自抗alk抗体的vh和/或vl cdr序列。在一些实施方案中,胞外结合域可以包括选自alk#1、alk#2、alk#3、alk#4、alk#5、alk#6或alk#7(例如,分别如表1和表2中所示)的抗体的vl和/或vh。在一些实施方案中,胞外结合域可以包括分别选自alk#1、alk#2、alk#3、alk#4、alk#5、alk#6或alk#7(例如,分别如表4和表3中所示)的抗体的vh和/或vl的hcdr1、hcdr2和hcdr3和/或lcdr1、lcdr2和lcdr3。
[0388]
在一些实施方案中,alk car包含至少一个接头。至少一个接头将可变重链(vh)区
缀合或连接到car的胞外结合域的恒定重链(ch)区。接头还可以将可变轻(vl)区连接到胞外结合域的可变恒定(vc)区。在一些实施方案中,接头是柔性蛋白质接头。在一些实施方案中,接头是(gly4ser)n接头。在一些实施方案中,接头是(gly4ser1)3。
[0389]
在一些实施方案中,alk car包括信号肽序列,例如,抗原结合域的n端,其引导新合成的分泌或膜蛋白到达和穿过膜(例如,内质网膜)。信号肽序列通常包含三个常见的结构特征:n端极性碱性区域(n区域)、疏水核心和亲水c区域)。信号肽序列可以包含任何合适的信号肽序列。虽然信号肽序列可以促进car在细胞表面上的表达,但在表达的car中存在信号肽序列并不是car发挥作用所必需的。当car在细胞表面表达时,信号肽序列可能会从car上切下。因此,在一些实施方案中,car缺乏信号肽序列。在一些实施方案中,信号肽序列的长度约为16-30个氨基酸。在一个实施方案中,信号肽序列是mcd8。在一个实施方案中,前导肽是cd8α。在一个实施方案中,信号肽序列是人类粒细胞-巨噬细胞集落刺激因子(gm-csf)受体序列。
[0390]
跨膜域
[0391]
本文考虑的alk car包括跨膜域。本文所述的alk car的跨膜域跨越car-t细胞脂质双层细胞膜并将胞外结合域和细胞内信号传送域分开。跨膜域可以来自天然来源或合成来源。在一些实施方案中,当来源是天然的时,结构域可以源自任何膜结合或跨膜蛋白。在一些实施方案中,跨膜域可以源自非人类跨膜域,并且在一些实施方案中,是人源化的(即,具有优化的编码跨膜域的核酸序列,使得其更可靠或有效地在人类主体)。在一些实施方案中,跨膜域源自在人类免疫效应细胞中表达的另一种跨膜蛋白。此类蛋白质的实例包括但不限于在免疫效应细胞中表达并具有跨膜域。用于所公开的alk car的跨膜域可以至少包括t细胞受体的α、β或ζ链、cd28、cd3ε、cd45、cd4、cd5、cd8、cd9、cd16、cd22、cd33、cd37、cd64、cd80、cd86、cd134、cd137、cd154。在一些实施方案中,跨膜域将是合成的,并且此类序列将包含许多疏水残基。
[0392]
在一些实施方案中,alk car跨膜域与胞外结构域融合。在一些实施方案中,alk car在跨膜域和胞外结合域、细胞内结构域或两者之间包含间隔物。此类间隔物的长度可以是1、2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19或20个氨基酸。在一些实施方案中,间隔物的长度可以是20、30、40、50、60、70、80、90或100个氨基酸。在其他实施方案中,间隔物的长度可以在100到500个氨基酸之间。间隔物可以是将一个结构域连接到另一个结构域并用于定位这种连接结构域以增强或优化car功能的任何多肽。在一些实施方案中,间隔结构域可以包括免疫球蛋白结构域,例如人类免疫球蛋白序列。在一个实施方案中,免疫球蛋白结构域包含免疫球蛋白ch2和ch3免疫球蛋白g(igg1)结构域序列(ch2ch3)。ch2ch3结构域将car的抗原结合域从表达car的细胞膜上延伸出去,可以更准确地模拟天然tcr的大小和结构域结构。
[0393]
在一些实施方案中,肽接头,优选长度为2至10个氨基酸,可形成alk car的跨膜域与胞内t细胞信号传送域和/或t细胞共刺激结构域之间的连接。在一个实施方案中,接头序列包括一个或多个甘氨酸-丝氨酸双联体。在一些实施方案中,接头是柔性蛋白质接头。在一些实施方案中,接头是(gly4ser)n接头。在一些实施方案中,接头是(gly4ser1)3。
[0394]
在一些实施方案中,跨膜域包括t细胞受体的跨膜域,例如cd8跨膜域。在另一个实施方案中,跨膜域包括t细胞共刺激分子的跨膜域,例如cd137(4-1bb)或cd28。
[0395]
在一些实施方案中,cd28跨膜域与如下提供的示例性氨基酸序列具有至少85%、至少90%、至少95%、至少98%、至少99%或100%的同一性:
[0396]
ievmypppyldneksngtiihvkgkhlcpsplfpgpskpfwvlvvvggvlacysllvtvafiifwvr
[0397]
在一些实施方案中,cd8跨膜域与m1928z car构建体的cd8跨膜域具有至少85%、至少90%、至少95%、至少98%、至少99%或100%的同一性(参见davila等人,plosone 2013)。
[0398]
在一些实施方案中,cd8跨膜域与如下提供的示例性氨基酸序列具有至少85%、至少90%、至少95%、至少98%、至少99%或100%的同一性:
[0399]
tttpaprpptpaptiasqplslrpeacrpaaggavhtrgldfacdiyiwaplagtcgvlllslvitlyc
[0400]
细胞内信号传送域
[0401]
本文所考虑的alk car包含一个或多个t细胞信号传送域,其能够转导t细胞效应器功能信号(例如,激活信号)并指导t细胞执行特定功能。许多因素可以诱导t细胞活化,包括同源抗原与t细胞表面上的t细胞受体的结合以及同源配体与t细胞表面上的共刺激分子的结合。t细胞共刺激分子是t细胞上的同源结合配偶体,其与共刺激配体特异性结合,从而介导t细胞的共刺激反应,例如但不限于增殖。共刺激分子包括但不限于mhci类分子。t细胞的激活导致免疫应答,例如t细胞增殖和分化(参见,例如,smith-garvin等人,annu.rev.immunol.,27:591-619,2009)。示例性的t细胞信号传送域是本领域已知的。非限制性实例包括cd3ζ、cd8、cd28、cd27、cd154、gitr(tnfrsf18)、cd134(ox40)和cd137(4-1bb)信号传送域。
[0402]
在一些实施方案中,本文考虑的alk car的细胞内信号传送域包含初级信号传送域。在一些实施方案中,嵌合抗原受体包含初级信号传送域和次级或共刺激信号传送域。在一些实施方案中,初级信号传送域包含一个或多个基于免疫受体酪氨酸的激活基序或itam。在一些实施方案中,初级信号传送域包含多于一个itam。并入嵌合抗原受体中的itam可能来源于来自其他细胞受体的itam。在一些实施方案中,包含itam的初级信号传送域可以源自tcr复合物的亚基,例如cd3γ、cd3ε、cd3ζ或cd3δ。在一些实施方案中,包含itam的初级信号传送域可以源自fcrγ、fcrβ、cd5、cd22、cd79a、cd79b或cd66d。在一些实施方案中,次级信号传送域源自cd28。在其他实施方案中,二级信号传送域源自cd2、cd4、cds、cd8α、cd83、cd134、cd137、icos或cd154。
[0403]
在一些实施方案中,alk car可以包括cdζ信号传送域、cd8信号传送域、cd28信号传送域、cd137信号传送域或其两种或更多种的组合。在一个实施方案中,细胞质结构域包括cd3ζ的信号传送域和cd28的信号传送域。在另一个实施方案中,细胞质结构域包括cd3ζ的信号传送域和cd137(4-1bb)的信号传送域。在又一个实施方案中,细胞质结构域包括cd3-zeta的信号传送域和cd28和cd137的信号传送域。本领域普通技术人员可以根据需要改变car上一个或多个t细胞信号传送域的顺序。
[0404]
在一些实施方案中,整个细胞内t细胞信号传送域可用于alk car。在一些实施方案中,细胞内t细胞信号传送域的截短部分仍能转导t细胞效应器功能,用于alk car。在一些实施方案中,t细胞受体(tcr)的细胞质序列和协同作用以在抗原受体接合后启动信号转导的共刺激分子用于alk car。
[0405]
在一些实施方案中,cd3ζ信号传送域与m1928z car构建体的cd3ζ信号传送域具有
至少85%、至少90%、至少95%、至少98%、至少99%或100%同一性(参见davila等人,plosone 2013)。
[0406]
在一些实施方案中,cd3ζ信号传送域与如下提供的示例性氨基酸序列具有至少85%、至少90%、至少95%、至少98%、至少99%或100%的同一性:
[0407]
rvkfsrsadapayqqgqnqlynelnlgrreeydvldkrrgrdpemggkprrknpqeglynelqkdkmaeayseigmkgerrrgkghdglyqglstatkdtydalhmqalppr
[0408]
在一些实施方案中,cd8信号传送域与m1928z car构建体的cd8信号传送域具有至少85%、至少90%、至少95%、至少98%、至少99%或100%的同一性(参见davila等人,plosone 2013)。
[0409]
在一些实施方案中,cd8信号传送域与如下提供的示例性氨基酸序列具有至少85%、至少90%、至少95%、至少98%、至少99%或100%的同一性:
[0410]
fvpvflparptttpaprpptpaptiasqplslrpeacrpaaggavhtrgldfacdiyiwaplagtcgvlllslvitlycnhrnr
[0411]
在一些实施方案中,cd28信号传送域与m1928z car构建体的cd28信号传送域具有至少85%、至少90%、至少95%、至少98%、至少99%或100%的同一性(参见davila等人,plosone 2013)。
[0412]
在一些实施方案中,cd28信号传送域与如下提供的示例性氨基酸序列具有至少85%、至少90%、至少95%、至少98%、至少99%或100%的同一性:
[0413]
skrsrllhsdymnmtprrpgptrkhyqpyapprdfaayrs
[0414]
在一些实施方案中,cd137(4-1bb)信号传送域与如下提供的示例性氨基酸序列具有至少85%、至少90%、至少95%、至少98%、至少99%或100%的同一性:
[0415]
krgrkkllyifkqpfmrpvqttqeedgcscrfpeeeeggcel
[0416]
在一些实施方案中,cd137(4-1bb)信号传送域与如下提供的示例性氨基酸序列具有至少85%、至少90%、至少95%、至少98%、至少99%或100%的同一性:
[0417]
rfsvvkrgrkkllyifkqpfmrpvqttqeedgcscrfpeeeeggcel
[0418]
在一些实施方案中,cd134(ox40)信号传送域与如下提供的示例性氨基酸序列具有至少85%、至少90%、至少95%、至少98%、至少99%或100%的同一性:
[0419]
rrdqrlppdahkppgggsfrtpiqeeqadahstlaki
[0420]
间变性淋巴瘤激酶(alk)抗体
[0421]
本发明提供了一种间变性淋巴瘤激酶嵌合抗原受体(alk car),其包含与alk多肽或其抗体结合片段特异性结合的alk抗体序列。全长alk多肽包括胞外结构域、对应于单程跨膜区的疏水性段和胞内激酶结构域。
[0422]
在一些实施方案中,alk多肽与全长alk蛋白具有至少85%、至少90%、至少95%、至少98%、至少99%或100%的同一性。在一些实施方案中,alk多肽与智人中的全长alk蛋白具有至少85%、至少90%、至少95%、至少98%、至少99%或100%同一性。在一些实施方案中,alk多肽与全长鼠alk蛋白具有至少85%、至少90%、至少95%、至少98%、至少99%或100%的同一性。在一些实施方案中,alk多肽包含alk胞外结构域。在一些实施方案中,alk多肽与智人中的alk胞外结构域具有至少85%、至少90%、至少95%、至少98%、至少99%或100%的同一性。在一些实施方案中,alk多肽与鼠alk胞外结构域具有至少85%、至少90%、
至少95%、至少98%、至少99%或100%的同一性。在一些实施方案中,alk多肽包含alk胞内结构域。在一些实施方案中,alk多肽与智人中的alk胞内结构域具有至少85%、至少90%、至少95%、至少98%、至少99%或100%的同一性。在一些实施方案中,alk多肽与鼠alk胞内结构域至少85%、至少90%、至少95%、至少98%、至少99%或100%相同。
[0423]
在一些实施方案中,alk多肽包含与genbank
tm
登录号:bad92714.1、acy79563、np_004295、aci47591或edl38401.1相关的alk氨基酸序列具有至少85%、至少90%、至少95%、至少98%、至少99%或100%的同一性的氨基酸序列。人类和鼠alk蛋白序列是公开的。本领域普通技术人员之一可鉴定附加的alk蛋白序列,包括alk变体。
[0424]
以下提供来自智人的示例性alk全长氨基酸序列(alk细胞质部分以粗体显示):
[0425][0426][0427]
以下提供来自智人的示例性全长alk氨基酸序列:
[0428]
[0429]
[0430]
[0431][0432]
以下提供来自genbank
tm
登录号np_004295的示例性智人alk氨基酸序列:
[0433]
[0434][0435]
以下提供来自智人的示例性alk多肽序列(胞外结构域(氨基酸19-1038)以粗体提供):
[0436]
[0437][0438]
以下提供来自小家鼠(mus musculus)的示例性alk全长氨基酸序列:
[0439][0440]
在一些实施方案中,alk抗原是分离的和/或纯化的。在一些实施方案中,抗原(例如alk蛋白)的氨基酸序列被反向翻译和优化以在哺乳动物细胞中表达。如本领域技术人员将理解的,核酸序列的优化包括用于在哺乳动物细胞中表达序列的密码子的优化和rna优化(例如rna稳定性)。
[0441]
在一些实施方案中,alk多肽或其抗体结合片段(例如,抗原或抗原蛋白)由多核苷酸编码。
[0442]
在一些实施方案中,alk多核苷酸与编码全长alk蛋白的多核苷酸具有至少85%、至少90%、至少95%、至少98%、至少99%或100%的同一性。在一些实施方案中,alk多核苷酸与智人中编码全长alk蛋白的多核苷酸具有至少85%、至少90%、至少95%、至少98%、至少99%或100%的同一性。在一些实施方案中,alk多核苷酸与编码全长鼠alk蛋白的多核苷酸具有至少85%、至少90%、至少95%、至少98%、至少99%或100%的同一性。在一些实施方案中,alk多核苷酸编码alk胞外结构域。在一些实施方案中,alk多核苷酸与在智人中编码alk胞外结构域的多肽具有至少85%、至少90%、至少95%、至少98%、至少99%或100%的同一性。在一些实施方案中,alk多核苷酸与编码鼠alk胞外结构域的多肽具有至少85%、至少90%、至少95%、至少98%、至少99%或100%的同一性。在一些实施方案中,alk多核苷酸编码alk胞内结构域。在一些实施方案中,alk多核苷酸与在智人中编码alk胞内结构域的多核苷酸具有至少85%、至少90%、至少95%、至少98%、至少99%或100%的同一性。在一些实施方案中,alk多核苷酸与编码鼠alk胞内结构域的多核苷酸具有至少85%、至少90%、至少95%、至少98%、至少99%或100%的同一性。在一些实施方案中,alk多核苷酸与编码与genbank
tm
登录号:bad92714.1、acy79563、np_004295、nm_007439.2或aci47591相关的alk
氨基酸序列的多核苷酸具有至少85%、至少90%、至少95%、至少98%、至少99%或100%同一性。人类和鼠alk多核苷酸序列是公开的。本领域普通技术人员可以鉴定额外的alk多核苷酸序列,包括alk变体。
[0443]
以下提供来自genbank
tm
登录号nm_004304的示例性智人alk氨基酸序列:
[0444]
[0445]
[0446]
[0447][0448]
以下提供来自智人的示例性全长alk核酸序列:
[0449]
[0450]
[0451]
[0452][0453]
以下提供来自genbank
tm
登录号nm_007439.2的示例性小家鼠alk核酸序列:
[0454]
[0455]
[0456][0457]
[0458]
在一些实施方案中,本文描述了包含alk抗原多肽的融合蛋白。在一些实施方案中,alk多肽可以与任何异源氨基酸序列融合以形成融合蛋白。例如,融合蛋白包括与异源蛋白融合的alk蛋白。在一些实施方案中,融合蛋白是与核仁磷蛋白(npm)蛋白融合的alk蛋白。在一些实施方案中,npm-alk融合蛋白与智人中的npm-alk融合蛋白具有至少85%、至少90%、至少95%、至少98%、至少99%或100%同一性。在一些实施方案中,npm-alk融合蛋白与如以下所提供的源自智人的示例性npm-alk融合蛋白氨基酸序列具有至少85%、至少90%、至少95%、至少98%、至少99%或100%的同一性(alk细胞质部分以粗体显示):
[0459][0460]
在一些实施方案中,npm-alk融合蛋白与如以下所提供的源自智人(genbank:aaa58698.1)的示例性npm-alk融合蛋白氨基酸序列具有至少85%、至少90%、至少95%、至少98%、至少99%或100%的同一性:
[0461][0462]
在一些实施方案中,npm-alk融合蛋白与如以下所提供的源自智人的示例性npm-alk融合蛋白氨基酸序列具有至少85%、至少90%、至少95%、至少98%、至少99%或100%的同一性:
[0463][0464][0465]
在一些实施方案中,npm-alk融合蛋白是由与如以下所提供的源自智人的示例性核酸序列具有至少85%、至少90%、至少95%、至少98%、至少99%或100%同一性的核酸序列所编码:
[0466][0467][0468]
在一些实施方案中,融合蛋白是融合至棘皮动物微管相关蛋白样4(eml4)蛋白的alk蛋白。在一些实施方案中,elm4-alk融合蛋白与智人中的elm4-alk融合蛋白或其变体具有至少85%、至少90%、至少95%、至少98%、至少99%或100%的同一性。在一些实施方案中,elm4-alk融合蛋白与如以下所提供的源自智人(genbank:bam37627.1)的示例性elm4-alk融合蛋白氨基酸序列具有至少85%、至少90%、至少95%、至少98%、至少99%或100%的同一性:
[0469][0470][0471]
在一些实施方案中,elm4-alk融合蛋白是由与如以下所提供的来自智人(genbank:ab274722.1)的示例性核酸序列具有至少85%、至少90%、至少95%、至少98%、至少99%或100%的同一性的核酸序列所编码:
[0472]
[0473]
[0474][0475]
在一些实施方案中,elm4-alk融合蛋白与如以下所提供的来自智人(genbank:baf73611.1)的示例性elm4-alk变体1融合蛋白氨基酸序列具有至少85%、至少90%、至少95%、至少98%、至少99%或100%的同一性:
[0476][0477]
在一些实施方案中,本发明的alk car包括来自特异性结合哺乳动物alk蛋白或抗原的抗alk抗体的序列。在一些实施方案中,alk car包括来自结合鼠alk蛋白或其抗体结合部分的抗alk抗体的序列。在一些实施方案中,alk car包括来自结合人类alk蛋白或其抗体结合部分的抗alk抗体的序列。在一些实施方案中,alkcar包括来自与alk受体的胞外结构域的一部分结合的抗alk抗体的序列。在一些实施方案中,alk car包括来自结合鼠alk受体的胞外结构域的一部分的抗alk抗体的序列。在一些实施方案中,alk car包括来自与人类alk受体的胞外结构域的一部分结合的抗alk抗体的序列。在一些实施方案中,alk car包括来自作为鼠抗体的抗alk抗体的序列。在一些实施方案中,alk car包括来自作为人类抗体的抗alk抗体的序列。在一些实施方案中,alk car包括来自作为人源化抗体的抗alk抗体的
序列。在一些实施方案中,alk car包括来自作为嵌合抗体的抗alk抗体的序列。
[0478]
在一些实施方案中,alk car包括来自抗alk抗体的序列,其调节alk活性(例如,alk信号传导)和/或alk表达的抗alk抗体的序列。在一些实施方案中,alk car包括来自抑制alk信号传导和/或alk表达(例如,抑制alk磷酸化)的抗alk抗体的序列。在一些实施方案中,alk car包括来自激活alk信号传导和/或alk表达的抗alk抗体的序列(例如,alk磷酸化的激动剂)。
[0479]
在一些实施方案中,alk car包括来自抗alk抗体的序列,所述抗体选自alk抗体#1(alk#1)、alk抗体#2(alk#2)、alk抗体#3(alk#3)、alk抗体#4(alk#4)、alk抗体#5(alk#5)、alk抗体#6(alk#6)或alk抗体#7(alk#7)。在一些实施方案中,alk car包括来自alk#1的序列。在一些实施方案中,alk car包括来自alk#2的序列。在一些实施方案中,alk car包括来自alk#3的序列。在一些实施方案中,alk car包括来自alk#4的序列。在一些实施方案中,alk car包括来自alk#5的序列。在一些实施方案中,alk car包括来自alk#6的序列。在一些实施方案中,alk car包括来自alk#7的序列。
[0480]
在一些实施方案中,alk car包括来自抗alk抗体或其抗原结合片段的序列,其包含选自alk抗体#1(alk#1)、alk抗体#2(alk#2)、alk抗体#3(alk#3)、alk抗体#4(alk#4)、alk抗体#5(alk#5)、alk抗体#6(alk#6)或alk抗体#7(alk#7)(见表1)的vl区。在一些实施方案中,alk car包括来自alk#1的vl区的序列。在一些实施方案中,alk car包括来自alk#2的vl区的序列。在一些实施方案中,alk car包括来自alk#3的vl区的序列。在一些实施方案中,alk car包括来自alk#4的vl区的序列。在一些实施方案中,alk car包括来自alk#5的vl区的序列。在一些实施方案中,alk car包括来自alk#6的vl区的序列。在一些实施方案中,alk car包括来自alk#7的vl区的序列。
[0481]
表1.可变轻链(vl)alk抗体序列
[0482]
[0483]
[0484][0485]
在一些实施方案中,alk car包括与如以下所提供的示例性抗alk抗体vl氨基酸序列至少85%、至少90%、至少95%、至少98%、至少99%或100%相同的序列:
[0486]
diqmtqspaslaasvgetvtitcraseniyyslawyqqkqgkspqlliynansledgvpsrfsgsgsgtqysmkinsmqpedtatyfckqaydvpftfgsgtkleikr
[0487]
在一些实施方案中,alk car包括与如以下所提供的示例性抗alk抗体vl氨基酸序列至少85%、至少90%、至少95%、至少98%、至少99%或100%相同的序列:
[0488]
aiqmtqttsslsaslgdrvtiscsvsqgisnslnwyqqkpdgtvklliyytsslhsgvpsrfsgsgsgtdysltisnlepediatyycqqysklpltfgagtklelkr
[0489]
在一些实施方案中,alk car包括与如以下所提供的示例性抗alk抗体vl氨基酸序列至少85%、至少90%、至少95%、至少98%、至少99%或100%相同的序列:
[0490]
divmtqsqrfmstsvgdrvsvtckasqnvgtnvawyqqkpgqspkaliysasyrysgvpdrftgsgsgt
dftltvsnvqsedlaeyfcqqynsypymytfgggtkleikr
[0491]
在一些实施方案中,alk car包括与如以下所提供的示例性抗alk抗体vl氨基酸序列至少85%、至少90%、至少95%、至少98%、至少99%或100%相同的序列:
[0492]
divltqspaslavslgqratiscrasesvdnygisfmnwfqqkpgqppklliyaasnqgsgvparfsgsgsgtdfslnihpmeeddtamyfcqqskevpwtfgggtkleikr
[0493]
在一些实施方案中,alk car包括与如以下所提供的示例性抗alk抗体vl氨基酸序列至少85%、至少90%、至少95%、至少98%、至少99%或100%相同的序列:
[0494]
divmtqsqrfmstsvgdrvsvtckasqnvgtnvawyqqkpgqspkaliysasyrysgvpdrftgsgsgtdftltisnvqsedlaeyfcqqynsypymytfgggtkleikr
[0495]
在一些实施方案中,alk car包括与如以下所提供的示例性抗alk抗体vl氨基酸序列至少85%、至少90%、至少95%、至少98%、至少99%或100%相同的序列:
[0496]
divmtqsqkfmstsvgdrvsitckasqnvgtavawyqlkpgqspklliysasnrftgvpdrftgsgsgtdftltisnmqsedladyfcqqyssypltfgsgtkleikr
[0497]
在一些实施方案中,alk car包括与如以下所提供的示例性抗alk抗体vl氨基酸序列至少85%、至少90%、至少95%、至少98%、至少99%或100%相同的序列:
[0498]
divmtqsqkfmstsvgdrvsvtckasqnvgtnvawyqqkpghspkaliysasyrysgvpdrftgsgsgtdftltisnvqsedlaeyfcqrynsypymftfgggtkleikr
[0499]
在一些实施方案中,alk car包括与如下提供的示例性核酸序列至少85%、至少90%、至少95%、至少98%、至少99%或100%相同的由多核苷酸编码的抗alk抗体vl区:
[0500][0501]
在一些实施方案中,alk car包括与如下提供的示例性核酸序列至少85%、至少90%、至少95%、至少98%、至少99%或100%相同的由多核苷酸编码的抗alk抗体vl区:
[0502][0503]
在一些实施方案中,alk car包括与如下提供的示例性核酸序列至少85%、至少90%、至少95%、至少98%、至少99%或100%相同的由多核苷酸编码的抗alk抗体vl区:
[0504]
[0505]
在一些实施方案中,alk car包括与如下提供的示例性核酸序列至少85%、至少90%、至少95%、至少98%、至少99%或100%相同的由多核苷酸编码的抗alk抗体vl区:
[0506][0507][0508]
在一些实施方案中,alk car包括与如下提供的示例性核酸序列至少85%、至少90%、至少95%、至少98%、至少99%或100%相同的由多核苷酸编码的抗alk抗体vl区:
[0509][0510]
在一些实施方案中,alk car包括与如下提供的示例性核酸序列至少85%、至少90%、至少95%、至少98%、至少99%或100%相同的由多核苷酸编码的抗alk抗体vl区:
[0511][0512]
在一些实施方案中,alk car包括与如下提供的示例性核酸序列至少85%、至少90%、至少95%、至少98%、至少99%或100%相同的由多核苷酸编码的抗alk抗体vl区:
[0513][0514]
在一些实施方案中,alk car包括抗alk抗体或其抗原结合片段,其包含选自alk抗体#1(alk#1)、alk抗体#2(alk#2)、alk抗体#3(alk#3)、alk抗体#4(alk#4)、alk抗体#5(alk#5)、alk抗体#6(alk#6)或alkk抗体#7(alk#7)(参见表2)的vh区。在一些实施方案中,alk car包括选自alk#1的vh区。在一些实施方案中,alk car包括选自alk#2的vh区。在一些实施例中,alk car包括选自alk#3的vh区。在一些实施方案中,alk car包括选自alk#4的vh区。在一些实施例中,alk car包括选自alk#5的vh区。在一些实施方案中,alk car包括选自alk#6的vh区。在一些实施例中,alk car包括选自alk#7的vh区。
[0515]
表2.可变重链(vh)alk抗体序列
[0516]
[0517]
[0518][0519]
在一些实施方案中,alk car包括与如以下所提供的示例性抗alk抗体vh氨基酸序列具有至少85%、至少90%、至少95%、至少98%、至少99%或100%同一性的序列:
[0520]
qvqlqqsgaelvkpgasvkisckasgyafssywmnwvkqrpgkglewigqiypgdgdtnyngkfkgkatltadkssstaymqlssltsedsavyfcasyyygskaywgqgtlvtvsa
[0521]
在一些实施方案中,alk car包括与如以下所提供的示例性抗alk抗体vh氨基酸序列具有至少85%、至少90%、至少95%、至少98%、至少99%或100%同一性的序列:
[0522]
qvqlqqpgaefvkpgasvklsckasgytftsywmhwvkqrpgrglewigridpnsggtkynekfkskat
ltvdkpsstaymqlssltsedsavyycardyygssyrfaywgqgtlvtvsa
[0523]
在一些实施方案中,alk car包括与如以下所提供的示例性抗alk抗体vh氨基酸序列具有至少85%、至少90%、至少95%、至少98%、至少99%或100%同一性的序列:
[0524]
qvqlqqsgaelakpgasvklsckasgytftnywmhwvkqrpgqglewigyinpssgytkynqkfkdkatltadkssstaymqlssltyedsavyycardyygssswfaywgqgtlvtvsa
[0525]
在一些实施方案中,alk car包括与如以下所提供的示例性抗alk抗体vh氨基酸序列具有至少85%、至少90%、至少95%、至少98%、至少99%或100%同一性的序列:
[0526]
qvqlqqsgaelvkpgasvkisckasgyafssywvnwvkqrpgkglewigqiypgdgdtnyngkfkgkatltadkssstaymqlssltsedsavyfcarsrgyfygstydswgqgttltvss
[0527]
在一些实施方案中,alk car包括与如以下所提供的示例性抗alk抗体vh氨基酸序列具有至少85%、至少90%、至少95%、至少98%、至少99%或100%同一性的序列:
[0528]
qvqlqqsgaelakpgasvklsckasgytftsywmhwvkqrpgqglewigyikpssgytkynqkfkdkatltadkssstaymqlssltyedsavyycardyygssswfaywgqgtlvtvsa
[0529]
在一些实施方案中,alk car包括与如以下所提供的示例性抗alk抗体vh氨基酸序列具有至少85%、至少90%、至少95%、至少98%、至少99%或100%同一性的序列:
[0530]
dvklvesgeglvkpggslklscaasgftfssyamswvrqtpekrlewvtyissggdyiyyadtvkgrftisrdnarntlylqmsslksedtamyyctreriwlrrffdvwgtgttvtvss
[0531]
在一些实施方案中,alk car包括与如以下所提供的示例性抗alk抗体vh氨基酸序列具有至少85%、至少90%、至少95%、至少98%、至少99%或100%同一性的序列:
[0532]
qvqlqqsgaelakpgasvklsckasgytftsywmhwvkqrpgqglewigyinpssgytkynqkfkdkatltadkssstaymqlssltfedsavyycardyygssswfaywgqgtlvtvsa
[0533]
在一些实施方案中,alk car包括与如下提供的示例性核酸序列至少85%、至少90%、至少95%、至少98%、至少99%或100%同一性的由多核苷酸编码的抗alk抗体vh区:
[0534][0535]
在一些实施方案中,alk car包括与如下提供的示例性核酸序列至少85%、至少90%、至少95%、至少98%、至少99%或100%同一性的由多核苷酸编码的抗alk抗体vh区:
[0536][0537]
在一些实施方案中,alk car包括与如下提供的示例性核酸序列至少85%、至少90%、至少95%、至少98%、至少99%或100%同一性的由多核苷酸编码的抗alk抗体vh区:
car包括本文提供的抗alk抗体或其抗原结合片段,其包含抗体alk#1、alk#2、alk#3、alk#4、alk#5、alk#6或alk#7中任一者的vl区和vh区。
[0549]
cdr主要负责与抗原的表位结合。使用本领域已知的任何方法,包括kabat等人(“sequences of proteins of immunological interest,5th ed.public health service,national institutes of health,bethesda,md.,1991;“kabat'numbering scheme),al-lazikani等人,(jmb 273,927-948,1997:“chothia’numbering scheme),和lefranc等人(“imgt unique numbering for immunoglobulin and t cell receptor variable domains and ig superfamily v-like domains.”dev.comp.immunol.,27:55-77,2003:“imgt'numbering scheme)描述的那些方法,可以容易地确定给定cdr的氨基酸序列位置。cdr的每条链通常称为cdr1、cdr2和cdr3(从n端到c端),且通常由特定cdr所在的链标识。因此,在本文中,vh-cdr3是来自其中发现它的抗体重链可变域的cdr3,并且vl-cdr1是来自其中发现它的抗体轻链可变域的cdr1。轻链cdr在本文中称为lcdr1、lcdr2和lcdr3。重链cdr在本文中称为hcdr1、hcdr2和hcdr3。
[0550]
在一些实施方案中,alk car包括特异性结合alk的抗alk抗体的cdr(例如,人类alk)的抗alk抗体的cdr。在一些实施方案中,alk car包括特异性结合alk的ecd(例如,人类alk ecd)的抗alk抗体的cdr。在一些实施方案中,alk car包括选自alk抗体#1(alk#1)、alk抗体#2(alk#2)、alk抗体#3(alk#3)、alk抗体#4(alk#4)、alk抗体#5(alk#5)、alk抗体#6(alk#6)或alk抗体#7(alk#7)(参见表3)的vl区的一个或多个cdr。在一些实施方案中,alk car包括选自alk#1的vl区的一个或多个cdr。在一些实施方案中,alk car包括选自alk#2的vl区的一个或多个cdr。在一些实施方案中,alk car包括选自alk#3的vl区的一个或多个cdr。在一些实施方案中,alk car包括选自alk#4的vl区的一个或多个cdr。在一些实施方案中,alk car包括选自alk#5的vl区的一个或多个cdr。在一些实施方案中,alk car包括选自alk#6的vl区的一个或多个cdr。在一些实施方案中,alk car包括选自alk#7的vl区的一个或多个cdr。
[0551]
表3.可变轻链(vl)互补决定区(cdr)alk抗体序列(kabat)
[0552][0553]
在一些实施方案中,alk car包括与如以下所提供的示例性氨基酸序列具有至少85%、至少90%、至少95%、至少98%、至少99%或100%的同一性的抗alk抗体lcdr1:
[0554]
raseniyysla
[0555]
在一些实施方案中,alk car包括与如以下所提供的示例性氨基酸序列具有至少85%、至少90%、至少95%、至少98%、至少99%或100%的同一性的抗alk抗体lcdr2:
[0556]
nansled
[0557]
在一些实施方案中,alk car包括与如以下所提供的示例性氨基酸序列具有至少85%、至少90%、至少95%、至少98%、至少99%或100%的同一性的抗alk抗体lcdr3:
[0558]
kqaydvpft
[0559]
在一些实施方案中,alk car包括与如以下所提供的示例性氨基酸序列具有至少85%、至少90%、至少95%、至少98%、至少99%或100%的同一性的抗alk抗体lcdr1:
[0560]
svsqgisnsln
[0561]
在一些实施方案中,alk car包括与如以下所提供的示例性氨基酸序列具有至少85%、至少90%、至少95%、至少98%、至少99%或100%的同一性的抗alk抗体lcdr2:
[0562]
ytsslhs
[0563]
在一些实施方案中,alk car包括与如以下所提供的示例性氨基酸序列具有至少85%、至少90%、至少95%、至少98%、至少99%或100%的同一性的抗alk抗体lcdr3:
[0564]
qqysklplt
[0565]
在一些实施方案中,alk car包括与如以下所提供的示例性氨基酸序列具有至少85%、至少90%、至少95%、至少98%、至少99%或100%的同一性的抗alk抗体lcdr1:
[0566]
kasqnvgtnva
[0567]
在一些实施方案中,alk car包括与如以下所提供的示例性氨基酸序列具有至少85%、至少90%、至少95%、至少98%、至少99%或100%的同一性的抗alk抗体lcdr2:
[0568]
sasyrys
[0569]
在一些实施方案中,alk car包括与如以下所提供的示例性氨基酸序列具有至少85%、至少90%、至少95%、至少98%、至少99%或100%的同一性的抗alk抗体lcdr3:
[0570]
qqynsypymyt
[0571]
在一些实施方案中,alk car包括与如以下所提供的示例性氨基酸序列具有至少85%、至少90%、至少95%、至少98%、至少99%或100%的同一性的抗alk抗体lcdr1:
[0572]
rasesvdnygisfmn
[0573]
在一些实施方案中,alk car包括与如以下所提供的示例性氨基酸序列具有至少85%、至少90%、至少95%、至少98%、至少99%或100%的同一性的抗alk抗体lcdr2:
[0574]
aasnqgs
[0575]
在一些实施方案中,alk car包括与如以下所提供的示例性氨基酸序列具有至少85%、至少90%、至少95%、至少98%、至少99%或100%的同一性的抗alk抗体lcdr3:
[0576]
qqskevpwt
[0577]
在一些实施方案中,alk car包括与如以下所提供的示例性氨基酸序列具有至少85%、至少90%、至少95%、至少98%、至少99%或100%的同一性的抗alk抗体lcdr1:
[0578]
kasqnvgtava
[0579]
在一些实施方案中,alk car包括与如以下所提供的示例性氨基酸序列具有至少85%、至少90%、至少95%、至少98%、至少99%或100%的同一性的抗alk抗体lcdr2:
[0580]
sasnrft
[0581]
在一些实施方案中,alk car包括与如以下所提供的示例性氨基酸序列具有至少85%、至少90%、至少95%、至少98%、至少99%或100%的同一性的抗alk抗体lcdr3:
[0582]
qqyssyplt
[0583]
在一些实施方案中,alk car包括与如以下所提供的示例性氨基酸序列具有至少85%、至少90%、至少95%、至少98%、至少99%或100%的同一性的抗alk抗体lcdr3:
[0584]
qrynsypymft
[0585]
在一些实施方案中,alk car包括选自alk抗体#1(alk#1)、alk抗体#2(alk#2)、alk抗体#3(alk#3)、alk抗体#4(alk#4)、alk抗体#5(alk#5)、alk抗体#6(alk#6)或alk抗体#7(alk#7)(参见表4)的vh区的一个或多个cdr。在一些实施方案中,alk car包括选自alk#1的vh区的一个或多个cdr。在一些实施方案中,alk car包括选自alk#2的vh区的一个或多个cdr。在一些实施方案中,alk car包括选自alk#3的vh区的一个或多个cdr。在一些实施方案中,alk car包括选自alk#4的vh区的一个或多个cdr。在一些实施方案中,alk car包括选自
alk#5的vh区的一个或多个cdr。在一些实施方案中,alk car包括选自alk#6的vh区的一个或多个cdr。在一些实施方案中,alk car包括选自alk#7的vh区的一个或多个cdr。
[0586]
表4.可变重链(vh)互补决定区(cdr)alk抗体序列(kabat)
[0587][0588]
在一些实施方案中,alk car包括与如以下所提供的示例性氨基酸序列具有至少85%、至少90%、至少95%、至少98%、至少99%或100%的同一性的抗alk抗体hcdr1:
[0589]
sywmn
[0590]
在一些实施方案中,alk car包括与如以下所提供的示例性氨基酸序列具有至少85%、至少90%、至少95%、至少98%、至少99%或100%的同一性的抗alk抗体hcdr2:
[0591]
qiypgdgdtnyngkfkg
[0592]
在一些实施方案中,alk car包括与如以下所提供的示例性氨基酸序列具有至少85%、至少90%、至少95%、至少98%、至少99%或100%的同一性的抗alk抗体hcdr3:
[0593]
yyygskay
[0594]
在一些实施方案中,alk car包括与如以下所提供的示例性氨基酸序列具有至少85%、至少90%、至少95%、至少98%、至少99%或100%的同一性的抗alk抗体hcdr1:
[0595]
sywmh
[0596]
在一些实施方案中,alk car包括与如以下所提供的示例性氨基酸序列具有至少85%、至少90%、至少95%、至少98%、至少99%或100%的同一性的抗alk抗体hcdr2:
[0597]
ridpnsggtkynekfks
[0598]
在一些实施方案中,alk car包括与如以下所提供的示例性氨基酸序列具有至少85%、至少90%、至少95%、至少98%、至少99%或100%的同一性的抗alk抗体hcdr3:
[0599]
dyygssyrfay
[0600]
在一些实施方案中,alk car包括与如以下所提供的示例性氨基酸序列具有至少85%、至少90%、至少95%、至少98%、至少99%或100%的同一性的抗alk抗体hcdr1:
[0601]
nywmh
[0602]
在一些实施方案中,alk car包括与如以下所提供的示例性氨基酸序列具有至少85%、至少90%、至少95%、至少98%、至少99%或100%的同一性的抗alk抗体hcdr2:
[0603]
yinpssgytkynqkfkd
[0604]
在一些实施方案中,alk car包括与如以下所提供的示例性氨基酸序列具有至少85%、至少90%、至少95%、至少98%、至少99%或100%的同一性的抗alk抗体hcdr3:
[0605]
dyygssswfay
[0606]
在一些实施方案中,alk car包括与如以下所提供的示例性氨基酸序列具有至少85%、至少90%、至少95%、至少98%、至少99%或100%的同一性的抗alk抗体hcdr1:
[0607]
sywvn
[0608]
在一些实施方案中,alk car包括与如以下所提供的示例性氨基酸序列具有至少85%、至少90%、至少95%、至少98%、至少99%或100%的同一性的抗alk抗体hcdr3:
[0609]
srgyfygstyds
[0610]
在一些实施方案中,alk car包括与如以下所提供的示例性氨基酸序列具有至少85%、至少90%、至少95%、至少98%、至少99%或100%的同一性的抗alk抗体hcdr1:
[0611]
sywmh
[0612]
在一些实施方案中,alk car包括与如以下所提供的示例性氨基酸序列具有至少85%、至少90%、至少95%、至少98%、至少99%或100%的同一性的抗alk抗体hcdr2:
[0613]
yikpssgytkynqkfkd
[0614]
在一些实施方案中,alk car包括与如以下所提供的示例性氨基酸序列具有至少85%、至少90%、至少95%、至少98%、至少99%或100%的同一性的抗alk抗体hcdr1:
[0615]
syams
[0616]
在一些实施方案中,alk car包括与如以下所提供的示例性氨基酸序列具有至少85%、至少90%、至少95%、至少98%、至少99%或100%的同一性的抗alk抗体hcdr2:
[0617]
yissggdyiyyadtvkg
[0618]
在一些实施方案中,alk car包括与如以下所提供的示例性氨基酸序列具有至少85%、至少90%、至少95%、至少98%、至少99%或100%的同一性的抗alk抗体hcdr3:
[0619]
eriwlrrffdv
[0620]
在一些实施方案中,alk car包括与如以下所提供的示例性氨基酸序列具有至少85%、至少90%、至少95%、至少98%、至少99%或100%的同一性的抗alk抗体hcdr1:
[0621]
sywmh
[0622]
在一些实施方案中,alk car包含来自vl区的一种或多种cdr和来自vh区的一种或多种cdr,其与抗体alk#1、alk#2、alk#3、alk#4、alk#5、alk#6或alk#7中任一种的vl和vh氨基酸序列至少85%、至少90%、至少95%、至少98%、至少99%或100%相同。在一些实施方案中,alkcar包含抗体alk#1、alk#2、alk#3、alk#4、alk#5、alk#6或alk#7。在一些实施方案中,alk car包含来自alk#1、alk#2、alk#3、alk#4、alk#5、alk#6或alk#7中任一种抗体的vl区的三个cdr。在一些实施方案中,alk car包含来自抗体alk#1、alk#2、alk#3、alk#4、alk#5、alk#6或alk#7中任一种的vh区的三个cdr。在一些实施方案中,alk car包含抗体alk#1、alk#2、alk#3、alk#4、alk#5、alk#6或alk#7。
[0623]
载体
[0624]
car-t细胞可以通过使用基因组整合载体产生,包括但不限于病毒载体,包括逆转录病毒、慢病毒或转座子,或非基因组整合(游离型)dna/rna载体,例如质粒或mrna。car和car-t细胞的生产是本领域已知的(参见,例如,us 7,446,190、us 7,741,465、us 9,181,527;kalos等人,sci transl med.2011,3(95):95ra73,milone等人mol ther.2009,17(8):1453-64,和maude等人n engl j med.2014,371(16):1507-17,其全部内容通过引用并入本文。
[0625]
提供了包含编码alk car的核苷酸序列的载体。用于表达如本文所述的alk car的载体可以是本领域已知和使用的任何合适的表达载体。在一些实施方案中,载体是原核或真核载体。在一些实施方案中,载体是表达载体,例如真核(例如哺乳动物)表达载体。在另一个实施方案中,载体是质粒(原核或细菌)载体。在另一个实施方案中,载体是病毒载体(例如,慢病毒载体)。在一些实施方案中,载体还包括与编码alk car的核苷酸序列可操作地连接的启动子。在一个具体实施方案中,启动子是巨细胞病毒(cmv)启动子。
[0626]
在一些实施方案中,载体包含编码与alk抗体#1(alk#1)、alk抗体#2(alk#2)、alk抗体#3(alk#3)、alk抗体#4(alk#4)、alk抗体#5(alk#5)、alk抗体#6(alk#6)或alk抗体#7(alk#7)的vh和/或vl氨基酸序列至少95%、至少96%、至少97%、至少98%、至少99%或100%相同的vh和/或vl氨基酸序列的核苷酸序列)。在一些实施方案中,载体包含编码alk#1的vh和vl的核苷酸序列。在一些实施方案中,载体包含编码alk#2的vh和vl的核苷酸序列。在一些实施方案中,载体包含编码alk#3的vh和vl的核苷酸序列。在一些实施方案中,载体包含编码alk#4的vh和vl的核苷酸序列。在一些实施方案中,载体包含编码alk#5的vh和vl的核苷酸序列。在一些实施方案中,载体包含编码alk#6的vh和vl的核苷酸序列。在一些实施方案中,载体包含编码alk#7的vh和vl的核苷酸序列。
[0627]
在一些实施方案中,载体包含编码与alk抗体#1(alk#1)、alk抗体#2(alk#2)、alk抗体#3(alk#3)、alk抗体#4(alk#4)、alk抗体#5(alk#5)、alk抗体#6(alk#6)或alk抗体#7(alk#7)的cdr氨基酸序列至少95%、至少96%、至少97%、至少98%、至少99%或100%相同的vh和/或vl氨基酸序列的一个或多个cdr的核苷酸序列。在一些实施方案中,载体包含编码alk#1的cdr的核苷酸序列。在一些实施方案中,载体包含编码alk#2的cdr的核苷酸序列。在一些实施方案中,载体包含编码alk#3的cdr的核苷酸序列。在一些实施方案中,载体包含编码alk#4的cdr的核苷酸序列。在一些实施方案中,载体包含编码alk#5的cdr的核苷酸序列。在一些实施方案中,载体包含编码alk#6的cdr的核苷酸序列。在一些实施方案中,载体包含编码alk#7的cdr的核苷酸序列。
[0628]
用含有编码alk的多核苷酸的表达载体转染宿主细胞(例如,t细胞、自然杀伤(nk)细胞、细胞毒性t淋巴细胞(ctl)细胞或调节性t细胞)产生的alk car-t细胞car,如本文所述,如本领域已知和在足以允许alk car表达的条件下使用,从而产生car-t细胞。还提供了含有载体的分离细胞(例如,t细胞、nk细胞、ctl细胞或调节性t细胞)。还考虑了质粒(载体)的集合。在某些实施方案中,质粒的集合包括编码如本文所述的alk car的质粒。
[0629]
产生嵌合抗原受体和包括此类受体的t细胞的方法是本领域已知的并且在本文中进一步描述(参见,例如,brentjens等人,2010,molecular therapy,18:4,666-668;morgan等人,2010,molecular therapy,published online feb.23,2010,pages 1-9;till等人,2008,blood,1 12:2261-2271;park等人,trends biotechnol.,29:550-557,2011;grupp等人,n engl j med.,368:1509-1518,2013;han等人,j.hematol oncol.,6:47,2013;tumaini等人,cytotherapy,15,1406-1417,2013;haso等人,(2013)blood,121,1165-1174;pct公开案第wo2012/079000、wo2013/126726号;和美国公开案第2012/0213783号,其各自整体内容通过引用并入本文)。
[0630]
[药物组合物]
[0631]
提供了包含至少一种alk car、编码alk car的多核苷酸或包含alk car的工程化免疫细胞的组合物,如本文所述。在一些实施方案中,组合物还包含药学上可接受的载体、稀释剂、赋形剂或载体。在一些实施方案中,还使用了佐剂(改变或增强免疫应答的药理学或免疫学试剂,例如,以产生更多更持久的抗体)。例如但不限于,佐剂可以是无机化合物,例如矾(alum)、氢氧化铝或磷酸铝;矿物油或石蜡油;角鲨烯;洗涤剂,例如奎爾a(quil a);植物皂苷;弗氏完全或不完全佐剂,生物佐剂(例如,细胞因子如il-1、il-2、il-12或il-15);细菌产品,例如杀死的百日咳博德特氏菌或类毒素;或免疫刺激性寡核苷酸(例如cpg寡核苷酸)。
[0632]
组合物和制剂(例如,生理学或药学上可接受的组合物)包括但不限于无菌水性或非水性溶液、悬浮液和乳液.非水溶剂的非限制性实例包括丙二醇、聚乙二醇、植物油,例如橄榄油和菜籽油,以及可注射的有机酯,例如油酸乙酯。水性载体包括水、醇/水溶液、乳液或悬浮液,包括盐水和缓冲介质。肠胃外载体包括例如氯化钠溶液、林格氏葡萄糖、葡萄糖和氯化钠、乳酸林格氏或不挥发油。静脉内载体包括,例如,液体和营养补充剂、电解质补充剂(例如基于林格氏葡萄糖的那些)等。防腐剂和其他添加剂也可存在于此类组合物和制剂中,例如抗微生物剂、抗氧化剂、螯合剂、着色剂、稳定剂、惰性气体等。
[0633]
一些组合物可能作为药学上可接受的酸或碱加成盐给药,通过与无机酸反应形成,例如盐酸、氢溴酸、高氯酸、硝酸、硫氰酸、硫酸和磷酸和有机酸,例如甲酸、乙酸、丙酸、乙醇酸、乳酸、丙酮酸、草酸、丙二酸、琥珀酸、马来酸和富马酸,或通过与无机碱反应,例如氢氧化钠、氢氧化铵、氢氧化钾和有机碱,例如单-、二-、三-烷基和芳基胺以及取代的乙醇胺。
[0634]
本文提供了药物组合物,其包括治疗有效量的alk car、编码alk car的多核苷酸或包含alk car的工程化免疫细胞,单独或与药学上可接受的载体组合。药学上可接受的载体包括但不限于盐水、缓冲盐水、葡萄糖、水、甘油、乙醇及其组合。载体和组合物可以是无菌的,并且制剂适合给药方式。所述组合物还可以含有少量的润湿剂或乳化剂,或ph缓冲剂。所述组合物可以是液体或水溶液、悬浮液、乳液、分散体、片剂、丸剂、胶囊、粉末或缓释
制剂。液体或水性组合物可以在使用前冻干并用溶液或缓冲液重构。所述组合物可以配制成栓剂,具有传统的粘合剂和载体,例如甘油三酯。口服制剂可以包括标准载体,例如药物级甘露醇、乳糖、淀粉、硬脂酸镁、糖精钠、纤维素和碳酸镁。可以使用任何通常已知的药物载体,例如无菌盐水溶液或芝麻油。所述介质还可以包含常规的药物辅助材料,例如用于调节渗透压的药学上可接受的盐、缓冲剂、防腐剂等。可用于所述组合物和给药方法的其他介质是生理盐水和芝麻油。
[0635]
[治疗、给药和递送的方法]
[0636]
提供了治疗疾病(例如,alk-阳性癌症(例如,神经母细胞瘤))或其症状的方法。所述方法包括将治疗有效量的如本文所述的alk car、编码alk car的多核苷酸或包含alk car的工程化免疫细胞或其药物组合物,如本文所述,施用于受试者(例如,哺乳动物),特别是人类受试者。本发明提供了治疗患有或有风险或易患疾病或其症状或延缓疾病(例如,alk-阳性癌症(例如,神经母细胞瘤))进展的对象的方法。在一些实施方案中,所述方法包括向受试者(例如哺乳动物受试者)施用一定量或治疗量的alk car、编码alk car的多核苷酸或包含alk car的工程化免疫细胞或其药物组合物,足以治疗疾病、延缓其生长或治疗其症状(例如,alk-阳性癌症(例如,神经母细胞瘤))。
[0637]
在一些实施方案中,本文的方法包括向受试者(包括被鉴定为需要这种治疗的人类受试者)施用有效量的alk car、编码alk car的多核苷酸或包含alk car的工程化免疫细胞,或其药物组合物,如本文所述以产生这种效果。将治疗方法适当地施用于患有、易感或有风险患有疾病或其症状即癌症(例如,alk-阳性癌症(例如,神经母细胞瘤))的受试者,特别是人类。alk阳性癌症的非限制性例子包括非小细胞肺癌(nsclc)、间变性大细胞淋巴瘤(alcl)、神经母细胞瘤、b细胞淋巴瘤、甲状腺癌、结肠癌、乳腺癌、炎性成肌纤维细胞瘤(imt)、肾癌癌、食管癌、黑色素瘤或其组合。在一些实施方案中,alk-阳性癌症是神经母细胞瘤。
[0638]
alk阳性癌症可能是由致癌alk基因引起的,所述基因要么与其他基因形成融合基因,获得额外的基因拷贝,要么发生基因突变。在一些实施方案中,alk-阳性癌症是由编码alk融合蛋白的alk融合基因引起的。在一些实施方案中,alk-阳性癌症是由alk基因和编码npm-alk融合蛋白的核仁磷蛋白(npm)基因之间的融合引起的。在一些实施方案中,alk-阳性癌症是由alk基因和棘皮动物微管相关蛋白样4(eml4)之间的融合引起的编码elm4-alk融合蛋白的基因。在一些实施方案中,alk-阳性癌症是由点突变引起的。在一些实施方案中,点突变是f1174l(alk
f1174l
)。
[0639]
识别需要这种治疗的受试者可以基于受试者或医疗保健专业人类员的判断,并且可以是主观的(例如,意见)或客观的(例如,可通过测试或诊断方法测量)。简而言之,可以通过诊断测试(例如血样、活检、基因测试、酶或蛋白标记测定)、标记分析、家族史等,包括受试者或医疗保健提供者的意见。如本文所述的alk car、编码alk car的多核苷酸或包含alk car的工程化免疫细胞或其药物组合物,也可用于治疗由致癌alk基因融合引起的疾病的任何其他病症,可能涉及重排、重复或突变。接受治疗的受试者可以是非人类哺乳动物,例如兽医受试者,或人类受试者(也称为“患者”)。
[0640]
此外,提供了预防或预防疾病(例如,alk-阳性癌症(例如,神经母细胞瘤))或其症状的预防方法。此类方法包括将治疗有效量的药物组合物给予受试者(例如哺乳动物,例如
人类),所述药物组合物包含本文所述的alk car、编码alk car的多核苷酸或包含alk car的工程化免疫细胞,特别是在疾病(例如,alk-阳性癌症(例如,神经母细胞瘤))发展或发作之前。
[0641]
在另一实施方案中,提供了监测疾病(例如,alk-阳性癌症(例如,神经母细胞瘤))的进展或监测疾病治疗的方法。所述方法包括在患有或易患疾病或其症状(例如,alk-阳性癌症(例如,神经母细胞瘤))的受试者中进行诊断测量(例如,ct扫描、筛查测定或检测测定),其中所述受试者已经如本文所述,给予足以治疗疾病或其症状的量(例如治疗量)的alk car、编码alk car的多核苷酸或包含alk car的工程化免疫细胞或其药物组合物。所述方法中的诊断测量可以与来自健康、正常对照的样品进行比较;在受试者的疾病前样本中;或在其他患病/患病的患者中确定治疗对象的疾病状态。对于监测,可以在确定第一次诊断测量之后的时间点从受试者获得第二次诊断测量,并且可以比较这两个测量以监测疾病进程或疗法/治疗的功效。在某些实施方案中,在开始所述治疗之前确定受试者中的治疗前测量值(例如,在从受试者获得的样品或活组织检查或ct扫描中);然后可以将所述测量值与治疗开始后和/或治疗过程中受试者的测量值进行比较,以确定疾病治疗的功效(监测功效)。
[0642]
alk car、编码alk car的多核苷酸、或包含alk car的工程化免疫细胞、或其药物组合物,可以通过通常用于将重组蛋白或含有重组蛋白的组合物引入体内的任何途径施用于受试者课程。给药途径和方法包括但不限于皮内、肌内、腹膜内、鞘内、肠胃外,例如静脉内(iv)或皮下(sc)、阴道、直肠、鼻内、吸入、眼内、颅内或口服。肠胃外给药,例如皮下、静脉内或肌肉内给药,通常通过注射(免疫)来实现。可将注射剂制备成常规形式和制剂,或者作为液体溶液或悬浮液,固体形式(例如,冻干形式),适合在注射前溶解或悬浮在液体中,或者作为乳液。注射液和混悬液可以由无菌粉剂、颗粒剂和片剂制备。给药可以是全身的或局部的。
[0643]
alk car、编码alk car的多核苷酸或包含alk car的工程化免疫细胞或其药物组合物,可以以任何合适的方式施用,例如与如上所述的药学上可接受的载体、稀释剂或赋形剂一起施用。药学上可接受的载体部分地由所施用的特定组合物以及由用于施用所述组合物的特定方法确定。因此,包含alk car、编码alk car的多核苷酸或包含alk car的工程化免疫细胞的药物组合物可以使用多种合适的和生理学和药学上可接受的制剂来制备。在一些实施方案中,所公开的方法包括从受试者分离t细胞,用编码alk car的表达载体(例如,慢病毒载体)转导t细胞,以及将表达alk car的t细胞施用于受试者以治疗受试者的疾病((例如,alk-阳性癌症(例如,神经母细胞瘤))。
[0644]
alk car、编码alk car的多核苷酸或包含alk car的工程化免疫细胞或其药物组合物的施用可以通过单剂量或多剂量来完成。给予受试者的剂量应足以随时间在受试者中诱导有益的治疗反应,例如抑制、阻断、减少、改善、防范或预防疾病(例如,alk-阳性癌症(例如,神经母细胞瘤)))。所需剂量因受试者而异,这取决于受试者的物种、年龄、体重和一般状况、所治疗癌症的严重程度、所使用的特定组合物和给药方式。合适的剂量可以由本领域技术人员,例如临床医生或医学从业人类员,仅使用常规实验来确定。本领域技术人员能够确定治疗有效量的alkcar、编码alk car的多核苷酸或包含alk car的工程化免疫细胞,或提供治疗效果或针对疾病的保护的药物组合物(例如,alk-阳性癌症(例如神经母细胞
瘤))适合施用于需要治疗或保护的受试者。
[0645]
在一些实施方案中,alk car、编码alk car的多核苷酸或包含alk car的工程化免疫细胞或其药物组合物以最大耐受剂量(mtd)的形式施用。在一些实施方案中,mtd是具有最接近20%的目标毒性率的估计的剂量限制毒性(dlt)概率的剂量。在一些实施方案中,以治疗有效剂量对哺乳动物施用alk car、编码alk car的多核苷酸或包含alk car的工程化免疫细胞或其药物组合物。在一些实施方案中,哺乳动物是小鼠。在一些实施方案中,向小鼠施用50万(0.5百万)至1500万(15百万)个alk car-t细胞的剂量。在一些实施方案中,哺乳动物是人类。在一些实施方案中,向人类施用至少约0.25x10
6 car
+
细胞/kg、至少约0.5x10
6 car
+
细胞/kg、至少约1x10
6 car
+
细胞/kg或至少约1.5x10
6 car
+
细胞/kg。
[0646]
[联合治疗]
[0647]
如本文所述的间变性淋巴瘤激酶嵌合抗原受体(alk car)或包含alk car的工程化免疫细胞可以在受试者中单独或与其他治疗剂联合施用以治疗癌症(例如,alk-阳性癌症(例如,神经母细胞瘤))。例如,alk car或包含alk car的工程化免疫细胞可以与佐剂一起施用,例如矾(alum)、弗氏不完全佐剂、弗氏完全佐剂、生物佐剂或免疫刺激性寡核苷酸(例如cpg寡核苷酸)。如前所述,佐剂可以与两亲体缀合(h.liu等人.,structure-based programming of lymph-node targeting in molecular vaccines.nature 507,5199522(2014))。在一些实施方案中,与佐剂缀合的两亲体是n-羟基琥珀酰亚胺酯-末端官能化的聚(乙二醇)-脂质(nhs-peg2kda-dspe)。
[0648]
一种或多种细胞因子,包括但不限于白细胞介素1(il-1)、白细胞介素2(il-2)、白细胞介素4(il-4)、白细胞介素6(il-6)、白细胞介素7(il-7)、白细胞介素12(il-12)、白细胞介素15(il-15)、白细胞介素21(il-21)、蛋白质记忆t细胞引诱剂“调节激活正常t细胞表达和分泌因子”(rantes)、粒细胞-巨噬细胞-集落刺激因子(gm-csf)、肿瘤坏死因子-α(tnf-α)、或干扰素-γ(ifn-γ)、巨噬细胞炎症蛋白1α(mip-1α);如果需要或有理由,可以将一种或多种分子,例如tnf配体超家族成员4配体(ox40l)或属于tnf超家族(4-1bbl)的2型跨膜糖蛋白受体,或这些分子的组合,用作生物佐剂(参见,例如,salgaller等人,1998,j.surg.oncol.68(2):122-38;lotze等人,2000,cancer j.sci.am.6(suppl1):s61-6;cao等人,1998,stem cells 16(suppl 1):251-60;kuiper等人,2000,adv.exp.med.biol.465:381-90)。这些分子可以全身(或局部)施用于受试者。
[0649]
alk car或包含alk car的工程化免疫细胞也可以作为与一种或多种其他治疗剂的联合治疗施用,例如alk肽或融合蛋白、alk肽疫苗、alk抑制剂、酪氨酸激酶抑制剂(tki)、和/或免疫检查点抑制剂。alk抑制剂的非限制性实例包括劳拉替尼检查点抑制剂的非限制性例子包括程序性细胞死亡蛋白1(pd-1)抑制剂、程序性死亡配体1(pd-l1)和细胞毒性t淋巴细胞相关抗原4(ctla-4)抑制剂。pd-1抑制剂的非限制性实例包括派姆单抗和纳武单抗ctla-4抑制剂的非限制性实例包括易普利姆玛(ipilimumab)tki抑制剂的非限制性实例包括克唑替尼、色瑞替尼、阿来替尼、布格替尼和劳拉替尼。在一些实施方案中,一种或多种alk肽或融合蛋白、alk肽疫苗、alk抑制剂、免疫检查点抑制剂和/或tki抑制剂与alk car或包含alk car的工程化免疫细胞同时或顺序施用于受试者(例如,人类)。
[0650]
在一些实施方案中,alk car或包含alk car的工程化免疫细胞与alk肽疫苗同时
2008jan;8(1):11-23)。大约10%的神经母细胞瘤病例在alk蛋白(例如alk
f1174l
)中具有激活点突变,与晚期疾病阶段和不良预后相关(passoni l等人,mutation-independent anaplastic lymphoma kinase overexpression in poor prognosis neuroblastoma patients.cancer res 2009sep15;69(18):7338-46;mosse yp等人,identification of alk as amajor familial neuroblastoma predisposition gene.nature 2008oct 16;455(7215):930-5)。alk酪氨酸激酶抑制剂(tki)已获得有希望的抗肿瘤作用,但疾病几乎总是会进展(mosse yp,anaplastic lymphoma kinase as a cancer target in pediatric malignancies.clin cancer res 2016feb 1;22(3):546-52)。因此,虽然alk仍然是神经母细胞瘤的一个有希望的靶点,但临床上很明显,必须实施tki的替代策略来靶向alk。特别是,alk蛋白具有适合免疫治疗靶向的几个特征。例如,alk在正常组织中几乎没有表达,且在人体中具有天然免疫原性(blasco rb等人,comment on"alk is a therapeutic target for lethal sepsis,"sci transl med 2018dec 12;10(471))。患有alk重排淋巴瘤和肺癌的患者确实可以自发产生针对alk的免疫应答(awad mm等人,epitope mapping of spontaneous autoantibodies to anaplastic lymphoma kinase(alk)in non-small cell lung cancer.oncotarget 2017nov 3;8(54):92265-74;8(54):92265-74;ait-tahar k等人,correlation of the autoantibody response to the alk oncoantigen in pediatric anaplastic lymphoma kinase-positive anaplastic large cell lymphoma with tumor dissemination and relapse risk.blood 2010apr 22;115(16):3314-9)。重要的是,alk是肿瘤存活和生长所需的有效驱动癌基因,可最大限度地减少alk阴性肿瘤细胞逃逸的机会(chiarle r等人,the anaplastic lymphoma kinase in the pathogenesis of cancer.nat rev cancer 2008jan;8(1):11-23;voena c等人,efficacy of a cancer vaccine against alk-rearranged lung tumors.cancer immunol res 2015dec;3(12):1333-43)。具体而言,在神经母细胞瘤中,治疗效果是通过alk敲减(di pd等人,neuroblastoma-targeted nanoparticles entrapping sirna specifically knockdown alk.mol ther 2011jun;19(6):1131-40)、抑制(infarinato nr等人,the alk/ros1inhibitor pf-06463922overcomes primary resistance to crizotinib in alk-driven neuroblastoma.cancer discov 2016jan;6(1):96-107)或抗体介导的药物输送(sano r等人,an antibody-drug conjugate directed to the alk receptor demonstrates efficacy in preclinical models of neuroblastoma.sci transl med 2019mar 13;11(483))。基于car-t的alk特异性癌症免疫治疗可能代表着增加临床益处的机会。因此,一系列alk特异性cars(alk cars)是从识别人类和鼠alk的alk抗体开发的,并在神经母细胞瘤的临床前模型中得到验证。
[0659]
评估了七(7)种针对人类alk受体胞外域的alk特异性抗体(alk抗体#1至#7)用于基于car的免疫治疗。这些抗体对alk胞外结构域(ecd)具有特异性,对alk信号传导具有各种活性(表5)。alk抗体#4和#7是alk信号的对抗,alk抗体#2、#3、#5和#6抑制alk信号,而alk抗体#1对alk信号没有影响。这些抗体还表现出不同的生物学亲和力并与人类alk受体的不同部分结合。例如,alk抗体#5、#6和#7)可识别人类和鼠alk,因此可用于小鼠的毒性研究。
[0660]
表5:alk抗体的表征
[0661]
alk抗体alk磷酸化kd
app
[nm]alk周转鼠-alk结合
1没有活性0.35无中等2抑制剂0.2无中等3弱抑制剂0.5无无4强激动剂0.5强的无5抑制剂0.5无强的6抑制剂0.4强的强的7弱激动剂0.5强的强的
[0662]
为了开发一种基于嵌合抗原受体(car)的免疫治疗来治疗神经母细胞瘤,通过将七种alk抗体中的每一种融合到t细胞受体胞内结构域以激活t细胞,构建了car-t细胞。具体而言,从七种抗体中的每一种克隆vh和vl区以产生scfv。alk scfvs被克隆到鼠car主链中,即sfg-m1928z-gfp car-t逆转录病毒构建体。sfg-m1928z-gfp car构建体已被证明在靶向小鼠模型中的cd19+细胞方面非常有效(dr.msadelain(mskcc,ny))。
[0663]
克隆策略显示在图1a中。重叠pcr用于产生vdj-h,然后是mcd8信号肽和vjκ,然后是部分(gly4ser1)3接头序列。在第二轮pcr后,mcd8sp、vdj-h、接头和vjκ被融合。通过gfp表达评估基因转移的功效。图1b显示了使用2a肽序列的报导基因(gfp)和car(m1928z)的小鼠car基因构建体主链gl-2a-m1928z的示意图。描绘了包装信号、剪接供体(sd)、剪接受体(sa)、scfv的vh和vl区、细胞外(ec)结构域(例如cd8)、跨膜(tm)结构域(例如cd8)、和胞质(c)结构域(例如,cd28、cd3ζ)。m1928zcar构造是按照davila等人,cd19car-targeted t cells induce long-term remission and b cell aplasia in an immunocompetent mouse model of b cell acute lymphoblastic leukemia,plos one(2013)的规定创建的,其全文以引用方式并入本文。得到的alk car构建体至少包含alk(例如,alk#1、alk#1、alk#2、alk#3、alk#4、alk#5、alk#6或alk#7)、cd8跨膜域、cd28细胞内信号传送域和cd3ζ细胞内信号传送域(图1c)。
[0664]
实施例2:将alkcar-t构建体转导到小鼠t细胞中
[0665]
为了使用alk car构建体生成car-t细胞,将表达cd19(m1928z-gfp)scfv或alk car的逆转录病毒载体转导到来自c57bl/6j小鼠的t细胞脾细胞中。从脾脏中纯化小鼠t细胞,用抗cd3/cd28+il2激活,并用含有gfp作为报导基因的car逆转录病毒构建体转导。在病毒感染后48小时通过gfp报导基因表达评估转导效率。通过测量gfp阳性t细胞的百分比来评估转导效率(图2)。活化的非转导t细胞用作阴性对照,cd19导向的car-t细胞用作阳性对照(图2)。
[0666]
实施例3:alk car-t细胞构建体的alk特异性溶细胞活性和细胞因子释放体外
[0667]
评估了alk特异性car构建体的细胞因子释放。具体而言,测量了alkcar-t细胞产生的ifnγ和gm-csf。逆转录病毒转导的car-t细胞以1:1的效应细胞(gfp+car-t细胞)与靶细胞的比例(e:t比例)孵育。靶细胞包括nih3t3、eμ-myc、sh-sy5y(表达正常低水平的突变alk
f1174l
)和sk-n-be(表达高水平的扩增野生型alk)。
[0668]
在具有alk#1、alk#2、alk#3、alk#4、alk#5、alk#6或alk#7(图3a)的car-t细胞存在下,在用全长人类alk逆转录病毒载体或模拟载体转导的nih3t3和eμ-myc细胞中测量ifnγ的产生。cd19car-t细胞作为阳性对照被共同孵育,因为人类神经母细胞瘤细胞不表达cd19,而未转导的t细胞作为阴性对照被共同孵育。在具有alk#4或alk#5的car-t细胞存在
下,在人类神经母细胞瘤细胞sh-sy5y和sk-n-be中测量了ifnγ产生(图3b)和gm-csf产生(图3c)。未转导的t细胞用作阴性对照。elisa用于评估共孵育24小时后细胞上清液中ifnγ和gm-csf的产生。在人类神经母细胞瘤细胞、sy5y和sk-n-be,以及过表达人类全长alk的nih3t3和eμ-myc细胞中观察到细胞因子的产生。
[0669]
还评估了alkcar-t细胞的体外杀伤活性。过表达模拟载体或全长人类alk的eμ-myc细胞用cfse染色,并与e:t比为1:1、5:1或10:1的效应细胞或alkcar-t细胞共同孵育。car-t细胞的细胞数根据用car构建体alk#1、alk#2、alk#3、alk#4、alk#5、alk#6或alk#7转导的gfp阳性细胞的百分比进行标准化。18和24小时后,通过确定活靶细胞的比例来计算溶细胞活性,公式如下:溶细胞活性=100-csfe+/cd19+活细胞的%。cd19car-t细胞被用作黄金标准对照,因为它们有效地靶向cd19+eμ-myc细胞(参见davila等人,plosone 2013)。eμ-myc载体(alk-)细胞用作对照以确定alk定向溶细胞活性的特异性。在cfse测定中发现了car-t细胞对eμ-myc/alk细胞的强溶细胞活性(图4)。几种alkcar的细胞溶解活性比最近发表的由不同抗体生成的alkcar-t构建体高2到6倍(sotillo e等人,convergence of acquired mutations and alternative splicing of cd19 enables resistance to cart-19immunotherapy.cancer discov 2015dec;5(12):1282-95)。
[0670]
实施例4:alk car构建体的体内验证
[0671]
cd19+/alk+系统性白血病模型用于验证和排列alkcars在体内的溶细胞活性。在患有eμ-myc/alk全身性肿瘤的小鼠中进行了alkcar-t细胞的过继转移。小鼠接受单独的细胞磷酰胺(ctx,100mg/kg)(n=8)、细胞磷酰胺加car-cd19(15x106基于gfp+)(n=8)或细胞磷酰胺加car-alk#5(15x106基于gfp+)(n=8)。未处理的小鼠(n=6)用作阴性对照。图5a提供了这些治疗小鼠的存活曲线。用免疫抑制剂、环磷酰胺和car-alk#5(n=6/8)治疗的小鼠在两个月内表现出延长的存活率(图5a)。相比之下,未经治疗的小鼠或仅用环磷酰胺治疗的小鼠会在一个月内因侵袭性b细胞恶性肿瘤而死亡。
[0672]
使用facs分析,在仅用ctx处理的一只小鼠中发现了cd19+/alk+细胞。在外周血中发现循环cd19+/alk+肿瘤细胞(图5b,左)。在淋巴结附近分离出alk+肿瘤块(图5b,右)。还对存活两个多月的8只小鼠中的6只进行了facs分析。在这些小鼠的外周血中未发现肿瘤细胞(图5c)。
[0673]
实施例5:用alk car-t构建体处理转基因小鼠
[0674]
生成的alk car用于免疫活性小鼠和免疫缺陷小鼠的研究。在两种可移植的神经母细胞瘤小鼠模型中研究了alkcar-t构建体:i)alk
f1174l
/mycn(brentjens rj等人,cd19-targeted t cells rapidly induce molecular remissions in adults with chemotherapy-refractory acute lymphoblastic leukemia.sci transl med 2013mar 20;5(177):177ra38)转基因小鼠;和i i)具有人类神经母细胞瘤细胞原位移植物的nsg免疫缺陷小鼠。
[0675]
alk
f1174l
/mycn转基因小鼠中的神经母细胞瘤是由人类突变体alk
f1174l
的过表达驱动的。alk
f1174l
/mycn转基因小鼠以与人类神经母细胞瘤细胞系sh-sy5y相当的水平表达alk,表达低alk水平的细胞系(heczey a等人,car t cells administered in combination with lymphodepletion and pd-1inhibition to patients with neuroblastoma.mol ther 2017sep 6;25(9):2214-24)。图6a显示了用于评估alk car-t在
皮下alk
f1174l
/mycn神经母细胞瘤模型中的抗肿瘤功效的实验设计。nsg小鼠在两侧被皮下移植1x10
6 alk
f1174l
/mycn细胞然后给小鼠注射10x10
6 alk#5car-t细胞或10x10
6 cd19 car-t细胞作为阳性对照。每天测量由alk car-t诱导的具有肿瘤体积的神经母细胞瘤生长延迟(双尾p值《0.0001,非配对t检验)(图6b)。测量阴性对照小鼠直到第23天。显示用alk#5car-t细胞治疗延长了荷有神经母细胞瘤的小鼠的存活期(图6c、图6d)。
[0676]
将具有人类神经母细胞原位移植物的nsg免疫缺陷小鼠植入肾囊中的1x10
6 sh-sy5y细胞,以模拟原位人类神经母细胞瘤。然后给小鼠注射10x10
6 alk#5car-t细胞或10x10 6
cd19 car-t细胞作为阳性对照。每天测量由alkcar-t诱导的具有肿瘤体积的神经母细胞瘤生长延迟(双尾p值《0.0001,非配对t检验)。
[0677]
实施例6.转移性神经母细胞瘤免疫活性模型中alk car-t细胞与劳拉替尼的抗肿瘤活性比较。
[0678]
alk car-t细胞的抗肿瘤作用在完全同基因的神经母细胞瘤模型中进行了评估。将alk
f1174l
/mycn神经母细胞瘤皮下移植到balb/c小鼠中。alk#5car-t细胞或cd19 car-t细胞由balb/c纯化的t细胞产生并每周静脉注射,持续三周。劳拉替尼通过口服管饲法(4mg/kg/天)给药三周。在第23天测量肿瘤体积。如图7a所示,alk#5car-t细胞与劳拉替尼的组合在30%的小鼠中根除神经母细胞瘤。免疫功能正常的小鼠静脉注射1x106alk
f1174l
/mycn神经母细胞瘤细胞以诱导多个转移性肿瘤形成,并用cd19 car-t细胞或alkcar-t细胞治疗。转移性肿瘤作为虚线圆圈显示在图7b中。图7c显示免疫活性小鼠在用指定的car-t细胞或劳拉替尼治疗的神经母细胞瘤的转移模型中的存活率。
[0679]
还评估了alk#5car-t细胞的潜在毒性。在正常细胞中,低alk表达仅限于大脑和睾丸中的少数神经元(kabir tf等人,immune checkpoint inhibitors in pediatric solid tumors:status in 2018.ochsner j 2018;18(4):370-6)。通过注射alk#5car-t细胞后的体重减轻、温度变化和il-6释放测量,未检测alk#5car-t细胞诱导的毒性迹象。组织学检查未显示脑部炎症的证据,小鼠未显示任何明显的神经系统症状。
[0680]
实施例7:人类alk car-t细胞的体外验证。
[0681]
为了在体外验证halk car-t细胞,生成了基于alk#5scfv的人源化版本的全人类alk#5car(halk#5car)。用halk#5car转导人类t细胞,并在体外靶向神经母细胞瘤肿瘤细胞。在通过流式细胞术评估的转导后第4天测量人类t细胞中的alk car表达(图8a)。由人类t细胞在与人类神经母细胞瘤细胞imr-32共培养中以效应物:靶细胞的指定比例释放的ifn-γ显示在图8b中。与人类神经母细胞瘤细胞imr-32以指定的效应物:靶细胞比例共培养的人类t细胞的增殖示于图8c中。如图8d所示,alk car-t细胞的体外杀伤活性通过以指定比例共培养3天后残留的imr-32神经母细胞瘤细胞的数量来量化。
[0682]
实施例8:体外和体内针对具有不同alk表达水平的人类神经母细胞瘤系的alk car的验证。
[0683]
靶分子在癌细胞上的表达水平是car-t细胞抗肿瘤活性的关键决定因素。alk在神经母细胞瘤细胞表面以不同水平表达,范围从野生型alk受体低表达的病例到野生型或突变alk受体中度或高表达的病例,包括在某些情况下具有alk基因扩增(heczey a等人,car t cells administered in combination with lymphodepletion and pd-1inhibition to patients with neuroblastoma.mol ther 2017sep6;25(9):2214-24)。几种神经母细
胞瘤细胞系代表了各种基因突变和不同的alk表达:具有高alk表达的细胞系,即,nb-1(alk wt扩增)和felix(突变alk
f1245c
);具有中度alk表达的细胞系,即,imr-32(alk wt)、nbl-s(alk wt)和cog-n-453(突变的alk
f1174l
);具有低alk表达的细胞系,即,sh-sy5y(突变的alk
f1174l
)和cog-n-424x(alk wt)。所有这些细胞系在体外生长良好并在nsg小鼠中移植(heczey a等人,car t cells administered in combination with lymphodepletion and pd-1inhibition to patients with neuroblastoma.mol ther 2017sep 6;25(9):2214-24)。
[0684]
表达halk#5car的人类t细胞的抗肿瘤活性在体外通过测量细胞毒活性、细胞因子释放和t细胞增殖进行测试,如前所述(chen y等人,eradication of neuroblastoma by t cells redirected with an optimized gd2-specific chimeric antigen receptor and interleukin-15.clin cancer res 2019jan 7)。
[0685]
通过植入四种患者来源的异种移植物(pdx)(sjnbl013762、sjnbl013761、sjnbl046148和sjnbl046),验证了halk#5car-t在nsg小鼠神经母细胞瘤模型中的体内抗肿瘤活性(圣裘德儿童研究医院(st.jude children’s research hospital))将荧光素酶报导基因(ffluc)表达到nsg小鼠中,并给小鼠注射halk#5car-t。
[0686]
实施例9:测试nk细胞作为car表达的细胞平台。
[0687]
使用γ-逆转录病毒或慢病毒载体对nk细胞进行遗传修饰仍然具有挑战性。α-逆转录病毒的使用在nk细胞中具有新的基因传递系统。为基于α-逆转录病毒的载体开发了一种拆分包装设计,其中病毒编码序列(gag/pol,env)被整合到病毒包装细胞中,没有包装序列,也没有序列重叠(awad mm等人,epitope mapping of spontaneous autoantibodies to anaplastic lymphoma kinase(alk)in non-small cell lung cancer.oncotarget 2017nov 3;8(54):92265-74)。为了提高病毒滴度,由于gag/pol表达增强,密码子优化的α-病毒包装序列具有几个数量级的增强滴度。产生的用于感染鼠细胞的假型化的α病毒载体高效转导小鼠造血干细胞(hsc)(ait-tahar k等人,correlation of the autoantibody response to the alk oncoantigen in pediatric anaplastic lymphoma kinase-positive anaplastic large cell lymphoma with tumor dissemination and relapse risk.blood 2010apr 22;115(16):3314-9)。用含有cd19 car表达盒的α-逆转录病毒载体转导nk细胞,选择性地增强nk细胞对表达cd19的白血病细胞的细胞毒性(voena c等人,efficacy of a cancer vaccine against alk-rearranged lung tumors.cancer immunol res 2015dec;3(12):1333-43)。
[0688]
使用α-逆转录病毒系统促进了alk car表达nk细胞的制造,以靶向alk阳性细胞。禽类α-逆转录病毒载体主链被用于更有效地介导car向nk细胞的传递。如图9a所示,总共6个启动子强度不同的载体被用于表达halk#5car(强启动子:mpsv;弱启动子:efs)和t细胞或nk信号成分(cd28、4-1bb,如目标1,或nkg2d与dap10)。
[0689]
对于所有这6个载体,产生了稳定的生产者克隆,并使用rd114/tr-假型α-逆转录病毒颗粒转导了nk-92细胞。筛选了大约50个克隆以分离感染性颗粒滴度》1x106/ml的生产系(在ht1080上滴定,用于这种滴定的标准人类细胞系)。
[0690]
与表达人类alk受体的ht1080细胞孵育24小时后,对用halk car构建体转导的nk-92细胞的体外杀伤活性进行量化。用mpsv.alk5.car构建体转导的nk-92细胞有效且特异性
地杀死了表达alk受体的靶细胞(图9b)6种不同的α-逆转录病毒比较了alk#5car构建体转导nk-92细胞的效率及其杀死具有不同alk表达水平的靶神经母细胞瘤细胞的效力。从所述筛选中鉴定出的构建体用于转导人类nk细胞。比较了α-逆转录病毒alk#5car nk-92或原代nk细胞与alk#5car-t细胞的杀伤活性。评估alk#5car nk细胞是否具有优于alk#5car-t细胞对表面alk表达低的细胞的杀伤活性。从体外研究中,确定了用于体内测试的最有效的alk#5car nk构建体。测试了供体来源的nk细胞和nk-92细胞。在携带转移性神经母细胞瘤的nsg小鼠中注射alk5.car nk或alk5.car-t细胞(5x106个细胞)。此外,将alk#5car nk细胞和alk#5car-t细胞共同注射(5x106个细胞)到携带转移性神经母细胞瘤的nsg小鼠中,以评估所述组合是否产生了更有效的抗肿瘤作用。
[0691]
实施例10:alk car-t细胞和alk阻断剂的组合。
[0692]
第一代alk酪氨酸激酶抑制剂(tki),如克唑替尼,对神经母细胞瘤的治疗效果有限,而第三代alktki,劳拉替尼,对突变的神经母细胞瘤有效(infarinato nr等人,the alk/ros1 inhibitor pf-06463922overcomes primary resistance to crizotinib in alk-driven neuroblastoma.cancer discov 2016jan;6(1):96-107)。评估了劳拉替尼对神经母细胞瘤细胞中alk活力和表达的影响。几种具有各种alk基因改变的神经母细胞瘤细胞系,包括nb-1(alk wt扩增)、imr-32(alk wt)、nbl-s(alk wt)、sh-sy5y(突变alk
f1174l
)、kelly(突变alk
f1174l
),用增加剂量的劳拉替尼治疗(图10a)。在48小时测量活力。单独的100nm劳拉替尼在kelly或sh-sy5y细胞中仅显示出适度的抗增殖活性,并且增殖减少不到50%(图10a)。
[0693]
通过流式细胞术在用10nm劳拉替尼处理24小时的kelly和imr-32细胞上测量表面alk的表达(图10b)。劳拉替尼不仅减少了肿瘤的生长,特别是alk突变的神经母细胞瘤细胞,而且还通过减少其内化或增加突变蛋白的稳定性,极大地增强了神经母细胞瘤细胞表面alk的表达。
[0694]
为了检查halk car-t细胞与劳拉替尼联合的协同杀伤作用,单独或联合劳拉替尼对神经母细胞瘤细胞系施用halk car-t细胞。首先,单独或与10nm和100nm的劳拉替尼联合施用halk car-t细胞,以对抗两种alk
f1174l
突变的神经母细胞瘤细胞系(kelly和sh-sy5y),它们表达相对低水平的alk(图15a、图15b)。cd19 car-t细胞、cd19 car-t细胞与10nm和100nm的劳拉替尼组合、alk car-t细胞与dmso、gd2car-t细胞和未转导的t细胞用作对照。alk
f1174l
突变的kelly或sh-sy5y细胞系先前已显示单独的halk car-t细胞的不完全杀伤(图12b)。第二,halk car-t细胞单独或与10nm和100nm的劳拉替尼联合施用以对抗lan5、sk-n-fi、imr-32和ngp人类神经母细胞瘤细胞系(图15c)。cd19 car-t细胞、cd19 car-t细胞与10nm和100nm的劳拉替尼组合、alk car-t细胞与dmso、gd2 car-t细胞和未转导的t细胞用作对照。如图所示。如图15a至图15c所示,劳拉替尼的加入使halk car-t细胞的杀伤活性最大化。
[0695]
劳拉替尼被评估为增强alk car-t细胞的活性,不仅通过影响肿瘤细胞的活力,而且通过增加alk表达。劳拉替尼增强神经母细胞瘤细胞表面alk表达和增加alk car-t细胞靶向的机制如图15d所示。当与10nm和100nm的劳拉替尼组合使用时,进行蛋白质印迹分析以评估alk在具有alk基因突变(lan-5(r1275q)、sh-sy5y(f1174l)、sk-n-sh(f1174l)、ngp(d1529e)、nbl-s(wt)、imr-32(wt)、sk-n-fi(wt)、kelly(wt))的神经母细胞瘤细胞中的表
达(图15c)。dmso处理和未转导的细胞用作对照。如图15c所示,劳拉替尼增加了alk基因突变的神经母细胞瘤细胞中alk的表达。
[0696]
进一步进行蛋白质印迹分析以评估alk在lan-5(r1275q)、sh-sy5y(f1174l)、sk-n-sh(f1174l)、ngp(d1529e)、nbl-s(wt)、imr-中的表达32(wt)、sk-n-fi(wt)、kelly(wt)神经母细胞瘤细胞与10nm和100nm的劳拉替尼联合使用时(图15e)。dmso处理和未转导的细胞用作对照。用10nm和100nm的劳拉替尼处理24、48、72和96小时后sh-sy5y神经母细胞瘤细胞中alkmrna的相对表达显示在图15中。dmso处理和未转导的细胞用作对照。
[0697]
为了测试劳拉替尼治疗期间表面alk表达增加是否增强了alkcar-t、imr-32和kelly细胞系的杀伤活性,这些细胞系在10nm劳拉替尼下上调alk表达而对细胞活力没有显着影响,与增加的3天的alk#5car-t细胞或对照cd19 car-t细胞(10:1、1:1、1:5、1:10肿瘤:t细胞比率)。然后通过流式细胞术测量神经母细胞瘤细胞活力。
[0698]
为了测试抗增殖作用,结合劳拉替尼诱导的表面alk表达增加,是否增强了halk car-t在体外和体内的杀伤活性,将神经母细胞瘤细胞系与10nm或100nm劳拉替尼一起孵育,加量增加halk5 car-t细胞或对照cd19 car-t细胞(肿瘤:t细胞比例为10:1、1:1、1:5、1:10)5天,然后nb细胞活力和alk表面表达通过流式细胞术测量残留的肿瘤细胞。
[0699]
对于体内治疗实验,免疫活性balb/c小鼠静脉注射1x106alk
f1174l
/mycn同源神经母细胞瘤细胞,免疫缺陷nsg小鼠静脉注射nb-1(alk wt扩增)、imr-32(alk wt)或kelly或sh-sy5y(突变的alk
f1174l
)细胞。肿瘤注射后一周,通过口服强饲法(4mg/kg/天-10mg/kg/天)给予劳拉替尼三周。halk car-t细胞或对照cd19 car-t细胞在第一次劳拉替尼治疗后一周注射。通过荧光素酶活性测量肿瘤生长,并在单独使用car-t细胞或与劳拉替尼联合治疗的小鼠中比较存活率。
[0700]
实施例11:使用alkcar-t细胞与alk疫苗的联合治疗
[0701]
alk
f1174l
/mycn转基因小鼠用于评估car-t细胞和alk疫苗的联合治疗。免疫活性balb/c小鼠皮下注射1x10
6 alk
f1174l
/mycn同基因神经母细胞瘤细胞。肿瘤注射后,alk car-t细胞与alk疫苗联合注射,如图11a的给药方案所示。评估了具有未缀合的alk肽或缀合至两亲体的alk肽的alk疫苗,例如n-羟基琥珀酰亚胺酯末端官能化聚(乙二醇)-脂质(nhs-peg2kda-dspe)。cd19 car-t细胞用作对照。通过荧光素酶活性测量肿瘤生长,并在单独使用car-t细胞或单独使用alk疫苗治疗的小鼠中比较存活率。
[0702]
alk
f1174l
/mycn转基因小鼠用于评估alk car-t细胞、alk疫苗和劳拉替尼的联合治疗。向balb/c小鼠皮下注射1x106个同基因alk
f1174l
/mycn神经母细胞瘤细胞。用alk疫苗对小鼠进行疫苗接种,并在指定的时间注射15x106alk car-t细胞,如图11a所示。alk tki劳拉替尼以4mg/kg bid给药,持续指定时间,如图11a所示。小鼠也在如图11a所示的指定时间用或不用免疫抑制剂环磷酰胺(ctx)治疗。将用alk疫苗、alk car-t细胞和劳拉替尼的组合治疗的小鼠的存活率与用alk car-t细胞和劳拉替尼的组合治疗的小鼠进行比较(图11b)。评估随访曲线直至截止34天。在alk car-t细胞中添加alk疫苗进一步提高了小鼠的存活率。
[0703]
实施例12:halk5 car-t细胞对显示不同alk表达水平的人类神经母细胞瘤细胞系的验证。
[0704]
靶分子在癌细胞上的表达水平是car-t细胞抗肿瘤活性的关键决定因素。alk在神
经母细胞瘤细胞表面以不同水平表达,因此评估halkcar-t在表达不同水平alk的神经母细胞瘤细胞中的抗肿瘤作用至关重要。几种代表各种基因突变和alk表达水平的神经母细胞瘤细胞系如表6所示。alk在人类神经母细胞瘤细胞系、lan-1、sk-n-fi、ngp、sk-n-sh、sh-sy5y、kelly、lan-5、nbl-s、felix、imr-32和nb-1中的表达,如图12a所示。所有这些细胞系在体外生长并在nsg小鼠中移植(heczey a等人,car t cells administered in combination with lymphodepletion and pd-1inhibition to patients with neuroblastoma.mol.ther.2017;25:2214-2224)。
[0705]
表6:人类神经母细胞瘤(nb)细胞系列表
[0706]
nb细胞系alkmycnlan-1f1174l放大的sk-n-fir1275q未放大*ngp野生型放大的sk-n-be(2)c野生型放大的sk-n-shf1174l未放大sh-sy5yf1174l未放大kellyf1174l放大的lan-5r1275q放大的nbl-s野生型未放大felixf1245c未放大imr-32野生型放大的nb-1放大的放大的
[0707]
为了测量halk car-t细胞的体外杀伤活性,在给予halk car-t细胞对抗nbl-s、sk-n-fi、imr-32、ngp、nb-1、lan-5、sk-n-sh、kelly、sh-sy5y神经母细胞瘤细胞系(图12b)后,测量了来自两个独立供体的残留肿瘤细胞。cd19 car-t细胞和未转导的t细胞用作阴性对照,gd2 car-t细胞用作阳性对照。car-t细胞和靶细胞以1:1的效应靶比率孵育5天。如图12b所示,halk car-t细胞在体外几乎完全消除了所有人类神经母细胞瘤细胞。halk car-t细胞的体外杀伤活性与阳性对照gd2 car-t细胞相当或优于大多数细胞系的最大杀伤力(图12b)。
[0708]
人类alk car-t细胞对几种人类神经母细胞瘤细胞系(nbl-s、sk-n-fi、imr-32、ngp、nb-1、lan5、sk-n-sh、kelly、sh-sy5y、raji)的杀伤活性也以1:1的肿瘤:car-t比率(图14a)或1:5的肿瘤:car-t比率(图14b)进行检查。cd19 car-t细胞和未转导的t细胞作为阴性对照,gd2 car-t细胞作为阳性对照。halk car-t细胞的体外杀伤活性与阳性对照gd2 car-t细胞相当或更好,并接近大多数细胞系的最大杀伤(图14a、14b)。
[0709]
通过静脉注射106种具有不同alk表达水平的荧光素酶转导的神经母细胞瘤细胞系(nb-1、imr-32、kelly和sh-sy5y)来检测halk5 car-t在nsg小鼠体内的抗肿瘤活性。halk car-t细胞和cd19 car-t细胞(5x106细胞/小鼠)在神经母细胞瘤注射后2周注射。通过ivis仪器监测荧光素酶评估肿瘤生长。从圣裘德儿童研究医院(stjude.org/research/resources-data/childhood-solid-tumor-network/available-resources.html#xenografts)。pdxs也表达ffluc,可以植入nsg小鼠体内。神经母细胞瘤pdxs也可以原位注
射到肾囊中。
[0710]
实施例13:alk car-t细胞毒性测试
[0711]
为了检查毒性,在单独使用alk5 car-t细胞和和与劳拉替尼联合使用的在注射和未注射肿瘤的小鼠中测量体重、体温、干扰素γ(ifnγ)产生、白介素6(il-6)产生和血清淀粉样蛋白a 3(msaa3)产生的变化(图13a至图13e)。cd19 car-t细胞、cd19 car-t细胞与劳拉替尼组合、劳拉替尼单独和未转导的t细胞用作对照。注射alkcar-t细胞后,未观察到体重、体温和白细胞介素6(il-6)产生的显着变化。
[0712]
实施例14:人类alkcar-t细胞的体内抗肿瘤活性
[0713]
在体内评估了halk car-t细胞的抗肿瘤活性。nsg小鼠被注射了表达高水平alk的nb-1细胞,然后单次注射alk car-t细胞(图16a)。cd19 car-t细胞和非转导(nt)细胞用作阴性对照,gd2 car-t细胞用作阳性对照。通过用ivis仪器检测的荧光素酶发光随时间监测肿瘤生长。监测这些小鼠的无治疗存活率(tfs),如图16b所示。在alk car t细胞对表达高水平野生型alk的神经母细胞瘤细胞的nsg小鼠中显示了体内功效。
[0714]
进一步开发了用于在nsg小鼠体内将alkcar-t细胞与三个周期的劳拉替尼组合的实验程序(图17a)。向nsg小鼠注射表达低水平突变alk的sk-n-sh细胞,然后用单次注射alkcar-t细胞进行治疗(图17b)。小鼠若非没有劳拉替尼治疗,则是根据图17a所示的程序用3个周期的劳拉替尼治疗。cd19 car-t细胞作为阴性对照,gd2 car-t细胞作为阳性对照。通过用ivis仪器检测的荧光素酶发光监测肿瘤生长。未经劳拉替尼治疗的nsg小鼠的存活率显示在图17c中。图17d显示了3个周期劳拉替尼的nsg小鼠的存活率。在alk car-t细胞的nsg小鼠中显示了单独或与劳拉替尼联合表达低水平突变alk的神经母细胞瘤细胞的体内功效。
[0715]
实施例15:在复发/难治性神经母细胞瘤患者中使用自体halk car-t细胞的剂量递增。
[0716]
无需任何额外的基因修饰(如il-15递送)即可评估表达halk car的自体t细胞。通过免疫组织化学(ihc)检测表面alk表达的存在可用作合格标准。预计约》80%的神经母细胞瘤患者会通过ihc表达可检测的alk水平。使用如图18所示的halk car转基因可生成临床级逆转录病毒载体(unc先进的细胞疗法(act)设施)和halk car-t可以按照经过验证的sop进行制造(unc atc)。选定的复发/难治性神经母细胞瘤患者可以使用制造的halk car-t细胞来测试递增剂量的自体halk car-t细胞的安全性和抗肿瘤活性。
[0717]
[患者资格]
[0718]
符合条件的受试者将拥有:1)由法定监护人类签署的书面hipaa授权;2)同意时年龄大于18个月且小于18岁;3)符合lansky或karnofsky≥60的体能状态(lansky为《16岁)定义的适当体能状态;4)预期寿命≥12周;5)初始诊断时神经母细胞瘤或神经节神经母细胞瘤的组织学确认。骨髓样本可以作为神经母细胞瘤的确认。6)具有持续性或复发性疾病的高危神经母细胞瘤,定义为:在完成积极的多药一线治疗后,神经母细胞瘤首次或更大程度复发;在积极的多药一线治疗期间首次出现进行性nb;持续性/难治性神经母细胞瘤定义为在至少4个周期的积极多药诱导化疗结束时或根据高风险nb方案(如a3973或anbl0532)未完全缓解(由修订后的inrc);7)根据修订的国际神经母细胞瘤反应标准可测量或可评估的疾病;8)足够的中枢神经系统功能(没有已知的中枢神经系统疾病,没有需要抗癫痫药物治
疗的癫痫症);9)足够的心功能(超声心动图缩短分数≥27%);10)足够的肺功能(无慢性氧气需求和室内空气脉搏血氧饱和度》94%)。
[0719]
[治疗计划]
[0720]
所有患者都将在car-t细胞输注前接受淋巴细胞清除化疗(heczey a等人,car t cells administered in combination with lymphodepletion and pd-1inhibition to patients with neuroblastoma.mol.ther.2017;25:2214-2224)。淋巴清除将包括第1-2天的环磷酰胺500mg/m2/天iv和第1-4天的氟达拉滨30mg/m2/天iv。持续重新评估方法(crm)将用于估计可在由2-6名受试者组成的剂量递增队列中施用的细胞的最大耐受剂量(mtd)。最终的mtd将是剂量限制毒性(dlt)估计概率最接近目标毒性率20%的剂量。将评估三种细胞剂量:d1:0.5x106car
+
细胞/kg;d2:1x106car
+
细胞/kg;d3:1.5x106car
+
细胞/kg。队列登记将交错进行,每个受试者必须完成至少2周的细胞治疗而不发生dlt,然后才能以所述剂量水平登记另一名受试者。至少两名受试者必须完成输注后4周的dlt安全性评估期,然后才会考虑在下一个更高剂量水平的受试者的队列入组。如果确定剂量水平1高于可耐受剂量,则会降级至剂量水平-1,此时受试者将接受0.25x106car
+
细胞/kg。rimiducid(又名ap1903)(0.4mg/kg)是一种二聚化剂,旨在接合和激活ic9以触发t细胞死亡,将用于缓解对护理标准无反应的3级或4级神经毒性或3级疼痛症状(di stasi a.等人,inducible apoptosis as a safety switch for adoptive cell therapy.n.engl.j.med.2011;365:1673-1683)。在研究的剂量扩展部分,受试者可能会接受第二次细胞输注(预先清除淋巴液)。风险评估将根据sop进行评估。如果剂量限制毒性(dlt)发生在dlt报告期内(即car-t细胞输注后4周),将根据nci ctcae标准v 5.0或crs和icans分级标准进行评估。
[0721]
[患者的临床监测]
[0722]
患者随访由sop指导,包括病史和体格检查,以及在输注前和t细胞后4小时和1、2、3、4、6周和第3、6、9和12个月进行的常规实验室检查输液,然后每6个月一次,持续4年。使用标准标准监测患者的肿瘤进展或复发。在car-t细胞输注后第6周对患者进行评估。作为标准临床护理的一部分获得的额外成像也将被评估。临床反应将使用修订后的国际神经母细胞瘤反应标准(inrc)进行评估。将使用kaplan-meier方法估计无进展生存期(pfs)和总生存期(os)。将在car-t细胞输注之前和之后6周进行成像。然后将在第3、6、9和12个月进行成像以用于研究目的。患者将在car-t细胞输注之前和之后6周进行双侧骨髓抽吸和活检。然后将在第3、6、9和12个月进行重复骨髓以用于研究目的。如果在第一年获得其他组织用于临床适应症,一部分将用于评估转导t细胞的存在。如果患者死亡,将要求进行尸检并评估组织中是否存在car-t细胞。
[0723]
实施例16:材料和方法
[0724]
[细胞系和细胞培养]
[0725]
人类神经母细胞瘤(nb)肿瘤细胞系imr-32、nbl-s、ngp、lan-5、lan-1、sk-n-sh、sk-n-fi、sh-sy5y和felix,以及人类burkitt’s淋巴瘤细胞系raji购自美国典型培养物保藏中心(atcc)。imr-32、nbl-s、ngp、lan-5、lan-1、sk-n-sh、sk-n-fi、sh-sy5y、nb-1和raji维持在rpmi1640(康宁)中,辅以10%胎牛血清(fbs)(gibco)、100u/ml青霉素、100μg/ml链霉素(corning)和2mml-谷氨酰胺(corning)。felix维持在补充有10%胎牛血清(fbs)(gibco)、100u/ml青霉素、100μg/ml链霉素(corning)、2mml-谷氨酰胺(corning)的
rpmi1640(corning)中,和1%胰岛素/转铁蛋白/硒(its)(康宁)。phoenix-eco和293t包装细胞获自dsmz并在补充有10%fbs(gibco)、100u/ml青霉素、100μg/ml链霉素(corning)的dulbecco改良eagle培养基(dmem)(corning)中培养,和2mml-谷氨酰胺(康宁)。
[0726]
将细胞保持在37℃的5%co2湿润气氛中。nb细胞系用编码gfp-萤火虫-萤光素酶(gfp-ffluc)基因的逆转录病毒载体转导,所述基因由giampietro dotti教授(vera等人,2006)友情提供。所有细胞系均不含支原体,并根据需要通过流式细胞术验证表面标志物和功能读数。劳拉替尼购自辉瑞公司。
[0727]
[car-t质粒构建]
[0728]
alk1、alk2、alk3、alk4、alk5、alk6和alk7 mab的重链和轻链可变区从小鼠杂交瘤中克隆,然后作为scfv片段克隆到先前验证的car格式中,包括鼠cd8α铰链和跨膜域、cd28胞内共刺激结构域和cd3ζ胞内信号传送域。alkcar盒被克隆到逆转录病毒载体sfg中。对于人类版本的alk5car,将鼠cd8α、cd28和cd3ζ替换为人类cd8α、cd28和cd3ζ,并修改alk5scfv以生成人源化版本(halk5car)。先前报导了对cd19和gd2特异的scfv(kochenderfer等人blood,116(20):4099-4102(2010);du h,et al.,antitumor responses in the absence of toxicity in solid tumors by targeting b7-h3 via chimeric antigen receptor t cells.cancer cell 2019;35:221-237)。
[0729]
[逆转录病毒生产]
[0730]
通过共转染phoenix-eco包装细胞产生用于转导鼠t细胞的逆转录病毒上清液。phoenix-eco细胞置于10cm培养皿中。第二天,根据制造商的说明,使用xfect transfection reagent(takara)用逆转录病毒载体和pcl-eco质粒转染细胞。转染后6小时更换培养基。转染48小时后收集病毒上清液,用0.45μm滤器过滤。
[0731]
用于制备用于转导人类t细胞的逆转录病毒上清液,2
×
10
6 293t细胞接种在10cm细胞培养皿中,并用逆转录病毒载体、编码momlvgag-pol的peg-pam-e质粒和编码rd114包膜的rdf质粒的质粒混合物转染,使用genejuice转染试剂(merckmillipore)根据制造商的说明进行。转染后48和72小时收集含有逆转录病毒的上清液,并用0.45μm过滤器过滤。
[0732]
[小鼠car-t细胞的产生]
[0733]
根据制造商的说明,使用easysep小鼠t细胞分离试剂盒(stemcell)从c57bl/6j小鼠获得的脾细胞中分离小鼠t细胞,并用100u/mlil-2和dynabeads小鼠t-activator cd3/cd28((gibco)进行刺激指示,24小时。用逆转录病毒上清液和6μg/ml聚凝胺通过2,000rpm的旋转感染转导活化的鼠t淋巴细胞80分钟,并在完全培养基(rpmi-1640(corning)、15%fbs(gibco)、100u/ml青霉素)、100μg/ml链霉素(corning)、2mml-谷氨酰胺(corning)、55μmβ-巯基乙醇(gibco)、1mm丙酮酸钠(corning)、10mmhepes(corning)、1x mem非必需氨基酸(corning))中扩增,使用rhil-2(100u/ml;r&dsystems)每2天更换一次培养基。在第4-6天,收集t细胞并用于体外和体内功能测定。
[0734]
[小鼠car-t细胞的共培养实验]
[0735]
eμ-myc用0.5μm羧基荧光素二乙酸琥珀酰亚胺酯(cfse;invitrogen)标记的细胞以1x105个细胞/孔的浓度接种在24孔板中,t细胞以不同的比例(e:t为1:1,2.5:1;5:1;10:1或20:1),不添加外源性细胞因子。18小时后分析细胞以通过facs测量残留的肿瘤细胞。通过鼠cd19-apc(130-102-546,miltenyibiotec)的表达和通过cfse的表达它们的活力来鉴
定靶细胞。
[0736]
[人类t细胞的转导和扩增]
[0737]
来自马萨诸塞州波士顿的波士顿儿童医院献血者中心的健康献血者的单采白细胞减少项圈。在第0天,淋巴细胞用ficoll-paqueplus密度分离(gehealthcare)分离,t细胞用easysep人类t细胞分离试剂盒(stemcell)分离,并根据制造商的说明用dynabeads human t-activator cd3/cd28(gibco)激活。第二天,制备转导板:在冷藏室中,用7μg/ml反连接蛋白(500μl/孔)(takarabioinc.,shiga,japan)包被未经组织培养处理的24孔板过夜。第2天,转导t细胞。简而言之,在冷藏室中用7mg/ml反连接蛋白包被过夜的非组织培养处理的24孔板用1ml培养基洗涤一次,每孔包被1ml逆转录病毒上清液,并以2000g离心90分钟。去除上清液后,铺板5x105个活化的t细胞,并以1000g离心10分钟。三天后,收集t细胞并在完全培养基(45%rpmi-1640和45%click's培养基(irvine scientific)、10%fbs(gibco)、2mm glutamax(gibco)、100单位/ml青霉素和100μg/ml链霉素(corning)与rhil-7(10ng/ml;peprotech)和rhil-15(5ng/ml;peprotech),每2-3天更换一次培养基。在第12-14天,细胞收集用于体外和体内实验。在用于体外功能测定之前,将t细胞在rhil-7/il-15耗尽的培养基中培养两天。
[0738]
[与hcar-t细胞的共培养实验]
[0739]
在共培养前24小时,将肿瘤细胞以5x105个细胞/孔的浓度接种在24孔板中。在不添加外源性细胞因子的情况下,将t细胞以不同的比例(e:t为1:1;1:5或1:10)添加到培养物中。在第5天分析细胞以通过facs测量残留的肿瘤细胞和t细胞。通过zombieaquadye(biolegend)染色将死细胞排除在外,而通过cd3的表达鉴定t细胞,通过gfp(nb细胞系)或cd19(raji细胞系)的表达鉴定肿瘤细胞。
[0740]
[流式细胞术]
[0741]
使用以下抗体进行流式细胞术:人类cd3percp-cy5.5(340948,bd biosciences)、人类cd3fitc(im1281u,beckman coulter)、人类cd19apc(im2470u,beckman coulter)、鼠cd19apc(130-102-546,miltenyi biotec)。根据制造商的说明,使用alexa fluor antibody labeling试剂盒(life technologies)用与alexa fluor647缀合的alk 5mab评估alk在肿瘤细胞系中的表达。使用f(ab')2-goatanti-mouseigg(h+l)alexa fluor647(invitrogen)检测alkcar-t细胞的表达。使用bddiva软件(bd biosciences)用bd facscelesta流式细胞仪采集样品。对于每个样本,至少采集10,000个事件,并使用flowjo10分析数据。
[0742]
[酶联免疫吸附试验]
[0743]
t细胞(5
×
104、1
×
105或5
×
105)在24孔板中与肿瘤细胞(5
×
105)共培养,不添加外源性细胞因子。24小时后,收集上清液并按照制造商的说明使用特定的elisa试剂盒(biolegend或r&d系统)重复测量ifnγ和gm-csf细胞因子。
[0744]
[t细胞增殖试验]
[0745]
用1.5mm羧基荧光素二乙酸琥珀酰亚胺酯(cfse;invitrogen)标记t细胞,并以1:1的e:t比率接种肿瘤细胞。在第5天使用流式细胞仪测量门控t细胞的cfse稀释度。
[0746]
[蛋白质印迹]
[0747]
使用gst-fish缓冲液(10mm mgcl2、150mm nacl、1%np-40、2%甘油、1mm edta、
25mm hepes ph 7.5)获得全细胞提取物,辅以蛋白酶抑制剂混合物(roche),1mm苯甲磺酰氟(pmsf)、10mm naf和1mm na3vo4。通过以15,000rpm离心20分钟清除提取物。收集上清液并使用bca蛋白质测定法(sigma)测定蛋白质浓度。用mini-proteantgx凝胶(bio-rad)分离等量的蛋白质裂解物,转移到硝酸纤维素膜(ge healthcare)上,并用以下一抗进行探测:alk、兔alk(d5f3)xp(cell signaling technology,#3633)、兔gfp(cell signaling technology,#2555)、兔多克隆抗β-肌动蛋白(sigma,#a5316)、兔α-肌动蛋白(d6f6)xp(cell signaling technology,#6487)。使用ecl解决方案(ge healthcare)开发膜。
[0748]
[劳拉替尼治疗后的nb细胞增殖和凋亡检测]
[0749]
在白色96孔板中,3
×
104个细胞/ml一式三份地生长。劳拉替尼治疗在24小时后完成。根据制造商的说明,在处理后5天使用cell titer-glomax测定法(promega,fitchburg,wi,usa)分析细胞生长。
[0750]
在24孔板中,5
×
104个细胞/ml一式三份地生长。劳拉替尼治疗在24小时后进行。根据制造商的说明,在用fitc膜联蛋白v和碘化丙啶(pi)染色液细胞凋亡检测试剂盒i(bd pharmingen)染色后,通过流式细胞术处理48小时后测量细胞凋亡。
[0751]
[量化和统计分析]
[0752]
具有两个尾p值计算的非配对和非参数mann whitney检验用于测量两组之间的差异。对于多组比较,使用单向方差分析或双向方差分析来确定样本之间的统计学显着差异。holm-sidak检验调整后的p值《0.05表示差异显着。测量值总结为平均值
±
标准差。使用graph pad prism v5通过卡方检验分析存活曲线之间的差异。使用graphpadprism软件(graph pad,la jolla,ca)进行图形生成和统计分析。
[0753]
[其他实施例]
[0754]
从前面的描述中,很明显可以对这里描述的本发明进行变化和修改以将其应用于各种用途和条件。这样的实施例也在所附权利要求的范围内。
[0755]
此处对变量的任何定义中的元素列表的引用包括将所述变量定义为任何单个元素或所列元素的组合(或子组合)。本文中一些实施例的叙述包括作为任何单个实施例或与任何其他实施例或其部分组合的实施例。
[0756]
本说明书中提及的所有专利和出版物都以引用的方式并入本文,其程度与每个独立的专利和出版物被具体地和单独地指示以引用的方式并入的程度相同。特别是,wo2017/035430、wo2017/147383、美国序列第62/902,096号和davila等人,cd19 car-targeted t cells induce long-term remission and b cell aplasia in an immunocompetent mouse model of b cell acute lymphoblastic leukemia,plos one(2013),通过引用并入本文。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1