使用免疫细胞治疗癌症的方法和组合物与流程
使用免疫细胞治疗癌症的方法和组合物
1.与相关申请的交叉引用
2.本技术要求2020年3月5日提交的美国临时专利申请系列号62/985,553的利益和优先权,其全部内容整体通过参考并入本文。
技术领域
3.本发明总的来说涉及用于在受试者中治疗癌症的组合物和方法,并且更具体来说,本发明涉及使用任选地与超抗原偶联物联合的免疫细胞来治疗癌症的方法和组合物,以及在癌症治疗中使用的免疫细胞的制造方法。
背景技术:
4.根据美国癌症协会的数据,美国每年有超过100万人被诊断出患有癌症。癌症是由细胞不受控制的增殖而导致的疾病,所述细胞曾经服从自然控制机制,但已被转化成以不受控制的方式继续增殖的癌细胞。
5.嵌合抗原受体(car)是合成的受体,其将免疫细胞例如t细胞重新靶向到肿瘤表面抗原(sadelain等,(2003),nat.rev.cancer.3(l):35-45;sadelain等,(2013)cancer discovery 3(4):388-398)。car提供了抗原结合和免疫细胞活化两种功能。一开始,car含有负责抗原识别的基于抗体的肿瘤结合元件例如单链fv(scfv),其连接到触发t细胞活化的cd3ζ或fc受体信号传导结构域。后来,car构建物包括额外的活化和共刺激信号传导结构域,其在化疗难治性b细胞恶性肿瘤患者中取得了令人鼓舞的结果(brentjens等,(2013)sci.trans.med.5(177):177ra38;brentjens等,(2011)blood 118(18):4817-4828;davila等,(2014)sci.trans.med.6(224):224ra25;grupp等,(2013)n.engl.j.med.368(16):1509-1518;kalos等,(2011)sci.trans.med.3(95):95ra73)。car疗法已被批准用于治疗复发性或难治性大b细胞淋巴瘤患者亚群和急性成淋巴细胞性白血病(all)患者亚群。然而,靶向实体肿瘤的car疗法已被证明更具挑战性(参见例如martinez等,(2019)front immunol 10:128)。
6.尽管在癌症治疗和管理方面取得了重大进展,但对治疗和管理癌症的新的有效疗法,仍存在着持续不断的需求。
技术实现要素:
7.本发明部分是基于下述发现,即通过将包含与结合癌抗原的靶向部分共价连接的超抗原(例如工程化葡萄球菌肠毒素超抗原sea/e-120)的超抗原偶联物与免疫细胞(例如t细胞,例如嵌合抗原受体(car)t细胞)联合,可以增强受试者中针对癌症的靶向免疫应答。此外已发现,使用超抗原偶联物和免疫细胞的抗癌治疗,可以通过使用表达与所述超抗原结合的t细胞受体(例如包含t细胞受体β可变区7-9(trbv7-9)的t细胞受体)的免疫细胞来增强。
8.因此,一方面,本发明提供了一种在有需要的受试者中治疗癌症的方法。所述方法
包括向所述受试者施用下述物质:(i)有效量的超抗原偶联物,其包含与结合由所述受试者中的癌细胞表达的第一癌抗原的靶向部分共价连接的超抗原;和(ii)有效量的免疫细胞(例如分离的免疫细胞),其包含编码结合由所述受试者中的癌细胞表达的第二癌抗原的嵌合抗原受体(car)的外源核苷酸序列。
9.在某些实施方式中,所述超抗原包含葡萄球菌肠毒素a或其免疫反应性变体和/或片段。在某些实施方式中,所述超抗原包含seq id no:3的氨基酸序列或其免疫反应性变体和/或片段。
10.在某些实施方式中,所述靶向部分是抗体。在某些实施方式中,所述抗体是抗5t4抗体,例如包含结合5t4癌抗原的fab片段的抗5t4抗体。在某些实施方式中,所述抗5t4抗体包含含有seq id no:8的第1-458位氨基酸残基的重链和含有seq id no:9的第1-214位氨基酸残基的轻链。
11.在某些实施方式中,所述超抗原偶联物包含含有seq id no:8的第一蛋白链和含有seq id no:9的第二蛋白链。
12.在某些实施方式中,所述免疫细胞(例如分离的免疫细胞)选自t细胞、自然杀伤细胞(nk)和自然杀伤t细胞(nkt)。在某些实施方式中,所述免疫细胞(例如分离的免疫细胞)是t细胞,例如包含含有trbv7-9的t细胞受体的t细胞。
13.在某些实施方式中,所述第一和第二癌抗原相同。在某些实施方式中,所述第一和第二癌抗原不同。在某些实施方式中,所述第一和/或第二癌抗原选自5t4、间皮素、前列腺特异性膜抗原(psma)、前列腺干细胞抗原(pcsa)、碳酸酐酶ix(caix)、癌胚抗原(cea)、cd5、cd7、cd10、cd19、cd20、cd22、cd30、cd33、cd34、cd38、cd41、cd44、cd47、cd49f、cd56、cd74、cd123、cd133、cd138、上皮糖蛋白2(egp 2)、上皮糖蛋白-40(egp-40)、上皮细胞粘附分子(epcam)、叶酸结合蛋白(fbp)、胎儿乙酰胆碱受体(achr)、叶酸受体-a和β(fra和β)、神经节苷脂g2(gd2)、神经节苷脂g3(gd3)、表皮生长因子受体(egfr)、表皮生长因子受体2(her-2/erb2)、表皮生长因子受体viii(egfrviii)、erb3、erb4、人端粒酶反转录酶(htert)、白介素-13受体亚基α-2(il-13ra2)、k-轻链、激酶插入结构域受体(kdr)、lewis a(ca19.9)、lewis y(ley)、li细胞粘附分子(licam)、黑素瘤相关抗原1(黑素瘤抗原家族al、mage-a1)、粘蛋白16(muc-16)、粘蛋白1(muc-1)、kg2d配体、睾丸癌抗原ny-eso-1、肿瘤相关糖蛋白72(tag-72)、血管内皮生长因子r2(vegf-r2)、肾母细胞瘤蛋白(wt-1)、1型酪氨酸蛋白激酶跨膜受体(ror1)、b7-h3(cd276)、b7-h6(nkp30)、硫酸软骨素蛋白聚糖-4(cspg4)、dnax辅助分子(dnam-1)、肝配蛋白a型受体2(epha2)、成纤维细胞相关蛋白(fap)、gpl00/hla-a2、磷脂酰肌醇蛋白聚糖3(gpc3)、ha-ih、herk-v、il-1ira、潜伏膜蛋白1(lmp1)、神经细胞粘附分子(n-cam/cd56)、程序性细胞死亡受体配体1(pd-l1)、b细胞成熟抗原(bcma)和trail受体(trail r)。在某些实施方式中,所述第一和/或第二癌抗原选自5t4、epcam、her2、egfrviii和il13rα2,例如所述第一癌抗原是5t4。
14.在某些实施方式中,所述超抗原偶联物和免疫细胞(例如分离的免疫细胞)被分开施用。在某些实施方式中,所述超抗原偶联物和免疫细胞(例如分离的免疫细胞)联合施用。在某些实施方式中,所述超抗原偶联物和免疫细胞(例如分离的免疫细胞)同时施用。在某些实施方式中,所述超抗原偶联物和免疫细胞(例如分离的免疫细胞)在不同时间施用。
15.在某些实施方式中,所述方法还包括向所述受试者施用基于pd-1的抑制剂,例如
pd-1或pd-l1抑制剂。在某些实施方式中,所述pd-1抑制剂是抗pd-1抗体,例如选自纳武单抗、派姆单抗和西米普利单抗的抗pd-1抗体。在某些实施方式中,所述pd-l1抑制剂是抗pd-l1抗体,例如选自阿特珠单抗、阿维单抗和德瓦鲁单抗的抗pd-l1抗体。
16.另一方面,本发明提供了一种药物组合物,其包含:(i)超抗原偶联物,其包含与结合由所述受试者中的癌细胞表达的第一癌抗原的靶向部分共价连接的超抗原;(ii)免疫细胞(例如分离的免疫细胞),其包含编码结合由所述受试者中的癌细胞表达的第二癌抗原的嵌合抗原受体(car)的外源核苷酸序列;和(iii)药学上可接受的载体或稀释剂。另一方面,本发明提供了一种在有需要的受试者中治疗癌症的方法。所述方法包括向所述受试者施用有效量的上述药物组合物。
17.另一方面,本发明提供了一种扩增包含含有trbv7-9的t细胞受体的t细胞(例如分离的t细胞)的方法。所述方法包括将所述t细胞与下述物质接触:(i)包含葡萄球菌肠毒素a或其免疫反应性变体和/或片段的超抗原,和/或(ii)包含ii类主要组织相容性复合体(mhc)的细胞。在某些实施方式中,所述超抗原包含seq id no:3的氨基酸序列或其免疫反应性变体和/或片段。在某些实施方式中,所述包含ii类mhc的细胞是抗原呈递细胞(apc)。在某些实施方式中,所述包含ii类mhc的细胞是单核细胞和/或b细胞。
18.另一方面,本发明提供了一种生产用于治疗受试者的t细胞(例如分离的t细胞)的方法。所述方法包括将t细胞(例如从所述受试者分离的t细胞)与下述物质接触:(i)包含葡萄球菌肠毒素a或其免疫反应性变体和/或片段的超抗原,和/或(ii)包含ii类主要组织相容性复合体(mhc)的细胞。在某些实施方式中,所述超抗原包含seq id no:3的氨基酸序列或其免疫反应性变体和/或片段。在某些实施方式中,所述包含ii类mhc的细胞是抗原呈递细胞(apc)。在某些实施方式中,所述包含ii类mhc的细胞是单核细胞和/或b细胞。
19.另一方面,本发明提供了一种生产嵌合抗原受体(car)t细胞的方法。所述方法包括:(a)将t细胞(例如从所述受试者分离的t细胞)与下述物质接触:(i)包含葡萄球菌肠毒素a或其免疫反应性变体和/或片段的超抗原,和/或(ii)包含ii类主要组织相容性复合体(mhc)的细胞;和(b)修饰所述t细胞以包含编码嵌合抗原受体(car)的外源核苷酸序列。在某些实施方式中,所述超抗原包含seq id no:3的氨基酸序列或其免疫反应性变体和/或片段。在某些实施方式中,所述包含ii类mhc的细胞是抗原呈递细胞(apc)。在某些实施方式中,所述包含ii类mhc的细胞是单核细胞和/或b细胞。
20.另一方面,本发明提供了一种生产嵌合抗原受体(car)t细胞的方法。所述方法包括:(a)修饰t细胞(例如从所述受试者分离的t细胞)以包含编码嵌合抗原受体(car)的外源核苷酸序列;和(b)将所述t细胞与下述物质接触:(i)包含葡萄球菌肠毒素a或其免疫反应性变体和/或片段的超抗原,和/或(ii)包含ii类主要组织相容性复合体(mhc)的细胞。在某些实施方式中,所述超抗原包含seq id no:3的氨基酸序列或其免疫反应性变体和/或片段。在某些实施方式中,所述包含ii类mhc的细胞是抗原呈递细胞(apc)。在某些实施方式中,所述包含ii类mhc的细胞是单核细胞和/或b细胞。
21.另一方面,本发明提供了一种生产嵌合抗原受体(car)t细胞的方法。所述方法包括修饰t细胞(例如分离的t细胞)以包含编码嵌合抗原受体(car)的外源核苷酸序列,其中所述t细胞已与下述物质接触:(i)包含葡萄球菌肠毒素a或其免疫反应性变体和/或片段的超抗原,和/或(ii)包含ii类主要组织相容性复合体(mhc)的细胞。在某些实施方式中,所述
超抗原包含seq id no:3的氨基酸序列或其免疫反应性变体和/或片段。在某些实施方式中,所述包含ii类mhc的细胞是抗原呈递细胞(apc)。在某些实施方式中,所述包含ii类mhc的细胞是单核细胞和/或b细胞。
22.另一方面,本发明提供了一种生产嵌合抗原受体(car)t细胞的方法。所述方法包括将t细胞(例如分离的t细胞)与下述物质接触:(i)包含葡萄球菌肠毒素a或其免疫反应性变体和/或片段的超抗原,和/或(ii)包含ii类主要组织相容性复合体(mhc)的细胞,其中所述t细胞已被修饰以包含编码嵌合抗原受体(car)的外源核苷酸序列。在某些实施方式中,所述超抗原包含seq id no:3的氨基酸序列或其免疫反应性变体和/或片段。在某些实施方式中,所述包含ii类mhc的细胞是抗原呈递细胞(apc)。在某些实施方式中,所述包含ii类mhc的细胞是单核细胞和/或b细胞。
23.另一方面,本发明提供了通过任一上述方法生产的(i)t细胞(例如分离的t细胞),(ii)car t细胞(例如分离的car-t细胞),(iii)t细胞群体(例如分离的t细胞群体),或(iv)car t细胞群体(例如分离的car t细胞群体)。另一方面,本发明提供了一种在有需要的受试者中治疗癌症的方法。所述方法包括向所述受试者施用有效量的上述t细胞或car t细胞或t细胞或car t细胞的群体。在某些实施方式中,所述方法还包括向所述受试者施用有效量的超抗原偶联物,其包含与结合由所述受试者中的癌细胞表达的第一癌抗原的靶向部分共价连接的超抗原。在某些实施方式中,所述方法不包括向所述受试者施用有效量的超抗原偶联物,其包含与结合由所述受试者中的癌细胞表达的第一癌抗原的靶向部分共价连接的超抗原。
24.另一方面,本发明提供了一种包含t细胞(例如分离的t细胞)的药物组合物,其中至少10%的所述t细胞包含含有trbv7-9的t细胞受体。在某些实施方式中,至少20%、30%或40%的所述t细胞包含含有trbv7-9的t细胞受体。另一方面,本发明提供了一种在有需要的受试者中治疗癌症的方法。所述方法包括向所述受试者施用有效量的上述药物组合物。
25.另一方面,本发明提供了一种t细胞(例如分离的t细胞),其被修饰以相对于尚未修饰的t细胞具有提高的trbv7-9表达。在某些实施方式中,所述t细胞包含编码trbv7-9的外源核苷酸序列。在某些实施方式中,所述t细胞还包含编码嵌合抗原受体(car)的外源核苷酸序列。另一方面,本发明提供了一种在有需要的受试者中治疗癌症的方法。所述方法包括向所述受试者施用:(i)有效量的超抗原偶联物,其包含与结合由所述受试者中的癌细胞表达的第一癌抗原的靶向部分共价连接的超抗原;和/或(ii)有效量的上述t细胞。
26.在任一上述治疗癌症的方法的某些实施方式中,所述癌症选自表达5t4、间皮素、前列腺特异性膜抗原(psma)、前列腺干细胞抗原(pcsa)、碳酸酐酶ix(caix)、癌胚抗原(cea)、cd5、cd7、cd10、cd19、cd20、cd22、cd30、cd33、cd34、cd38、cd41、cd44、cd47、cd49f、cd56、cd74、cd123、cd133、cd138、上皮糖蛋白2(egp 2)、上皮糖蛋白-40(egp-40)、上皮细胞粘附分子(epcam)、叶酸结合蛋白(fbp)、胎儿乙酰胆碱受体(achr)、叶酸受体-a和β(fra和β)、神经节苷脂g2(gd2)、神经节苷脂g3(gd3)、表皮生长因子受体(egfr)、表皮生长因子受体2(her-2/erb2)、表皮生长因子受体viii(egfrviii)、erb3、erb4、人端粒酶反转录酶(htert)、白介素-13受体亚基α-2(il-13ra2)、k-轻链、激酶插入结构域受体(kdr)、lewis a(ca19.9)、lewis y(ley)、li细胞粘附分子(licam)、黑素瘤相关抗原1(黑素瘤抗原家族al、mage-a1)、粘蛋白16(muc-16)、粘蛋白1(muc-1)、kg2d配体、睾丸癌抗原ny-eso-1、肿瘤相关
糖蛋白72(tag-72)、血管内皮生长因子r2(vegf-r2)、肾母细胞瘤蛋白(wt-1)、1型酪氨酸蛋白激酶跨膜受体(ror1)、b7-h3(cd276)、b7-h6(nkp30)、硫酸软骨素蛋白聚糖-4(cspg4)、dnax辅助分子(dnam-1)、肝配蛋白a型受体2(epha2)、成纤维细胞相关蛋白(fap)、gpl00/hla-a2、磷脂酰肌醇蛋白聚糖3(gpc3)、ha-ih、herk-v、il-1ira、潜伏膜蛋白1(lmp1)、神经细胞粘附分子(n-cam/cd56)、程序性细胞死亡受体配体1(pd-l1)、b细胞成熟抗原(bcma)和trail受体(trail r)或其任何组合的癌症。在某些实施方式中,所述癌症选自表达5t4、epcam、her2、egfrviii和il13rα2的癌症,例如所述癌症是表达5t4的癌症。
27.在任一上述治疗癌症的方法的某些实施方式中,所述癌症包括实体肿瘤。在某些实施方式中,所述癌症选自乳腺癌、膀胱癌、宫颈癌、结肠癌、结肠直肠癌、子宫内膜癌、胃癌、头颈癌、肝癌、黑素瘤、间皮瘤、非小细胞肺癌、卵巢癌、胰腺癌、前列腺癌、肾细胞癌和皮肤癌。
28.本发明的这些和其他方面和特点描述在下面的详细描述和权利要求书中。
附图说明
29.参考下述附图可以更完全地理解本发明。
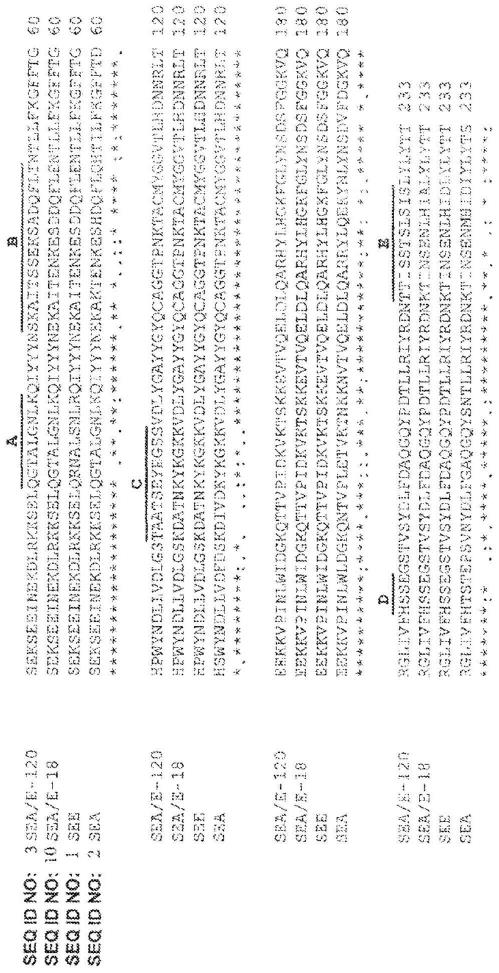
30.图1是示出了某些野生型和修饰的超抗原中的同源a-e区的序列比对。
31.图2是对应于包含两条蛋白链的示例性超抗原偶联物埃托-那普妥莫单抗/的氨基酸序列。所述第一蛋白链包含seq id no:7的第1至458位残基(也参见seq id no:8),并包括对应于seq id no:7的第1至222位残基的嵌合5t4 fab重链和对应于seq id no:7的第226至458位残基的sea/e-120超抗原,它们通过对应于seq id no:7的223-225位残基的ggp三肽连接物共价连接。所述第二链包含seq id no:7的第459至672位残基(也参见seq id no:9),并包括嵌合5t4 fab轻链。所述两条蛋白链通过所述fab重链与轻链之间的非共价相互作用结合在一起。
32.图3是示例性超抗原偶联物埃托-那普妥莫单抗/的示意图。
33.图4是条形图,说明了car t细胞与靶向肿瘤的超抗原埃托-那普妥莫单抗(“nap”)的组合对头颈部肿瘤细胞系fadu的存活率的影响。fadu细胞的存活率在存在或不存在nap(0.1ng/ml)的情况下与her2 car t细胞(“car t”)或阴性对照car t细胞(“t细胞”)共培养4小时后测量。将存活率归一化到未处理的对照(“无t细胞”)。从左至右示出了下述结果:未处理的对照(“无t细胞”);无nap的阴性对照car t细胞(“t细胞”);使用0.1ng/ml nap的阴性对照car t细胞(“t细胞”);无nap的用0.25μg car mrna电转化的her2 car t细胞(“car t”);和使用0.1ng/ml nap的用0.25μg car mrna电转化的her2 car t细胞(“car t”)。平均值
±
sd;单向anova(***p=0.0007,相比于对照;****p《0.0001,相比于所有测试组;ns=不显著);#=在αcd3和αcd28抗体存在下生长的car t细胞;&=在nap存在下生长的car t细胞或t细胞。
34.图5说明了不同car t细胞活化方法对car表达的影响。通过流式细胞术分析带有myc标签的car在活化的car t细胞中的表达。所述表示出了平均荧光强度(mfi),其指示了在所指示的活化方法后的car表达。
35.图6说明了在所指示的活化条件下生长的表达trbv7-9的cd8
+ t细胞的百分率。将trbv7-9用nap-pe多聚体染色并通过流式细胞术进行分析。
36.图7是条形图,说明了不同car t细胞活化方法对car t细胞活性的影响,所述活性通过头颈部肿瘤细胞系fadu在car t细胞处理后的存活率来度量。在与已用所指示的方法活化的her2 car t细胞共培养4小时后,测量fadu细胞的存活率。将存活(存活率)归一化到未处理的对照(“无car t细胞”)。从左至右示出了下述结果:未处理的对照(“无car t细胞”);在αcd3和il2存在下生长的car t细胞;在αcd3、αcd28和il2存在下生长的car t细胞;在nap(1μg/ml)和il2存在下生长的car t细胞;和在nap(10μg/ml)和il2存在下生长的car t细胞。n=4;平均值
±
sd;单向anova(****p《0.0001,相比于cd3或cd3/cd28)。
37.图8说明了不同car t细胞活化方法对infγ和脱粒标志物cd107a的表达的影响。将fadu肿瘤细胞与通过所指示的方法活化的cd8
+
car t细胞温育4小时。将对照t细胞在没有任何靶细胞的情况下单独温育。随后,将cd8
+
car t细胞染色,并通过流式细胞术分析infγ和cd107a表达(图8a)。呈现了表达ifnγ(图8b,左)和cd107a(图8b,右)的cd8+car t细胞的百分率。从左至右示出了下述结果:在αcd3和il2存在下生长的car t细胞;在αcd3、αcd28和il2存在下生长的car t细胞;在nap(1μg/ml)和il2存在下生长的car t细胞;和在nap(10μg/ml)和il2存在下生长的car t细胞。
38.图9是条形图,说明了car t细胞与nap或未偶联的葡萄球菌肠毒素超抗原(sea)的组合对头颈部肿瘤细胞系fadu的存活率的影响。在与已用所指示的方法活化的her2 car t细胞共培养4小时后,测量fadu细胞的存活率。将存活(存活率)归一化到未处理的对照(“无car t细胞”)。从左至右示出了下述结果:无t细胞处理(“对照”);无nap或sea的car t细胞(“car t”);使用0.01ng/ml nap的car t细胞(“car t+nap”);使用0.01ng/ml sea的car t细胞(“car t+sea”)。平均值
±
sd;单向anova(****p《0.0001,相比于所有测试组;ns=不显著);#=在αcd3和αcd28抗体存在下生长的car t细胞;&=在10μg/ml nap存在下生长的car t细胞;λ=在10ng/ml sea存在下生长的car t细胞。
39.详细描述
40.本发明部分是基于下述发现,即通过将包含与结合癌抗原的靶向部分共价连接的超抗原(例如工程化葡萄球菌肠毒素超抗原sea/e-120)的超抗原偶联物与免疫细胞(例如t细胞,例如嵌合抗原受体(car)t细胞)联合,可以增强受试者中针对癌症的靶向免疫应答。此外已发现,使用超抗原偶联物和免疫细胞的抗癌治疗,可以通过使用表达与所述超抗原结合的t细胞受体(例如包含t细胞受体β可变区7-9(trbv7-9)的t细胞受体)的免疫细胞来增强。
41.因此,一方面,本发明提供了一种在有需要的受试者中治疗癌症的方法。所述方法包括向所述受试者施用:(i)有效量的超抗原偶联物,其包含与结合由所述受试者中的癌细胞表达的第一癌抗原的靶向部分共价连接的超抗原;和(ii)有效量的免疫细胞(例如分离的免疫细胞),其包含编码结合由所述受试者中的癌细胞表达的第二癌抗原的嵌合抗原受体(car)的外源核苷酸序列。
42.另一方面,本发明提供了一种药物组合物,其包含:(i)超抗原偶联物,其包含与结合由所述受试者中的癌细胞表达的第一癌抗原的靶向部分共价连接的超抗原;(ii)免疫细胞(例如分离的免疫细胞),其包含编码结合由所述受试者中的癌细胞表达的第二癌抗原的嵌合抗原受体(car)的外源核苷酸序列;和(iii)药学上可接受的载体或稀释剂。另一方面,本发明提供了一种在有需要的受试者中治疗癌症的方法。所述方法包括向所述受试者施用
有效量的上述药物组合物。
43.另一方面,本发明提供了一种扩增包含含有trbv7-9的t细胞受体t细胞(例如分离的t细胞)的方法。所述方法包括将所述t细胞与下述物质接触:(i)包含葡萄球菌肠毒素a或其免疫反应性变体和/或片段的超抗原,和/或(ii)包含ii类主要组织相容性复合体(mhc)的细胞。
44.另一方面,本发明提供了一种生产用于治疗受试者的t细胞(例如分离的t细胞)的方法。所述方法包括将t细胞(例如从所述受试者分离的t细胞)与下述物质接触:(i)包含葡萄球菌肠毒素a或其免疫反应性变体和/或片段的超抗原,和/或(ii)包含ii类主要组织相容性复合体(mhc)的细胞。
45.另一方面,本发明提供了一种生产嵌合抗原受体(car)t细胞的方法。所述方法包括:(a)将t细胞(例如从所述受试者分离的t细胞)与下述物质接触:(i)包含葡萄球菌肠毒素a或其免疫反应性变体和/或片段的超抗原,和/或(ii)包含ii类主要组织相容性复合体(mhc)的细胞;和(b)修饰所述t细胞以包含编码嵌合抗原受体(car)的外源核苷酸序列。
46.另一方面,本发明提供了一种生产嵌合抗原受体(car)t细胞的方法。所述方法包括:(a)修饰t细胞(例如从所述受试者分离的t细胞)以包含编码嵌合抗原受体(car)的外源核苷酸序列;和(b)将所述t细胞与下述物质接触:(i)包含葡萄球菌肠毒素a或其免疫反应性变体和/或片段的超抗原,和/或(ii)包含ii类主要组织相容性复合体(mhc)的细胞。
47.另一方面,本发明提供了一种生产嵌合抗原受体(car)t细胞的方法。所述方法包括修饰t细胞(例如分离的t细胞)以包含编码嵌合抗原受体(car)的外源核苷酸序列,其中所述t细胞已与下述物质接触:(i)包含葡萄球菌肠毒素a或其免疫反应性变体和/或片段的超抗原,和/或(ii)包含ii类主要组织相容性复合体(mhc)的细胞。
48.另一方面,本发明提供了一种生产嵌合抗原受体(car)t细胞的方法。所述方法包括将t细胞(例如分离的t细胞)与下述物质接触:(i)包含葡萄球菌肠毒素a或其免疫反应性变体和/或片段的超抗原,和/或(ii)包含ii类主要组织相容性复合体(mhc)的细胞,其中所述t细胞已被修饰以包含编码嵌合抗原受体(car)的外源核苷酸序列。
49.另一方面,本发明提供了一种通过任一上述方法生产的t细胞(例如分离的t细胞)或car t细胞(例如分离的car t细胞)。另一方面,本发明提供了一种通过任一上述方法生产的t细胞群体(例如分离的t细胞群体)或car t细胞群体(例如分离的car t细胞群体)。另一方面,本发明提供了一种在有需要的受试者中治疗癌症的方法。所述方法包括向所述受试者施用有效量的上述t细胞或car t细胞或t细胞或car t细胞的群体。在某些实施方式中,所述方法还包括向所述受试者施用有效量的超抗原偶联物,其包含与结合由所述受试者中的癌细胞表达的第一癌抗原的靶向部分共价连接的超抗原。在某些实施方式中,所述方法不包括向所述受试者施用有效量的超抗原偶联物,其包含与结合由所述受试者中的癌细胞表达的第一癌抗原的靶向部分共价连接的超抗原。
50.另一方面,本发明提供了一种包含t细胞(例如分离的t细胞)的药物组合物,其中至少10%的所述t细胞包含含有trbv7-9的t细胞受体。另一方面,本发明提供了一种在有需要的受试者中治疗癌症的方法。所述方法包括向所述受试者施用有效量的上述药物组合物。
51.另一方面,本发明提供了一种t细胞(例如分离的t细胞),其被修饰以相对于尚未
修饰的t细胞具有提高的trbv7-9表达。在某些实施方式中,所述t细胞包含编码trbv7-9的外源核苷酸序列。另一方面,本发明提供了一种在有需要的受试者中治疗癌症的方法。所述方法包括向所述受试者施用:(i)有效量的超抗原偶联物,其包含与结合由所述受试者中的癌细胞表达的第一癌抗原的靶向部分共价连接的超抗原;和/或(ii)有效量的上述t细胞。
52.在下文中更详细讨论了本发明的各种不同特点和方面。
53.i.定义
54.除非另有定义,否则本文中使用的技术和科学术语均具有与本发明所属领域的普通技术人员通常理解的相同的含义。出于本发明的目的,在下文中定义了下述术语。
55.当在本文中使用时,没有具体数目的指称可以意味着一个或多个。例如诸如“使用超抗原和免疫细胞的治疗”可以意味着使用一种超抗原和免疫细胞、使用超过一种超抗原和一种免疫细胞、使用一种超抗原和超过一种免疫细胞或使用超过一种超抗原和超过一种免疫细胞的治疗。
56.当在本文中使用时,除非另有指明,否则术语“抗体”被理解为意味着完整抗体(例如完整的单克隆抗体)或抗体的抗原结合片段,包括已被优化、工程化改造或化学偶联的抗体(例如包括全人抗体在内的噬菌体展示抗体、半合成抗体或全合成抗体)的完整抗体或抗原结合片段。已被优化的抗体的实例是亲和成熟的抗体。已被工程化改造的抗体的实例是fc优化抗体、被工程化改造以降低免疫原性的抗体和多特异性抗体(例如双特异性抗体)。抗原结合片段的实例包括fab、fab’、f(ab’)2、fv、单链抗体(例如scfv)、微抗体和双体抗体。与毒素组成部分偶联的抗体是化学偶联的抗体的实例。
57.当在本文中使用时,术语“癌症”和“癌性”被理解为意味着哺乳动物中通常以不受调控的细胞生长为特征的生理状况。癌症的实例包括但不限于黑素瘤、上皮癌、淋巴瘤、母细胞瘤、肉瘤和白血病或淋巴恶性肿瘤。癌症的更具体实例包括鳞状细胞癌(例如上皮鳞状细胞癌)、包括小细胞肺癌、非小细胞肺癌、肺腺癌和肺鳞癌在内的肺癌、腹膜癌、肝细胞癌、包括胃肠癌在内的胃癌、胰腺癌、成胶质细胞瘤、宫颈癌、卵巢癌、肝癌、膀胱癌、肝细胞瘤、乳腺癌、结肠癌、直肠癌、结肠直肠癌、骨癌、脑癌、成视网膜细胞瘤、子宫内膜癌或子宫癌、唾液腺癌、肾癌、前列腺癌、外阴癌、甲状腺癌、肝癌、肛门癌、阴茎癌、睾丸癌以及头颈癌、牙龈癌或舌癌。所述癌症包含癌或癌细胞,例如所述癌症可能包含多个个体癌或癌细胞,例如白血病或包含多个相关的癌或癌细胞的肿瘤。
58.当在本文中使用时,术语“难治的”是指对治疗无反应或不再有反应的癌症。在某些实施方式中,难治性癌症可以在治疗之前或开始时对所述治疗有抗性。在其他实施方式中,所述难治性癌症可以在治疗期间或之后变得有抗性。难治性癌症也被称为耐药性癌症。当在本文中使用时,术语“复发”是指在对先前的治疗有反应(例如肿瘤负荷降低、肿瘤体积减小、肿瘤转移减少或指示对治疗的阳性反应的生物标志物的调节)之后,难治性癌症或难治性癌症的体征或症状的回归。
59.当在本文中使用时,术语“免疫原”是激起(唤起、诱导或引起)免疫应答的分子。这种免疫应答可能涉及抗体产生、某些细胞例如特异性免疫活性细胞的激活或两者。免疫原可能源自于许多类型的物质,例如但不限于来自于生物体的分子如蛋白质、蛋白质亚基、被杀死或失活的全细胞或裂解物、合成分子和广泛类型的其他生物和非生物制剂。应该理解,基本上任何大分子(包括天然存在的大分子或通过重组dna方法产生的大分子),包括几乎
所有蛋白质,都可以充当免疫原。
60.当在本文中使用时,术语“免疫原性”是指免疫原激起(唤起、诱导或引起)免疫应答的能力。不同分子可能具有不同程度的免疫原性,并且例如已知与另一个分子相比具有更大免疫原性的分子能够激起(唤起、诱导或引起)与具有较低免疫原性的药剂相比更大的免疫应答。
61.当在本文中使用时,术语“抗原”在本文中用于指称被抗体、特异性免疫活性细胞或两者识别的分子。抗原可能源自于许多类型的物质,例如都不限于来自于生物体的分子例如蛋白质、蛋白质亚基、核酸、脂类、被杀死或失活的全细胞或裂解物、合成分子和广泛类型的其他生物和非生物制剂。
62.当在本文中使用时,术语“抗原性”是指抗原被抗体、特异性免疫活性细胞或两者识别的能力。
63.当在本文中使用时,术语“表位扩散”是指免疫应答的表位特异性从针对抗原的初始表位特异性免疫应答多样化到针对该抗原(分子内扩散)或其他抗原(分子间扩散)上的其他表位。表位扩散允许受试者的免疫系统对原始治疗方案做出响应来确定最初未被免疫系统识别的额外的靶表位,同时降低肿瘤群体中逃逸变体的可能性,并因此影响疾病的进展。
64.当在本文中使用时,术语“免疫应答”是指免疫系统的细胞例如b细胞、t细胞(cd4+或cd8+)、调节性t细胞、抗原呈递细胞、树突状细胞、单核细胞、巨噬细胞、nkt细胞、nk细胞、嗜碱性粒细胞、嗜酸性粒细胞或中性粒细胞对刺激的应答。在某些实施方式中,所述应答特异性针对特定抗原(“抗原特异性应答”),并且是指cd4+ t细胞、cd8+ t细胞或b细胞通过它们的抗原特异性受体产生的应答。在某些实施方式中,免疫应答是t细胞应答,例如cd4+应答或cd8+应答。由这些细胞产生的应答可以包括例如细胞毒性、增殖、细胞因子或趋化因子的产生、运输或胞吞作用,并且可以取决于经历应答的免疫细胞的本质。
65.当在本文中使用时,术语“主要组织相容性复合物”或“mhc”是指特定基因簇,它们中的许多编码参与抗原呈递的进化相关细胞表面蛋白,它们是组织相容性的重要决定因素。i类mhc或mhc-i的主要功能是将抗原呈递到cd8
+ t淋巴细胞(cd8
+ t细胞)。ii类mhc或mhc-ii的主要功能是将抗原呈递到cd4
+ t淋巴细胞(cd4
+ t细胞)。
66.当在本文中使用时,术语“衍生”例如“衍生自”包括但不限于例如衍生自生物宿主例如细菌、病毒和真核细胞和生物体的野生型分子,以及修饰的分子例如通过化学手段修饰或在重组表达系统中生产的分子。
67.当在本文中使用时,术语“血清反应”或“血清反应性”被理解为意味着药剂例如分子与哺乳动物例如但不限于人类的血清中的抗体反应的能力。这包括与所有类型的抗体的反应,例如特异性针对所述分子的抗体和与所述分子结合的非特异性抗体,不论所述抗体是否失活或中和所述药剂。正如本领域中已知的,不同药剂相对于彼此可能具有不同的血清反应性,其中与另一种药剂相比具有更低血清反应性的药剂,与具有更高血清反应性的药剂相比将例如与更少的抗体反应和/或对抗体具有更低的亲和性和/或亲和力。这可能也包括所述药剂在动物例如哺乳动物如人类中引发抗体免疫应答的能力。
68.当在本文中使用时,术语“可溶性t细胞受体”或“可溶性tcr”被理解为意味着包含全长(例如膜结合)受体的链的“可溶性”t细胞受体,区别在于所述受体链的跨膜区被缺失
或突变,使得所述受体在被细胞表达时将不插入到膜中、横跨膜或以其他方式与膜结合。可溶性t细胞受体可能只包含野生型受体的细胞外结构域或所述结构域的细胞外片段(例如缺少跨膜和胞质结构域)。
69.当在本文中使用时,术语“超抗原”被理解为意味着通过与ii类mhc分子和t细胞受体的vβ结构域结合而刺激一部分t细胞,从而激活表达特定vβ基因区段的t细胞的一类分子。所述术语包括天然存在的野生型超抗原例如从某些细菌分离或从所述细菌的未修饰的基因表达的超抗原,以及修饰的超抗原,其中例如编码超抗原的dna序列已例如通过遗传工程进行修饰,以例如产生与靶向部分融合的蛋白,和/或改变所述超抗原的某些性质例如但不限于它的ii类mhc结合(例如降低亲和性)和/或它的血清反应性和/或它的免疫原性和/或抗原性(例如降低它的血清反应性)。所述定义包括在本文中或在下述美国专利和专利申请中描述的野生型和修饰的超抗原及其任何免疫反应性变体和/或片段:美国专利号5,858,363、6,197,299、6,514,498、6,713,284、6,692,746、6,632,640、6,632,441、6,447,777、6,399,332、6,340,461、6,338,845、6,251,385、6,221,351、6,180,097、6,126,945、6,042,837、6,713,284、6,632,640、6,632,441、5,859,207、5,728,388、5,545,716、5,519,114、6,926,694、7,125,554、7,226,595、7,226,601、7,094,603、7,087,235、6,835,818、7,198,398、6,774,218、6,913,755、6,969,616和6,713,284,美国专利申请号2003/0157113、2003/0124142、2002/0177551、2002/0141981、2002/0115190、2002/0051765和2001/0046501,以及pct国际公开号wo/03/094846。
70.当在本文中使用时,术语“靶向部分”是指能够与细胞分子例如细胞表面分子、优选为疾病特异性分子例如优选地在癌症(或癌性)细胞上表达的抗原结合的任何结构、分子或组成部分。示例性的靶向部分包括但不限于抗体(包括其抗原结合片段)等、可溶性t细胞受体、白介素、激素和生长因子。
71.当在本文中使用时,术语“靶向肿瘤的超抗原”或“tts”或“靶向癌症的超抗原”被理解为意味着包含与一个或多个靶向部分共价连接(直接或间接地)的一个或多个超抗原的分子。
72.当在本文中使用时,术语“t细胞受体”被理解为意味着t细胞特有的受体,并包括本领域中已知的对所述术语的理解。所述术语还包括例如包含在细胞膜处表达的高度可变的α或β链的二硫键连接的异二聚体的作为与不变的cd3链的复合体的受体,以及由在细胞膜处表达的可变的γ和δ链组成的在一部分t细胞上作为与cd3的复合体的受体。
73.当在本文中使用时,术语“治疗有效量”和“有效量”被理解为意味着活性药剂例如药物活性药剂或药物组合物的在治疗疾病或病症中至少产生一定效果的量。用于实践本发明以用于治疗性治疗的药物活性药剂的有效量随着施用方式、受试者的年龄、体重和总体健康而变。有效量可以在一次或多次施用、应用或剂量中施用,并且不打算限于特定制剂或施用途径。
74.当在本文中使用时,术语“受试者”和“患者”是指将要通过本文中描述的方法和组合物治疗的生物体。这些生物体优选地包括但不限于哺乳动物(例如鼠科、猴科、马科、牛科、猪科、犬科、猫科动物等),更优选地包括人类。
75.当在本文中使用时,术语“治疗”被理解为意味着在哺乳动物例如在人类中治疗疾病。这包括:(a)抑制所述疾病,即停止其发展;和(b)缓解所述疾病,即引起疾病状态的消
退;和(c)置于所述疾病。当在治疗性治疗的情形中使用时,术语“阻止”或“阻断”被理解为完全阻止或阻断或不完全阻止或阻断(例如部分阻止或阻断)给定的行为、行动、活性或事件。
76.当在本文中使用时,术语“抑制癌症生长”被理解为意味着在体外或体内可测量地减缓、停止或逆转癌症或癌细胞的生长速率。理想情况下,所述生长速率被减缓20%、30%、50%或70%或更多,正如使用用于确定细胞生长速率的适合的测定法所确定的。通常,生长速率的逆转通过在肿瘤细胞中启动或加速细胞死亡的坏死或凋亡机制来实现,引起肿瘤的萎缩。
77.当在本文中使用时,术语“变体”、“修饰的”、“改变的”、“突变的”等被理解为意味着与参比蛋白质、肽或其他化合物不同的蛋白质或肽和/或其他药剂和/或化合物。这种意义上的变体在下文和本文中别处更详细描述。例如,所述变体的核酸序列变化可能是沉默的,例如它们不改变由所述核酸序列编码的氨基酸。在改变限于这种类型的沉默变化的情况下,变体将编码与参比肽具有相同氨基酸序列的肽。变体的核酸序列的变化可能改变由所述参比核酸序列编码的肽的氨基酸序列。这种核酸变化可能引起由所述参比序列编码的蛋白质或肽中的氨基酸替换、添加、缺失、融合和/或截短,正如下文讨论的。通常,氨基酸序列的差异有限,使得所述参比和变体的序列总体上相近并且在许多区域中相同。变体和参比蛋白质或肽的氨基酸序列可能相差一个或多个替换、添加、缺失、融合和/或截短,它们可以以任何组合存在。变体也可能是本发明的蛋白质或肽的片段,它们与参比蛋白质或肽序列的差异在于比所述参比序列更短,例如通过末端或内部缺失。本发明的蛋白质或肽的另一种变体还包括基本上保留了与所述参比蛋白质或肽相同的功能或活性的蛋白质或肽。变体还可能是:(i)其中一个或多个氨基酸残基被保守或非保守氨基酸残基替换的变体,并且这个被替换的氨基酸残基可能是也可能不是由遗传密码编码的残基,或(ii)其中一个或多个氨基酸残基包括取代基的变体,或(iii)其中成熟蛋白质或肽与另一种化合物、例如增加所述蛋白质或肽的半衰期的化合物(例如聚乙二醇)融合的变体,或(iv)其中将另外的氨基酸例如前导或分泌序列或用于成熟蛋白质或肽的纯化的序列融合到所述成熟蛋白质或肽的变体。变体可以通过诱变技术和/或改变机制例如化学改变、融合、附接等,包括适用于核酸、氨基酸、细胞或生物体的此类技术或机制来制造,和/或可以通过重组手段来制造。
78.当在本文中使用时,术语“顺序施用”和相关术语是指至少一种药剂(例如超抗原偶联物)和至少一种其他药剂(例如免疫细胞)的相伴施用,并包括这些药剂的交错施用(即时间交错)和剂量的变化。这包括一种药剂在另一种药剂施用之前、重叠(部分或完全地)或之后施用。此外,术语“顺序施用”和相关术语还包括施用至少一种超抗原、一种免疫细胞和一种或多种任选的其他化合物,例如皮质类固醇、免疫调节剂和被设计用于降低对施用到所述受试者的超抗原偶联物的潜在免疫反应性的另一种药剂。
79.当在本文中使用时,术语“系统的”和“系统地”在施用的背景中被理解为意味着药剂的施用使得所述药剂暴露于与整个身体相关的至少一个系统例如但不限于循环系统、免疫系统和淋巴系统,而不是仅暴露于身体的局部部位例如但不限于肿瘤内。因此,例如,系统疗法或系统性施用的药剂是其中与整个身体相关的至少一个系统而不是相反只有靶组织暴露于所述疗法或药剂的疗法或药剂。
80.当在本文中使用时,术语“肠胃外施用”包括化合物在不涉及通过肠道吸收的情况
下被吸收到受试者中的任何施用形式。在本发明中使用的示例性肠胃外施用包括但不限于肌肉内、静脉内、腹膜内或关节内施用。
81.在定量值之前使用术语“约”的情况下,除非另有具体陈述,否则本发明还包括所述特定定量值本身。当在本文中使用时,除非另有指明或推断,否则术语“约”是指与标称值相差
±
10%。
82.在本说明书中的各个不同地方,值被成组或以范围公开。具体来说,这种描述打算包括这些组和范围的成员的每一种单独的子组合。例如,0至40的范围内的整数具体来说打算单个地公开0、1、2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、21、22、23、24、25、26、27、28、29、30、31、32、33、34、35、36、37、38、39和40,并且1至20范围内的整数具体来说打算单个地公开1、2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19和20。
83.在整个本说明书中,在组合物被描述为具有、包括或包含特定组分的情况下,或者在过程和方法被描述为具有、包括或包含特定步骤的情况下,设想了另外存在基本上由所述叙述的组分组成或由其组成的本发明的组合物,并且存在基本上由所述叙述的过程步骤组成或由其组成的本发明的过程和方法。
84.在本技术中,在要素或组分被称为是包括在叙述的要素或组分的列表中或选自所述列表的情况下,应该理解所述要素或组分可以是所述叙述的要素或组分中的任一者,或者所述要素或组分可以选自所述叙述的要素或组分中的两者或更多种。
85.此外应该理解,本文中描述的组合物或方法的要素和/或特点可以以各种不同方式组合而不背离本发明的精神和范围,无论在本文中是明示还是暗示。例如,在提及特定化合物时,该化合物可用于本发明的组合物的各种不同实施方式中和/或本发明的方法中,除非从上下文另有理解。换句话说,在本技术中,实施方式以能够撰写和绘制清晰简洁的申请的方式描述和描绘,但意图是并且应该认识到实施方式可以进行各种不同的组合或分离,而不背离本教导和发明。例如应该认识到,本文中描述和描绘的所有特点可以适用于本文中描述和描绘的本发明的所有方面。
86.应该理解,表述
“……
中的至少一种”包括在所述表述之后叙述的对象中的每一者和所述叙述的对象中的两者或更多者的各种不同组合,除非从上下文和使用中另有理解。与三个或更多个叙述的对象相结合的表述“和/或”应该被理解为具有相同的含义,除非从上下文另有理解。
87.术语“包括”、“具有”或“含有”,包括其语法同义语的使用,通常应该被理解为是开放性和非限制性的,例如不排除另外的未叙述的要素或步骤,除非另有具体陈述或从上下文另有理解。
88.应当理解,只要本发明仍可操作,步骤的顺序或执行某些行动的顺序并不重要。此外,两个或更多个步骤或行动可以同时进行。
89.本文中任何和所有的实例或示例性语言例如“诸如”或“包括”的使用,仅旨在更好地说明本发明,并且除非宣称,否则不对本发明的范围构成限制。本说明书中的任何语言都不应被解释为表明任何未要求保护的要素对于本发明的实践是必不可少的。
90.ii.免疫细胞
91.除其他事项外,本发明提供了:(i)包含可用于治疗癌症的免疫细胞的方法和组合物,其中所述免疫细胞可以单独使用或与超抗原偶联物联合使用,和(ii)可用于治疗癌症
的免疫细胞的制造方法。
92.免疫细胞包括例如淋巴细胞例如b细胞和t细胞、自然杀伤细胞(nk细胞)、自然杀伤t细胞(nkt细胞)、髓样细胞例如单核细胞、巨噬细胞、嗜酸性粒细胞、肥大细胞、嗜碱性粒细胞和粒细胞。
93.在某些实施方式中,所述免疫细胞是t细胞,其可以是例如培养的t细胞,例如原代t细胞或来自于培养的t细胞系的t细胞例如jurkat、supti等,或从哺乳动物例如从待治疗的受试者获得的t细胞。如果从哺乳动物获得,所述t细胞可以从大量来源获得,包括但不限于血液、骨髓、淋巴结、胸腺或其他组织或体液。t细胞也可以被富集或纯化。所述t细胞可以是任何类型的t细胞,并且可以处于任何发育阶段,包括但不限于cd4+/cd8+双阳性t细胞、cd4+辅助性t细胞例如th1和th2细胞、cd4+ t细胞、cd8+ t细胞(例如细胞毒性t细胞)、肿瘤浸润淋巴细胞(til)、记忆t细胞(例如中央记忆t细胞和效应记忆t细胞)、初始t细胞等。所述细胞(例如t细胞)可以包括源自于待治疗的受试者的自体细胞或源自于供体的同种异体细胞。
94.在某些实施方式中,所述t细胞通过t细胞受体结合抗原例如癌抗原。所述t细胞受体可以是内源或重组t细胞受体。t细胞受体包含被称为α-和β-链的两条链,它们在t细胞表面上组合,以形成可以识别mhc限制性抗原的异二聚体受体。α-和β-链中的每一者包含两个区域,即恒定区和可变区。α-和β-链的每个可变区定义了三个被称为互补决定区(cdr)的环,即cdr1、cdr2和cdr3,它们为t细胞受体提供了抗原结合活性和结合特异性。
95.在某些实施方式中,所述免疫细胞包含含有t细胞受体β可变区7-9(trbv7-9)的t细胞受体。trbv7-9的示例性氨基酸序列描绘在seq id no:11中,编码trbv7-9的示例性核苷酸序列描绘在seq id no:12中。术语trbv7-9包括相对于野生型trbv7-9序列具有一个或多个氨基酸替换、缺失或插入的变体,和/或包括trbv7-9的融合蛋白或偶联物。当在本文中使用时,术语trbv7-9的“功能性片段”是指全长trbv7-9的保留了相应的全长、天然存在的trbv7-9的例如至少10%、至少20%、至少30%、至少40%、至少50%、至少60%、至少70%、至少80%、至少90%或100%的sea/e-120结合活性的片段。
96.设想了在包含免疫细胞例如t细胞(其包含含有t细胞受体β可变区7-9(trbv7-9)的t细胞受体)的药物组合物中,至少约2%、至少约5%、至少约10%、至少约20%、至少约30%、至少约40%、至少约50%、至少约60%、至少约70%、至少约80%、至少约90%或约100%的细胞可能包含含有trbv7-9的t细胞受体。例如,在某些实施方式中,约2%至约100%、约5%至约100%、约10%至约100%、约20%至约100%、约30%至约100%、约40%至约100%、约60%至约100%、约80%至约100%、约2%至约80%、约5%至约80%、约10%至约80%、约20%至约80%、约30%至约80%、约40%至约80%、约60%至约80%、约2%至约60%、约5%至约60%、约10%至约60%、约20%至约60%、约30%至约60%、约40%至约60%、约2%至约40%、约5%至约40%、约10%至约40%、约20%至约40%、约30%至约40%、约2%至约30%、约5%至约30%、约10%至约30%、约20%至约30%、约2%至约20%、约5%至约20%、约10%至约20%、约2%至约10%、约5%至约10%、或约2%至约5%的细胞包含含有trbv7-9的t细胞受体。
97.在某些实施方式中,所述免疫细胞例如t细胞或nkt细胞通过嵌合抗原受体(car)与抗原例如癌抗原结合,即所述t细胞或nkt细胞包含编码car的外源核苷酸序列。当在本文
中使用时,术语“嵌合抗原受体”或“car”是指包括抗原特异性结合组成部分和源自于免疫受体的一个或多个信号传导链的任何人工受体。car可以包含特异性针对抗原的抗体的单链可变片段(scfv),其通过铰链和跨膜区偶联到t细胞信号传导分子的胞质结构域(例如与t细胞触发结构域(例如来自于cd3ζ)串联的t细胞共刺激结构域(例如来自于cd28、cd137、ox40、icos或cd27))和/或偶联到的nk细胞信号传导分子(例如dnax活化蛋白12(dap12))的胞质结构域。表达嵌合抗原受体的t细胞被称为car t细胞,表达嵌合抗原受体的nk细胞被称为car nk细胞,表达嵌合抗原受体的nkt细胞被称为car nkt细胞。
98.示例性car t细胞包括靶向cd19的ctl019细胞(novartis;参见grupp等,(2015)blood 126:4983)、jcar014(juno therapeutics)、jcar015/19-28z细胞(juno therapeutics;参见park等,(2015)j.clin.oncol.33(15s):7010)、jcar017细胞(juno therapeutics)、kte-c19细胞(kite pharma;参见locke等,(2015)blood 126:3991)和ucart19细胞(cellectis;参见gouble等,(2014)blood 124:4689)。其他示例性的靶向cd19的car或靶向cd19的car t细胞描述在美国专利号7,446,179、8,399,645、美国专利公开号us20130071414、us20140370045、us20140271635、us20170166623、us20150283178和us20170107286、国际(pct)公开号wo2009091826、wo2012079000、wo2014153270、wo2014184143、wo2015095895、wo2016210293、wo2016139487和wo2016100232,以及makita等,(2017)cancer science108(6):1109-1118;brentjens等,(2011)blood 118(18):4817;davila等,(2014)sci.transl.med.6(224):224;lee等,(2015)lancet 385(9967):517;brentjens等,(2013)sci.transl.med.5(177):177;grupp等,(2013)n.engl.j.med.368(16):1509;porter等,(2011)n.engl.j.med.365(8):725;kochenderfer等,(2013)blood;和kalos等,(2011)sci.transl.med.3(95):95中。示例性的靶向间皮素的car t细胞描述在国际(pct)公开号wo2013142034、wo2015188141和wo2017040945中。其他示例性的car或car t细胞描述在美国专利号5,712,149、5,906,936、5,843,728、6,083,751、6,319,494、7,446,190、7,741,965、8,399,645、8,906,682、9,181,527、9,272,002和9,266,960、美国专利公布号us20160362472、us20160200824和us20160311917以及国际(pct)公开号wo2015120180中。含有t细胞受体敲除和结合cd123的嵌合抗原受体的工程化免疫细胞描述在国际(pct)公开号wo2016120220中。
99.car t细胞可以使用本领域中已知的方法来产生。t细胞可以从大量来源获得,包括外周血单核细胞、骨髓、淋巴结组织、脐带血、胸腺组织、来自于感染部位的组织、腹水、胸腔积液、脾组织、肿瘤和t细胞系。例如,t细胞可以从使用专业技术人员已知的任何技术例如ficoll
tm
分离从受试者收集的血液单位获得。在某些实施方式中,通过单采从个体的循环血获得细胞。所述单采产物通常含有淋巴细胞包括t细胞、单核细胞、粒细胞、b细胞、其他有核白细胞、红细胞和血小板。可以对通过单采收集的细胞进行清洗以除去血浆级分,并将细胞置于适合的缓冲液或介质中,用于后续处理步骤。例如,可以将所述细胞用磷酸盐缓冲盐水(pbs)清洗。在清洗后,可以将所述细胞重悬浮在各种不同的生物相容性缓冲液例如无ca
2+
或无mg
2+
pbs、plasmalyte a或其他盐水和/或缓冲溶液中。t细胞也可以通过裂解红细胞并例如通过percoll
tm
梯度进行离心或通过反向流离心淘析以剥离单核细胞,从外周血淋巴细胞分离。可以通过正或负选择技术进一步分离t细胞的特定亚群例如cd3+、cd28+、cd4+、cd8+、cd45ra+和cd45ro+ t细胞。例如,在一个实施方式中,通过与抗cd3抗体/抗cd28抗
体偶联的珠子例如m-450cd3/cd28(thermo fisher scientific)温育一段足以正选择所需t细胞的时间,来分离t细胞。
100.可以通过本领域已知的方法对t细胞进行工程化改造以表达car。通常,构建编码所述car的多核苷酸载体,并将所述载体转染或转导到t细胞群体中。例如,可以使用反转录病毒或慢病毒载体将编码car的核苷酸序列递送到细胞中。示例性的反转录病毒载体包括但不限于载体骨架pmsgv1-cd8-28bbz,其源自于pmsgv(基于鼠类干细胞病毒的拼接gag载体)。对于其他示例性慢病毒载体来说,参见例如dull等,(1998)j.virol 72:8463-8471和美国专利号5,994,136、6,682,907、7,629,153、8,329,462、8,748,169、9,101,584。反转录病毒转导可以使用已知技术来进行,例如johnson等,(blood 114,535-546(2009))的技术。car在被转导的t细胞上的表面表达可以例如通过流式细胞术来确定。编码car的核苷酸序列也可以使用体外转录的mrna递送到细胞中。
101.t细胞和/或被工程化改造以表达car的t细胞,通常可以使用在例如下述文献中描述的方法来活化和扩增:美国专利号6,352,694;6,534,055;6,905,680;6,692,964;5,858,358;6,887,466;6,905,681;7,144,575;7,067,318;7,172,869;7,232,566;7,175,843;5,883,223;6,905,874;6,797,514;6,867,041;和美国专利申请公开号20060121005。通常,t细胞通过与刺激cd3/tcr复合体相关信号的药剂和刺激t细胞表面上的共刺激分子的配体接触来扩增。例如,可以通过与抗cd3抗体、抗cd28抗体、抗cd2抗体或蛋白激酶c激活物(例如苔藓虫素)和/或钙离子载体接触,来刺激t细胞群体。
102.用于制造car t细胞的其他方法描述在例如levine等,(2016)ol.ther.methods clin.dev.4:92-101中。
103.在某些实施方式中,car结合选自5t4、间皮素、前列腺特异性膜抗原(psma)、前列腺干细胞抗原(pcsa)、碳酸酐酶ix(caix)、癌胚抗原(cea)、cd5、cd7、cd10、cd19、cd20、cd22、cd30、cd33、cd34、cd38、cd41、cd44、cd47、cd49f、cd56、cd74、cd123、cd133、cd138、上皮糖蛋白2(egp2)、上皮糖蛋白-40(egp-40)、上皮细胞粘附分子(epcam)、叶酸结合蛋白(fbp)、胎儿乙酰胆碱受体(achr)、叶酸受体-a和β(fra和β)、神经节苷脂g2(gd2)、神经节苷脂g3(gd3)、表皮生长因子受体(egfr)、表皮生长因子受体2(her-2/erb2)、表皮生长因子受体viii(egfrviii)、erb3、erb4、人端粒酶反转录酶(htert)、白介素-13受体亚基α-2(il-13ra2)、k-轻链、激酶插入结构域受体(kdr)、lewis a(ca19.9)、lewis y(ley)、li细胞粘附分子(licam)、黑素瘤相关抗原1(黑素瘤抗原家族al、mage-a1)、粘蛋白16(muc-16)、粘蛋白1(muc-1)、kg2d配体、睾丸癌抗原ny-eso-1、肿瘤相关糖蛋白72(tag-72)、血管内皮生长因子r2(vegf-r2)、肾母细胞瘤蛋白(wt-1)、1型酪氨酸蛋白激酶跨膜受体(ror1)、b7-h3(cd276)、b7-h6(nkp30)、硫酸软骨素蛋白聚糖-4(cspg4)、dnax辅助分子(dnam-1)、肝配蛋白a型受体2(epha2)、成纤维细胞相关蛋白(fap)、gpl00/hla-a2、磷脂酰肌醇蛋白聚糖3(gpc3)、ha-ih、herk-v、il-1ira、潜伏膜蛋白1(lmp1)、神经细胞粘附分子(n-cam/cd56)、程序性细胞死亡受体配体1(pd-l1)、b细胞成熟抗原(bcma)和trail受体(trail r)的癌抗原。
104.iii.超抗原偶联物
105.a.超抗原
106.超抗原是能够以例如皮摩尔的浓度激活t淋巴细胞的细菌蛋白质、病毒蛋白质和人类工程化蛋白质。超抗原也可以激活大部分t淋巴细胞(t细胞)。超抗原无需加工即可与i
类主要组织相容性复合物(mhci)结合,并且特别是可以与ii类mhc上抗原结合沟外的保守区域结合(例如在单核细胞上),避开了常规肽结合部位中的大部分多态性。超抗原也可以与t细胞受体(tcr)的vβ链结合,而不是与t细胞受体的高变环结合。细菌超抗原的实例包括但不限于葡萄球菌肠毒素(se)、酿脓链球菌(streptococcus pyogenes)外毒素(spe)、金黄色葡萄球菌(staphylococcus aureus)中毒性休克综合征毒素(tsst-1)、链球菌致有丝分裂外毒素(sme)、链球菌超抗原(ssa)、葡萄球菌肠毒素a(sea)、葡萄球菌肠毒素b(seb)和葡萄球菌肠毒素e(see)。
107.编码许多超抗原的多核苷酸序列已被分离和克隆,并且从这些或修饰的(重新工程化改造的)多核苷酸序列表达的超抗原已被用于抗癌疗法(参见下文讨论的埃托-那普妥莫单抗/)。由这些多核苷酸序列表达的超抗原可以是野生型超抗原、修饰的超抗原或与靶向部分偶联或融合的野生型或修饰的超抗原。所述超抗原可以直接例如通过注射施用到哺乳动物例如人类,或者可以例如通过将患者的血液在身体外部暴露到所述超抗原或例如通过将编码超抗原的基因放置在待治疗的哺乳动物体内(例如通过已知的基因治疗方法和载体,例如通过含有并能够表达所述基因的细胞)并在所述哺乳动物体内表达所述基因来递送。
108.超抗原的实例和它们向哺乳动物的施用被描述在下述美国专利和专利申请中:美国专利号5,858,363、6,197,299、6,514,498、6,713,284、6,692,746、6,632,640、6,632,441、6,447,777、6,399,332、6,340,461、6,338,845、6,251,385、6,221,351、6,180,097、6,126,945、6,042,837、6,713,284、6,632,640、6,632,441、5,859,207、5,728,388、5,545,716、5,519,114、6,926,694、7,125,554、7,226,595、7,226,601、7,094,603、7,087,235、6,835,818、7,198,398、6,774,218、6,913,755、6,969,616和6,713,284,美国专利申请号2003/0157113、2003/0124142、2002/0177551、2002/0141981、2002/0115190和2002/0051765,以及pct国际公布号wo/03/094846。
109.b.修饰的超抗原
110.在本发明的范围内,超抗原可以以各种不同方式进行工程化改造,包括保留或增强超抗原刺激t淋巴细胞的能力的修饰,并且可能例如改变所述超抗原的其他方面,例如它的血清反应性或免疫原性。修饰的超抗原包括具有超抗原活性(即激活一部分t淋巴细胞的能力)的合成分子。
111.设想了可以对编码超抗原的多核苷酸序列做出各种不同改变而不显著丧失其生物学效用或活性,即诱导t细胞应答以产生对肿瘤细胞的细胞毒性。此外,可以降低所述超抗原对ii类mhc分子的亲和性,并对所述超抗原的细胞毒性具有极小影响。这例如可以帮助降低在超抗原保留其结合ii类mhc抗原的情况下原本可能出现的毒性(因此在这种情况下,表达ii类的细胞例如免疫系统细胞也可能受到对所述超抗原的应答的影响)。
112.用于修饰超抗原(例如多核苷酸和多肽)、包括用于制造合成的超抗原的技术在本领域中是公知的,并包括例如pcr突变、丙氨酸扫描突变和定点突变(参见美国专利号5,220,007、5,284,760、5,354,670、5,366,878、5,389,514、5,635,377和5,789,166)。
113.在某些实施方式中,可以对超抗原进行修饰,使得它的血清反应性与参比野生型超抗原相比降低,但它激活t细胞的能力相对于野生型得以保留或增强。用于制造此类修饰的超抗原的一种技术包括将来自于一个超抗原的某些区域中的某些氨基酸替换成另外的
氨基酸。这是可能的,因为许多超抗原包括但不限于sea、see和sed在与某些功能相关的某些区域中享有序列同源性(marrack和kappler(1990)science 248(4959):1066;也参见图1,其示出了不同野生型和工程化改造的超抗原之间的同源性区域)。例如在本发明的某些实施方式中,对具有所需的诱导t细胞激活的应答但没有所需的高血清反应性的超抗原进行修饰,使得得到的超抗原保留其t细胞激活能力但具有降低的血清反应性。
114.本领域技术人员已知并了解,人类的血清正常情况下含有各种不同滴度的针对超抗原的抗体。例如对于葡萄球菌超抗原来说,相对滴度是tsst-1》seb》sec-1》se3》sec2》sea》sed》see。结果,例如see(葡萄球菌肠毒素e)的血清反应性低于例如sea(葡萄球菌肠毒素a)。在这个数据的基础上,本领域技术人员可以优选地施用低滴度超抗原例如see来代替高滴度超抗原例如seb(葡萄球菌肠毒素b)。然而,正如也已发现的,不同超抗原彼此之间具有不同的t细胞激活性能,并且对于野生型超抗原来说,最佳的激活t细胞的超抗原通常也具有不理想的高血清反应性。
115.这些相对滴度有时对应于血清反应性的潜在问题,例如中和抗体的问题。因此,使用低滴度超抗原例如sea或see可能有助于降低或避免肠胃外施用的超抗原的血清反应性。当例如通过典型的抗超抗原抗体在普通人群中测量时,低滴度超抗原具有低的血清反应性。在某些情况下,它也可能具有低的免疫原性。如本文中所述,此类低滴度超抗原可以被修饰以保留其低滴度。
116.用于修饰超抗原的方法可用于产生具有所需t细胞激活性能和降低的血清反应性两者,并在在某些情况下也具有降低的免疫原性的超抗原。鉴于超抗原之间的某些同源性区域与血清反应性有关,因此可能制造具有所需的t细胞激活和所需的血清反应性和/或免疫原性的重组超抗原。此外,超抗原或葡萄球菌肠毒素的蛋白质序列和免疫交叉反应性被分成两个相关的组。一组由sea、see和sed组成。第二组是spea、sec和seb。因此,可以选自低滴度超抗原以降低或消除与针对葡萄球菌肠毒素的高滴度或内源抗体的交叉反应性。
117.超抗原中据信在血清反应性中发挥作用的区域包括例如a区,其包含第20、21、22、23、24、25、26和27位氨基酸残基;b区,其包含第34、35、36、37、38、39、40、41、42、43、44、45、46、47、48和49位氨基酸残基;c区,其包含第74、75、76、77、78、79、80、81、82、83和84位氨基酸残基;d区,其包含第187、188、189和190位氨基酸残基;以及e区,其包含第217、218、219、220、221、222、223、224、225、226和227位氨基酸残基(参见美国专利号7,125,554和本文中的图1)。因此,设想了可以使用例如氨基酸替换对这些区域进行突变,以产生具有改变的血清反应性的超抗原。
118.上文列出的超抗原的多肽或氨基酸序列可以从任何序列数据库例如protein data bank和/或genbank获得。示例性的genbank登记号包括但不限于see是p12993;sea是p013163;seb是p01552;sec1是p01553;sed是p20723;并且seh是aaa19777。
119.在本发明的某些实施方式中,可以对野生型see序列(seq id no:1)或野生型sea序列(seq id no:2)进行修饰,使得在任何指定的区域a-e(参见图1)中的氨基酸被其他氨基酸替换。此类替换包括例如k79、k81、k83和d227或k79、k81、k83、k84和d227,或例如k79e、k81e、k83s和d227s或k79e、k81e、k83s、k84s和d227a。在某些实施方式中,所述超抗原是sea/e-120(seq id no:3;也参见美国专利号7,125,554)或sea
d227a
(seq id no:4;也参见美国专利号7,226,601)。
120.1.修饰的多核苷酸和多肽
121.编码天然存在的或参比超抗原的多核苷酸的生物功能等同物可以包含已被工程化改造以含有不同序列,并在同时保留了编码所述天然存在的或参比超抗原的能力的多核苷酸。这可以凭借遗传密码的简并性,即存在编码相同氨基酸的多种密码子来实现。在一个实例中,可以在多核苷酸中引入限制性酶识别序列,而不扰乱该多核苷酸编码蛋白质的能力。其他多核苷酸序列可以编码与参比超抗原不同,但在至少一种生物学特性或活性方面功能上基本等同(例如至少50%、60%、70%、80%、90%、95%、98%的所述生物学特性或活性,例如但不限于诱导t细胞应答以产生对肿瘤细胞的细胞毒性的能力)的超抗原。
122.在另一个实例中,多核苷酸可以是(并且编码)功能上等同于参比超抗原的超抗原,即使它可能含有更加显著的变化。蛋白质结构中的某些氨基酸可以被其他氨基酸替换,而不显著丧失与例如抗体的抗原结合区、底物分子上的结合位点、受体和诸如此类的结构的相互结合能力。此外,保守氨基酸置换可能不破坏蛋白质的生物活性,因此由此产生的结构变化通常不会影响所述蛋白质执行其被设计的功能的能力。因此,设想了可以在本文公开的基因和蛋白质的序列中做出各种不同改变,同时仍满足本发明的目标。
123.可以对氨基酸替换进行设计,以利用氨基酸侧链取代基的相对相似性,例如它们的疏水性、亲水性、电荷、尺寸等。氨基酸侧链取代基的尺寸、形状和/或类型的分析揭示出精氨酸、赖氨酸和/或组氨酸都是带正电荷的残基;丙氨酸、甘氨酸和/或丝氨酸都具有相近的尺寸;和/或苯丙氨酸、色氨酸和/或酪氨酸都具有大致相似的形状。因此,基于这些考虑,精氨酸、赖氨酸和/或组氨酸;丙氨酸、甘氨酸和/或丝氨酸;和/或苯丙氨酸、色氨酸和/或酪氨酸;在本文中被定义为生物学功能等同物。此外,可能可以引入非天然存在的氨基酸。使用其他天然存在和非天然存在的氨基酸进行氨基酸置换的方法描述在美国专利号7,763,253中。
124.就功能等同物而言,应该理解,在蛋白质和/或多核苷酸的“生物学功能等同物”的定义中暗示的概念是,在所述分子的限定部分中可以做出有限数量的变化,同时保留具有可接受水平的等同生物活性的分子。因此,生物学功能等同物被认为是其中选定的氨基酸(或密码子)可以被替换而不显著影响生物功能的那些蛋白质(和多核苷酸)。功能活性包括诱导t细胞应答以产生对肿瘤细胞的细胞毒性。
125.此外,设想了可以通过“结构域交换”替换各种不同蛋白质的同源区来产生修饰的超抗原,这涉及使用不同但在这种情况下相关的多肽来产生嵌合分子。通过比较各种不同的超抗原蛋白以鉴定这些分子的功能上相关的区域(参见例如图1),可以交换这些分子的相关结构域以便确定这些区域对超抗原功能的重要性。这些分子可能具有额外的价值,因为这些“嵌合体”可以与天然分子区分开,同时可能提供相同的功能。
126.在某些实施方式中,所述超抗原包含与选自seq id no:1、seq id no:2、seq id no:3和seq id no:4的参比超抗原的序列具有至少70%、75%、80%、85%、90%、95%、98%或99%同一性的氨基酸序列,其中所述超抗原任选地保留所述参比超抗原的至少50%、60%、70%、80%、90%、95%、98%、99%或100%的生物学活性或性质。
127.在某些实施方式中,所述超抗原包含由与编码选自seq id no:1、seq id no:2、seq id no:3和seq id no:4的参比超抗原的核酸具有至少70%、75%、80%、85%、90%、95%、98%或99%同一性的核酸编码的氨基酸序列,其中所述超抗原任选地保留所述参比
超抗原的至少50%、60%、70%、80%、90%、95%、98%、99%或100%的生物学活性或性质。
128.序列同一性可以以本领域技术范围之内的各种不同方式来确定,例如使用可公开获得的计算机软件如blast、blast-2、align或megalign(dnastar)软件。使用由程序blastp、blastn、blastx、tblastn和tblastx使用的算法的blast(基本局部比对搜索工具)分析(karlin等,(1990)proc.natl.acad.sci.usa87:2264-2268;altschul,(1993)j.mol.evol.36,290-300;altschul等,(1997)nucleic acids res.25:3389-3402,通过参考并入本文)被定制用于序列相似性搜索。对于搜索序列数据库中的基本问题的讨论,参见altschul等,(1994)nature genetics 6:119-129,其整体通过参考并入本文。本领域技术人员可以为测量比对,包括为了在待比较的序列的全长内实现最大对齐所需的任何算法确定适合的参数。用于直方图、描述、比对、期望(即报告与数据库序列匹配的统计显著性阈值)、截止值、矩阵和过滤器的搜索参数为默认设置。由blastp、blastx、tblastn和tblastx使用的默认评分矩阵是blosum62矩阵(henikoff等,(1992)proc.natl.acad.sci.usa 89:10915-10919,整体通过参考并入本文)。4个blastn参数可以调整如下:q=10(空位建立罚分);r=10(空位扩展罚分);wink=1(在沿着查询序列的每第wink个位置处生成字命中);和gapw=16(设置在其中生成带空位比对的窗口宽度)。等效的blastp参数设置可以是q=9;r=2;wink=1;和gapw=32。搜索也可以使用ncbi(美国国家生物技术信息中心(national center for biotechnology information))的blast高级选项参数来进行(例如:-g,空位开放罚分(cost to open gap)[整数]:默认值=对于核苷酸来说5/对于蛋白质来说11;-e,空位扩展罚分(cost to extend gap)[整数]:默认值=对于核苷酸来说2/对于蛋白质来说1;-q,核酸序列基对不匹配所罚分数[整数]:默认值=-3;-r,核苷酸序列基对匹配所加分数[整数]:默认值=1;-e,预期值[实数]:默认值=10;-w,字长[整数]:默认值=对于核苷酸来说11/对于megablast来说28/对于蛋白质来说3;-y,以比特为单位的用于blast扩展的衰减(x):默认值=对于blastn来说20/对于其他来说7;-x,用于带空位比对的x衰减值(以比特为单位):默认值=对于所有程序来说15,不适用于blastn;和
–
z,用于带空位比对的最终x衰减值(以比特为单位):对于blastn来说50for,对于其他来说25)。也可以使用用于成对蛋白质比对的clustalw(默认参数可以包括例如blosum62矩阵和空位开放罚分=10和空位扩展罚分=0.1)。可以在gcg软件包10.0版中获得的序列之间的bestfit比较使用dna参数gap=50(空位建立罚分)和len=3(空位扩展罚分),在蛋白质比较中的等效设置是gap=8和len=2。
[0129]
c.靶向超抗原
[0130]
为了提高特异性,所述超抗原优选被偶联到靶向部分,以产生结合偏好性被癌细胞表达的抗原例如细胞表面抗原如5t4的靶向超抗原偶联物。所述靶向部分是可用于将超抗原结合到所述癌细胞例如癌细胞表面的媒介。所述靶向超抗原偶联物应该保留激活大量t淋巴细胞的能力。例如,所述靶向超抗原偶联物应该激活大量t细胞,并将它们导向含有与所述靶向部分结合的肿瘤相关抗原的组织。在这种情况下,特定靶细胞被偏好性杀死,留下身体的其余部分相对不受损害。这种类型的疗法是合乎需要的,因为非特异性抗癌药剂例如细胞抑制性化学治疗药物是非特异性的,并杀死大量与待治疗的肿瘤无关的细胞。例如,使用靶向超抗原偶联物的研究显示,对靶向超抗原的首次注射做出响应,伴有细胞毒性t淋巴细胞(ctl)在肿瘤组织中的浸润的炎症快速增加(dohlsten等,(1995)
proc.natl.acad.sci.usa 92:9791-9795)。这种伴有ctl在肿瘤中的浸润的炎症是靶向超抗原的抗癌治疗剂的主要效应物之一。
[0131]
肿瘤靶向超抗原代表了针对癌症的免疫疗法,并且是含有偶联到超抗原的靶向部分的治疗性融合蛋白(dohlsten等,(1991)proc.natl.acad.sci.usa88:9287-9291;dohlsten等,(1994)proc.natl.acad.sci.usa 91:8945-8949)。
[0132]
所述靶向部分原则上可以是能够与细胞分子例如细胞表面分子、优选为疾病特异性分子结合的任何结构。所述靶向部分所针对的靶向分子(例如抗原)通常不同于(a)超抗原所结合的vβ链表位,和(b)超抗原所结合的ii类mhc表位。所述靶向部分可以选自抗体包括其抗原结合片段、可溶性t细胞受体、生长因子、白介素(例如白介素-2)、激素等。
[0133]
在某些优选实施方式中,所述靶向部分是抗体(例如fab、f(ab)2、fv、单链抗体等)。抗体是极其多用途且有用的细胞特异性靶向部分,因为它们通常可以针对任何感兴趣的细胞表面抗原产生。已产生了针对细胞表面受体、肿瘤相关抗原和白细胞谱系特异性标志物例如cd抗原的单克隆抗体。抗体可变区基因可以通过本领域中公知的方法从杂交瘤细胞容易地分离。可用于产生靶向部分的示例性肿瘤相关抗原可以包括但不限于gp100、melan-a/mart、mage-a、mage(黑素瘤抗原e)、mage-3、mage-4、magea3、酪氨酸酶、trp2、ny-eso-1、cea(癌胚抗原)、psa、p53、乳腺珠蛋白-a、存活蛋白、muc1(黏蛋白1)/df3、金属泛激蛋白-1(mps-1)、细胞色素p450亚型1b1、90k/mac-2结合蛋白、ep-cam(mk-1)、hsp-70、htert(trt)、lea、lage-1/camel、tage-1、gage、5t4、gp70、scp-1、c-myc、cyclin b1、mdm2、p62、koc、imp1、rcas1、ta90、oa1、ct-7、hom-mel-40/ssx-2、ssx-1、ssx-4、hom-tes-14/scp-1、hom-tes-85、hdac5、mbd2、trip4、ny
‑‑
co-45、knsl6、hip1r、seb4d、kiaa1416、imp1、90k/mac-2结合蛋白、mdm2、ny/eso、egfrviii、il-13rα2、her2、gd2、egfr、pdl1、间皮素、psma、tgfβrdn、lmp1、gpc3、fra、mg7、cd133、cmet、psca、磷脂酰肌醇聚糖3、ror1、nkr-2、cd70和lmna。
[0134]
示例性的癌症靶向抗体可以包括但不限于抗cd19抗体、抗cd20抗体、抗5t4抗体、抗ep-cam抗体、抗her-2/neu抗体、抗egfr抗体、抗cea抗体、抗前列腺特异性膜抗原(psma)抗体和抗igf-1r抗体。应该理解,所述超抗原可以被偶联到免疫反应性抗体片段例如c215fab、5t4fab(参见wo8907947)或c242fab(参见wo9301303)。
[0135]
可以在本发明中使用的肿瘤靶向超抗原的实例包括c215fab-sea(seq id no:5)、5t4fab-sea
d227a
(seq id no:6)和5t4fab-sea/e-120(seq id no:7,参见图2和图3)。
[0136]
在优选实施方式中,优选的偶联物是被称为埃托-那普妥莫单抗/的超抗原偶联物,其是抗5t4抗体的fab片段与sea/e-120超抗原的融合蛋白。埃托-那普妥莫单抗/包含两条蛋白链,它们合在一起包括工程化改造的葡萄球菌肠毒素超抗原(sea/e-120)和包含融合到鼠类igg1/κ抗体c242的恒定区序列的修饰的5t4可变区序列的靶向性5t4 fab。所述第一蛋白链包含seq id no:7的第1至458位残基(也参见seq id no:8),并且包括通过对应于seq id no:7的第223-225位残基的ggp三肽连接物共价连接的对应于seq id no:7的第1至222位残基的嵌合5t4 fab重链和对应于seq id no:7的第226至458位残基的sea/e-120超抗原。所述第二链包含的seq id no:7的第459至672位残基(也参见seq id no:9),并包括嵌合5t4 fab轻链。所述两条蛋白链通过所述fab重链与轻链之间的非共价相互作用保持在一起。seq id no:7的第1-458位残基对应于的seq id no:8的
第1-458位残基,并且seq id no:7的第459-672位残基对应于seq id no:9的第1-214位残基。埃托-那普妥莫单抗/包含通过所述fab重链与fab轻链之间的非共价相互作用保持在一起的seq id no:8和9的蛋白质。埃托-那普妥莫单抗/在10pm左右的浓度下诱导t细胞介导的癌细胞灭杀,并且所述偶联物的超抗原组分已被工程化改造,以对人类抗体和ii类mhc具有低结合。
[0137]
设想了其他基于抗体的靶向部分可以使用本领域中已知的技术来设计、修饰、表达和纯化,并且在下文中更详细讨论。
[0138]
另一种类型的靶向部分包括可溶性t细胞受体(tcr)。某些形式的可溶性tcr可能只含有细胞外结构域或细胞外和胞质结构域。也可以设想tcr的其他修饰,以产生其中跨膜结构域已被缺失和/或改变,使得所述tcr不是膜结合型的可溶性tcr,正如在美国专利申请号u.s.2002/119149、u.s.2002/0142389、u.s.2003/0144474和u.s.2003/0175212以及国际公布号wo2003020763、wo9960120和wo9960119中所描述的。
[0139]
所述靶向部分可以使用重组技术偶联到所述超抗原,或将所述靶向部分化学连接到所述超抗原。
[0140]
1.重组连接物(融合蛋白)
[0141]
设想了可以使用常规的重组dna技术来产生和表达编码直接或间接(例如通过含有氨基酸的连接物)连接到靶向部分的超抗原的基因。例如,可以将修饰的超抗原的氨基端连接到靶向部分的羧基端,反之亦然。对于可以充当靶向部分的抗体或抗体片段来说,可以利用轻链或重链中的任一者来产生融合蛋白。例如对于fab片段来说,可以将所述修饰的超抗原的氨基端连接到抗体重链的第一恒定结构域(ch1)。在某些情况下,通过将vh和vl结构域连接到超抗原,可以将所述修饰的超抗原连接到fab片段。或者,可以使用肽连接物将所述超抗原和靶向部分联结在一起。当使用连接物时,所述连接物优选地含有亲水性氨基酸残基例如gln、ser、gly、glu、pro、his和arg。优选的连接物是由1-10个氨基酸残基、更特别是3-7个氨基酸残基组成的肽桥。示例性的连接物是三肽-glyglypro-。这些方法已被成功地用于埃托-那普妥莫单抗/超抗原偶联物的设计和制造。
[0142]
2.化学连接
[0143]
还设想了可以通过化学连接将所述超抗原连接到所述靶向部分。所述超抗原与靶向部分的化学连接可能需要连接物,例如肽连接物。所述肽连接物优选为亲水的,并展示出选自酰胺、硫醚、二硫化物等的一个或多个反应性组成部分(参见美国专利号5,858,363、6,197,299和6,514,498)。还设想了所述化学连接可以是同或异双功能交联试剂。超抗原与靶向部分的化学连接通常利用存在于所述化合物的许多位置中的官能团(例如伯胺基或羧基)。
[0144]
iv.表达方法
[0145]
感兴趣的蛋白质例如超抗原偶联物、嵌合抗原受体和/或t细胞受体亚基,可以通过将编码所述感兴趣的蛋白质的基因并入到适合的表达载体中,在感兴趣的宿主细胞中表达。
[0146]
宿主细胞可以例如通过转化或转染技术进行遗传工程改造,以并入核酸序列并表达所述超抗原。核酸序列在宿主细胞中的引入可以通过磷酸钙转染、deae-葡聚糖介导的转染、显微注射、阳离子脂质介导的转染、电穿孔、转导、刮擦装载、弹道学引入、感染或其他方
法来实现。此类方法描述在许多标准实验室手册中,例如davis等,(1986)《分子生物学基础方法》(basic methods in molecular biology)和sambrook等,(1989)《分子克隆实验指南》(molecular cloning:a laboratory manual),第2版,cold spring harbor laboratory press,cold spring harbor,n.y。
[0147]
适合的宿主细胞的代表性实例包括细菌细胞,例如链球菌、葡萄球菌、大肠埃希氏杆菌、链霉菌和枯草芽孢杆菌细胞;真菌细胞,例如酵母细胞和曲霉细胞;昆虫细胞,例如果蝇s2和夜蛾sf9细胞;哺乳动物细胞,例如cho、cos、hela、c127、3t3、bhk、hek-293和bowes黑素瘤细胞。
[0148]
在使用重组dna技术时,感兴趣的蛋白质可以使用标准表达载体和表达系统来表达。将已被遗传工程改造以含有编码所述超抗原的核酸序列的表达载体引入(例如转染)到宿主细胞中,以生产所述超抗原(参见例如dohlsten等,(1994);forsberg等,(1997)j.biol.chem.272:12430-12436;erlandsson等,(2003)j.mol.biol.333:893-905和wo2003002143)。
[0149]
当在本文中使用时,“表达载体”是指包含含有可操作连接到待表达的核苷酸序列的表达控制序列的重组多核苷酸的载体。表达载体包含足以用于表达的顺式作用元件;用于表达的其他元件可以由宿主细胞提供或提供在体外表达系统中。表达载体包括本领域中已知的所有表达载体,例如粘粒、质粒(例如裸露的或包含在脂质体中的)、反转录转座子(例如piggybac、睡美人)和并入有感兴趣的重组多核苷酸的病毒(例如慢病毒、反转录病毒、腺病毒和腺相关病毒)。
[0150]
在某些实施方式中,所述表达载体是病毒载体。术语“病毒”在本文中用于指称不具有蛋白质合成或能量产生机制的专性细胞内寄生物。示例性的病毒载体包括反转录病毒载体(例如慢病毒载体)、腺病毒载体、腺相关病毒载体、疱疹病毒载体、epstein-barr病毒(ebv)载体、多瘤病毒载体(例如猿猴空泡病毒40(sv40)载体)、痘病毒载体和假型病毒载体。
[0151]
所述病毒可以是rna病毒(具有由rna组成的基因组)或dna病毒(具有由dna组成的基因组)。在某些实施方式中,所述病毒载体是dna病毒载体。示例性的dna病毒包括细小病毒(例如腺相关病毒)、腺病毒、asfarvirus、疱疹病毒(例如单纯性疱疹病毒1和2(hsv-1和hsv-2)、epstein-barr病毒(ebv)、巨细胞病毒(cmv))、乳头瘤病毒(例如hpv)、多瘤病毒(例如猿猴空泡病毒40(sv40))和痘病毒(例如痘苗病毒、牛痘病毒、天花病毒、禽痘病毒、羊痘病毒、粘液瘤病毒)。在某些实施方式中,所述病毒载体是rna病毒载体。示例性的rna病毒包括布尼亚病毒(例如汉坦病毒)、冠状病毒、黄病毒(例如黄热病病毒、西尼罗病毒、登革热病毒)、肝炎病毒(例如甲型肝炎病毒、丙型肝炎c病毒、戊型肝炎病毒)、流感病毒(例如甲型流感病毒、乙型流感病毒、丙型流感病毒)、麻疹病毒、腮腺炎病毒、诺如病毒(例如诺沃克病毒)、脊髓灰质炎病毒、呼吸道合胞病毒(rsv)、反转录病毒(例如人类免疫缺陷病毒-1(hiv-1))和环曲病毒。
[0152]
在某些实施方式中,所述表达载体包含与编码感兴趣的蛋白质例如超抗原偶联物、嵌合抗原受体和/或t细胞受体亚基的核苷酸序列可操作连接的调控序列或启动子。术语“可操作连接”是指多核苷酸元件以有功能的关系的连接。当一个核酸序列与另一个核酸序列以有功能的关系放置时,它是“可操作连接的”。例如,如果启动子或增强子影响一个基
因的转录,则它与所述基因可操作连接。可操作连接的核苷酸序列通常是毗邻的。然而,由于增强子通常与启动子相隔几千碱基起作用并且内含子序列可能具有可变的长度,因此某些多核苷酸元件可以是可操作连接但不直接相邻的,并且甚至可能从不同的等位基因或染色体反式起作用。
[0153]
可以使用的示例性启动子包括但不限于反转录病毒ltr、sv40启动子、人巨细胞病毒(cmv)启动子、u6启动子或任何其他启动子(例如细胞启动子例如真核细胞启动子,包括但不限于组蛋白、pol iii和β-肌动蛋白启动子)。可以使用的其他病毒启动子包括但不限于腺病毒启动子、tk启动子和b19细小病毒启动子。
[0154]
在某些实施方式中,启动子是诱导型启动子。诱导型启动子的使用允许在需要时打开或关闭可操作连接的多核苷酸序列的表达。在某些实施方式中,所述启动子在存在外源分子或活性的情况下诱导,例如金属硫蛋白启动子、糖皮质激素启动子、黄体酮启动子和四环素启动子。在某些实施方式中,所述启动子在肿瘤微环境中被诱导,例如il-2启动子、nfat启动子、细胞表面蛋白启动子(例如cd69启动子或pd-1启动子)、细胞因子启动子(例如tnf启动子)、细胞活化启动子(例如ctla4、ox40或cd40l启动子)或细胞表面黏附蛋白启动子(例如vla-1启动子)。
[0155]
在某些实施方式中,启动子介导在数天内测量到的快速、持续的表达(例如cd69启动子)。在某些实施方式中,启动子介导延迟的、晚期诱导型表达(例如vla1启动子)。在某些实施方式中,启动子介导快速的瞬时表达(例如tnf启动子这种立即早期响应基因启动子等)。
[0156]
启动子例如强、弱、诱导型、组织特异性、发育特异性、具有特定活化动力学(例如早期和/或晚期活化)和/或具有被诱导基因的特定表达动力学(例如短期或长期表达)的启动子的选择在专业技术人员的普通技术范围之内,并且对于本领域技术人员来说从本文中包含的教导将是显而易见的。
[0157]
用于表达或调控表达的其他系统的实例包括“on-switch”car(wu等,(2015)science 350:aab4077)、组合激活系统(fedorov等,(2014)cancer journal 20:160-165;kloss等,(2013)nature biotechnology 31:71-75)、强力霉素诱导型car(sakemura等,(2016)cancer immunol.res.4:658-668)、抗体诱导型car(hill等,(2018)nature chemical biology 14:112-117)、灭杀开关(di stasi等,(2011)n.engl.j.med.365:1673-1683(2011);budde等,(2013)plos one 8:e82742)、暂停开关(wei等,(2012)nature 488:384-388)、可调节受体系统(ma等,(2016)proc.natl.acad.sci.usa 113:e450-458;rodgers等,(2016)proc.natl.acad.sci.usa 113:e459-468;kudo等,(2014)cancer res.74:93-103)和增殖开关(chen等,(2010)proc.natl.acad.sci.usa 107,8531-8536)。
[0158]
用于超抗原的生产系统的实例可以在例如美国专利号6,962,694中找到。
[0159]
慢病毒载体
[0160]
在某些实施方式中,所述病毒载体可以是反转录病毒载体。反转录病毒载体的实例包括莫洛尼鼠白血病病毒载体、脾坏死病毒载体和源自于反转录病毒例如劳斯肉瘤病毒、哈维肉瘤病毒(harvey sarcoma virus)、禽白血病病毒、人免疫缺陷病毒、骨髓增殖性肉瘤病毒和乳腺肿瘤病毒的载体。反转录病毒载体可用作介导反转录病毒介导的真核细胞中的基因转移的试剂。
[0161]
在某些实施方式中,所述反转录病毒载体是慢病毒载体。示例性的慢病毒载体包括源自于人免疫缺陷病毒1(hiv-1)、人免疫缺陷病毒2(hiv-2)、猴免疫缺陷病毒(siv)、猫免疫缺陷病毒(fiv)、牛免疫缺陷病毒(biv)、杰姆布拉纳病病毒(jdv)、马传染性贫血病毒(eiav)和山羊关节炎脑炎病毒(caev)的载体。
[0162]
反转录病毒载体通常被构建成使得大部分编码病毒结构基因的序列被缺失并被感兴趣的基因代替。通常,使用本领域中已知的遗传工程技术将结构基因(即gag、pol和env)从反转录病毒骨架移除。因此,最小的反转录病毒载体从5'至3'包含:5'长末端重复序列(ltr),包装信号,任选的外源启动子和/或增强子,感兴趣的外源基因,和3'ltr。如果不提供外源启动子,则基因表达由5'ltr驱动,其是一种弱启动子,并需要tat的存在来激活表达。用于制造慢病毒的结构基因可以提供在单独的载体中,从而使产生的病毒粒子复制缺陷。具体对于慢病毒来说,包装系统可以包含编码gag、pol、rev和tat基因的单个包装载体,以及编码包膜蛋白env(通常为vsv-g,因为它具有广泛的感染性)的第三个独立的载体。为了提高包装系统的安全性,可以将包装载体分离,从一个载体表达rev,并从另一个载体表达gag和pol。通过使用包含嵌合5’ltr的反转录病毒载体,其中所述5’ltr的u3区被异源调控元件代替,也可以从所述包装系统中消除tat。
[0163]
基因可以以几种通用方式并入到前病毒骨架中。最直接的结构是其中将反转录病毒的结构基因用在ltr内的病毒调控序列的控制之下转录的单个基因代替的结构。还构建了可以将超过一个基因引入到靶细胞中的反转录病毒载体。通常,在此类载体中,一个基因在病毒ltr的调控控制之下,而第二个基因摆脱被剪接的信息表达,或在自身内部启动子的调控之下。
[0164]
因此,所述新的基因两侧带有5
′
和3
′
ltr,它们分别用于促进病毒粒子rna的转录和多聚腺苷酸化。术语“长末端重复序列”或“ltr”是指位于反转录病毒dna的末端处的碱基对的结构域,它们在其天然序列的背景中是正向重复序列,并含有u3、r和u5区。ltr通常提供对反转录病毒基因的表达(例如基因转录本的促进、起始和多聚腺苷酸化)和病毒复制来说基础的功能。ltr含有大量调控信号,包括转录控制元件、多聚腺苷酸化信号和病毒基因组的复制和整合所需的序列。u3区含有增强子和启动子元件。u5区是引物结合位点与r区之间的区域,并含有多聚腺苷酸化序列。r(重复序列)区在u3与u5区之间。在某些实施方式中,所述r区包含反式激活响应(tar)遗传元件,其与反式激活(tat)遗传元件相互作用,以增强病毒复制。在其中5
′
ltr的u3区被异源启动子代替的实施方式中,不需要这个元件。
[0165]
在某些实施方式中,所述反转录病毒载体包含修饰的5
′
ltr和/或3
′
ltr。对3
′
ltr进行修饰通常是为了通过赋予病毒以复制缺陷来提高慢病毒或反转录病毒系统的安全性。在特定实施方式中,所述反转录病毒载体是自失活(sin)载体。当在本文中使用时,sin反转录病毒载体是指一种复制缺陷型反转录病毒载体,其中3
′
ltr u3区已被修饰(例如通过缺失或替换)以防止第一轮病毒复制之外的病毒转录。这是因为所述3
′
ltr u3区在病毒复制期间被用作5
′
ltr u3区的模板,因此在没有u3增强子-启动子的情况下不能制造病毒转录本。在另一个实施方式中,3
′
ltr被修饰,使得u5区被例如理想的多聚腺苷酸化序列代替。应该指出,对ltr的修饰例如对3
′
ltr、5
′
ltr或3
′
和5
′
ltr两者的修饰,也包括在本发明中。
[0166]
在某些实施方式中,将5
′
ltr的u3区用异源启动子代替,以在病毒粒子生产期间驱动病毒基因组转录。可以使用的启动子的实例包括例如猿猴病毒40(sv40)(例如早期或晚
期)、巨细胞病毒(cmv)(例如立即早期)、莫洛尼鼠白血病病毒(momlv)、劳斯肉瘤病毒(rsv)和单纯性疱疹病毒(hsv)(胸苷激酶)启动子。典型的启动子能够以tat不依赖性方式驱动高水平的转录。这种代替降低了重组以产生可复制病毒的可能性,因为在所述病毒生产系统中没有完整的u3序列。
[0167]
与5
′
ltr相邻的是基因组的反转录和病毒rna有效包装成颗粒(psi位点)所必需的序列。当在本文中使用时,术语“包装信号”或“包装序列”是指位于反转录病毒的基因组内,在病毒粒子形成期间反转录病毒rna链的衣壳化所需的序列(参见例如clever等,1995j.virology,69(4):2101-09)。包装信号可以是病毒基因组的衣壳化所需的最小包装信号(也被称为psi[ψ]序列)。
[0168]
在某些实施方式中,所述反转录病毒载体(例如慢病毒载体)还包含flap。当在本文中使用时,术语“flap”是指一种其序列包括反转录病毒例如hiv-1或hiv-2的中心多聚嘌呤道和中心终止序列(cppt和cts)的核酸。适合的flap元件描述在美国专利号6,682,907和zennou等,(2000)cell,101:173中。在反转录期间,正链dna在cppt处的中心起始和在cts处的中心终止导致形成三链dna结构,即中心dna瓣。尽管不希望受到任何理论限制,所述dna瓣可以作为慢病毒基因组核输入的顺式活性决定子和/或可以提高病毒的滴度。在特定实施方式中,反转录病毒载体骨架包含在所述载体中感兴趣的异源基因的上游或下游的一个或多个flap元件。例如,在特定实施方式中,转移质粒包括flap元件。在一个实施方式中,本发明的载体包含从hiv-1分离的flap元件。
[0169]
在某些实施方式中,所述反转录病毒载体(例如慢病毒载体)还包含输出元件。在一个实施方式中,反转录病毒载体包含一个或多个输出元件。术语“输出元件”是指调控rna转录本从细胞核向细胞质的运输的顺式作用转录后调控元件。rna输出元件的实例包括但不限于人免疫缺陷病毒(hiv)rre(参见例如cullen等,(1991)j.virol.65:1053;和cullen等,(1991)cell 58:423)和乙型肝炎病毒转录后调控元件(hpre)。通常,rna输出元件位于基因的3
′
utr内,并且可以作为一个或多个拷贝插入。
[0170]
在某些实施方式中,所述反转录病毒载体(例如慢病毒载体)还包含转录后调控元件。各种不同的转录后调控元件可以提高异源核酸的表达,例如土拨鼠肝炎病毒转录后调控元件(wpre;参见zufferey等,(1999)j.virol.,73:2886);乙型肝炎病毒中存在的转录后调控元件(hpre)(huang等,mol.cell.biol.,5:3864)等(liu等,(1995),genes dev.,9:1766)。转录后调控元件通常位于异源核酸序列的3
′
末端。这种配置导致合成5
′
部分包含所述异源核酸编码序列并且3
′
部分包含所述转录后调控元件序列的mrna转录本。在某些实施方式中,本发明的载体缺少或不包含转录后调控元件例如wpre或hpre,因为在某些情况下这些元件提高细胞转化的风险和/或不实质性或显著增加mrna转录本的量或提高mrna稳定性。因此,在某些实施方式中,本发明的载体缺少或不包含wpre或hpre作为附加的安全措施。
[0171]
指导异源核酸转录本的高效终止和多聚腺苷酸化的元件提高异源基因表达。转录终止信号通常存在于多聚腺苷酸化信号的下游。因此,在某些实施方式中,所述反转录病毒载体(例如慢病毒载体)还包含多聚腺苷酸化信号。当在本文中使用时,术语“多聚腺苷酸化信号”或“多聚腺苷酸化序列”是指通过rna聚合酶h指导新生rna转录本的终止和多聚腺苷酸化两者的dna序列。重组转录本的高效多聚腺苷酸化的合乎需要的,因为缺少多聚腺苷酸
化信号的转录本不稳定并迅速降解。可用于本发明的自体的多聚腺苷酸化信号的说明性实例包括理想多聚腺苷酸化序列(例如aataaa、attaaa、agtaaa)、牛生长激素多聚腺苷酸化序列(bghpa)、兔β-珠蛋白多聚腺苷酸化序列(rβgpa)或本领域中已知的另一种适合的异源或内源多聚腺苷酸化序列。
[0172]
在某些实施方式中,反转录病毒载体还包含绝缘子元件。绝缘子元件可能有助于保护反转录病毒表达的序列例如治疗性基因免于整合位点效应,所述效应可以由基因组dna中存在的顺式作用元件介导,并导致被转移序列的表达失调(即位置效应;参见例如burgess-beusse等,(2002)proc.natl.acad.sci.,usa,99:16433;和zhan等,2001,hum.genet.,109:471)。在某些实施方式中,所述反转录病毒载体在一个或两个ltr中或所述载体整合到细胞基因组中的区域内的别处包含绝缘子元件。适合用于本发明的绝缘子包括但不限于鸡β-珠蛋白绝缘子(参见chung等,(1993).cell 74:505;chung等,(1997)proc.natl.acad.sci.,usa 94:575;和bell等,1999.cell 98:387)。绝缘子元件的实例包括但不限于从β-珠蛋白基因座分离的绝缘子,例如鸡hs4。
[0173]
慢病毒载体的非限制性实例包括plvx-ef1α-acgfp1-c1(clontech目录号631984)、plvx-ef1α-ires-mcherry(clontech目录号631987)、plvx-puro(clontech目录号632159)、plvx-ires-puro(clontech目录号632186)、plenti6/v5-dest
tm
(thermo fisher)、plenti6.2/v5-dest
tm
(thermo fisher)、plko.1(addgene的质粒编号10878)、plko.3g(addgene的质粒编号14748)、psico(addgene的质粒编号11578)、pljm1-egfp(addgene的质粒编号19319)、fugw(addgene的质粒编号14883)、plvthm(addgene的质粒编号12247)、plvut-ttr-krab(addgene的质粒编号11651)、pll3.7(addgene的质粒编号11795)、plb(addgene的质粒编号11619)、pwpxl(addgene的质粒编号12257)、pwpi(addgene的质粒编号12254)、ef.cmv.rfp(addgene的质粒编号17619)、plenti cmv puro dest(addgene的质粒编号17452)、plenti-puro(addgene的质粒编号39481)、pultra(addgene的质粒编号24129)、plx301(addgene的质粒编号25895)、phiv-egfp(addgene的质粒编号21373)、plv-mcherry(addgene的质粒编号36084)、plionii(addgene的质粒编号1730)、pinducer10-mir-rup-phes(addgene的质粒编号44011)。这些载体可以被修饰以适合于治疗性用途。例如,可以将选择标记(例如puro、egfp或mcherry)缺失或用第二个感兴趣的外源基因代替。慢病毒载体的其他实例公开在美国专利号7,629,153、7,198,950、8,329,462、6,863,884、6,682,907、7,745,179、7,250,299、5,994,136、6,287,814、6,013,516、6,797,512、6,544,771、5,834,256、6,958,226、6,207,455、6,531,123和6,352,694以及pct公开号wo2017/091786中。
[0174]
腺相关病毒(aav)载体
[0175]
在某些实施方式中,表达载体是腺相关病毒(aav)载体。aav是一种小的、无包膜的二十面体病毒,属于细小病毒科和依赖细小病毒属。aav具有约4.7kb的单链线性dna基因组。aav能够感染几种组织类型的分裂和静止细胞,不同的aav血清型表现出不同的组织嗜性。
[0176]
aav包括大量血清学可区分的类型,包括血清型aav-1至aav-12,以及来自于非人类灵长动物的超过100种血清型(参见例如srivastava(2008)j.cell biochem.,105(1):17
–
24,和gao等,(2004)j.virol.,78(12),6381
–
6388)。在本发明中使用的aav载体的血清
型可以由本领域技术人员根据递送效率、组织嗜性和免疫原性来选择。例如,aav-1、aav-2、aav-4、aav-5、aav-8和aav-9可用于递送到中枢神经系统;aav-1、aav-8和aav-9可用于递送到心脏;aav-2可用于递送到肾脏;aav-7、aav-8和aav-9可用于递送到肝脏;aav-4、aav-5、aav-6、aav-9可用于递送到肺,aav-8可用于递送到胰腺,aav-2、aav-5和aav-8可用于递送到感光细胞;aav-1、aav-2、aav-4、aav-5和aav-8可用于递送到视网膜色素上皮;aav-1、aav-6、aav-7、aav-8和aav-9可用于递送到骨骼肌。在某些实施方式中,所述aav衣壳蛋白包含在美国专利号7,198,951中公开的序列,例如但不限于aav-9(美国专利号7,198,951的seq id nos:1-3)、aav-2(美国专利号7,198,951的seq id no:4)、aav-1(美国专利号7,198,951的seq id no:5)、aav-3(美国专利号7,198,951的seq id no:6)和aav-8(美国专利号7,198,951的seq id no:7)。本发明中还考虑到了从恒河猴鉴定到的aav血清型例如rh.8、rh.10、rh.39、rh.43和rh.74。除了天然的aav血清型之外,已开发了修饰的aav衣壳,用于改善递送效率、组织嗜性和免疫原性。示例性的天然和修饰的aav衣壳公开在美国专利号7,906,111、9,493,788和7,198,951以及pct公开号wo2017189964a2中。
[0177]
野生型aav基因组含有两个145个核苷酸的反向末端重复序列(itr),其含有指导aav复制、基因组衣壳化和整合的信号序列。除了itr之外,三个aav启动子p5、p19和p40驱动编码rep和cap基因的两个开放阅读框的表达。与单个aav内含子的差异剪接偶联的两个rep启动子导致从rep基因产生四种rep蛋白(rep 78、rep 68、rep 52和rep 40)。rep蛋白负责基因组复制。cap基因从p40启动子表达,并编码三种衣壳蛋白(vp1、vp2和vp3),它们是cap基因的剪接变体。这些蛋白质形成aav粒子的衣壳。
[0178]
由于用于复制、衣壳化和整合的顺式作用信号包含在所述itr内,因此4.3kb的内部基因组的一部分或全部可以被外来dna例如感兴趣的外源基因的表达盒代替。因此,在某些实施方式中,所述aav载体包含的基因组包含两侧带有5’itr和3’itr的外源基因的表达盒。所述itr可以源自于与衣壳相同的血清型或其衍生物。或者,所述itr可以是与衣壳不同的血清型,从而产生假型aav。在某些实施方式中,所述itr源自于aav-2。在某些实施方式中,所述itr源自于aav-5。所述itr中的至少一者可以被修饰以突变或缺失末端解离位点,从而允许产生自身互补的aav载体。
[0179]
为了产生aav载体,所述rep和cap蛋白可以反式提供在例如质粒上。允许aav复制的宿主细胞系必须表达rep和cap基因、两侧带有itr的表达盒和由辅助病毒提供的辅助功能例如腺病毒基因e1a、e1b55k、e2a、e4orf6和va(weitzman等,《腺相关病毒生物学》(adeno-associated virus biology),腺相关病毒:方法和方案(adeno-associated virus:methods and protocols),pp.1
–
23,2011)。用于产生和纯化aav载体的方法已被详细描述(参见例如mueller等,(2012)current protocols in microbiology,14d.1.1-14d.1.21,新的重组腺相关病毒载体的生产和发现(production and discovery of novel recombinant adeno-associated viral vectors))。大量细胞类型适用于生产aav载体,包括hek293细胞、cos细胞、hela细胞、bhk细胞、vero细胞以及昆虫细胞(参见例如美国专利号6,156,303、5,387,484、5,741,683、5,691,176、5,688,676和8,163,543,美国专利公开号20020081721,和pct公开号wo00/47757、wo00/24916和wo96/17947)。aav载体通常通过一个含有两侧带有itr的表达盒的质粒和一个或多个提供其他aav和辅助病毒基因的另外的质粒,在这些细胞类型中产生。
[0180]
在本发明中可以使用任何血清型的aav。同样,设想了可以使用任何腺病毒类型,并且本领域技术人员能够鉴定适合于生产所需重组aav载体(raav)的aav和腺病毒类型。aav粒子可以例如通过亲和层析、iodixonal梯度或cscl梯度来纯化。
[0181]
aav载体可以具有尺寸为4.7kb或大于或小于4.7kb的单链基因组,包括大至5.2kb或小至3.0kb的超尺寸基因组。因此,在将要从aav载体表达的感兴趣的外源基因小的情况下,aav基因组可以包含填塞序列。此外,载体基因组可以是基本上自身互补的,从而允许在细胞中快速表达。在某些实施方式中,所述自身互补的aav载体的基因组从5'至3'包含:5'itr;第一核酸序列,其包含可操作连接到感兴趣的基因的编码序列的启动子和/或增强子;修饰的itr,其不具有有功能的末端解离位点;第二核酸序列,其与所述第一核酸序列互补或基本上互补;和3'itr。所有类型的含有基因组的aav载体均适合用于本发明的方法。
[0182]
aav载体的非限制性实例包括paav-mcs(agilent technologies)、paavk-ef1α-mcs(system bio目录号aav502a-1)、paavk-ef1α-mcs1-cmv-mcs2(system bio目录号aav503a-1)、paav-zsgreen1(clontech目录号6231)、paav-mcs2(addgene质粒编号46954)、aav-stuffer(addgene质粒编号106248)、paavsccbpigpluc(addgene质粒编号35645)、aavs1_puro_pgk1_3xflag_twin_strep(addgene质粒编号68375)、paav-ram-d2tta::tre-mcs-wpre-pa(addgene质粒编号63931)、paav-ubc(addgene质粒编号62806)、paavs1-p-mcs(addgene质粒编号80488)、paav-gateway(addgene质粒编号32671)、paav-puro_sikd(addgene质粒编号86695)、paavs1-nst-mcs(addgene质粒编号80487)、paavs1-nst-cag-dest(addgene质粒编号80489)、paavs1-p-cag-dest(addgene质粒编号80490)、paavf-enhcb-lacznls(addgene质粒编号35642)和paavs1-shrna(addgene质粒编号82697)。这些载体可以被修饰以适合于治疗用途。例如,感兴趣的外源基因可以被插入到多克隆位点中,并且选择标记(例如puro或编码荧光蛋白的基因)可以被缺失或用另一个(相同或不同的)感兴趣的外源基因代替。aav载体的其他实例公开在下述文献中:美国专利号5,871,982、6,270,996、7,238,526、6,943,019、6,953,690、9,150,882和8,298,818,美国专利公开号2009/0087413,和pct公开号wo2017075335a1、wo2017075338a2和wo2017201258a1。
[0183]
腺病毒载体
[0184]
在某些实施方式中,所述病毒载体可以是腺病毒载体。腺病毒是中等尺寸(90-100nm)、无包膜的(裸露的)二十面体病毒,由核衣壳和双链线性dna基因组构成。术语“腺病毒”是指腺病毒属的任何病毒,包括但不限于人类、牛、羊、马、犬、猪、鼠和猿猴腺病毒亚属。通常,腺病毒载体通过在腺病毒的腺病毒基因组中引入一个或多个突变(例如缺失、插入或替换)来产生,以便适应于非本源核酸序列在所述腺病毒中的插入,例如用于基因转移。
[0185]
人类病毒可用作所述腺病毒载体的腺病毒基因组的来源。例如,腺病毒可以是亚群a(例如血清型12、18和31)、亚群b(例如血清型3、7、1 1、14、16、21、34、35和50)、亚群c(例如血清型1、2、5和6)、亚群d(例如血清型8、9、10、13、15、17、19、20、22-30、32、33、36-39和42-48)、亚群e(例如血清型4)、亚群f(例如血清型40和41)、未分类的亚群(例如血清型49和51)或任何其他腺病毒血清群或血清型。腺病毒血清型1至51可以从美国典型培养物保藏中心(american type culture collection)(atcc,manassas,virginia)获得。非c群腺病毒载体、生产非c群腺病毒载体的方法和使用非c群腺病毒载体的方法公开在例如美国专利号5,801,030、5,837,511和5,849,561以及pct公开号wo1997/012986和wo1998/053087中。
[0186]
非人类腺病毒(例如猿、猴、禽、犬、绵羊或牛腺病毒)可用于产生所述腺病毒载体(即作为所述腺病毒载体的腺病毒基因组的来源)。例如,所述腺病毒载体可以基于猴腺病毒,包括新世界和旧世界猴两者(参见例如“病毒分类:国际病毒分类委员会的vhith报告”(virus taxonomy:vhith report of the international committee on taxonomy of viruses)(2005))。感染灵长动物的腺病毒的系统发育分析公开在例如roy等,(2009)plos pathog.5(7):e1000503中。大猩猩腺病毒可用作腺病毒载体的腺病毒基因组的来源。大猩猩腺病毒和腺病毒载体描述在例如pct公开nos.wo2013/052799、wo2013/052811和wo2013/052832中。腺病毒载体也可以包含亚型的组合,从而成为“嵌合”腺病毒载体。
[0187]
所述腺病毒载体可以是复制型、条件复制型或复制缺陷型的。复制型腺病毒载体可以在典型的宿主细胞、即通常能够被腺病毒感染的细胞中复制。条件复制型腺病毒载体是已被工程化改造以在预定条件下复制的腺病毒载体。例如,可以将复制必需的基因功能例如由腺病毒早期区域编码的基因功能可操作连接到诱导型、阻遏型或组织特异性转录控制序列,例如启动子。条件复制型腺病毒载体被进一步描述在美国专利no.5,998,205中。复制缺陷型腺病毒载体是作为例如一个或多个复制必需的基因功能或区域的缺陷的结果而需要补充腺病毒基因组的复制所需的一个或多个基因功能或区域的腺病毒载体,因此所述腺病毒载体不在典型的宿主细胞、特别是将要被所述腺病毒载体感染的人类的细胞中复制。
[0188]
优选地,所述腺病毒载体是复制缺陷的,使得所述复制缺陷型腺病毒载体需要补充所述腺病毒基因组的至少一个复制必需的基因功能或一个或多个区域才能繁殖(例如形成腺病毒载体粒子)。所述腺病毒载体可以仅在腺病毒基因组的早期区域(即e1-e4区)、仅在腺病毒基因组的晚期区域(即l1-l5区域)、在腺病毒基因组的早期和晚期区域两者中缺陷一个或多个复制必需的基因功能,或缺陷所有的腺病毒基因(即高容量腺病毒载体(hc-ad))。参见例如morsy等,(1998)proc.natl.acad.sci.usa 95:965-976;chen等,(1997)proc.natl.acad.sci.usa 94:1645-1650;和kochanek等,(1999)hum.gene ther.10(15):2451-9。复制缺陷型腺病毒载体的实例公开在美国专利号5,837,511、5,851,806、5,994,106、6,127,175、6,482,616和7,195,896以及pct公开号wo1994/028152、wo1995/002697、wo1995/016772、wo1995/034671、wo1996/022378、wo1997/012986、wo1997/021826和wo2003/022311中。
[0189]
本发明的复制缺陷型腺病毒载体可以在互补细胞系中生产,所述互补细胞系以适合的水平提供在所述复制缺陷型腺病毒载体中不存在但为病毒繁殖所需的基因功能,以便产生高滴度的病毒载体储用物。这种互补细胞系是已知的,并包括但不限于293细胞(描述在例如graham等,(1977)j.gen.virol.36:59-72中)、per.c6细胞(描述在例如pct公开号wo1997/000326和美国专利号5,994,128和6,033,908中)和293-orf6细胞(描述在例如pct公开号wo1995/034671和brough等,(1997)j.virol.71:9206-9213中)。用于生产本发明的复制缺陷型腺病毒载体的其他适合的互补细胞系包括为了繁殖编码其表达在宿主细胞中抑制病毒生长的转入基因的腺病毒载体而产生的互补细胞(参见例如美国专利公开号2008/0233650)。其他适合的互补细胞描述在例如美国专利号6,677,156和6,682,929以及pct公开号wo2003/020879中。含有腺病毒载体的组合物的配方进一步描述在例如美国专利号6,225,289和6,514,943以及pct公开号wo2000/034444中。
[0190]
其他示例性腺病毒载体和/或制备或繁殖腺病毒载体的方法描述在美国专利号5,559,099、5,837,511、5,846,782、5,851,806、5,994,106、5,994,128、5,965,541、5,981,225、6,040,174、6,020,191、6,083,716、6,113,913、6,303,362、7,067,310和9,073,980中。
[0191]
可商购的腺病毒载体系统包括可以从thermo fisher scientific获得的virapower
tm
腺病毒表达系统、可以从agilent technologies获得的adeasy
tm
腺病毒载体系统和可以从takara bio usa,inc获得的adeno-x
tm
表达系统3。
[0192]
病毒载体生产
[0193]
用于生产病毒载体的方法在本领域中是已知的。通常,使用常规技术在适合的宿主细胞系中生产感兴趣的病毒,所述技术包括将转染或感染的宿主细胞在适合条件下培养,以便允许产生感染性病毒粒子。可以将编码病毒基因和/或感兴趣的基因的核酸并入到质粒中,并通过常规的转染或转化技术引入到宿主细胞中。适合于生产所公开的病毒的示例性宿主细胞包括人类细胞系例如hela、hela-s3、hek293、911、a549、her96或per-c6细胞。具体的生产和纯化条件随着所使用的病毒和生产系统而变。
[0194]
在某些实施方式中,可以将生产细胞直接施用到受试者,然而在其他实施方式中,在生产后,从培养物回收并任选地纯化感染性病毒粒子。典型的纯化步骤可以包括噬斑纯化、离心例如氯化铯梯度离心、澄清、酶处理例如全能核酸酶或蛋白酶处理、层析步骤例如离子交换层析或过滤步骤。
[0195]
蛋白质纯化
[0196]
所述超抗原和/或超抗原-靶向部分偶联物优选地在使用之前进行纯化,这可以使用各种不同的纯化方案来实现。在已将所述超抗原或超抗原-靶向部分偶联物与其他蛋白质分开后,可以将所述感兴趣的蛋白质用层析和电泳技术进一步纯化,以实现部分或完全纯化(或纯化至均质)。特别适合于纯肽制备的分析方法是离子交换层析、尺寸排阻层析、亲和层析、聚丙烯酰胺凝胶电泳、等电聚焦。当在本文中使用时,术语“纯化的”打算是指可以与其他组分分离开的组合物,其中所述感兴趣的大分子(例如蛋白质)相对于它的原始状态被纯化至任何程度。通常,术语“纯化的”是指已经历分级以除去各种不同的其他组分,并且基本上保留其生物学活性的大分子。术语“基本上纯化的”是指其中感兴趣的大分子形成组合物的主要组分,例如占所述组合物含量的约50%、约60%、约70%、约80%、约90%、约95%或以上的组合物。
[0197]
用于定量蛋白质的纯化程度的各种不同方法对于本领域技术人员来说是已知的,包括例如确定有活性级分的比活性,以及通过sds-page分析、高效液相色谱(hplc)或任何其他分级技术评估级分中给定蛋白质的量。适合用于蛋白质纯化的各种不同技术包括例如用硫酸铵、peg、抗体等或通过热变性来沉淀,然后进行离心;层析步骤,例如离子交换、凝胶过滤、反相、羟基磷灰石、亲和层析;等电聚焦;凝胶电泳;以及这些和其他技术的组合。设想了进行各种不同纯化步骤的顺序可以被改变,或者某些步骤可以被省略,并仍产生适合于制备基本上纯化的蛋白质或肽的方法。
[0198]
v.药物组合物
[0199]
对于治疗用途来说,将免疫细胞(例如分离的天然存在的免疫细胞或本文中描述的工程化改造的免疫细胞)和/或超抗原偶联物优选地与药学上可接受的载体合并。当在本文中使用时,术语“药学上可接受的”是指在合理的医学判断范围内,适合于与人类和动物
的组织接触使用而没有过度毒性、刺激性、过敏反应或其他问题或并发症,与合理的收益/风险比相称的那些化合物、材料、组合物和/或剂型。
[0200]
当在本文中使用时,术语“药学上可接受的载体”是指适合于与人类和动物的组织接触使用而没有过度毒性、刺激性、过敏反应或其他问题或并发症,与合理的收益/风险比相称的缓冲剂、载体和赋形剂。药学上可接受的载体包括任何标准药物载体,例如磷酸盐缓冲盐水溶液、水、乳液(例如油/水或水/油乳液)和各种不同类型的润湿剂。所述组合物还可以包括稳定剂和防腐剂。载体、稳定剂和佐剂的实例,参见例如martin,《remington制药学》(remington’s pharmaceutical sciences),第15版,mack publ.co.,easton,pa[1975]。药学上可接受的载体包括与药物施用相容的缓冲剂、溶剂、分散介质、包衣、等渗剂和吸收延迟剂等。此类介质和试剂用于药物活性物质的用途在本领域中是已知的。
[0201]
在某些实施方式中,药物组合物可以包含用于改变、维持或保留所述组合物的例如ph、摩尔渗透压浓度、黏度、澄清度、颜色、等渗性、气味、无菌性、稳定性、溶解或释放速率、吸附或渗透的制剂材料。在这样的实施方式中,适合的制剂材料包括但不限于氨基酸(例如甘氨酸、谷氨酰胺、天冬氨酸、精氨酸或赖氨酸);抗微生物剂;抗氧化剂(例如抗坏血酸、亚硫酸钠或亚硫酸氢钠);缓冲剂(例如硼酸盐、碳酸氢盐、tris-hcl、柠檬酸盐、磷酸盐或其他有机酸);增量剂(例如甘露糖醇或甘氨酸);螯合剂(例如乙二胺四乙酸(edta));络合剂(例如咖啡因、聚乙烯吡咯烷酮、β-环糊精或羟丙基-β-环糊精);填充剂;单糖、二糖、和其他碳水化合物(例如葡萄糖、甘露糖或糊精);蛋白质(例如血清白蛋白、明胶或免疫球蛋白);着色剂、调味剂和稀释剂;乳化剂;亲水性聚合物(例如聚乙烯吡咯烷酮);低分子量多肽;成盐平衡离子(例如钠);防腐剂(例如苯扎氯铵、苯甲酸、水杨酸、硫柳汞、苯乙醇、对羟基苯甲酸甲酯、对羟基苯甲酸丙酯、氯己定、山梨酸或过氧化氢);溶剂(例如甘油、丙二醇或聚乙二醇);糖醇(例如甘露糖醇或山梨糖醇);悬浮剂;表面活性剂或润湿剂(例如普朗尼克、peg、失水山梨糖醇酯、聚山梨醇酯例如聚山梨醇酯20、聚山梨醇酯、曲拉通、氨丁三醇、卵磷脂、胆固醇、泰洛沙泊);稳定性增强剂(例如蔗糖或山梨糖醇);张力增强剂(例如碱金属卤化物,优选为氯化钠或氯化钾、甘露糖醇、山梨糖醇);递送媒介;稀释剂;赋形剂和/或药物佐剂(参见《remington制药学》(remington’s pharmaceutical sciences)第18版,(mack publishing company,1990))。
[0202]
在某些实施方式中,药物组合物可以含有纳米粒子,例如聚合纳米粒子、脂质体或胶束(参见anselmo等,(2016)bioeng.transl.med.1:10-29)。
[0203]
在某些实施方式中,药物组合物可以含有持续或受控递送制剂。用于配制持续或受控递送手段例如脂质体载体、可生物侵蚀微粒或多孔珠和储库型注射剂的技术,对于本领域技术人员来说也是已知的。持续释放制剂可以包括例如多孔聚合物微粒或采取成型制品形式的半透性聚合物基质,例如薄膜或微胶囊。持续释放基质可以包括聚酯、水凝胶、聚丙交酯、l-谷氨酸和γ-l-谷氨酸乙酯的共聚物、聚(甲基丙烯酸2-羟乙基酯)、乙烯-乙酸乙烯酯或聚d(-)-3-羟基丁酸。持续释放组合物还可以包括可以通过本领域已知的几种方法中的任一种来制备的脂质体。
[0204]
本文公开的含有免疫细胞和/或超抗原偶联物的药物组合物可以以单一剂型呈现,并且可以通过任何适合的方法制备。药物组合物应该被配制成与其计划施用途径相容。施用途径的实例是静脉内(iv)、肌肉内、真皮内、吸入、透皮、局部、透黏膜、鞘内和直肠施
用。在某些实施方式中,本文公开的含有免疫细胞和/或超抗原偶联物的药物组合物通过iv输注施用。或者,所述药剂可以局部而不是系统地施用,例如通过将所述一种或多种药剂直接注射到作用部位中,通常采取储库或持续释放制剂的形式。在某些实施方式中,本文公开的含有免疫细胞和/或超抗原偶联物的药物组合物通过肿瘤内注射施用。
[0205]
有用的制剂可以通过制药领域中公知的方法来制备。例如参见《remington制药学》(remington's pharmaceutical sciences)第18版(mack publishing company,1990)。适用于肠胃外施用的制剂组分包括无菌稀释剂例如注射用水、盐水溶液、非挥发油、聚乙二醇、甘油、丙二醇或其他合成溶剂,抗细菌剂例如苯甲醇或对羟基苯甲酸甲酯,抗氧化剂例如抗坏血酸或亚硫酸氢钠,螯合剂例如edta,缓冲剂例如乙酸盐、柠檬酸盐或磷酸盐,以及用于调节渗涨度的药剂例如氯化钠或右旋糖。
[0206]
对于静脉内施用来说,适合的载体包括生理盐水、抑菌水、cremophor eltm(basf,parsippany,nj)或磷酸盐缓冲盐水(pbs)。所述载体在制造和储存条件下应该是稳定的,并且应该针对微生物防腐。所述载体可以是含有例如水、乙醇、多元醇(例如甘油、丙二醇和液体聚乙二醇)及其适合的混合物的溶剂或分散介质。
[0207]
药物制剂优选是无菌的。除菌可以通过任何适合的方法例如经无菌过滤膜过滤来实现。在所述组合物被冷冻干燥的情况下,过滤除菌可以在冷冻干燥和重构之前或之后进行。
[0208]
在某些实施方式中,药物组合物可以包含例如至少约0.1%的活性化合物。在其他实施方式中,所述活性化合物可以例如占所述单元重量的约2%至约75%之间或约25%至约60%之间和其间任何可推导的范围。本领域技术人员在制备此类药物剂型时应该考虑到诸如溶解性、生物可利用性、生物半衰期、施用途径、产品保质期等因素以及其他药理学考虑因素,因此,各种不同的剂量和治疗方案可能是合乎需要的。此类确定为本领域技术人员所知并使用。
[0209]
所述活性药剂以有效减少、降低、抑制或以其他方式废止癌细胞的生长或增殖,诱导凋亡,抑制癌症或肿瘤的血管发生,抑制转移或在细胞中诱导细胞毒性的量施用。用于实践本发明以对癌症进行治疗性治疗的活性化合物的有效量随着施用方式、受试者的年龄、体重和总体健康而变。这些术语包括协同的情况,其中单独的单一药剂例如超抗原偶联物或免疫细胞可能作用微弱或完全不起作用,但在彼此组合例如但不限于通过顺序施用时,所述两种或更多种药剂发挥作用以产生协同结果。
[0210]
通常,活性组分的治疗有效量在0.1mg/kg至100mg/kg,例如1mg/kg至100mg/kg、1mg/kg至10mg/kg的范围内。施用量取决于多种变量,例如待治疗的疾病或病症的类型和程度、患者的总体健康、抗体的体内功效、药物制剂和施用途径。初始剂量可以提高到超过上限水平,以便迅速达到所需的血液水平或组织水平。或者,初始剂量可以小于最佳值,并且在治疗期间可以逐渐提高每日剂量。可以对人类剂量进行优化,例如在被设计从0.5mg/kg运行至20mg/kg的常规i期剂量递增研究中。施用频率可以随着多种因素而变,例如施用途径、剂量、抗体的血清半衰期和所治疗的疾病。示例性的施用频率是每天一次、每周一次和每两周一次。优选的施用途径是肠胃外,例如静脉内输注。在某些实施方式中,超抗原偶联物被冷冻干燥,然后在施用时在缓冲盐水中重构。
[0211]
在某些非限制性实例中,分离的、天然存在的或工程化改造的免疫细胞例如t细胞
的剂量在例如105至109个细胞/kg、105至108个细胞/kg、105至107个细胞/kg、105至106个细胞/kg、106至109个细胞/kg、106至108个细胞/kg、106至107个细胞/kg、107至109个细胞/kg、107至108个细胞/kg或108至109个细胞/kg或106至10
11
个总细胞、106至10
10
个总细胞、106至109个总细胞、106至108个总细胞、106至107个总细胞、107至10
11
个总细胞、107至10
10
个总细胞、107至109个总细胞、107至108个总细胞、108至10
11
个总细胞、108至10
10
个总细胞108至109个总细胞、109至10
11
个总细胞、109至10
10
个总细胞或10
10
至10
11
个总细胞的范围内。施用量将取决于多种变量,例如待治疗的疾病或病症的类型和程度、患者的总体健康、抗体的体内功效、药物制剂和施用途径。可以通过定期评估来监测进展。
[0212]
在某些非限制性实例中,所述超抗原偶联物的剂量也可以包括每次施用约1微克/kg/体重、约5微克/kg/体重、约10微克/kg/体重、约15微克/kg/体重、约20微克/kg/体重、约50微克/kg/体重、约100微克/kg/体重、约200微克/kg/体重、约350微克/kg/体重、约500微克/kg/体重、约1毫克/kg/体重、约5毫克/kg/体重、约10毫克/kg/体重、约50毫克/kg/体重、约100毫克/kg/体重、约200毫克/kg/体重、约350毫克/kg/体重、约500毫克/kg/体重至约1000mg/kg/体重或更高,以及其间任何可推导的范围。在从本文中列出的数字可推导的范围的非限制性实例中,包括约5mg/kg/体重至约100mg/kg/体重、约5微克/kg/体重至约500毫克/kg/体重、约1微克/kg/体重至约100毫克/kg/体重。基于上面描述的数字,可以施用其他的示例性剂量范围,例如约1微克/kg/体重至约1000微克/kg/体重、约1微克/kg/体重至约100微克/kg/体重、约1微克/kg/体重至约75微克/kg/体重、约1微克/kg/体重至约50微克/kg/体重、约1微克/kg/体重至约40微克/kg/体重、约1微克/kg/体重至约30微克/kg/体重、约1微克/kg/体重至约20微克/kg/体重、约1微克/kg/体重至约15微克/kg/体重、约1微克/kg/体重至约10微克/kg/体重、约5微克/kg/体重至约1000微克/kg/体重、约5微克/kg/体重至约100微克/kg/体重、约5微克/kg/体重至约75微克/kg/体重、约5微克/kg/体重至约50微克/kg/体重、约5微克/kg/体重至约40微克/kg/体重、约5微克/kg/体重至约30微克/kg/体重、约5微克/kg/体重至约20微克/kg/体重、约5微克/kg/体重至约15微克/kg/体重、约5微克/kg/体重至约10微克/kg/体重、约10微克/kg/体重至约1000微克/kg/体重、约10微克/kg/体重至约100微克/kg/体重、约10微克/kg/体重至约75微克/kg/体重、约10微克/kg/体重至约50微克/kg/体重、约10微克/kg/体重至约40微克/kg/体重、约10微克/kg/体重至约30微克/kg/体重、约10微克/kg/体重至约20微克/kg/体重、约10微克/kg/体重至约15微克/kg/体重、约15微克/kg/体重至约1000微克/kg/体重、约15微克/kg/体重至约100微克/kg/体重、约15微克/kg/体重至约75微克/kg/体重、约15微克/kg/体重至约50微克/kg/体重、约15微克/kg/体重至约40微克/kg/体重、约15微克/kg/体重至约30微克/kg/体重、约15微克/kg/体重至约20微克/kg/体重、约20微克/kg/体重至约1000微克/kg/体重、约20微克/kg/体重至约100微克/kg/体重、约20微克/kg/体重至约75微克/kg/体重、约20微克/kg/体重至约50微克/kg/体重、约20微克/kg/体重至约40微克/kg/体重、约20微克/kg/体重至约30微克/kg/体重等的范围。
[0213]
在例如施用超抗原偶联物的某些实施方式中,施用的所述超抗原偶联物的有效量或剂量是在0.01至500μg/kg受试者体重例如0.1-500μg/kg受试者体重和例如1-100μg/kg受试者体重的范围内的量。
[0214]
本文公开的组合物可以局部或系统地施用。施用通常是肠胃外施用。在优选实施
方式中,所述药物组合物被皮下施用,在甚至更优选实施方式中,被静脉内施用。用于肠胃外施用的制剂包括无菌水性或非水性溶液、悬液和乳液。
[0215]
vi.治疗性用途
[0216]
本文公开的组合物和方法可用于在受试者中治疗各种不同形式的癌症或在受试者中抑制癌症生长。本发明提供了一种在受试者中治疗癌症的方法。所述方法包括单独地或与另一种治疗药剂联合向所述受试者施用有效量的所公开的免疫细胞和/或超抗原偶联物,以在所述受试者中治疗所述癌症。例如,可以将所述公开的免疫细胞和/或超抗原偶联物施用到所述受试者,以减缓癌细胞的生长速率、减少转移的发生或数目、减小肿瘤尺寸、抑制肿瘤生长、减少肿瘤或癌细胞的血液供应、促进针对癌细胞或肿瘤的免疫应答、阻止或抑制癌症的进展,其程度为例如至少40%、50%、60%、70%、80%、90%、95%、98%、99%或100%。或者,可以将所述免疫细胞和/或超抗原偶联物施用到所述受试者以便治疗所述癌症,例如将患有癌症的受试者的寿命增加例如3个月、6个月、9个月、12个月、1年、5年或10年。
[0217]
优选地,待治疗的患者将具有足够的骨髓功能(被定义为》2,000/mm3的外周绝对粒细胞计数和100,000/mm3的血小板计数)、足够的肝功能(胆红素《1.5mg/dl)和足够的肾功能(肌酐《1.5mg/dl)。
[0218]
设想了可以使用本文描述的方法和组合物治疗多种癌症,包括但不限于原发性或转移黑素瘤、腺癌、鳞状细胞癌、腺鳞状细胞癌、胸腺瘤、淋巴瘤、肉瘤、肺癌、肝癌、非霍奇金淋巴瘤、霍奇金淋巴瘤、白血病、子宫癌、乳腺癌、前列腺癌、卵巢癌、胰腺癌、结肠癌、多发性骨髓瘤、成神经细胞瘤、npc、膀胱癌、宫颈癌等。
[0219]
此外,可以使用本文中描述的方法和组合物治疗的癌症可以基于待治疗的身体位置和/或系统,例如但不限于骨骼(例如尤因氏家族的肿瘤、骨肉瘤);脑(例如成人脑肿瘤(例如成人脑肿瘤、脑干胶质瘤(儿童期)、小脑星形细胞瘤(儿童期)、脑星形细胞瘤/恶性胶质瘤(儿童期)、室管膜瘤(儿童期)、髓母细胞瘤(儿童期)、幕上原始神经外胚层肿瘤和松果体母细胞瘤(儿童期)、视觉通路和下丘脑胶质瘤(儿童期)和儿童期脑肿瘤(其他));乳腺(例如女性或男性乳腺癌);消化/胃肠道(例如肛门癌、胆管癌(肝外)、类癌肿瘤(胃肠)、结肠癌、食道癌、胆囊癌、肝癌(成人原发性)、肝癌(儿童期)、胰腺癌、小肠癌、胃癌);内分泌(例如肾上腺皮质癌、类癌肿瘤(胃肠道)、胰岛细胞癌(内分泌胰腺)、甲状旁腺癌、嗜铬细胞瘤、垂体瘤、甲状腺癌);眼(例如黑素瘤(眼内)、视网膜母细胞瘤);泌尿生殖系统(例如膀胱癌、肾(肾细胞)癌、阴茎癌、前列腺癌、肾盂和输尿管癌(移行细胞)、睾丸癌、尿道癌、肾母细胞瘤和其他儿童期肾肿瘤);生殖细胞(例如颅外生殖细胞肿瘤(儿童期)、性腺外生殖细胞肿瘤、卵巢生殖细胞肿瘤、睾丸癌);妇产科(例如宫颈癌、子宫内膜癌、妊娠滋养细胞肿瘤、卵巢上皮癌、卵巢生殖细胞肿瘤、卵巢低恶性潜能肿瘤、子宫肉瘤、阴道癌、外阴癌);头颈部(例如下咽癌、喉癌、唇和口腔癌、转移性鳞状颈癌伴隐匿性原发癌、鼻咽癌、口咽癌、副鼻窦和鼻腔癌、甲状旁腺癌、唾液腺癌);肺(例如非小细胞肺癌、小细胞肺癌);淋巴瘤(例如aids相关淋巴瘤、皮肤t细胞淋巴瘤、霍奇金淋巴瘤(成人)、霍奇金淋巴瘤(儿童期)、妊娠期霍奇金淋巴瘤、蕈样肉芽肿、非霍奇金淋巴瘤(成人)、非霍奇金淋巴瘤(儿童期)、妊娠期非霍奇金淋巴瘤、原发性中枢神经系统淋巴瘤、sezary综合征、t细胞淋巴瘤(皮肤)、华氏巨球蛋白血症);肌肉骨骼(例如尤因氏家族的肿瘤、骨肉瘤/骨骼的恶性纤维组织细胞瘤、横纹肌肉
瘤(儿童期)、软组织肉瘤(成人)、软组织肉瘤(儿童期)、子宫肉瘤);神经系统(例如成人脑肿瘤、儿童期脑肿瘤(例如脑干胶质瘤、小脑星形细胞瘤、脑星形细胞瘤/恶性胶质瘤、室管膜瘤、髓母细胞瘤、幕上原始神经外胚层肿瘤和松果体母细胞瘤、视觉通路和下丘脑胶质瘤、其他脑肿瘤)、成神经细胞瘤、垂体肿瘤、原发性中枢神经系统淋巴瘤);呼吸系统/胸部(例如非小细胞肺癌、小细胞肺癌、恶性间皮瘤、胸腺瘤和胸腺癌);和皮肤(例如皮肤t细胞淋巴瘤、卡波西肉瘤、黑素瘤和皮肤癌)。
[0220]
应该理解,所述方法可用于治疗各种不同的癌症,例如选自乳腺癌、膀胱癌、宫颈癌、结肠癌、结肠直肠癌、子宫内膜癌、胃癌、头颈癌、肝癌、黑素瘤、间皮瘤、非小细胞肺癌、卵巢癌、胰腺癌、前列腺癌、肾细胞癌和皮肤癌的癌症。
[0221]
此外,所述癌症可以包括由肿瘤细胞构成的肿瘤。例如,肿瘤细胞可以包括但不限于黑素瘤细胞、膀胱癌细胞、乳腺癌细胞、肺癌细胞、结肠癌细胞、前列腺癌细胞、肝癌细胞、胰腺癌细胞、胃癌细胞、睾丸癌细胞、肾癌细胞、卵巢癌细胞、淋巴癌细胞、皮肤癌细胞、脑癌细胞、骨癌细胞或软组织癌细胞。可以按照本发明治疗的实体肿瘤的实例包括肉瘤和癌,例如但不限于:纤维肉瘤,粘液肉瘤,脂肪肉瘤,软骨肉瘤,骨源性肉瘤,脊索瘤,血管肉瘤,内皮肉瘤,淋巴管肉瘤,淋巴管内皮肉瘤,滑膜瘤,间皮瘤,尤文氏瘤,平滑肌肉瘤,横纹肌肉瘤,结肠癌,胰腺癌,乳腺癌,卵巢癌,前列腺癌,鳞状细胞癌,基底细胞癌,腺癌,汗腺癌,皮脂腺癌,乳头状癌,乳头状腺癌,囊腺癌,髓样癌,支气管癌,肾细胞癌,肝癌,胆管癌,绒毛膜癌,精原细胞癌,胚胎癌,肾母细胞瘤,宫颈癌,睾丸肿瘤,肺癌,小细胞肺癌,膀胱癌,上皮癌,神经胶质瘤,星形细胞瘤,髓母细胞瘤,颅咽管瘤,室管膜瘤,松果体瘤,血管母细胞瘤,听神经瘤,少突神经胶质瘤,脑膜瘤,黑素瘤,成神经细胞瘤和视网膜母细胞瘤。
[0222]
治疗方案也可能变化,并且通常取决于肿瘤类型、肿瘤位置、疾病进展和患者的健康和年龄。某些类型的肿瘤可能需要更积极的治疗方案,但与此同时,患者可能不能耐受更积极的治疗方案。临床医生通常可能最适合在其本领域技术和所述治疗性剂型的已知功效和毒性(如果有的话)的基础上做出此类决定。
[0223]
用于原发性肿瘤或切除后的肿瘤床的典型治疗过程可能涉及多次施用。典型的原发性肿瘤治疗可能包括在两周期间6次施用。所述两周的方案可以重复1、2、3、4、5、6次或更多次。在治疗过程中,可以重新评估完成所述计划施用方案的必要性。
[0224]
使用所述超抗原偶联物的免疫疗法通常引起t淋巴细胞的快速(在数小时内)有力的多克隆激活。超抗原偶联物治疗周期可能包括每天4至5次超抗原偶联物药物静脉内注射。这种治疗周期可以以例如4至6周的间隔提供。伴有ctl在肿瘤中的浸润的炎症是抗肿瘤治疗性超抗原的主要效应物之一。在ctl短时间内大量激活和分化后,t细胞应答迅速(在4-5天内)降低回到基线水平。因此,细胞抑制药物可能干扰超抗原治疗的淋巴细胞增殖时段是短暂且明确的。
[0225]
在某些实施方式中,每2至12周(例如2、3、4、5、6、7、8、9、10、11或12周),受试者被每天施用超抗原偶联物例如本文中设想的超抗原偶联物连续2至6天(例如连续2、3、4、5或6天)。在某些实施方式中,每3至4周(例如3或4周),受试者被每天施用超抗原偶联物例如本文设想的超抗原偶联物连续4天。
[0226]
在某些实施方式中,本发明的治疗方案可以包括将所述肿瘤或肿瘤细胞与所述超抗原偶联物和免疫细胞例如car t细胞同时进行接触。这可以通过将所述细胞与包含两种
药剂的单一组合物或药物制剂接触或通过将所述细胞与两种不同组合物或制剂同时接触来实现,在后一种情况中一种组合物包含所述超抗原偶联物并且另一种组合物包含所述免疫细胞例如car t细胞。
[0227]
或者,所述超抗原偶联物可以在所述免疫细胞例如car t细胞之前或之后以数分钟、数天至数周范围内的时间间隔施用。在所述免疫细胞例如car t细胞和超抗原偶联物分开施加到所述细胞的实施方式中,人们应该确保在每一者递送的时间之间没有显著的时间间隔,使得所述超抗原偶联物和免疫细胞例如car t细胞仍将能够对所述细胞发挥有利的组合效应。在此类情况下,设想了人们可以将所述细胞在彼此之间约12-72小时以内与两种用药模式接触。在某些情况下,可能希望显著延长治疗时长,然而,在相应的施用之间流逝时间为几天(2、3、4、5、6或7天)至几周(1、2、3、4、5、6、7或8周)。
[0228]
可以使用各种不同的组合,其中所述超抗原偶联物用“a”表示,并且所述免疫细胞例如car t细胞用“b”表示:a/b/a,b/a/b,b/b/a,a/a/b,a/b/b,b/a/a,a/b/b/b,b/a/b/b,b/b/b/a,b/b/a/b,a/a/b/b,a/b/a/b,a/b/b/a,b/b/a/a,b/a/b/a,b/a/a/b,a/a/a/b,b/a/a/a,a/b/a/a,以及a/a/b/a。
[0229]
设想了与所述超抗原偶联物相组合施用的免疫细胞例如car t细胞的有效量或剂量,是导致至少累加但优选地协同抗肿瘤效果,并且不干扰或抑制免疫系统的增强或t细胞激活的剂量。如果所述免疫细胞例如car t细胞与超抗原偶联物同时施用,则所述免疫细胞例如car t细胞可以以低剂量施用,使得它不干扰所述超抗原偶联物的作用机制。
[0230]
本文描述的方法和组合物可以单独地或者与其他治疗剂和/或形式联合使用。当在本文中使用时,术语“联合”施用被理解为意味着在受试者患有障碍的过程中将两种(或更多种)不同治疗递送至到所述受试者,使得所述治疗对患者的效果在时间点上有重叠。在某些实施方式中,一种治疗的递送在第二种治疗的递送开始时仍在发生,使得在施用方面存在重叠。这在本文中有时被称为“同时”或“并行递送”。在其他实施方式中,一种治疗的递送在另一种治疗的递送开始之前结束。在任一种情况的某些实施方式中,由于联合施用,所述治疗更加有效。例如,第二种治疗更加有效,例如使用较少的第二种治疗可以看到等同的效果,或者第二种治疗与在不存在第一种治疗的情况下施用第二种治疗时将会看到的相比以更大程度减轻症状,或者在使用第一种治疗时观察到类似的情况。在某些实施方式中,与在不存在另一种治疗的情况下递送一种治疗时观察到的相比,递送使得症状或与所述障碍相关的其他参数的减轻更大。所述两种治疗的效果可以是部分累加、完全累加或超过累加的。所述递送可以使递送的第一种治疗的效果在递送第二种治疗时仍可检测。
[0231]
在某些实施方式中,本文描述的方法或组合物与一种或多种另外的疗法例如手术、放疗或另一种治疗性制剂的施用相结合施用。在某些实施方式中,所述另外的疗法可以包括化疗例如细胞毒性药剂。在某些实施方式中,所述另外的疗法可以包括靶向疗法,例如酪氨酸激酶抑制剂、蛋白酶体抑制剂或蛋白酶抑制剂。在某些实施方式中,所述另外的疗法可以包括抗炎、抗血管生成、抗纤维化或抗增殖化合物,例如甾类、生物免疫调节剂、单克隆抗体、抗体片段、适体、sirna、反义分子、融合蛋白、细胞因子、细胞因子受体、支气管扩张剂、他汀类药物、抗炎剂(例如甲氨蝶呤)或nsaid。在某些实施方式中,所述另外的疗法可以包括被设计用于降低所述受试者对施用的超抗原偶联物的可能的免疫反应性的化合物。例如,对施用的超抗原的免疫反应性,可以通过与例如在受试者中减少抗超抗原抗体的产生
的抗cd20抗体和/或抗cd19抗体共同施用来降低。在某些实施方式中,所述另外的疗法可以包括不同类型的治疗剂的组合。
[0232]
在某些实施方式中,本文描述的方法和组合物与免疫增强剂联合施用。
[0233]
在某些实施方式中,示例性的免疫增强剂可以:(a)刺激活化的t细胞信号传导,(b)阻遏癌细胞与t细胞之间的t细胞抑制性信号传导,(c)通过非人类igg1介导的免疫应答途径例如人类igg4免疫球蛋白介导的途径阻遏导致t细胞扩增、激活和/或活性的抑制性信号传导,(d)(a)与(b)的组合,(e)(a)与(c)的组合,(f)(b)与(c)的组合,和(g)(a)、(b)与(c)的组合。
[0234]
在某些实施方式中,所述免疫增强剂是检查点途径抑制剂。所述检查点抑制剂可以例如选自pd-1拮抗剂、pd-l1拮抗剂、ctla-4拮抗剂、腺苷a2a受体拮抗剂、b7-h3拮抗剂、b7-h4拮抗剂、btla拮抗剂、kir拮抗剂、lag3拮抗剂、tim-3拮抗剂、vista拮抗剂或tigit拮抗剂。
[0235]
pd-1是存在于t细胞表面上的受体,其充当免疫系统检查点,在适合的时间点抑制或以其他方式调节t细胞活性,以防止过于活跃的免疫应答。然而,癌细胞可以通过表达与t细胞表面上的pd-1相互作用的配体例如pd-l1、pd-l2等,利用该检查点来关闭或调节t细胞活性。使用这种方法,癌症可以避开t细胞介导的免疫应答。
[0236]
在所述ctla-4途径中,t细胞上的ctla-4与其在抗原呈递细胞(而不是癌细胞)表面上的配体(例如也被称为b7-1的cd80和cd86)的相互作用导致t细胞抑制。结果,所述抑制t细胞激活或活性的配体(例如cd80或cd86)由抗原呈递细胞(免疫系统中的一种关键细胞类型)而不是癌细胞提供。尽管ctla-4和pd-1结合两者对t细胞具有相似的负面影响,但这两种免疫检查点的下调时间安排、负责的信号传导机制和免疫抑制的解剖学位置不同(american journal of clinical oncology.volume 39,number 1,february 2016)。与局限于t细胞激活的早期引发阶段的ctla-4不同,pd-1在晚得多的效应阶段期间起作用(keir等,(2008)annu.rev immunol.,26:677
–
704)。ctla-4和pd-1代表了两种具有独立的、非冗余作用机制的t细胞抑制性受体。
[0237]
在某些实施方式中,所述免疫增强剂阻止(完全或部分)由所述癌细胞表达的抗原阻遏所述癌细胞与t细胞之间的t细胞抑制性信号传导。在一个实施方式中,这种免疫增强剂是检查点抑制剂,例如基于pd-1的抑制剂。此类免疫增强剂的实例包括例如抗pd-1抗体、抗pd-l1抗体和抗pd-l2抗体。
[0238]
在某些实施方式中,所述超抗原偶联物与基于pd-1的抑制剂一起施用。基于pd-1的抑制剂可以包括(i)pd-1抑制剂,即与t细胞上的pd-1结合以阻止由感兴趣的癌细胞表达的pd-1配体的结合的分子(例如抗体或小分子),和/或(ii)pd-l抑制剂例如pd-l1或pd-l2抑制剂,即与pd-1配体(例如pd-l1或pd-l2)结合以阻止所述pd-1配体与它在t细胞上的同源pd-1的结合的分子(例如抗体或小分子)。
[0239]
在某些实施方式中,所述超抗原偶联物与ctla-4抑制剂例如抗ctla-4抗体一起施用。示例性的抗ctla-4抗体描述在美国专利号6,984,720、6,682,736、7,311,910、7,307,064、7,109,003、7,132,281、6,207,156、7,807,797、7,824,679、8,143,379、8,263,073、8,318,916、8,017,114、8,784,815和8,883,984、国际(pct)公开号wo98/42752、wo00/37504和wo01/14424以及欧洲专利号ep 1212422b1中。示例性的抗ctla-4抗体包括伊匹单抗或曲美
木单抗。
[0240]
在某些实施方式中,所述免疫增强剂通过人类igg4(非人类igg1)介导的免疫应答途径例如不通过adcc途径阻止(完全或部分)由所述癌细胞表达的抗原阻遏t细胞扩增、激活和/或活性。设想了在此类实施方式中,尽管由所述超抗原偶联物和免疫增强剂加强的免疫应答可能包括一些adcc活性,但所述免疫应答的主要组分不涉及adcc活性。相反,目前用于免疫疗法的某些抗体例如伊匹单抗(抗ctla-4igg1单克隆抗体)可以通过效应细胞上的fc受体,通过经它们的fc结构域的信号传导,经adcc杀死靶向细胞。伊匹单抗与许多其他治疗性抗体相同,被设计成人类igg1免疫球蛋白,并且尽管伊匹单抗阻断ctla-4与cd80或cd86之间的相互作用,但它的作用机制据信包括表达高水平细胞表面ctla-4的肿瘤浸润性调节性t细胞的adcc耗竭(mahoney等,(2015)nature reviews,drug discovery 14:561-584)。鉴于ctla-4在一部分t细胞(调节性t细胞)上高表达,用于负向控制t细胞激活,因此当施用抗ctla-4igg1抗体时,调节性t细胞的数目通过adcc减少。
[0241]
在某些实施方式中,理想的是使用其作用方式主要是阻断癌细胞与t细胞之间的抑制性信号传导而不显著耗竭所述t细胞群体(例如允许所述t细胞群体扩增)的免疫增强剂。为此,理想的是使用具有或基于人类igg4同种型的抗体,例如抗pd-1抗体、抗pd-l1抗体或抗pd-l2抗体。在某些情况下人类igg4同种型是优选的,因为这种抗体同种型与人类igg1同种型相比引起很少或不引起adcc活性(mahoney等,(2015)同上)。因此,在某些实施方式中,所述免疫增强剂例如抗pd-1抗体、抗pd-l1抗体或抗pd-l2抗体具有或基于人类igg4同种型。在某些实施方式中,所述免疫增强剂是一种未知的耗竭treg的抗体,例如针对非ctla-4检查点的igg4抗体(例如抗pd-1igg4抑制剂)。
[0242]
在某些实施方式中,所述免疫增强剂是具有或基于人类igg1同种型或另一种同种型,引发抗体依赖性细胞介导的细胞毒性(adcc)和/或补体介导的细胞毒性(cdc)的抗体。在其他实施方式中,所述免疫增强剂是具有或基于人类igg4同种型或另一种同种型,引发很少不不引发体依赖性细胞介导的细胞毒性(adcc)和/或补体介导的细胞毒性(cdc)的抗体。
[0243]
示例性的基于pd-1的抑制剂描述在美国专利号8,728,474、8,952,136和9,073,994以及欧洲专利号1537878b1中。示例性的抗pd-1抗体描述在例如美国专利号8,952,136、8,779,105、8,008,449、8,741,295、9,205,148、9,181,342、9,102,728、9,102,727、8,952,136、8,927,697、8,900,587、8,735,553和7,488,802中。示例性的抗pd-1抗体包括纳武单抗(bristol-myers squibb)、派姆单抗(merck)、西米普利单抗(regeneron/sanofi)、spartalizumab(pdr001)、medi0680(amp-514)、匹利珠单抗(ct-011)、dostarlimab、信迪利单抗、特瑞普利单抗、卡瑞利珠单抗、替雷利珠单抗和prolgolimab。示例性的抗pd-l1抗体描述在例如美国专利号9,273,135、7,943,743、9,175,082、8,741,295、8,552,154和8,217,149中。示例性的抗pd-l1抗体包括阿维单抗(emd serono/pfizer)、阿特珠单抗(genentech)和德瓦鲁单抗(medimmune/astrazeneca)。
[0244]
在某些实施方式中,受试者每1至5周(例如每1、2、3、4或5周)施用基于pd-1的抑制剂,例如抗pd-1抗体,例如本文设想的抗pd-1抗体。在某些实施方式中,受试者每2至4周(例
如每2、3或4周)施用基于pd-1的抑制剂,例如抗pd-1抗体,例如本文设想的抗pd-1抗体。
[0245]
所述基于pd-1的抑制剂可以使用本领域技术人员已知的技术例如上文中描述的技术来设计、表达和纯化。所述抗pd-1抗体可以如美国专利号8,728,474、8,952,136和9,073,994中所述来设计、表达、纯化、配制和施用。
[0246]
其他免疫增强剂(例如抗体和各种不同的小分子)可以靶向涉及下述配体中的一者或多者的信号传导途径:b7-h3(存在于前列腺癌、肾细胞癌、非小细胞肺癌、胰腺癌、胃癌、卵巢癌、结肠直肠癌细胞等上);b7-h4(存在于乳腺癌、肾细胞癌、卵巢癌、胰腺癌、黑素瘤细胞等上);hhla2(存在于乳腺癌、肺癌、甲状腺癌、黑素瘤、胰腺癌、卵巢癌、肝癌、膀胱癌、结肠癌、前列腺癌、肾癌细胞等上);半乳糖凝集素(存在于非小细胞肺癌、结肠直肠癌和胃癌细胞等上);cd30(存在于霍奇金淋巴瘤、大细胞淋巴瘤细胞等上);cd70(存在于非霍奇金淋巴瘤、肾癌细胞等上);icosl(存在于成胶质细胞瘤、黑素瘤细胞等上);cd155(存在于肾癌、前列腺癌、胰腺癌、成胶质细胞瘤细胞等上);和tim3。同样地,可以使用的其他潜在免疫增强剂包括例如4-1bb(cd137)激动剂(例如全人igg4抗cd137抗体urelumab/bms-663513)、lag3抑制剂(例如人源化igg4抗lag3抗体lag525,novartis)、ido抑制剂(例如小分子incb024360,incyte corporation)、tgfβ抑制剂(例如小分子galunisertib,eli lilly)和存在于t细胞和/或肿瘤细胞上的其他受体或配体。在某些实施方式中,靶向涉及上述配体中的一者或多者的信号传导途径的免疫增强剂(例如抗体和各种不同的小分子)适合于基于激动剂/拮抗剂相互作用但不通过adcc的药物干预。
[0247]
进一步设想了本发明可以与手术干预组合使用。在手术干预的情况下,本发明可以在术前使用,以例如使不可手术的肿瘤受试者变成可以切除。或者,本发明可以在手术时和/或其后使用,以治疗残留的或转移的疾病。例如,可以用包含所述免疫细胞和/或超抗原偶联物的剂型注射或灌注切除的肿瘤床。所述灌注可以在切除后继续,例如通过留下植入在手术部位处的导管。也设想了定期术后治疗。本发明的疗法与手术的任何组合均在本发明的范围之内。
[0248]
在适当情况下也可以应用连续施用,例如在切除肿瘤并对肿瘤床进行治疗以消除残留的微小疾病的情况下。优选地通过注射器或导管递送。此类连续灌注可以在治疗开始后进行约1-2小时至约2-6小时、至约6-12小时、至约12-24小时、至约1-2天、至约1-2周或更长的时间段。通常,通过连续灌注施用的治疗性组合物的剂量等同于通过单次或多次注射提供的剂量,并根据灌注进行的时间长度进行调整。还设想了可以使用肢体灌注来施用本发明的治疗性组合物,特别是在黑素瘤和肉瘤的治疗中。
[0249]
可以与本文描述的方法或组合物联合施用的示例性的细胞毒性药剂包括例如抗微管剂、拓扑异构酶抑制剂、抗代谢物、蛋白质合成和降解抑制剂、有丝分裂抑制剂、烷化剂,铂化剂、核酸合成的抑制剂、组蛋白脱乙酰酶抑制剂(hdac抑制剂,例如伏立诺他(saha、mk0683)、恩替司他(ms-275)、帕比司他(lbh589)、曲古抑菌素a(tsa)、mocetinostat(mgcd0103)、贝利司他(pxd101)、罗米地辛(fk228、depsipeptide))、dna甲基转移酶抑制剂、氮芥类、亚硝基脲类、乙烯亚胺类、烷基磺酸酯类、三氮烯类、叶酸类似物、核苷类似物、核糖核苷酸还原酶抑制剂、长春花生物碱、紫杉烷类、埃博霉素、嵌入剂、能够干扰信号转导途径的药剂、促进细胞凋亡和辐射的试剂或结合表面蛋白以递送有毒药剂的抗体分子偶联物。在一个实施方式中,可以与本文描述的方法或组合物一起施用的细胞毒性药剂是基于
nap的组合具有最强效应,导致癌细胞存活率降低75%(p《0.0001,相比于所有测试组)。这些结果证实了car t细胞与靶向肿瘤的超抗原nap的联合施用可以导致增强的抗癌效果,其大于单独施用的每种药剂的累加效果。
[0259]
实施例2
[0260]
本实施例描述了测试用nap刺激对car t细胞效能的影响。
[0261]
从健康供体分离外周血单核细胞(pbmc)。pbmc包括t细胞和包含ii类主要组织相容性复合体(mhc)的细胞(例如单核细胞)。将pbmc与(i)nap(1或10μg/ml)和il-2(20单位/ml),(ii)针对cd3和cd28的抗体和il-2(20单位/ml),或(iii)针对cd3的抗体和高剂量il-2(300单位/ml)温育。在刺激4天后,分离cd8
+ t细胞并静息过夜,然后通过如实施例2中所述用1μg her2 car mrna电转化对其进行诱导以表达car构建物。在研究的当天,通过流式细胞术定量car构建物的表达,并发现其在所有活化方法之间相近(图5)。使用藻红蛋白(pe)标记的nap的多聚体,通过facs测量trbv7-9表达。结果显示,相对于cd3/cd28刺激,在nap活化后trbv7-9 cd8
+ t细胞的百分率富集10倍(图6)。
[0262]
为了评估car t细胞的效能,将表达her2的fadu癌细胞与活化的her2car t细胞温育4小时。在这个测定中不添加nap。效应细胞:靶细胞比例(t细胞:肿瘤细胞)为5:1。在处理结束时,如实施例2中所述使用cck8试剂盒确定fadu癌细胞的存活率。
[0263]
尽管使用nap的刺激对car表达没有影响,但nap刺激显著增强了car t细胞对抗fadu癌细胞的效能。cd3/cd28刺激的car t细胞将癌细胞存活率降低约35%,而nap刺激的car t细胞将癌细胞存活率降低超过70%(p《0.0001;图7)。此外,与cd3/cd28刺激的car t细胞相比,更大百分率的nap刺激的car t细胞表达infγ和脱粒标志物cd107a,它们是t细胞活性提高的指示物(图8)。令人吃惊的是,尽管在所测试的实验条件中不存在nap,但先前用nap的刺激提高了car t细胞活性。
[0264]
总而言之,这些结果证实了nap活化显著增强car t细胞的效能,并表明与包括在施用到患者之前进行t细胞(例如car t细胞)的cd3/cd28诱导的体外活化和扩增的标准方法相比,nap刺激可能是一种改进。
[0265]
实施例3
[0266]
本实施例描述了比较car t细胞与nap或未偶联的葡萄球菌肠毒素超抗原(sea)的组合针对fadu头颈部肿瘤细胞系的抗癌效果的体外研究。
[0267]
从健康供体分离外周血单核细胞(pbmc)。pbmc包括t细胞和包含ii类主要组织相容性复合体(mhc)的细胞(例如单核细胞)。将pbmc与(i)nap(10μg/ml)和il-2(20单位/ml),(ii)sea(10ng/ml)和il-2(20单位/ml),或(iii)针对cd3和cd28的抗体和il-2(20单位/ml)温育。在刺激4天后,分离cd8
+ t细胞,静息过夜,然后如实施例1和2中所述通过用0.167μg her2 car mrna电转化对其进行诱导,以表达car构建物。
[0268]
将表达被car靶向的抗原(her2)和被nap靶向的抗原(5t4)两者的fadu癌细胞与cd8
+ t细胞温育4小时。效应细胞:靶细胞比率(t细胞:fadu细胞)为5。在指示的情况下,向测定添加0.01ng/ml nap或0.01ng/ml sea。在处理结束时,如实施例1中所述使用cck8试剂盒确定fadu癌细胞的存活率。将对照组(无t细胞)的存活率归一化至100%。结果示出在图9中。
[0269]
sea和car t细胞(在sea存在下生长)的组合对fadu细胞无效。在针对cd3和cd28的
抗体存在下生长的car t细胞同样无效。相反,nap和car t细胞(在nap存在下生长)的组合将fadu细胞存活率降低76.2%(p《0.0001;图9)。这些结果证实了car t细胞和超抗原偶联物nap的组合相对于car t细胞和未偶联的超抗原sea的组合具有显著的抗癌效果。
[0270]
通过参考并入
[0271]
本文中提及的每个专利和科学文献的全部公开内容为所有目的通过参考并入本文。
[0272]
等同性
[0273]
在不背离本发明的精神或本质特征的情况下,本发明可以以其他特定形式体现。因此,上述实施方式在所有方面都应被认为是说明性的,而不是对本文中描述的本发明的限制。因此,本发明的范围由随附的权利要求书而不是由上述描述指定,并且落于所述权利要求书的等同性含义和范围之内的所有变化都旨在包含在其中。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1