用于细胞器特异性蛋白递送的分子的制作方法
用于细胞器特异性蛋白递送的分子
1.相关申请
2.本技术要求于2020年03月26日提交的美国临时专利申请号63/000,138的优先权,其全部内容通过引用并入本文。
背景技术:
3.阳离子细胞穿透肽(cpp)已成为一种将治疗性蛋白递送到细胞中的有前途的方法。然而,将cpp附加到治疗性蛋白的一个潜在缺点是cpp可能会干扰治疗性蛋白的正确亚细胞定位或功能。例如,某些细胞穿透肽,如hiv-tat,已被证明可以将治疗性蛋白直接递送到细胞核中,这可能不是目标治疗性蛋白所需的亚细胞目的地。
4.例如,已经尝试使用tat-fxn融合蛋白将治疗性蛋白递送到哺乳动物细胞的线粒体中。tat-fxn融合蛋白含有tat和frataxin(fxn),这是一种与遗传性病况弗里德赖希氏共济失调(frda)相关的线粒体蛋白。frda患者的神经系统受到进行性损伤,导致肌肉无力并最终失去运动控制。frda是由frda基因的转录抑制引起的,导致frda患者缺乏或含微量hfxn蛋白。
5.将治疗性蛋白递送到细胞中的有效技术的改进,同时保持治疗性蛋白的适当亚细胞定位或功能,包括在细胞器特异性治疗性蛋白递送的背景下,仍是医学需求很大的领域。
技术实现要素:
6.本公开提供了能够有效递送至细胞的融合蛋白,例如,以比以前更高的水平递送。本公开还提供了融合蛋白,其能够有效地将目标治疗性蛋白递送至细胞并实现和维持目标治疗性蛋白的适当亚细胞定位和/或功能。例如,本公开提供了能够有效递送至非核细胞器的融合蛋白。本公开提供的示例性融合蛋白除了包含将被递送至细胞的目的蛋白以外,还包含细胞穿透肽(cpp);和/或靶增强序列(tes)。在本公开的融合蛋白中,cpp能够干扰将目标蛋白递送到蛋白的适当亚细胞定位和/或其功能,并且tes可以防止cpp的这种干扰。本公开提供的另一个示例性融合蛋白除了包含被递送至非核细胞器的目标蛋白以外,还包含细胞器靶向序列(ots);细胞穿透肽(cpp);和/或靶增强序列(tes)。在本公开的所述融合蛋白中,cpp能够干扰将目标蛋白递送至非核细胞器,并且tes防止cpp的这种干扰。
7.本公开还至少部分基于令人吃惊的发现,在还包含目标蛋白和cpp的融合蛋白中包含某些氨基酸序列(即,tes),有助于将目标蛋白有效递送到细胞,例如,导致用于融合蛋白处理的细胞中目标蛋白的水平增加,并且允许目标蛋白适当亚细胞定位和/或功能。特别地,本发明人已经发现,用包含目标蛋白、cpp和tes的融合蛋白处理的细胞所含目标蛋白的量显著高于用包含目标蛋白和cpp但缺乏tes的融合蛋白处理的细胞的目标蛋白的量。因此,本发明人令人吃惊的发现,将tes引入包含cpp和目标蛋白的融合蛋白能够在已与融合蛋白接触的细胞中显著增加目标蛋白的量。本发明人还令人吃惊的发现,包含目标蛋白、cpp和tes的融合蛋白被细胞机制正确处理,实现了适当的细胞定位,例如,靶向非核细胞器,并且在递送至细胞时具有目标蛋白的所需活性。
8.在本公开提供的一些示例性融合蛋白中,tes包含可被内源性胞内蛋白酶切割的氨基酸序列。在一些实施方式中,该tes紧邻cpp,其位于融合蛋白的n末端。在融合蛋白进入细胞胞质后,tes被胞内核酸酶切割。不希望受到特定理论的束缚,据信tes的切割有助于从融合蛋白中除去cpp,并且阻止cpp促进目标蛋白的跨膜扩散和细胞外扩散。这使得目标蛋白在细胞中累积。本公开至少部分地基于令人吃惊的发现,在还包含目标蛋白、cpp和ots的融合蛋白中还包含某些氨基酸序列(即,tes),有助于将目标蛋白有效递送到非核细胞器,如线粒体。特别地,本发明人发现,由于cpp对目标蛋白的线粒体递送的干扰,包含目标蛋白、cpp和细胞器靶向序列(ots),例如,线粒体靶向序列(mts),但不包含tes的融合蛋白,在进入细胞时定位于细胞核而不是线粒体。本发明人还发现,在还包含目标蛋白、cpp和ots(例如,mts)的融合蛋白中包含某些氨基酸序列(如tes)有助于在融合蛋白进入细胞时将目标蛋白递送到线粒体。
9.在本公开提供的示例性融合蛋白中,tes包含可被内源性胞内蛋白酶切割的氨基酸序列。在一些实施方式中,该tes紧邻cpp,其位于融合蛋白的n末端。在融合蛋白进入细胞胞质后,tes被胞内核酸酶切割。tes的切割有助于从融合蛋白中除去cpp,并防止cpp干扰融合蛋白向线粒体的递送。在本公开的其他示例性融合蛋白中,tes包含核输出信号肽(nes),其阻止cpp促进融合蛋白向细胞核的递送,相反,其有助于融合蛋白向非核细胞器(如线粒体)的递送。
10.在本公开的其他示例性融合蛋白中,tes包含核输出信号肽(nes),其阻止目标蛋白在细胞核中的累积。
11.在一些方面中,本公开提供了一种融合蛋白,其包含:将被递送到细胞中的目标蛋白;细胞穿透肽(cpp)和靶增强序列(tes)。
12.在一些实施方式中,cpp位于融合蛋白的n末端处和其中tes在cpp的c末端处融合。在一些实施方式中,融合蛋白从n末端处起始包含以下或由其组成:cpp;tes;和目标蛋白。
13.在一些实施方式中,cpp位于融合蛋白的c末端处和其中tes在cpp的n末端处融合。
14.在一些实施方式中,融合蛋白从c末端处起始包含以下或由其组成:目标蛋白;tes;和cpp。
15.在一些实施方式中,目标蛋白缺乏ots。
16.在其他实施方式中,融合蛋白还包含对目标蛋白是外源性的细胞器靶向序列(ots)。
17.在一些实施方式中,目标蛋白包含ots。
18.在一些实施方式中,ots与目标蛋白是异源的。在一些实施方式中,ots对目标蛋白是内源性的。
19.在一些实施方式中,目标蛋白选自以下:frataxin(fxn)、tafazin、丙酮酸脱氢酶(pdh)、slirp、lrppc、park2蛋白、park6蛋白、park7蛋白、磷脂酶a2,vi组及其变体或衍生物。在一些实施中,目标蛋白包含frataxin(fxn)或park2蛋白(parkin)或者其变体或衍生物。
20.在一些实施方式中,cpp包含选自细胞穿透肽数据库cppsite 2.0中列出的cpp的肽。在一些实施方式中,cpp包含选自以下的肽:hiv-tat、甘丙肽、黄蜂毒素、transportan、穿膜肽、聚精氨酸、vp22及其变体或衍生物。在一些实施方式中,cpp包含hiv-tat或者其变
体或衍生物。
21.在一些实施方式中,tes是核输出信号肽。在一些实施方式中,核输出信号肽包含与seq id no:36-43中任一项具有至少85%序列同一性的序列。在一些实施方式中,核输出信号肽包含选自以下的肽:nes1、nes2、nes3、nes4、nes5、nes6、nes7、nes8及其变体或衍生物。在一些实施方式中,核输出信号肽包含选自以下的肽:nes1和nes2或者其变体或衍生物。
22.在一些实施方式中,tes是蛋白酶敏感肽。在一些实施方式中,蛋白酶敏感肽包含泛素样修饰因子。在一些实施方式中,蛋白酶敏感肽包含与seq id no:18-31中任一项具有至少85%序列同一性的序列。
23.在一些实施方式中,蛋白酶敏感肽包含选自以下的肽:泛素、半胱天冬酶切割结构域、钙蛋白酶切割结构域、sumo1、sumo2、sumo3、sumo4、isg15、atg8、atg12、nedd8及其变体或衍生物。
24.在一些实施方式中,融合蛋白包含与seq id no:55-61、69-71和81的任一项具有至少85%、90%或95%序列同一性的氨基酸序列。
25.在一些方面中,本公开提供了一种融合蛋白,其包含:将被递送至非核细胞器的目标蛋白;细胞器靶向序列(ots);细胞穿透肽(cpp);和靶增强序列(tes);其中cpp能够干扰目标蛋白递送至非核细胞器;和其中tes防止cpp的上述干扰。
26.在一些实施方式中,cpp位于融合蛋白的n末端处和其中tes在cpp的c末端处融合。
27.在一些实施方式中,融合蛋白从n末端处开始包含以下或由其组成:cpp;tes;ots;和目标蛋白。
28.在一些实施方式中,cpp位于融合蛋白的c末端处和其中tes在cpp的n末端处融合。在一些实施方式中,非核细胞器选自以下:线粒体、细胞溶质、溶酶体、内质网(er)、过氧化物酶体和高尔基体。在一些实施方式中,天然存在形式的目标蛋白定位于线粒体、细胞溶质、溶酶体、内质网(er)、过氧化物酶体或高尔基体。
29.在一些实施方式中,目标蛋白选自以下:frataxin(fxn)、tafazin、丙酮酸脱氢酶(pdh)、slirp、lrppc、park2蛋白、park6蛋白、park7蛋白、磷脂酶a2,vi组及其变体或衍生物。在一些实施方式中,目标蛋白是frataxin(fxn)或者其变体或衍生物。在一些实施方式中,目标蛋白是丙酮酸脱氢酶(pdh)或者其变体或衍生物。
30.在一些实施方式中,cpp包含选自细胞穿透肽数据库cppsite 2.0中列出的cpp的肽。在一些实施方式中,cpp包含选自以下的肽:hiv-tat、甘丙肽、黄蜂毒素、transportan、穿膜肽、聚精氨酸、vp22及其变体或衍生物。在一些实施方式中,cpp包含hiv-tat或者其变体或衍生物。
31.在一些实施方式中,tes是核输出信号肽。在一些实施方式中,核输出信号肽包含与seq id no:36-43中的任一项具有至少85%序列同一性的序列。在一些实施方式中,核输出信号肽包含选自以下的肽:nes1、nes2、nes3、nes4、nes5、nes6、nes7、nes8及其变体或衍生物。在一些实施方式中,核输出信号肽包含选自以下的肽:nes1、nes2及其变体或衍生物。
32.在一些实施方式中,tes是蛋白酶敏感肽。在一些实施方式中,蛋白酶敏感肽包含泛素样修饰因子。在一些实施方式中,蛋白酶敏感肽包含与seq id no:18-31中的任一项具有至少85%序列同一性的序列。在一些实施方式中,蛋白酶敏感肽包含选自以下的肽:泛
素、半胱天冬酶切割结构域、钙蛋白酶切割结构域、sumo1、sumo2、sumo3、sumo4、isg15、atg8、atg12、nedd8及其变体或衍生物。
33.在一些实施方式中,本公开的融合蛋白还包含分泌信号(ss)。
34.在一些实施方式中,本公开的融合蛋白还包含胞外蛋白水解位点(eps)。
35.在一些实施方式中,融合蛋白将目标蛋白递送至非核细胞器。在一些实施方式中,融合蛋白将目标蛋白递送至线粒体。
36.在一些实施方式中,融合蛋白包含与seq id no:55-61、69-71和81中的任一项具有至少85%、90%或95%序列同一性的氨基酸序列。
37.在一些方面中,本公开还提供了编码本公开的融合蛋白的核酸。
38.在一些方面中,本公开还提供了一种用于将融合蛋白引入细胞中的表达载体,其包含本公开的核酸。在一些实施方式中,表达载体选自以下:逆转录病毒载体、dna载体、质粒、rna载体、腺病毒载体、腺病毒相关载体、慢病毒载体、噬菌体、杆状病毒及其组合。
39.在一些方面中,本公开提供了一种用于将蛋白细胞内递送至非核细胞器的缀合物,所述缀合物包含本公开的融合蛋白和连接至所述融合蛋白的部分,其中所述部分选自以下:放射性标记、荧光标记、小分子和聚合物分子。在一些实施方式中,聚合物分子是聚乙二醇(peg)。
40.在一些方面中,本公开提供了一种细胞,其包含本公开的融合蛋白,本公开的核酸,本公开的表达载体,本公开的缀合物或其组合。
41.在一些实施方式中,细胞是干细胞或ips细胞。在一些实施方式中,细胞选自以下:肌祖细胞、神经元祖细胞、骨髓干细胞、细菌细胞系或酵母细胞系。
42.在一些方面中,本公开还提供了一种药物组合物,其包含本公开的融合蛋白,本公开的缀合物或其组合以及药学上可接受的稀释剂、载体、添加剂或赋形剂。
43.在一些方面中,本公开提供了一种将目标蛋白递送至细胞的方法,所述方法包括将细胞与本公开的融合蛋白,本公开的核酸,本公开的载体或本公开的缀合物接触。
44.在一些方面中,本公开还提供了一种将目标蛋白细胞内递送至细胞中的非核细胞器的方法,所述方法包括将所述细胞与本公开的融合蛋白,本公开的核酸,任一本公开的载体或本公开的缀合物。在一些实施方式中,非核细胞器是线粒体。
45.在一些方面中,本公开还提供了一种用于治疗非核线粒体相关病症的治疗性化合物,所述化合物包含本公开的融合蛋白,本公开的核酸,本公开的载体或本公开的缀合物。在一些实施方式中,非核细胞器相关病症选自以下:弗里德赖希氏共济失调(fdra)、巴斯综合征、帕金森氏病、威尔逊氏病、莱氏综合征、纤维化和pla2g6相关神经退行性疾病(plan)。在一些实施方式中,非核细胞器相关病症是fdra。在一些实施方式中,非核细胞器相关病症是帕金森氏病。
46.在一些方面中,本公开还提供了一种用于治疗非核细胞器相关病症的方法,所述方法包括向有需要的受试者施用本公开的融合蛋白,本公开的核酸,本公开的载体,本公开的缀合物或本公开的药物组合物,以治疗非核细胞器相关病症是。
47.在一些实施方式中,非核细胞器相关病症选自以下:弗里德赖希氏共济失调(fdra)、巴斯综合征、帕金森氏病、威尔逊氏病、莱氏综合征和纤维化。在一些实施方式中,非核细胞器相关病症是fdra。在一些实施方式中,非核细胞器相关病症是帕金森氏病。
48.在一些实施方式中,受试者是人。
49.在一些方面中,本公开还提供了一种用于增加向细胞递送的目标蛋白的量的方法,所述方法包括:通过将靶增强序列(tes)引入包含目标蛋白和细胞穿透肽(cpp)的融合蛋白中修饰融合蛋白的序列,从而产生修饰的融合蛋白;和将细胞与修饰的融合蛋白接触,从而与通过缺乏tes的融合蛋白递送至细胞的目标蛋白的量相比增加递送至细胞的目标蛋白的量。
50.在一些实施方式中,修饰的融合蛋白,cpp位于融合蛋白的n末端处和其中tes在cpp的c末端处融合。
51.在一些实施方式中,修饰的融合蛋白从n末端处起始包含:cpp;tes;和目标蛋白。
52.在一些实施方式中,修饰的融合蛋白从n末端处起始包含:cpp;tes;ots;和目标蛋白。
53.在一些实施方式中,修饰的融合蛋白的cpp位于融合蛋白的c末端处和其中tes在cpp的n末端处融合。在一些实施方式中,与通过缺乏tes的融合蛋白递送至细胞器的目标蛋白的量相比,递送至通过ots靶向的细胞器的目标蛋白的量增加。
54.在一些实施方式中,目标蛋白选自以下:frataxin(fxn)、tafazin、丙酮酸脱氢酶(pdh)、slirp、lrppc、park2蛋白、park6蛋白、park7蛋白、磷脂酶a2,vi组或者其变体或衍生物。在一些实施方式中,目标蛋白是frataxin(fxn)或者其变体或衍生物。在一些实施方式中,目标蛋白是park2蛋白或者其变体或衍生物。
55.在一些实施方式中,cpp包含选自细胞穿透肽数据库cppsite 2.0中列出的cpp的肽。在一些实施方式中,cpp包含选自以下的肽:hiv-tat、甘丙肽、黄蜂毒素、transportan、穿膜肽、聚精氨酸、vp22及其变体或衍生物。在一些实施方式中,cpp包含hiv-tat或者其变体或衍生物。
56.在一些实施方式中,tes是核输出信号肽。在一些实施方式中,核输出信号肽包含与seq id no:36-43中任一项具有至少85%序列同一性的序列。在一些实施方式中,核输出信号肽包含选自以下的肽:nes1、nes2、nes3、nes4、nes5、nes6、nes7、nes8及其变体或衍生物。在一些实施方式中,核输出信号肽包含选自以下的肽:nes1、nes2及其变体或衍生物。
57.在一些实施方式中,tes是蛋白酶敏感肽。在一些实施方式中,蛋白酶敏感肽包含泛素样修饰因子。在一些实施方式中,蛋白酶敏感肽包含与seq id no:18-31中的任一项具有至少85%序列同一性的序列。在一些实施方式中,蛋白酶敏感肽包含选自以下的肽:泛素、半胱天冬酶切割结构域、钙蛋白酶切割结构域、sumo1、sumo2、sumo3、sumo4、isg15、atg8、atg12、nedd8及其变体或衍生物.
58.在一些实施方式中,修饰的融合蛋白包含与seq id no:55-61、69-71和81中的任一项具有至少85%序列同一性的氨基酸序列。
59.在一个方面中,本公开提供了一种融合蛋白,其包含:将被递送至非核细胞器的目标蛋白;细胞器靶向序列(ots);细胞穿透肽(cpp);和靶增强序列(tes);其中cpp能够干扰目标蛋白向非核细胞器的递送;和其中tes防止cpp的上述干扰。
60.在一些实施方式中,cpp位于融合蛋白的n末端处和tes在cpp的c末端处融合。在一些实施方式中,本公开提供了一种融合蛋白,其从n末端处起始包含:cpp;tes;ots;和目标蛋白。
61.在一些实施方式中,cpp位于融合蛋白的c末端处和tes在cpp的n末端处融合。
62.在一些实施方式中,非核细胞器选自以下:线粒体、细胞溶质、溶酶体、内质网(er)、过氧化物酶体和高尔基体。
63.在一些实施方式中,天然存在形式的所述目标蛋白定位于线粒体、细胞溶质、溶酶体、内质网(er)、过氧化物酶体或高尔基体。
64.在一些实施方式中,目标蛋白选自以下:frataxin(fxn)、tafazin、丙酮酸脱氢酶(pdh)、lrppc、park2蛋白、park6蛋白、park7蛋白、磷脂酶a2,vi组、转录因子及其变体或衍生物。在一个实施方式中,目标蛋白是frataxin(fxn)或者其变体或衍生物。在一个实施方式中,目标蛋白是丙酮酸脱氢酶(pdh)或者其变体或衍生物。
65.在一些实施方式中,cpp包含选自细胞穿透肽数据库cppsite 2.0中列出的cpp的肽。在进一步的实施方式中,cpp包含选自以下的肽:hiv-tat、甘丙肽、黄蜂毒素、transportan、穿膜肽、聚精氨酸、vp22及其变体或衍生物。在一些实施方式中,cpp包含hiv-tat或者其变体或衍生物。
66.在一些实施方式中,tes是核输出信号肽。在进一步的实施方式中,核输出信号肽包含与seq id no:36-43中的任一项具有至少85%序列同一性的序列。在一些实施方式中,核输出信号肽包含选自以下的肽:nes1、nes2、nes3、nes4、nes5、nes6、nes7、nes8及其变体或衍生物。在一些实施方式中,核输出信号肽包含选自以下的肽:nes1、nes2及其变体或衍生物。
67.在一些实施方式中,tes是蛋白酶敏感肽。在一些实施方式中,蛋白酶敏感肽包含泛素样修饰因子。在一些实施方式中,泛素样修饰因子包含与seq id no:18-31中的任一项具有至少85%序列同一性的序列。
68.在一些实施方式中,蛋白酶敏感肽包含选自以下的肽:泛素、半胱天冬酶切割结构域、钙蛋白酶切割结构域、sumo1、sumo2、sumo3、sumo4、isg15、atg8、atg12、nedd8及其变体或衍生物。
69.在一些实施方式中,本公开提供的融合蛋白包含分泌信号(ss)。在一些实施方式中,融合蛋白包含胞外蛋白水解位点(eps)。
70.在一些实施方式中,融合蛋白将目标蛋白递送至非核细胞器。在一个具体的实施方式中,融合蛋白将目标蛋白递送至线粒体。
71.在一些实施方式中,融合蛋白包含与seq id no:55-61中的任一项具有至少85%序列同一性的序列。
72.在另一个方面中,本公开提供了一种编码本公开的融合蛋白的核酸。
73.在一个相关的方面中,本公开提供了一种用于将融合蛋白引入细胞中的表达载体,其包含本公开的核酸。
74.在一些实施方式中,表达载体选自以下:逆转录病毒载体、dna载体、质粒、rna载体、腺病毒载体、腺病毒相关载体、慢病毒载体、噬菌体、杆状病毒及其组合。
75.在另一个方面中,本公开提供了一种用于将蛋白细胞内递送至非核细胞其的蛋白缀合物,所述蛋白缀合物包含本公开的融合蛋白和连接至融合蛋白的部分,其中所述部分选自以下:放射性标记、荧光标记、小分子和聚合物分子。在一个实施方式中,聚合物分子是聚乙二醇(peg)。
76.在另一个方面中,本公开提供了一种细胞,其包含本公开的融合蛋白、核酸、表达载体或缀合物,或其组合。在一些方面中,细胞是干细胞或ips细胞。在一些方面中,细胞可以选自以下:肌祖细胞、神经元祖细胞、骨髓干细胞、细菌细胞或酵母细胞。
77.在另一个方面中,本公开提供了一种药物组合物,其包含本公开的融合蛋白或蛋白缀合物或者其组合,以及药学上可接受的稀释剂、载体、添加剂或赋形剂。
78.在另一个方面中,本公开提供了一种将目标蛋白细胞内递送至细胞中的非核细胞器的方法,其包括将细胞与本公开的融合蛋白、核酸、载体或蛋白缀合物接触。在一个方面中,非核细胞器是线粒体。
79.在另一个方面中,本公开提供了一种用于治疗非核细胞器相关病症的治疗性化合物,其包含本公开的融合蛋白、核酸、载体或蛋白缀合物。在一些实施方式中,非核细胞器相关病症选自以下:弗里德赖希氏共济失调(fdra)、巴斯综合征、帕金森氏病、威尔逊氏病、莱氏综合征、纤维化和pla2g6相关神经退行性疾病(plan)。在一个实施方式中,plan可以包含选自以下的病症:婴儿神经轴索营养不良(inad)、非典型神经轴索营养不良(anad)、帕金森氏综合征,其包括成人发病的肌张力障碍帕金森病(dp)和常染色体体隐性早发性帕金森病(arep)。在一个方面中,非核细胞器相关病症是fdra.
80.在一个相关的方面中,本公开提供了一种用于治疗非核细胞器相关病症的方法,其包括向有需要的受试者施用本公开的融合蛋白、核酸、载体、蛋白缀合物或药物组合物,以治疗非核细胞器相关病症。在一些实施方式中,非核细胞器相关病症选自以下:弗里德赖希氏共济失调(fdra)、巴斯综合征、帕金森氏病、威尔逊氏病、莱氏综合征和纤维化。在一个具体实施方式中,非核细胞器相关病症是fdra。
81.在一些实施方式中,受试者是人。
82.提供本发明内容目的在于以简化形式介绍概念的选择,所述概念将在以下具体实施方式中进一步描述。本发明内容不旨在表明要求保护的主题的关键特征或必要特征,也不旨在用于限制要求保护的主题的范围。
附图说明
83.下面参考在本段之后列出的附图描述本公开的实施方式的非限制性实施方式。在多于一个图中出现的相同特征在其出现的所有图中通常用相同的标记来标记。附图中标记表示本公开的实施方式的给定特征的图标的标签可以用于引用给定特征。图中所示的特征的尺寸是为了方便和清楚呈现而选择的,并且不一定按比例示出。
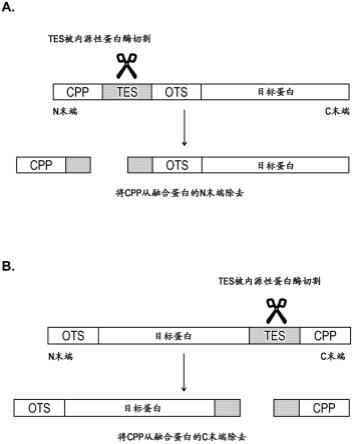
84.图1是本公开的某些融合蛋白的示意图,其包含具有蛋白酶切割位点的靶增强序列(tes)。
85.图2是在本公开的融合蛋白中各种结构域构造的示意图。
86.图3是用tat-gg-hfxn融合蛋白(5μm)处理并用抗hfxn抗体(左图)或线粒体特异性抗tomm20抗体(中图)进行免疫荧光标记后大鼠l6成肌细胞的一系列照片。右图显示了抗hfxn和抗tomm20标记的重叠。
87.图4是免疫荧光标记后使用编码hfxn(上图)或tat-gg-hfxn融合蛋白(下图)的质粒转染的大鼠l6成肌细胞的一系列照片。成肌细胞用抗hfxn抗体(左图)或抗tomm20抗体(中图)标记。右图显示了两个标记的重叠。
88.图5,图a-c表示包含hfxn的本公开的示例性融合蛋白的设计的示意图。图a显示了与hfxn1-210的氨基末端融合的tat-gg(tat-gg-hfxn融合蛋白)。图b显示了tat-gg融合至蛋白水解敏感性氨基酸序列,然后是hfxn1-210。图c显示了tat-gg融合至hfxn1-210,然后是核输出信号(nes);根据本公开的实施方式。
89.图6,图a-i是使用编码hfxn(图4a)、tat-gg-hfxn融合蛋白(图4b)、tat-gg-sumo1-hfxn(图4c)、tat-gg-llvy-hfxn(图4d)、tat-gg-hfxn-nes1(图4e)、tat-gg-hfxn-nes2(图4f)、tat-gg-泛素(图4g)、tat-gg-devd-hfxn(图4h)和tat-gg-eplfaerk-hfxn(图4i)的质粒转染的免疫荧光标记的大鼠l6成肌细胞的照片。对于免疫荧光标记,使用针对hfxn(左图)和tomm20(中图)的抗体对l6成肌细胞染色。右图显示了两个标记的重叠。
90.图7是来自使用hfxn变体hfxn(第1道)、at-gg-hfxn融合蛋白(第2道)、tat-gg-sumo1-hfxn(第3道)、tat-gg-泛素-hfxn(第4道)、tat-gg-eplfaerk-hfxn(第5道)、tat-gg-llvy-hfxn(第6道)、tat-gg-hfxn-nes1(第7道)、tat-gg-hfxn-nes2(第8道)和假样品(第9道)转染的大鼠l6成肌细胞的细胞裂解物的western印记分析的照片。使用抗hfxn抗体标记印记并将β-肌动蛋白作为对照。
91.图8是本公开的hfxn融合蛋白的结构示意图,在实施例5中测试了其细胞转导能力。
92.图9,图a是用0.25μm、0.5μm和1μm tat-gg-hfxn、tat-gg-eplfaerk-hfxn、tat-gg-泛素-hfxn和作为阴性对照的载剂处理的雪旺细胞的一系列照片。在照片中,绿色对应于作为线粒体标记物的tomm20信号,红色代表hfxn信号和蓝色代表作为核标记物的hoechst 33342染料信号。
93.图9,图b是用tat-gg-泛素-hfxn处理的细胞的高倍图像。该图像显示了hfxn染色的细节及其在线粒体的定位。
94.图9,图c是显示了用不同浓度的tat gg hfxn、tat gg eplfaerk hfxn和tat gg-泛素hfxm处理的细胞的平均hfxn-染色信号与平均核染色信号的比值的条形图。
95.图9,图d是从sds-page凝胶中转移后的硝酸纤维素膜的图片,该凝胶中上样了用于转导实验的tat-gg-hfxn、tat-gg-eplfaerk-hfxn、tat-gg-ubiquitin-hfxn样品,并对总蛋白进行染色。图片显示融合蛋白缺乏降解,并且在转导实验中使用了相同数量的每种融合蛋白。
96.图10,图a是使用1μm hfxn融合蛋白tat-gg-hfxn、tat-gg-eplfaerk-hfxn和tat-gg-泛素-hfxn处理并使用线粒体、核和抗fxn染色的雪旺和h9c2细胞的一系列代表性照片。白色箭头表示hfxn在线粒体的代表性定位。
97.图10,图b显示了平均抗fxn染色信号与平均抗线粒体染色信号的比值,该比值是用tat gg hfxn、tat gg eplfaerk hfxn和tat gg-泛素hfxn处理的雪旺细胞中hfxn融合蛋白浓度的函数。
98.图10,图c显示了平均抗fxn染色信号与平均抗线粒体染色信号的比值,该比值是用tat gg hfxn、tat gg eplfaerk hfxn和tat gg-泛素hfxn处理的h9c2细胞中hfxn融合蛋白浓度的函数。
99.图10,图d显示了平均抗fxn染色信号与平均抗线粒体染色信号的比值,该比值是用tat gg hfxn、tat gg eplfaerk hfxn、tat gg-泛素hfxn和tat-gg-hfxn-nes1处理的雪
旺细胞中hfxn融合蛋白浓度的函数。
100.图11是从使用各种hfxn融合蛋白转染的细胞中分离的总蛋白样品进行并使用抗fxn抗体分析的western印记的照片。
101.图12,图a显示了包含使用本公开的hfxn融合蛋白处理的lrpprc kd细胞和scr-5细胞样品的培养板的图片。
102.图12,图b是用每个hfxn融合蛋白或载剂的最高测试浓度处理的lrpprc kd和scr-5对照细胞的一系列照片。
103.图12,图c是显示在使用hfxn融合蛋白处理的lrpprc kd细胞的培养基中cyr61的量的图。
104.图12,图d是显示在使用hfxn融合蛋白处理的lrpprc kd细胞的培养基中乳酸的量的图。
105.图13是本公开的parkin融合蛋白结构的示意图。
106.图14是显示parkin染色与线粒体染色的比值的图,该比值是用不同浓度的his6 sumo tat gg parkin、tat-gg-eplfaerk-parkin和tat-gg泛素parkin处理的细胞的parkir融合蛋白浓度的函数。
107.图15是在不存在或存在10μm cccp的条件下用0μm或0.5μm tat-gg-eplfaerk-parkin处理的l6大鼠成肌细胞的一系列照片。
具体实施方式
108.本公开的一个方面涉及一种融合蛋白,其包含将被递送至细胞的目标蛋白。在一些实施方式中,融合蛋白包含将被递送至特定细胞器的目标蛋白,例如,非核细胞器,如线粒体。融合蛋白还包含至少一个细胞穿透肽(cpp)、至少一个靶增强序列(tes)和任选地至少一个细胞器靶向信号(ots)。
109.在本公开的某些方面中,cpp能够干扰将目标蛋白递送至细胞器,如非核细胞器。例如,如本公开中的某些实验数据所证明的,cpp,例如,hiv-tat,可能会干扰目标蛋白(例如,fxn)递送至线粒体。具体地,hiv-tat促进fxn向核而不是向线粒体递送。因此,本公开的融合蛋白包含tes,其防止或减弱cpp对将目标蛋白递送到适当细胞(例如,非核)细胞器的干扰。
110.例如,在一些实施方式中,cpp可以位于融合蛋白n末端处和tes可以在cpp的c末端处融合。或者,cpp可以位于融合蛋白c末端处和tes可以在cpp的n末端处融合。tes可以包含胞内蛋白酶识别序列,其有助于融合蛋白在进入细胞时在tes处切割,从而从融合蛋白的剩余物中除去cpp并阻止其将融合蛋白导向细胞核。
111.或者,tes可以包含核输出信号,例如,在cpp介导的融合蛋白递送到细胞核后,促进融合蛋白从细胞核输出的信号。
112.本公开的另一个方面还涉及提供一种融合蛋白,其包含将被递送到细胞的目标蛋白。融合蛋白包含至少一个细胞穿透肽(cpp)、至少一个靶增强序列(tes)和目标蛋白。
113.在本公开的一些实施方式中,cpp能够干扰目标蛋白递送至细胞。例如,如本公开中的某些实验数据所证明的,用包含目标蛋白、cpp和tes的融合蛋白处理细胞目标蛋白的量明显高于用包含目标蛋白和cpp但不包含tes的融合蛋白处理细胞的目标蛋白的量。因
此,出乎意料地发现,将tes引入包含cpp和目标蛋白的融合蛋白中可以显著增加递送到细胞的目标蛋白的量。
114.不希望受到特定理论的束缚,据信细胞内内源性蛋白酶对tes的切割有助于从融合蛋白中去除cpp,并阻止cpp促进目标蛋白的跨膜扩散和胞外扩散。这使得目标蛋白在细胞中累积。从融合蛋白中除去cpp也可以防止cpp干扰目标蛋白的适当亚细胞定位。因此,本公开的融合蛋白包含tes,其防止或减弱cpp对将目标蛋白递送到细胞的干扰。在一些实施方式中,本公开的融合蛋白包含tes,其防止或减弱cpp对细胞内目标蛋白的适当亚细胞定位的干扰。
115.在一些实施方式中,cpp可以位于融合蛋白的n末端处和tes可以在cpp的c末端处融合。或者,cpp可以位于融合蛋白的c末端处和tes可以在cpp的n末端处融合。tes可以包含胞内蛋白酶识别序列,该序列有助于融合蛋白在进入细胞时在tes处切割,从而从融合蛋白的剩余物中除去cpp并阻止其将融合蛋白导向细胞外。
116.或者,tes可以包含核输出信号肽(nes)。不希望受到特定理论的束缚,据信cpp有助于融合蛋白运输到细胞核,nes当存在于融合蛋白中时,阻止融合蛋白在细胞核中累积。通过阻止融合蛋白在细胞核中的累积,nes促进核外融合蛋白中所含的目标蛋白的适当亚细胞定位,例如,在线粒体中。
117.在一些实施方式中,通过内源性蛋白酶切割tes除去cpp有助于目标蛋白的适当亚细胞定位。在一些情况下,目标蛋白,例如,nfκb、雄激素受体、雌激素受体或乌头酶,通常可能定位于一个以上的细胞隔室,如细胞核和线粒体。通过内源性蛋白酶切割tes除去cpp可防止cpp干扰对内源性刺激作出反应的目标蛋白的适当亚细胞定位。
118.目标蛋白
119.本公开提供的融合蛋白包含将被递送到细胞的目标蛋白。在一些实施方式中,本公开提供的融合蛋白包含将被递送到细胞内的特定细胞器中的目标蛋白,例如,非核细胞器。在本公开的融合蛋白中包含的目标蛋白可以与非核细胞器相关,例如,目标蛋白可以是胞内、非核细胞器特异性蛋白。例如,目标蛋白可以定位于非核细胞器和/或可能能够或促进非核细胞器中受影响的胞内功能。示例性非核细胞器包括细胞溶质、线粒体、溶酶体、内质网、高尔基体和过氧化物酶体。在一些实施方式中,包含在本公开的融合蛋白中的目标蛋白可替代地与细胞核关联,并且在一些实施方式中,与细胞核和一个或多个非核细胞器相关联,例如,目标蛋白可以是位于细胞核和其他非和细胞器(例如,细胞溶质、线粒体、溶酶体、内质网、高尔基体和过氧化物酶体)中的胞内蛋白。
120.目标蛋白可能与受试者的病理状况相关。例如,这种病理状况可能是由于受试者中目标蛋白的缺乏而导致的,例如,当目标蛋白可能发生突变以减少或消除目标蛋白的自然活性时,或者当目标蛋白可能完全缺失时。
121.在本公开的一些方面中,目标蛋白可能与线粒体相关。与线粒体相关的示例性目标蛋白可以包括,例如,frataxin(fxn)、tafazin、丙酮酸脱氢酶β2(pdhb)、富含亮氨酸的ppr基序蛋白(lrpprc蛋白)、slirp、parkin rbr e3泛素蛋白连接酶(park2蛋白或parkin)、pten诱导的激酶1(pink1或park6蛋白)、蛋白脱糖酶dj-1(park7蛋白)和磷脂酶a2,vi组。
122.在一些实施方式中,目标蛋白包含ots。在一些实施方式中,ots对目标蛋白是内源性的。在一些实施方式中,ots对目标蛋白是外源性的。
123.在一些实施方式中,目标蛋白缺乏ots。在一些实施方式中,目标蛋白缺乏天然形式的ots,即,其天然不包含ots。在一些实施方式中,缺乏ots的目标蛋白是蛋白的成熟形式,其中内源性ots已被除去。
124.在一个具体实施方式中,与线粒体相关的目标蛋白可以是frataxin(fxn),例如,人fxn,其与病理状况弗里德赖希氏共济失调(fdra)相关。frda是一种遗传性、进行性神经退行性病症,其由编码fxn的基因突变引起。fxn是一种重要的和系统发育上保守的蛋白,其存在于全身的细胞中,在心脏、脊髓、肝脏、胰腺和骨骼肌中含量最高。fxn在细胞核中编码,在胞质中表达,并导入线粒体,其在此处被加工成成熟形式。在人类中,210个氨基酸全长hfxn(hfxn
1-210
,23.1kda)在氨基酸末端含有一个典型的线粒体靶向序列(mts),该序列在导入线粒体基质时由线粒体基质加工肽酶(mpp)进行两步切割。所得蛋白是130个氨基酸的14.2kda成熟hfxn蛋白(hfxn
81-210
)。全长hfxn和成熟hfxn的序列显示在下表1中。
125.表1:全长hfxn和成熟hfxn的序列
[0126][0127][0128]
因此,在一些方面中,本公开的融合蛋白可以包含全长hfxn(hfxn
1-210
),即,包含mts作为细胞器靶向序列(ots)。在一些方面中,融合蛋白可以包含与全长hfxn序列(例如,表1中列出的seq id no:1)具有至少85%,例如,至少86%、至少87%、至少88%、至少89%、至少90%、至少91%、至少92%、至少93%、至少94%、至少95%、至少96%、至少97%、至少98%、至少99%或100%序列同一性的氨基酸序列。
[0129]
在一些方面中,本公开的融合蛋白可以包含成熟hfxn(hfxn
81-210
)。在一些方面中,融合蛋白可以包含与成熟hfxn(例如,表1中列出的seq id no:2)的序列具有至少85%,例如,至少86%、至少87%、至少88%、至少89%、至少90%、至少91%、至少92%、至少93%、至少94%、至少95%、至少96%、至少97%、至少98%、至少99%或100%序列同一性的氨基酸序列。
[0130]
在其他方面中,可以包含在本公开的融合蛋白中的示例性目标蛋白包含tafazzin、丙酮酸脱氢酶β2(pdhb)、富含亮氨酸的ppr基序蛋白(lrpprc蛋白)、slirp、parkin rbr e3泛素蛋白连接酶(park2蛋白或parkin)、pten诱导的激酶1(pink1或park6蛋白)、蛋白脱糖酶dj-1(park7蛋白)和磷脂酶a2,vi组。
[0131]
下表2列出了可以使用包含所述目标蛋白的本公开的融合蛋白治疗目标蛋白治疗的示例性目标蛋白,相应人序列和相关病理状况。
[0132]
表2:示例性目标蛋白,相应人序列和相关病理状况
[0133]
pdhb蛋白、lrpprc蛋白、slirp蛋白和pink1蛋白序列的下划线部分是使用mitoprot ii鉴定的预测线粒体靶向序列(m.g.claros,p.vincens.computational method to predict mitochondrially imported proteins and their targeting sequences.eur.j.biochem.241,770-786,其全部内容在此通过引用并入本文)。
[0134]
[0135]
[0136]
[0137]
[0138][0139]
在一些实施方式中,本公开的融合蛋白中包含的目标蛋白可以包含在表2中列出的任何序列(例如,seq id no:3-9或72-80中的任一项)或由其组成。在一些实施方式中,本公开的融合蛋白中包含的目标蛋白可以包含与在表2中列出的任何一氨基酸序列(例如,seq id no:3-9或72-80中的任一项)具有至少85%,例如,至少86%、至少87%、至少88%、至少89%、至少90%、至少91%、至少92%、至少93%、至少94%、至少95%、至少96%、至少97%、至少98%、至少99%或100%序列同一性的氨基酸序列或由其组成。
[0140]
在一些实施方式中,本公开的融合蛋白中包含的目标蛋白可以包含在表2中列出的任何序列(例如,seq id no:3-9或72-80中的任一项)并且缺乏内源性ots(即,其中已除去内源性ots)或由其组成。相关领域的技术人员将容易识别特定蛋白的ots。
[0141]
在本公开的一些方面中,目标蛋白可以与溶酶体相关。在本公开的一些方面中,目标蛋白可以与内质网(er)相关。在本公开的一些方面中,目标蛋白可以与高尔基体相关。
[0142]
在一些实施方式中,目标蛋白可以是位于细胞核的蛋白。在一些实施方式中,目标蛋白可以是位于细胞核和一个或多个其他细胞器的蛋白。本领域技术人员将意识到的是,通过将tes引入包含cpp和此类目标蛋白的融合蛋白,将消除cpp对目标蛋白定位的干扰,例如,将防止或减少向细胞核的异常定位,从而允许天然调控途径指示响应于内源性信号的蛋白的正确定位,并且从而提高重新定位到适当亚细胞位置的倾向。此类蛋白可以包括例如nfkβ、stat3、雄激素受体、雌激素受体和p53。
[0143]
在一些实施方式中,本公开的融合蛋白可以包含如本文所述的目标蛋白,或者目标蛋白的功能性类似物、衍生物或片段。如本文所用,术语“衍生物”包括不同于本公开中具体定义的多肽(例如,seq id no:3-9或72-80)的氨基酸序列(多肽),其是通过不改变原始多肽活性的氨基酸的插入、缺失、取代和修饰来实现的。应当意识到的是,如本文所用,术语“一个或多个插入”、“一个或多个缺失”或“一个或多个取代”分别涵盖多肽的1至50个氨基酸残基之间的任何添加、缺失或替代,例如,1至5个氨基酸残基之间、1至10个氨基酸残基之间、5至15个氨基酸残基之间、10至20个氨基酸残基之间、25至40个氨基酸残基之间或者30至50个氨基酸残基之间。更特别地,一个或多个插入、一个或多个缺失或一个或多个取代可以是1、2、3、4、5、6、7、8、9或10个氨基酸残基的任何一个。应注意的是,一个或多个插入、一个或多个缺失或者一个或多个取代可以出现在修饰的肽的任何位置,也可以出现在其n’末端或c’末端。在一个实施方式中,目标蛋白是fxn的衍生物,例如,人fxn。在一个实施方式中,目标蛋白是tafazzin的衍生物。在一个实施方式中,目标蛋白是pdhb的衍生物。在一个实施方式中,目标蛋白是lrpprc的衍生物。在一个实施方式中,目标蛋白是slirp的衍生物。在一个实施方式中,目标蛋白是park2蛋白的衍生物。在一个实施方式中,目标蛋白是pink1(或park6蛋白)的衍生物。在一个实施方式中,目标蛋白是park7的衍生物。在一个实施方式中,目标蛋白是磷脂酶a2,vi组(例如,变体1、2、3、4、5、6、7、8或9)的衍生物。
[0144]
在一些实施方式中,在本发明的背景下,目标蛋白的氨基酸序列可能不同于与上述任何病理状况相关联的天然蛋白的氨基酸序列。在一些实施方式中,与同任何病理状况相关的天然存在的蛋白的氨基酸序列相比,目标蛋白的氨基酸序列可以包含保守性氨基酸取代,即,用结构相似的氨基酸取代。例如,结构相似的氨基酸包括:(异亮氨酸(i)、亮氨酸(l)和缬氨酸(v));(苯丙氨酸(f)和酪氨酸(y));(赖氨酸(k)和精氨酸(r));(谷氨酰胺(q)和天冬酰胺(n));(天冬氨酸(d)和谷氨酸(e));和(甘氨酸(g)和丙氨酸(a))。
[0145]
如本文所用,术语“衍生物”包括原始多肽的同源物、变体和类似物,以及原始多肽的共价修饰。本公开中提供的融合蛋白包含的任何一种蛋白或肽的衍生物、变体和类似物将具有与其天然形式相同的生物活性。在一个具体实施方式中,目标蛋白是fxn的同源物、变体或类似物,例如,人fxn。
[0146]
在一些实施方式中,可以在本公开的融合蛋白中包含的目标蛋白可以是在受试者中天然存在的。受试者可以是哺乳动物,例如,小鼠、大鼠、猴或人。
[0147]
细胞器靶向序列(ots)
[0148]
在一些实施方式中,本公开的融合蛋白还可以包含细胞器靶向序列(ots)。如本文所用,术语“细胞器靶向序列”或“ots”指任何氨基酸序列,例如,蛋白、肽或共有结构域,其有助于将目标蛋白递送至特定非核细胞器。例如,ots可以是线粒体靶向序列(mts),其有助于将目标蛋白递送至线粒体。mts可以是约10-70个氨基酸的肽,其包含形成两亲性螺旋的
疏水性和正电荷氨基酸交替模式。
[0149]
ots还可以是内质网(er)靶向序列。er靶向序列可以是约16-30个氨基酸的肽,其包含亲水性区域、疏水性区域以及包含er特异性信号肽的切割位点的c末端区。
[0150]
ots还可以包含heat基序,其可以存在于定位于高尔基体和内质网(er)的天然存在的蛋白中。heat是由短环连接的两个α螺旋组成的蛋白串联重复结构基序。heat重复序列可以形成α螺线管,其是存在于很多胞质蛋白中的一种类型的螺线管蛋白结构域。
[0151]
ots还可以是过氧化物酶体靶向信号(pts),其可以位于目标蛋白的n末端或c末端处。n末端过氧化物酶体靶向信号可以具有共有序列arg-leu-x-x-x-x-x-his/gln-leu,其中x可以是任何氨基酸。c末端过氧化物酶体靶向信号可以较短,并且由ser-lys-leu组成,但也存在其他变异,如pts2和mpts(膜pts)。mpts可以由蛋白环内(即,膜间距之间)的一簇碱性氨基酸(精氨酸和赖氨酸)组成。
[0152]
ots还可以是溶酶体靶向基序,例如,包含序列tyr-x-xo,其中x可以是任何氨基酸和o可以是体积较大的疏水性氨基酸或二亮氨酸基序(leu-leu)。
[0153]
在本公开的融合蛋白中,ots可以是天然序列,即,ots可以在融合蛋白中也存在的目标蛋白中天然存在,或者与该蛋白天然相关。例如,ots和目标蛋白可以是相同天然存在的多肽序列的一部分。在一个具体实例中,本公开的融合蛋白可以包含成熟hfxn和mts序列mwtlgrravagllaspspaqaqtltrvprpaelaplcgrrglrtd idatctprrassnqrglnqiwnvkkqsvylmnlrk(seq id no:10),其均是与全长hfxn(seq id no:1)相对应的相同天然存在的多肽序列的一部分。在细胞中合成后,当将多肽序列导入线粒体基质时,线粒体基质加工肽酶(mpp)将天然存在的多肽序列seq id no:1进行两步切割。因此,生成不包含mts的成熟hfxn(seq id no:2)。
[0154]
在其他实施方式中,在本公开的融合蛋白中包含的ots可以是异源序列,即,与也包含在融合蛋白中的目标蛋白不天然相关。作为异源序列的ots可以衍生自不同于融合蛋白中所含目标蛋白的蛋白。例如,本公开的融合蛋白可以包含fxn,例如,成熟hfxn,作为目标蛋白,以及来源于柠檬酸合酶或脂肪酰胺脱氢酶(lad)的mts,如在美国专利号8,912,147中所描述的,其全部内容通过引用并入本文。异源ots可以是另一种蛋白的片段,其通过切割或重组技术产生,也可以通过化学合成,并进一步融合到目标蛋白。
[0155]
在一些实施方式中,ots可以包含氨基酸序列,其与天然蛋白或异源蛋白的天然ots结构域具有至少85%,例如,至少90%、至少95%、至少96%、至少97%、至少98%、至少99%或100%序列同一性。
[0156]
在一些实施方式中,本公开的融合蛋白包含mts,例如,mwtlgrravagllaspspaqaqtltrvprpaelaplcgrrglrtd idatctprrassnqrglnqiwnvkkqsvylmnlrk(seq id no:10)。在其他实例中,本公开的融合蛋白包含与seq id no:10具有至少85%,例如,至少86%、至少87%、至少88%、至少89%、至少90%、至少91%、至少92%、至少93%、至少94%、至少95%、至少96%、至少97%、至少98%、至少99%或100%序列同一性的氨基酸序列。在一些实施方式中,融合蛋白可以包含seq id no:10的功能类似物、衍生物或片段,如上文所定义的。
[0157]
在一些实施方式中,ots可以与目标蛋白天然相关,例如,天然存在形式的目标蛋白可以包含ots作为其序列的一部分。此类目标蛋白的一个实例是全长hfxn(seq id no:1),作为其序列的一部分,其包含mts(seq id no:10)和成熟hfxn(seq id no:2)。当包含
ots作为其序列的一部分的目标蛋白包含在本公开的融合蛋白中时,除了作为目标蛋白的一部分存在的ots以外,该融合蛋白不包含其他ots。
[0158]
在其他实施方式中,与目标蛋白天然相关的ots可以被不与目标蛋白一起天然存在的ots取代。例如,作为全长hfxn的一部分并且与hfxn天然相关的mts(seq id no:10)可以用不同的ots替代,例如,衍生自柠檬酸合酶或脂酰胺脱氢酶(lad)的mts,如在美国专利号8,912,147中所描述的。因此,本公开的融合蛋白可以包含成熟hfxn(seq id no:2)和不同于seq id no:10的mts,如来源于lad的mts。
[0159]
在一些实施方式中,本公开的融合蛋白可以不存在ots。例如,本公开的融合蛋白可以包含目标蛋白、cpp(例如,hiv-tat)和tes,并缺乏ots。在一些实施方式中,本公开的融合蛋白由目标蛋白、cpp(例如,hiv-tat)和tes组成。
[0160]
细胞穿透肽(cpp)
[0161]
本公开提供的融合蛋白还包含细胞穿透肽(cpp)。细胞穿透肽(cpp)是短肽序列,通常长度为5至30个氨基酸之间,其能够促进各种分子货物(如蛋白)的细胞摄取。cpp可以是多聚阳离子,即,具有氨基酸组成,其可能含有相对高丰度的带正电的氨基酸,如赖氨酸或精氨酸。ccp还可以是两亲性的,即,其序列包含极性/带电氨基酸和非极性、疏水性氨基酸的交替模式。cpp还可以是疏水性的,即,只含有低净电荷的非极性残基,或具有对细胞摄取至关重要的疏水性氨基酸基团。
[0162]
在本公开背景下有用的cpp可以是本领域技术人员公知的任何cpp。例如,在本公开的融合蛋白中包含的cpp可以是在细胞穿透肽数据库cppsite 2.0中列出的任何cpp,其全部内容通过引用在此并入本文。例如,在本公开的背景下有用的cpp可以选自以下:hiv-tat(其在本文中还可以称为“tat”)、甘丙肽、黄蜂毒素、transportan、穿膜肽、聚精氨酸或vp22。在一个具体实施方式中,cpp是hiv-tat。下表4中列出了示例性cpp的氨基酸序列。
[0163]
表4:示例性cpp和相应序列
[0164][0165]
在一些实例中,本公开的融合蛋白可以包含与表4中列出的任一氨基酸序列(即,seq id no:11、seq id no:12、seq id no:13、seq id no:14、seq id no:15、seq id no:16、seq id no:17或seq id no:83)具有至少85%,例如,至少86%、至少87%、至少88%、至少89%、至少90%、至少91%、至少92%、至少93%、至少94%、至少95%、至少96%、至少97%、至少98%、至少99%或100%序列同一性的氨基酸序列。在一些实例中,本公开的融合
蛋白可以包含表4中列出的任一氨基酸序列(即,seq id no:11、seq id no:12、seq id no:13、seq id no:14、seq id no:15、seq id no:16、seq id no:17或seq id no:83)的目标蛋白的功能性类似物、衍生物或片段。
[0166]
在一个实施方式中,在本公开的融合蛋白中包含的cpp是hiv-tat,例如,seq id no:11。在另一个具体实例中,在本公开的融合蛋白中包含的cpp是hiv-tat(具有n末端甲硫氨酸),例如,seq id no:83。在另一个实例中,本公开的融合蛋白包含全长fxn,例如,seq id no:1和作为cpp的hiv-tat。在另一个其他实例中,本公开的融合蛋白包含成熟fxn,例如,seq id no:2,作为目标蛋白和hiv-tat作为cpp。
[0167]
在一些实施方式中,以及不希望受到特定理论的束缚,据信在本公开的融合蛋白中包含的cpp可能会干扰将同样包含在融合蛋白中的目标蛋白递送到细胞器,例如,非核细胞器。例如,如在本公开的实施例1中所示,tat-gg-hfxn融合蛋白主要定位于胞浆中和细胞核中,而不是线粒体中。
[0168]
靶增强序列(tes)
[0169]
本公开的融合蛋白还包含靶增强序列(tes)。如本文所用,术语“靶增强序列(tes)”指当存在于包含cpp的融合蛋白中时,可防止或减弱cpp对将目标蛋白递送到其适当亚细胞位置的干扰的氨基酸序列。例如,在一些实施方式中,如本文所用,tes指一种氨基酸序列,其通过消除或减弱cpp对意向细胞器(例如,非核细胞器,如线粒体)的目标蛋白递送的干扰,促进意向细胞器目标蛋白的有效递送。示例性tes可以包含蛋白酶敏感序列,在本文中也称为“蛋白酶可切割结构域”、“蛋白酶敏感结构域”或“蛋白酶敏感肽”。示例性tes还可以包含核输出信号肽。
[0170]
蛋白酶敏感肽也可以称为“蛋白酶可切割位点”。蛋白酶敏感肽或蛋白酶可切割位点指氨基酸序列中的特定氨基酸序列,该序列被特定的胞内胞浆蛋白酶识别和切割。
[0171]
如上文所述,在一些实施方式中,在本公开的融合蛋白中,cpp可能能够干扰融合蛋白中所含目标蛋白递送至非核细胞器。包含蛋白酶切割位点的tes有助于从融合蛋白中除去cpp,从而防止cpp的干扰。例如,如图1的图a中所示,在本公开的一些示例性融合蛋白中,cpp可以位于融合蛋白的n末端处和tes可以在cpp的c末端侧处融合。当融合蛋白暴露于内源性蛋白酶时,内源性蛋白酶可以在蛋白酶切割位点处切割tes,促进从融合蛋白的n末端去除cpp。类似地,如图1的图b中所示,在本公开的其他示例性融合蛋白中,cpp可以位于融合蛋白的c末端处和tes可以在cpp的n末端侧处融合。当融合蛋白暴露于内源性蛋白酶时,内源性蛋白酶可以在蛋白酶切割位点处切割tes,从而从融合蛋白的c末端去除cpp。
[0172]
可以包含在tes中的蛋白酶敏感肽或蛋白的非限制性实例包括泛素样修饰因子,如泛素、半胱天冬酶切割结构域、钙蛋白酶切割结构域、sumo1、sumo2、sumo3、sumo4、isg15、atg8、atg12和nedd8。
[0173]
泛素在真核生物中高度保守,人直系同源物的序列为:
[0174]
mqifvktltgktitlevepsdtienvkakiqdkegippdqqrli fagkqledgrtlsdyniqkestlhlvlrlrgg(seq id no.18)。
[0175]
示例性半胱天冬酶切割结构域可以包含devd(seq id no.19)。
[0176]
钙蛋白酶切割结构域的非限制性实例是eplfaerk(seq id no.20)或llvy(seq id no.21)。
[0177]
其他示例性蛋白酶切割位点可以包含在waugh,protein expr.purif.2011,80(2):283-293中描述的任何切割位点,其每一个的全部内容通过引用并入本文。
[0178]
具有特定蛋白酶切割位点的示例性蛋白酶可以包括泛素酶、半胱天冬酶、钙蛋白酶、肠激酶(轻链)、肠肽酶、prescission蛋白酶、人鼻病毒蛋白酶(hrv 3c)、tev(烟草蚀纹病毒)蛋白酶、tvmv(烟草叶脉斑点病毒)蛋白酶、xa因子蛋白酶、凝血酶和本领域技术人员公知的其他蛋白酶。下表5包括蛋白酶切割位点及其各自蛋白酶的一些实例。
[0179]
表5:示例性蛋白酶切割位点和相应蛋白酶
[0180][0181][0182]
sumo(小泛素样修饰因子)蛋白是一个小蛋白家族(长度约为100个氨基酸,分子量约为12kda),其与细胞中的其他蛋白共价连接或分离,以修饰其功能。sumo家族成员之间的精确长度和分子量不同,这取决于蛋白来源的生物体。sumo蛋白的实例是sumo1、sumo2、sumo3和sumo4,其具有下表6中列出的氨基酸序列。
[0183]
表6:sumo蛋白的氨基酸序列
[0184][0185][0186]
在一些实施方式中,在本公开的融合蛋白中包含的tes可以包含蛋白酶敏感肽或蛋白。在一些实例中,tes可以包含本文所述的序列,例如,表5中列出的任一seq id no(seq id no:22、seq id no:23、seq id no:24、seq id no:25、seq id no:26、seq id no:27、seq id no:28、seq id no:29、seq id no:30、seq id no:31或seq id no:84),或与表5中列出的任一seq id no(seq id no:22、seq id no:23、seq id no:24、seq id no:25、seq id no:26、seq id no:27、seq id no:28、seq id no:29、seq id no:30、seq id no:31或seq id no:84)具有至少85%,例如,至少90%或至少95%序列同一性的序列。在一些实例中,本公开的融合蛋白可以包含表5中列出的任一seq id no(seq id no:22、seq id no:23、seq id no:24、seq id no:25、seq id no:26、seq id no:27、seq id no:28、seq id no:29、seq id no:30、seq id no:31或seq id no:84)的目标蛋白的功能性类似物、衍生物或片段。
[0187]
在其他实施方式中,在本公开的融合蛋白中包含的tes可以包含泛素样修饰因子。在一些实例中,tes可以包含本文所述的序列,例如,表6中列出的任一seq id no(seq id no:32、seq id no:33、seq id no:34或seq id no:35),或与表6中列出的任一seq id no(seq id no:32、seq id no:33、seq id no:34或seq id no:35)具有至少85%,例如,至少86%、至少87%、至少88%、至少89%、至少90%、至少91%、至少92%、至少93%、至少94%、至少95%、至少96%、至少97%、至少98%或至少99%序列同一性的序列。在一些实例中,本公开的融合蛋白可以包含表6中列出的任一seq id no(seq id no:32、seq id no:33、seq id no:34或seq id no:35)的目标蛋白的功能性类似物、衍生物或片段。
[0188]
与seq id no:22-31的任一项或seq id no:32-35的任一项具有至少85%序列同一性的氨基酸序列可以从以下数据库的一个或多个中找到:genbank、蛋白数据库(pdb)、swissprot、蛋白信息资源(pir)或蛋白研究基金(prf)。
[0189]
在一些实例中,在本公开的融合蛋白中包含的tes可以包含核输出信号(nes)。当在蛋白中存在时,nes将蛋白从细胞核输出到胞质。蛋白通过核转运通过核孔复合物输出。因此,在本公开的背景下,当在融合蛋白中存在的cpp促进将目标蛋白递送至细胞核时,tes
通过促进目标蛋白从细胞核输出到胞质来抵消cpp的上述作用。通过这种方式,tes增加了将目标蛋白递送到目标非核细胞器(即,线粒体)的可能性。
[0190]
在一些实例中,nes可以是由四个疏水性残基组成的肽,其不一定是串联的。例如,nes可以是包含氨基酸序列lxxxlxxlxl的肽,其中“l”是疏水性残基(通常为亮氨酸)和“x”是除亮氨酸以外的任何氨基酸。不希望受到特定理论的束缚,据信nes中疏水性残基的间距可以通过检查含有nes的已知结构来解释,因为关键残基通常位于蛋白中相邻二级结构的同一面,这使得其能够与蛋白的出口蛋白相互作用。
[0191]
本公开涵盖本领域普通技术人员公知的任何nes,包括在nesbase 1.0版(核输出信号数据库)中列出的nes,其全部内容在此通过引用并入本文。表7列出了某些示例性mes及其相应序列。
[0192]
表7:示例性nes和相应序列
[0193]
seq id no.sumo蛋白氨基酸序列36nes1lalklagldl37nes2lqkkleelel38nes3mqelsnilnl39nes4lpplerltl40nes5lcqafsdvil41nes6rtfdmhslesslidimr42nes7tnlealqkkleelelde43nes8rsfemtefnqaleeikg
[0194]
在本公开的一些实施方式中,tes可以包含本文所述的序列,例如,表7中列出的任一seq id no(seq id no:36、seq id no:37、seq id no:38、seq id no:39、seq id no:40、seq id no:41、seq id no:42或seq id no:43),或与表7中列出的任一seq id no(seq id no:36、seq id no:37、seq id no:38、seq id no:39、seq id no:40、seq id no:41、seq id no:42或seq id no:43)具有至少85%,例如,至少86%、至少87%、至少88%、至少89%、至少90%、至少91%、至少92%、至少93%、至少94%、至少95%、至少96%、至少97%、至少98%或至少99%序列同一性的序列。在一些实例中,本公开的融合蛋白可以包含表7中列出的任一seq id no(seq id no:36、seq id no:37、seq id no:38、seq id no:39、seq id no:40、seq id no:41、seq id no:42或seq id no:43)的目标蛋白的功能性类似物、衍生物或片段。
[0195]
与seq id no:36-43的任一项具有至少85%序列同一性的氨基酸序列可以从以下数据库的一个或多个中找到:genbank、蛋白数据库(pdb)、swissprot、蛋白信息资源(pir)或蛋白研究基金(prf)。
[0196]
融合蛋白
[0197]
在本公开的一个实施方式中,本文提供的融合蛋白可以包含将被递送至非核细胞器的目标蛋白、细胞器靶向序列(ots)、细胞穿透肽(cpp)和靶增强序列(tes),其中cpp能够干扰将目标蛋白递送到非核细胞器,而tes可以防止cpp的干扰。在一些实例中,目标蛋白、ots、cpp和tes可以直接相互融合形成单个多肽链。在其他实例中,目标蛋白、ots、cpp和tes可以通过间隔子相互融合形成单个多肽链。
[0198]
在一个具体实施方式中,目标蛋白是fxn,例如,seq id no:2。在一个具体实施方式中,ots是mts,例如,seq id no:10。在一个具体实施方式中,cpp是hiv-tat,例如,seq id no:11。在一个具体实施方式中,tes可以是蛋白酶敏感肽或蛋白,例如,sumo1(例如,seq id no:32);泛素(例如,seq id no:18);半胱天冬酶切割位点,例如,devd(seq id no:19)或钙蛋白酶切割位点,例如,eplfaerk(seq id no:20)或llvy(seq id no:21)。在一个具体实施方式中,tes可以是nes,例如,nes1(seq id no:36)或nes2(seq id no:37)。
[0199]
在本公开的实施方式中,本文提供的融合蛋白可以包含将被递送至细胞的目标蛋白、细胞穿透肽(cpp)和靶增强序列(tes)。在一些实施方式中,cpp能够干扰将目标蛋白递送到细胞和/或细胞器,而tes可以防止cpp的干扰。在一些实例中,目标蛋白、cpp和tes可以直接相互融合形成单个多肽链。在其他实例中,目标蛋白、cpp和tes可以通过间隔子相互融合形成单个多肽链。
[0200]
在一个具体实施方式中,目标蛋白是parkin,例如,seq id no:7。在一个具体实施方式中,cpp是hiv-tat,例如,seq id no:11。在一个具体实施方式中,tes可以是蛋白酶敏感肽或蛋白,例如,sumo 1(例如,seq id no:32);泛素(例如,seq id no:18);半胱天冬酶切割位点,例如,devd(seq id no:19)或钙蛋白酶切割位点,例如,eplfaerk(seq id no:20)或llvy(seq id no:21)。在一个具体实施方式中,tes可以是nes,例如,nes1(seq id no:36)或nes2(seq id no:37)
[0201]
在本公开提供的融合蛋白中,目标蛋白、ots(如果存在的话)、cpp和tes相对于彼此的位置以及n末端和c末端可以改变。包含目标蛋白、ots、cpp和tes的不同相对构型的示例性融合蛋白如图2中所示。例如,如图2的图a所示,从n末端起始,示例性融合蛋白可以包含cpp,然后是tes,然后是ots,然后是在c末端处的目标蛋白。在图2的图b中所示的另一个实例中,从n末端起始,融合蛋白可以包含cpp,然后是tes,然后是目标蛋白,然后是在c末端的ots。在图2的图c中所示的另一个实例中,从n末端起始,示例性融合蛋白可以包含ots,然后是目标蛋白,然后是tes,然后是在c末端处的cpp。在图2的图d中所示的另一个实例中,从n末端起始,融合蛋白可以包含目标蛋白,然后是ots,然后是tes,然后是在c末端处的cpp。在图2的图e中所示的另一个实例中,从n末端起始,融合蛋白可以包含cpp,然后是ots,然后是目标蛋白,然后是tes。在图2的图f中所示的另一个实例中,从n末端起始,融合蛋白可以包含tes,然后是ots,然后是目标蛋白,然后是cpp。在图2的图g中所示的又一个实例中,从n末端起始,融合蛋白可以包含cpp,然后是tes,然后是目标蛋白。在图2的图h中所示的又一个实例中,从n末端起始,融合蛋白可以包含目标蛋白,然后是tes,然后是cpp。
[0202]
在一些实例中,在本公开的融合蛋白中,不同结构域(即,目标蛋白、cpp、ots,如果存在的话和tes)可以直接相互融合形成单一多肽链。如本文所用,术语“直接”指第一结构域的c末端氨基酸和第二结构域的n末端氨基酸之间不存在相互直接融合的干扰氨基酸。也就是说,第一结构域末端(n末端或c末端)处的(第一或最后一个)氨基酸可以融合至第二结构域的末端(n末端或c末端)处的(第一或最后一个)氨基酸,形成单一多肽。换言之,在该实施方式中,第一结构域的c末端的最后一个氨基酸通过共价键直接连接至第二结构域的n末端的第一氨基酸,或者第一结构域的n末端的第一氨基酸通过共价键直接连接至第二结构域的c末端的最后一个氨基酸以形成单一多肽。
[0203]
在其他实例中,在本公开的融合蛋白中,不同结构域(即,目标蛋白、cpp、ots,如果
存在的话和tes)可以通过间隔物融合在一起以形成单一多肽链。如本文所用,术语“间隔物”可以与术语“接头”互换使用,指至少一个氨基酸序列,其将两个结构域连接在一起以形成一条多肽链。当包含在融合蛋白中时,间隔物可以防止空间位阻。在一些实例中,间隔物或接头的长度可以从2至31个氨基酸改变,例如,从2至10个氨基酸、从5至15个氨基酸、从10至25个氨基酸或从12至31个氨基酸。本领域普通技术人员将能够为每个特定融合蛋白确定合适的接头或间隔物长度,以使得接头或间隔物不会对融合蛋白的构象或融合蛋白各结构域之间的相互作用施加任何约束。接头或间隔物可以是此前描述的内源性和天然存在的接头或间隔物,其在分隔蛋白内的结构域或形成二聚体中起作用。或者,接头或间隔物可以是人工设计的接头或间隔物,其用于产生融合蛋白的重组技术中。在本公开的背景下使用的接头或间隔物的实例显示在下表8中。
[0204]
表8:示例性接头或间隔物
[0205]
seq id no.氨基酸序列44ggggslvprgsggggs45gsgsgs46gsgsgsgsgsgsgsgs47ggsgghmgsgg48ggsggsggsgg49ggsgg50gggsegggsegggseggg51aagaataa52ggggg53ggssg54gsgggtgggsg gt gg
[0206]
在一些实施方式中,本公开的融合蛋白可以包含gg(gly-gly)接头。例如,本公开的融合蛋白可以包含gg接头,其将cpp结构域与tes结构域连接,例如,蛋白酶切割位点。在另一个实例中,本公开的融合蛋白可以包含gg接头,其将cpp结构域与ots结构域连接,例如,mts。在一个具体实施方式中,tat-cpp与mts-fxn通过gg接头连接。
[0207]
本公开的示例性融合蛋白及其相应序列列于下表9中。
[0208]
表9:示例性融合蛋白
[0209]
[0210]
[0211][0212]
在一些实施方式中,本公开提供的融合蛋白包含表9中所列的任一序列或由其组成,即,seq id no:55-61、69-71或81的任一项(seq id no:55、seq id no:56、seq id no:57、seq id no:58、seq id no:59、seq id no:60、seq id no:61、seq id no:69、seq id no:70、seq id no:71或seq id no:81)。在一些实施方式中,本公开提供的融合蛋白包含与表9中所列的任一序列具有至少85%,例如,至少86%、至少87%、至少88%、至少89%、至少90%、至少91%、至少92%、至少93%、至少94%、至少95%、至少96%、至少97%、至少98%、至少99%或100%序列同一性的氨基酸序列或由其组成,例如,seq id no:55-61、69-71或81的任一项(seq id no:55、seq id no:56、seq id no:57、seq id no:58、seq id no:59、seq id no:60、seq id no:61、seq id no:69、seq id no:70、seq id no:71或seq id no:81)。在一些实施方式中,本公开的融合蛋白可以包含表9中所列的任一序列的功能性类似物、衍生物或片段,即,seq id no:55-61的任一项(seq id no:55、seq id no:56、seq id no:57、seq id no:58、seq id no:59、seq id no:60、seq id no:61、seq id no:69、seq id no:70、seq id no:71或seq id no:81)。
[0213]
在一个实施方式中,融合蛋白包含具有如seq id no:55中所示的氨基酸序列的tat-gg-sumo1-hfxn或由其组成。在一个实施方式中,融合蛋白包含具有如seq id no:81中所示的氨基酸序列的tat-ss_sumo-hfxn或由其组成。在一个实施方式中,融合蛋白包含具有如seq id no:56中所示的氨基酸序列的tat-gg-泛素-hfxn或由其组成。在一个实施方式中,融合蛋白包含具有seq id no:57中所示的氨基酸序列的tat-gg-devd-hfxn或由其组成。在一个实施方式中,融合蛋白包含具有seq id no:58中所示的氨基酸序列的tat-gg-eplfaerk-hfxn或由其组成。在一个实施方式中,融合蛋白包含具有seq id no:59中所示的氨基酸序列的tat-gg-llvy-hfxn或由其组成。在一个实施方式中,融合蛋白包含具有seq id no:60中所示的氨基酸序列的tat-gg-hfxn-nes1或由其组成。在一个实施方式中,融合
蛋白包含具有seq id no:61中所示的氨基酸序列的tat-gg-hfxn-nes2或由其组成。在一个实施方式中,融合蛋白包含具有seq id no:69中所示的氨基酸序列的tat-gg-泛素-parkin或由其组成。在一个实施方式中,融合蛋白包含具有seq id no:70中所示的氨基酸序列的tat-gg-eplfaerk-parkin或由其组成。在一个实施方式中,融合蛋白包含具有seq id no:71中所示的氨基酸序列的tat-parkin-nes1或由其组成。
[0214]
在一些实施方式中,本公开提供的融合蛋白包含:1)与作为目标蛋白的全长hfxn(seq id no:1)具有至少85%、至少90%、至少95%或至少99%序列同一性的氨基酸序列;2)如上文所述的任何cpp;和3)如上文所述的任何tes。
[0215]
在一些实施方式中,本公开提供的融合蛋白包含:1)与作为目标蛋白的全长hfxn(seq id no:1)具有至少85%、至少90%、至少95%或至少99%序列同一性的氨基酸序列;2)与tat-hiv(seq id no:11或seq id no:83)具有至少85%、至少90%、至少95%或至少99%序列同一性的氨基酸序列;和3)如上文所述的任何tes。
[0216]
例如,本公开提供的融合蛋白可以包含:1)与作为目标蛋白的全长hfxn(seq id no:1)具有至少85%、至少90%、至少95%或至少99%序列同一性的氨基酸序列;2)与tat-hiv(seq id no:11或seq id no:83)具有至少85%、至少90%、至少95%或至少99%序列同一性的氨基酸序列;和3)与泛素(seq id no:18)具有至少85%、至少90%、至少95%或至少99%序列同一性的氨基酸序列。
[0217]
例如,本公开提供的融合蛋白可以包含:1)与作为目标蛋白的全长hfxn(seq id no:1)具有至少85%、至少90%、至少95%或至少99%序列同一性的氨基酸序列;2)与tat-hiv(seq id no:11)具有至少85%、至少90%、至少95%或至少99%序列同一性的氨基酸序列;和3)与seq id no:20的钙蛋白酶切割结构域具有至少85%、至少90%、至少95%或至少99%序列同一性的氨基酸序列。
[0218]
例如,本公开提供的融合蛋白可以包含:1)与作为目标蛋白的全长hfxn(seq id no:1)具有至少85%、至少90%、至少95%或至少99%序列同一性的氨基酸序列;2)与tat-hiv(seq id no:11或seq id no:83)具有至少85%、至少90%、至少95%或至少99%序列同一性的氨基酸序列;和3)与seq id no 19、seq id no:21、seq id no:22、seq id no:23、seq id no:24、seq id no:25、seq id no:26、seq id no:27、seq id no:28、seq id no:29、seq id no:30、或seq id no:31、seq id no:32、seq id no:33、seq id no:34和seq id no:35的任一项具有至少85%、至少90%、至少95%或至少99%序列同一性的氨基酸序列。
[0219]
在一些实施方式中,本公开提供的融合蛋白包含:1)与作为目标蛋白的parkin(seq id no:7)具有至少85%、至少90%、至少95%或至少99%序列同一性的氨基酸序列;2)如本文所述的任何cpp;和3)如本文所述的任何tes。
[0220]
在一些实施方式中,本公开提供的融合蛋白包含:1)与作为目标蛋白的parkin(本文也称为“park2蛋白”,seq id no:7)具有至少85%、至少90%、至少95%或至少99%序列同一性的氨基酸序列;与tat-hiv(seq id no:11)具有至少85%、至少90%、至少95%或至少99%序列同一性的氨基酸序列;和3)如本文所述的任何tes。
[0221]
例如,本公开的融合蛋白可以包含1)与作为目标蛋白的parkin(seq id no:7)具有至少85%、至少90%、至少95%或至少99%序列同一性的氨基酸序列;2)与tat-hiv(seq id no:11或seq id no:83)具有至少85%、至少90%、至少95%或至少99%序列同一性的氨
基酸序列;和3)与泛素(seq id no:18)具有至少85%、至少90%、至少95%或至少99%序列同一性的氨基酸序列。
[0222]
例如,本公开的融合蛋白可以包含1)与作为目标蛋白的parkin(seq id no:7)具有至少85%、至少90%、至少95%或至少99%序列同一性的氨基酸序列;2)与tat-hiv(seq id no:11或seq id no:83)具有至少85%、至少90%、至少95%或至少99%序列同一性的氨基酸序列;和3)与seq id no:20的钙蛋白酶切割结构域具有至少85%、至少90%、至少95%或至少99%序列同一性的氨基酸序列。
[0223]
例如,本公开的融合蛋白可以包含1)与作为目标蛋白的parkin(seq id no:7)具有至少85%、至少90%、至少95%或至少99%序列同一性的氨基酸序列;2)与tat-hiv(seq id no:11或seq id no:83)具有至少85%、至少90%、至少95%或至少99%序列同一性的氨基酸序列;和3)与seq id no:19、seq id no:21、seq id no:22、seq id no:23、seq id no:24、seq id no:25、seq id no:26、seq id no:27、seq id no:28、seq id no:29、seq id no:30、或seq id no:31、seq id no:32、seq id no:33、seq id no:34和seq id no:35的任一项具有至少85%、至少90%、至少95%或至少99%序列同一性的氨基酸序列。
[0224]
在一些实施方式中,本公开提供的一个或多个融合蛋白还可以包含真核细胞的翻译后修饰特征,例如,哺乳动物细胞,例如,人细胞。在一些实施方式中,融合蛋白可以包含一个或多个(例如,2、3、4、5、6、7、8、9、10个或更多个)翻译后修饰,如糖基化、磷酸化、乙酰化或其组合。在一些实施方式中,糖基化可包括向精氨酸、天冬酰胺、半胱氨酸、羟赖氨酸、丝氨酸、苏氨酸、酪氨酸或色氨酸添加糖基。糖基化可以包括,例如,o-连接糖基化或n-连接糖基化。本公开的融合蛋白的糖基化水平可以在体外使用sds-page凝胶和用过碘酸-希夫(pas)法修订的western印记来评估。可以包含糖基化的融合蛋白的细胞定位可以通过利用本领域公知的凝集素荧光缀合物来完成。可存在于本公开的融合蛋白中的磷酸化可以使用磷酸化特异性抗体通过western印记来评估。
[0225]
本公开的融合蛋白中可能存在的翻译后修饰还可以包括与疏水性基团缀合(例如,肉豆蔻酰化、棕榈酰化、异戊二烯化、戊二烯化或糖基磷脂酰肌醇化)、与辅因子的缀合(例如,脂酰化、黄素部分(例如,fmn或fad))、heme c附着、磷酸泛酰巯基乙炔化或亚视黄醇席夫碱形成、二苯甲酰胺形成、乙醇胺磷酸甘油附着、高赖氨酸形成、酰化(例如,o-酰化、n-酰化或s-酰化)、甲酰化、乙酰化、烷基化(例如,甲基化或乙基化)、酰胺化、丁酰化、γ-羧化、丙二酰化、羟基化、碘化、添加核苷酸,如adp-核糖基化、氧化、磷酸酯(o-连接)或氨基磷酸酯(n-连接)形成(例如,磷酸化或腺苷酸化)、丙酰化、焦谷氨酸形成、s-谷胱甘肽化、s-亚硝基化、琥珀酰化、硫酸化、isg化、sumo化、泛素化、类泛素化或氨基酸的化学修饰(例如,瓜氨酸化、脱酰胺化、消除化或氨甲酰化)、二硫键桥形成、(例如,脯氨酸、丝氨酸、丙氨酸或甲硫氨酸)的消旋化。
[0226]
核酸
[0227]
本公开还提供了一种编码如上文所述的融合蛋白的核酸,或其任何变体。
[0228]
如本文所用,术语“一个或多个核酸”与术语“一个或多个多核苷酸”是可互换的,并且通常指任何多核糖核苷酸或多脱氧核糖核苷酸,其可以是未修饰的rna或dna或者修饰的rna或dna或者其任何组合。术语“一个或多个核酸”包括但不限于单链和双链核酸。
[0229]
本公开提供了如本文所述的融合蛋白或其变体。本公开提供的变体可以包括适用
于氨基酸和核酸序列的保守取代的变体。关于核酸序列,保守修饰的变体指编码相同或基本相同氨基酸序列的那些核酸。具体而言,简并密码子取代可以通过产生其中一个或多个选定(或所有)密码子的第三位被混合碱基和/或脱氧肌苷残基取代的序列来实现。由于遗传密码的简并性,大量功能相同的核酸编码任何给定的蛋白。例如,密码子gca、gcc、gcg和gcu都编码氨基酸丙氨酸。因此,在其中丙氨酸是由密码子指定的每个位置,可以将密码子改变为所描述的任何相应密码子而不改变编码的多肽。这种核酸变异是沉默变异,是保守修饰的变异的一种。本文所述的每个编码多肽的核酸序列也描述了所述核酸的每个可能的沉默变异。技术人员将意识到的是,核酸中的每个密码子(除了aug和tgg以外,auc通常是甲硫氨酸的唯一密码子,tgg通常是色氨酸的唯一密码子)可以被修饰以编码功能相同的多肽。因此,编码多肽的核酸的每个沉默变异隐含在每个所述的序列中。
[0230]
关于氨基酸序列的保守取代,普通技术人员可以意识到,对核酸、肽、多肽或蛋白序列的单个取代、缺失或添加会改变、添加或缺失编码序列中的单个氨基酸或一小部分氨基酸是保守修饰的变体,其中改变导致氨基酸被化学上相似的氨基酸取代。提供功能相似的氨基酸的保守取代表是本领域众所周知的。这种保守修饰的变体是对本公开的多态性变体、种间同源物和等位基因的补充且不排除。
[0231]
以下各组均包含相互保守取代的氨基酸:
[0232]
1)丙氨酸(a)、甘氨酸(g);
[0233]
2)丝氨酸(s)、苏氨酸(t);
[0234]
3)天冬氨酸(d)、谷氨酸(e);
[0235]
4)天冬酰胺(n)、谷氨酰胺(q);
[0236]
5)半胱氨酸(c)、甲硫氨酸(m);
[0237]
6)精氨酸(r)、赖氨酸(k)、组氨酸(h);
[0238]
7)异亮氨酸(1)、亮氨酸(l)、缬氨酸(v);和
[0239]
8)苯丙氨酸(f)、酪氨酸(y)、色氨酸(w)。
[0240]
下表10中列出了编码本公开的融合蛋白的某些示例性核酸。
[0241]
表10:编码本公开的融合蛋白的核酸
[0242]
[0243]
[0244]
[0245]
[0246][0247]
在一些实施方式中,编码本公开的融合蛋白的核酸包含表10中列出的任一序列,即,seq id no:62-68的任一项(seq id no:62、seq id no:63、seq id no:64、seq id no:65、seq id no:66、seq id no:67、seq id no:68、seq id no:86、seq id no:87或seq id no:88)。在一些实施方式中,编码本公开提供的融合蛋白的核酸序列包含与seq id no:62-68的任一项(seq id no:62、seq id no:63、seq id no:64、seq id no:65、seq id no:66、seq id no:67、seq id no:68、seq id no:86、seq id no:87或seq id no:88)具有至少85%,例如,至少86%、至少87%、至少88%、至少89%、至少90%、至少91%、至少92%、至少93%、至少94%、至少95%、至少96%、至少97%、至少98%、至少99%或100%序列同一性的序列。
[0248]
在一个实施方式中,编码融合蛋白tat-gg-sumo1-hfxn的核酸序列具有如seq id no:62中所示的序列。在一个实施方式中,编码融合蛋白tat-gg-泛素-hfxn的核酸序列具有如seq id no:63中所示的序列。在一个实施方式中,编码融合蛋白tat-gg-devd-hfxn的核酸序列具有如seq id no:64中所示的序列。在一个实施方式中,编码融合蛋白tat-gg-eplfaerk-hfxn的核酸序列具有如seq id no:65中所示的序列。在一个实施方式中,编码融合蛋白tat-gg-llvy-hfxn的核酸序列具有如seq id no:66中所示的序列。在一个实施方式中,编码融合蛋白tat-gg-hfxn-nes1的核酸序列具有如seq id no:67中所示的序列。在一个实施方式中,编码融合蛋白tat-gg-hfxn-nes2的核酸序列具有如seq id no:68中所示的序列。在一个实施方式中,编码融合蛋白tat-gg-泛素-parkin的核酸序列具有如seq id no:86中所示的序列。在一个实施方式中,编码融合蛋白tat-gg-eplfaerk-parkin的核酸序列具有如seq id no:87中所示的序列。在一个实施方式中,编码融合蛋白tat-gg-parkin-nes1的核酸序列具有如seq id no:88中所示的序列。
[0249]
本公开还提供了一种用于在细胞中生产如本文定义的融合蛋白的表达载体,例
如,哺乳动物细胞、细菌细胞或真菌细胞。本公开的表达载体可以包含编码本公开的融合蛋白的核酸(例如,seq id no:62-68的任一项)。本公开的表达载体可以包含编码本公开的融合蛋白的核酸,例如,seq id no:62-68的任一项。例如,表达载体可以是逆转录病毒载体、dna载体、质粒、rna载体、腺病毒载体、腺病毒相关载体、慢病毒载体、噬菌体、杆状病毒或其任何组合。
[0250]
载体
[0251]
载体可以使dna片段或核酸序列整合到宿主的基因组中,或者使未整合的遗传元件能够表达。载体通常是自我复制的dna或rna构建体,包含所需的核酸序列,以及可操作地连接的遗传控制元件,这些元件在适宜宿主细胞中被识别并影响所需间隔序列的翻译。在通常情况下,遗传控制元件可以包括原核启动子系统或真核启动子表达控制系统。此类系统通常包含转录启动子和转录增强子以提高rna表达水平。载体通常包含允许载体独立于宿主细胞进行复制的复制原点。因此,术语控制和调控元件包括启动子、终止子和其他表达控制元件。此类调控元件在本领域中描述并且为本领域技术人员所知。例如,当与dna序列可操作地连接时控制dna序列表达的多种表达控制序列中的任一种可用于这些载体中以表达编码本文所述的任何所需融合蛋白的dna序列。
[0252]
载体可以另外包含适当的限制性位点、抗生素抗性或用于选择包含载体的细胞的其他标志物。质粒是最常用的载体形式,但其他形式的载体也适用于本文,其具有同等功能,并且是或编的是本领域已知适用于本文的。
[0253]
载体也可以称为构建体,或称为重组核酸。如本文所指,术语“重组dna”、“重组核酸序列”或“重组基因”指包含编码如本文所述的融合蛋白的开放阅读框架(orf)的核酸。包含编码如本文所述的融合蛋白的orf的构建体可以任选地进一步包含可操作地连接到本文所述的核酸序列的附加元件,如启动子、调节和控制元件、翻译、表达和其他信号。如本文所用,术语“可操作地连接”旨在表示以允许转基因转录的方式附接。如本文所用,术语“编码”旨在表示主题核酸可以在适当的表达系统中转录和翻译成所需的多肽或主题蛋白,例如,当主题核酸与适宜载体(例如,表达载体)中的合适的控制序列如启动子和增强子元件连接时,以及当载体被引入合适的系统或细胞时。
[0254]
根据一些实施方式,可以将编码本公开的融合蛋白的重组dna克隆进入载体,例如,能够整合进入细胞的慢病毒载体质粒。根据一些实施方式,可以将编码一种或多种融合蛋白的重组dna克隆到编码可选择性状(如抗生素抗性基因)的质粒dna构建体中。根据一些实施方式,可以将编码融合蛋白的重组dna克隆到适合于在细胞中稳定表达融合蛋白的质粒构建体中。
[0255]
缀合物
[0256]
本公开还提供了一种用于将目标蛋白细胞内递送至非核细胞器的缀合物。本公开的缀合物可以包含如本公开中定义的融合蛋白,以及至少一种标记,例如放射性、荧光、发色团、酶、肽或蛋白标记,小分子或聚合物(如聚乙二醇,peg,例如)。
[0257]
细胞
[0258]
本公开还提供了一种细胞,其包含如本文所述的融合蛋白、核酸、载体、缀合物或其任何组合的任何一种。在一些方面中,细胞可以是干细胞或ips细胞。在其他方面中,细胞可以选自以下:肌祖细胞、神经元祖细胞、骨髓干细胞、细菌细胞或酵母细胞。例如,细胞可
以是肌肉或肌祖细胞、成纤维细胞、表皮细胞、心脏细胞、干细胞、胚胎干细胞、多能细胞、神经元、骨髓干细胞中的任何一种,并且包括酵母或细菌细胞系。
[0259]
在某些实施方式中,包含融合蛋白、核酸、载体、缀合物或其任何组合的细胞可以选自以下:长期造血干细胞、短期造血干细胞、多能祖细胞、谱系限制祖细胞、淋巴样祖细胞、髓系祖细胞、常见髓系祖细胞、红系祖细胞、巨核细胞红系祖细胞、视网膜细胞、感光细胞、视杆细胞、视锥细胞、视网膜色素上皮细胞、小梁网细胞、耳蜗毛细胞、外毛细胞、内毛细胞、肺上皮细胞、支气管上皮细胞、肺泡上皮细胞、肺上皮祖细胞、横纹肌细胞、心肌细胞、肌肉卫星细胞、神经元、神经元干细胞、诱导多能干(ips)细胞、胚胎干细胞、成纤维细胞、单核细胞衍生的巨噬细胞或树突状细胞、巨核细胞、中性粒细胞、嗜酸性粒细胞、嗜碱性粒细胞、肥大细胞、细胞、b细胞,例如,祖b细胞、pre b细胞、pro b细胞、记忆b细胞、浆b细胞、胃肠上皮细胞、胆管上皮细胞、胰腺导管上皮细胞、肠干细胞、肝细胞、肝星状细胞、枯否细胞、成骨细胞、破骨细胞、脂肪细胞、前脂肪细胞、胰岛细胞(例如,β细胞、α细胞、δ细胞)、胰腺外分泌细胞、雪旺细胞和少突胶质细胞。
[0260]
在一些实施方式中,包含融合蛋白的细胞是分裂细胞。在其他实施方式中,包含融合蛋白的细胞是非分裂细胞。
[0261]
在一些实施方式中,包含本公开的融合蛋白的细胞可以在受试者中,如施用融合蛋白的受试者,例如,用于治疗病理状况,例如,遗传病。在一些实例中,病理状况可以是非核细胞器相关病症。在一个具体实例中,病理状况是弗里德赖希氏共济失调。
[0262]
在一个具体实例中,可以向受试者施用本公开的融合蛋白,例如,seq id no:55-61的任一项,用于治疗弗里德赖希氏共济失调。在其他实例中,可以向受试者施用本公开的融合蛋白用于治疗线粒体病症,例如,线粒体肌病、糖尿病和耳聋、leber遗传性视神经病、神经病、色素性视网膜炎、上睑下垂(narp)、肌神经源性胃肠脑病、肌阵挛性癫痫、阿尔茨海默氏病、肌营养不良、lou gehrig病和癌症。在另外其他实例中,可以向受试者施用本公开的融合蛋白用于治疗溶酶体病症,如鞘脂病组的脂质贮积病(例如,尼曼匹克症、法布里病、克拉伯病、戈谢病、泰-萨克斯病或异染性脑白质营养不良)、亨特氏综合征、i-细胞病、多发性硫酸酯酶缺乏症、ii型和iiia型粘脂病、半乳糖唾液酸中毒gm2-ap缺乏症、sap缺乏症和唾液酸贮积病。在另外其他实例中,可以向受试者施用本公开提供的融合蛋白,例如,seq id no:69-71的任一项,用于治疗帕金森氏病。
[0263]
在其他实施方式中,包含本公开的融合蛋白的细胞可以是已被工程化以表达融合蛋白的细胞。在一些实例中,此类工程化细胞可以从受试者获得,例如,分离。用于工程化改造细胞以表达本公开的融合蛋白的方法是本领域普通技术人员公知的,并且包括本文下面在标题为“细胞内递送的方法”的部分中描述的方法。
[0264]
药物组合物
[0265]
本公开还提供了一种药物组合物,其包含如上文所述的融合蛋白或缀合物,以及药学上可接受的稀释剂、载体、添加剂和/或赋形剂。
[0266]
药物组合物的制备描述在,例如,hoover,john e(编著),remington's pharmaceutical sciences,mack publishing co.,easton,pa.第18版(1990),和liberman,h.a.和lachman,l.(编著)pharmaceutical dosage forms,marcel decker,new york,n.y.(1989)中,其每一个的全部内容通过引用在此并入。
[0267]
可以在体外将药物组合物递送至细胞,例如,通过使细胞与药物组合物接触。或者,对于体内递送,本公开提供的药物组合物可以口服、胃肠外、吸入喷雾、直肠、皮内、透皮或局部施用,以含有所需常规无毒药学上可接受的载体、佐剂和载剂的剂量单位剂型形式施用。局部施用还可以涉及使用透皮施用,如透皮贴剂或离子电渗装置。如本文所用,术语胃肠外包括皮下、静脉内、肌内或胸骨内注射或输注技术。
[0268]
可注射药物组合物,例如,无菌可注射水性或油质混悬剂,可以根据本领域公知的技术使用适宜的分散剂或润湿剂和混悬剂来配制。无菌可注射药物制剂还可以是在无毒胃肠外可接受稀释剂或溶剂(例如,1,3-丁二醇)中的无菌可注射溶液或混悬剂。可以使用的可接受的载体和溶剂包括水、林格氏溶液和等渗氯化钠溶液。此外,通常将无菌的不挥发油通常用作溶剂或混悬介质。为此目的,可以使用任何温和的不挥发油,包括合成的甘油单酯或甘油二酯。此外,脂肪酸,如油酸,可用于制备注射剂。可以使用二甲基乙酰胺,包括离子和非离子去垢剂的表面活性剂和聚乙二醇。如上文讨论的溶剂和润湿剂的混合物也是有用的。
[0269]
用于胃肠外施用的药物组合物可以是水性或非水性等渗无菌注射溶液或混悬剂形式。这些溶液和混悬剂可以由无菌粉末或颗粒制备,所述粉末或颗粒具有一种或多种用于口服施用的制剂中提及的载体或稀释剂。可以将融合蛋白或组合物溶解在水、聚乙二醇、丙二醇、乙醇、玉米油、棉籽油、花生油、芝麻油、苯甲醇、氯化钠和/或各种缓冲液中。其他佐剂和施用模式在制药领域是众所周知的。
[0270]
用于口服施用的液体剂型可以包括含有本领域常用的惰性稀释剂(如水)的药学上可接受的乳剂、溶液、混悬剂、糖浆和酏剂。此类药物组合物还可以包含佐剂,如润湿剂、乳化剂和混悬剂,以及甜味剂、调味剂和芳香剂。
[0271]
用于口服施用的固体剂型包括胶囊、片剂、丸剂、散剂和颗粒剂。在此类固体剂型中,融合蛋白可以与乳糖、蔗糖、淀粉粉、链烷酸纤维素酯、纤维素烷基酯、滑石粉、硬脂酸、硬脂酸镁、氧化镁、磷酸和硫酸的钠盐和钙盐、明胶、阿拉伯胶、海藻酸钠、聚乙烯吡咯烷酮和/或聚乙烯醇混合,然后压片或封装以方便施用。此类胶囊或片剂可以包含控释制剂,如可以在活性化合物在羟丙基甲基纤维素中的分散体中提供。在胶囊、片剂和丸剂的情况下,剂型还可以包含缓冲剂,如柠檬酸钠,或者碳酸镁或碳酸钙或碳酸氢钙。片剂和丸剂可以另外制备有肠溶衣。
[0272]
可以通过将活性剂与适宜无刺激性赋形剂混合来制备本文讨论的融合蛋白的直肠施用栓剂,如可可脂,合成的甘油单酯、甘油二酯或甘油三酯,脂肪酸或聚乙二醇,其在常温下为固体但在直肠温度下为液体,因此会在直肠中融化并释放药物。
[0273]
可以通过各种方法施用本公开的融合蛋白,包括,例如,口服、肠内、粘膜、经皮或胃肠外。优选胃肠外施用,特别是通过静脉内、肌内、皮下、皮内、关节内、鞘内和腹腔内输注或注射,包括使用本领域技术人员可用的泵连续输注或间歇输注。或者,可以通过微囊化制剂的方式施用融合蛋白,例如,基于脂质体。
[0274]
细胞内递送方法
[0275]
在一些实施方式中,本公开还提供了用于将目标蛋白细胞内递送至细胞中的非核细胞器的方法。所述方法包括将细胞与上文所述的融合蛋白、核酸、载体或缀合物接触。在一个实例中,非核细胞器是线粒体。在一个实例中,目标蛋白是fxn,例如,fxn。
[0276]
使细胞与本公开的融合蛋白接触可以发生在将本公开的融合蛋白、核酸、载体、缀合物、药物组合物或其任何组合施用于受试者(例如,人)的背景下。受试者可以患有病理状况,例如,遗传病,如非核细胞器相关病症。在一个具体实例中,病理状况是弗里德赖希氏共济失调。
[0277]
在一些实施方式中,用于将目标蛋白细胞内递送至非核细胞器的方法可以包括通过使细胞与编码本公开的融合蛋白的核酸或与包含本公开的核酸的载体接触来接触细胞,例如,分离的细胞。在一些方面中,细胞是干细胞或ips细胞。在其他方面中,细胞可以选自肌祖细胞、神经元祖细胞、骨髓干细胞、细菌细胞或酵母细胞。在一些方面中,细胞可以是肌祖细胞、神经元祖细胞、骨髓干细胞、细菌细胞系或酵母细胞系,其具有编码本公开的融合蛋白的核酸。所述方法还可以包括用于促进将本公开的核酸或载体递送到细胞中的其他步骤,例如,电穿孔、化学或聚合物转染、病毒转导、机械膜破坏或本领域技术人员公知的其他方法。
[0278]
在一些实施方式中,本公开还提供了用于增加递送至细胞的目标蛋白的量的方法。如本公开中的某些实验数据所证明的,例如,在实施例6中,与使用包含目标蛋白和cpp,但不包含tes的融合蛋白处理的细胞相比,用包含目标蛋白、cpp和tes的融合蛋白处理的细胞目标蛋白的量显著更高。因此,实验数据表明,tes有助于目标蛋白递送至细胞和/或在细胞中累积。因此,将tes引入包含cpp和目标蛋白的融合蛋白能够显著增加细胞中目标蛋白的量。
[0279]
不希望受到特定理论的束缚,据信细胞中内源性蛋白酶对tes的切割促进了cpp从融合蛋白中的去除,并防止cpp促进目标蛋白扩散穿过质膜并扩散到细胞外。这使得目标蛋白在细胞中累积,导致递送至细胞的目标蛋白的量增加。
[0280]
在一些实施方式中,细胞可以在受试者(例如,人)中。因此,用于增加递送至细胞的目标蛋白的量的方法可以使得减少作为治疗的一部分递送至受试者的融合蛋白的剂量,例如,用于治疗非核细胞器相关病症。
[0281]
在一些实施方式中,目标蛋白可以是fxn。因此,在一些实施方式中,融合蛋白可以包含cpp(例如,seq id no:11或seq id no:83)、tes和fxn(例如,seq id no:1或seq id no:2),以及受试者可以患有与fxn缺陷相关的病症,例如,弗里德赖希氏共济失调。在其他实施方式中,融合蛋白可以包含cpp(例如,seq id no:11或seq id no:83)、tes和fxn(例如,seq id no:1或seq id no:2),以及受试者可以患有不与fxn缺陷相关的病症,例如,莱氏综合征,法裔加拿大型。
[0282]
在一些实施方式中,目标蛋白可以是parkin。因此,在一些实施方式中,融合蛋白可以包含cpp(例如,seq id no:11或seq id no:83)、tes和parkin(例如,seq id no:7),以及受试者可以患有与在编码parkin的park2基因中的突变相关的帕金森氏病。在其他实施方式中,融合蛋白可以包含cpp(例如,seq id no:11或seq id no:83)、tes和parkin(例如,seq id no:7),以及受试者可以患有与在编码parkin的park2基因中的突变不相关的帕金森氏病,例如,与在pink1(park6)基因中的突变相关的帕金森氏病。
[0283]
在一些方面中,本公开提供的用于增加递送至细胞的目标蛋白的量的方法包括通过将靶增强序列(tes)引入包含目标蛋白和细胞穿透肽(cpp)的融合蛋白中修饰融合蛋白的序列,从而产生修饰的融合蛋白;以及使细胞与修饰的融合蛋白接触,从而增加递送至细
胞的目标蛋白的量。
[0284]
cpp可以位于修饰的融合蛋白的n末端处和tes可以在cpp的c末端处融合。例如,从n末端处起始,修饰的融合蛋白可以包含:cpp;tes和目标蛋白。在另一个实例中,从n末端处起始,修饰的融合蛋白可以包含:cpp、tes、ots和目标蛋白。
[0285]
cpp还可以位于修饰的融合蛋白的c末端处和tes可以在cpp的n末端处融合。例如,从n末端处起始,修饰的融合蛋白可以包含:目标蛋白、tes和cpp。在另一个实例中,从n末端处起始,修饰的融合蛋白可以包含:目标蛋白、ots、tes和cpp。在又一个实例中,从n末端处起始,修饰的融合蛋白可以包含:ots、目标蛋白、tes和cpp。
[0286]
在一些实施方式中,目标蛋白可以是如本文所述的任何目标蛋白,例如,在本文的表2中列出的任何目标蛋白。例如,目标蛋白可以选自以下:frataxin(fxn)、tafazin、丙酮酸脱氢酶(pdh)、slirp、lrppc、park2蛋白、park6蛋白、park7蛋白及其变体或衍生物。在一个实例中,目标蛋白是frataxin(fxn)或者其变体或衍生物。在另一个实例中,目标蛋白是park2蛋白(parkin)或者其变体或衍生物。
[0287]
在一些实施方式中,cpp可以是如本文所述的任何cpp,例如,在本文的表4中列出的任何cpp。例如,cpp可包含选自细胞穿透肽cppsite 2.0数据库中列出的cpp的肽。例如,cpp可以包含选自以下的肽:hiv-tat、甘丙肽、黄蜂毒素、transportan、穿膜肽、聚精氨酸、vp22及其变体或衍生物。在一个实施方式中,cpp可以包含hiv-tat或者其变体或衍生物。
[0288]
在一些实施方式中,在修饰的融合蛋白中包含的tes可以是本文所述的任何tes。例如,tes可以是核输出信号肽,例如,包含与seq id no:36-43的任一项具有至少85%、至少90%、至少95%或至少99%序列同一性的序列。在一些实例中,核输出信号肽可以包含选自以下的肽:nes1、nes2、nes3、nes4、nes5、nes6、nes7、nes8及其变体或衍生物。在一个实例中,核输出信号肽可以包含nes1或者其变体或衍生物。在另一个实例中,核输出信号肽可以包含nes或者其变体或衍生物。
[0289]
在修饰的融合蛋白中包含的tes还可以是蛋白酶敏感肽。例如,tes可以包含泛素样修饰因子,例如,可以包含与seq id no:18-31的任一项具有至少85%、至少90%、至少95%或至少99%序列同一性的序列。
[0290]
在其他实例中,tes可以包含选自以下的蛋白酶敏感肽:泛素、半胱天冬酶切割结构域、钙蛋白酶切割结构域、sumo1、sumo2、sumo3、sumo4、isg15、atg8、atg12、nedd8及其变体或衍生物。
[0291]
在一些实例中,修饰的融合蛋白可以包含与seq id no:55-61和69-71的任一项具有至少85%、至少90%、至少95%或至少99%序列同一性的氨基酸序列。
[0292]
治疗方法
[0293]
本文提供了一种用于在有需要的受试者中治疗非核细胞器相关病症的治疗性化合物。在一些实施方式中,治疗性化合物可以包括本公开的融合蛋白、核酸、载体或缀合物。在一些实施方式中,非核细胞器相关病症的非限制性实例可以包括线粒体病症和溶酶体病症。在一些实施方式中,非核细胞器相关病症是遗传病。
[0294]
在本公开中还提供了用于治疗非核细胞器相关病症的方法,其包括向有需要的受试者施用如本文所述的融合蛋白、核酸、载体、缀合物、细胞或药物组合物。在一些实施方式中,非核细胞器相关病症是线粒体病症。在一个具体实例中,线粒体病症是弗里德赖希氏共
济失调。
[0295]
在一些实例中,非核细胞器相关病症可以是溶酶体病症,即,与溶酶体功能障碍相关的病症。
[0296]
在一些实施方式中,非核细胞器相关病症可以选自以下:弗里德赖希氏共济失调(fdra)、巴斯综合征、帕金森氏病、莱氏综合征,如莱氏综合征,法裔加拿大型,和丙酮酸脱氢酶缺乏症。
[0297]
可基于多种因素选择患有或可能处于发展成本文公开的任何一种或多种病症的风险的受试者进行治疗,包括症状表现,和/或鉴定使受试者易患疾病或病症的标志物(如基因突变)。
[0298]
如本文所用,术语“受试者”包括人或非人动物,优选脊椎动物,和更优选人。受试者还可以包括转基因生物体。更优选地,受试者是人,如患有或倾向于发展成非核细胞器相关病症的人,如弗里德赖希氏共济失调或帕金森氏病。
[0299]
如本文所用,术语“治疗非核细胞器相关病症”包括减少、改善或消除与非核细胞器相关病症相关的一种或多种症状,例如,弗里德赖希氏共济失调或帕金森氏病。术语“治疗非核细胞器相关病症”还包括部分或基本上实现以下一项或多项:减轻或改善与非核细胞器相关病症相关的症状或指征;阻止非核细胞器相关病症的至少一种症状的进展或恶化。术语“治疗非核细胞器相关病症”还包括预防非核细胞器相关病症的至少一种症状的发展或推迟其出现,或者发展出至少一种非核细胞器相关病症的症状,其严重程度低于未经治疗会出现的相同症状。
[0300]
治疗弗里德赖希氏共济失调(fdra)的方法
[0301]
在一个实施方式中,本公开提供了用于治疗弗里德赖希氏共济失调(fdra)的方法,其包括向有需要的受试者施用本公开的融合蛋白。例如,本公开提供了用于治疗frda的方法,其包括向有需要的受试者施用融合蛋白,所述融合蛋白包含:1)与作为目标蛋白的全长hfxn(seq id no:1)具有至少85%、至少90%、至少95%或至少99%序列同一性的氨基酸序列;2)如本文所述的任何cpp;和3)如本文所述的任何tes。
[0302]
在一些实施方式中,用于治疗frda的方法包括向有需要的受试者施用融合蛋白,所述融合蛋白包含:1)与作为目标蛋白的全长hfxn(seq id no:1)具有至少85%、至少90%、至少95%或至少99%序列同一性的氨基酸序列;2)与tat-hiv(seq id no:11)具有至少85%、至少90%、至少95%或至少99%序列同一性的氨基酸序列;和3)如本文所述的任何tes。
[0303]
在一些实施方式中,用于治疗frda的方法包括向有需要的受试者施用融合蛋白,所述融合蛋白包含:1)与作为目标蛋白的全长hfxn(seq id no:1)具有至少85%、至少90%、至少95%或至少99%序列同一性的氨基酸序列;2)与tat-hiv(seq id no:11)具有至少85%、至少90%、至少95%或至少99%序列同一性的氨基酸序列;和3)与泛素(seq id no:18)具有至少85%、至少90%、至少95%或至少99%序列同一性的氨基酸序列。
[0304]
在一些实施方式中,用于治疗frda的方法包括向有需要的受试者施用融合蛋白,所述融合蛋白包含:1)与作为目标蛋白的全长hfxn(seq id no:1)具有至少85%、至少90%、至少95%或至少99%序列同一性的氨基酸序列;2)与tat-hiv(seq id no:11)具有至少85%、至少90%、至少95%或至少99%序列同一性的氨基酸序列;和3)与seq id no:20的
钙蛋白切割结构域具有至少85%、至少90%、至少95%或至少99%序列同一性的氨基酸序列。
[0305]
在一些实施方式中,用于治疗frda的方法包括向有需要的受试者施用融合蛋白,所述融合蛋白包含:1)与作为目标蛋白的全长hfxn(seq id no:1)具有至少85%、至少90%、至少95%或至少99%序列同一性的氨基酸序列;2)与tat-hiv(seq id no:11)具有至少85%、至少90%、至少95%或至少99%序列同一性的氨基酸序列;和3)与seq id no 19、seq id no:21、seq id no:22、seq id no:23、seq id no:24、seq id no:25、seq id no:26、seq id no:27、seq id no:28、seq id no:29、seq id no:30、或seq id no:31、seq id no:32、seq id no:33、seq id no:34和seq id no:35的任一项具有至少85%、至少90%、至少95%或至少99%序列同一性的氨基酸序列。
[0306]
在一些实施方式中,用于治疗frda的方法包括向有需要的受试者施用融合蛋白,所述融合蛋白包含选自以下的氨基酸序列或由其组成:seq id no:56、seq id no:57、seq id no:58、seq id no:59、seq id no:60、seq id no:61和seq id no:81。
[0307]
在一个实施方式中,用于治疗frda的方法包括向有需要的受试者施用融合蛋白,所述融合蛋白包含与seq id no:56具有至少约85%、约90%、约95%或约99%序列同一性的氨基酸序列或由其组成。
[0308]
在一个实施方式中,用于治疗frda的方法包括向有需要的受试者施用融合蛋白,所述融合蛋白包含与seq id no:57具有至少约85%、约90%、约95%或约99%序列同一性的氨基酸序列或由其组成。
[0309]
在一个实施方式中,用于治疗frda的方法包括向有需要的受试者施用融合蛋白,所述融合蛋白包含与seq id no:58具有至少约85%、约90%、约95%或约99%序列同一性的氨基酸序列或由其组成。
[0310]
在一个实施方式中,用于治疗frda的方法包括向有需要的受试者施用融合蛋白,所述融合蛋白包含与seq id no:59具有至少约85%、约90%、约95%或约99%序列同一性的氨基酸序列或由其组成。
[0311]
在一个实施方式中,用于治疗frda的方法包括向有需要的受试者施用融合蛋白,所述融合蛋白包含与seq id no:60具有至少约85%、约90%、约95%或约99%序列同一性的氨基酸序列或由其组成。
[0312]
在一个实施方式中,用于治疗frda的方法包括向有需要的受试者施用融合蛋白,所述融合蛋白包含与seq id no:61具有至少约85%、约90%、约95%或约99%序列同一性的氨基酸序列或由其组成。
[0313]
在一个实施方式中,用于治疗frda的方法包括向有需要的受试者施用融合蛋白,所述融合蛋白包含与seq id no:81具有至少约85%、约90%、约95%或约99%序列同一性的氨基酸序列或由其组成。
[0314]
如本文所用,术语“frda”涵盖与frataxin缺陷相关的任何疾病、病症或病况。如本文所用,术语“frda相关疾病、病症或病况”涵盖继发于和/或由frda引起的疾病、病症或病况,即,当存在于受试者中时,其伴随着frda并且在不存在frda的受试者中不存在。frda相关疾病、病症或病况的非限制性实例包括frda相关肺炎、frda相关肥厚型心肌病和frda相关糖尿病。frda相关疾病、病症或病况的其他非限制性实例包括其特征为以下但不限于此
的frda相关疾病、病症或病况:
[0315]
(1)神经系统缺陷,包括但不限于以下一项或多项:本体感觉丧失、反射丧失、行走能力丧失、眼睛无法凝视;
[0316]
(2)吞咽障碍和/或吞咽能力逐渐丧失;进行性听力丧失;
[0317]
(3)由于fxn缺陷引起的视网膜变性导致的视力进行性丧失;
[0318]
(4)进行性失语;
[0319]
(5)代谢综合征,包括但不限于甘油三酯升高、高密度脂蛋白(hdl)胆固醇降低和低密度脂蛋白(ldl)胆固醇升高;
[0320]
(6)需要手术矫正的脊柱侧弯;和/或其组合。
[0321]
在一些实施方式中,向受试者施用本公开的融合蛋白可以治疗frda,包括,例如,frda相关疾病、病症或病况。如本文所用,“治疗frda”涵盖减轻、改善或降低frda的严重程度,包括frda相关疾病、病症或病况。例如,“治疗frda”涵盖减轻、改善或降低与frda相关的至少一种症状或指征。如本文所用,“治疗frda”还涵盖延迟frda的进展,例如,包括frda相关疾病、病症或病况,例如,延迟与frda相关的至少一个症状或指征的出现,或者防止受试者至少一个与frda相关的症状或指征的严重程度的增加。
[0322]
在一些实施方式中,术语“治疗frda”还涵盖增加患有frda的受试者(例如,人)的存活(例如,生存时间),包括,例如,与frda相关的疾病、病症或病况。例如,frda治疗可能导致患有frda的受试者(例如,人)的预期寿命延长,包括,例如,与frda相关的疾病、病症或病况。在一些实施方式中,与患有类似疾病但未进行治疗的一个或多个对照个体的平均预期寿命相比,在本公开的背景下使用frda治疗可以导致受试者的预期寿命增加大于约10%、大于约20%、大于约30%、大于约40%、大于约50%、大于约60%、大于约70%、大于约80%、大于约90%、大于约100%、大于约110%、大于约120%、大于约130%、大于约140%、大于约150%、大于约160%、大于约170%、大于约180%、大于约190%或者大于约200%或更多。
[0323]
在一些实施方式中,与患有类似疾病但未进行治疗的一个或多个对照个体的平均预期寿命相比,在本公开的背景下使用frda治疗(包括,例如,frda相关疾病、病况或病症)可以导致受试者的预期寿命增加大于约6个月、大于约8月、大于约10月、大于约12月、大于约2年、大于约4个月、大于约6个月、大于约8个月或者大于约10个月或更多。在一些实施方式中,在本公开的背景下使用frda治疗(包括,例如,frda相关疾病、病况或病症)可以导致患有frda的受试者(例如,人)的长期存活,包括,例如,与frda相关的疾病、病症或病况。如本文所用,术语“长期存活”指存活时间或预期寿命长于约40年、45年、50年、55年、60年或更长时间。
[0324]
本领域普通技术人员已知的临床评估可用于评估frda,包括,例如,与frda相关的疾病、病症或病况,以确定frda的严重程度和/或以确定向受试者施用本公开的融合蛋白的效果。描述了frda临床评估方法的实例,包括frda的严重程度评估,例如,在paap等,“standardized assessment of hereditary ataxia patients in clinical studies”,mov disord clin pract.2016,3(3):230-240和patel等,“progression of friedreich ataxia:quantitative characterization over5years”,ann clin transl neurol 2016,3(9):684-694中,其每一个的全部内容通过引用在此并入本文。
[0325]
定时25英尺(t25-fw)是一种定量的灵活性和腿部功能性能测试,用于测量完成25
英尺步行所需的时间。在一些实施方式中,向受试者施用本公开的融合蛋白可能导致frda严重程度降低,例如,通过完成25英尺步行所需的时间所测量的。例如,与施用本公开的融合蛋白之前在受试者中测量的完成25英尺步行所需的时间相比,或与基线值相比,向受试者施用本公开的融合蛋白可以导致完成25英尺步行所需的时间减少,例如,完成25英尺步行所需的时间减少至少约%、至少约10%、至少约25%或至少约50%。基线值可能是在施用本公开的融合蛋白之前测量的完成25英尺步行所需的时间。
[0326]
在其他实施方式中,向受试者施用本公开的融合蛋白可以延迟受试者frda的进展,如通过完成25英尺步行所需的时间所测量的。例如,与基线值相比(即,在施用本公开的融合蛋白之前在受试者中测量的完成25英尺步行所需的时间),向受试者施用本公开的融合蛋白可能导致完成25英寸步行所需的时间大致相同,或完成25英寸步行所需的时间缺乏实质性增加(例如,完成25英寸步行所需的时间增加不到20%、不到10%或不到5%)。
[0327]
改良的弗里德赖希氏共济失调评定量表(mfars)是一种基于检查的评定量表,用于评估frda的严重程度,如例如在burk等,“monitoring progression in friedreich ataxia(frda):the use of clinical scales”,j of neurochemistry 2013,126(suppl.1):118-124和rummey等,“psychometric properties of the friedreich’s ataxia rating scale”,neurol genet 2019,5:e371中所描述的,其每一个的全部内容通过引用在此并入本文。
[0328]
在一些实施方式中,mfars评分可以包括以下至少一个子评分:a)基于功能性残基评定量表(fars-fds;0-6级;通常由神经科医师进行评估);b)基于日常生活活动量表的评分(fars-adl,0-36分;由患者或护理者进行评估);和c)基于神经评定量表的评分(fars-neuro,0-125分;由神经学家进行评估)。在一些实例中,fars_adl评分是一种fars评定量表,用于评估受试者完成adl(例如,说话、切割食物、穿衣和个人卫生)的能力,分数范围从0至36分。调查对象可以是受试者;受试者和家庭的组合;或者无法完成测试的受试者的家庭成员、配偶或护理者。
[0329]
在一些实施方式中,基于神经评定量表的评分可以包括神经评定量表的修订评分,涉及受试者直接参与,并针对frda影响的特定区域,如延髓、上肢、下肢和直立稳定性(mfars-neuro,0-99分)。mfars-neuro不包括fars问卷神经评定量表中的子量表d(周围神经系统)和子量表a(延髓)的前2个问题。
[0330]
在一些实施方式中,mfars评分可能基于从完整fars问卷中得出的两个子评分:如上文所述的mfars-neuro和如上文所述的fars_adl。
[0331]
在一些实施方式中,向受试者施用本公开的融合蛋白可以导致frda的严重程度降低,如例如通过如本文所述的mfars评分或至少一个mfars子评分所测量的。例如,与基线值(即,施用本公开的融合蛋白之前在受试者中测量的mfars评分或至少一个mfars子评分)相比,向受试者施用本公开的融合蛋白可以导致mfars评分或至少一个mfars子评分降低。
[0332]
在其他实施方式中,向受试者施用本公开的融合蛋白可以延迟受试者中frda的进展,如例如通过如本文所公开的mfars评分或至少一个mfars子评分所测量的。例如,与基线值(即,施用本公开的融合蛋白之前在受试者中测量的mfars评分或至少一个mfars子评分)相比,或与基线值相比,向受试者施用本公开的融合蛋白可以导致mfars评分或至少一个mfars子评分基本相似,或者mfars评分或至少一个mfars子评分大幅减少。
[0333]
九柱钉测试(9hpt)可用于测量frda患者的手指灵活性。在该测试中,要求受试者从容器中一个接一个地取出钉子,并尽快将其放入木板上的九个孔中。然后,受试者必须逐个从孔中取出钉子,比将其放回容器中。评分基于完成测试活动所用的时间,以秒为单位记录。
[0334]
在一些实施方式中,向受试者施用本公开的融合蛋白可以导致frda的严重程度降低,如例如通过9hpt评分所测量的。例如,与基线值(即,在施用本公开的融合蛋白之前在受试者中测量的9hpt评分)相比,向受试者施用本公开的融合蛋白可以导致以至完成测试活动的时间表示的9hpt评分降低(例如,以至完成测试活动的时间表示的9hpt评分降低至少约5%、10%、25%或50%)。
[0335]
在其他实施方式中,向受试者施用本公开的融合蛋白可以推迟受试者frda的进展,如例如通过9hpt评分所测量的。例如,与基线值(即,在施用本公开的融合蛋白之前在受试者中测量的9hpt评分)相比,向受试者施用本公开的融合蛋白可以导致以至完成测试活动的时间表示的9hpt评分是基本上相似的9hpt评分或没有大幅增加。
[0336]
在一些实施方式中,与基线水平(即,在施用本公开的融合蛋白之前在受试者的至少一个组织或生物液中的hfxn水平)相比,向受试者施用本公开的融合蛋白导致在受试者至少一个组织或生物液中hfxn水平增加。在一些实施方式中,向受试者施用本公开的融合蛋白导致受试者至少一个组织或生物液中hfxn水平的增加足以产生治疗效果,即足以治疗受试者的frda。
[0337]
在一些实施方式中,向患有frda的受试者施用本公开的融合蛋白可以导致受试者的至少一个组织或生物液中hfxn的水平低于未患frda的受试者(例如,正常健康受试者)的至少一个组织或生物液中hfxn的水平,但仍足以产生治疗效果,即足以治疗受试者的frda。例如,向患有frda的受试者施用本公开的融合蛋白后,受试者的至少一个组织或生物液中hfxn的水平可以是未患有frda的受试者(例如,正常健康受试者)的至少一个组织或生物液中hfxn水平的约10%至约50%、约20%至约60%或约30%至约80%,但hfxn的水平仍然足以产生治疗效果,即足以治疗受试者的frda。
[0338]
在一些实施方式中,与施用本公开的融合蛋白之前在受试者的至少一个组织或生物液中的hfxn水平相比,或与基线水平相比,向患有frda的受试者施用本公开的融合蛋白可以导致在受试者的至少一个组织或生物液中的hfxn水平增加至少约5%、约10%、约25%、约50%、约100%、约150%、约200%、约300%、约400%、约500%或约600%。
[0339]
在一些实施方式中,与施用本公开的融合蛋白之前在受试者的至少一个组织或生物液中的hfxn水平相比,或与基线水平相比,向患有frda的受试者施用本公开的融合蛋白可以导致在受试者的至少一个组织或生物液中的hfxn水平增加约5%至约30%、约10%至约50%、约25%至约100%、约50%至约150%、约100%至约300%、约50%至约250%、约150%至约500%或约200%至约700%。在一些实施方式中,与施用本公开的融合蛋白之前在受试者的至少一个组织或生物液中的hfxn水平相比,或与基线水平相比,向患有frda的受试者施用本公开的融合蛋白可以导致在受试者的至少一个组织或生物液中的hfxn水平增加至少约2倍、约3倍、约4倍、约5倍。在一些实施方式中,与施用本公开的融合蛋白之前在受试者的至少一个组织或生物液中的hfxn水平相比,或与基线水平相比,向患有frda的受试者施用本公开的融合蛋白可以导致在受试者的至少一个组织或生物液中的hfxn水平增
加约2倍至约5倍之间,或约2倍至约10倍之间。
[0340]
在一些实施方式中,其中hfxn水平可以测量和/或升高的受试者的组织可以是任何能够进行活检的组织。在一些实施方式中,组织可以包括支气管肺泡组织(可通过例如支气管肺泡刷取样)、粘膜(例如,鼻粘膜,可通过例如鼻刷取样)、毛囊、皮肤组织或颊部组织。在一些实施方式中,组织包括皮肤组织或颊部组织。
[0341]
在一些实施方式中,其中hfxn水平可以测量和/或升高的受试者的生物液可以是血液或其组分(例如,血清、血浆、血小板或任何其他血液组分)、尿液或唾液。
[0342]
frda相关肺炎
[0343]
诊断为frda的受试者遭受背根神经节的神经变性,导致进行性共济失调。这通常会导致逐渐丧失行走、进食、说话、吞咽和肺部吸入的能力。肺部吸入事件可导致肺炎、频繁住院,并最终导致自诊断之日起10-15年内的死亡。
[0344]
因此,对诊断为frda的fxn缺陷受试者而言,施用本公开的融合蛋白作为蛋白替代疗法可以有效预防肺部吸入,从而预防肺部吸入后的肺炎。因此,本公开提供了在受试者中治疗frda相关肺炎的方法,其包括向有需要的受试者施用本公开的融合蛋白,从而在受试者中治疗frda相关肺炎。
[0345]
frda相关肥厚型心肌病
[0346]
肥厚型心肌病是心脏肌肉变厚,使心脏难以通过循环系统泵血的一种疾病。其可能是由心脏细胞线粒体中fxn的缺陷引起的。在诊断为患有frda的受试者中,进行性肥厚型心肌病约50%的时间进展为心力衰竭和死亡。用本发明的融合蛋白进行蛋白替代疗法可以替代肥厚型心肌病的fxn缺陷。
[0347]
因此,在诊断为frda和肥厚型心肌病的fxn缺陷受试者中,施用本公开的融合蛋白作为蛋白替代疗法是有效的。因此,本公开提供了在受试者中治疗frda相关肥厚型心肌病的方法,其包括向有需要的受试者施用本公开的融合蛋白,从而在受试者中治疗frda相关肥厚型心肌病。
[0348]
糖尿病
[0349]
糖尿病的特征是无法正确调节血糖水平,导致血糖水平升高。在诊断为frda的受试者中,糖尿病通常是胰腺中fxn缺陷的线粒体所致。使用本公开的融合蛋白的蛋白替代疗法可以替代糖尿病的fxn缺陷。
[0350]
因此,在诊断为糖尿病的fxn缺陷受试者中,施用本公开的融合蛋白作为蛋白替代疗法是有效的。因此,本公开提供了在受试者中治疗frda相关糖尿病的方法,其包括向有需要的受试者施用本公开的融合蛋白,从而在受试者中治疗frda相关糖尿病。
[0351]
其他frda相关疾病/病症
[0352]
诊断为frda的受试者经常会出现与fxn缺陷相关的其他病症。此类frda相关病症可以包括但不限于:神经病症,包括但不限于,本体感觉丧失、反射丧失、行走能力丧失、眼睛注视能力丧失;吞咽障碍和/或吞咽能力逐渐丧失;听力进行性丧失;由于缺乏fxn导致视网膜变性而导致的进行性视力丧失;语言逐渐丧失;代谢综合征,包括但不限于,甘油三酯升高、高密度脂蛋白(hdl)胆固醇降低和低密度脂蛋白(ldl)胆固醇升高;需要手术矫正的脊柱侧凸;和/或其组合。使用本公开的融合蛋白进行蛋白替代疗法可以替代这些frda相关疾病/病症的fxn缺陷。
[0353]
因此,对诊断为患有frda并经历神经疾病的fxn缺陷的受试者而言,施用本公开的融合蛋白作为蛋白替代疗法是有效的,其包括但不限于,本体感觉丧失、反射丧失、行走能力丧失、眼睛注视能力丧失;吞咽障碍和/或吞咽能力逐渐丧失;听力进行性丧失;由于缺乏fxn导致视网膜变性而导致的进行性视力丧失;语言逐渐丧失;代谢综合征,包括但不限于,甘油三酯升高、hdl胆固醇降低和ldl胆固醇升高;需要手术矫正的脊柱侧凸;和/或其组合。
[0354]
因此,本公开提供了治疗frda相关疾病、病症或病况的方法,其包括向有需要的受试者施用本公开的融合蛋白,其中与frda相关的疾病、病症或病况选自:神经病症,包括但不限于,本体感觉丧失、反射丧失、行走能力丧失、眼睛注视能力丧失;吞咽障碍和/或吞咽能力逐渐丧失;听力进行性丧失;由于缺乏fxn导致视网膜变性而导致的进行性视力丧失;语言逐渐丧失;代谢综合征,包括但不限于,甘油三酯升高、hdl胆固醇降低和ldl胆固醇升高;和需要手术矫正的脊柱侧凸。
[0355]
在某些实施方式中,使用本公开的融合蛋白、药物组合物或治疗性化合物(例如,包含fxn的融合蛋白)治疗有需要的受试者增加受试者中的细胞fxn水平。在一些实施方式中,相对于治疗前受试者中fxn的水平,本公开的方法使细胞fxn的水平增加至少约10%,例如,约20%、约25%、约30%、约40%、约50%、约60%、约70%、约75%、约80%、约85%、约90%、约95%或更多。在另一个实施方式中,本公开的方法使细胞fxn的水平增加至少约2倍、至少约3倍、至少约4倍、至少约5倍、至少约6倍、至少约7倍、至少约8倍、至少约9倍或至少约10倍。在一些实施方式中,通过比较施用本公开的融合蛋白前后受试者的fxn细胞水平来测量增加。
[0356]
在施用本公开的融合蛋白、药物组合物和/或治疗性化合物之前、期间和之后,受试者中细胞的fxn水平可在生物样品中测量,如血液、血清、血浆、尿液、腹膜液、脑脊液、粪便、肠粘膜刮片、从组织中采集的样品和/或从以下一种或多种内容物中采集的样品:胃、十二指肠、空肠、回肠、盲肠、结肠、直肠和肛管。在一些实施方式中,该方法可以包括施用本文公开的融合蛋白以增加受试者的fxn细胞水平。在一些实施方式中,该方法可以包括施用本公开的融合蛋白,以增加受试者细胞fxn水平至与治疗前细胞fxn水平相比增加超过约1%、2%、5%、10%、20%、25%、30%、40%、50%、60%、70%、75%、80%、85%、90%或95%。细胞fxn水平可以通过本领域公知的方法测量。例如,fxn的细胞水平可以通过收集样品来测量,如皮肤活检(冲片)、口腔拭子、血小板,并使用elisa、混合lba-lc-ms/ms或其他质谱相关方法分析其fxn。
[0357]
治疗莱氏综合征法裔加拿大型(lsfc)的方法
[0358]
本公开还提供了治疗莱氏综合征法裔加拿大型(lsfc)的方法,其包括向有需要的受试者施用本公开的融合蛋白,以使得受试者中的lsfc被治疗。令人吃惊的是,用本公开的hfxn融合蛋白处理细胞可以减少lrpprc缺陷细胞中的线粒体损伤,细胞生长培养基酸化证明了这一点。还令人吃惊的发现,用本公开的hfxn融合蛋白处理细胞后,lrpprc缺陷细胞分泌到细胞生长培养基中的cyr61蛋白量减少。此外,还令人吃惊的发现,本公开中包含tes的hfxn融合蛋白在减少lrpprc缺陷细胞的培养基酸化和cyr61分泌方面比不含tes的hfxn融合蛋白更有效。
[0359]
上述发现表明,与lrpprc缺陷相关的某些分子和细胞变化可以通过施用本公开的hfxn融合蛋白来缓解和/或逆转。上述发现还表明,与lrpprc缺陷相关的lsfc可通过施用本
公开的hfxn融合蛋白来治疗。此外,上述发现表明,本发明中包含tes的hfxn融合蛋白在治疗lsfc患者的lsfc和/或乳酸中毒方面比不包含tes的hfxn融合蛋白更有效。
[0360]
在一些实施方式中,本公开提供了用于在有需要的受试者中治疗lsfc的方法,其包括向受试者施用融合蛋白,所述融合蛋白包含:1)与作为目标蛋白的全长hfxn(seq id no:1)具有至少85%、至少90%、至少95%或至少99%序列同一性的氨基酸序列;2)如本文所述的任何cpp;和3)如本文所述的任何tes。
[0361]
在一些实施方式中,用于治疗lsfc的方法包括向有需要的受试者施用融合蛋白,所述融合蛋白包含:1)与作为目标蛋白的全长hfxn(seq id no:1)具有至少85%、至少90%、至少95%或至少99%序列同一性的氨基酸序列;2)与tat-hiv(seq id no:11)具有至少85%、至少90%、至少95%或至少99%序列同一性的氨基酸序列;和3)如本文所述的任何tes。
[0362]
在一些实施方式中,用于治疗lsfc的方法包括向有需要的受试者施用融合蛋白,所述融合蛋白包含:1)与作为目标蛋白的全长hfxn(seq id no:1)具有至少85%、至少90%、至少95%或至少99%序列同一性的氨基酸序列;2)与tat-hiv(seq id no:11)具有至少85%、至少90%、至少95%或至少99%序列同一性的氨基酸序列;和3)与泛素(seq id no:18)具有至少85%、至少90%、至少95%或至少99%序列同一性的氨基酸序列。
[0363]
在一些实施方式中,用于治疗lsfc的方法包括向有需要的受试者施用融合蛋白,所述融合蛋白包含:1)与作为目标蛋白的全长hfxn(seq id no:1)具有至少85%、至少90%、至少95%或至少99%序列同一性的氨基酸序列;2)与tat-hiv(seq id no:11)具有至少85%、至少90%、至少95%或至少99%序列同一性的氨基酸序列;和3)与seq id no:20的钙蛋白酶切割结构域具有至少85%、至少90%、至少95%或至少99%的氨基酸序列。
[0364]
在一些实施方式中,用于治疗lsfc的方法包括向有需要的受试者施用融合蛋白,所述融合蛋白包含:1)与作为目标蛋白的全长hfxn(seq id no:1)具有至少85%、至少90%、至少95%或至少99%序列同一性的氨基酸序列;2)与tat-hiv(seq id no:11)具有至少85%、至少90%、至少95%或至少99%序列同一性的氨基酸序列;和3)与seq id no 19、seq id no:21、seq id no:22、seq id no:23、seq id no:24、seq id no:25、seq id no:26、seq id no:27、seq id no:28、seq id no:29、seq id no:30、或seq id no:31、seq id no:32、seq id no:33、seq id no:34和seq id no:35的任一项具有至少85%、至少90%、至少95%或至少99%序列同一性的氨基酸序列。
[0365]
在一些实施方式中,用于治疗lsfc的方法包括向有需要的受试者施用融合蛋白,所述融合蛋白包含选自以下的氨基酸序列或由其组成:seq id no:56、seq id no:57、seq id no:58、seq id no:59、seq id no:60、seq id no:61和seq id no:83。
[0366]
在一个实施方式中,用于治疗lsfc的方法包括向有需要的受试者施用融合蛋白,所述融合蛋白包含与seq id no:56具有至少约85%、约90%、约95%或约99%序列同一性的氨基酸序列或由其组成。
[0367]
在一个实施方式中,用于治疗lsfc的方法包括向有需要的受试者施用融合蛋白,所述融合蛋白包含与seq id no:57具有至少约85%、约90%、约95%或约99%序列同一性的氨基酸序列或由其组成。
[0368]
在一个实施方式中,用于治疗lsfc的方法包括向有需要的受试者施用融合蛋白,
所述融合蛋白包含与seq id no:58具有至少约85%、约90%、约95%或约99%序列同一性的氨基酸序列或由其组成。
[0369]
在一个实施方式中,用于治疗lsfc的方法包括向有需要的受试者施用融合蛋白,所述融合蛋白包含与seq id no:59具有至少约85%、约90%、约95%或约99%序列同一性的氨基酸序列或由其组成。
[0370]
在一个实施方式中,用于治疗lsfc的方法包括向有需要的受试者施用融合蛋白,所述融合蛋白包含与seq id no:60具有至少约85%、约90%、约95%或约99%序列同一性的氨基酸序列或由其组成。
[0371]
在一个实施方式中,用于治疗lsfc的方法包括向有需要的受试者施用融合蛋白,所述融合蛋白包含与seq id no:61具有至少约85%、约90%、约95%或约99%序列同一性的氨基酸序列或由其组成。
[0372]
在一个实施方式中,用于治疗lsfc的方法包括向有需要的受试者施用融合蛋白,所述融合蛋白包含与seq id no:83具有至少约85%、约90%、约95%或约99%序列同一性的氨基酸序列或由其组成。
[0373]
在一些实施方式中,本公开提供了用于在患有lsfc的受试者中治疗乳酸酸中毒的方法,其包括向有需要的受试者施用本公开的融合蛋白,以使得在受试者中的乳酸酸中毒被治疗。例如,本公开提供了用于在患有lsfc的受试者中治疗乳酸酸中毒的方法,其包括向受试者施用融合蛋白,所述融合蛋白包含:1)与作为目标蛋白的全长hfxn(seq id no:1)具有至少85%、至少90%、至少95%或至少99%序列同一性的氨基酸序列;2)如本文所述的任何cpp;和3)如本文所述的任何tes。
[0374]
在一些实施方式中,用于在患有lsfc的受试者中治疗乳酸酸中毒的方法包括向受试者施用融合蛋白,所述融合蛋白包含:1)与作为目标蛋白的全长hfxn(seq id no:1)具有至少85%、至少90%、至少95%或至少99%序列同一性的氨基酸序列;2)与tat-hiv(seq id no:11)具有至少85%、至少90%、至少95%或至少99%序列同一性的氨基酸序列;和3)如本文所述的任何tes。
[0375]
在一些实施方式中,用于在患有lsfc的受试者中治疗乳酸酸中毒的方法包括向受试者施用融合蛋白,所述融合蛋白包含:1)与作为目标蛋白的全长hfxn(seq id no:1)具有至少85%、至少90%、至少95%或至少99%序列同一性的氨基酸序列;2)与tat-hiv(seq id no:11)具有至少85%、至少90%、至少95%或至少99%序列同一性的氨基酸序列;和3)与泛素(seq id no:18)具有至少85%、至少90%、至少95%或至少99%序列同一性的氨基酸序列。
[0376]
在一些实施方式中,用于在患有lsfc的受试者中治疗乳酸酸中毒的方法包括向受试者施用融合蛋白,所述融合蛋白包含:1)与作为目标蛋白的全长hfxn(seq id no:1)具有至少85%、至少90%、至少95%或至少99%序列同一性的氨基酸序列;2)与tat-hiv(seq id no:11)具有至少85%、至少90%、至少95%或至少99%序列同一性的氨基酸序列;和3)与seq id no:20的钙蛋白酶切割结构域具有至少85%、至少90%、至少95%或至少99%的氨基酸序列。
[0377]
在一些实施方式中,用于在患有lsfc的受试者中治疗乳酸酸中毒的方法包括向受试者施用融合蛋白,所述融合蛋白包含:1)与作为目标蛋白的全长hfxn(seq id no:1)具有
至少85%、至少90%、至少95%或至少99%序列同一性的氨基酸序列;2)与tat-hiv(seq id no:11)具有至少85%、至少90%、至少95%或至少99%序列同一性的氨基酸序列;和3)与seq id no 19、seq id no:21、seq id no:22、seq id no:23、seq id no:24、seq id no:25、seq id no:26、seq id no:27、seq id no:28、seq id no:29、seq id no:30、或seq id no:31、seq id no:32、seq id no:33、seq id no:34和seq id no:35的任一项具有至少85%、至少90%、至少95%或至少99%序列同一性的氨基酸序列。
[0378]
在一些实施方式中,用于在患有lsfc的受试者中治疗乳酸酸中毒的方法包括向受试者施用融合蛋白,所述融合蛋白包含选自以下的氨基酸序列或由其组成:seq id no:56、seq id no:57、seq id no:58、seq id no:59、seq id no:60、seq id no:61和seq id no:83。
[0379]
在一个实施方式中,用于在患有lsfc的受试者中治疗乳酸酸中毒的方法包括向受试者施用融合蛋白,所述融合蛋白包含与seq id no:56具有至少约85%、约90%、约95%或约99%序列同一性的氨基酸序列或由其组成。
[0380]
在一个实施方式中,用于在患有lsfc的受试者中治疗乳酸酸中毒的方法包括向受试者施用融合蛋白,所述融合蛋白包含与seq id no:57具有至少约85%、约90%、约95%或约99%序列同一性的氨基酸序列或由其组成。
[0381]
在一个实施方式中,用于在患有lsfc的受试者中治疗乳酸酸中毒的方法包括向受试者施用融合蛋白,所述融合蛋白包含与seq id no:58具有至少约85%、约90%、约95%或约99%序列同一性的氨基酸序列或由其组成。
[0382]
在一个实施方式中,用于在患有lsfc的受试者中治疗乳酸酸中毒的方法包括向受试者施用融合蛋白,所述融合蛋白包含与seq id no:59具有至少约85%、约90%、约95%或约99%序列同一性的氨基酸序列或由其组成。
[0383]
在一个实施方式中,用于在患有lsfc的受试者中治疗乳酸酸中毒的方法包括向受试者施用融合蛋白,所述融合蛋白包含与seq id no:60具有至少约85%、约90%、约95%或约99%序列同一性的氨基酸序列或由其组成。
[0384]
在一个实施方式中,用于在患有lsfc的受试者中治疗乳酸酸中毒的方法包括向受试者施用融合蛋白,所述融合蛋白包含与seq id no:61具有至少约85%、约90%、约95%或约99%序列同一性的氨基酸序列或由其组成。
[0385]
在一个实施方式中,用于在患有lsfc的受试者中治疗乳酸酸中毒的方法包括向受试者施用融合蛋白,所述融合蛋白包含与seq id no:83具有至少约85%、约90%、约95%或约99%序列同一性的氨基酸序列或由其组成。
[0386]
如本文所用,术语“治疗lsfc”涵盖减轻、改善或降低lsfc的严重程度,例如,减轻、改善或降低受试者中与lsfc相关的至少一种症状或指征。如本文所用,“治疗lsfc”还涵盖延迟lsfc进展,例如,延迟与lsfc相关的至少一种症状或指征的出现,或者防止受试者中至少一个与lsfc相关的症状或指标加重。在一些实施方式中,与lsfc相关的至少一种症状或指征可以选自以下:发育迟缓、共济失调、低张力、脑损伤、昏迷、呼吸模式异常、癫痫、中风样发作和乳酸性酸中毒。
[0387]
治疗帕金森氏病的方法
[0388]
在一个实施方式中,本公开提供了用于治疗帕金森氏病(pd)的方法,其包括向有
需要的受试者施用本公开的融合蛋白。例如,本公开提供了用于治疗帕金森氏病的方法,其包括向有需要的受试者施用本公开的融合蛋白。例如,本公开提供了用于治疗帕金森氏病的方法,其包括向有需要的受试者施用融合蛋白,所述融合蛋白包含:1)与作为目标蛋白的pink1(seq id no:8)具有至少85%、至少90%、至少95%或至少99%序列同一性的氨基酸序列;2)如本文所述的任何cpp;和3)如本文所述的任何tes。
[0389]
在一些实施方式中,用于治疗帕金森氏病的方法包括向有需要的受试者施用融合蛋白,所述融合蛋白包含:1)与作为目标蛋白的pink1(seq id no:8)具有至少85%、至少90%、至少95%或至少99%序列同一性的氨基酸序列;2)与tat-hiv(seq id no:11)具有至少85%、至少90%、至少95%或至少99%序列同一性的氨基酸序列;和3)如本文所述的任何tes,例如,泛素(seq id no:18)或钙蛋白酶切割结构域(seq id no:20)。
[0390]
在一些实施方式中,用于治疗帕金森氏病的方法包括向有需要的受试者施用融合蛋白,所述融合蛋白包含:1)与作为目标蛋白的pink1(seq id no:8)具有至少85%、至少90%、至少95%或至少99%序列同一性的氨基酸序列;2)与tat-hiv(seq id no:11)具有至少85%、至少90%、至少95%或至少99%序列同一性的氨基酸序列;和3)与泛素(seq id no:18)具有至少85%、至少90%、至少95%或至少99%序列同一性的氨基酸序列。
[0391]
在一个实施方式中,本公开提供了用于治疗帕金森氏病的方法,其包括向有需要的受试者施用融合蛋白,所述融合蛋白包含:1)与作为目标蛋白的parkin(seq id no:7)具有至少85%、至少90%、至少95%或至少99%序列同一性的氨基酸序列;2)如本文所述的任何cpp;和3)如本文所述的任何tes。
[0392]
在一些实施方式中,用于治疗帕金森氏病的方法包括向有需要的受试者施用融合蛋白,所述融合蛋白包含:1)与作为目标蛋白的parkin(seq id no:7)具有至少85%、至少90%、至少95%或至少99%序列同一性的氨基酸序列;2)与tat-hiv(seq id no:11)具有至少85%、至少90%、至少95%或至少99%序列同一性的氨基酸序列;和3)如本文所述的任何tes。
[0393]
在一些实施方式中,用于治疗帕金森氏病的方法包括向有需要的受试者施用融合蛋白,所述融合蛋白包含:1)与作为目标蛋白的parkin(seq id no:7)具有至少85%、至少90%、至少95%或至少99%序列同一性的氨基酸序列;2)与tat-hiv(seq id no:11)具有至少85%、至少90%、至少95%或至少99%序列同一性的氨基酸序列;和3)与泛素(seq id no:18)具有至少85%、至少90%、至少95%或至少99%序列同一性的氨基酸序列。
[0394]
在一些实施方式中,用于治疗帕金森氏病的方法包括向有需要的受试者施用融合蛋白,所述融合蛋白包含:1)与作为目标蛋白的parkin(seq id no:7)具有至少85%、至少90%、至少95%或至少99%序列同一性的氨基酸序列;2)与tat-hiv(seq id no:11)具有至少85%、至少90%、至少95%或至少99%序列同一性的氨基酸序列;和3)与seq id no:20的钙蛋白酶切割结构域具有至少85%、至少90%、至少95%或至少99%序列同一性的氨基酸序列。
[0395]
在一些实施方式中,用于治疗帕金森氏病的方法包括向有需要的受试者施用融合蛋白,所述融合蛋白包含:1)与作为目标蛋白的parkin(seq id no:1)具有至少85%、至少90%、至少95%或至少99%序列同一性的氨基酸序列;2)与tat-hiv(seq id no:11)具有至少85%、至少90%、至少95%或至少99%序列同一性的氨基酸序列;和3)与seq id no 19、
seq id no:21、seq id no:22、seq id no:23、seq id no:24、seq id no:25、seq id no:26、seq id no:27、seq id no:28、seq id no:29、seq id no:30、或seq id no:31、seq id no:32、seq id no:33、seq id no:34和seq id no:35的任一项具有至少85%、至少90%、至少95%或至少99%序列同一性的氨基酸序列。
[0396]
在一些实施方式中,用于治疗帕金森氏病的方法包括向有需要的受试者施用融合蛋白,所述融合蛋白包含选自以下的氨基酸序列或由其组成:seq id no:69、seq id no:70和seq id no:71。
[0397]
在一个实施方式中,用于治疗帕金森氏病的方法包括向有需要的受试者施用融合蛋白,所述融合蛋白包含与seq id no:69具有至少约85%、约90%、约95%或约99%序列同一性的氨基酸序列或由其组成。
[0398]
在一个实施方式中,用于治疗帕金森氏病的方法包括向有需要的受试者施用融合蛋白,所述融合蛋白包含与seq id no:70具有至少约85%、约90%、约95%或约99%序列同一性的氨基酸序列或由其组成。
[0399]
在一个实施方式中,用于治疗帕金森氏病的方法包括向有需要的受试者施用融合蛋白,所述融合蛋白包含与seq id no:71具有至少约85%、约90%、约95%或约99%序列同一性的氨基酸序列或由其组成。
[0400]
如本文所用,术语“帕金森氏病”涵盖散发性帕金森氏病和家族性帕金森氏病。家族性帕金森氏病约占帕金森氏病病例的5-10%,约20个基因的突变与帕金森氏病相关。在一些实施方式中,家族型帕金森氏病可能与在选自以下的一个或多个基因中的突变相关:park2(prkn)、pink1(prkn6)、park7、snca和lrrk2。在一个实施方式中,家族型帕金森氏病可能与park2(prkn)中的突变相关。在另一个实施方式中,家族型帕金森氏病可能与pink1(prkn6)中的突变相关。在一个实施方式中,帕金森氏病不是散发性帕金森氏病。
[0401]
在一个实施方式中,本公开提供了用于治疗与park2基因中的突变相关的帕金森氏病的方法,其包括向有需要的受试者施用本公开的融合蛋白,所述融合蛋白包含parkin(seq id no:7),例如,融合蛋白包含与seq id no:69、seq id no:70或seq id no:71的任一项具有至少约85%、约90%、约95%或约99%序列同一性的氨基酸序列。
[0402]
在一个实施方式中,本公开提供了用于治疗与pink1(prkn6)基因中的突变相关的帕金森氏病的方法,其包括向有需要的受试者施用本公开的融合蛋白,所述融合蛋白包含parkin(seq id no:7),例如,融合蛋白包含与seq id no:69、seq id no:70或seq id no:71的任一项具有至少约85%、约90%、约95%或约99%序列同一性的氨基酸序列。
[0403]
在一些实施方式中,帕金森氏病的特征是具有选自以下的至少一种症状:
[0404]
a)通常从四肢开始的震颤或抖动,经常是手或手指。与帕金森氏病相关的震颤可能包括拇指和食指来回摩擦,称为滚动震颤,以及手放松时(休息时)的震颤;
[0405]
b)运动缓慢(运动迟缓);
[0406]
c)肌肉僵硬;
[0407]
d)姿势和平衡受损;
[0408]
e)自动移动丧失;
[0409]
此外,“非运动症状”或“多巴胺无应答”的体征或症状在帕金森氏病受试者中也很常见,可能包括以下任何一种:
[0410]
f)认知障碍;
[0411]
g)情绪障碍,如抑郁和焦虑;
[0412]
h)睡眠问题,包括rem睡眠障碍,即个人做梦;
[0413]
i)站立时低血压;
[0414]
j)便秘;
[0415]
k)语言和吞咽问题;和
[0416]
l)无法解释的疼痛、流口水和嗅觉丧失。
[0417]
如本文所用,术语“治疗帕金森氏病”涵盖减少、减轻或改善如上所述的帕金森氏病的一个或多个体征或症状;减轻帕金森氏病的程度,保持帕金森氏病稳定(即,不恶化),改善或缓解疾病状态。帕金森氏病的治疗可以包括如上所述减轻、缓解或改善pd的主要或非运动症状中的一种或多种,例如,减少、减轻或改善震颤、运动迟缓、肌肉僵硬、减少语言和吞咽问题等。在一个实施方式中,治疗还包括抑制或延缓帕金森氏病的进展。
[0418]
治疗不需要治愈。无需定量确定治疗结局。然而,在某些实施方式中,治疗结局可以通过跟踪帕金森氏病的纵向病程来量化,例如,用统一帕金森氏病分级量表(updrs)或修订后的updrs,称为mds-updrs。updrs是一种最常用于帕金森氏病临床评价的评分系统。其包含42个项目,通过与受试者的访谈和临床观察进行评价。在updrs量表中,共有199分,其中199分代表最严重的残疾,0分代表无残疾。updrs包括以下部分:
[0419]
第i部分:心理状态、行为和情绪的评价;
[0420]
第ii部分:日常生活活动(adl)的自我评价,包括说话、吞咽、书写、穿衣、卫生、摔倒、流口水、睡觉、走路和切食物;
[0421]
第iii部分:临床医师评分监测的运动评价;
[0422]
第iv部分:治疗并发症;
[0423]
第v部分:帕金森氏病严重程度的hoehn和yahr分期;和
[0424]
第vi部分:schwab和英格兰adl量表。
[0425]
通过访谈和临床观察进行评价。一些部分需要为每个末端指定多个等级。修订后的updrs保留了原updrs的四量表结构,对各子量表进行重组。量表标题;(1)非运动性日常生活经历(13项),(2)运动性日常生活经历(13项),(3)运动检查(18项),和(4)运动并发症(6项)。每个子量表都有0-4级,其中0=正常,1=轻微,2=轻度,3=中度,和4=重度。
[0426]
updrs或mds-updrs可用于跟踪人的帕金森氏病的进展或测量治疗的获益,例如,包括施用本公开的融合蛋白的疗法。
[0427]
在一些实施方式中,根据本文所述的方法向受试者施用本公开的融合蛋白导致抑制或减缓受试者的帕金森氏病进展。具体地,在一些实施方式中,向受试者施用本公开的融合蛋白导致在一段时间内受试者的updrs评分基本上没有增加,例如,1周、2周、3周、1个月、2个月、3个月、6个月、9个月、1年、2年、3年或5年时间。在一些实施方式中,向受试者施用本公开的融合蛋白导致在一段时间内受试者的updrs评分降低,例如,1周、2周、3周、1个月、2个月、3个月、6个月、9个月、1年、2年、3年或5年时间。
[0428]
治疗巴斯综合征和家族性孤立性扩张型心肌病的方法
[0429]
在一个实施方式中,本公开提供了用于治疗巴斯综合征和家族性孤立性扩张型心肌病的方法,其包括向有需要的受试者施用本公开的融合蛋白。例如,本公开提供了用于治
疗巴斯综合征和家族性孤立性扩张型心肌病的方法,其包括向有需要的受试者施用融合蛋白,所述融合蛋白包含:1)与作为目标蛋白的tafazzin(seq id no:3)具有至少85%、至少90%、至少95%或至少99%序列同一性的氨基酸序列;2)如本文所述的任何cpp;和3)如本文所述的任何tes。
[0430]
在一些实施方式中,用于治疗巴斯综合征和家族性孤立性扩张型心肌病的方法包括向有需要的受试者施用融合蛋白,所述融合蛋白包含:1)与作为目标蛋白的tafazzin(seq id no:3)具有至少85%、至少90%、至少95%或至少99%序列同一性的氨基酸序列;2)与tat-hiv(seq id no:11)具有至少85%、至少90%、至少95%或至少99%序列同一性的氨基酸序列;和3)如本文所述的任何tes,例如,泛素(seq id no:18)或钙蛋白酶切割结构域(seq id no:20)。
[0431]
治疗丙酮酸脱氢酶e1β缺乏症的方法
[0432]
在一个实施方式中,本公开提供了用于治疗丙酮酸脱氢酶e1β缺乏症的方法,其包括向有需要的受试者施用本公开的融合蛋白。例如,本公开提供了用于治疗丙酮酸脱氢酶e1β缺乏症的方法,其包括向有需要的受试者施用融合蛋白,所述融合蛋白包含:1)与作为目标蛋白的pdhb(seq id no:4)具有至少85%、至少90%、至少95%或至少99%序列同一性的氨基酸序列;2)如本文所述的任何cpp;和3)如本文所述的任何tes。
[0433]
在一些实施方式中,用于治疗丙酮酸脱氢酶e1β缺乏症的方法包括向有需要的受试者施用融合蛋白,所述融合蛋白包含1)与作为目标蛋白的pdhb(seq id no:4)具有至少85%、至少90%、至少95%或至少99%序列同一性的氨基酸序列;2)与tat-hiv(seq id no:11)具有至少85%、至少90%、至少95%或至少99%序列同一性的氨基酸序列;和3)如本文所述的任何tes,例如,泛素(seq id no:18)或钙蛋白酶切割结构域(seq id no:20)。
[0434]
治疗莱氏综合征法裔加拿大型的方法
[0435]
在一个实施方式中,本公开提供了用于治疗莱氏综合征法裔加拿大型的方法,其包括向有需要的受试者施用本公开的融合蛋白。例如,本公开提供了用于治疗莱氏综合征法裔加拿大型的方法,其包括向有需要的受试者施用融合蛋白,所述融合蛋白包含:1)与作为目标蛋白的lrpprc(seq id no:5)或slirp(seq id no:6)具有至少85%、至少90%、至少95%或至少99%序列同一性的氨基酸序列;2)如本文所述的任何cpp;和3)如本文所述的任何tes。
[0436]
在一些实施方式中,用于治疗莱氏综合征法裔加拿大型的方法包括向有需要的受试者施用融合蛋白,所述融合蛋白包含:1)与作为目标蛋白的lrpprc(seq id no:5)或slirp(seq id no:6)具有至少85%、至少90%、至少95%或至少99%序列同一性的氨基酸序列;2)与tat-hiv(seq id no:11)具有至少85%、至少90%、至少95%或至少99%序列同一性的氨基酸序列;和3)如本文所述的任何tes,例如,泛素(seq id no:18)或钙蛋白酶切割结构域(seq id no:20)。
[0437]
治疗pla2g6相关神经变性(plan)的方法
[0438]
在一个实施方式中,本公开提供了用于治疗pla2g6相关神经变性(plan)的方法。在一些实施方式中,术语“pla2g6相关神经变性(plan)”可以包括一种或多种以下病症:婴儿神经轴索营养不良(inad)、非典型神经轴索性营养不良(anad)、帕金森综合征(包含成人发病的肌张力障碍性帕金森病(dp)和常染色体隐性早发性帕金森病(arep))。
[0439]
在一些实施方式中,用于治疗plan的方法包括向有需要的受试者施用融合蛋白,所述融合蛋白包含:1)与作为目标蛋白的如在表2中所述的磷脂酶a2,vi组(seq id no:72-80)的变体1-9的任何一个具有至少85%、至少90%、至少95%或至少99%序列同一性的氨基酸序列;2)如本文所述的任何cpp;和3)如本文所述的任何tes。
[0440]
在一些实施方式中,用于治疗plan的方法包括向有需要的受试者施用融合蛋白,所述融合蛋白包含:1)与作为目标蛋白的如在表2中所述的磷脂酶a2,vi组(seq id no:72-80)的变体1-9的任何一个具有至少85%、至少90%、至少95%或至少99%序列同一性的氨基酸序列;2)与tat-hiv(seq id no:11)具有至少85%、至少90%、至少95%或至少99%序列同一性的氨基酸序列;和3)如本文所述的任何tes,例如,泛素(seq id no:18)或钙蛋白酶切割结构域(seq id no:20)。除非上下文特别说明或显而易见,如本文所用,将术语“约”理解为在本领域的正常公差范围内,例如,在平均值的2个标准偏差内。大约可以理解为在规定值的10%、9%、8%、7%、6%、5%、4%、3%、2%、1%、0.5%、0.1%、0.05%或0.01%范围内。除非上下文另有明确规定,否则此处提供的所有数值都可以用术语“约”修饰
[0441]
如本文所用,术语“施用(administer)”、“施用(administering)”或“施用(administration)”包括本公开融合蛋白、药物组合物或治疗性化合物的任何递送方法。在某些实施方式中,本公开的融合到那边、药物组合物或治疗性化合物可以通过胃肠外途径施用,例如,静脉内、肌内或皮下。在一个具体实施方式中,本公开的融合蛋白、药物组合物或治疗性化合物可以皮下施用。融合到那边、药物组合物或治疗性化合物的施用可由多人协同工作进行。施用药剂包括,例如,给受试者开处方施用和/或直接或通过另一受试者提供施用特定药物的指示,可以通过自身递送,例如,口服递送、皮下递送、通过中央置管静脉内递送等;或由训练有素的专业人员进行递送,如静脉内递送、肌内递送等。
[0442]
实施例
[0443]
实施例1:比较hfxn和tat-gg-hfxn融合蛋白的亚细胞定位免疫荧光染色法确定tat-gg-hfxn融合蛋白治疗大鼠l6成肌细胞后hfxn的亚细胞定位
[0444]
人frataxin蛋白(hfxn
1-210
)是在细胞核中编码的,并且合成为210个氨基酸的前体蛋白,其具有如seq id no.1中所示的氨基酸序列(表1)。其表达后,全长hfxn
1-210
通过其n末端80aa线粒体靶向序列(mts)定向至线粒体,在那里其被主动导入并进行蛋白水解处理,以产生蛋白130aa成熟形式或活性片段(hfxn
81-210
),预测分子量为14.2kda,序列如seq id no.2(表1)所示。fxn成熟形式最终存在于线粒体基质中。
[0445]
seq id no.1:
[0446]
mwtlgrrava gllaspspaq aqtltrvprp aelaplcgrr glrtdidatc tprrassnqr glnqiwnvkk qsvylmnlrk sgtlghpgsl dettyerlae etldslaeff edladkpytf edydvsfgsg vltvklggdl gtyvinkqtp nkqiwlssps sgpkrydwtg knwvyshdgv slhellaael tkalktkldl sslaysgkda
[0447]
seq id no.2:
[0448]
sgtlghpgsl dettyerlae etldslaeff edladkpytf edydvsfgsg vltvklggdl gtyvinkqtp nkqiwlssps sgpkrydwtg knwvyshdgv slhellaael tkalktkldl sslaysgkda
[0449]
开发了一种tat-gg-hfxn融合到那边,其用于治疗弗里德赖希氏共济失调(fdra)的蛋白替代疗法。tat-gg-hfxn融合蛋白已被证明可以挽救细胞和动物中与frda相关的疾
病表型。据信tat-gg-hfxn融合蛋白在细胞内定位于线粒体。
[0450]
通过免疫荧光显微镜评价tat-gg-hfxn融合蛋白治疗后大鼠l6成肌细胞中hfxn的亚细胞定位(图3)。简言之,在无血清培养基中用tat-gg-hfxn融合蛋白(5μm)处理大鼠l6成肌细胞2小时。2小时后,用完全培养基替代含有tat-gg-hfxn融合蛋白的无血清培养基,并且孵育细胞。如图3中所示,在小的点状细胞内囊泡以及细胞核内强烈地检测到hfxn(图3,见图“hfxn”和“重叠”)。观察到的含有hfxn的细胞内囊泡与线粒体膜标记tomm20没有明显重叠(图3中所示,图“重叠”)。这些囊泡可能代表tat gg hfxn融合蛋白被细胞摄取后通过内体/溶酶体系统的转运,但需要进一步研究来证明这一假设。总之,这些数据表明,在细胞中可以检测到hfxn,并且在用tat gg hfxn融合蛋白治疗后,在细胞核中可以强烈检测到hvxn。尽管在所述条件下用tat-gg-hfxn融合蛋白治疗后线粒体中可能存在低水平的hfxn,但免疫荧光染色法在大鼠l6成肌细胞中几乎检测不到线粒体hfxn。
[0451]
hfxn或tat-gg-hfxn融合蛋白转染大鼠l6成肌细胞后hfxn-亚细胞定位的比较
[0452]
在上述条件下,经tat-gg-hfxn融合蛋白处理后,主要在大鼠l6成肌细胞的细胞核中检测到(图3)。附加在全长hfxn上的n末端tat-gg序列可能在治疗性蛋白内化进入细胞后将其导入细胞核。为了更仔细地评估tat-gg对hfxn的影响,通过免疫荧光显微镜检测并比较大鼠l6成肌细胞中胞内表达的tat-gg-hfxn融合蛋白与hfxn的亚细胞定位。使用转染的本领域技术人员公知的脂质转染试剂,将含有编码tat gg hfxn融合蛋白或hfxn1-210基因结构的表达质粒转染大鼠l6成肌细胞,比如例如l6 cell avalanche
tm
系统(来自ez biosystems)。24小时后,使用4%多聚甲醛固定转染细胞,并用抗hfxn抗体或线粒体膜标记物tomm20以及hoechst 33342核染色进行染色。正如所预期的那样,转染hfxn1-210构建体的大鼠l6成肌细胞线粒体hfxn阳性,与线粒体膜标记tomm20的明确共定位证明了这一点(图4,上图,“重叠”)。而相反的是,转染tat-gg-hfxn融合蛋白的大鼠l6成肌细胞在正规细胞胞质和细胞核内hfxn染色呈阳性(图4,下图,“重叠”)。在极低比例转染tat gg hfxn融合蛋白的细胞中,线粒体中也检测到hfxn(图4,下图,“重叠”中非常罕见共定位染色)。总之,这些数据表明tat-gg-hfxn融合蛋白的亚细胞定位不同于hfxn的天然亚细胞定位,从主要在线粒体(hfxn)转移到胞质和强烈地在细胞核中(tat-gg-hfxn融合蛋白)。
[0453]
实施例2:用于增强hfxn递送至线粒体的新型tat-gg-hfxn构建体的设计
[0454]
实施例1,图3和图4所示的荧光共定位结果表明,细胞中绝大多数tat-gg-hfxn融合蛋白分子没有特异性定位于线粒体,这可能是由于在分子的氨基末端存在附加的tat-gg序列。为了克服这一障碍,设计了几种新型frataxin融合蛋白,并对其线粒体递送率进行了测试。作用于线粒体的治疗性融合蛋白的线粒体递送率的提高也将为线粒体疾病(比如,例如,frda)提供更好的治疗。为了实现这一目的,设计了新的融合蛋白,图5,图a-c显示了该蛋白的示意图。
[0455]
将一组蛋白设计成包含蛋白酶可切割结构域,并生成了编码“蛋白酶可激活”细胞渗透性hfxn融合蛋白的构建体库。这些结构体包含编码细胞穿透肽(cpp)的序列,如hiv-tat(ygrkkrrqrrr;seq id no.11)肽,融合至可被内源性胞内蛋白酶切割的氨基酸序列,随后立即是目标蛋白,在本例中是全长前体hfxn。将双肽gg用作cpp和蛋白水解切割结构域之间的接头。tat-gg从胞浆中融合蛋白的裂解将产生一种无tat的hfxn蛋白,该蛋白可以通过内源性mts导入线粒体。举例而言,所使用的可切割胞内蛋白酶敏感性蛋白是sumo-1(由
sumo蛋白酶切割)和泛素(由泛素酶切割),以及蛋白水解敏感性肽是devd(半胱天冬酶切割位点,seq id no:19)、eplfaerk(seq id no:20)和llvy(钙蛋白酶切割位点,seq id no:21)。
[0456]
将另一组蛋白设计为包含核输出信号(nes),这样可以避免目标蛋白在细胞核中累积。因此,将构建体设计为包含cpp,连接到目标蛋白,连接到nes。举例而言,将tat-gg-hfxn融合构建体的羧基末端直接融合到核输出信号(nes),如来源于pkiα(nes1)和mapkk(nes2)的nes结构域。
[0457]
图5,图a-c中提供了融合蛋白的示意图,表11中提供了融合蛋白构建体的总结。
[0458]
表11:新型tat-fnx融合蛋白
[0459][0460]
实施例3:hfxn融合蛋白的胞内表达——线粒体转运的初步筛选
[0461]
将编码各种hfxn变体hfxn、tat-gg-hfxn(tat-hfxn融合蛋白)、tat-gg-sumo1-hfxn、tat-gg-泛素-hfxn、tat-gg-devd-hfxn、tat-gg-eplfaerk-hfxn、tat-gg-llvy-hfxn、tat-gg-hfxn-nes1和tat-gg-hfxn-nes2的基因构建体克隆进入表达载体。举例而言,使用质粒载体pcdna3.1(+)(piscataway,nj)。所有蛋白编码序列都是针对哺乳动物(人)表达而优化的密码子。变体的氨基酸序列及其各自的编码核酸序列见本发明其他地方的表9和表10。
[0462]
使用转染的本领域技术人员公知的基于脂质的转染试剂(例如,使用l6 cell avalanche
tm
系统(来自ez biosystems))将表达质粒转染大鼠l6成肌细胞。如实施例1中所述,通过免疫荧光显微镜检测hfxn亚细胞定位。将转染细胞培养24小时,然后用4%多聚甲醛固定细胞,并用抗hfxn抗体和线粒体膜标记物tomm20染色。此外,使用hoechst 33342核染料对细胞核染色。
[0463]
免疫标记结果见图6,图a-i,并总结在表2中。
[0464]
表12:hfxn和fxn融合蛋白变体的定位
[0465]
构建体胞内定位hfxn线粒体tat-gg-hfxn融合蛋白细胞核(大部分)tat-gg-sumo1-hfxn线粒体
tat-gg-泛素-hfxn线粒体tat-gg-devd-hfxn胞质和细胞核tat-gg-eplfaerk-hfxn线粒体、胞质和细胞核tat-gg-llvy-hfxn线粒体、胞质和细胞核tat-gg-hfxn-nes1线粒体、胞质和细胞核tat-gg-hfxn-nes2线粒体、胞质和细胞核
[0466]
如实施例1中所证实的,当hfxn在大鼠l6成肌细胞中表达时,其定位于线粒体,而tat-gg-hfxn融合蛋白主要在胞浆和细胞核中检测到。在使用tat-gg-sumo1-hfxn和tat-gg-泛素-hfxn转染的细胞中,在线粒体中检测到hfxn。在使用tat-gg-devd-hfxn转染的细胞中,在胞质和细胞核中检测到hfxn,并且未观察到显著的线粒体定位。在使用tat-gg-eplfaerk-hfxn和tat-gg-llvy-hfxn转染的细胞中,在线粒体中以及在胞质和细胞核内检测到hfxn。总之,这些数据表明,胞内sumo蛋白酶、脱泛素酶以及胞内钙蛋白酶能够在各自的切割位点切割融合蛋白,并产生定位于线粒体的hfxn变体。与tat-gg-hfxn融合蛋白类似,线粒体中未检测到tat-gg-devd-hfxn,表明在当前条件下,半胱天冬酶介导的devd(seq id no:19)切割效率低下。
[0467]
在转染tat-gg-hfxn-nes1和tat-gg-hfxn-nes2的细胞中,在线粒体以及胞浆和细胞核内检测到hfxn。总之,这些数据表明,hfxn融合蛋白的核输出导致hfxn线粒体输入的改善。
[0468]
实施例4:通过western印记分析评估hfxn成熟情况
[0469]
在其天然状态下,全长hfxn
1-210
通过其n末端线粒体靶向序列(mts)定向至线粒体,其在线粒体中输入并分两步进行蛋白水解加工,以产生成熟形式的蛋白hfxn
81-210
片段。为了通过新型hfxn变体的蛋白水解加工评价hfxn的成熟程度,对在转染了各表达质粒的大鼠l6成肌细胞中产生的hfxn变体进行western印记分析,所述表达质粒包含编码hfxn、tat-gg-hfxn融合蛋白、tat-gg-sumo1-hfxn、tat-gg-泛素-hfxn、tat-gg-eplfaerk-hfxn、tat-gg-llvy-hfxn、tat-gg-hfxn-nes1和tat-gg-hfxn-nes2的基因。转染后72小时收获细胞,在添加蛋白酶抑制剂和edta的冰冻放射免疫沉淀分析(ripa)缓冲液中进行裂解。细胞裂解物通过sds-page(十二烷基硫酸钠-聚丙烯酰胺凝胶电泳)分离,转移到硝酸纤维素膜上,并使用市售针对hfxn的抗体(购自abcam),以及针对β-肌动蛋白的抗体作为上样对照进行western印记分析。
[0470]
结果如图7中所示。从转染hfxn构建体的细胞获得的裂解物中检测到完全成熟的hfxn(第1道,条带低于15kda标记物,~14.2kda)。还在从转染编码tat-gg-hfxn融合蛋白(第2道)和tat-gg-sumo1-hfxn(第3道)的质粒的细胞获得的裂解物中检测到对应于成熟hfxn(~14.2kda)的条带。从转染tat-gg-泛素-hfxn(第4道)、tat-gg-eplfaerk-hfxn(第5道)和tat-gg-hfxn-nes1(第7道,其中hfxn-nes1通过sds-page迁移较慢,因为附加的nes1增加了~1kda的分子量)的细胞获得的裂解物中检测到较高数量的成熟hfxn。在tat-gg-llvy-hfxn(第6道),和tat-gg-hfxn-nes2(第8道)中也检测到与成熟hfxn对应的条带。这些结果表明,新构建体tat-gg-泛素-hfxn、tat-gg-eplfaerk-hfxn和tat-gg-hfxn-nes1在细胞内进行蛋白水解加工,产生的成熟hfxn数量高于tat-gg-hfxn融合蛋白。
[0471]
实施例5:使用hfxn融合蛋白转导雪旺细胞
[0472]
本实验的目的是确定和比较不同hfxn融合蛋白转导细胞的能力。
[0473]
本实验利用了实施例1中描述的tat-gg-hfxn融合蛋白和新tat-fxn融合蛋白:tat-gg-泛素-hfxn(seq id no:56)和tat-gg-eplfaerk-hfxn(seq id no:58)。在tat-gg-eplfaerk-hfxn(seq id no:58),eplfaerk(seq id no:20)是钙蛋白酶1敏感性序列。在实验中使用的融合蛋白的示意性结构如图8中所示。
[0474]
实验使用了雪旺细胞,因为这些细胞生长相对较快,并且易于转导。此外,这些细胞中hfxn的内源性水平低于检测限,因此,预计不会干扰tat-gg-hfxn融合蛋白产生的信号。
[0475]
将雪旺细胞以每孔8,000个细胞的接种密度接种在96孔板(corning 3904)中,并在37℃下培养过夜。在第1天,在含有dmem,1%热灭活fbs和20mm甘油的转导介质中制备含有1.25μm、1μm和0.5μm每个tat-gg-hfxn融合蛋白的溶液。每孔使用150μl pbs洗涤细胞,然后每孔加入60μl tat-gg-hfxn溶液或仅用于阴性对照的转导介质。将细胞在37℃下孵育2小时,然后每孔加入60μl含有dmem,10%fbs和1%抗生素:抗真菌剂(gemini生物制品400-101)的完全培养基,并在37℃下培养过夜。
[0476]
在第2天重复进行相同处理。在第3天,用150μl pbs洗涤每个孔中的细胞,然后向每孔中添加50μl tryple(gibco
tm 12604021),并在37℃下孵育5分钟。在此之后,通过向每个孔中添加50μl完全培养基来终止胰酶化反应。将细胞重悬并转移到每孔含有40μl完全dmem的纤连蛋白包被的玻璃底培养板(corning 4584)中。让细胞在37℃下过夜。
[0477]
在第4天,用pbs洗涤细胞,然后将50μl新制备的4%多聚甲醛溶液添加到每个孔中,并在室温下孵育细胞10分钟。随后,每孔用150μl pbs洗涤细胞两次,然后每孔加入50μl封闭缓冲液(0.3%triton-x 100,pbs中的5%正常山羊血清)。将细胞在室温下孵育1小时,然后去除封闭缓冲液,并向每个孔中添加50μl在封闭缓冲液中稀释的一抗(来自abcam的抗frataxin抗体ab110328和来自abcam的抗tomm20抗体ab78547)。抗frataxin抗体以1:600稀释,而tomm20抗体以1:300稀释。将细胞在4℃下孵育过夜。
[0478]
在第5天,用每孔120μl pbs洗涤细胞两次,并向每个孔中添加50μl在封闭缓冲液中稀释的二抗(来自abcam的抗小鼠igg alexafluor594,ab150116和来自abcam的抗家兔igg alexafluor488,ab150077)。每种抗体1:1000稀释。将细胞在室温下孵育1小时,每孔使用150μl pbs洗涤,并且每孔添加50μl 300nm hoescht 33342染色并在室温下孵育3分钟。随后,使用pbs洗涤细胞。
[0479]
使用lionheart显微镜对细胞成像。用与小鼠抗hfxn单克隆一抗结合的alexa-594标记的山羊抗小鼠igg二抗检测人fxn。用与抗tomm20多克隆一抗结合的alexa-488-标记的山羊抗家兔igg二抗检测线粒体膜。
[0480]
实验结果如图9所示。具体地,图9,图a是使用0.25μm、0.5μm和1μm tat-gg-hfxn、tat-gg-eplfaerk-hfxn、tat-gg-泛素-hfxn和作为阴性对照的载剂处理的雪旺细胞的一组照片。在照片中,绿色对应于作为线粒体标记物的tomm20信号,红色对应于hfxn信号和蓝色对应于作为细胞核标记物的hoechst 33342染料信号。在成像条件下,在雪旺细胞中无法检测到内源性frataxin水平。如图9,图a所示,用载剂转导的细胞仅显示细胞核和线粒体染色,而不显示hfxn染色。使用tat-gg-hfxn转导的细胞显示一些hfxn染色。而相反的是,用tat-gg-eplfaerk-hfxn和tat-gg-泛素-hfxn转导的细胞在相应浓度下表现出较高的hfxn
tat-gg-hfxn处理的细胞中观察到hfxn的线粒体定位较少。
[0491]
测定每个样本的平均抗fxn染色信号和平均抗线粒体染色信号,并计算平均抗fxn染色信号与平均抗线粒体染色信号(tomm20)的比值。图10,图b显示了平均抗fxn染色信号与平均抗线粒体染色信号的比值,该比值是雪旺细胞中hfxn融合蛋白浓度的函数。图10,图c显示了平均抗fxn染色信号与平均抗线粒体染色信号的比值,该比值是h9c2细胞中hfxn融合蛋白浓度的函数。图10,图b和图c中的结果表明,与用tat-gg-hfxn处理的雪旺细胞和h9c2细胞相比,用gg-eplfaerk-hfxn and tat-gg-泛素-hfxn处理的雪旺细胞和h9c2细胞中定位于线粒体的hfxn的量更高。此外,用gg-eplfaerk-hfxn和tat-gg-泛素-hfxn处理的细胞中线粒体定位的量是剂量依赖性的。
[0492]
使用雪旺细胞和hfxn融合蛋白进行了另一项细胞转染实验,所述hfxn融合蛋白包括:tat-gg-hfxn、tat-gg-eplfaerk-hfxn、tat-gg-泛素-hfxn和tat-gg-hfxn nes1(seq id no:60和如图8中所示)。实验所用的实验方案与上述相同。图10,图d显示了平均抗fxn染色信号与平均抗线粒体染色信号的比值,该比值是雪旺细胞中hfxn融合蛋白浓度的函数。图10,图d中的结果表明,与使用tat-gg-hfxn处理的雪旺细胞和h9c2细胞相比,在用tat-gg-eplfaerk-hfxn、tat-gg-泛素-hfxn和tat-gg-hfxn-nes1处理的雪旺细胞中定位于线粒体的hfxn的量更高。结果还表明,在融合蛋白浓度为0.5μm时,经tat-gg-hfxn-nes1处理后定位于线粒体的hfxn的量显著高于经tat-gg-eplfaerk-hfxn、tat-gg-泛素-hfxn处理后定位于线粒体的hfxn的量。此外,用新型hfxn融合蛋白处理的细胞中线粒体定位的量是剂量依赖性的。
[0493]
图10,图a-d的结果表明,与用tat-gg-hfxn处理的细胞相比,在用本公开的新型融合蛋白处理的细胞中检测到更高的hfxn的量,即,tat-gg-eplfaerk-hfxn、tat-gg-泛素-hfxn和tat-gg-hfxn-nes1。结果还表明,用本公开的新型hfxn融合蛋白处理的细胞中的hfxn定位于线粒体。
[0494]
实施例7:新型hfxn融合蛋白的胞内加工的确认
[0495]
本实验的目的是确认本公开的新型hfxn融合蛋白通过细胞机制正确加工以产生成熟的fxn蛋白。本实验使用l6大鼠成肌细胞以及实施例5中使用的和图8中所示的相同hfxn融合蛋白,即,tat-gg-hfxn、tat-gg-eplfaerk-hfxn和tat-gg-泛素-hfxn。本实验还使用了如下所示的另外两个hfxn融合蛋白:tat-gg-hfxn-nes1(seq id no:60)和tat-gg-sumo-hfxn(seq id no:81)。tat-gg-sumo-hfxn(seq id no:81)的氨基酸序列如下所示:
[0496]
mygrkkrrqrrrggsdsevnqeakpevkpevkpethinlkvsdgsseiffkikkttplrrlmeafakrqgkemdslrflydgiriqadqtpedldmedndiieahreqiggmwtlgrravagllaspspaqaqtltrvprpaelaplcgrrglrtdidatctprrassnqrglnqiwnvkkqsvylmnlrksgtlghpgsldettyerlaeetldslaeffedladkpytfedydvsfgsgvltvklggdlgtyvinkqtpnkqiwlsspssgpkrydwtgknwvyshdgvslhellaaeltkalktkldlsslaysgkda。
[0497]
在实验中,用编码hfxn融合蛋白的dna载体转染l6细胞,并将细胞孵育24小时。收集并处理细胞以分离总蛋白,然后在sds-page凝胶上分离。sds-page分离后,用western印记分析凝胶中的frataxin,使用抗fxn抗体和抗β肌动蛋白抗体作为对照。
[0498]
图11是从转染了各种hfxn融合蛋白并使用抗fxn抗体分析的细胞中分离的总蛋白样品的western印记照片。第1道包含用编码hfxn对照但没有tat融合的构建体转染的细胞
样品。在该实施例中,约15kda的条带对应于成熟的、经过加工的hfxn,其在mts序列被内源性线粒体α-和β-mpp蛋白酶双重切割后产生。
[0499]
第2道对应于使用编码tat-gg-hfxn融合蛋白的构建体转染的细胞样品。在该实施例中,少量hfxn以加工成熟的frataxin的形式存在,然而,大多数hfxn以约25kda的全长未加工融合蛋白的形式存在。
[0500]
第3道、第4道和第5道分别对应于编码tat-sumo-hfxn、tat-gg-泛素-hfxn和tat-gg-eplfaerk-hfxn的构建体转染的细胞样品。在相同实验条件下,这些样品中成熟hfxn的量高于第1道和第2道的样品。第3-5道中还存在对应于不完全hfxn加工和各种sumo切割(第3道)的中间切割产物。
[0501]
第6道包含使用编码tat-gg-hfxn-nes的构建体转染的细胞样品。该样品还包含与第1道和第2道的样品相比更高的量的成熟hfxn。在第6道中还存在对应于不完全hfxn加工的中间切割产物。值得注意的是,成熟hfxn和中间切割产物的分子量高于其他样品中成熟hfxn和中间切割产物的分子量,因为nes不通过加工切割,在mts切割后其仍是融合蛋白的一部分。
[0502]
图11中的结果表明,本公开的新型hfxn融合蛋白(即,tat-sumo-hfxn、tat-gg-泛素-hfxn,tat-gg-eplfaerk-hfxn和tat-gg-hfxn-nes)在细胞中加工以产生成熟hfxn。结果还表明,加工新型hfxn融合蛋白以产生成熟hfxn比加工tat-gg-hfxn融合蛋白更有效。与tat-gg-hfxn融合蛋白相比,新的hfxn融合蛋白的加工效率更高,这至少可以部分解释为,与tat-gg-hfxn融合蛋白相比,新的hfxn融合蛋白定位于细胞核的数量更低,如图4和图6中所示。
[0503]
实施例8:hfxn融合蛋白的功能表征
[0504]
本实验的目的是表征新型hfxn融合蛋白的功能。申请人此前已发现,lrpprc缺陷的细胞表现出高水平的细胞培养基酸化和向培养基分泌syr61蛋白。申请人此前还发现,lrpprc缺陷细胞的处理导致细胞培养基酸化和分泌的syr61蛋白的量减少(参见,例如,wo 2021/011929,其全部内容通过引用并入本文)。因此,可以将细胞培养基酸化和分泌的syr61蛋白的量作为细胞中fxn活性的指标。
[0505]
本实验使用细胞系hek 293lrpprc kd(克隆21c),此前例如在wo 2021/011929中对其进行了描述。简言之,该细胞系是lrpprc敲低细胞系,其通过将lrpprc shrna转移到hek293细胞而产生,导致lrpprc基因沉默。实验中还使用了转染扰码序列(scr-5)的对照细胞系。本实验还使用了在实施例5中使用的和在图8中所示的相同hfxn融合蛋白,即,tat-gg-hfxn、tat-gg-eplfaerk-hfxn和tat-gg-泛素-hfxn。
[0506]
在实验中,将lrpprc kd细胞和scr-5细胞以每孔50,000个细胞的接种密度接种在24孔板中的完全dmem中(dmem、10%fbs和1%抗生素:抗真菌剂)。在第1天,在37℃下使用载剂、tat-gg-hfxn、tat-gg-eplfaerk-hfxn或tat-gg-泛素-hfxn处理细胞3小时。在融合蛋白浓度为2.5μm、5μm和10μm时,用tat-gg-hfxn融合蛋白处理细胞。在融合蛋白浓度为0.25μm、0.5μm和1μm时,用tat-gg-eplfaerk-hfxn xn和tat-gg-泛素-hfxn处理细胞。在三小时后,向每个孔中添加完全培养基,并在37℃下孵育细胞过夜。
[0507]
在第2天重复相同处理,并在37℃下孵育细胞过夜。在第3天,将细胞在完全培养基中再培养48小时。
[0508]
48小时后,收集培养基。使用人cyr61/ccn1 quantikine elisa试剂盒(r&d systems目录号#dcyr10)通过cyr61 elisa进行cyr61水平分析。根据生产厂商的方案使用乳酸glo试剂盒(#j5021promega corporation)确定培养基中的乳酸水平。
[0509]
图12,图a显示了含有用本公开的hfxn融合蛋白处理的lrpprc kd细胞和scr-5细胞样品的培养板的图片。细胞培养基的酸化通过培养基中酚红的颜色从粉红色(低酸化)变为黄色(高酸化)来反映。图12,图a还显示了图中所示细胞培养板中样品的示意图。
[0510]
图12,图a中的结果表明,lrpprc kd细胞诱导细胞培养基酸化(如培养板第4列第1-3行孔中的黄色培养基所示),并且在用测试的hfxn融合蛋白处理后,培养基酸化程度以剂量依赖性方式降低(如图所示:培养板第3列第1-3行孔中的橙色培养基;第2列第1-3行孔中的粉色培养基;和第1列第1-3行孔中的深粉/红色培养基)。结果还表明,tat-gg-hfxn在浓度为10μm时可以防止培养基酸化,而tat-gg-eplfaerk-hfxn和tat-gg-泛素-hfxn在浓度为1μm的情况下都可以阻止培养基酸化。
[0511]
图12,图b是用最高测试浓度的每种hfxn融合蛋白或载剂处理的lrpprc kd和scr-5对照细胞的一系列照片。在图12,图b中的结果表明,细胞培养基的酸化不是由于细胞死亡所致。
[0512]
图12,图c是显示在使用hfxn处理的lrpprc kd细胞的培养基中cyr61的量的图。图12,图c的结果显示了用hfxn融合蛋白处理后lrpprc kd细胞对cyr61分泌的浓度依赖性抑制。结果还表明,与tat-gg-hfxn相比,tat-gg-eplfaerk-hfxn和tat-gg-泛素-hfxn的浓度显著降低时,可以观察到对cyr61分泌的抑制作用。该作用也反映在与tat-gg-hfxn的ic
50
值相比,tat-gg-eplfaerk-hfxn和tat-gg-泛素-hfxn的cyr61抑制的ic
50
值更低,如图12,图c的表中所示。
[0513]
图12,图d是显示在使用hfxn融合蛋白处理的lrpprc kd细胞的培养基中乳酸的量的图。图12,图d中的结果显示了用hfxn融合蛋白处理后lrpprc kd细胞对乳酸生成的浓度依赖性抑制。结果还表明,与tat-gg-hfxn相比,tat-gg-eplfaerk-hfxn和tat-gg-泛素-hfxn的浓度显著降低时观察到对乳酸产生的抑制作用。该作用也反映在与tat-gg-hfxn的ic
50
值相比,tat-gg-eplfaerk-hfxn和tat-gg-泛素-hfxn的乳酸产生抑制的ic
50
值更低,如图12,图d的表中所示。
[0514]
图12,图a-d中的结果表明,tat-gg-eplfaerk-hfxn和tat-gg-泛素-hfxn与tat-gg-hfxn相比具有更高活性,如通过乳酸产生和cyr61分泌抑制所测量的。结果表明,将tes引入融合蛋白增强了融合蛋白的功能。
[0515]
实施例9:新型parkin融合构建体的设计和合成
[0516]
本实验的目的是合成包含人parkin蛋白的根据本公开的新型融合蛋白(seq id no:7)。
[0517]
parkin融合蛋白的设计与在实施例2中所述的hfxn融合构建体的设计相似。一些parkin融合蛋白包含编码细胞穿透肽(cpp)的序列,如hiv-tat(ygrkkrrqrrr;seq id no.11)肽,其融合至tes,例如,能够被内源性胞内蛋白酶切割的氨基酸序列,以及紧随其后的是作为目标蛋白的parkin。将双肽gg作为cpp和蛋白水解切割结构域之间的接头。在细胞溶质中从融合蛋白切割tat-gg将得到无tat-parkin蛋白。在parkin融合蛋白中使用的蛋白水解切割结构域是泛素(seq id no:18)和eplfaerk(seq id no:45)。
[0518]
将替代parkin融合蛋白设计为包含核输出信号(nes),这样可以避免parkin在细胞核中的累积。将构建体设计为包含cpp,连接作为目标蛋白的parkin,连接nes。
[0519]
在图13中提供了parkin融合蛋白的示意图,在表13中提供了融合蛋白构建体的总结。
[0520]
表13:新型tat-parkin融合蛋白
[0521][0522]
作为对照的his6-sumo-tat-gg-parkin(seq id no:82)的氨基酸序列如下所示:
[0523]
hhhhhhsdsevnqeakpevkpevkpethinlkvsdgsseiffkikkttplrrlmeafakrqgkemdslrflydgiriqadqtpedldmedndiieahreqiggmygrkkrrqrrrggmivfvrfnsshgfpvevdsdtsifqlkevvakrqgvpadqlrvifagkelrndwtvqncdldqqsivhivqrpwrkgqemnatggddprnaaggcerepqsltrvdlsssvlpgdsvglavilhtdsrkdsppagspagrsiynsfyvyckgpcqrvqpgklrvqcstcrqatltltqgpscwddvlipnrmsgecqsphcpgtsaefffkcgahptsdketsvalhliatnsrnitcitctdvrspvlvfqcnsrhvicldcfhlycvtrlndrqfvhdpqlgyslpcvagcpnslikelhhfrilgeeqynryqqygaeecvlqmggvlcprpgcgagllpepdqrkvtceggnglgcgfafcreckeayhegecsavfeasgtttqayrvderaaeqarweaasketikkttkpcprchvpveknggcmhmkcpqpqcrlewcwncgcewnrvcmgdhwfdv。
[0524]
值得注意的是,在对照融合蛋白his6-sumo-tat-gg-parkin中,存在his6-sumo部分只是为了便于纯化。使用his6标签(seq id no:85)纯化后,通过蛋白酶介导的sumo序列的切割,除去his6标签(seq id no:85)。因此,seq id no:82的对照融合蛋白不包含tes序列。
[0525]
实施例10:parkin融合蛋白的转导能力
[0526]
本实验的目的是确定parkin融合蛋白转导细胞并定位于线粒体的能力。
[0527]
实验使用l6大鼠成肌细胞,因为这些细胞内源性parkin水平较低,因此不会干扰tat-gg-hfxn融合蛋白产生的信号。实验还使用了实施例9中描述的parkin融合蛋白。
[0528]
在实验中,将l6细胞以每孔8,000个细胞的接种密度接种在96孔板(corning 3904)中,置于完全dmem培养基(dmem、10%fbs和1%抗生素:抗真菌剂)中,并在37℃下培养过夜。在第1天,在37℃下,用0.0625μm、0.125μm、0.25μm、0.5μm和1μm每种parkin融合蛋白处理细胞2小时。2小时后,每孔添加相同量的完全培养基,并在37℃下孵育过夜。在第2天重复进行相同处理。
[0529]
在第3天,用pbs洗涤细胞,胰酶消化,再重悬在完全细胞培养基中,转移至纤连蛋白包被的玻璃底培养板上,使其在37℃下沉淀过夜。在第4天,用pbs洗涤细胞,并在室温下
用新制备的4%多聚甲醛溶液处理10分钟。10分钟后,用pbs洗涤细胞两次,然后每孔添加50μl封闭缓冲液(含0.3%triton-x 100,5%正常山羊血清的pbs)并在室温下孵育1小时。1小时后,抽吸封闭缓冲液,每孔添加50μl在封闭缓冲液中稀释的一抗(抗parkin抗体,12235-1-ap(1:100)和抗tomm20抗体,emd millipore mabt166(1:500))并在4℃下孵育过夜。
[0530]
在第5天,用pbs洗涤细胞两次,并且每孔添加50μl在封闭缓冲液中稀释的二抗(抗小鼠igg alexafluor594,ab150116abcam(1:1000),抗家兔igg alexafluor488,ab150077abcam(1:1000))。将细胞在室温下孵育1小时,然后用pbs轻轻洗涤,与50μl 300nm hoescht 33342染料混合,并在室温下静置3分钟。随后,用pbs洗涤细胞两次并成像。使用operetta(perkin elmer的high content imager)的harmony软件评估了parkin蛋白与线粒体的共定位比率,并且以定位于线粒体的parkin比率作为蛋白浓度(μm)的函数绘图。具有而言,计算alexafluor488染色量(对应于parkin)与alexaflu 594染色量(对应于线粒体)的比值并绘制在图上,以比较各种parkin融合蛋白的转导效率。
[0531]
实验结果如图14中所示。具有而言,图14是用不同浓度的his6-sumo-tat-gg-parkin、tat-gg-eplfaerk-parkin和tat-gg-泛素-parkin处理的细胞的parkin染色与线粒体染色的比率作为parkin融合蛋白浓度的函数的图。图14中的结果表明,使用parkin融合蛋白的细胞转导以剂量依赖性方式发生,较高的比率表明线粒体定位较高。结果表明,含有tes的parkin融合蛋白(即,tat-gg-eplfaerk-parkin和tat-gg-泛素-parkin)在1μm浓度下比不含tes的对照parkin融合蛋白(his6-sumo-tat-gg-parkin)具有更多的线粒体定位。本实验结果表明,含有tes的parkin融合蛋白转导进入细胞并且正确定位到线粒体的量比对照his6-sumo-tat-parkin融合蛋白更高。实施例11:parkin融合蛋白的活性
[0532]
本实验的目的是测试用新型parkin融合蛋白处理的细胞中parkin的活性。具有而言,本实验的目的是确定在用新型parkin融合蛋白处理细胞后,parkin是否定位于线粒体,以在线粒体解偶联剂羰基氰化物间氯苯腙(cccp)存在下诱导有丝分裂。
[0533]
在实验中,在存在和不存在10μm cccp的情况下,使用0μm、0.5μm和1μm his6-sumo-tat-gg-parkin、tat-gg-eplfaerk-parkin或tat-gg-泛素-parkin处理l6大鼠成肌细胞。然后基本上按照实施例10中所述进行免疫染色和显微镜检查。
[0534]
tat-gg-eplfaerk-parkin的实验结果如图15中所示。具体而言,图15是在存在或不存在10μm cccp的情况下,用0μm或0.5μm tat-gg-eplfaerk-parkin处理的l6大鼠成肌细胞的一组照片。图15中所示的结果表明,在存在或不存在cccp的情况下,对照l6大鼠成肌细胞未显示出任何形态学差异。此外,图15显示,在没有使用parkin融合蛋白处理的情况下,在l6细胞中仍无法检测到内源性parkin。图15中的结果还表明,在用tat-gg-eplfaerk-parkin处理的l6大鼠成肌细胞中,在cccp存在的情况下观察到parkin定位于线粒体。该观察结果与已知的内源性parkin在线粒体吞噬中的作用一致,即在线粒体膜去极化后,parkin线粒体重新定位到线粒体。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1