用于治疗异位性皮肤炎的抗IL-36R抗体的制作方法
用于治疗异位性皮肤炎的抗il-36r抗体
序列表
1.本技术含有序列表,所述序列表已以ascii格式经由efs网提交且以全文引用的方式并入本文中。2021年5月11日创建的该ascii复本命名为09-0702-tw-1-2021-05-17-sl.txt且大小为146,364个字节。
技术领域
2.本发明涉及向患有异位性皮肤炎(atd)的个体施用抗介白素-36受体(抗il-36r)抗体及治疗和/或预防个体的异位性皮肤炎(atd)。更具体地,本发明涉及向患有atd的个体施用佩索利单抗(spesolimab)。
背景技术:
3.异位性皮肤炎(atd)是一种慢性/复发性发炎性皮肤病,其特征为强烈搔痒(例如,严重瘙痒)及鳞状及干性湿疹病变。atd通常与其他异位性病症(例如过敏性鼻炎及哮喘)相关。患有异位性皮肤炎的患者容易发生由细菌及病毒所引起的严重皮肤感染,所述细菌及病毒包括(但不限于)金黄色葡萄球菌(s.aureus)及单纯疱疹病毒。金黄色葡萄球菌引起严重的局部及弥漫性(例如,脓疱)皮肤感染。金黄色葡萄球菌定殖及病变感染显著影响atd疾病活动性及严重程度。
4.典型的治疗包括局部洗剂及保湿剂、抗生素、抗病毒剂及抗真菌剂。然而,大多数治疗选择仅提供暂时、不完全的症状缓解。此外,在许多患有中度至重度atd的患者中,长期使用局部皮质类固醇或钙调神经磷酸酶抑制剂可导致皮肤微生物感染的风险增加。因此,在本领域需要用于治疗和/或预防atd的新颖靶向疗法。
技术实现要素:
5.本发明通过提供结合至il-36r的生物治疗剂,特别是抗体来解决以上需要,所述生物治疗剂作为用于治疗异位性皮肤炎的第一线疗法、第二线疗法、第三线疗法或后续线疗法。
6.在一个方面,本发明涉及一种用于治疗、预防或改善个体的异位性皮肤炎(atd)的方法,其包括向个体施用治疗有效量的抗il-36r抗体或其抗原结合片段(如本文所公开)。在与此方面相关的一个实施方案中,抗il-36r抗体为佩索利单抗。在与此方面相关的另一实施方案中,根据表1及表2中提供的剂量及给药方案中的任一种施用抗il-36r抗体。
7.在一个方面,本发明涉及一种减少患有异位性皮肤炎的个体的皮肤的微生物定殖的方法,其包括向个体施用治疗有效量的抗il-36-r抗体或其抗原结合片段(如本文所公开)。在与此方面相关的一个实施方案中,定殖属于选自由以下组成的组的微生物:金黄色葡萄球菌(staphylococcus aureus)、链球菌属(streptococcus spp.)、铜绿假单胞菌(pseudomonas aeruginosa)、拟杆菌属(bacteroides spp.)、传染性软疣病毒(molluscumcontagiosum virus)、单纯疱疹病毒(herpes simplex virus)、柯萨奇病毒
(coxsackievirus)、牛痘病毒(vaccinia virus)、白色念珠菌(candida albicans)、小孢子菌属(microsporum spp.)、毛癣菌属(trichophyton spp.)、青霉菌属(penicillium spp.)、枝孢菌属(cladosporium spp.)、链格孢菌属(alternaria spp.)及曲霉属(aspergillus spp.)。在与此方面相关的另一实施方案中,微生物为金黄色葡萄球菌(staphylococcus aureus/s.aureus)。在与此方面相关的另一实施方案中,在施用如本文所公开的抗il-36-r抗体或其抗原结合片段之后,金黄色葡萄球菌定殖相对于基线减少至少10%或至少20%。在与此方面相关的一个实施方案中,抗il-36r抗体为佩索利单抗。在与此方面相关的另一实施方案中,根据表1及表2中提供的剂量及给药方案中的任一种施用抗il-36r抗体。
8.在一个方面,本发明涉及一种降低患有异位性皮肤炎的个体对皮肤感染的易感性的方法,其包括向个体施用治疗有效量的抗il-36-r抗体或其抗原结合片段(如本文所公开)。在与此方面相关的一个实施方案中,皮肤感染为由选自由以下组成的组的微生物引起:金黄色葡萄球菌、链球菌属、铜绿假单胞菌、拟杆菌属、单纯疱疹病毒、传染性软疣病毒、柯萨奇病毒、牛痘病毒、白色念珠菌、小孢子菌属、毛癣菌属、青霉菌属、枝孢菌属、链格孢菌属及曲霉属。在与此方面相关的另一实施方案中,微生物为金黄色葡萄球菌。在与此方面相关的一个实施方案中,抗il-36r抗体为佩索利单抗。在与此方面相关的另一实施方案中,根据表1及表2中提供的剂量及给药方案中的任一种施用抗il-36r抗体。
9.在一个方面,本发明涉及一种治疗与患者的atd相关的皮肤病症的方法,所述方法包括向患者施用或已向患者施用治疗有效量的本发明的抗il-36r抗体或其抗原结合片段(如本文所公开)。在与此方面相关的一个实施方案中,抗il-36r抗体为佩索利单抗。在与此方面相关的另一实施方案中,根据表1及表2中提供的剂量及给药方案中的任一种施用抗il-36r抗体。
10.在一个方面,本发明涉及一种治疗与个体的atd相关的皮肤炎症的方法,所述方法包括向个体施用或已向个体施用治疗有效量的本发明的抗il-36r抗体或其抗原结合片段。在与以上方面中的任一个相关的一个实施方案中,第二治疗剂为在抗il-36-r抗体或其抗原结合片段之前、之后或与其同时向个体施用。在一相关实施方案中,第二治疗剂选自由以下组成的组:抗细菌剂、抗病毒剂、抗真菌剂、另一il-36r拮抗剂、ige抑制剂、皮质类固醇、nsaid、il-4r拮抗剂及ifnγ。在与此方面相关的一个实施方案中,抗il-36r抗体为佩索利单抗。在与此方面相关的另一实施方案中,根据表1及表2中提供的剂量及给药方案中的任一种施用抗il-36r抗体。
11.在与以上方面中的任一个相关的一个实施方案中,抗il-36r抗体包括:a)包含seq id no:26的氨基酸序列(l-cdr1);seq id no:35、102、103、104、105、106或140的氨基酸序列(l-cdr2);seq id no:44的氨基酸序列(l-cdr3)的轻链可变区;及b)包含seq id no:53或141的氨基酸序列(h-cdr1);seq id no:62、108、109、110、111或142的氨基酸序列(h-cdr2);seq id no:72的氨基酸序列(h-cdr3)的重链可变区。
12.在与以上方面中的任一个相关的一个实施方案中,抗il-36r抗体包括:a)包含seq id no:26的氨基酸序列(l-cdr1);seq id no:35、102、103、104、105、106或140的氨基酸序列(l-cdr2);seq id no:44的氨基酸序列(l-cdr3)的轻链可变区;及b)包含seq id no:141的氨基酸序列(h-cdr1);seq id no:62、108、109、110、111或142的氨基酸序列(h-cdr2);
seq id no:72的氨基酸序列(h-cdr3)的重链可变区。
13.在与以上方面中的任一个相关的一个实施方案中,抗il-36r抗体包括:i.a)包含seq id no:26的氨基酸序列(l-cdr1);seq id no:102的氨基酸序列(l-cdr2);seq id no:44的氨基酸序列(l-cdr3)的轻链可变区;及b)包含seq id no:53的氨基酸序列(h-cdr1);seq id no:62、108、109、110或111的氨基酸序列(h-cdr2);seq id no:72的氨基酸序列(h-cdr3)的重链可变区;或ii.a)包含seq id no:26的氨基酸序列(l-cdr1);seq id no:103的氨基酸序列(l-cdr2);seq id no:44的氨基酸序列(l-cdr3)的轻链可变区;及b)包含seq id no:53的氨基酸序列(h-cdr1);seq id no:62、108、109、110或111的氨基酸序列(h-cdr2);seq id no:72的氨基酸序列(h-cdr3)的重链可变区;或iii.a)包含seq id no:26的氨基酸序列(l-cdr1);seq id no:104的氨基酸序列(l-cdr2);seq id no:44的氨基酸序列(l-cdr3)的轻链可变区;及b)包含seq id no:53的氨基酸序列(h-cdr1);seq id no:62、108、109、110或111的氨基酸序列(h-cdr2);seq id no:72的氨基酸序列(h-cdr3)的重链可变区;或iv.a)包含seq id no:26的氨基酸序列(l-cdr1);seq id no:105的氨基酸序列(l-cdr2);seq id no:44的氨基酸序列(l-cdr3)的轻链可变区;及b)包含seq id no:53的氨基酸序列(h-cdr1);seq id no:62、108、109、110或111的氨基酸序列(h-cdr2);seq id no:72的氨基酸序列(h-cdr3)的重链可变区;或v.a)包含seq id no:26的氨基酸序列(l-cdr1);seq id no:106的氨基酸序列(l-cdr2);seq id no:44的氨基酸序列(l-cdr3)的轻链可变区;及b)包含seq id no:53的氨基酸序列(h-cdr1);seq id no:62、108、109、110或111的氨基酸序列(h-cdr2);seq id no:72的氨基酸序列(h-cdr3)的重链可变区;或vi.a)包含seq id no:26的氨基酸序列(l-cdr1);seq id no:140的氨基酸序列(l-cdr2);seq id no:44的氨基酸序列(l-cdr3)的轻链可变区;及b)包含seq id no:53的氨基酸序列(h-cdr1);seq id no:62、108、109、110或111的氨基酸序列(h-cdr2);seq id no:72的氨基酸序列(h-cdr3)的重链可变区;或vii.a)包含seq id no:26的氨基酸序列(l-cdr1);seq id no:104的氨基酸序列(l-cdr2);seq id no:44的氨基酸序列(l-cdr3)的轻链可变区;及b)包含seq id no:141的氨基酸序列(h-cdr1);seq id no:62、108、109、110、111或142的氨基酸序列(h-cdr2);seq id no:72的氨基酸序列(h-cdr3)的重链可变区。
14.在与以上方面中的任一个相关的一个实施方案中,抗il-36r抗体包括:(i)包含seq id no:77的氨基酸序列的轻链可变区;及包含seq id no:87的氨基酸序列的重链可变区;或(ii)包含seq id no:77的氨基酸序列的轻链可变区;及包含seq id no:88的氨基酸序列的重链可变区;或(iii)包含seq id no:77的氨基酸序列的轻链可变区;及包含seq id no:89的氨基酸序列的重链可变区;或(iv)包含seq id no:80的氨基酸序列的轻链可变区;及包含seq id no:87的氨基酸序列的重链可变区;或
(v)包含seq id no:80的氨基酸序列的轻链可变区;及包含seq id no:88的氨基酸序列的重链可变区;或(vi)包含seq id no:80的氨基酸序列的轻链可变区;及包含seq id no:89的氨基酸序列的重链可变区;或(vii)包含seq id no:85的氨基酸序列的轻链可变区;及包含seq id no:100的氨基酸序列的重链可变区;或(viii)包含seq id no:85的氨基酸序列的轻链可变区;及包含seq id no:101的氨基酸序列的重链可变区;或(ix)包含seq id no:86的氨基酸序列的轻链可变区;及包含seq id no:100的氨基酸序列的重链可变区;或(x)包含seq id no:86的氨基酸序列的轻链可变区;及包含seq id no:101的氨基酸序列的重链可变区。
15.在与以上方面中的任一个相关的一个实施方案中,抗il-36r抗体包括:i.包含seq id no:115的氨基酸序列的轻链;及包含seq id no:125的氨基酸序列的重链;或ii.包含seq id no:115的氨基酸序列的轻链;及包含seq id no:126的氨基酸序列的重链;或iii.包含seq id no:115的氨基酸序列的轻链;及包含seq id no:127的氨基酸序列的重链;或iv.包含seq id no:118的氨基酸序列的轻链;及包含seq id no:125的氨基酸序列的重链;或v.包含seq id no:118的氨基酸序列的轻链;及包含seq id no:126的氨基酸序列的重链;或vi.包含seq id no:118的氨基酸序列的轻链;及包含seq id no:127的氨基酸序列的重链;或vii.包含seq id no:123的氨基酸序列的轻链;及包含seq id no:138的氨基酸序列的重链;或viii.包含seq id no:123的氨基酸序列的轻链;及包含seq id no:139的氨基酸序列的重链;或ix.包含seq id no:124的氨基酸序列的轻链;及包含seq id no:138的氨基酸序列的重链。
16.在与本文所描述的方面及实施方案中的任一种相关的一个实施方案中,皮下或静脉内或通过两个途径同时或依序且以任何次序施用抗il-36r抗体。在一相关实施方案中,皮下给药包括施用300mg或600mg的抗il-36r抗体。在一相关实施方案中,静脉内给药包括施用300mg、600mg、900mg或1200mg的抗il-36r抗体。在一相关实施方案中,皮下给药包括每周一次(qw)、每2周一次(q2w)、每4周一次(q4w)、每6周一次(q6w)或每8周一次(q8w)施用一个或多个300mg剂量或一个或多个600mg剂量的抗il-36r抗体,或其组合。
17.在与本文所描述的方面及实施方案中的任一种相关的另一实施方案中,皮下或静脉内或通过两个途径同时或依序且以任何次序施用抗il-36r抗体。在一相关实施方案中,
皮下给药包括初始剂量(例如,引入或诱导剂量方案)。在一相关实施方案中,皮下给药进一步包括后续剂量(例如,维持给药方案)。在一相关实施方案中,初始剂量包括:(a)每天施用一个或多个150mg剂量的抗il-36r抗体,持续2周;或(b)每天施用一个或多个300mg剂量的抗il-36r抗体,持续2周;或(c)一个或多个600mg剂量的抗il-36r抗体,4周内施用两次、三次或四次或每周施用两次持续2周、或每周施用两次持续3周、或每周施用两次持续4周;或(d)施用一次一个900mg或1200mg剂量的抗il-36r抗体;或(e)三周内(例如,第0周及第2周)施用两次各两个900mg或1200mg剂量的抗il-36r抗体;后续剂量包括:(a)q2w、q4w、q6w或q8w施用一个或多个300mg剂量的抗il-36r抗体;或(b)q2w、q4w、q6w或q8w施用一个或多个600mg剂量的抗il-36r抗体;且其中第一后续剂量的施用在施用最后一个初始剂量之后2至4周之间或2周或4周。在一实施方案中,若仅施用一个初始剂量,则第一后续剂量的施用在施用初始剂量之后2至4周之间或2周或4周。
18.在与本文所描述的方面及实施方案中的任一种相关的另一实施方案中,以各150mg或300mg(每天施用,持续2周)或各600mg(四周内施用两次、三次或四次或两周、三周或四周内每周施用两次)或900mg或1200mg(施用一次)或各900mg或1200mg(三周内施用两次)的初始sc剂量,随后300mg或600mg(q2w、q4w、q6w或q8w施用)之后续sc剂量皮下施用抗il-36r抗体。在一实施方案中,在最后一个初始剂量之后两至四周或两周或四周施用第一后续剂量。在一实施方案中,若仅施用一个初始剂量,则第一后续剂量的施用在施用初始剂量之后两至四周之间或两周或四周。
19.在一相关实施方案中,抗il-36r抗体给药引起相对于安慰剂或基线的以下结果中的一个或多个:i.在4和/或16周时湿疹面积及严重程度指数(easi)评分改善至少10%;ii.在4和/或16周时达到easi 50的患者的比例改善至少10%;iii.在4和/或16周时达到easi 75的患者的比例改善至少10%;iv.scorad、最大瘙痒强度及dlqi改善至少10%;v.直至第44周具有药物相关不良事件(ae)的患者数量改善至少10%;vi.第4周的湿疹面积及严重程度指数(easi)相对于基线的绝对值及百分比变化改善至少10%;vii.第4周和/或第16周的湿疹面积及严重程度指数(easi)改善50%(easi50)的患者比例改善至少10%;viii.第4周和/或第16周的湿疹面积及严重程度指数(easi)改善75%(easi75)的患者比例改善至少5%;ix.第4周和/或第16周的异位性皮肤炎评分(scorad)改善至少10%;x.第4周和/或第16周时实现研究者总体评定(iga)中至少2级降低至清除(0)或几乎清除(1)的患者比例改善至少5%;xi.第16周的easi评分相对于基线的百分比变化的至少10个百分点差异;xii.第16周的easi50反应率的至少10个百分点差异;xiii.第16周的easi75反应率的至少5个百分点差异;xiv.第16周的scorad、最大瘙痒强度及dlqi相对于基线的百分比变化的至少10个百分点差异;
xv.第44周的湿疹面积及严重程度指数(easi)相对于基线的百分比变化的至少10个百分点差异;或xvi.第16周的iga率的至少5个百分点差异。
20.在与以上方面及其相关实施方案中的任一种相关的另一实施方案中,皮下施用抗il-36r抗体。在一相关实施方案中,皮下给药包括施用一个或多个初始剂量。在一相关实施方案中,皮下给药进一步包括施用一个或多个后续剂量。在一相关实施方案中,初始剂量为根据本文所描述的实施方案各施用的150mg、300mg、600mg、900mg或1200mg。在一相关实施方案中,每日(以连续日)施用150mg或300mg的初始剂量,持续两周。在一相关实施方案中,每周施用各600mg的初始剂量一次,持续两周,包括第0周及第1周;第0周及第2周;第0周及第3周;或第0周及第4周。在一相关实施方案中,每周施用各600mg的初始剂量一次,持续三周,包括第0周、第1周及第2周;第0周、第1周及第3周;第0周、第1周及第4周;第0周、第2周及第3周;第0周、第2周及第4周;或第0周、第3周及第4周。在一相关实施方案中,每周施用各600mg的初始剂量一次,持续四周,包括第0周、第1周、第2周及第3周;第0周、第1周、第2周及第4周;第0周、第1周、第3周及第4周;或第0周、第2周、第3周及第4周。在一相关实施方案中,每周施用各600mg的初始剂量两次,持续2周。在一相关实施方案中,每周施用各600mg的初始剂量两次,持续3周。在一相关实施方案中,每周施用各600mg的初始剂量两次,持续4周。在一相关实施方案中,施用900mg或1200mg的初始剂量一次。在一相关实施方案中,三周内(例如,第0周及第2周)施用各900mg或1200mg的初始剂量两次。在一相关实施方案中,后续剂量包括300mg或600mg的抗il-36r。在一相关实施方案中,后续剂量给药在初始剂量给药结束之后两至四周或两周或四周开始。在一相关实施方案中,每2周一次(q2w)、每4周一次(q4w)、每6周一次(q6w)或每8周一次(q8w)施用各300mg或600mg之后续剂量。在一相关实施方案中,抗il-36r抗体给药引起相较于安慰剂或基线的以下结果中的一个或多个:i.在4和/或16周时湿疹面积及严重程度指数(easi)评分改善至少10%;ii.在4和/或16周时达到easi 50的患者的比例改善至少10%;iii.在4和/或16周时达到easi 75的患者的比例改善至少10%;iv.scorad、最大瘙痒强度及dlqi改善至少10%;v.直至第44周具有药物相关不良事件(ae)的患者数量改善至少10%;vi.第4周的湿疹面积及严重程度指数(easi)相对于基线的绝对值及百分比变化改善至少10%;vii.第4周和/或第16周的湿疹面积及严重程度指数(easi)改善50%(easi50)的患者比例改善至少10%;viii.第4周和/或第16周的湿疹面积及严重程度指数(easi)改善75%(easi75)的患者比例改善至少5%;ix.第4周和/或第16周的异位性皮肤炎评分(scorad)改善至少10%;x.第4周和/或第16周时实现研究者总体评定(iga)中至少2级降低至清除(0)或几乎清除(1)的患者比例改善至少5%;xi.第16周的easi评分相对于基线的百分比变化的至少10个百分点差异;xii.第16周的easi50反应率的至少10个百分点差异;xiii.第16周的easi75反应率的至少5个百分点差异;
xiv.第16周的scorad、最大瘙痒强度及dlqi相对于基线的百分比变化的至少10个百分点差异;xv.第44周的湿疹面积及严重程度指数(easi)相对于基线的百分比变化的至少10个百分点差异;或xvi.第16周的iga率的至少5个百分点差异。
21.在与以上方面中的任一个相关的一个实施方案中,抗il-36r抗体或其抗原结合片段(本文所公开)存在于根据本发明的方面中的任一种用于向个体施用的稳定药物制剂中(如描述于2020年3月5日提交的共同未决pct申请第pct/us2020/021059号中,其全部内容在此以全文引用的方式并入本文中)。
22.在一个实施方案中,根据本文所描述的方面中的任一个的治疗方法包括向个体施用治疗量的稳定药物制剂,苏搜狐稳定药物制剂包含约20mg/ml至约150mg/ml的抗il-36r抗体(本文所公开)、约20mm至约80mm的药学上可接受的缓冲液(例如,乙酸盐缓冲液)、约100mm至约250mm的药学上可接受的张力调节剂(例如,蔗糖)、约0mm至约80mm的药学上可接受的稳定剂(例如,精氨酸)或其药学上可接受的盐、约0至约150mm的药学上可接受的盐(例如,氯化钠)及约0g/l至约1.5g/l的量的药学上可接受的表面活性剂(例如,聚山梨醇酯20),其中治疗、预防或改善个体的异位性皮肤炎(atd),其中降低或抑制患有异位性皮肤炎的个体的皮肤的微生物定殖,其中降低或抑制患有异位性皮肤炎的个体对皮肤感染的易感性,其中治疗或预防个体中与atd相关的皮肤病症,其中治疗个体中与atd相关的皮肤炎症。在一相关实施方案中,稳定药物制剂为水性药物制剂。在一相关实施方案中,水性药物制剂的ph为约5至约7。在一相关实施方案中,药物制剂为用于向个体静脉内给药。在一相关实施方案中,药物制剂为用于向个体皮下给药。在一相关实施方案中,用于静脉内给药的药物制剂包含呈约60mg/ml的量的抗il-36r抗体。在一相关实施方案中,用于皮下给药的药物制剂包含呈约150mg/ml的量的抗il-36r抗体。
23.不言而喻,本文所公开的方法、给药流程和/或给药方案中的任一种也同样适用于此类方法、给药流程和/或给药方案中所公开的il36-r抗体中的任一种的用途:即如本文所公开的抗il36r抗体,其用于治疗、预防和/或改善所公开的疾病和/或病状中的任一种。换言之,本发明还提供如本文所公开的抗il36r抗体的用途,其用于制备用于治疗、预防和/或改善所公开的疾病和/或病状中的任一种的药剂。
24.本发明的额外特征及优势将由以下阐述的随后详细描述的综述而变得显而易见,且部分将由描述显而易见,且可通过实践本发明技术习得。应理解,前述一般描述及以下详细描述均为示例性及解释性的,且旨在提供对如所要求保护的本发明的进一步解释。
附图说明
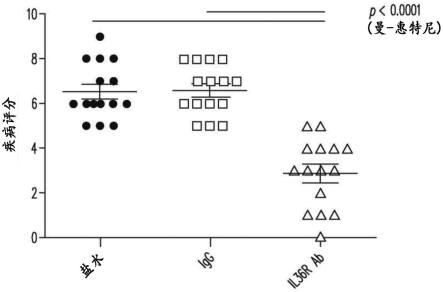
25.所附附图是为了提供对本发明的进一步理解而被包括,且纳入及构成本说明书的一部分,其说明本发明技术的方面且与本说明书一起用以解释本发明的原理。图1显示抑制信号级联的il-36拮抗剂配位体(il-36ra/il1f5、il-38/ilf10)。图2显示针对il-36α,β,γ及il-36r染色的来自异位性皮肤炎及非atd健康对照组(使用ish探针)的福尔马林固定石蜡包埋(ffpe)皮肤活检体。图3显示小鼠抗il-36r阻断mab的全身性给药(腹膜内)使小鼠金黄色葡萄球菌皮
肤炎症模型中的疾病评分降低。图4显示小鼠抗il36r阻断mab的全身性给药(腹膜内)使小鼠金黄色葡萄球菌皮肤炎症模型中的表皮厚度降低。图5显示相对于安慰剂患者,接受600mg(iv)佩索利单抗(每四周一次(q4w),第0周开始及第12周结束)的患者中,直至第16周easi评分相对于基线的变化(%)-mmrm估计(oc-mi)-fas-如实施例7中所论述。mmrm表示混合模型重复测量。mi表示多个归属。oc表示观察到的病例,其意指数据并未设定成遗失或任何其他内容。图6显示在佩索利单抗及安慰剂组中在试验时段期间未服用皮质类固醇(cs)的患者子组中直至第16周easi评分相对于基线的变化(%)(mmrm oc fas w/o cs)。fas表示全分析。fas w/o cs意指在试验期间同时使用cs的患者的数据从分析中排除。图7显示直至试验结束easi评分相对于基线的变化(%)-在再次分配时段之后继续的fas患者中的观察值。顶线患者接受8个剂量的佩索利单抗。底线在第0周、第4周、第8周及第12周仅接受四个剂量。实心(solid/closed)圆表示来自最初随机分组至佩索利单抗且在第0周、第4周、第8周及第12周接受四个剂量的佩索利单抗,但在第16周直至第28周未接受开放标记佩索利单抗治疗的5名患者的资料。空心圆表示来自最初在第0周、第4周、第8周及第12周随机分组至佩索利单抗且在第16周至第28周再次分配以接受四个更多剂量的开放标记佩索利单抗的16名无反应者患者的资料。
具体实施方式
26.在描述本发明之前,应理解,本发明不限于所描述的特定方法及实验条件,因为此类方法及条件可变化。还应理解,本文所使用的术语仅出于描述特定实施方案的目的,且不意图为限制性的,因为本发明的范围将仅由随附权利要求书限制。
27.在以下详细描述中,阐述诸多特定详情以提供对本发明的充分理解。然而,这对于本领域普通技术人员而言是显而易见的,可在无这些特定详情中的一些的情况下实践本发明技术方案。在其他情况下,并未详细显示熟知结构及技术以免混淆本发明。
28.除非另外定义,否则本文所使用的所有技术术语及科学术语具有与本发明所属领域的普通技术人员通常所理解相同的含义。
29.本发明包括通过向个体施用治疗有效量的抗il-36r抗体或其抗原结合片段来降低患有atd的个体对皮肤感染的易感性的方法。
30.在不希望受此理论束缚的情况下,相信抗il-36r抗体或其抗原结合片段结合至人类il-36r,且因此干扰il-36激动剂的结合,且因此,至少部分地阻断il-36r与发炎介体的信号级联。此由图1说明。il-36r也称为il-1rl2及il-1rrp2。已报导,促效性il-36配位体(α、β或γ)通过接合il-36受体发起信号级联,所述il-36受体接着与il-1受体辅助蛋白(il-1racp)形成杂二聚体。
31.本发明的抗il36r抗体公开于本文中,例如公开于美国专利第9,023,995号中,其全部内容以引用的方式并入本文中。定义
32.词组例如“一方面”并非暗示此方面对于本发明必不可少或此方面适用于本发明技术的所有构型。与方面相关的公开内容可适用于所有构型或一个或多个构型。一方面可
提供本发明的一个或多个实例。例如“一方面”的词组可指代一个或多个方面且反之亦然。词组例如“一实施方案”并非暗示此实施方案对于本发明技术必不可少或此实施方案适用于本发明技术的所有构型。与实施方案相关的公开内容可适用于所有实施方案或一个或多个实施方案。一个实施方案可提供本发明的一个或多个实例。
33.如本文所使用,术语“治疗(treat/treating)”或类似表述意指在暂时性或永久性基础上减轻症状,消除症状的因果关系,或预防或减缓指定的病症或病状的症状的出现。
34.术语“约”一般应意指鉴于测量的性质或精确度,所测量的量的可接受误差或偏差程度。通常,示例性误差或偏差程度在给定值或值范围的5%内或3%内或1%内。例如,表述“约100”包括105及95、或103及97、或101及99,以及其间的所有值(例如,对于95至105的范围,95.1、95.2等;或对于97至103的范围,97.1、97.2等;对于99至101的范围,99.1、99.2等)。除非另外陈述,否则本文中给定的数值量为近似值,意指当未明确陈述时可推断术语“约”。
35.如本文所使用,术语“药物制剂”或“制剂”是指其中活性药物或药剂与化学物质组合产生最终药物品或药品的过程以及过程产物,因此最终制剂是指例如液体、粉剂或组合物的药物产品。因此,在一个实施方案中,药物制剂为药物组合物。
36.在本上下文中,“药物组合物”是指液体或粉末制剂,其呈这样的形式以便允许活性成分的生物活性明确有效,且其不含有对组合物将施用的个体有显著毒性的额外组分。此类组合物为无菌的。“粉剂”是指供非经肠使用的冷冻干燥或冻干或喷雾干燥的药物组合物。粉剂通常在水中进行复原或溶解。冻干为一种低温脱水过程,其涉及冷冻产物,降低压力,接着通过升华移除冰。冷冻干燥会产生高质量产物,这是因为加工时使用低温。对于良好研发的冻干制剂,产品的形状及外观随时间推移保持不变且复水产物的质量极佳。喷雾干燥为一种由液体或浆液通过用热气迅速干燥来产生干燥粉末且目标为达成恒定粒度分布的方法。
37.术语“初始剂量”、“后续剂量”是指施用抗il-36r抗体的时间顺序。因此,“初始剂量”包括在治疗期开始时,例如在治疗之前四周内施用的一个或多个剂量;“后续剂量”包括在初始剂量之后施用的一个或多个剂量。通常在初始剂量的最后一个剂量之后约2至4周(例如,2周或4周)施用后续剂量的第一剂量。初始及后续剂量可均含有相同量的抗il-36r抗体或其抗原结合片段,但在所施用的抗体量或施用频率方面一般可彼此不同。然而,在某些实施方案中,初始、后续剂量中所含有的抗il-36r抗体的量在治疗过程期间彼此不同。在某些实施方案中,一个或多个初始剂量各包含第一量的抗体或其抗原结合片段,且一个或多个后续剂量各包含第二量的抗体或其抗原结合片段。在一些实施方案中,第一量或初始剂量的抗体或其片段为后续量/剂量的抗体或其抗原结合片段的1.5
×
、2
×
、2.5
×
、3
×
、3.5
×
、4
×
或5
×
。在某些实施方案中,一个或多个(例如1、2、3、4或5个或更多)初始剂量在治疗方案开始时作为“起始剂量”或“前导剂量”施用,随后可以较低频率施用后续剂量(例如“维持剂量”)。例如,可以各约150mg、约300mg、约600mg、约900mg或约1200mg的一个或多个初始剂量(或起始剂量或前导剂量),随后以各约300mg或600mg的抗il-36r抗体的一个或多个后续剂量(或维持剂量)向患有atd的个体施用抗il-36r抗体。
38.如本文所使用,“缓冲液”是指通过其酸-碱结合物组分的作用来抵抗ph变化的缓冲溶液。“ph”在本文中是指组合物在室温下的酸度或碱度。测量组合物的ph的标准方法为
本领域技术人员所知。通常,测量ph为由以下组成:校准仪器、将电极置放于充分混合的样品中,且接着直接自ph计读取ph。本发明的示例性缓冲液包括乙酸盐、柠檬酸盐、组氨酸、丁二酸盐、磷酸盐及tris。
39.如本文所使用,术语“张力调节剂”或“张力试剂”或“张力剂”是指提供与体内血清的渗透压等效的渗透压的物质,包括盐(例如,氯化钠、氯化钾、氯化镁)或糖(例如,蔗糖、海藻糖、山梨糖醇、硫酸镁(mgso4)、甘油、甘露糖醇或右旋糖)。另外,溶液中所存在的糖充当蛋白质的低温保护剂,其允许原料药在不受损的情况下冷冻。这允许以冷冻形式进行装运且在注入药品之前长期储存原料药。本发明的示例性张力调节剂包括氯化钠、氯化钾、氯化镁(盐)和/或蔗糖、海藻糖、山梨糖醇、硫酸镁(mgso4)、甘油、甘露糖醇或右旋糖(糖)。
40.如本文所使用,术语“稳定剂”或“稳定试剂”是指有助于药物制剂中活性成分的稳定性的物质。本发明的示例性稳定剂包括精氨酸、组氨酸、甘氨酸、半胱氨酸、脯氨酸、甲硫氨酸、赖氨酸或其药学上可接受的盐。
41.如本文所使用,术语“表面活性剂”是指往往会降低溶解其的液体的表面张力的物质。本发明的示例性表面活性剂包括泊洛沙姆188(poloxamer 188)、聚山梨醇酯20、聚山梨醇酯40、聚山梨醇酯60或聚山梨醇酯80。
42.术语“皮下给药”是指通过自药物容器相对缓慢的持续递送将药剂引入动物或人类患者的皮肤下,优选皮肤与皮下组织之间的袋内。捏起或拉起皮肤且远离皮下组织可产生袋。
43.出于治疗的目的,术语“个体”是指归类为哺乳动物的任何动物,包括人类、家畜及农畜,以及动物园、竞技或宠物动物,例如狗、马、猫、母牛及其类似动物。优选地,哺乳动物为人类。
44.如本文所使用,术语“治疗”及“疗法”及类似术语意指包括疾病或病症的治疗性以及预防性或抑制措施,从而产生任何临床上需要或有益的作用,包括(但不限于)减轻或缓解一种或多种症状、消退、减缓或停止疾病或病症的进展。因此,例如,术语治疗包括在疾病或病症的症状发作之前或之后施用药剂,由此预防或移除疾病或病症的一种或多种病征。作为另一实例,术语包括在疾病的临床表达之后施用药剂以对抗疾病的症状。此外,在施用影响疾病或病症的临床参数,例如组织损伤程度或癌转移的量或程度的情况下,无论治疗是否引起疾病得到改善,在发作之后及已产生临床症状之后施用药剂包括如本文所使用的“治疗”或“疗法”。此外,只要与在不存在使用人源化抗il-36r抗体组合物的情况下的症状相比,单独或与另一治疗剂组合的本发明的组合物减轻或改善所治疗的病症的至少一种症状,则结果应视为对潜在病症的有效治疗,而与病症的所有症状是否得到减轻无关。
45.术语“治疗有效量”用以指缓解或改善所治疗病症的症状中的一个或多个的活性剂的量。在另一方面中,治疗有效量是指显示是有效例如减缓疾病进展的目标血清浓度。功效可视待治疗的病状而定以常规方式测量。
46.术语“预防有效量”用以指在所需剂量及时段下,可有效达成所需预防结果的量。通常,在atd症状发作之前在个体中使用预防剂量以便预防或抑制急性症状的发生。在一实施方案中,如本文所涵盖的皮下剂量可为在初始或诱导剂量之后用于患有atd的患者中的预防剂量,以预防患者的atd症状的可能复发。
47.术语“药品说明书”用以指治疗产品的商业封装中通常包括的说明书,其含有关于
适应症、用法、给药、禁忌和/或关于使用此类治疗产品的警告的信息。
48.尽管类似或等效于本文所描述的方法及材料的任何方法及材料可用于本发明的实践中,但现在描述优选的方法及材料。本文所提及的所有出版物均以全文引用的方式并入本文中以描述全文。用于治疗、预防或改善皮肤感染的方法
49.异位性皮肤炎(atd)为一种具有复杂演进发病机制的常见皮肤病。atd通常可在儿童早期开始,持续至成人期或在成人中新近发展。疾病的盛行率持续上升,数据表明在美国四分之一至三分之一的个体将受影响(sullivan及silverberg,2017)。若干因素导致atd的发病机制,包括驱使免疫细胞活化及其迁移至皮肤的环境及遗传因素,及障壁异常。皮肤的微生物群对于维持免疫稳态及防止病原体(例如金黄色葡萄球菌)的生长至关重要。在atd加剧期间,正常微生物群的多样性减少,使得金黄色葡萄球菌增殖,部分通过具有抗金黄色葡萄球菌活性的细菌减少促进。金黄色葡萄球菌详述具有引起炎症且促进进一步免疫失调的潜力的若干分子(geoghean等人,2017)。虽然在atd病理生理学与失调的th2反应之间存在较强联系,但新出现的数据表明不同于直接th2相关机制的额外疾病驱动(例如th17、th22及先天性驱动)可为相关的且可提供治疗性干预的机会(esaki等人,2015)。atd发病机制的这些额外组分的演进已导致质疑疾病的起源及其是否通过外部或内部因素触发(即,由外而内与有内而外的假设)(silverberg及silverberg,2015)。
50.il36r为il1r家族的新颖成员,其与il1r辅助蛋白(il1racp)及与上皮介导的炎症及障壁功能障碍相关的il1rrp2形成杂二聚复合物。具有刺激(il36α、il36β、il36γ)及抑制性配位体(il36ra及il38)的杂二聚il36r系统与il1/ilr家族的其他成员(例如il1、il18及il33)共享多种结构及功能类似性。所有il1家族成员(il1α、il1β、il18、il36α、il36β、il36γ及il38)经由独特的同源受体蛋白进行信号传导,该同源受体蛋白在配位体结合时募集共同il1racp次单元且活化受体阳性细胞类型中的nfκb及map激酶路径(dinarello,2011;towne等人,2004;towne等人,2011)。遗传人类研究已在il36r信号传导与皮肤炎症之间建立较强联系,如通过在il36ra功能缺失突变的患者中发生全身性脓疱型牛皮癣所证实,此导致不受控制的il36r信号传导(marrakchi等人,2011)。
51.il36r在上皮细胞(例如角质细胞、肠上皮细胞)、真皮纤维母细胞及免疫细胞(骨髓细胞、b细胞及t细胞)中表达。出现il36r与异位性皮肤炎发病机制之间的联系。已在来自atd患者的病变组织中证实il36α及il36γ以及il36ra的表达增加(d'erme等人,2015;suarez-farinas等人,2015))。体内,il36r信号传导促进由金黄色葡萄球菌的上表皮攻击诱导的发炎反应(liu等人,2017)。与野生型对照组相比,缺乏il36r受体的小鼠具有显著减少的皮肤炎症及角质细胞增殖,而无金黄色葡萄球菌定殖增强。这些观察结果受限于il36r路径,因为在缺乏其他il1细胞因子家族;il1α-ko、il1β-ko或il33-ko的小鼠中未观察到对金黄色葡萄球菌诱导的炎症的影响。这种减少的il36r依赖性皮肤炎症的细胞机制为经由减少来自浸润t细胞的il17及il22两者。鉴于金黄色葡萄球菌定殖与atd疾病的严重程度之间的较强关系,有力考虑il36r生物学可有助于atd病理生理学且因此阻断il36r活化将对罹患atd的患者有益。
52.因此,本发明包括包含向有需要的个体施用治疗有效量的抗il-36r抗体或其抗原结合片段的方法。如本文所使用,表述“有需要的个体”意指展现异位性皮肤炎的一种或多
种症状(例如,皮肤感染)和/或已诊断患有atd的人类或非人类动物。在一实施方案中,皮肤感染选自由以下组成的组:脓疱、蜂窝组织炎、感染的皮肤炎、疱疹性湿疹、毛囊炎、感染的水疱、霉菌病、花斑癣、金黄色葡萄球菌感染及链球菌感染。引起感染的微生物包括(但不限于):金黄色葡萄球菌、链球菌属、铜绿假单胞菌、拟杆菌属、单纯疱疹病毒、柯萨奇病毒、传染性软疣病毒、牛痘病毒、白色念珠菌、小孢子菌属、毛癣菌属、青霉菌属、枝孢菌属、链格孢菌属及曲霉属。术语“有需要的个体”还可指患有atd且对皮肤感染的易感性增加或处于罹患皮肤感染的更大风险的个体。其还可包括血清总体及过敏原特异性ige或血清趋化激素(例如,ccl17或ccl27)含量升高的个体。
53.在某些方面中,本发明的方法可用于减少由atd所致的炎症和/或搔痒。
54.本发明提供减少患有atd的个体中皮肤的微生物定殖的方法,其包括向个体施用治疗有效量的抗il-36r抗体或其抗原结合片段。在某些实施方案中,本发明提供减少金黄色葡萄球菌在患有异位性皮肤炎的患者的皮肤上定殖的方法。在一些实施方案中,在施用抗il-36r抗体之后,微生物定殖相较于基线减少了至少10%、至少15%、至少20%、至少25%、至少30%、至少35%、至少40%、至少45%、至少50%、至少55%、至少60%、至少65%、至少70%或至少75%。
55.微生物定殖可用本领域已知的测试及程序来测量,例如通过pcr、微生物培养、显微术及染色或免疫荧光。在某些实施方案中,微生物定殖可通过本领域已知的微生物蛋白质生物标记物的存在来测量,例如微生物毒素,例如葡萄球菌中毒性休克综合征毒素-1。用于检测和/或量化此类生物标记物的方法为本领域已知的。本发明的抗体
56.本发明的抗il36r抗体公开于美国专利第9,023,995号或wo2013/074569中,其中的每一者的全部内容以引用的方式并入本文中。
57.如本文所使用,术语“抗体”包括包含通过二硫键互连的四条多肽链(两条重(h)链及两条轻(l)链)的免疫球蛋白分子,以及其多聚体(例如,igm)。在典型抗体中,各重链包含重链可变区(本文中缩写为hcvr或vh)及重链恒定区。重链恒定区包含三个域,即ch1、ch2及ch3。各轻链包含轻链可变区(本文中缩写为lcvr或v
l
)及轻链恒定区。轻链恒定区包含一个域(c
l
1)。vh及v
l
区可进一步细分成高变区,称为互补决定区(cdr),穿插有称为构架区(fr)的更保守区。各vh及v
l
由自氨基端至羧基端按以下次序排列的三个cdr及四个fr构成:fr1、cdr1、fr2、cdr2、fr3、cdr3、fr4。在本发明的不同实施方案中,抗il-36r抗体(或其抗原结合部分)的fr可与人类生殖系序列一致或可经天然或人工修饰。氨基酸共有序列可基于两个或更多个cdr的并列分析来定义。
58.如本文所使用,术语“抗体”还包括完整抗体分子的抗原结合片段。如本文所使用,术语抗体的“抗原结合部分”、抗体的“抗原结合片段”及其类似术语包括特异性结合抗原以形成复合物的任何天然存在、以酶方式可获得、合成或经基因工程改造的多肽或糖蛋白。抗体的抗原结合片段可使用任何适合的标准技术衍生自例如完整抗体分子,例如涉及编码抗体可变域及任选存在的恒定域的dna的操纵及表达的蛋白水解消化或重组基因工程改造技术。此类dna为已知的和/或易于购自例如商业来源、dna文库(包括例如噬菌体-抗体文库),或可合成。dna可以化学方式或通过使用分子生物学技术定序及操纵,例如将一个或多个可变域和/或恒定域配置成适合的构型,或引入密码子,产生半胱氨酸残基,修饰、添加或缺失
氨基酸等。
59.抗原结合片段的非限制性实施例包括:(i)fab片段;(ii)f(ab')2片段;(iii)fd片段;(iv)fv片段;(v)单链fv(scfv)分子;(vi)dab片段;及(vii)由模拟抗体的高变区的氨基酸残基组成的最小识别单元(例如,经分离的互补决定区(cdr),例如cdr3肽),或限制性fr3-cdr3-fr4肽。其他经工程改造的分子,例如结构域特异性抗体、单结构域抗体、结构域缺失抗体、嵌合抗体、cdr移植抗体、双功能抗体、三功能抗体、四功能抗体、微型抗体、纳米抗体(例如单价纳米抗体、二价纳米抗体等)、小模块免疫药物(smip)及鲨鱼可变ignar结构域还涵盖在如本文所使用的表述“抗原结合片段”内。
60.抗体的抗原结合片段将通常包含至少一个可变域。可变域可为任何尺寸或氨基酸组成且一般将包含与一个或多个构架序列相邻或同框的至少一个cdr。在具有与v
l
域相关的vh域的抗原结合片段中,vh及v
l
域可以任何适合的排列相对于彼此定位。例如,可变区可为二聚的且含有v
h-vh、v
h-v
l
或v
l-v
l
二聚体。或者,抗体的抗原结合片段可含有单体vh或v
l
域。
61.用于本发明的方法中的抗体可为人类抗体。如本文所使用,术语“人类抗体”意图包括具有衍生自人类生殖系免疫球蛋白序列的可变区及恒定区的抗体。本发明的人类抗体仍然可包括例如在cdr且尤其cdr3中不由人类生殖系免疫球蛋白序列编码的氨基酸残基(例如,通过体外随机或位点特异性突变诱发或通过体内体细胞突变引入的突变)。然而,如本文所使用,术语“人类抗体”不意图包括其中衍生自另一种哺乳动物物种(例如小鼠)的生殖系的cdr序列已移植于人类构架序列上的抗体。
62.用于本发明的方法中的抗体可为重组人类抗体。如本文所使用,术语“重组人类抗体”意图包括通过重组方式制备、表达、产生或分离的所有人类抗体,例如使用转染至宿主细胞中的重组表达载体表达的抗体(下文进一步描述);自重组组合人类抗体文库分离的抗体(下文进一步描述);自对于人类免疫球蛋白基因而言为转殖基因的动物(例如小鼠)分离的抗体(参见例如taylor等人,(1992)nucl.acids res,20:6287-6295)或通过涉及将人类免疫球蛋白基因序列剪接至其他dna序列的任何其他方式制备、表达、产生或分离的抗体。此类重组人类抗体具有衍生自人类生殖系免疫球蛋白序列的可变区及恒定区。然而,在某些实施方案中,此类重组人类抗体经受体外突变诱发(或当使用人类ig序列的动物转殖基因时,为体内体细胞突变诱发),且因此重组抗体的vh及v
l
区的氨基酸序列为虽然衍生自人类生殖系vh及v
l
序列且与其相关,但可不体内天然存在于人类抗体生殖系抗体库内的序列。
63.在与本发明的任何方面相关的某些示例性实施方案中,可在本发明的方法的上下文中使用的抗il-36r抗体或其抗原结合片段包括:a)包含seq id no:26的氨基酸序列(l-cdr1);seq id no:35、102、103、104、105、106或140的氨基酸序列(l-cdr2);seq id no:44的氨基酸序列(l-cdr3)的轻链可变区;及b)包含seq id no:53或141的氨基酸序列(h-cdr1);seq id no:62、108、109、110、111或142的氨基酸序列(h-cdr2);seq id no:72的氨基酸序列(h-cdr3)的重链可变区。
64.根据某些实施方案,抗il-36r抗体或其抗原结合片段包含:i.a)包含seq id no:26的氨基酸序列(l-cdr1);seq id no:102的氨基酸序列(l-cdr2);seq id no:44的氨基酸序列(l-cdr3)的轻链可变区;及b)包含seq id no:53的氨基酸序列(h-cdr1);seq id no:62、108、109、110或111的氨基酸序列(h-cdr2);seq id no:72
的氨基酸序列(h-cdr3)的重链可变区;或ii.a)包含seq id no:26的氨基酸序列(l-cdr1);seq id no:103的氨基酸序列(l-cdr2);seq id no:44的氨基酸序列(l-cdr3)的轻链可变区;及b)包含seq id no:53的氨基酸序列(h-cdr1);seq id no:62、108、109、110或111的氨基酸序列(h-cdr2);seq id no:72的氨基酸序列(h-cdr3)的重链可变区;或iii.a)包含seq id no:26的氨基酸序列(l-cdr1);seq id no:104的氨基酸序列(l-cdr2);seq id no:44的氨基酸序列(l-cdr3)的轻链可变区;及b)包含seq id no:53的氨基酸序列(h-cdr1);seq id no:62、108、109、110或111的氨基酸序列(h-cdr2);seq id no:72的氨基酸序列(h-cdr3)的重链可变区;或iv.a)包含seq id no:26的氨基酸序列(l-cdr1);seq id no:105的氨基酸序列(l-cdr2);seq id no:44的氨基酸序列(l-cdr3)的轻链可变区;及b)包含seq id no:53的氨基酸序列(h-cdr1);seq id no:62、108、109、110或111的氨基酸序列(h-cdr2);seq id no:72的氨基酸序列(h-cdr3)的重链可变区;或v.a)包含seq id no:26的氨基酸序列(l-cdr1);seq id no:106的氨基酸序列(l-cdr2);seq id no:44的氨基酸序列(l-cdr3)的轻链可变区;及b)包含seq id no:53的氨基酸序列(h-cdr1);seq id no:62、108、109、110或111的氨基酸序列(h-cdr2);seq id no:72的氨基酸序列(h-cdr3)的重链可变区或vi.a)包含seq id no:26的氨基酸序列(l-cdr1);seq id no:140的氨基酸序列(l-cdr2);seq id no:44的氨基酸序列(l-cdr3)的轻链可变区;及b)包含seq id no:53的氨基酸序列(h-cdr1);seq id no:62、108、109、110或111的氨基酸序列(h-cdr2);seq id no:72的氨基酸序列(h-cdr3)的重链可变区;或vii.a)包含seq id no:26的氨基酸序列(l-cdr1);seq id no:104的氨基酸序列(l-cdr2);seq id no:44的氨基酸序列(l-cdr3)的轻链可变区;及b)包含seq id no:141的氨基酸序列(h-cdr1);seq id no:62、108、109、110、111或142的氨基酸序列(h-cdr2);seq id no:72的氨基酸序列(h-cdr3)的重链可变区。
65.根据某些实施方案,抗il-36r抗体或其抗原结合片段包含:(i)包含seq id no:77的氨基酸序列的轻链可变区;及包含seq id no:87的氨基酸序列的重链可变区;或(ii)包含seq id no:77的氨基酸序列的轻链可变区;及包含seq id no:88的氨基酸序列的重链可变区;或(iii)包含seq id no:77的氨基酸序列的轻链可变区;及包含seq id no:89的氨基酸序列的重链可变区;或(iv)包含seq id no:80的氨基酸序列的轻链可变区;及包含seq id no:87的氨基酸序列的重链可变区;或(v)包含seq id no:80的氨基酸序列的轻链可变区;及包含seq id no:88的氨基酸序列的重链可变区;或(vi)包含seq id no:80的氨基酸序列的轻链可变区;及包含seq id no:89的氨基酸序列的重链可变区;或(vii)包含seq id no:85的氨基酸序列的轻链可变区;及包含seq id no:100的氨
基酸序列的重链可变区;或(viii)包含seq id no:85的氨基酸序列的轻链可变区;及包含seq id no:101的氨基酸序列的重链可变区;或(ix)包含seq id no:86的氨基酸序列的轻链可变区;及包含seq id no:100的氨基酸序列的重链可变区;或(x)包含seq id no:86的氨基酸序列的轻链可变区;及包含seq id no:101的氨基酸序列的重链可变区。
66.根据某些实施方案,抗il-36r抗体或其抗原结合片段包含:i.包含seq id no:115的氨基酸序列的轻链;及包含seq id no:125的氨基酸序列的重链;或ii.包含seq id no:115的氨基酸序列的轻链;及包含seq id no:126的氨基酸序列的重链;或iii.包含seq id no:115的氨基酸序列的轻链;及包含seq id no:127的氨基酸序列的重链;或iv.包含seq id no:118的氨基酸序列的轻链;及包含seq id no:125的氨基酸序列的重链;或v.包含seq id no:118的氨基酸序列的轻链;及包含seq id no:126的氨基酸序列的重链;或vi.包含seq id no:118的氨基酸序列的轻链;及包含eq id no:127的氨基酸序列的重链;或vii.包含seq id no:123的氨基酸序列的轻链;及包含seq id no:138的氨基酸序列的重链;或viii.包含seq id no:123的氨基酸序列的轻链;及包含seq id no:139的氨基酸序列的重链;或ix.包含seq id no:124的氨基酸序列的轻链;及包含seq id no:138的氨基酸序列的重链。
67.在一个方面,本文描述且公开抗il-36r抗体,尤其人源化抗il-36r抗体,及包含一种或多种抗il-36r抗体,尤其一种或多种本发明的人源化抗il-36r抗体的组合物及制品。还描述包括抗il-36抗体,尤其人源化抗il-36r抗体的抗原结合片段的结合剂。
68.本发明的代表性抗体的可变区及cdr公开如下:l-cdr1氨基酸序列》81b4vk32_3 l-cdr1tasssvsssyfh(seq id no:26)》81b4vk32_105 l-cdr1tasssvsssyfh(seq id no:26)》81b4vk32_116 l-cdr1tasssvsssyfh(seq id no:26)》81b4vk32_127 l-cdr1tasssvsssyfh(seq id no:26)
》81b4vk32_138 l-cdr1tasssvsssyfh(seq id no:26)》81b4vk32_140 l-cdr1tasssvsssyfh(seq id no:26)》81b4vk32_141 l-cdr1tasssvsssyfh(seq id no:26)》81b4vk32_147 l-cdr1tasssvsssyfh(seq id no:26)》73c5vk39_2 l-cdr1kasqdvgtnvl(seq id no:27)》73c5vk39_7 l-cdr1kasqdvgtnvl(seq id no:27)》73c5vk39_15 l-cdr1kasqdvgtnvl(seq id no:27)l-cdr2氨基酸序列》81b4vk32_3l-cdr2(seq id 102)rtstlas》81b4vk32_105 l-cdr2(seq id 103)rtsilas》81b4vk32_116 l-cdr2(seq id 104)rtsrlas》81b4vk32_127 l-cdr2(seq id 104)rtsrlas》81b4vk32_138 l-cdr2(seq id 104)rtsrlas》81b4vk32_140 l-cdr2(seq id 105)rtsqlas》81b4vk32_141 l-cdr2(seq id 106)rtsklas》81b4vk32_147 l-cdr2(seq id 140)rtshlas》73c5vk39_2 l-cdr2sasyrhs(seq id no:36)》73c5vk39_7 l-cdr2sasyrhs(seq id no:36)》73c5vk39_1 ll-cdr2sasyrhs(seq id no:36)l-cdr3氨基酸序列》81b4vk32_3 l-cdr3
hqfhrsplt(seq id no:44)》81b4vk32_105 l-cdr3hqfhrsplt(seq id no:44)》81b4vk32_116 l-cdr3hqfhrsplt(seq id no:44)》81b4vk32_127 l-cdr3hqfhrsplt(seq id no:44)》81b4vk32_138 l-cdr3hqfhrsplt(seq id no:44)》81b4vk32_140 l-cdr3hqfhrsplt(seq id no:44)》81b4vk32_141 l-cdr3hqfhrsplt(seq id no:44)》81b4vk32_147 l-cdr3hqfhrsplt(seq id no:44)》73c5vk39_2 l-cdr3qqysryplt(seq id no:45)》73c5vk39_7 l-cdr3qqysryplt(seq id no:45)》73c5vk39_15 l-cdr3qqysryplt(seq id no:45)h-cdr1氨基酸序列》81b4vh33_49 h-cdr1gysftsswih(seq id no:53)》81b4vh33_85t h-cdr1gysftsswih(seq id no:53)》81b4vh33_90 h-cdr1gysftsswih(seq id no:53)》81b4vh33_93 h-cdr1gysftsswih(seq id no:53)》81b4vh50_22 h-cdr1gysftsswih(seq id no:53)》81b4vh50_30 h-cdr1gysftsswih(seq id no:53)》81b4vh51_13 h-cdr1gysftsswih(seq id no:53)》81b4vh51_15 h-cdr1gysftsswih(seq id no:53)》81b4vh52_83 h-cdr1
gysftsswih(seq id no:53)》73c5vh46_4 h-cdr1gfsltdyavh(seq id no:107)》73c5vh46_19 h-cdr1gfsltdyavh(seq id no:107)》73c5vh46_40 h-cdr1gfsltdyavh(seq id no:107)》73c5vh47_65 h-cdr1gfsltdyavh(seq id no:107)》73c5vh47_77 h-cdr1gfsltdyavh(seq id no:107)》73c5vh58_91 h-cdr1gfsltdyavh(seq id no:107)h-cdr2氨基酸序列》81b4vh33_49 h-cdr2einpgnvrtnynenf(seq id no:62)》81b4vh33_85t h-cdr2einpgnvrtnynenf(seq id no:62)》81b4vh33_90 h-cdr2einpgnvrtnynenf(seq id no:62)》81b4vh33_93 h-cdr2einpgnvrtnynenf(seq id no:62)》81b4vh50_22 h-cdr2eilpgvvrtnynenf(seq id no:108)》81b4vh50_30 h-cdr2einpgavrtnynenf(seq id no:109)》81b4vh51_13 h-cdr2einpglvrtnynenf(seq id no:110)》81b4vh51_15 h-cdr2einpgavrtnynenf(seq id no:109)》81b4vh52_83 h-cdr2einpgsvrtnynenf(seq id no:111)》73c5vh46_4 h-cdr2viwsdgstdynapfks(seq id no:64)》73c5vh46_19 h-cdr2viwsdgstdynapfks(seq id no:64)》73c5vh46_40 h-cdr2viwsdgstdynapfks(seq id no:64)》73c5vh47_65 h-cdr2
viwsdgstdynapfks(seq id no:64)》73c5vh47_77 h-cdr2viwsdgstdfnapfks(seq id no:63)》73c5vh58_91 h-cdr2viwsdgstdynapfks(seq id no:64)h-cdr3氨基酸序列》81b4vh33_49 h-cdr3vfygepyfpy(seq id no:72)》81b4vh33_85t h-cdr3vfygepyfpy(seq id no:72)》81b4vh33_90 h-cdr3vfygepyfpy(seq id no:72)》81b4vh33_93 h-cdr3vfygepyfpy(seq id no:72)》81b4vh50_22 h-cdr3vfygepyfpy(seq id no:72)》81b4vh50_30 h-cdr3vfygepyfpy(seq id no:72)》81b4vh51_13 h-cdr3vfygepyfpy(seq id no:72)》81b4vh51_15 h-cdr3vfygepyfpy(seq id no:72)》81b4vh52_83 h-cdr3vfygepyfpy(seq id no:72)》73c5vh46_4 h-cdr3kggysgswfay(seq id no:73)》73c5vh46_19 h-cdr3kggysgswfay(seq id no:73)》73c5vh46_40 h-cdr3kggysgswfay(seq id no:73)》73c5vh47_65 h-cdr3kggysgswfay(seq id no:73)》73c5vh47_77 h-cdr3kggysgswfay(seq id no:73)》73c5vh58_91 h-cdr3kggysgswfay(seq id no:73)
69.在一个方面,本发明的可变区连接于恒定区。例如,本发明的可变区连接于下文显示的恒定区以形成抗体的重链或轻链。
70.本发明的代表性轻链及重链序列显示如下(衍生自抗体81b4及73c5的人源化可变区连接于恒定区)。轻链氨基酸序列
重链氨基酸序列
71.上文所列的cdr使用chothia编号系统(al-lazikani等人,(1997)jmb 273,927-948)定义。
72.在一个方面,本发明的抗体包含3个轻链cdr及3个重链cdr,例如如上文所阐述。
73.在一个方面,本发明的抗体包含如上文所阐述的轻链及重链可变区。在一个方面,本发明的轻链可变区与轻链恒定区,例如κ或λ恒定区融合。在一个方面,本发明的重链可变区与重链恒定区,例如iga、igd、ige、igg或igm,尤其igg1、igg2、igg3或igg4融合。
74.本发明提供一种抗il-36r抗体,其包含:包含seq id no:115的氨基酸序列的轻链;及包含seq id no:125的氨基酸序列的重链(抗体b1)。
75.本发明提供一种抗il-36r抗体,其包含:包含seq id no:115的氨基酸序列的轻链;及包含seq id no:126的氨基酸序列的重链(抗体b2)。
76.本发明提供一种抗il-36r抗体,其包含:包含seq id no:115的氨基酸序列的轻链;及包含seq id no:127的氨基酸序列的重链(抗体b3)。
77.本发明提供一种抗il-36r抗体,其包含:包含seq id no:118的氨基酸序列的轻链;及包含seq id no:125的氨基酸序列的重链(抗体b4)。
78.本发明提供一种抗il-36r抗体,其包含:包含seq id no:118的氨基酸序列的轻链;及包含seq id no:126的氨基酸序列的重链(抗体b5)。
79.本发明提供一种抗il-36r抗体,其包含:包含seq id no:118的氨基酸序列的轻链;及包含seq id no:127的氨基酸序列的重链(抗体b6)。
80.本发明提供一种抗il-36r抗体,其包含:包含seq id no:123的氨基酸序列的轻链;及包含seq id no:138的氨基酸序列的重链(抗体c3)。
81.本发明提供一种抗il-36r抗体,其包含:包含seq id no:123的氨基酸序列的轻链;及包含seq id no:139的氨基酸序列的重链(抗体c2)。
82.本发明提供一种抗il-36r抗体,其包含:包含seq id no:124的氨基酸序列的轻链;及包含seq id no:138的氨基酸序列的重链(抗体c1)。
83.本发明的代表性抗体显示如下。表a.
表b
cdr2);seq id no:44的氨基酸序列(l-cdr3)的轻链可变区;及b)包含seq id no:53的氨基酸序列(h-cdr1);seq id no:62、108、109、110或111的氨基酸序列(h-cdr2);seq id no:72的氨基酸序列(h-cdr3)的重链可变区;或ii.a)包含seq id no:26的氨基酸序列(l-cdr1);seq id no:103的氨基酸序列(l-cdr2);seq id no:44的氨基酸序列(l-cdr3)的轻链可变区;及b)包含seq id no:53的氨基酸序列(h-cdr1);seq id no:62、108、109、110或111的氨基酸序列(h-cdr2);seq id no:72的氨基酸序列(h-cdr3)的重链可变区;或iii.a)包含seq id no:26的氨基酸序列(l-cdr1);seq id no:104的氨基酸序列(l-cdr2);seq id no:44的氨基酸序列(l-cdr3)的轻链可变区;及b)包含seq id no:53的氨基酸序列(h-cdr1);seq id no:62、108、109、110或111的氨基酸序列(h-cdr2);seq id no:72的氨基酸序列(h-cdr3)的重链可变区;或iv.a)包含seq id no:26的氨基酸序列(l-cdr1);seq id no:105的氨基酸序列(l-cdr2);seq id no:44的氨基酸序列(l-cdr3)的轻链可变区;及b)包含seq id no:53的氨基酸序列(h-cdr1);seq id no:62、108、109、110或111的氨基酸序列(h-cdr2);seq id no:72的氨基酸序列(h-cdr3)的重链可变区;或v.a)包含seq id no:26的氨基酸序列(l-cdr1);seq id no:106的氨基酸序列(l-cdr2);seq id no:44的氨基酸序列(l-cdr3)的轻链可变区;及b)包含seq id no:53的氨基酸序列(h-cdr1);seq id no:62、108、109、110或111的氨基酸序列(h-cdr2);seq id no:72的氨基酸序列(h-cdr3)的重链可变区;或vi.a)包含seq id no:26的氨基酸序列(l-cdr1);seq id no:140的氨基酸序列(l-cdr2);seq id no:44的氨基酸序列(l-cdr3)的轻链可变区;及b)包含seq id no:53的氨基酸序列(h-cdr1);seq id no:62、108、109、110或111的氨基酸序列(h-cdr2);seq id no:72的氨基酸序列(h-cdr3)的重链可变区;或vii.a)包含seq id no:26的氨基酸序列(l-cdr1);seq id no:104的氨基酸序列(l-cdr2);seq id no:44的氨基酸序列(l-cdr3)的轻链可变区;及b)包含seq id no:141的氨基酸序列(h-cdr1);seq id no:62、108、109、110、111或142的氨基酸序列(h-cdr2);seq id no:72的氨基酸序列(h-cdr3)的重链可变区。
92.在与以上方面中的任一个相关的一个实施方案中,抗il-36r抗体包括:(i)包含seq id no:77的氨基酸序列的轻链可变区;及包含seq id no:87的氨基酸序列的重链可变区;或(ii)包含seq id no:77的氨基酸序列的轻链可变区;及包含seq id no:88的氨基酸序列的重链可变区;或(iii)包含seq id no:77的氨基酸序列的轻链可变区;及包含seq id no:89的氨基酸序列的重链可变区;或(iv)包含seq id no:80的氨基酸序列的轻链可变区;及包含seq id no:87的氨基酸序列的重链可变区;或(v)包含seq id no:80的氨基酸序列的轻链可变区;及包含seq id no:88的氨基酸序列的重链可变区;或(vi)包含seq id no:80的氨基酸序列的轻链可变区;及包含seq id no:89的氨基
酸序列的重链可变区;或(vii)包含seq id no:85的氨基酸序列的轻链可变区;及包含seq id no:100的氨基酸序列的重链可变区;或(viii)包含seq id no:85的氨基酸序列的轻链可变区;及包含seq id no:101的氨基酸序列的重链可变区;或(ix)包含seq id no:86的氨基酸序列的轻链可变区;及包含seq id no:100的氨基酸序列的重链可变区;或(x)包含seq id no:86的氨基酸序列的轻链可变区;及包含seq id no:101的氨基酸序列的重链可变区。
93.在与第一至第五方面中的任一种相关的一个实施方案中,抗il-36r抗体包括:i.包含seq id no:115的氨基酸序列的轻链;及包含seq id no:125的氨基酸序列的重链;或ii.包含seq id no:115的氨基酸序列的轻链;及包含seq id no:126的氨基酸序列的重链;或iii.包含seq id no:115的氨基酸序列的轻链;及包含seq id no:127的氨基酸序列的重链;或iv.包含seq id no:118的氨基酸序列的轻链;及包含seq id no:125的氨基酸序列的重链;或v.包含seq id no:118的氨基酸序列的轻链;及包含seq id no:126的氨基酸序列的重链;或vi.包含seq id no:118的氨基酸序列的轻链;及包含seq id no:127的氨基酸序列的重链;或vii.包含seq id no:123的氨基酸序列的轻链;及包含seq id no:138的氨基酸序列的重链;或viii.包含seq id no:123的氨基酸序列的轻链;及包含seq id no:139的氨基酸序列的重链;或ix.包含seq id no:124的氨基酸序列的轻链;及包含seq id no:138的氨基酸序列的重链。
94.在与本文所描述的方面及实施方案中的任一种相关的一个实施方案中,皮下或静脉内或通过两个途径同时或依序且以任何次序施用抗il-36r抗体。在一相关实施方案中,皮下给药包括施用300mg或600mg的抗il-36r抗体。在一相关实施方案中,静脉内给药包括施用300mg、600mg、900mg或1200mg的抗il-36r抗体。在一相关实施方案中,皮下给药包括每周一次(qw)、每2周一次(q2w)、每4周一次(q4w)、每6周一次(q6w)或每8周一次(q8w)施用一个或多个300mg剂量或一个或多个600mg剂量的抗il-36r抗体,或其组合。
95.在与本文所描述的方面及实施方案中的任一种相关的另一实施方案中,皮下或静脉内或通过两个途径同时或依序且以任何次序施用抗il-36r抗体。在一相关实施方案中,皮下给药包括初始剂量(例如,引入或诱导剂量方案)。在一相关实施方案中,皮下给药进一步包括后续剂量(例如,维持给药方案)。在一相关实施方案中,初始剂量包括:(a)每天施用一个或多个150mg剂量的抗il-36r抗体,持续2周;或(b)每天施用一个或多个300mg剂量的
抗il-36r抗体,持续2周;或(c)一个或多个600mg剂量的抗il-36r抗体,4周内施用两次、三次或四次或每周施用两次持续2周、或每周施用两次持续3周、或每周施用两次持续4周;或(d)施用一次一个900mg或1200mg剂量的抗il-36r抗体;或(e)三周内(例如,第0周及第2周)施用两次各两个900mg或1200mg剂量的抗il-36r抗体;后续剂量包括:(a)q2w、q4w、q6w或q8w施用一个或多个300mg剂量的抗il-36r抗体;或(b)q2w、q4w、q6w或q8w施用一个或多个600mg剂量的抗il-36r抗体;且其中后续剂量的施用在施用最后一个初始剂量之后2至4周之间或2周或4周。在一实施方案中,若仅施用一个初始剂量,则第一后续剂量的施用在施用初始剂量之后2至4周之间或2周或4周。
96.在与本文所描述的方面及实施方案中的任一种相关的另一实施方案中,以各150mg或300mg(每天施用,持续2周)或各600mg(四周内施用两次、三次或四次或两周、三周或四周内每周施用两次)或900mg或1200mg(施用一次)或各900mg或1200mg(三周内施用两次)的初始sc剂量,随后300mg或600mg(q2w、q4w、q6w或q8w施用)之后续sc剂量皮下施用抗il-36r抗体。在一实施方案中,在最后一个初始剂量之后两至四周或两周或四周施用第一后续剂量。在一实施方案中,若仅施用一个初始剂量,则第一后续剂量的施用在施用初始剂量之后两至四周之间或两周或四周。
97.在与以上方面中的任一个相关的另一实施方案中,以初始剂量及后续剂量皮下施用抗il-36r抗体。在一相关实施方案中,初始剂量各为150mg、300mg、600mg、900mg或1200mg。在一相关实施方案中,每日(以连续日)施用各150mg或300mg的初始剂量,持续两周。在一相关实施方案中,每周施用各600mg的初始剂量一次,持续两周,包括第0周及第1周;第0周及第2周;第0周及第3周;或第0周及第4周。在一相关实施方案中,每周施用各600mg的初始剂量一次,持续三周,包括第0周、第1周及第2周;第0周、第1周及第3周;第0周、第1周及第4周;第0周、第2周及第3周;第0周、第2周及第4周;或第0周、第3周及第4周。在一相关实施方案中,每周施用各600mg的初始剂量一次,持续四周,包括第0周、第1周、第2周及第3周;第0周、第1周、第2周及第4周;第0周、第1周、第3周及第4周;或第0周、第2周、第3周及第4周。在一相关实施方案中,每周施用各600mg的初始剂量两次,持续2周。在一相关实施方案中,每周施用各600mg的初始剂量两次,持续3周。在一相关实施方案中,每周施用各600mg的初始剂量两次,持续4周。在一相关实施方案中,施用900mg或1200mg的初始剂量一次。在一相关实施方案中,三周内(例如,第0周及第2周)施用各900mg或1200mg的初始剂量两次。在一相关实施方案中,后续剂量包括300mg或600mg的抗il-36r。
98.在一相关实施方案中,后续剂量各为300mg或600mg。在一相关实施方案中,后续剂量给药在初始剂量给药结束之后两至四周开始。在一相关实施方案中,每2周一次(q2w)、每4周一次(q4w)、每6周一次(q6w)或每8周一次(q8w)施用各300mg或600mg之后续剂量。
99.根据本发明的给药方案的代表性实施例公开于下表1及表2中。表1:剂量及给药方案
表2:剂量及给药方案
sc:皮下或经皮下iv:静脉内或经静脉内
100.在与以上方面中的任一个相关的一个实施方案中,在用本发明的抗il-36r抗体治疗期间或之后,评估哺乳动物或患者相对于安慰剂或基线的改善,其定义如下:i.在4和/或16周时湿疹面积及严重程度指数(easi)评分改善至少10%;ii.在4和/或16周时达到easi 50的患者的比例改善至少10%;iii.在4和/或16周时达到easi 75的患者的比例改善至少10%;iv.scorad、最大瘙痒强度及dlqi改善至少10%;v.直至第44周具有药物相关不良事件(ae)的患者数量改善至少10%;vi.第4周的湿疹面积及严重程度指数(easi)相对于基线的绝对值及百分比变化改善至少10%;vii.第4周和/或第16周的湿疹面积及严重程度指数(easi)改善50%(easi50)的
患者比例改善至少10%;viii.第4周和/或第16周的湿疹面积及严重程度指数(easi)改善75%(easi75)的患者比例改善至少5%;ix.第4周和/或第16周的异位性皮肤炎评分(scorad)改善至少10%;x.第4周和/或第16周时实现研究者总体评定(iga)中至少2级降低至清除(0)或几乎清除(1)的患者比例改善至少5%;xi.第16周的easi评分相对于基线的百分比变化的至少10个百分点差异;xii.第16周的easi50反应率的至少10个百分点差异;xiii.第16周的easi75反应率的至少5个百分点差异;xiv.第16周的scorad、最大瘙痒强度及dlqi相对于基线的百分比变化的至少10个百分点差异;xv.第44周的湿疹面积及严重程度指数(easi)相对于基线的百分比变化的至少10个百分点差异;或xvi.第16周的iga率的至少5个百分点差异。
101.在一相关实施方案中,针对所列举的指标中的任一种,与服用安慰剂的患者相比,对给药有反应的患者的比例较高或显著较高。
102.在与以上方面中的任一个相关的一个实施方案中,抗il-36r抗体或其抗原结合片段(本文所公开)存在于稳定药物制剂中,用于根据本发明的方面中的任一种向个体施用。
103.在另一实施方案中,制剂包含治疗量的抗il-36r抗体(本文所公开)及i)药学上可接受的缓冲液;或ii)药学上可接受的张力调节剂;或iii)药学上可接受的稳定剂;或iv)药学上可接受的盐;或v)药学上可接受的表面活性剂;或vi)药学上可接受的缓冲液及药学上可接受的张力调节剂;或vii)药学上可接受的缓冲液、药学上可接受的张力调节剂及药学上可接受的稳定剂;或viii)药学上可接受的缓冲液、药学上可接受的张力调节剂、药学上可接受的稳定剂及药学上可接受的盐;或ix)药学上可接受的缓冲液、药学上可接受的张力调节剂、药学上可接受的稳定剂、药学上可接受的盐及药学上可接受的表面活性剂;各自呈药学上可接受的量且在药学上可接受的ph下。
104.在另一实施方案中,抗il-36r抗体或其抗原结合片段以以下浓度存在于制剂中:约15mg/ml、约20mg/ml、约25mg/ml、约30mg/ml、约60mg/ml、约75mg/ml、约80mg/ml、约100mg/ml或约150mg/ml。在另一相关实施方案中,药学上可接受的缓冲液以在约20mm至约80mm范围内的浓度,或以约20mm、约25mm、约35mm、约40mm、约45mm、约50mm、约60mm的浓度存在于制剂中。在另一相关实施方案中,药学上可接受的张力调节剂以在约100mm至约250mm范围内的浓度,或以约100mm、约120mm、约150mm、约180mm、约200mm的浓度存在于制剂中。在另一相关实施方案中,药学上可接受的稳定剂以在约0mm至约80mm范围内的浓度,或以约
25mm或约50mm的浓度存在于制剂中。在另一相关实施方案中,药学上可接受的盐以在约0至约150mm范围内的浓度,或以约3mm、5mm、10mm、25mm或50mm的浓度存在于制剂中。在另一相关实施方案中,药学上可接受的表面活性剂以在约0g/l至约1.5g/l范围内的浓度,或以约0.1g/l、0.2g/l、0.4g/l、0.5g/l或1g/l的浓度存在于制剂中。在与第一方面相关的一个实施方案中,制剂的特征在于ph在约5至约8范围内。在另一相关实施方案中,ph为约5、约5.5、约6、约6.5、约7、约7.5或约8。
105.在另一实施方案中,缓冲液包含组氨酸、磷酸盐、丁二酸盐、柠檬酸盐、乙酸盐或tris;张力调节剂为一种或多种糖和/或多元醇,包括蔗糖、海藻糖、山梨糖醇、硫酸镁(mgso4)、甘油、甘露糖醇或右旋糖;稳定剂包含氨基酸,包括精氨酸、组氨酸、甘氨酸、半胱氨酸、脯氨酸、甲硫氨酸、赖氨酸、天冬氨酸、谷氨酸或其药学上可接受的盐;盐包含氯化钠(nacl)、氯化镁(mgcl2)、氯化钾(kcl)、氯化锂(licl)、氯化钙(cacl2)、硼酸盐或氯化锌(zncl2);且表面活性剂包含泊洛沙姆188、聚山梨醇酯20、聚山梨醇酯40、聚山梨醇酯60或聚山梨醇酯80。
106.在一个实施方案中,根据本文所描述的方面中的任一个的治疗方法包括向个体施用治疗量的稳定药物制剂,所述稳定药物制剂包含约20mg/ml至约150mg/ml的抗il-36r抗体、约20mm至约80mm的药学上可接受的缓冲液(例如,乙酸盐缓冲液)、约100mm至约250mm的药学上可接受的张力调节剂(例如,蔗糖)、约0mm至约80mm的药学上可接受的稳定剂(例如,精氨酸)或其药学上可接受的盐、约0至约150mm的药学上可接受的盐(例如,氯化钠)及呈约0g/l至约1.5g/l的量的药学上可接受的表面活性剂(例如,聚山梨醇酯20),其中治疗、预防或改善个体的异位性皮肤炎(atd),其中降低或抑制患有异位性皮肤炎的个体的皮肤的微生物定殖,其中降低或抑制患有异位性皮肤炎的个体对皮肤感染的易感性,其中治疗或预防个体中与atd相关的皮肤病症,其中治疗个体中与atd相关的皮肤炎症。在一相关实施方案中,稳定药物制剂为水性药物制剂。在一相关实施方案中,水性药物制剂的ph为约5至约7。在一相关实施方案中,药物制剂为用于向个体静脉内给药。在一相关实施方案中,药物制剂为用于向个体皮下给药。在一相关实施方案中,用于静脉内给药的药物制剂包含呈约60mg/ml的量的抗il-36r抗体。在一相关实施方案中,用于皮下给药的药物制剂包含呈约150mg/ml的量的抗il-36r抗体。在一相关实施方案中,抗il-36r抗体包含:(i)包括示为seq id no:118的氨基酸序列的轻链及包括示为seq id no:125的氨基酸序列的重链;或(ii)包括示为seq id no:118的氨基酸序列的轻链及包括示为seq id no:126的氨基酸序列的重链;或(iii)包括示为seq id no:118的氨基酸序列的轻链及包括示为seq id no:127的氨基酸序列的重链。在一相关实施方案中,抗il-36r抗体包含:包含seq id no:77的氨基酸序列的轻链可变区;及包含seq id no:87的氨基酸序列的重链可变区;或包含seq id no:77的氨基酸序列的轻链可变区;及包含seq id no:88的氨基酸序列的重链可变区;或包含seq id no:77的氨基酸序列的轻链可变区;及包含seq id no:89的氨基酸序列的重链可变区;或包含seq id no:80的氨基酸序列的轻链可变区;及包含seq id no:87的氨基酸序列的重链可变区;或包含seq id no:80的氨基酸序列的轻链可变区;及包含seq id no:88的氨基酸序列的重链可变区;或包含seq id no:80的氨基酸序列的轻链可变区;及包含seq id no:89的氨基酸序列的重链可变区。
107.在一个实施方案中,根据前述方面中的任一种的治疗方法包括向个体施用治疗量
的选自由以下组成的组的稳定药物制剂:i.包括以下的制剂:约20mg/ml至约150mg/ml抗il-36r抗体、约40mm组氨酸、约120mm蔗糖、约50mm l-精氨酸、约5mm nacl及约1.0g/l聚山梨醇酯20,ph为约6.0;ii.包括以下的制剂:约20mg/ml至约150mg/ml抗il-36r抗体、约45mm乙酸盐、约150mm蔗糖、约25mm l-精氨酸、约0.4g/l聚山梨醇酯20,ph为约5.5;iii.包括以下的制剂:约20mg/ml至约150mg/ml抗il-36r抗体、约45mm乙酸盐、约180mm蔗糖、约25mm甘氨酸、约0.4g/l聚山梨醇酯80,ph为约5.5;iv.包括以下的制剂:约20mg/ml至约150mg/ml抗il-36r抗体、约25mm柠檬酸盐、约150mm海藻糖、约25mm甲硫氨酸、约0.2g/l聚山梨醇酯20,ph为约6.0;v.包括以下的制剂:约20mg/ml至约150mg/ml抗il-36r抗体、约25mm组氨酸、约180mm蔗糖、约20mm甘露糖醇、约0.2g/l聚山梨醇酯20,ph为约6.5;vi.包括以下的制剂:约20mg/ml至约150mg/ml抗il-36r抗体、约25mm柠檬酸盐、约200mm蔗糖、约0.4g/l聚山梨醇酯80,ph为约6.5;vii.包括以下的制剂:约20mg/ml至约150mg/ml抗il-36r抗体、约45mm乙酸盐、约150mm蔗糖、约25mm l-精氨酸、约0.4g/l聚山梨醇酯20,ph为约5.5;viii.包括以下的制剂:约20mg/ml至约150mg/ml抗il-36r抗体、约35mm组氨酸、约180mm海藻糖、约25mm l-精氨酸、约3mm nacl、约0.4g/l聚山梨醇酯80,ph为约6.0;ix.包括以下的制剂:约20mg/ml至约150mg/ml抗il-36r抗体、约25mm乙酸盐、约100mm甘露糖醇、约50mm nacl、约0.2g/l聚山梨醇酯20,ph为约5.5;x.包括以下的制剂:约20mg/ml至约150mg/ml抗il-36r抗体、约20mm丁二酸盐、约220mm蔗糖、约0.1g/l聚山梨醇酯80,ph为约6.0;及xi.包括以下的制剂:约20mg/ml至约150mg/ml抗il-36r抗体、约25mm柠檬酸盐、约0.4g/l聚山梨醇酯20,ph为约6.5,其中治疗、预防或改善个体的异位性皮肤炎(atd),其中降低或抑制患有异位性皮肤炎的个体的皮肤的微生物定殖,其中降低或抑制患有异位性皮肤炎的个体对皮肤感染的易感性,其中治疗或预防个体中与atd相关的皮肤病症,其中治疗个体中与atd相关的皮肤炎症。
108.在一相关实施方案中,稳定药物制剂为水性药物制剂。在一相关实施方案中,药物制剂为用于向个体静脉内给药。在一相关实施方案中,药物制剂为用于向个体皮下给药。在一相关实施方案中,用于静脉内给药的药物制剂包含呈约60mg/ml的量的抗il-36r抗体。在一相关实施方案中,用于皮下给药的药物制剂包含呈约150mg/ml的量的抗il-36r抗体。在一相关实施方案中,抗il-36r抗体包含:(i)包括示为seq id no:118的氨基酸序列的轻链及包括示为seq id no:125的氨基酸序列的重链;或(ii)包括示为seq id no:118的氨基酸序列的轻链及包括示为seq id no:126的氨基酸序列的重链;或(iii)包括示为seq id no:118的氨基酸序列的轻链及包括示为seq id no:127的氨基酸序列的重链。在一相关实施方案中,抗il-36r抗体包含:包含seq id no:77的氨基酸序列的轻链可变区;及包含seq id no:87的氨基酸序列的重链可变区;或包含seq id no:77的氨基酸序列的轻链可变区;及包含seq id no:88的氨基酸序列的重链可变区;或包含seq id no:77的氨基酸序列的轻链可变区;及包含seq id no:89的氨基酸序列的重链可变区;或包含seq id no:80的氨基酸序
列的轻链可变区;及包含seq id no:87的氨基酸序列的重链可变区;或包含seq id no:80的氨基酸序列的轻链可变区;及包含seq id no:88的氨基酸序列的重链可变区;或包含seq id no:80的氨基酸序列的轻链可变区;及包含seq id no:89的氨基酸序列的重链可变区。
109.在一个实施方案中,根据前述方面中的任一种的治疗方法包括向个体施用治疗量的选自由以下组成的组的稳定药物制剂:i.包括以下的制剂:约20mg/ml抗il-36r抗体、约40mm组氨酸、约120mm蔗糖、约50mm l-精氨酸、约5mm nacl及约1.0g/l聚山梨醇酯20,ph为约6.0;ii.包括以下的制剂:约60mg/ml抗il-36r抗体、约45mm乙酸盐、约150mm蔗糖、约25mm l-精氨酸、约0.4g/l聚山梨醇酯20,ph为约5.5;iii.包括以下的制剂:约20mg/ml抗il-36r抗体、约45mm乙酸盐、约180mm蔗糖、约25mm甘氨酸、约0.4g/l聚山梨醇酯80,ph为约5.5;iv.包括以下的制剂:约150mg/ml抗il-36r抗体、约25mm柠檬酸盐、约150mm海藻糖、约25mm甲硫氨酸、约0.2g/l聚山梨醇酯20,ph为约6.0;v.包括以下的制剂:约150mg/ml抗il-36r抗体、约25mm组氨酸、约180mm蔗糖、约20mm甘露糖醇、约0.2g/l聚山梨醇酯20,ph为约6.5;vi.包括以下的制剂:约20mg/ml抗il-36r抗体、约25mm柠檬酸盐、约200mm蔗糖、约0.4g/l聚山梨醇酯80,ph为约6.5;vii.包括以下的制剂:约150mg/ml抗il-36r抗体、约45mm乙酸盐、约150mm蔗糖、约25mm l-精氨酸、约0.4g/l聚山梨醇酯20,ph为约5.5;viii.包括以下的制剂:约15mg/ml抗il-36r抗体、约35mm组氨酸、约180mm海藻糖、约25mm l-精氨酸、约3mm nacl、约0.4g/l聚山梨醇酯80,ph为约6.0;ix.包括以下的制剂:约80mg/ml抗il-36r抗体、约25mm乙酸盐、约100mm甘露糖醇、约50mm nacl、约0.2g/l聚山梨醇酯20,ph为约5.5;x.包括以下的制剂:约100mg/ml抗il-36r抗体、约20mm丁二酸盐、约220mm蔗糖、约0.1g/l聚山梨醇酯80,ph为约6.0;及xi.包括以下的制剂:约60mg/ml抗il-36r抗体、约25mm柠檬酸盐、约0.4g/l聚山梨醇酯20,ph为约6.5,其中治疗、预防或改善个体的异位性皮肤炎(atd),其中降低或抑制患有异位性皮肤炎的个体的皮肤的微生物定殖,其中降低或抑制患有异位性皮肤炎的个体对皮肤感染的易感性,其中治疗或预防个体中与atd相关的皮肤病症,其中治疗个体中与atd相关的皮肤炎症。
164.在一相关实施方案中,稳定药物制剂为水性药物制剂。在一相关实施方案中,药物制剂为用于向个体静脉内给药。在一相关实施方案中,药物制剂为用于向个体皮下给药。在一相关实施方案中,用于静脉内给药的药物制剂包含呈约60mg/ml的量的抗il-36r抗体。在一相关实施方案中,用于皮下给药的药物制剂包含呈约150mg/ml的量的抗il-36r抗体。在一相关实施方案中,抗il-36r抗体包含:(i)包括示为seq id no:118的氨基酸序列的轻链及包括示为seq id no:125的氨基酸序列的重链;或(ii)包括示为seq id no:118的氨基酸序列的轻链及包括示为seq id no:126的氨基酸序列的重链;或(iii)包括示为seq id no:118的氨基酸序列的轻链及包括示为seq id no:127的氨基酸序列的重链。在一相关实施方
案中,抗il-36r抗体包含:包含seq id no:77的氨基酸序列的轻链可变区;及包含seq id no:87的氨基酸序列的重链可变区;或包含seq id no:77的氨基酸序列的轻链可变区;及包含seq id no:88的氨基酸序列的重链可变区;或包含seq id no:77的氨基酸序列的轻链可变区;及包含seq id no:89的氨基酸序列的重链可变区;或包含seq id no:80的氨基酸序列的轻链可变区;及包含seq id no:87的氨基酸序列的重链可变区;或包含seq id no:80的氨基酸序列的轻链可变区;及包含seq id no:88的氨基酸序列的重链可变区;或包含seq id no:80的氨基酸序列的轻链可变区;及包含seq id no:89的氨基酸序列的重链可变区。
110.在一个实施方案中,本发明涉及一种治疗患者中与atd相关的皮肤病症的方法,所述方法包括向患者皮下施用或已向患者皮下施用治疗有效量的本发明的抗il-36r抗体。在一相关实施方案中,皮下给药包括每周一次(qw)、每2周一次(q2w)、每4周一次(q4w)、每6周一次(q6w)或每8周一次(q8w)施用一个或多个300mg剂量或一个或多个600mg剂量的抗il-36r抗体,或其组合。
111.在一个实施方案中,本发明涉及一种治疗患者中与atd相关的皮肤病症的方法,所述方法包括向患者施用或已向患者施用治疗有效量的本发明的抗il-36r抗体。在一相关实施方案中,以初始剂量及后续剂量皮下施用抗il-36r抗体。在一相关实施方案中,皮下施用初始剂量。在一相关实施方案中,皮下施用后续剂量。在一相关实施方案中,初始剂量包括:(a)每天施用一个或多个150mg剂量的抗il-36r抗体,持续2周;或(b)每天施用一个或多个300mg剂量的抗il-36r抗体,持续2周;或(c)一个或多个600mg剂量的抗il-36r抗体,4周内施用两次、三次或四次或每周施用两次持续2周、或每周施用两次持续3周、或每周施用两次持续4周;或(d)施用一次一个900mg或1200mg剂量的抗il-36r抗体;或(e)三周内(例如,第0周及第2周)施用两次各两个900mg或1200mg剂量的抗il-36r抗体;后续剂量包括:(a)q2w、q4w、q6w或q8w施用一个或多个300mg剂量的抗il-36r抗体;或(b)q2w、q4w、q6w或q8w施用一个或多个600mg剂量的抗il-36r抗体;且其中后续剂量的施用在施用最后一个初始剂量之后2至4周之间或2周或4周。在一实施方案中,若仅施用一个初始剂量,则第一后续剂量的施用在施用初始剂量之后2至4周之间或2周或4周。
112.在与以上方面或其相关实施方案中的任一种相关的一个实施方案中,与安慰剂或基线相比,至少10%、20%、30%、40%、50%、60%、70%或80%的用本发明的抗il-36r抗体治疗的患者在4和/或16周时经历easi评分改善至少10%、至少20%、至少30%、至少40%或至少50%。
113.在与以上方面或其相关实施方案中的任一种相关的一个实施方案中,与安慰剂组或其基线相比,至少10%、20%、30%、40%、50%、60%、70%或80%的用本发明的抗il-36r抗体治疗的患者在4和/或16周时达到easi 50。
114.在与以上方面或其相关实施方案中的任一种相关的一个实施方案中,与安慰剂组或其基线相比,至少10%、20%、30%、40%、50%、60%、70%或80%的用本发明的抗il-36r抗体治疗的患者在4和/或16周时达到easi 75。
115.在与以上方面或其相关实施方案中的任一种相关的一个实施方案中,至少10%、20%、30%、40%、50%、60%、70%或80%的用本发明的抗il-36r抗体治疗的患者经历scorad、最大瘙痒强度及dlqi改善至少10%、至少20%、至少30%、至少40%或至少50%。
116.在与以上方面或其相关实施方案中的任一种相关的一个实施方案中,与安慰剂组
或其基线相比,至少10%、20%、30%、40%、50%、60%、70%或80%的用本发明的抗il-36r抗体治疗的患者直至第44周经历更少的药物相关不良事件(ae)。
117.在与以上方面或其相关实施方案中的任一种相关的一个实施方案中,与安慰剂组或其基线相比,至少10%、20%、30%、40%、50%、60%、70%或80%的用本发明的抗il-36r抗体治疗的患者在第4周经历湿疹面积及严重程度指数(easi)相对于基线的绝对值及百分比变化改善至少10%、至少20%、至少30%、至少40%或至少50%。
118.在与以上方面或其相关实施方案中的任一种相关的一个实施方案中,与安慰剂组或其基线相比,至少10%、20%、30%、40%、50%、60%、70%或80%的用本发明的抗il-36r抗体治疗的患者在第4周和/或第16周时实现湿疹面积及严重程度指数(easi)改善至少10%、至少20%、至少30%、至少40%或至少50%(easi50)。
119.在与以上方面或其相关实施方案中的任一种相关的一个实施方案中,与安慰剂组或其基线相比,至少10%、20%、30%、40%、50%、60%、70%或80%的用本发明的抗il-36r抗体治疗的患者在第4周和/或第16周时实现湿疹面积及严重程度指数(easi)改善至少75%(easi75)。
120.在与以上方面或其相关实施方案中的任一种相关的一个实施方案中,与安慰剂组或其基线相比,至少10%、20%、30%、40%、50%、60%、70%或80%的用本发明的抗il-36r抗体治疗的患者在第4周和/或第16周时经历异位性皮肤炎评分(scorad)改善至少10%、至少20%、至少30%、至少40%或至少50%。
121.在与以上方面或其相关实施方案中的任一种相关的一个实施方案中,与安慰剂或其基线相比,至少10%、20%、30%、40%、50%、60%、70%或80%的用本发明的抗il-36r抗体治疗的患者在第4周和/或第16周时实现研究者总体评定(iga)中至少2级降低至清除(0)或几乎清除(1)。
122.在与以上方面中的任一个相关的一个实施方案中,抗il-36r抗体包括:a)包含seq id no:26的氨基酸序列(l-cdr1);seq id no:35、102、103、104、105、106或140的氨基酸序列(l-cdr2);seq id no:44的氨基酸序列(l-cdr3)的轻链可变区;及b)包含seq id no:53或141的氨基酸序列(h-cdr1);seq id no:62、108、109、110、111或142的氨基酸序列(h-cdr2);seq id no:72的氨基酸序列(h-cdr3)的重链可变区。
123.在与以上方面中的任一个相关的一个实施方案中,在施用本发明的抗il-36r抗体之后,改善的效果(包括缓解或改善的症状)持续4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、20、21、22、23、24、25、26、27、28、29、30、31、32、33、34、35、36、37、38、39、40、41、42、43、44、45、46、47、48、49、50、51或52周。药物组合物及其给药
124.本发明的抗体可单独或与其他药剂组合施用。用于此类药物组合物中的抗体的实施例为包含具有seq id no:1至10中的任一种的轻链可变区氨基酸序列的抗体或抗体片段的那些者。用于此类药物组合物中的抗体的实施例还包含具有seq id no:11至20中的任一种的重链可变区氨基酸序列的人源化抗体或抗体片段的那些。
125.用于此类药物组合物中的抗体的其他实施例还包含具有seq id no:76至86中的任一种的轻链可变区氨基酸序列的人源化抗体或抗体片段的那些者。用于此类药物组合物中的优选抗体亦为包含具有seq id no:87至101中的任一种的重链可变区氨基酸序列的人
crit.ref.biomed.eng.14:201;buchwald等人,1980,surgery 88:507;saudek等人,1989,n.engl.j.med.321:574)。在另一实施方案中,可使用聚合材料。(参见例如medical applications of controlled release(langer及wise编,crc press,boca raton,fla.,1974);controlled drug bioavailability,drug product design and performance(smolen及ball编,wiley,new york,1984);ranger及peppas,1983,macromol.sci.rev.macromol.chem.23:61。还参见levy等人,1985,science 228:190;during等人,1989,ann.neurol.25:351;howard等人,1989,j.neurosurg.71:105)。其他控制释放系统论述于例如langer,见上文。
133.il-36r结合剂(例如,抗il-36r抗体)可以包含治疗有效量的结合剂及一种或多种药学上兼容的成分的药物组合物形式施用。
134.在一个实施方案中,抗il-36r抗体或其抗原结合片段(本文所公开)存在于根据本文所描述的方面中的任一个适用于向个体施用的药物制剂中(如描述于2020年3月5日申请的共同未决pct申请第pct/us2020/021059号中,其全部内容在此以全文引用的方式并入本文中)。为方便起见,此实施方案的各种实施例描述为如下经编号的条项(1、2、3等)。这些条项提供为实施例且并不限制本发明技术。应注意,附属条项中的任一种可以任何组合形式进行组合,且置放于各别独立条项,例如条项1中。其他条项可以类似方式呈现。1.一种用于治疗个体的异位性皮肤炎(atd)的方法;或一种预防或改善个体的atd的方法;或一种降低患有atd的个体的皮肤的微生物定殖的方法;或一种降低患有atd的个体对皮肤感染的易感性的方法;或一种治疗个体中与atd相关的皮肤病症的方法;或一种治疗个体中与atd相关的皮肤炎症的方法,所述方法包括向个体施用药物制剂中的抗il-36r抗体的给药方案;或一种药物制剂中的抗il-36r抗体,其用于治疗个体的异位性皮肤炎(atd);或一种药物制剂中的抗il-36r抗体,其用于预防或改善个体的atd;或一种药物制剂中的抗il-36r抗体,其用于降低患有atd的个体的皮肤的微生物定殖;或一种药物制剂中的抗il-36r抗体,其用于降低患有atd的个体对皮肤感染的易感性;或一种药物制剂中的抗il-36r抗体,其用于治疗个体中与atd相关的皮肤病症;或一种药物制剂中的抗il-36r抗体,其用于治疗个体中与atd相关的皮肤炎症;其包括向个体施用给药方案;或一种药物制剂中的抗il-36r抗体的用途,其用于制备用于治疗个体的异位性皮肤炎(atd)的药剂;或一种药物制剂中的抗il-36r抗体的用途,其用于制备用于预防或改善个体的atd的药剂;或一种药物制剂中的抗il-36r抗体的用途,其用于制备用于降低患有atd的个体的皮肤的微生物定殖的药剂;或一种药物制剂中的抗il-36r抗体的用途,其用于制备用于降低患有atd的个体对皮肤感染的易感性的药剂;或一种药物制剂中的抗il-36r抗体的用途,其用于制备用于治疗个体中与atd相关的皮肤病症的药剂;或一种药物制剂中的抗il-36r抗体的用途,其用于制备用于治疗个体中与atd相关的皮肤炎症的药剂;其包括向个体施用给药方案;其中抗il-36r抗体包括:a.包括示为seq id no:118的氨基酸序列的轻链及包括示为seq id no:125的氨基酸序列的重链;或b.包括示为seq id no:118的氨基酸序列的轻链及包括示为seq id no:126的氨
基酸序列的重链;或c.包括示为seq id no:118的氨基酸序列的轻链及包括示为seq id no:127的氨基酸序列的重链;其中药物制剂选自由以下组成的组:i.包括以下的制剂:约20mg/ml抗il-36r抗体、约40mm组氨酸、约120mm蔗糖、约50mm l-精氨酸、约5mm nacl及约1.0g/l聚山梨醇酯20,ph为约6.0;ii.包括以下的制剂:约60mg/ml抗il-36r抗体、约45mm乙酸盐、约150mm蔗糖、约25mm l-精氨酸、约0.4g/l聚山梨醇酯20,ph为约5.5;iii.包括以下的制剂:约20mg/ml抗il-36r抗体、约45mm乙酸盐、约180mm蔗糖、约25mm甘氨酸、约0.4g/l聚山梨醇酯80,ph为约5.5;iv.包括以下的制剂:约150mg/ml抗il-36r抗体、约25mm柠檬酸盐、约150mm海藻糖、约25mm甲硫氨酸、约0.2g/l聚山梨醇酯20,ph为约6.0;v.包括以下的制剂:约150mg/ml抗il-36r抗体、约25mm组氨酸、约180mm蔗糖、约20mm甘露糖醇、约0.2g/l聚山梨醇酯20,ph为约6.5;vi.包括以下的制剂:约20mg/ml抗il-36r抗体、约25mm柠檬酸盐、约200mm蔗糖、约0.4g/l聚山梨醇酯80,ph为约6.5;vii.包括以下的制剂:约150mg/ml抗il-36r抗体、约45mm乙酸盐、约150mm蔗糖、约25mm l-精氨酸、约0.4g/l聚山梨醇酯20,ph为约5.5;viii.包括以下的制剂:约15mg/ml抗il-36r抗体、约35mm组氨酸、约180mm海藻糖、约25mm l-精氨酸、约3mm nacl、约0.4g/l聚山梨醇酯80,ph为约6.0;ix.包括以下的制剂:约80mg/ml抗il-36r抗体、约25mm乙酸盐、约100mm甘露糖醇、约50mm nacl、约0.2g/l聚山梨醇酯20,ph为约5.5;x.包括以下的制剂:约100mg/ml抗il-36r抗体、约20mm丁二酸盐、约220mm蔗糖、约0.1g/l聚山梨醇酯80,ph为约6.0;及xi.包括以下的制剂:约60mg/ml抗il-36r抗体、约25mm柠檬酸盐、约0.4g/l聚山梨醇酯20,ph为约6.5;其中给药方案包括:a.每周一次(qw)、每2周一次(q2w)、每4周一次(q4w)、每6周一次(q6w)或每8周一次(q8w)皮下施用一个或多个300mg剂量或一个或多个600mg剂量的抗il-36r抗体;或b.以初始剂量及后续剂量皮下施用抗il-36r抗体;(i)其中初始剂量包括:i.每天施用一个或多个150mg剂量的抗il-36r抗体,持续2周;或ii.每天施用一个或多个300mg剂量的抗il-36r抗体,持续2周;或iii.一个或多个600mg剂量的抗il-36r抗体,4周内施用两次、三次或四次或每周施用两次持续2周、或每周施用两次持续3周、或每周施用两次持续4周;或iv.三周内仅施用一次或两次各一个或两个900mg或1200mg剂量的抗il-36r抗体;及(ii)其中后续剂量包括:i.q2w、q4w、q6w或q8w施用一个或多个300mg剂量的抗il-36r抗体;或
ii.q2w、q4w、q6w或q8w施用一个或多个600mg剂量的抗il-36r抗体;及(iii)其中后续剂量的施用在施用最后一个初始剂量之后2至4周之间或2周或4周。2.一种用于治疗个体的异位性皮肤炎(atd)的方法;或一种预防或改善个体的atd的方法;或一种降低患有atd的个体的皮肤的微生物定殖的方法;或一种降低患有atd的个体对皮肤感染的易感性的方法;或一种治疗个体中与atd相关的皮肤病症的方法;或一种治疗个体中与atd相关的皮肤炎症的方法,所述方法包括向个体施用药物制剂中的抗il-36r抗体的给药方案;或一种药物制剂中的抗il-36r抗体,其用于治疗个体的异位性皮肤炎(atd);或一种药物制剂中的抗il-36r抗体,其用于预防或改善个体的atd;或一种药物制剂中的抗il-36r抗体,其用于降低患有atd的个体的皮肤的微生物定殖;或一种药物制剂中的抗il-36r抗体,其用于降低患有atd的个体对皮肤感染的易感性;或一种药物制剂中的抗il-36r抗体,其用于治疗个体中与atd相关的皮肤病症;或一种药物制剂中的抗il-36r抗体,其用于治疗个体中与atd相关的皮肤炎症;其包括向个体施用给药方案;或一种药物制剂中的抗il-36r抗体的用途,其用于制备用于治疗个体的异位性皮肤炎(atd)的药剂;或一种药物制剂中的抗il-36r抗体的用途,其用于制备用于预防或改善个体的atd的药剂;或一种药物制剂中的抗il-36r抗体的用途,其用于制备用于降低患有atd的个体的皮肤的微生物定殖的药剂;或一种药物制剂中的抗il-36r抗体的用途,其用于制备用于降低患有atd的个体对皮肤感染的易感性的药剂;或一种药物制剂中的抗il-36r抗体的用途,其用于制备用于治疗个体中与atd相关的皮肤病症的药剂;或一种药物制剂中的抗il-36r抗体的用途,其用于制备用于治疗个体中与atd相关的皮肤炎症的药剂;其包括向个体施用给药方案;其中抗il-36r抗体包括:(i)包含seq id no:77的氨基酸序列的轻链可变区;及包含seq id no:87的氨基酸序列的重链可变区;或(ii)包含seq id no:77的氨基酸序列的轻链可变区;及包含seq id no:88的氨基酸序列的重链可变区;或(iii)包含seq id no:77的氨基酸序列的轻链可变区;及包含seq id no:89的氨基酸序列的重链可变区;或(iv)包含seq id no:80的氨基酸序列的轻链可变区;及包含seq id no:87的氨基酸序列的重链可变区;或(v)包含seq id no:80的氨基酸序列的轻链可变区;及包含seq id no:88的氨基酸序列的重链可变区;或(vi)包含seq id no:80的氨基酸序列的轻链可变区;及包含seq id no:89的氨基酸序列的重链可变区;其中制剂选自由以下组成的组:i.包括以下的制剂:约20mg/ml抗il-36r抗体、约40mm组氨酸、约120mm蔗糖、约50mm l-精氨酸、约5mm nacl及约1.0g/l聚山梨醇酯20,ph为约6.0;ii.包括以下的制剂:约60mg/ml抗il-36r抗体、约45mm乙酸盐、约150mm蔗糖、约
25mm l-精氨酸、约0.4g/l聚山梨醇酯20,ph为约5.5;iii.包括以下的制剂:约20mg/ml抗il-36r抗体、约45mm乙酸盐、约180mm蔗糖、约25mm甘氨酸、约0.4g/l聚山梨醇酯80,ph为约5.5;iv.包括以下的制剂:约150mg/ml抗il-36r抗体、约25mm柠檬酸盐、约150mm海藻糖、约25mm甲硫氨酸、约0.2g/l聚山梨醇酯20,ph为约6.0;v.包括以下的制剂:约150mg/ml抗il-36r抗体、约25mm组氨酸、约180mm蔗糖、约20mm甘露糖醇、约0.2g/l聚山梨醇酯20,ph为约6.5;vi.包括以下的制剂:约20mg/ml抗il-36r抗体、约25mm柠檬酸盐、约200mm蔗糖、约0.4g/l聚山梨醇酯80,ph为约6.5;vii.包括以下的制剂:约150mg/ml抗il-36r抗体、约45mm乙酸盐、约150mm蔗糖、约25mm l-精氨酸、约0.4g/l聚山梨醇酯20,ph为约5.5;viii.包括以下的制剂:约15mg/ml抗il-36r抗体、约35mm组氨酸、约180mm海藻糖、约25mm l-精氨酸、约3mm nacl、约0.4g/l聚山梨醇酯80,ph为约6.0;ix.包括以下的制剂:约80mg/ml抗il-36r抗体、约25mm乙酸盐、约100mm甘露糖醇、约50mm nacl、约0.2g/l聚山梨醇酯20,ph为约5.5;x.包括以下的制剂:约100mg/ml抗il-36r抗体、约20mm丁二酸盐、约220mm蔗糖、约0.1g/l聚山梨醇酯80,ph为约6.0;及xi.包括以下的制剂:约60mg/ml抗il-36r抗体、约25mm柠檬酸盐、约0.4g/l聚山梨醇酯20,ph为约6.5;其中给药方案包括:a.每周一次(qw)、每2周一次(q2w)、每4周一次(q4w)、每6周一次(q6w)或每8周一次(q8w)皮下施用一个或多个300mg剂量或一个或多个600mg剂量的抗il-36r抗体;或b.以初始剂量及后续剂量皮下施用抗il-36r抗体;(i)其中初始剂量包括:i.每天施用一个或多个150mg剂量的抗il-36r抗体,持续2周;或ii.每天施用一个或多个300mg剂量的抗il-36r抗体,持续2周;或iii.一个或多个600mg剂量的抗il-36r抗体,4周内施用两次、三次或四次或每周施用两次持续2周、或每周施用两次持续3周、或每周施用两次持续4周;或iv.三周内仅施用一次或两次各一个或两个900mg或1200mg剂量的抗il-36r抗体;及(ii)其中后续剂量包括:i.q2w、q4w、q6w或q8w施用一个或多个300mg剂量的抗il-36r抗体;或ii.q2w、q4w、q6w或q8w施用一个或多个600mg剂量的抗il-36r抗体;及(iii)其中后续剂量的施用在施用最后一个初始剂量之后2至4周之间或2周或4周。3.一种用于治疗个体的异位性皮肤炎(atd)的方法;或一种预防或改善个体的atd的方法;或一种降低患有atd的个体的皮肤的微生物定殖的方法;或一种降低患有atd的个体对皮肤感染的易感性的方法;或一种治疗个体中与atd相关的皮肤病症的方法;或一种治疗个体中与atd相关的皮肤炎症的方法,所述方法包括向个体施用药物制剂中的抗il-36r
抗体的给药方案;或一种药物制剂中的抗il-36r抗体,其用于治疗个体的异位性皮肤炎(atd);或一种药物制剂中的抗il-36r抗体,其用于预防或改善个体的atd;或一种药物制剂中的抗il-36r抗体,其用于降低患有atd的个体的皮肤的微生物定殖;或一种药物制剂中的抗il-36r抗体,其用于降低患有atd的个体对皮肤感染的易感性;或一种药物制剂中的抗il-36r抗体,其用于治疗个体中与atd相关的皮肤病症;或一种药物制剂中的抗il-36r抗体,其用于治疗个体中与atd相关的皮肤炎症;其包括向个体施用给药方案;或一种药物制剂中的抗il-36r抗体的用途,其用于制备用于治疗个体的异位性皮肤炎(atd)的药剂;或一种药物制剂中的抗il-36r抗体的用途,其用于制备用于预防或改善个体的atd的药剂;或一种药物制剂中的抗il-36r抗体的用途,其用于制备用于降低患有atd的个体的皮肤的微生物定殖的药剂;或一种药物制剂中的抗il-36r抗体的用途,其用于制备用于降低患有atd的个体对皮肤感染的易感性的药剂;或一种药物制剂中的抗il-36r抗体的用途,其用于制备用于治疗个体中与atd相关的皮肤病症的药剂;或一种药物制剂中的抗il-36r抗体的用途,其用于制备用于治疗个体中与atd相关的皮肤炎症的药剂;其包括向个体施用给药方案;其中抗il-36r抗体包括:a.包括示为seq id no:118的氨基酸序列的轻链及包括示为seq id no:127的氨基酸序列的重链;其中药物制剂选自由以下组成的组:i.包括以下的制剂:约20mg/ml抗il-36r抗体、约40mm组氨酸、约120mm蔗糖、约50mm l-精氨酸、约5mm nacl及约1.0g/l聚山梨醇酯20,ph为约6.0;ii.包括以下的制剂:约60mg/ml抗il-36r抗体、约45mm乙酸盐、约150mm蔗糖、约25mm l-精氨酸、约0.4g/l聚山梨醇酯20,ph为约5.5;iii.包括以下的制剂:约20mg/ml抗il-36r抗体、约45mm乙酸盐、约180mm蔗糖、约25mm甘氨酸、约0.4g/l聚山梨醇酯80,ph为约5.5;iv.包括以下的制剂:约150mg/ml抗il-36r抗体、约25mm柠檬酸盐、约150mm海藻糖、约25mm甲硫氨酸、约0.2g/l聚山梨醇酯20,ph为约6.0;v.包括以下的制剂:约150mg/ml抗il-36r抗体、约25mm组氨酸、约180mm蔗糖、约20mm甘露糖醇、约0.2g/l聚山梨醇酯20,ph为约6.5;vi.包括以下的制剂:约20mg/ml抗il-36r抗体、约25mm柠檬酸盐、约200mm蔗糖、约0.4g/l聚山梨醇酯80,ph为约6.5;vii.包括以下的制剂:约150mg/ml抗il-36r抗体、约45mm乙酸盐、约150mm蔗糖、约25mm l-精氨酸、约0.4g/l聚山梨醇酯20,ph为约5.5;viii.包括以下的制剂:约15mg/ml抗il-36r抗体、约35mm组氨酸、约180mm海藻糖、约25mm l-精氨酸、约3mm nacl、约0.4g/l聚山梨醇酯80,ph为约6.0;ix.包括以下的制剂:约80mg/ml抗il-36r抗体、约25mm乙酸盐、约100mm甘露糖醇、约50mm nacl、约0.2g/l聚山梨醇酯20,ph为约5.5;x.包括以下的制剂:约100mg/ml抗il-36r抗体、约20mm丁二酸盐、约220mm蔗糖、约0.1g/l聚山梨醇酯80,ph为约6.0;及
xi.包括以下的制剂:约60mg/ml抗il-36r抗体、约25mm柠檬酸盐、约0.4g/l聚山梨醇酯20,ph为约6.5;其中给药方案包括:a.每周一次(qw)、每2周一次(q2w)、每4周一次(q4w)、每6周一次(q6w)或每8周一次(q8w)皮下施用一个或多个300mg剂量或一个或多个600mg剂量的抗il-36r抗体;或b.以初始剂量及后续剂量皮下施用抗il-36r抗体;(iv)其中初始剂量包括:i.每天施用一个或多个150mg剂量的抗il-36r抗体,持续2周;或ii.每天施用一个或多个300mg剂量的抗il-36r抗体,持续2周;或iii.一个或多个600mg剂量的抗il-36r抗体,4周内施用两次、三次或四次或每周施用两次持续2周、或每周施用两次持续3周、或每周施用两次持续4周;或iv.三周内仅施用一次或两次各一个或两个900mg或1200mg剂量的抗il-36r抗体;及(v)其中后续剂量包括:i.q2w、q4w、q6w或q8w施用一个或多个300mg剂量的抗il-36r抗体;或ii.q2w、q4w、q6w或q8w施用一个或多个600mg剂量的抗il-36r抗体;及(vi)其中后续剂量的施用在施用最后一个初始剂量之后2至4周之间、2周或4周。4.一种用于治疗个体的异位性皮肤炎(atd)的方法;或一种预防或改善个体的atd的方法;或一种降低患有atd的个体的皮肤的微生物定殖的方法;或一种降低患有atd的个体对皮肤感染的易感性的方法;或一种治疗个体中与atd相关的皮肤病症的方法;或一种治疗个体中与atd相关的皮肤炎症的方法,所述方法包括向个体施用药物制剂中的抗il-36r抗体的给药方案;或一种药物制剂中的抗il-36r抗体,其用于治疗个体的异位性皮肤炎(atd);或一种药物制剂中的抗il-36r抗体,其用于预防或改善个体的atd;或一种药物制剂中的抗il-36r抗体,其用于降低患有atd的个体的皮肤的微生物定殖;或一种药物制剂中的抗il-36r抗体,其用于降低患有atd的个体对皮肤感染的易感性;或一种药物制剂中的抗il-36r抗体,其用于治疗个体中与atd相关的皮肤病症;或一种药物制剂中的抗il-36r抗体,其用于治疗个体中与atd相关的皮肤炎症;其包括向个体施用给药方案;或一种药物制剂中的抗il-36r抗体的用途,其用于制备用于治疗个体的异位性皮肤炎(atd)的药剂;或一种药物制剂中的抗il-36r抗体的用途,其用于制备用于预防或改善个体的atd的药剂;或一种药物制剂中的抗il-36r抗体的用途,其用于制备用于降低患有atd的个体的皮肤的微生物定殖的药剂;或一种药物制剂中的抗il-36r抗体的用途,其用于制备用于降低患有atd的个体对皮肤感染的易感性的药剂;或一种药物制剂中的抗il-36r抗体的用途,其用于制备用于治疗个体中与atd相关的皮肤病症的药剂;或一种药物制剂中的抗il-36r抗体的用途,其用于制备用于治疗个体中与atd相关的皮肤炎症的药剂;其包括向个体施用给药方案;其中抗il-36r抗体包括:(i)包含seq id no:80的氨基酸序列的轻链可变区;及包含seq id no:89的氨基酸序列的重链可变区;
其中制剂选自由以下组成的组:i.包括以下的制剂:约20mg/ml抗il-36r抗体、约40mm组氨酸、约120mm蔗糖、约50mm l-精氨酸、约5mm nacl及约1.0g/l聚山梨醇酯20,ph为约6.0;ii.包括以下的制剂:约60mg/ml抗il-36r抗体、约45mm乙酸盐、约150mm蔗糖、约25mm l-精氨酸、约0.4g/l聚山梨醇酯20,ph为约5.5;iii.包括以下的制剂:约20mg/ml抗il-36r抗体、约45mm乙酸盐、约180mm蔗糖、约25mm甘氨酸、约0.4g/l聚山梨醇酯80,ph为约5.5;iv.包括以下的制剂:约150mg/ml抗il-36r抗体、约25mm柠檬酸盐、约150mm海藻糖、约25mm甲硫氨酸、约0.2g/l聚山梨醇酯20,ph为约6.0;v.包括以下的制剂:约150mg/ml抗il-36r抗体、约25mm组氨酸、约180mm蔗糖、约20mm甘露糖醇、约0.2g/l聚山梨醇酯20,ph为约6.5;vi.包括以下的制剂:约20mg/ml抗il-36r抗体、约25mm柠檬酸盐、约200mm蔗糖、约0.4g/l聚山梨醇酯80,ph为约6.5;vii.包括以下的制剂:约150mg/ml抗il-36r抗体、约45mm乙酸盐、约150mm蔗糖、约25mm l-精氨酸、约0.4g/l聚山梨醇酯20,ph为约5.5;viii.包括以下的制剂:约15mg/ml抗il-36r抗体、约35mm组氨酸、约180mm海藻糖、约25mm l-精氨酸、约3mm nacl、约0.4g/l聚山梨醇酯80,ph为约6.0;ix.包括以下的制剂:约80mg/ml抗il-36r抗体、约25mm乙酸盐、约100mm甘露糖醇、约50mm nacl、约0.2g/l聚山梨醇酯20,ph为约5.5;x.包括以下的制剂:约100mg/ml抗il-36r抗体、约20mm丁二酸盐、约220mm蔗糖、约0.1g/l聚山梨醇酯80,ph为约6.0;及xi.包括以下的制剂:约60mg/ml抗il-36r抗体、约25mm柠檬酸盐、约0.4g/l聚山梨醇酯20,ph为约6.5;其中给药方案包括:a.每周一次(qw)、每2周一次(q2w)、每4周一次(q4w)、每6周一次(q6w)或每8周一次(q8w)皮下施用一个或多个300mg剂量或一个或多个600mg剂量的抗il-36r抗体;或b.以初始剂量及后续剂量皮下施用抗il-36r抗体;(i)其中初始剂量包括:i.每天施用一个或多个150mg剂量的抗il-36r抗体,持续2周;或ii.每天施用一个或多个300mg剂量的抗il-36r抗体,持续2周;或iii.一个或多个600mg剂量的抗il-36r抗体,4周内施用两次、三次或四次或每周施用两次持续2周、或每周施用两次持续3周、或每周施用两次持续4周;或iv.三周内仅施用一次或两次各一个或两个900mg或1200mg剂量的抗il-36r抗体;及(ii)其中后续剂量包括:i.q2w、q4w、q6w或q8w施用一个或多个300mg剂量的抗il-36r抗体;或ii.q2w、q4w、q6w或q8w施用一个或多个600mg剂量的抗il-36r抗体;及(iii)其中后续剂量的施用在施用最后一个初始剂量之后2至4周之间或2周或4周。
5.如条项1至5中任一项的方法、供使用的抗il36r抗体或用于制备的用途,其中定殖属于选自由以下组成的组的微生物:金黄色葡萄球菌、链球菌属、铜绿假单胞菌、拟杆菌属、传染性软疣病毒、单纯疱疹病毒、柯萨奇病毒、牛痘病毒、白色念珠菌、小孢子菌属、毛癣菌属、青霉菌属、枝孢菌属、链格孢菌及曲霉属。6.如条项5的方法、供使用的抗il36r抗体或用于制备的用途,其中微生物为金黄色葡萄球菌。7.如条项6的方法、供使用的抗il36r抗体或用于制备的用途,其中金黄色葡萄球菌定殖相对于基线减少至少20%。8.如条项1至5中任一项的方法、供使用的抗il36r抗体或用于制备的用途,其中皮肤感染为由选自由以下组成的组的微生物引起:金黄色葡萄球菌、链球菌属、铜绿假单胞菌、拟杆菌属、单纯疱疹病毒、传染性软疣病毒、柯萨奇病毒、牛痘病毒、白色念珠菌、小孢子菌属、毛癣菌属、青霉菌属、枝孢菌属、链格孢菌及曲霉属。9.如条项8的方法、供使用的抗il36r抗体或用于制备的用途,其中微生物为金黄色葡萄球菌。10.如条项1至5中任一项的方法、供使用的抗il36r抗体或用于制备的用途,其中第二治疗剂为在抗il-36r抗体之前、之后或与其同时向个体施用。11.如条项10的方法、供使用的抗il36r抗体或用于制备的用途,其中第二治疗剂选自由以下组成的组:抗细菌剂、抗病毒剂、抗真菌剂、抗il-36r抗体、ige抑制剂、皮质类固醇、非类固醇抗炎药(nsaid)、il-4r拮抗剂及ifn-γ。12.如条项1至5的方法、供使用的抗il36r抗体或用于制备的用途,其中药物制剂在小瓶、具有或不具有针安全装置的注射器或自动注射器中。13.如条项12的方法、供使用的抗il36r抗体或用于制备的用途,其中自动注射器或具有针安全装置的注射器包括:a.呈约2ml调配体积的约300mg的抗体;或b.呈约1.5ml调配体积的约225mg的抗体;或c.呈约1ml调配体积的约150mg的抗体;或d.呈约0.5ml调配体积的约75mg的抗体;或e.呈约0.4ml调配体积的约60mg的抗体。14.如条项12的方法、供使用的抗il36r抗体或用于制备的用途,其中小瓶包括:a.呈约20ml调配体积的约1200mg的抗体;或b.呈约15ml调配体积的约900mg的抗体;或c.呈约10ml调配体积的约600mg的抗体;或d.呈约150ml调配体积的约300mg的抗体;或e.呈约2.5ml调配体积的约1500mg的抗体。15.如条项1至5中任一项的方法、供使用的抗il36r抗体或用于制备的用途,其中治疗引起个体的改善;其中改善通过选自由以下组成的组的终点来判定:(i)在治疗之后16周时湿疹面积及严重程度指数(easi)评分的正面变化;(ii)在治疗之后16周时达到easi50;(iii)在治疗之后第16周达到easi 75;及(iv)异位性皮肤炎评分(scorad)、最大瘙痒强度或皮肤病生活质量指数(dlqi)的正面变化。
16.如前述条项中任一项的方法、供使用的抗il36r抗体或用于制备的用途,其中与基线处或在治疗之前的个体的病状相比或与安慰剂相比,治疗引起个体的以下结果中的一个或多个:i.在4和/或16周时湿疹面积及严重程度指数(easi)评分改善至少10%;ii.在4和/或16周时达到easi 50的患者的比例改善至少10%;iii.在4和/或16周时达到easi 75的患者的比例改善至少10%;iv.scorad、最大瘙痒强度及dlqi改善至少10%;v.直至第44周具有药物相关不良事件(ae)的患者数量改善至少10%;vi.第4周的湿疹面积及严重程度指数(easi)相对于基线的绝对值及百分比变化改善至少10%;vii.第4周和/或第16周的湿疹面积及严重程度指数(easi)改善50%(easi50)的患者比例改善至少10%;viii.第4周和/或第16周的湿疹面积及严重程度指数(easi)改善75%(easi75)的患者比例改善至少5%;ix.第4周和/或第16周的异位性皮肤炎评分(scorad)改善至少10%;x.第4周和/或第16周时实现研究者总体评定(iga)中至少2级降低至清除(0)或几乎清除(1)的患者比例改善至少5%;xi.第16周的easi评分相对于基线的百分比变化的至少10个百分点差异;xii.第16周的easi50反应率的至少10个百分点差异;xiii.第16周的easi75反应率的至少5个百分点差异;xiv.第16周的scorad、最大瘙痒强度及dlqi相对于基线的百分比变化的至少10个百分点差异;xv.第44周的湿疹面积及严重程度指数(easi)相对于基线的百分比变化的至少10个百分点差异;或xvi.第16周的iga率的至少5个百分点差异。
164.此外,药物组合物可以药物试剂盒形式提供,其包含(a)含有呈冻干形式的il-36r结合剂(例如,抗il-36r抗体)的容器;及(b)含有供注射用的药学上可接受的稀释剂(例如,无菌水)的第二容器。药学上可接受的稀释剂可用于对冻干抗il-36r抗体或药剂进行复原或稀释。任选与此类容器相关的可为由管理药物或生物产品的制造、使用或销售的政府机构所规定的形式的注意事项,该注意事项反映由人类给药的制造、使用或销售机构的批准。组合疗法
165.根据某些实施方案,本发明的方法包括将一种或多种额外治疗剂与抗il-36r抗体组合向个体施用。如本文所使用,表述“与
…
组合”意指在包含抗il-36r抗体的药物组合物之前、之后或与其同时施用额外治疗剂。术语“与
…
组合”还包括抗il-36r抗体与第二治疗剂的依序或同时施用。
166.例如,当在包含抗il-36r抗体的药物组合物“之前”施用时,额外治疗剂可在施用包含抗il-36r抗体的药物组合物之前约72小时、约60小时、约48小时、约36小时、约24小时、约12小时、约10小时、约8小时、约6小时、约4小时、约2小时、约1小时、约30分钟、约15分钟或约10分钟施用。当在包含抗il-36r抗体的药物组合物“之后”施用时,额外治疗剂可在施用
包含抗il-36r抗体的药物组合物之后约10分钟、约15分钟、约30分钟、约1小时、约2小时、约4小时、约6小时、约8小时、约10小时、约12小时、约24小时、约36小时、约48小时、约60小时或约72小时施用。与包含抗il-36r抗体的药物组合物“同时”施用意指额外治疗剂为在施用包含抗il-36r抗体的药物组合物少于5分钟内(之前、之后或同时)以各别剂型向个体施用或以包含额外治疗剂及抗il-36r抗体的单一组合剂型向个体施用。
167.额外治疗剂可为例如抗细菌剂(包括局部及全身性抗生素、广谱及窄谱抗生素)、抗病毒剂(例如,阿昔洛韦(acyclovir)或膦甲酸(foscarnet))、抗真菌剂(例如,氟康唑(fluconazole)及硝酸益康唑(econazole nitrate))、il-4r拮抗剂、ige拮抗剂、干扰素-γ(ifnγ)抗生素、局部防腐洗剂或任何其他润肤剂治疗或其组合。
168.本发明的方法包括与用于添加剂或协同活性的第二治疗剂组合施用抗il-36r抗体或其抗原结合片段(本文所公开)以降低例如患有atd的患者中皮肤感染的风险。
169.根据本发明的某些实施方案,可历经限定时程向个体施用单次或多次剂量的抗il-36r抗体。根据本发明的此方面的方法包括向个体依序施用多次剂量的抗il-36r抗体。如本文所使用,“依序施用”意指在不同时间点,例如在相隔预定时间间隔(例如数小时、数天、数周或数月)的不同日子向个体施用各剂量的抗il-36r抗体。本发明包括如下方法,其包括向患者依序施用单一初始剂量的抗il-36r抗体,随后施用一个或多个后续剂量的抗il-36r抗体。
170.在本发明的一个示例性实施方案中,以包含在前一剂量之后的数小时、数天、数周或数月的预定时间间隔施用各后续剂量。如本文所使用,词组“前一剂量”意指在多次施用序列中,在施用该序列中的下一剂量之前向患者施用的抗il-36r抗体的剂量,没有中间剂量。
171.根据本发明的此方面的方法可包括向患者施用任何数目之后续剂量的抗il-36r抗体。例如,在某些实施方案中,仅向患者施用单一第二剂量。在其他实施方案中,向患者施用一个或多个(例如2、3、4、5、6、7、8或更多个)后续剂量。
172.给药或给药方案
173.根据本发明的某些实施方案,可历经限定时程向个体施用单次或多次剂量的抗il-36r抗体。根据本发明的此方面的方法包括向个体依序施用多次剂量的抗il-36r抗体。如本文所使用,“依序施用”意指在不同时间点,例如在相隔预定时间间隔(例如数小时、数天、数周或数月)的不同日子向个体施用各剂量的抗il-36r抗体。本发明包括如下方法,其包括向患者依序施用单一初始剂量的抗il-36r抗体,随后施用一个或多个后续剂量的抗il-36r抗体。
174.在本发明的一个示例性实施方案中,以包含在前一剂量之后的数小时、数天、数周或数月的预定时间间隔施用各后续剂量。如本文所使用,词组“前一剂量”意指在多次施用序列中,在施用该序列中的下一剂量之前向患者施用的抗il-36r抗体的剂量,没有中间剂量。
175.根据本发明的此方面的方法可包括向患者施用任何数目之后续剂量的抗il-36r抗体。例如,在某些实施方案中,仅向患者施用单一第二剂量。在其他实施方案中,向患者施用一个或多个(例如2、3、4、5、6、7、8或更多个)后续剂量。
176.在与本发明的任何方面或实施方案相关的一个实施方案中,给药方案为表1及表2
中所列的方案中的任一种。在另一实施方案中,给药方案包括:(a)每周一次(qw)、每2周一次(q2w)、每4周一次(q4w)、每6周一次(q6w)或每8周一次(q8w)皮下施用一个或多个300mg剂量或一个或多个600mg剂量的抗il-36r抗体;或(b)以初始剂量及后续剂量皮下施用抗il-36r抗体;(i)其中初始剂量包括:(1)每天施用一个或多个150mg剂量的抗il-36r抗体,持续2周;或(2)每天施用一个或多个300mg剂量的抗il-36r抗体,持续2周;或(3)一个或多个600mg剂量的抗il-36r抗体,4周内施用两次、三次或四次或每周施用两次持续2周、或每周施用两次持续3周、或每周施用两次持续4周;或(4)施用一次一个900mg或1200mg剂量的抗il-36r抗体;或(5)三周内(例如,第0周及第2周)施用两次各两个900mg或1200mg剂量的抗il-36r抗体;(ii)其中后续剂量包括:(1)q2w、q4w、q6w或q8w施用一个或多个300mg剂量的抗il-36r抗体;或(2)q2w、q4w、q6w或q8w施用一个或多个600mg剂量的抗il-36r抗体;且(iii)其中后续剂量的施用在施用最后一个初始剂量之后2至4周之间。制品
177.在另一方面中,包括含有适用于治疗上文所描述病症的材料的制品。制品包含容器及标签。适合的容器包括(例如)瓶子、小瓶、注射器及试管。容器可由多种材料(例如玻璃或塑料)形成。容器容纳有效治疗病状的组合物且可具有无菌接取口。例如,容器可为具有可通过皮下注射针刺穿的塞子的静脉内溶液袋或小瓶。组合物中的活性剂为人源化抗il-36r抗体。容器上或与容器相关的卷标指示该组合物用于治疗所选病状。制品可进一步包括第二容器,该第二容器包含药学上可接受的缓冲液,例如磷酸盐缓冲盐水、林格氏溶液(ringer's solution)及右旋糖溶液。其可进一步包括自商业及使用者的观点来看合乎需要的其他材料,包括其他缓冲液、稀释剂、过滤器、针、注射器及带有使用说明书的药品说明书。
178.本发明在以下实施例中进一步加以描述,其不意图限值本发明的范围。实施例实施例1:小鼠抗il36r阻断抗体在抑制小鼠中异位性皮肤炎样皮肤炎症方面的治疗活性
179.先前发现金黄色葡萄球菌上表皮暴露于小鼠皮肤诱导异位性皮肤炎(atd)样炎症,该炎症视il-36受体(il-36r)活性而定且可通过皮下施用il-36r ab抑制。然而,用抗il-36r阻断单克隆抗体(mab)全身性治疗是否可通过减少il-36依赖型金黄色葡萄球菌诱导的皮肤炎症而具有治疗效果尚不明确。
180.在此实施例中,我们评估了本发明的il-36r阻断mab在抑制由金黄色葡萄球菌上表皮暴露于小鼠皮肤诱导的atd样炎症方面的功效。通过在背侧皮肤上施用金黄色葡萄球菌(1
×
10^8cfu)浸泡的纱布垫7天进行金黄色葡萄球菌上表皮暴露,同时在第1、2及5天用抗il-36r阻断mab或同型对照mab的全身性给药(腹膜内)处理小鼠。
181.如图3及图4中所示,抗il-36r阻断mab治疗导致ad样皮肤炎症显著减少,如通过由盲化观察的疾病评分(水肿、红斑、坏死及脱皮)及由组织学切片定量的表皮厚度所测量。这些资料证明全身性递送的抗il-36r阻断抗体在由上表皮暴露于金黄色葡萄球菌诱导的ad样炎症的小鼠模型中减少皮肤炎症的能力。实施例2:抑制来自il-36γ刺激的经重建构的人类表皮的il-8产生方案经重建构的表皮
182.将抗il-36r抗体(1.5μg/ml)与经重建构的人类表皮一起预培育且用人类重组il-36γ(20ng/ml)刺激。重组人类il-1β(20ng/ml;r&d系统)用作阳性对照。在培养物中24小时之后,收集细胞上清液且分析il-8(il-8的分析描述于实施例3中)。一式三份地测试样品且平均pg/ml
±
标准误差显示于下表(表3)中。表3.实施例3:抑制经重建构的人类表皮中il-36配位体诱导的s100a7及s100a12基因表达
183.用促效il-36配位体刺激经重建构的人类表皮诱导s100a7及s100a12基因表达。s100a7及s100a12为位于表皮分化复合物内的基因。方案:将经重建构的人类表皮与抗il-36r抗体(1.5μg/ml)一起预培育且用人类重组il-36γ(20ng/ml)刺激。重组人类il-1β(20ng/ml;r&d系统)用作阳性对照。在5% co2及37℃下在培养物中24小时之后,自经重建构的人类表皮分离rna且通过实时逆转录酶-聚合酶链反应分析基因表达。使用2-δδct
方法计算相对表达。一式三份地测试样品且平均表达
±
标准误差显示于下表(表4)中。表4.实施例4:在人类皮肤活检体中通过原位杂交(ish)技术论证il-36配位体/受体表达
184.来自异位性皮肤炎及非atd健康对照组的福尔马林固定石蜡包埋(ffpe)皮肤活检体为购自供货商且使用ish探针,对il-36α,β,γ及il-36r进行染色。il36r以及il36α,γ的表达增加见于异位性皮肤炎皮肤样品中,主要在表皮中,在真皮细胞的亚群中具有偶发性/罕见表达。参见图2。实施例5:i期、多中心、随机、双盲、多剂量、安慰剂对照的平行组研究以评定在患有异位性皮肤炎的患者中用本发明的抗体进行16周治疗的安全性、耐受性、药物动力学及功效
185.在此实施例中,向患有异位性皮肤炎的患者施用本发明的化合物或产品且测定化
合物或产品在患有异位性皮肤炎(atd)的患者中的安全性、耐受性、药物动力学及功效。给药模式:iv、sc纳入准则:
●
患有慢性atd至少3年的成人(easi≥16、iga≥3、10%≥bsa)
●
nrs的最大瘙痒强度≥3
●
记录对局部皮质类固醇的不充分反应且能够在随机分组之前至少14天停止tcs排除准则
·
在无适当清除期的情况下使用针对atd的局部或全身性皮质类固醇或其他药剂
·
需要抗生素治疗的活动性感染
·
妊娠、哺乳或计划在试验同时怀孕的女性。
·
重度、进行性或不受控制的肾脏、肝脏、血液科、内分泌、肺、心脏、神经、大脑或精神疾病或其病征及症状。
·
具有移植器官(筛选之前》12周,角膜移植除外)或曾经接受干细胞疗法(例如,prochymal)的患者。
·
包括淋巴瘤的淋巴增生疾病的已知病史,或暗示可能的淋巴增生疾病的病征及症状,例如淋巴腺病和/或脾肿大。
·
在筛选访视之前5年内有任何经记载的活动性或疑似恶性疾病或恶性疾病史,除经适当治疗的皮肤的基底或鳞状细胞癌或子宫颈的原位癌外。
·
先前为了预防过敏性反应已经历过敏免疫疗法的患者。
·
使用如表4.2.2.1:1中所指定的任何受限药疗或如研究人员所评定,被认是有可能会干扰研究的安全进行的任何药物。
·
在研究时段期间或在随机分组之前6周内计划施用活毒疫苗。
·
有对全身性地施用生物剂或其赋形剂过敏/超敏的病史。
·
如研究人员所评定,在随机分组之前的最后2周期间出现活动性全身性感染(例外:感冒)。
·
有慢性或相关急性感染,包括人类免疫缺乏病毒(hiv)、病毒性肝炎及(或)活动性或潜伏肺结核(排除具有阳性quantiferon tb测试的患者。具有疑似假阳性或未可测定的quantiferon tb结果的患者可再测试)。
·
如研究人员所评定,在随机分组之前12周内进行或在随机分组之后32周内计划大手术(例如,髋置换、动脉瘤移除、胃结扎)。
·
在筛选时,总白血球计数(wbc)《3,000/μl,或血小板《100,000/μl,或嗜中性白血球《1,500/μl,或血红蛋白《8.5g/dl。
·
在筛选时,天冬氨酸转氨酶(ast)或丙氨酸转氨酶(alt)》2
×
正常值上限,或总胆红素》1.5
×
正常值上限(不排除患有吉尔伯特氏综合征(gilbert's syndrome)的患者)。
·
当前入选另一研究性装置或药物研究,或自另一研究性装置或药物研究结束小于30天,或正接受其他研究性处理。
·
长期酒精或药物滥用或在研究人员看来,使得所述患者成为不可靠研究个体或不大可能完成试验的任何病状。终点:
186.以下终点为评定安全性及功效和/或相对于安慰剂或基线的改善的量度:4及16周时easi评分的变化;4及16周时达到easi 50的患者比例;4及16周时达到easi 75的患者比例;scorad、最大瘙痒强度及dlqi的变化。安全性准则:
187.不良事件、生命体征、身体检查、ecg及临床实验室参数。实施例6:治疗患有atd的患者
188.在此实施例中,本发明的抗il36r抗体用于治疗患有atd的患者。在施用抗il-36r抗体之后,安全性及功效评定公开如下:至少10%、11%、12%、13%、14%、15%、16%、17%、18%、19%、20%、21%、22%、23%、24%、25%、26%、27%、28%、29%、30%、31%、32%、33%、34%、35%、36%、37%、38%、39%、40%、41%、42%、43%、44%、45%、46%、47%、48%、49%、50%、51%、52%、53%、54%、55%、56%、57%、58%、59%、60%、61%、62%、63%、64%、65%、66%、67%、68%、69%、70%、71%、72%、73%、74%、75%、76%、77%、78%、79%、80%、81%、82%、83%、84%、85%、86%、87%、88%、89%或90%的atd患者对于实施例7中或权利要求书中所列的终点显示相对于基线或相较于安慰剂的改善。实施例7:iia期、多中心、随机、双盲、安慰剂对照的研究以评估患有中度至重度异位性皮肤炎的成年患者中用bi 655130(佩索利单抗)治疗的安全性、耐受性及功效
189.在此实施例中,向患有中度至重度异位性皮肤炎的成年患者施用本发明的化合物或产品且测量以下结果。主要结果测量:
190.第16周时湿疹面积及严重程度指数(easi)评分相对于基线的百分比变化[时间范围:基线及第16周]次要结果测量:
[0191]
具有药物相关不良事件(ae)的患者数量[时间范围:直至第44周]
[0192]
第4周时湿疹面积及严重程度指数(easi)相对于基线的绝对值及百分比变化[时间范围:基线及第4周]
[0193]
第4周及第16周时湿疹面积及严重程度指数(easi)相对于基线改善50%(easi50)的患者比例[时间范围:基线、第4周及第16周]
[0194]
第4周及第16周时湿疹面积及严重程度指数(easi)相对于基线改善75%(easi75)的患者比例[时间范围:基线、第4周及第16周]
[0195]
第4周及第16周时异位性皮肤炎评分(scorad)相对于基线的变化[时间范围:基线、第4周及第16周]
[0196]
第4周及第16周时实现研究者总体评定(iga)中相对于基线至少2级降低至清除(0)或几乎清除(1)的患者比例[时间范围:基线、第4周及第16周]给药模式:iv、sc纳入准则:-在任何筛选程序开始之前,根据优良临床实验规范(gcp)及本地法规书面签署知情同意书且注明日期-男性或女性患者,18至75岁(在筛选时)-诊断异位性皮肤炎至少1年-中度至重度异位性皮肤炎定义为:
‑‑
在筛选及基线时至少10%体表面积(bsa)的异位性皮肤炎受累
‑‑
湿疹面积及严重程度指数(easi)在筛选时为至少12及在基线时为至少16
‑‑
研究者总体评定(iga)在筛选及基线时为至少3-对局部皮质类固醇的不充分反应的经记载病史,如通过研究人员所判断-愿意使用标准润肤剂持续研究的持续时间-有生育潜力的女性(wocbp)必须准备好且能够使用根据ich m3(r2)的高效节育方法,当持续且恰当地使用时,其引起每年小于1%的低失败率。在患者信息中提供符合这些准则的避孕方法清单。排除准则:-在第一次给予试验治疗之前7天内使用针对异位性皮肤炎的局部皮质类固醇或其他药剂。-在第一次给予试验治疗之前4周内使用针对异位性皮肤炎的全身性皮质类固醇或其他药剂。-妊娠、哺乳或计划在试验同时怀孕的女性。在研究药物给药之前停止哺乳的女性不需要自参与排除;其应在最后一次研究药物给药之后至多16周避免母乳哺育-具有移植器官(筛选之前》12周,角膜移植除外)或曾经接受干细胞疗法(例如,prochymal)的患者。-在筛选访视之前5年内有任何经记载的活动性或疑似恶性疾病或恶性疾病史,除经适当治疗的皮肤的鳞状细胞癌或子宫颈的原位癌外。-使用任何受限药疗或如研究人员所评定,被认是有可能会干扰研究的安全进行的任何药物。-有对全身性地施用试验药疗剂或其赋形剂过敏/超敏的病史。-根据研究人员评定,在第一次药物给药之前的最后2周期间的活动性全身性感染(真菌及细菌疾病)。-包括人类免疫缺乏病毒(hiv)或病毒性肝炎的相关慢性或急性感染(例外:感冒)。若患者经治疗且自急性感染治愈,则可重新筛选患者。-活动性或潜伏性肺结核(tb):
‑‑
排除患有活动性肺结核的患者。
‑‑
除非以下,否则排除在筛选期间具有阳性quantiferon tb测试的患者:
‑‑‑
患者先前诊断为活动性或潜伏性tb且在最近3年内及根据此方案第一次施用试验药物之前至少6个月根据本地实践/指南已完成适当治疗(患者可重新筛选一次以符合此规则)
‑‑‑
具有疑似假阳性或不确定quantiferon tb结果的患者可重新测试一次
‑‑‑
若在重复测试之后quantiferon tb测试结果不可用或提供不确定结果:结核菌素皮肤测试反应≥10mm(若接受≥15mg/d普赖松或其等效物,则≥5mm)视为阳性且将排除患者。-当前入选另一研究性装置或药物试验,或自另一研究性装置或药物试验结束小
于30天,或正接受其他研究性处理。-当前或先前疾病、除ad以外的医学病状(包括慢性酒精或药物滥用或任何病状)、手术程序、精神病学或社会问题、医学检查发现(包括生命体征及ecg)或参考范围以外的筛选时的实验室值的证据在研究人员看来在临床上显著且将使研究参与者不可靠地遵守方案,遵守所有研究访视/程序或完成试验,损害患者的安全性或损害数据的质量。-在第一次研究药物给药之前的12周内进行或在研究期间计划大手术(主要根据研究人员)(例如,髋置换、动脉瘤移除、胃结扎)。-重度、进行性或不受控制的肝病,定义为ast或alt或碱性磷酸酶的正常值上限(uln)升高》3倍,或总胆红素的uln升高》2倍。结果概述
[0197]
在iia期、随机、双盲、安慰剂对照的试验1368.32中,51名患有中度至重度异位性皮肤炎的患者历经16周(主要分析的时间点)的时段每4周静脉内用600mg佩索利单抗(33名患者)安慰剂(18名患者)治疗。试验仍在开放标记扩展阶段中进行,但来自第16周的主要分析的初步资料为可用的。
[0198]
在16周的治疗之后easi评分相对于基线的百分比变化显示600mg佩索利单抗的临床上有意义的治疗效果:与安慰剂的调整平均差异为-25.6%(90% ci-54.9%,3.7%)。结果指示il-36在ad中起作用且佩索利单抗可是有效治疗选择。ae频率及实验室值不存在相关差异,佩索利单抗具有良好耐受性,且未在试验1368.32中识别安全信号。临床资料配置及人口统计数据
[0199]
在iia期、随机、双盲、安慰剂对照的试验1368.32中,进入51名患有中度至重度异位性皮肤炎的患者。患者以2:1分配比例随机分组且历经16周(主要分析的时间点)的时段每4周静脉内接受600mg佩索利单抗(33名经治疗患者)或安慰剂(18名经治疗患者)。在16周的治疗之后,可将无反应患者重新分配给佩索利单抗开放标记治疗再持续至多16周。试验仍在此开放标记阶段中进行,但来自第16周的主要分析的初步资料为可用的。
[0200]
在中期分析时,安慰剂组中8名患者(44.4%)及佩索利单抗组中22名患者(66.7%)已完成16周的双盲治疗。过早中断试验药物的最常见原因为不良事件(安慰剂:16.7%;佩索利单抗:15.2%)、个体退出(安慰剂:16.7%;佩索利单抗:9.1%)及缺乏功效(安慰剂:11.1%;佩索利单抗:3.0%)。
[0201]
基线处的人口统计及疾病特征在治疗组之间合理地平衡。约一半患者为女性(51.0%);且患者为白人(47.1%)、亚洲人(31.4%)或黑人/非裔美国人(21.6%)。平均年龄为39.4岁(sd 15.5岁);且自ad的第一次诊断的平均时间为20.3年(sd 14.9年)。基线easi评分为24.9(sd 10.8),其中重度easi类别中约三分的二患者(60.8%)及中度easi类别中三分之一(39.2%)。安全性结果
[0202]
总体上51名患有中度至重度异位性皮肤炎的患者随机分组至此双盲、随机及安慰剂对照的佩索利单抗试验中。患者以2:1分配比例随机分组且历经16周(主要分析的时间点)的时段每4周静脉内接受600mg佩索利单抗(33名经治疗患者)或安慰剂(18名经治疗患
者)。在16周的治疗之后,可将无反应患者重新分配给佩索利单抗开放标记治疗再持续至多16周。试验仍在此开放标记阶段中进行,但来自第16周的主要分析的初步资料为可用的。
[0203]
在双盲治疗期期间,安慰剂组中18名患者中的10名(55.6%)及佩索利单抗组中33名患者中的24名(72.7%)报导在治疗时至少1例ae。具有严重ae(rctc 3级或4级)的患者及具有研究者定义的药物相关ae的患者的频率在安慰剂组中比在佩索利单抗组中更高(安慰剂:6名患者,33.3%;佩索利单抗:4名患者,12.1%)。在两个组中以类似频率报导导致中断的不良事件及sae(表5)。表5.试验1368.32:不良事件总体概述-saf(双盲治疗期)患者可统计于多于1个类别中若不良事件在第一次与最后一次试验药物给药(加16周的残余作用时段)之间开始或恶化,则在治疗时视为不良事件1此还可包括暂时中断试验药物的患者
164.最频繁报导的ae为“异位性皮肤炎”(安慰剂:7名患者,38.9%;佩索利单抗:9名患者,27.3%)、“毛囊炎”(安慰剂:2名患者,11.1%;佩索利单抗:3名患者,9.1%)及“上呼吸道感染”(安慰剂:0名患者;佩索利单抗:3名患者,9.1%)。报导每个治疗组不超过2名患者的所有其他ae(表6)。表6.试验1368.32:通过pt报导超过1名患者总体-saf(双盲治疗期),具有不良事件的患者频率
患者可统计于多于1个类别中若不良事件在第一次与最后一次试验药物给药(加16周的残余作用时段)之间开始或恶化,则在治疗时视为不良事件
165.安慰剂组中1名患者(5.6%)及佩索利单抗组中3名患者(9.1%)报导sae。
166.安慰剂组中8名患者(44.4%)及佩索利单抗组中11名患者(33.3%)报导与超敏反应相关的分组pt(使用meddra smq),且主要由异位性皮肤炎(安慰剂:7名患者,38.9%;佩索利单抗:9名患者,27.3%)驱动。
167.关于安全性实验室及生命体征,用佩索利单抗治疗无临床上相关的异常。
168.总之ae频率及实验室值不存在相关差异,佩索利单抗具有良好耐受性,且未在试验1368.32中识别安全信号。功效结果
169.在iia期、随机、双盲、安慰剂对照的试验1368.32中,51名患有中度至重度异位性皮肤炎的患者历经16周(主要分析的时间点)的时段每4周静脉内用600mg佩索利单抗(33名患者)安慰剂(18名患者)治疗。试验仍在开放标记扩展阶段中进行,但来自第16周的主要分析的初步资料为可用的。
170.基线疾病特征通常在2个治疗组之间相当。easi评分为24.9(sd 10.8),其中重度easi类别中约三分的二患者(60.8%)及中度easi类别中三分之一(39.2%)。自第一次诊断为ad的平均时间为20.3年(sd 14.9年)。
171.在安慰剂组中,平均easi评分在试验开始时降低,但在第8周再次增加,而佩索利单抗治疗组中的平均easi评分持续降低。综合而言,试验显示第8周开始有意义的治疗效果(图5)。
172.在16周的治疗之后easi评分相对于基线的百分比变化亦显示600mg佩索利单抗的临床上有意义的,但无统计学上显著的治疗效果:与安慰剂的调整平均差异为-25.6%(90% ci-54.9%,3.7%)。(图5)在可用的次要终点及敏感性分析中观察到一致结果。例如,在排除伴随受限类固醇药物使用之后的数据的敏感性分析中,与安慰剂的调整平均差异为-48.3%(90% ci 82.8%,-13.9%)。(图6)在仅包括已按计划完成的双盲治疗期的患者的敏感性分析中,与安慰剂的调整平均差异为-45.6%(90% ci-82.6%,-8.6%)。虽然非正式终点,但对患者进行功效随访直至试验结束。最初作为反应者随机分组至佩索利单抗的5名患者在第16周时实现easi75,且因此自第16周不接受开放标记佩索利单抗治疗,直
至第28周维持其easi 50反应。(图7)最初随机分组至佩索利单抗且为无反应者的16名患者在第16周时并未实现easi75,大多数在再次分配时段期间显示easi的额外降低。在再次分配时段中,根据患者在第16周时是否为easi75反应者,将患者置于开放标记佩索利单抗或“无药物”。总体而言,结果指示il-36在ad中起作用且佩索利单抗可为患者的有效治疗选择。考虑到小样本大小及试验设计的限制,在初始或开放标记佩索利单抗治疗之后已反应的患者的反应持续直至试验结束。
173.次要终点测量中的结果为在第16周时的以下结果。在次要终点easi50及easi75中,风险差异(即,与安慰剂患者相比,在佩索利单抗患者中观察到的改善)(90%ci)分别为18.3(3.3,33.4)及7.6(-6.8,22.1)。对于次要终点scorad,在16周的治疗之后相对于基线的scorad百分比变化中与安慰剂的调整平均差异(即,改善)为-14.9(90% ci-35.2,5.5)。对于次要终点iga(iga 0或1,≥2级降低),风险差异(即,改善)(90% ci)为6.1(-3.5,15.7)。对于搔痒,作为scorad的子终点,在16周的治疗之后搔痒vas相对于基线的百分比变化中与安慰剂的调整平均差异(即,改善)为-20.9(90% ci-44.5,2.7),不包括在基线处评分小于4的患者。在另一终点dlqi中,在16周的治疗之后相对于基线的dlqi百分比变化中与安慰剂的调整平均差异(即,改善)为-39.8(90% ci-106.4,26.8)。实施例8:治疗患有atd的成年患者
174.在此实施例中,本发明的抗il36r抗体用于治疗患有atd的成年患者。在根据实施例7施用本发明的化合物或产品之后,至少10%、11%、12%、13%、14%、15%、16%、17%、18%、19%、20%、21%、22%、23%、24%、25%、26%、27%、28%、29%、30%、31%、32%、33%、34%、35%、36%、37%、38%、39%、40%、41%、42%、43%、44%、45%、46%、47%、48%、49%、50%、51%、52%、53%、54%、55%、56%、57%、58%、59%、60%、61%、62%、63%、64%、65%、66%、67%、68%、69%、70%、71%、72%、73%、74%、75%、76%、77%、78%、79%、80%、81%、82%、83%、84%、85%、86%、87%、88%、89%或90%的atd患者对于实施例7中或权利要求书中所列的结果测量显示相对于基线或相较于安慰剂的改善。实施例9.在患有中度至重度异位性皮肤炎的患者中佩索利单抗(bi 655130)、抗介白素-36受体抗体的功效及安全性
175.简介&目标:异位性皮肤炎(ad)为特征为慢性发炎及持续剧烈搔痒的复发性皮肤病。介白素-36(il-36)路径被认为在ad的病理生理学中起重要作用。这里,我们报导了在患有中度至重度ad的患者中的iia期、概念验证研究(nct03822832)中佩索利单抗、抗il-36受体单克隆抗体的功效及安全性。
176.材料&方法:在此安慰剂对照的多中心研究中,患者经筛选且2:1随机分组以静脉内接受600mg佩索利单抗或安慰剂(每4周,直至第12周)且在16周的双盲治疗之后评估。有反应的患者(与基线相比,实现湿疹面积及严重程度指数[easi 75]评分减少75%)再随访12周。将无反应的患者重新分配至开放标记600mg佩索利单抗再持续16周。主要终点为第16周时easi评分相对于基线的百分比变化。次要终点包括第4周时easi评分相对于基线的变化,第4周及第16周时具有easi 50及easi 75的患者比例及不良事件(ae)的发生。
177.结果:总计筛选71名患者且51名随机分组;30名患者完成16周双盲治疗期,佩索利单抗组中66.7%(n=22/33)及安慰剂组中44.4%(n=8/18)。第16周时easi评分相对于基
线的百分比变化对于佩索利单抗为-37.9%(标准误差[se]9.8)及对于安慰剂为-12.3%(se 14.3);佩索利单抗与安慰剂之间的调整平均差异(90%置信区间[ci])为-25.6%(-54.9%,3.7%;p=0.1492)。在仅包括已完成双盲治疗期的患者的敏感性分析中,佩索利单抗与安慰剂之间的调整平均差异为-45.6%(90% ci-82.6%,-8.6%)。对于佩索利单抗与安慰剂,第4周时easi相对于基线的调整平均百分比变化为-2.2%(90% ci-25.8%,21.4%)。第16周时实现easi 50的患者比例对于佩索利单抗为30.3%(n=10/33)及对于安慰剂为5.6%(n=1/18),差异为24.1%(90% ci 8.6%,39.6%)。类似地,第16周时实现easi 75的患者比例对于佩索利单抗为15.2%(n=5/33)及对于安慰剂为5.6%(n=1/18),差异为9.4%(90% ci-4.1%,22.9%)。佩索利单抗及安慰剂组中具有任何ae的患者比例分别为72.7%(n=24/33)及55.6%(n=10/18);其中,15.2%(n=5/33)及16.7%(n=3/18)因ae中断。在佩索利单抗及安慰剂组中,分别在9.1%(n=3/33)及5.6%(n=1/18)的患者中报导严重ae。
178.结论:此概念验证研究显示在用佩索利单抗治疗16周之后,easi评分相对于基线的百分比变化的主要终点的变化在临床上有意义,但在统计学上不显著。在研究组之间的次要终点中观察到一致结果。此试验中的安全性数据与用佩索利单抗进行之前述试验一致。需要进一步研究以确认il-36受体抑制在患有中度至重度ad的患者中的作用。
179.尽管已描述本发明的某些方面及实施方案,但这些方面及实施方案仅借助于实施例呈现,且并不意图限制本发明的范围。实际上,本文所描述的新颖方法及系统在不脱离其精神的情况下可以多种其他形式实施。随附权利要求书及其等效物意图涵盖将在本发明的范围及精神内的这些形式或修改。
180.包括本发明中所引用的期刊论文的全部专利和/或出版物以引用的方式明确地并入本文中。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1