用于抗炎、伤口愈合或促进伤口愈合的包含玫瑰干细胞来源外排体作为活性成分的组合物的制作方法
1.本发明涉及用于抗炎、伤口愈合或加速伤口愈合的组合物,其包含玫瑰干细胞来源外排体作为活性成分。
2.此外,本发明涉及使用上述组合物用于预防、抑制、减轻、改善或治疗炎性疾病、使伤口愈合或加速伤口愈合的方法。
背景技术:
3.炎症是机体针对物理或化学损伤、细菌、真菌或病毒感染、或者由多种变应原引起的病理状况等的防御反应。炎性应答显示为固有免疫应答的一部分。多种物质以及生理和化学现象参与炎性应答,并且最近的研究已表明,多种炎性细胞因子在炎性应答中发挥重要作用。参与炎性应答的主要细胞因子包括il-1β、tnf-α、il-6、il-8、il-12、ifn-β等。这些细胞因子的表达和分泌提高以及其激活与一系列复杂的生理应答相关,包括炎性介质的分泌、免疫细胞浸润、细胞迁移和组织破坏,以及症状,例如红斑、水肿、发热和疼痛。
4.一般而言,如果将感染原从机体中去除并使受损组织再生,则炎性应答不会成为一个显著的问题,并且受影响的区域会恢复至其正常状态。然而,如果未将感染原从机体中去除或者由于机体的内部物质,炎性应答过度或持续,则发生急性或慢性炎性疾病。非甾体抗炎药、甾体抗炎药、神经肽拮抗剂、cox抑制剂、抗组胺药和免疫抑制药物例如环孢素a用于减轻或治疗炎性应答或由此引起的炎性疾病,但是具有这样的问题:他们引起不良作用,例如皮肤萎缩、血管舒张、色素脱失、超敏反应、耐受、中性粒细胞减少等。另外,存在这样的限制:上述药物仅有助于将与炎症有关的症状控制至一定水平,而不是对其进行根本治疗。
5.近年来,已经积极地进行了关于使用天然物质来开发炎性疾病治疗剂或功能性化妆品的研究。在基于这些天然物质的炎性疾病治疗剂或功能性化妆品的情况下,天然提取物中活性成分的量低,并且因此需要使用大量的天然提取物以获得抗炎作用。在大多数情况下,在市场营销中已经强调了这些治疗剂或功能性化妆品是基于天然物质的事实,但是需要关于天然物质对抗炎作用的实际效力的更多的科学研究。然而,包含植物提取物作为活性成分的功能性化妆品具有以下问题:他们在其施加至皮肤之后蒸发期间可引起异物感,并且其作用持续时间短。
6.已知细胞例如角质形成细胞、成纤维细胞、内皮细胞、巨噬细胞等在伤口愈合中相互协作,并且这些细胞的过程例如迁移、增殖和分化受多种生长因子或细胞因子调节。出于这个原因,已经开发了使用生长因子和细胞因子的伤口愈合方法。
7.然而,使用生长因子和细胞因子的伤口愈合方法具有以下问题:伤口愈合时间长,并且由于伤口愈合机制通过涉及数种蛋白质的复杂作用,一种特定的生长因子或细胞因子不能表现出令人满意的治疗效果。另外,鉴于间充质干细胞分泌生长因子和细胞因子,已提出使用间充质干细胞的条件培养基用于使伤口愈合的方法。然而,未活化的间充质干细胞具有从细胞分泌的细胞因子和生长因子的量少的问题。另外,间充质干细胞的条件培养基
还包含成分例如在细胞生长期间由细胞分泌的废物产物、用于防止污染而添加的抗生素以及动物来源血清等,并且因此当将条件培养基施加于伤口时,伤口可能暴露于多种风险。
8.最近,有报道称细胞分泌组(secretome)包含调节细胞行为的多种生物活性分子。特别地,细胞分泌组包含具有细胞间信号传导功能的
‘
外排体(exosome)’或
‘
胞外囊泡’,并且因此已积极地对其组分和功能进行了研究。
9.细胞将多种膜囊泡脱落到其胞外环境,并且这些释放的囊泡通常称为胞外囊泡(extracellular vesicle,ev)。ev也被称为细胞膜来源囊泡、核外颗粒体(ectosome)、脱落囊泡、微粒、外排体等,并且在一些情况下也与外排体区别使用。
10.外排体是尺寸为数十至数百纳米的囊泡,其包含与细胞膜具有相同结构的磷脂双层膜。这种外排体包含被称为外排体载物(cargo)的蛋白质、核酸(mrna、mirna等)等。已知外排体载物包括范围广泛的信号传导因子,并且这些信号传导因子对细胞类型具有特异性并且根据分泌细胞的环境而受到不同调节。已知外排体是由细胞分泌的细胞间信号传导介质,并且通过其传输的多种细胞信号调节细胞行为,包括靶细胞的激活、生长、迁移、分化、去分化、凋亡和坏死。根据外排体来源于的细胞的性质和状态,外排体包含特定的遗传物质和生物活性因子。来源于增殖中干细胞的外排体调节细胞行为,例如细胞迁移、增殖和分化,并且概括了参与组织再生的干细胞的特征(nature review immunology 2002(2)569-579)。
11.也就是说,称为细胞的“化身”的外排体类似于细胞包含生物活性因子例如生长因子,并且作为在细胞间传递生物活性因子的载体,即用于介导细胞间的通讯。已知外排体不仅从动物细胞例如干细胞、免疫细胞、成纤维细胞和癌细胞中释放,而且还从多种生物体(例如植物、细菌、真菌和藻类)的细胞中释放。例如,外排体可从植物干细胞的条件培养基,以及癌细胞、免疫细胞、间充质干细胞等的条件培养基中分离。
12.然而,关于分离、纯化和表征来源于植物干细胞的外排体的研究仍然不足。因此,需要对来源于植物干细胞的外排体进行更详细的表征和功能性研究。
13.在广泛多个地区例如北半球的寒带、亚北极带、温带和亚热带栽培着多种玫瑰品种,并且其提取物用于香水和化妆品。然而,迄今为止的技术处于这样的水平:其中通过将玫瑰花瓣干燥并对经干燥的花瓣进行热水提取或溶剂提取而获得的提取物用于香水和空气清新剂。
14.另外,已经引入了使用通过培养玫瑰愈伤组织获得的玫瑰愈伤组织的条件培养基的技术,但该技术还仅仅处于这样的水平:愈伤组织本身的条件培养基或通过将愈伤组织干燥并随后对经干燥的愈伤组织进行热水提取或溶剂提取而获得的提取物用作化妆品成分。另外,玫瑰愈伤组织的条件培养基包含生长调节剂或愈伤组织诱导物质,并且因此几乎不被认为是天然化妆品成分,并且培养物中所包含的生长调节剂可引起副作用,例如皮肤问题。
15.本发明人已经发现来源于玫瑰干细胞的外排体在抗炎、伤口愈合或加速伤口愈合方面是有效的,并且已经开发了用于抗炎、伤口愈合或加速伤口愈合的组合物,其包含玫瑰干细胞来源外排体作为活性成分。
16.同时,应理解的是,作为背景技术描述的内容仅旨在帮助理解本发明的背景,并不被认为是针对本发明的现有技术。
技术实现要素:
17.技术挑战
18.本发明的一个目的是提供用于抗炎、伤口愈合或加速伤口愈合的组合物,其包含玫瑰干细胞来源外排体作为活性成分。
19.本发明的另一个目的是提供使用上述组合物来预防、抑制、减轻、改善或治疗炎性疾病、使伤口愈合或加速伤口愈合的方法。
20.然而,如上所述的本发明的目的是举例说明性的并且本发明的范围不受此限制。另外,从以下描述、所附权利要求书和附图,本发明的其他目的和优点将更加明显。
21.技术方案
22.本发明提供了用于抗炎、伤口愈合或加速伤口愈合的组合物,其包含玫瑰干细胞来源外排体作为活性成分。
23.本文中使用的术语“玫瑰(蔷薇属物种(rosa spp.))”是指属于双子叶植物纲、蔷薇目、蔷薇科中蔷薇属的植物,并且包括所有的野生物种和栽培的花园物种。
24.本文中使用的术语“外排体”是指从植物细胞分泌或释放到胞外空间中且具有膜结构的纳米尺寸的囊泡,并且还被称为外排体样囊泡或外排体样颗粒。
25.本文中使用的术语“抗炎”意指炎症的预防、抑制、减轻、改善或治疗。作为一个实例而非限制本发明,炎性疾病的实例包括皮炎、特应性皮炎、湿疹、由细菌、病毒或真菌感染引起的炎症、烧伤、由烧伤引起的炎症、伤口、由伤口引起的炎症等。
26.本文中使用的术语“伤口”意指其中机体的一部分或全部受到损伤的状况,并且旨在涵盖其中构成机体之内部表面或外部表面的组织(例如皮肤、肌肉、神经组织、骨、软组织、内部器官或血管组织)被损伤或破坏的病理状况。作为实例而非限制本发明,伤口的一些实例包括擦伤、撕裂伤、刺伤、切伤、撕脱伤、褥疮、由辐射导致的组织破坏、穿透伤、枪伤、烧伤、冻伤、手术伤口、整形手术之后的缝合伤口、由化学物质导致的伤口等,并且可包括对个体的任何部位的任何损伤。
27.本文中使用的术语“离子透入(iontophoresis)”是指这样的方法:使微电流流过已施加活性成分的皮肤,从而产生势差并改变皮肤的电环境,并由此使离子化的活性成分通过电斥力穿透皮肤。在本发明的一个实施方案中使用的离子透入的一些实例包括:通过使微电流从外部电源流入到皮肤上的电极贴片中而将微电流引入到皮肤中的方法,所述微电流由外部电源产生;将微电流引入到皮肤中的方法,所述微电流由皮肤上的电极贴片中设置的电池产生;以及通过皮肤上设置有逆向电渗析装置的贴片将微电流引入到皮肤中的方法,所述微电流由逆向电渗析装置中的高浓度电解质溶液与低浓度电解质溶液之间的浓度差产生。然而,本发明不限于此,并且当然可使用多种类型的离子透入。
28.本文中使用的术语“玫瑰干细胞来源外排体”意在包括从例如玫瑰植物细胞的条件培养基、玫瑰愈伤组织的条件培养基或与其等同的玫瑰生物溶液中分离的所有外排体。
29.根据本发明的一个实施方案的包含玫瑰干细胞来源外排体作为活性成分的组合物可表现出选自抗炎、伤口愈合和加速伤口愈合中的至少一种作用。
30.在根据本发明的一个实施方案的组合物中,玫瑰干细胞可通过诱导来源于玫瑰胚或玫瑰叶的愈伤组织并随后培养所述愈伤组织的细胞来获得。
31.例如,根据本发明的包含玫瑰干细胞来源外排体作为活性成分的组合物可以是用
于抗炎、伤口愈合或加速伤口愈合的药物组合物。另外,根据本发明的包含玫瑰干细胞来源外排体作为活性成分的组合物可用作用于抗炎、伤口愈合或加速伤口愈合的功能性化妆品组合物、皮肤外用剂或准药物。
32.作为实例而非限制本发明,根据本发明的一个实施方案的组合物可通过注射、微针法、离子透入、施加或其组合来施用或进行治疗。例如,该组合物可以是可注射制剂、输注制剂、喷雾制剂、液体制剂或贴片制剂。
33.在本发明的一个实施方案中,当组合物用作药物组合物时,其可包含可药用载体、赋形剂或稀释剂。载体、赋形剂和稀释剂包括但不限于:乳糖、右旋糖、海藻糖、蔗糖、山梨糖醇、甘露糖醇、木糖醇、赤藓糖醇、麦芽糖醇、淀粉、金合欢胶、藻酸类、明胶、磷酸钙、碳酸钙、硅酸钙、纤维素、甲基纤维素、微晶纤维素、聚乙烯吡咯烷酮、水、羟基苯甲酸甲酯、羟基苯甲酸丙酯、滑石、硬脂酸镁和矿物油。另外,根据本发明的一个实施方案的药物组合物的有效量意指为了实现抗炎、伤口愈合和/或加速伤口愈合的作用而需要施用的量。
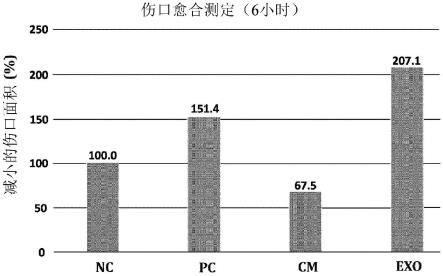
34.制剂中根据一个实施方案的药物组合物的含量可根据如上所述的另外组分的种类、量、形式等适当地选择。例如,本发明的药物组合物可以以基于可注射制剂的总重量的约0.1wt%至99wt%、优选约10wt%至90wt%的量包含在内。此外,根据本发明的一个实施方案的药物组合物的合适剂量可根据以下进行调整:疾病的严重程度,制剂的类型,配制方法,患者的年龄、性别、体重、健康状况、饮食、排泄率,施用时间和施用方案。例如,当将根据本发明的一个实施方案的药物组合物施用于成人时,其可以以每天0.001mg/kg至100mg/kg的剂量施用一次至数次。
35.另外,本发明提供了用于治疗炎症、使伤口愈合或加速伤口愈合的方法,该方法包括将治疗有效量的组合物施用于哺乳动物,或将所述组合物施加至皮肤、炎性区域或受伤区域。哺乳动物可以是选自以下的至少一种哺乳动物:人、狗、猫、啮齿动物、马、牛、猴和猪。
36.有益效果
37.与常规的玫瑰过滤物、玫瑰提取物、玫瑰愈伤组织的条件培养基、或者玫瑰愈伤组织的过滤物或提取物相比,本发明的组合物包含杂质例如生长调节剂的可能性较低,并且具有优异的抗炎、伤口愈合和/或加速伤口愈合的作用。
38.应理解,本发明的范围不限于上述作用。
附图说明
39.图1a示出了根据本发明的一个实施方案获得的玫瑰干细胞来源外排体的通过透射电子显微术(transmitted electron microscopy,tem)获得的颗粒图像。图1b示出了图1a的放大的颗粒图像。
40.图2是示出了玫瑰干细胞来源外排体的nta分析的结果的图。
41.图3示出了显示经荧光染色的外排体被递送到人真皮成纤维细胞中的细胞的荧光显微图像(绿色:递送到细胞中的外排体;蓝色:细胞核;以及红色:细胞膜)。
42.图4a至4c是显示在用玫瑰干细胞来源外排体处理人真皮成纤维细胞的划痕-伤口之后人真皮成纤维细胞的迁移显著提高的图。
43.图5是显示当用玫瑰干细胞来源外排体处理raw 264.7细胞时raw264.7细胞中由lps诱导的il-6显著降低的图。
44.图6是显示与玫瑰干细胞的条件培养基(玫瑰愈伤组织的条件培养基)相比玫瑰干细胞来源外排体具有优异的降低il-6(炎性细胞因子)的作用(即优异的抗炎作用)的图。
具体实施方式
45.在下文中,将参照以下实施例更详细地描述本发明。然而,以下实施例仅是举例说明本发明并且不旨在限制或约束本发明的范围。本领域技术人员可从本发明的详细描述和实施例中容易地推断出的那些被解释为落入本发明的范围内。本发明中提及的参考文献通过引用并入本文。
46.应理解的是,在本说明书通篇,当任何部分被提及“包含”任何组分时,除非另外指明,否则其不排除其他组分,而是还可包含其他组分。
47.实施例
48.实施例1:玫瑰干细胞的制备
49.根据本领域已知的植物干细胞的制备和培养方法,从玫瑰胚和/或玫瑰叶诱导愈伤组织,并培养所诱导的愈伤组织的细胞。另外,选择具有良好生长状态的愈伤组织并大量培养,从而制备玫瑰干细胞的条件培养基(玫瑰愈伤组织的条件培养基)。
50.实施例2:玫瑰干细胞来源外排体的制备
51.如实施例1中所述制备的玫瑰干细胞的条件培养基(玫瑰愈伤组织的条件培养基)购自bio-fd&c co.,ltd.(位于韩国仁川(incheon,korea),并且供应大马士革玫瑰(damask rose)愈伤组织的条件培养基)。将玫瑰干细胞的条件培养基通过0.22μm过滤器过滤以除去杂质,例如细胞碎片、废物产物和大颗粒。通过切向流过滤(tangential flow filtration,tff)方法从经过滤的条件培养基中分离玫瑰干细胞来源外排体。
52.通过透射电子显微术(tem)分析分离的玫瑰干细胞来源外排体的尺寸。如图1a和图1b中所示,确定了分离的玫瑰干细胞来源外排体是纳米尺寸的囊泡。使用ns300(购自malvern panalytical)通过纳米粒示踪分析(nanoparticle tracking analysis,nta)分析了玫瑰干细胞来源外排体的尺寸和浓度(图2)
53.实施例3:玫瑰干细胞来源外排体向真皮成纤维细胞中的递送能力的评价
54.为了检测玫瑰干细胞来源外排体是否会被递送到人真皮成纤维细胞(购自cefo co.,ltd.)中,进行了以下分析。为了对实施例2中制备的玫瑰干细胞来源外排体的膜进行荧光染色,使外排体与pkh67荧光染料(购自sigma-aldrich)反应。在反应之后,将反应溶液用mw3000柱(购自thermofisher scientific)分级,以去除在外排体膜中未被染色的游离phk67。通过使pkh67荧光染料与缓冲溶液反应并用mw3000柱对反应产物进行分级制备阴性对照。将用pkh67染色的外排体与预培养的人真皮成纤维细胞一起孵育,并随后使用荧光显微镜观察外排体是否会随时间被递送到细胞中。使用hoechst荧光染料(购自sigma-aldrich)对细胞核进行染色,并且使用cellmask橙色质膜染色剂荧光染料对细胞膜进行染色。作为检测外排体是否会被递送到细胞中的结果,确定了经荧光染色的外排体被递送到细胞中并且绿色荧光在细胞中随时间累积(图3)。
55.实施例4:使用真皮成纤维细胞的皮肤再生作用的评价
56.为了评价如实施例2中所述制备的玫瑰干细胞来源外排体是否促进人真皮成纤维细胞中的伤口愈合,进行了划痕-伤口测定。将分散在包含胎牛血清的dmem中的人真皮成纤
维细胞以10,000个细胞/孔的密度接种到用于伤口诱导的培养板(imagelock板;购自essenbio)中,并在5% co2和37℃下培养24小时。在细胞达到90%或更高的汇合率之后,使用woundmaker(购自essenbio)产生划痕。为了评价使用人真皮成纤维细胞的皮肤再生作用,将实验组如下分类:
57.(1)阴性对照(nc):单独用不含血清的培养基处理的实验组;
58.(2)阳性对照(pc):用包含10%胎牛血清的培养基处理的实验组;
59.(3)玫瑰干细胞的条件培养基(cm):用在实施例2中制备并用不含血清的培养基稀释的玫瑰干细胞的条件培养基(玫瑰愈伤组织的条件培养基)处理的实验组(基于颗粒的数目,cm的处理浓度为1.0
×
109个颗粒/ml);以及
60.(4)玫瑰干细胞来源外排体(exo):用实施例2中制备并用不含血清的培养基稀释的玫瑰干细胞来源外排体处理的实验组(基于颗粒的数目,exo的处理浓度为1.0
×
109个颗粒/ml)。
61.在此之后,对每个实验组进行划痕-伤口测定,并且将人真皮成纤维细胞在37℃下在5% co2下培养24小时。各自在每个实验组处理之后6、12和24小时,使用incucyte(购自sartorius)分别测量每个实验组的伤口愈合效力。
62.作为测量伤口愈合效力的结果,确定了用本发明玫瑰干细胞来源外排体进行的处理与阳性对照相比在处理之后6小时显著提高了人真皮成纤维细胞的迁移,并且与阴性对照和玫瑰干细胞的条件培养基相比在所有测量时间点(在处理之后6小时、12小时和24小时)人真皮成纤维细胞的迁移也显著提高(图4a至图4c)。
63.从以上结果可以看出,与玫瑰干细胞的条件培养基(玫瑰愈伤组织的条件培养基)相比,本发明的玫瑰干细胞来源外排体具有优异的促进人真皮成纤维细胞迁移的作用,即优异的伤口愈合作用。
64.因此,本发明的玫瑰干细胞来源外排体可用作用于使伤口愈合或加速伤口愈合的组合物的活性成分。
65.实施例5.玫瑰干细胞来源外排体的抗炎作用的评价1
66.为了评价如实施例2中所述制备的玫瑰干细胞来源外排体是否表现出抗炎作用,将raw 264.7细胞悬浮于包含10% fbs的dmem中,并随后接种到多孔板的每个孔中以达到80%至90%的汇合率。在第二天,将raw 264.7细胞用在包含lps的新鲜培养基(包含1% fbs和200nm lps的dmem)中稀释的玫瑰干细胞来源外排体处理24小时。用于评价抗炎作用的实验组如下分类:
67.(1)阴性对照:其中单独用lps处理raw 264.7细胞的实验组;
68.(2)阳性对照(pc):其中用lps加200μm地塞米松处理raw 264.7细胞的实验组;以及
69.(3)玫瑰干细胞来源外排体(exo):其中用在实施例2中制备并用lps培养基稀释的玫瑰干细胞来源外排体处理raw 264.7细胞的实验组(基于颗粒的数目,exo的处理浓度为1.0
×
109个颗粒/ml)。
70.在每个实验组的raw 264.7细胞培养结束之后,收集培养物上清液,并通过测量培养物上清液中存在的炎性细胞因子检测炎性应答。使用il-6elisa试剂盒测量培养物上清液中炎性细胞因子的量。使用elisa试剂盒(购自r&d system)根据制造商的手册,测量单独
用lps处理的组中产生的il-6(炎性细胞因子)的量,以及在用lps加地塞米松处理和lps加玫瑰干细胞来源外排体处理的各组中产生的il-6(炎性细胞因子)的量。
71.如图5所示,确定了当用lps加本发明的玫瑰干细胞来源外排体处理raw 264.7细胞(其为小鼠巨噬细胞)时,与其中单独用lps处理raw264.7细胞的阴性对照组相比,il-6的产生被显著抑制,并且il-6的产生降低至与其中用lps加地塞米松处理raw 264.7细胞的阳性对照组中的水平类似的水平。
72.从以上结果可以看出,本发明的玫瑰干细胞来源外排体具有优异的抗炎作用。因此,本发明的玫瑰干细胞来源外排体可用于预防、抑制、减轻、改善或治疗炎性疾病。
73.实施例6.玫瑰干细胞来源外排体的抗炎作用的评价2
74.为了评价如实施例2中所述制备的玫瑰干细胞来源外排体是否表现出抗炎作用,将raw 264.7细胞悬浮于包含10% fbs的dmem中,并随后接种到多孔板的每个孔中以达到80%至90%的汇合率。在第二天,将raw 264.7细胞用在包含lps的新鲜培养基(包含1% fbs和200nm lps的dmem)中稀释的玫瑰干细胞来源外排体处理24小时。用于评价抗炎作用的实验组如下分类:
75.(1)阴性对照(nc):其中单独用lps处理raw 264.7细胞的实验组;
76.(2)阳性对照(pc):其中用lps加200μm地塞米松处理raw 264.7细胞的实验组;
77.(3)玫瑰干细胞的条件培养基(cm):其中用实施例2中制备并用lps培养基稀释的玫瑰干细胞的条件培养基(玫瑰愈伤组织的条件培养基)处理raw 264.7细胞的实验组(基于蛋白质含量,cm的处理浓度为:5μg/ml和50μg/ml);以及
78.(4)玫瑰干细胞来源外排体(exo):其中用实施例2中制备并用lps培养基稀释的玫瑰干细胞来源外排体处理raw 264.7细胞的实验组(基于蛋白质含量,exo的处理浓度为:5μg/ml和50μg/ml)。
79.在每个实验组的raw 264.7细胞培养结束之后,收集培养物上清液,并通过测量培养物上清液中存在的炎性细胞因子检测炎性应答。使用il-6elisa试剂盒(购自r&d system)测量培养物上清液中炎性细胞因子的量。使用elisa试剂盒根据制造商的手册测量在单独用lps处理的组中产生的il-6(炎性细胞因子)的量,以及在用lps加地塞米松、玫瑰干细胞的条件培养基(玫瑰愈伤组织的条件培养基)和玫瑰干细胞来源外排体中每一种处理的各组中产生的il-6(炎性细胞因子)的量。使用mtt测定(购自sigma-aldrich)对剩余细胞进行细胞生存力测量,并使用细胞生存力对il-6的测量值进行归一化。
80.如图6中所示,确定了当用lps加本发明的玫瑰干细胞来源外排体处理raw 264.7细胞(其是小鼠巨噬细胞)时,与其中单独用lps处理raw 264.7细胞的阴性对照组中il-6的产生相比,il-6的产生被显著抑制,并且il-6的产生也降低至优于其中用lps加地塞米松处理raw 264.7细胞的阳性对照组中水平的水平。
81.另外,确定了当用lps加本发明的玫瑰干细胞来源外排体处理raw264.7细胞时,il-6的产生降低至优于其中用lps加相同浓度的玫瑰干细胞的条件培养基(玫瑰愈伤组织的条件培养基)处理raw 264.7细胞的cm组中水平的水平。特别地,确定了,当用lps加浓度为5μg/ml的本发明玫瑰干细胞来源外排体处理raw 264.7细胞时,与其中用lps加相同浓度的玫瑰干细胞的条件培养基(玫瑰愈伤组织的条件培养基)处理raw 264.7细胞的cm组相比,il-6的产生被显著抑制。
82.从以上结果可以看出,与玫瑰干细胞的条件培养基(玫瑰愈伤组织的条件培养基)相比,本发明的玫瑰干细胞来源外排体具有优异的抗炎作用。因此,本发明的玫瑰干细胞来源外排体可用于预防、抑制、减轻、改善或治疗炎性疾病。
83.尽管已参照一些实施方案描述了本发明,但是本发明的范围不限于这些实施方案。本领域的任何技术人员将理解,在不脱离本发明的精神和范围的情况下可进行多种修改和改变,并且这些修改和改变也落入本发明的范围内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1