用于治疗癌症的识别KRASG12D的抗CD3的可溶性TORS和融合物的制作方法
用于治疗癌症的识别kras g12d的抗cd3的可溶性tors和融合物
1.本发明涉及特异性结合分子,其与来源于突变体kras的hla限制性肽vvvgadgvgk(seq id no:1)结合。所述特异性结合分子可以包含嵌入框架序列内的cdr序列。cdr和框架序列可以对应于t细胞受体(tcr)可变结构域,并且可以进一步包含相对于天然tcr可变结构域的非天然突变。本发明的特异性结合分子特别适合用作治疗癌症的新型免疫治疗剂。
背景技术:
2.kirsten大鼠肉瘤病毒癌基因同源物(kras)是一种普遍表达的小gtpase,其驱动生长因子受体下游的细胞信号转导、存活和增殖(uniprot编号:p01116)。kras中的致癌、体细胞功能获得突变在文献中有详细描述,据报道,约20%的人类癌症都存在,包括例如,胰腺癌、结直肠癌、肺癌、子宫内膜癌、卵巢癌和前列腺癌(cox等,nat rev drug discov.2014nov;13(11):828-51)。单个氨基酸取代可能导致产生突变的kras。特别是,据报道,kras位置g12的突变占所有突变的83%(hobbs等,cancer cell.2016mar14;29(3):251-253)。g12d和g12v突变在胰腺癌和结肠癌中都很常见。已经开发了很多小分子药物来靶向g12突变的kras,但是到目前为止,还没有一种药物被批准用于治疗用途。因此,需要更有效的药物来靶向突变的kras,也需要小分子药物的替代品。
3.t细胞受体(tcr)识别短肽抗原,这些抗原展示在抗原呈递细胞表面与主要组织相容性复合物(mhc)分子复合(在人中,mhc分子也称为人类白细胞抗原,或hla)(davis等,annu rev immunol.1998;16:523-44)。靶向来源于g12d突变体kras的hla-a*11限制性肽vvvgadgvgk(seq id no.1)的tcr是本领域公知的(wang等,cancer immunol res.2016mar;4(3):204
–
214)。开发基于tcr的靶向vvvgadgvgk-hla-a*11复合物的治疗剂具有挑战性,因为tcr必须能够充分区分突变(肿瘤)肽和未突变的野生型肽,两者仅相差一个氨基酸。野生型肽的交叉识别可能导致对正常健康组织的不需要的靶向。
技术实现要素:
4.在第一个方面中,本发明提供了一种特异性结合分子,所述特异性结合分子具有与同hla-a11复合的vvvgadgvgk(seq id no:1)结合的性质,并且包含tcrα链可变结构域和/或tcrβ链可变结构域,所述tcrα链可变结构域和所述tcrβ链可变结构域中的每一个包含fr1-cdr1-fr2-cdr2-fr3-cdr3-fr4,其中fr是框架区和cdr是互补性决定区,其中
5.(a)所述α链cdr具有以下序列:
6.cdr1
–
trdttyy(seq id no:32),
7.cdr2
–
rnsfdeqne(seq id no:33),
8.cdr3
–
calsgpsgagsyqltf(seq id no:34),
9.其中任选地具有一个或多个突变,
10.和/或
11.(b)所述β链cdr具有以下序列:
12.cdr1
–
mnhey(seq id no:35),
13.cdr2
–
svgegt(seq id no:36),
14.cdr3
–
cassygpgqhnsplhf(seq id no:37),
15.其中任选地具有一个或多个突变。
16.在第一个方面的特异性结合分子中,所述α链可变结构域框架区包含以下序列:
17.fr1
–
seq id no:2的氨基酸1-26,
18.fr2
–
seq id no:2的氨基酸34-50,
19.fr3
–
seq id no:2的氨基酸60-91,
20.fr4
–
seq id no:2的氨基酸108-117,
21.或与所述序列具有至少90%、91%、92%、93%、94%、95%、96%、97%、98%或99%同一性的各序列,和/或
22.所述β链可变结构域框架区包含以下序列:
23.fr1
–
seq id no:3的氨基酸1-26,
24.fr2
–
seq id no:3的氨基酸32-48,
25.fr3
–
seq id no:3的氨基酸55-90,
26.fr4
–
seq id no:3的氨基酸106-115,
27.或与所述序列具有至少90%、91%、92%、93%、94%、95%、96%、97%、98%或99%同一性的各序列。
28.本发明提供了特异性结合分子,其包含tcr cdr和框架区,其与hla-a11限制性肽vvvgadgvgk(seq id no.1)结合。所述特异性结合分子具有用于治疗癌症的特别理想的治疗性质。
29.特异性结合分子或其结合片段包含tcr可变结构域,其可以对应于来自天然tcr的那些,或更优选地,tcr可变结构域可以被工程化改造。天然tcr可变结构域也可以称为野生型、天然、亲本、未突变或支架结构域。特异性结合分子或结合片段可用于产生具有理想治疗特性的分子,例如对靶标的超生理亲和力、长的结合半衰期、对靶标的高特异性和良好的稳定性。本发明还包括整合了特异性结合分子或其结合片段和t细胞重定向部分的双特异性或双功能或融合分子。此类分子可以通过重定向和激活多克隆t细胞反应来介导针对癌细胞的有效和特异性反应。此外,使用具有超生理亲和力的特异性结合分子有助于识别和清除呈现低水平肽-hla的癌细胞。或,特异性结合分子或结合片段可以与其他治疗剂和/或诊断剂融合,和/或掺入工程化的t细胞中用于过继疗法。
30.tcr结构域序列可以参考imgt命名法来定义,该命名法对于tcr领域的技术人员而言广为人知且可以获得。例如,参见:lefranc和lefranc,(2001).“t cell receptor factsbook”,academic press;lefranc,(2011),cold spring harb protoc 2011(6):595-603;lefranc,(2001),curr protoc immunol appendix 1:appendix 100;和lefranc,(2003),leukemia 17(1):260-266。简而言之,αβtcr由两条以二硫键连接的链组成。通常认为每条链(α和β)具有两个结构域,即可变结构域和恒定结构域。短连接区连接可变结构域和恒定结构域,并且通常被认为是α可变区的一部分。另外,β链通常包含在连接区旁的短的多样性区,该多样性区通常也被认为是β可变区的一部分。每条链的可变结构域位于n端,并包含嵌入框架序列(fr)的三个互补性决定区(cdr)。cdr包含肽-mhc结合的识别位点。存在
若干个编码α链可变(vα)区的基因和若干个编码β链可变(vβ)区的基因,其区别在于它们的框架、cdr1和cdr2序列,以及部分定义的cdr3序列。在imgt命名法中,vα和vβ基因分别用前缀trav和trbv来表示(folch和lefranc,(2000),exp clin immunogenet 17(1):42-54;scaviner和lefranc,(2000),exp clin immunogenet 17(2):83-96;lefranc和lefranc,(2001),“t cell receptor factsbook”,academic press)。同样地,α链和β链各有若干连接基因或j基因,分别被称为traj或trbj,而β链有被称为trbd的多样性基因或d基因(folch和lefranc,(2000),exp clin immunogenet 17(2):107-114;scaviner和lefranc,(2000),exp clin immunogenet 17(2):97-106;lefranc和lefranc,(2001),“t cell receptor factsbook”,academic press)。t细胞受体链的巨大多样性源于各种v、j和d基因之间的组合重排,包括等位基因变体和连接多样性(arstila,等,(1999),science 286(5441):958-961;robins等,(2009),blood 114(19):4099-4107.)。tcrα和β链的恒定区或c区分别称为trac和trbc(lefranc,(2001),curr protoc immunol appendix 1:appendix 10)。
31.如本文所用,术语“特异性结合分子”是指能够与靶抗原结合的分子。此类分子可采用如本文所讨论的多种不同形式。此外,还设想了本发明的特异性结合分子的片段。片段是指特异性结合分子的保留与靶抗原结合的部分。
32.术语“突变”涵盖了替换、插入和缺失。对天然(也称为亲本、天然、未突变、野生型或支架)特异性结合分子的突变可以赋予有益的治疗性质,如高亲和力、高特异性和高效力;例如,突变可以包括增加特异性结合分子与vvvgadgvgk-hla-a*11复合物的结合亲和力(kd)和/或结合半衰期(t
1/2
)的那些。
33.α链框架区fr1、fr2和fr3可以包含对应于trav19*01链的氨基酸序列和/或β链框架区fr1、fr2和fr3,可以包含对应于trbv6-2/3*01链的那些的氨基酸序列。
34.fr4区可以包含α和β可变链的连接区(分别为traj和trbj)。traj区可以包含对应于traj28*01的那些的氨基酸序列。trbj区可以包含对应于trbj1-6*02的那些的氨基酸序列。
35.在tcrα链可变区中,可能至少有一个突变。在α链cdr中可能有一个或两个或三个或四个或五个或六个或七个或八个或九个或十个或十一个或十二个或十三个或十四个或十五个或十六个或十七个或更多个突变(即,所有三个cdr总计)。例如,在α链cdr中可能有17个突变或可能有10个突变。所述突变的一个或多个可以选自以下突变,参考seq id no:2的编号:
36.t31a、r51q、n52p、s53w、f54w、d55g、e56s、q57s、n58r、e59g、l94m、g96v、s98d、g99s或g99m、a100r或a100e或a100d、s102h、l105f
37.因此,可能存在上面列出的任何或所有突变,任选地与其他突变组合
38.突变的α链cdr可以包含以下组的突变之一(参考seq id no:2的编号):
39.第1组:t31a、r51q、n52p、s53w、f54w、d55g、e56s、q57s、n58r、e59g、l94m、g96v、s98d、g99s、a100r、s102h、l105f
40.第2组:t31a、r51q、n52p、s53w、f54w、d55g、e56s、q57s、n58r、e59g、l94m、g96v、s98d、g99m、a100e、s102h、l105f
41.第3组:t31a、r51q、n52p、s53w、f54w、d55g、l94m、g96v、a100d、l105f
42.α链cdr1可以包含以下序列
43.trdttyy(seq id no:32)
44.trdtayy(seq id no:38)
45.α链cdr2可以包含以下序列
46.rnsfdeqne(seq id no:33)
47.qpwwgssrg(seq id no:39)
48.qpwwgeqne(seq id no:40)
49.α链cdr3可以包含以下序列
50.calsgpsgagsyqltf(seq id no:34)
51.camsvpdsrghyqftf(seq id no:41)
52.camsvpdmeghyqftf(seq id no:42)
53.camsvpsgdgsyqftf(seq id no:43)
54.例如,在突变的α链中,cdr1是trdtayy,cdr2是qpwwgssrg和cdr3是camsvpdsrghyqftf。或,cdr1是trdtayy,cdr2是qpwwgssrg和cdr3是camsvpdmeghyqftf。或,cdr1是trdtayy,cdr2是qpwwgeqne和cdr3是camsvpsgdgsyqftf。
55.突变的α链可以与任何β链配对。
56.在tcrβ链可变区中,可能至少有一个突变。在β链cdr中可能有一个或两个或三个或四个或五个或六个或七个或更多个突变(即,所有三个cdr总计)。例如,在β链cdr中可能有5个突变或可能有7个突变。所述突变的一个或多个可以选自以下突变,参考seq id no:3的编号
57.v50g、g51w,e52g,g53k,t54d,s94k,y95v
58.因此,可能存在上面列出的任何或所有突变,任选地与其他突变组合
59.β链cdr可以包含以下组的突变之一(参考seq id no:3的编号):
60.第1组:v50g、g51w、e52g、g53k、t54d、s94k、y95v
61.第2组:v50g、g51w、e52g、g53k、t54d,
62.β链cdr1可以包含以下序列
63.mnhey(seq id no:35)
64.β链cdr2可以包含以下序列
65.svgegt(seq id no:36)
66.sgwgkd(seq id no:44)
67.β链cdr3可以包含以下序列
68.cassygpgqhnsplhf(seq id no:37)
69.caskvgpgqhnsplhf(seq id no:45)
70.例如,在突变的β链中,cdr1是mnhey,cdr2是sgwgkd和cdr3是caskvgpgqhnsplhf。或,cdr1是mnhey,cdr2是sgwgkd和cdr3是cassygpgqhnsplhf。
71.突变的β链可以与任何α链配对。
72.α链和β链优选的配对包含以下cdr序列
73.在α链中,cdr1是trdtayy,cdr2是qpwwgssrg和cdr3是camsvpdsrghyqftf,和在β链中,cdr1是mnhey,cdr2是sgwgkd和cdr3是caskvgpgqhnsplhf
74.在α链中,cdr1是trdtayy,cdr2是qpwwgssrg和cdr3是camsvpdmeghyqftf,和在β链
中,cdr1是mnhey,cdr2是sgwgkd和cdr3是cassygpgqhnsplhf
75.在α链中,cdr1是trdtayy,cdr2是qpwwgeqne和cdr3是camsvpsgdgsyqftf,和在β链中,cdr1是mnhey,cdr2是sgwgkd和cdr3是cassygpgqhnsplhf
76.cdr内的一个或多个突变优选地提高特异性结合分子对vvvgadgvgk-hla-a*11复合物的结合亲和力或特异性,但是可以另外地或替代地赋予其他优点,如当融合至免疫效应物时改善分离形式的稳定性或改善效力。一个或多个位置的突变可以另外地或替代地影响相邻位置与同源pmhc复合物的相互作用,例如通过提供更有利的相互作用角度。突变可以包括能够减少非特异性结合的突变,即,减少结合至相对于vvvgadgvgk-hla-a*11的替代性抗原的突变。突变可以包括提高折叠效率和/或稳定性和/或可制造性的突变。一些突变可能有利于这些特征中的每一个;另一些可能有利于例如亲和力而非特异性,或有利于特异性而非亲和力等。
77.通常,总共需要至少5个、至少10个、至少15个或更多个cdr突变以获得对靶抗原具有pm亲和力的特异性结合分子。总共可能需要至少5个、至少10个、至少15个cdr突变以获得对靶抗原具有pm亲和力的特异性结合分子。对靶抗原具有pm亲和力的特异性结合分子尤其适用于可溶性治疗剂。用于过继性治疗应用的特异性结合分子对靶抗原可具有较低的亲和力,并因此可具有较少的cdr突变,例如,总共至多1个、至多2个、至多5个或更多个cdr突变。在一些情况下,通过将一个或多个cdr突变回复到原始的天然残基,可能获得具有pm亲和力的特异性结合分子并产生较低亲和力的分子。在一些情况下,天然的(也称为未突变的)特异性结合分子可以对靶抗原具有足够高的亲和力而不需要突变。值的注意的是,本发明的天然形式的特异性结合分子具有有利的治疗性质,包括高特异性。不希望受到任何特定理论的束缚,本发明人认为本发明的分子区分wt和突变体kras肽的能力至少部分是由于突变肽在与hla结合时采用的不同确认。
78.突变可以另外地或备选地在框架区内的cdr之外进行;这样的突变可以导致特异性结合分子治疗性质改善,如改善的结合,和/或特异性,和/或稳定性,和/或纯化的可溶性形式的收率。例如,本发明的特异性结合分子可以另外地或备选地在两条链之一的fr1的n末端处包含一个或多个突变,以改善n末端甲硫氨酸切割的效率。n末端起始甲硫氨酸的去除通常对蛋白的功能和稳定性至关重要。无效切割可能对治疗不利,因为它可能导致异质蛋白产物和/或起始甲硫氨酸的存在可能在人体中是致免疫的。在一些情况下,起始甲硫氨酸可以存在于本发明的特异性结合分子中。
79.优选地,本发明的特异性结合分子的α链可变结构域可以包含与seq id no:2的第1-26位、第34-50位、第60-91位、第108-117位框架氨基酸残基具有至少90%、至少91%、至少92%、至少93%、至少94%、至少95%、至少96%、至少97%、至少98%或至少99%同一性的各框架氨基酸序列。本发明的特异性结合分子的β链可变结构域可以包含与seq id no:3的第1-26位、第32-48位、第55-90位、第106-115位框架氨基酸残基具有至少90%、至少91%、至少92%、至少93%、至少94%、至少95%、至少96%、至少97%、至少98%或至少99%同一性的各框架氨基酸序列。或,当作为一个整体考虑时,所述同一性百分比可能超过框架序列。
80.α链可变结构域可以包含seq id no:4-6的氨基酸序列中的任一个(在图2中所示)和β链可变结构域可以包含seq id no:7-8的氨基酸序列中的任一个(在图3中所示)。
81.例如,特异性结合分子可以包含以下α和β链对。
82.α链可变结构域β链可变结构域seq id no 4seq id no 7seq id no 5seq id no 8seq id no 6seq id no 8
83.优选的tcr链配对是seq id no:4和seq id no:7。
84.本文公开的本发明的任何特异性结合分子的表型沉默变体属于本发明的范围内。如本文所用,术语“表型沉默变体”应理解为指具有整合了除了上述那些之外的一个或多个其他氨基酸变化(包括替换、插入和缺失)的tcr可变结构域的特异性结合分子,该特异性结合分子具有与相应的不含所述一个或多个变化的特异性结合分子具有相似的表型。为了本技术的目的,特异性结合分子表型包含结合亲和力(kd和/或结合半衰期)和特异性。优选地,除了结合亲和力和特异性之外,与免疫效应物相关联的可溶性特异性结合分子的表型包括免疫激活效力和纯化产率。当在相同的条件(例如在25℃下和/或在相同的spr芯片上)下测量时,表型沉默变体对vvvgadgvgk-hla-a*11复合物的kd和/或结合半衰期可以为不含所述一个或多个变化的相应特异性结合分子的所测得的kd和/或结合半衰期的50%以内,或更优选为30%以内、25%以内或20%以内。在实施例1和实施例2中进一步提供了适宜的条件。
85.此外,表型沉默变体在与vvvgadgvgk-hla-a*11复合物的结合和与wt kras肽的结合,和/或与一个或多个额外的脱靶肽hla复合物的结合之间,可以保持相同或持续相同的治疗窗口。表型沉默的变体可以在响应于呈递vvvgadgvgk-hla-a*11复合物和wt kras肽的细胞和/或呈递一种或多种额外的脱靶肽hla复合物的细胞的免疫细胞激活的效力之间保持相同或持续相同的治疗窗。治疗窗可以根据正常细胞和肿瘤细胞系观察到的最低有效浓度(“loel”)来计算。治疗窗可以是至少100倍的差异、至少1000倍的差异或更大。表型变体可以共享相同或基本相同的识别基序,如下文进一步讨论的顺序诱变技术所确定的。
86.如本领域技术人员所知晓的,可能产生结合其可变结构域变化的特异性结合分子,而与上文详述的那些相比,不改变与vvvgadgvgk-hla-a*11复合物的相互作用的亲和力或特异性,和/或任何其他功能特征。特别地,这种沉默突变可以结合在序列中已知不直接参与抗原结合的部分(例如,框架区和/或cdr中不接触抗原的部分)。这些变体包括在本发明的范围内。
87.如本领域技术人员将显而易见的是,可以在c末端和/或n末端提供的序列截短或延伸1、2、3、4、5个或更多个残基,而基本上不影响特异性结合分子的功能性特征。可以将在c末端和/或n末端提供的序列截短或延伸1、2、3、4或5个残基。所有这些变体涵盖在本发明中。
88.表型沉默变体可以包含一个或多个保守替换和/或一个或多个耐受替换。耐受替换意指那些不落入如下所提供的保守的定义但仍然是表型沉默的替换。技术人员知道不同的氨基酸具有相似的性质并因此是“保守的”。蛋白质、多肽或肽的一种或多种这样的氨基酸通常可以被一种或多种其他这样的氨基酸替换,而不会消除该蛋白质、多肽或肽的所需活性。
89.因此,氨基酸甘氨酸、丙氨酸、缬氨酸、亮氨酸和异亮氨酸(具有脂肪族侧链的氨基
酸)通常可以互相替换。在这些可能的替换中,优选使用甘氨酸和丙氨酸来互相替换(因为它们具有相对短的侧链),以及使用缬氨酸、亮氨酸和异亮氨酸来互相替换(因为它们具有较大的疏水脂肪族侧链)。通常可以互相替换的其他氨基酸包括:苯丙氨酸、酪氨酸和色氨酸(具有芳香族侧链的氨基酸);赖氨酸、精氨酸和组氨酸(具有碱性侧链的氨基酸);天冬氨酸和谷氨酸(具有酸性侧链的氨基酸);天冬酰胺和谷氨酰胺(具有酰胺侧链的氨基酸);以及半胱氨酸和甲硫氨酸(具有含硫侧链的氨基酸)。应当理解,本发明范围内的氨基酸替换可以使用天然存在的或非天然存在的氨基酸来进行。例如,本文构思可以用乙基基团取代丙氨酸上的甲基基团,和/或可以对肽骨架进行微小的改变。无论是否使用天然氨基酸或合成氨基酸,优选仅存在l-氨基酸。
90.这种性质的替换通常被称为“保守”或“半保守”氨基酸替换。因此,本发明延伸至包含上述任意氨基酸序列的特异性结合分子的用途,但在该序列中具有一个或多个保守替换和/或一个或多个耐受替换,使得特异性结合分子的氨基酸序列与包含seq id no:2、4-6的氨基酸1-117和/或seq id no:3、7-8的氨基酸1-115的特异性结合分子具有至少90%的同一性,例如至少90%、至少91%、至少92%、至少93%、至少94%、至少95%、至少96%、至少97%、至少98%、至少99%或100%的同一性。
91.如本领域已知的“同一性”是通过比较序列所确定的两个或更多个多肽序列或两个或更多个多核苷酸序列之间的关系。在本领域中,同一性也意指多肽或多核苷酸序列(视情况而定)之间的序列相关程度,如通过这种序列的串之间的匹配所确定。虽然存在许多测量两个多肽序列或两个多核苷酸序列之间的同一性的方法,但通常用于确定同一性的方法是在计算机程序中编码的。
92.用于确定两个序列之间的同一性的优选计算机程序包括但不限于gcg程序包(devereux,等,nucleic acids research,12,387(1984),blastp、blastn和fasta(atschul等,j.molec.biol.215,403(1990))sim-蛋白序列比对工具(xiaoquin huang和webb miller:"a time-efficient,linear-space local similarity algorithm"advances in applied mathematics,vol.12(1991),pp.337-357)。
93.可以使用程序(例如clustal程序)来比较氨基酸序列。该程序比较氨基酸序列,并通过视情况而定在任一序列中插入空格来找到最优对齐。可以针对最优对齐来计算氨基酸同一性或相似性(同一性加上氨基酸类型的保守性)。像blastx这样的程序会对齐相似序列的最长延伸,并为该拟合赋值。因此,可以在发现若干相似区,每个区具有不同的分数的情况下获得比较。本发明中考虑了两种类型的同一性分析。
94.通过出于最优比较目的对序列进行对齐(例如,可以在第一序列中引入空位以与序列进行最佳对齐)并且比较相应位置处的氨基酸残基或核苷酸,来确定两个氨基酸序列或两个核酸序列的百分比同一性。“最佳对齐”是获得最高的百分比同一性的两个序列的对齐。百分比同一性由所比较序列中的相同氨基酸残基或核苷酸的数量来确定的(即,同一性%=相同位置数/位置总数
×
100)。
95.可以使用本领域技术人员已知的数学算法来完成两个序列之间的百分比同一性的确定。用于比较两个序列的数学算法的例子是karlin和altschul(1990)proc.natl.acad.sci.usa 87:2264-2268的算法,该算法在karlin和altschul(1993)proc.natl.acad.sci.usa90:5873-5877中进行了改进。altschul等,(1990)
j.mol.biol.215:403-410的blastn和blastp程序已经整合了这种算法。可以用blastn程序来进行两个核苷酸序列之间的同一性百分比的确定。可以用blastp程序来进行两个蛋白质序列之间的同一性百分比的确定。为了获得用于比较目的的加空位对齐(gapped alignment),可以使用gapped blast,如1997年altschul等,(1997)nucleic acids res.25:3389-3402所述。或,可以使用psi-blast来执行迭代搜索,检测分子之间的远距离关系(id.)。当使用blast、gapped blast和psi-blast程序时,可以使用各个程序(例如,blastp和blastp)的默认参数。参见http://www.ncbi.nlm.nih.gov。默认的常规参数可以包括,例如,字体大小=3,期望阈值=10。可以选择参数以自动调整为输入短序列。用于序列比较的数学算法的另一例子是myers和miller,cabios(1989)的算法。作为cgc序列比对软件包的一部分的align程序(版本2.0)已经合并了这种算法。本领域已知的用于序列分析的其他算法包括如torellis和robotti(1994)comput.appl.biosci.,10:3-5中所述的advance和adam;以及pearson和lipman(1988)proc.natl.acad.sci.85:2444-8中所述的fasta。在fasta中,ktup是设置搜索的灵敏度和速度的控制选项。出于评估本发明中的百分比同一性的目的,使用blastp以及默认参数作为比较方法。另外,当所述同一性百分比提供氨基酸的非整数值(即,具有90%序列同一性的25个氨基酸的序列提供的值为“22.5”时,则将所得值向下舍入到下一个整数,即“22”)。因此,在提供的例子中,在25个氨基酸中具有22个匹配的序列在90%序列同一性内。
96.可以使用任何适当的方法将突变(包括保守和耐受的替换、插入和缺失)引入所提供的序列中,所述方法包括但不限于基于聚合酶链反应(pcr)、基于限制酶的克隆或不依赖于连接的克隆(lic)步骤的方法。这些方法在许多标准分子生物学文本中都有详细描述。有关聚合酶链反应(pcr)和基于限制酶的克隆的更多细节,参见sambrook&russell,(2001)molecular cloning
–
a laboratory manual(第3版)cshl press。有关不依赖于连接的克隆(lic)步骤的更多信息可以在rashtchian,(1995)curr opin biotechnol 6(1):30-6中找到。本发明提供的tcr序列可以从固态合成或本领域已知的任何其他合适的方法获得。
97.本发明的特异性结合分子具有结合vvvgadgvgk-hla-a*11复合物的性质。本发明的特异性结合分子显示出对vvvgadgvgk-hla-a*11复合物的高度特异性,并因此特别适合于治疗用途。在本发明的特异性结合分子的背景下,特异性涉及其识别抗原阳性靶细胞的能力,同时具有识别抗原阴性靶细胞的最小能力。抗原阳性细胞是已确定表达突变体kras的细胞和/或已确定呈递vvvgadgvgk-hla-a*11复合物的细胞。当与多个hla-a*11亚型中的一个结合时,本发明的特异性结合分子可以结合靶向肽的复合物,例如,当与hla-a*1101结合时本发明的特异性结合分子可以结合靶向肽的复合物,和/或当与hla-a*1102结合时本发明的特异性结合分子可以结合靶向肽的复合物。
98.特异性可以在体外测量,例如在细胞试验(比如实施例3和实施例4中描述的细胞试验)中测量。为了测试特异性,特异性结合分子可以是可溶性形式并且与免疫效应物结合,和/或可以在细胞(如t细胞)表面上表达。可以通过如上文所定义的测量在抗原阳性和抗原阴性靶细胞存在的情况下的t细胞活化水平来确定特异性。抗原阴性靶细胞的最小识别被定义为当在相同条件下和在治疗相关的tcr浓度下测量时低于存在抗原阳性靶细胞时产生的水平的20%、优选低于10%、优选低于5%、并且更优选低于1%的t细胞活化水平。对于与免疫效应物相关联的可溶性tcr,治疗相关浓度可以定义为10-9
m或更低的浓度,和/或
大于相应ec50或ic50值的高达100倍、优选高达1000倍的浓度。优选地,对于与免疫效应物相关的可溶性特异性结合分子,相对于抗原阴性细胞,针对抗原阳性细胞的t细胞活化在ec50或ic50值之间存在至少100倍、至少1000倍、至少10000倍的差异——该差异可称为治疗窗。另外地或备选地,可以基于对正常细胞和肿瘤细胞系观察到的最低有效浓度(“loel”)来计算治疗窗。抗原阳性细胞可以使用合适的肽浓度通过肽冲击来获得,以获得与癌细胞相当的抗原呈递水平(例如,10-9
m肽,如bossi等,(2013)oncoimmunol.1;2(11):e26840中所描述的),或抗原阳性细胞可以天然地呈递所述肽。优选地,抗原阳性细胞和抗原阴性细胞都是人细胞。优选地,抗原阳性细胞是人癌细胞。抗原阴性细胞优选包括来源于人健康组织的细胞。抗原阴性细胞可以包括表达和/或存在野生型kras肽的那些。
99.另外地或替代地,特异性可以涉及特异性结合分子结合至vvvgadgvgk-hla-a*11复合物而不结合至一组替代肽-hla复合物或wt kras肽的能力。这可以通过例如实施例1和实施例2的biacore方法来确定。所述组可含有至少5种,优选至少10种可替代肽-hla复合物。替代肽可以与seq id no:1共享低水平的序列同一性,并且可以是天然存在的。替代肽优选衍生自在人健康组织中表达的蛋白。特异性结合分子与vvvgadgvgk-hla-a*11复合物的结合可以是其他天然呈递的肽hla复合物的至少2倍,更优选至少10倍,或至少100倍或至少1000倍,或至少3000倍。
100.确定特异性结合分子特异性的替代的或另外的方法可以是使用连续诱变(例如丙氨酸扫描)来鉴定肽识别基序。构成结合基序的一部分的残基是不允许替换的残基。不允许替换可以定义为如下肽位置:在不允许替换中,特异性结合分子的结合亲和力相对于非突变肽的结合亲和力降低至少50%,或优选至少80%。在cameron等,(2013),sci transl med.2013aug 7;5(197):197ra103和wo2014096803中进一步描述了与tcr相关的这种方法,但应理解此类方法也可应用于本发明的特异性结合分子。在这种情况下,特异性结合分子的特异性可以通过鉴定含有替代基序的肽,特别是在人蛋白质组中含有替代基序的肽,并测试这些肽与特异性结合分子的结合来确定。特异性结合分子与一种或多种替代肽的结合可表明缺乏特异性。在这种情况下,可能需要通过细胞试验进一步测试特异性结合分子的特异性。肽中心部分(丙氨酸)替换的低耐受性表明,特异性结合分子具有高特异性并因此表现出低的与替代肽发生交叉反应的风险。
101.本发明的特异性结合分子可具有用作治疗剂的理想的安全性特性。在这种情况下,特异性结合分子可以是可溶形式,并且可以优选地与免疫效应物融合。适宜的免疫效应物包括但不限于细胞因子(如il-2和ifn-γ);超级抗原及其突变体;趋化因子(如il-8、血小板因子4、黑色素瘤生长刺激蛋白);抗体和抗体样支架,包括与免疫细胞如t细胞或nk细胞(例如,抗cd3、抗cd28或抗cd16)上的抗原结合的片段、衍生物和变体;和fc受体或补体活化剂。理想的安全性特性意味着除了显示良好的特异性外,本发明的特异性结合分子还可以通过进一步的临床前安全性测试。这种测试的例子包括:全血测定,以确认在存在全血的情况下细胞因子释放最少,并因此使在体内引起潜在细胞因子释放综合征的风险低;以及同种异体反应性测试,以确认识别替代性hla类型的可能性低。
102.本发明的特异性结合分子可以适于高产率纯化,特别是可溶性形式的特异性分子。产率可以基于在纯化过程结束时获得的正确折叠物质相对于原始培养物体积的量来确定。高产率通常指大于1mg/l,或大于2mg/l,或更优选大于3mg/l,或大于4mg/l,或大于5mg/
l,或更高的产率。
103.本发明的突变的特异性结合分子优选针对vvvgadgvgk-hla-a*11复合物具有大于(即,强于)天然tcr(也称为非突变的,或支架tcr)的kd,例如在1pm至1μm范围内。在一个方面中,本发明的特异性结合分子针对复合物的kd从约(即,+/-10%)1pm至约400nm、从约1pm至约1000pm、从约1pm至约500pm、从约1pm至约100pm。另外地或可替代地,所述特异性结合分子对复合物的结合半衰期(t
1/2
)可以在约1分钟至约60小时、约20分钟至约50小时、或约2小时至约35小时、或约4小时至约20小时的范围内。优选地,本发明的特异性结合分子针对vvvgadgvgk-hla-a*11复合物具有从约1pm至约200pm的kd和/或从约4h至约20h的结合半衰期。当与治疗剂和/或可检测标记物相关联时,这种高亲和力对于可溶形式的特异性结合分子是优选的。
104.在另一个方面中,本发明的突变的特异性结合分子针对复合物可以有从约50nm至约200μm,或从约100nm至约2μm的kd,和/或针对复合物从约3sec至约12min的结合半衰期。这种特异性结合分子对于过继治疗应用可能是优选的。
105.确定结合亲和力(与平衡常数kd成反比)和结合半衰期(表示为t
1/2
)的方法是本领域技术人员已知的。在一个优选的实施方案中,结合亲和力和结合半衰期分别使用表面等离子体共振(spr)或生物层干涉法(bli)来确定,例如分别使用biacore仪器或octet仪器来确定。实施例1和实施例2中提供了优选的方法。将意识到的是,特异性结合分子的亲和力加倍导致kd减半。根据ln2除以解离率(k
off
)计算t
1/2
。因此,t
1/2
加倍导致k
off
减半。tcr的kd和k
off
值通常是对可溶形式的tcr进行测量的,即被截短以去除细胞质和跨膜结构域残基的那些形式(包括单链tcr和/或包含非天然二硫键或其他二聚结构域的tcr)。为了考虑独立测量之间的变化,尤其是解离时间超过20小时下的相互作用,可以使用相同的测定方案测量给定特异性结合分子的结合亲和力和/或结合半衰期数次(例如,3次或更多次),并取结果的平均值。为了比较两个样品(即两个不同的特异性结合分子和/或同一特异性结合分子的两种制剂)之间的结合数据,优选使用相同的测定条件(例如,温度)进行测量,例如实施例1和实施例2中所述的那些条件。
106.本发明的某些优选的突变的特异性结合分子对vvvgadgvgk-hla-a*11复合物的结合亲和力和/或结合半衰期显著高于天然tcr。增加天然tcr的结合亲和力可以降低tcr对其肽-mhc配体的特异性,这在zhao等,(2007)j.immunol,179:9,5845-5854中得到证实。然而,尽管本发明的这种突变的特异性结合分子具有比天然tcr显著更高的结合亲和力,其仍保持对vvvgadgvgk-hla-a*11复合物的特异性。
107.某些优选的本发明的突变的特异性结合分子能够在体外产生针对抗原阳性细胞的高效t细胞应答,特别是呈递低水平抗原的那些细胞(即,约5-100)。这种特异性结合分子可以是可溶性形式,并连接至免疫效应物,如抗cd3抗体。测量的t细胞应答可以是t细胞活化标志物(如干扰素γ或颗粒酶b)的释放、或靶细胞杀伤、或t细胞活化的其他量度,如t细胞增殖。优选地,高效响应是ec50或ic50值在pm范围内的响应,例如,1000pm或更低、或500pm或更低、或200pm或更低。
108.本发明的特异性结合分子可以包含tcr可变结构域。优选地,tcr可变结构域包含α链和β链的异二聚体。或,tcr可变结构域可以包含γ链和δ链的异二聚体。在一些情况下,本发明的特异性结合分子可以包含tcr可变结构域的同源二聚体,如αα或ββ同源二聚体(或γ
no:19)、ggsgg(seq id no:20)、gsggg(seq id no:21)、gsgggp(seq id no:22)、ggeps(seq id no:23)、ggegggp(seq id no:24)和ggegggsegggs(seq id no:25)(如在wo2010/133828中所描述的)和gggsgggg(seq id no:26)。其他的接头可以包括具有以下序列基序中的一个或多个的序列:gggs(seq id no:27)、ggggs(seq id no:28)、tvlrt(seq id no:29)、tvssas(seq id no:30)和tvlssas(seq id no:31)。在存在的情况下,恒定结构域中的一个或两个可以是全长的,或它们可以如上所述被截短和/或含有突变。优选地,单链tcr是可溶的。在某些实施方案中,本发明的单链tcr可以在各恒定结构域的残基之间具有引入的二硫键,如在wo 2004/033685中描述的。wo2004/033685;wo98/39482;wo01/62908;weidanz等,(1998)j immunol methods 221(1-2):59-76;hoo等,(1992)proc natl acad sci u s a 89(10):4759-4763;schodin(1996)mol immunol 33(9):819-829中进一步描述了单链tcr。
114.tcr可变结构域可以按双体形式排布。在双体形式中,两个单链片段以头尾方向二聚化,形成分子质量类似于串联scfv的紧凑分子(~50kda)。
115.本发明还包括显示本发明的特异性结合分子的颗粒,以及将所述颗粒包含在颗粒文库中。此类颗粒包括但不限于噬菌体、酵母细胞、核糖体或哺乳动物细胞。生产此类颗粒和文库的方法是本领域公知的(例如参见wo2004/044004;wo01/48145,chervin等,(2008)j.immuno.methods 339.2:175-184)。
116.本发明的特异性结合分子可用于将可检测的标记或治疗剂递送至抗原呈递细胞和含有抗原呈递细胞的组织。因此,其可以与可检测标记(用于诊断目的,其中特异性结合分子用于检测呈递同源抗原的细胞的存在)和/或治疗剂,包括免疫效应物;和/或药代动力学(pk)修饰部分结合(共价或以其他方式)。
117.pk修饰部分的实例包括但不限于peg(dozier等,(2015)int j mol sci.oct 28;16(10):25831-64和jevsevar等,(2010)biotechnol j.jan;5(1):113-28)、pasylation(schlapschy等,(2013)protein eng des sel.aug;26(8):489-501)、白蛋白、和白蛋白结合结构域(dennis等,(2002)j biol chem.sep 20;277(38):35035-43)、和/或非结构化的多肽(schellenberger等,(2009)nat biotechnol.dec;27(12):1186-90)。其他pk修饰部分包括抗体fc片段。pk修饰部分可用于延长本发明的特异性结合分子的体内半衰期。
118.当使用免疫球蛋白fc结构域时,它可以是任何抗体fc区。fc区是抗体的尾部区域,该区域与细胞表面fc受体和补体系统的一些蛋白质相互作用。fc区通常包含两条均具有两个或三个重链恒定结构域(称为ch2、ch3和ch4)的多肽链和以及铰链区。这两条链通过铰链区内的二硫键连接。来自免疫球蛋白亚类igg1、igg2和igg4的fc结构域结合fcrn并经历fcrn介导的再循环,这赋予了长的循环半衰期(3周至4周)。igg与fcrn的相互作用已定位于覆盖部分ch2和ch3结构域的fc区。用于本发明的优选免疫球蛋白fc包括但不限于来自igg1或igg4的fc结构域。优选地,fc结构域来源于人序列。fc区还可以优选地包括促进二聚化的kih突变,以及防止与活化受体(即功能沉默分子)相互作用的突变。免疫球蛋白fc结构域可以按任何合适的顺序或构型与其他结构域(即,tcr可变结构域和/或tcr恒定结构域和/或免疫效应物结构域)的c端或n端融合。免疫球蛋白fc可以通过接头与一个或多个其他结构域(即,tcr可变结构域和/或tcr恒定结构域和/或免疫效应物结构域)融合。接头序列通常是柔性的,因为它们主要由诸如不具有可能限制柔性的庞大侧链的甘氨酸、丙氨酸和丝氨酸的氨基酸组成。或,具有更大刚性的接头可能是期望的。可以容易地确定可用的接头序列
或接头序列的最佳长度。通常,接头序列的长度将小于约12个氨基酸,如小于10或为2至10个氨基酸。接头的长度可以为1、2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、21、22、23、24、25、26、27、28、29或30个氨基酸。可用于本发明的多结构域结合分子的适宜接头的实例包括但不限于:ggggs(seq id no:18)、gggsg(seq id no:19)、ggsgg(seq id no:20)、gsggg(seq id no:21)、gsgggp(seq id no:22)、ggeps(seq id no:23)、ggegggp(seq id no:24)和ggegggsegggs(seq id no:25)(如在wo2010/133828中所描述的)和gggsgggg(seq id no:26)。其他的接头可以包括具有以下序列基序中的一个或多个的序列:gggs(seq id no:27)、ggggs(seq id no:28)、tvlrt(seq id no:29)、tvssas(seq id no:30)和tvlssas(seq id no:31)。当免疫球蛋白fc与tcr融合时,它可以通过接头或不通过接头而与α链或β链融合。此外,fc的各个链可以与tcr的各个链融合。
119.优选地,fc区可以源自igg1或igg4亚类。这两条链可以包含ch2和ch3恒定结构域以及全部或部分铰链区。铰链区可以基本上或部分对应于来自iggl、igg2、igg3或igg4的铰链区。铰链可以包括全部或部分核心铰链结构域和全部或部分下铰链区。优选地,铰链区包含至少一个连接两条链的二硫键。
120.fc区可以包含相对于wt序列的突变。突变包括替换、插入和缺失。可以为了引入期望的治疗特性而进行此类突变。例如,为了促进异源二聚化,可以将杵臼结构(kih)突变工程化改造到ch3结构域中。在这种情况下,将一条链工程化改造为包含庞大的突出残基(即杵),例如y,而将另一条链工程化改造为包含一个互补的口袋(即臼)。kih突变的合适位置是本领域已知的。另外地或可替代地,可以引入消除或减少与fcy受体的结合和/或增加与fcrn的结合、和/或阻止fab臂交换或去除蛋白酶位点的突变。另外地或可替代地,可以进行突变以提高可制造性,例如去除或改变糖基化位点。
121.pk修饰部分也可以是白蛋白结合结构域,其也可以起到延长半衰期的作用。如本领域中已知的,白蛋白具有19天的长循环半衰期,部分原因在于其大小高于肾阈值以及由于其特异性相互作用和经由fcrn的再循环。与白蛋白连接是一种众所周知的改善治疗分子体内循环半衰期的策略。白蛋白可以通过使用特定的白蛋白结合结构域以非共价方式连接,或通过缀合或直接基因融合以共价方式连接。sleep等,biochim biophys acta.2013dec;1830(12):5526-34中给出了利用与白蛋白的连接来改善半衰期的治疗分子的例子。
122.白蛋白结合结构域可以是能够与白蛋白结合的任何部分,包括任何已知的白蛋白结合部分。白蛋白结合结构域可以选自特异性结合白蛋白的内源性或外源性配体、有机小分子、脂肪酸、肽和蛋白质。优选的白蛋白结合结构域的例子包括:短肽,如dennis等,j biol chem.2002sep 20;277(38):35035-43中描述的(例如肽qrlmediclprwgclweddf);经工程化改造以结合白蛋白的蛋白,如抗体、抗体片段和抗体样支架,例如由gsk商品化提供的(o'connor-semmes等,clin pharmacol ther.2014dec;96(6):704-12)和由ablynx商品化提供的(van roy等,arthritis res ther.2015may 20;17:135)以及基于在自然界中发现的白蛋白结合结构域(如链球菌蛋白g蛋白)的蛋白,例如由affibody商品化提供的
123.优选地,白蛋白是人血清白蛋白(hsa)。白蛋白结合结构域对人白蛋白的亲和力可
γ,
132.·
趋化因子,如il-8、血小板因子4、黑色素瘤生长刺激蛋白等
·
补体途径或fc受体激活剂
133.·
检查点抑制剂,如靶向pd1或pd-l1的那些
134.·
小分子细胞毒性剂,即具有杀伤哺乳动物细胞的能力的分子量小于700道尔顿的化合物。这种化合物还可以含有能够具有细胞毒性作用的有毒金属。此外,应当理解,这些小分子细胞毒性剂还包括前药,即在生理条件下衰变或转化以释放细胞毒性剂的化合物。这种药剂的实例包括顺铂、美登素衍生物、雷卡霉素、卡奇霉素、多西他赛、依托泊苷、吉西他滨、异环磷酰胺、伊立替康、美法仑、米托蒽醌、卟吩姆钠光敏素ii、替莫唑胺、拓扑替康、trimetreate arbourate、奥瑞斯他汀e、长春新碱和多柔比星
135.·
肽细胞毒素,即具有杀伤哺乳动物细胞能力的蛋白质或其片段。例如,蓖麻毒素、白喉毒素、假单胞菌细菌外毒素a、脱氧核糖核酸酶和核糖核酸酶;
136.·
放射性核素,即随着α或β粒子或γ射线中的一种或多种的同时发射而衰变的元素的不稳定同位素。例如,碘131、铼186、铟111、钇90、铋210和213、锕225和砹213;可以使用螯合剂来促进这些放射性核素与高亲和力tcr或其多聚体的缔合;
137.·
超级抗原及其突变体
138.·
肽-hla复合物,其中所述肽来源于常见人病原体,如爱泼斯坦巴尔病毒(ebv)
139.·
异种蛋白结构域、同种异体蛋白结构域、病毒/细菌蛋白结构域、病毒/细菌肽
140.优选的是与免疫效应物结合的本发明的可溶性特异性结合分子(通常通过以任何合适的构型融合到α链或β链的n端或c端,或两者)。tcr的n末端可以连接至免疫效应多肽的c末端。
141.特别优选的免疫效应物是抗cd3抗体或功能性片段或所述抗cd3抗体的变体。如本文所用,术语“抗体”涵盖这种片段和变体。抗cd3抗体的实例包括但不限于okt3、ucht-1、bma-031和12f6。适用于本文所述的组合物和方法的抗体片段和变体/类似物包括微型抗体、双体、fab片段、f(ab’)2片段、dsfv和scfv片段。在术语抗体中涵盖的其他实例包括nanobodies
tm
(这些构建体由ablynx(belgium)销售,其包含衍生自骆驼科动物(例如,骆驼或美洲驼)抗体的合成的单一免疫球蛋白重链可变结构域),域抗体(domantis,belgium),其包含亲和力成熟的单一免疫球蛋白重链可变结构域或免疫球蛋白轻链可变结构域,以及表现出抗体样结合特性的替代蛋白支架,如affibody(affibody,sweden),其包含工程化蛋白a支架,或anticalins(pieris,germany),其包含工程化anticalins,或darpins(molecular partners,switzerland),其包含设计的锚定蛋白重复蛋白。
142.融合分子的优选排布的实例包括在wo2010133828、wo2019012138和wo2019012141中描述的那些。
143.本发明的特异性结合分子可以包含:
144.第一多肽链,其包含所述α链可变结构域和抗体的可变结构域的第一结合区;和
145.第二多肽链,其包含所述β链可变结构域和所述抗体的可变结构域的第二结合区,
146.其中所述各自的多肽链结合,以使得所述特异性结合分子能够同时结合vvvgadgvgk(seq id no:1)hla-a*11复合物和所述抗体的抗原。
147.本文还提供了一种双特异性多肽分子,其选自包括第一多肽链和第二多肽链的分
子组,其中:所述第一多肽链包含特异性结合人免疫效应细胞的细胞表面抗原的抗体的可变结构域(vd1)的第一结合区,和
148.特异性结合mhc相关肽表位的tcr的可变结构域(vr1)的第一结合区,和
149.连接所述结构域的第一接头(link1);
150.所述第二多肽链包含特异性结合mhc相关肽表位的tcr可变结构域(vr2)的第二结合区,和
151.特异性结合人免疫效应细胞的细胞表面抗原的抗体的可变结构域(vd2)的第二结合区,和
152.连接所述结构域的第二接头(link2);
153.其中所述第一结合区(vd1)和所述第二结合区(vd2)结合以形成结合人免疫效应细胞的细胞表面抗原的第一结合位点(vd1)(vd2);
154.所述第一结合区(vr1)和所述第二结合区(vr2)结合以形成结合所述mhc相关肽表位的第二结合位点(vr1)(vr2);
155.其中所述两条多肽链与人igg铰链结构域和/或人igg fc结构域或其二聚体部分融合;和
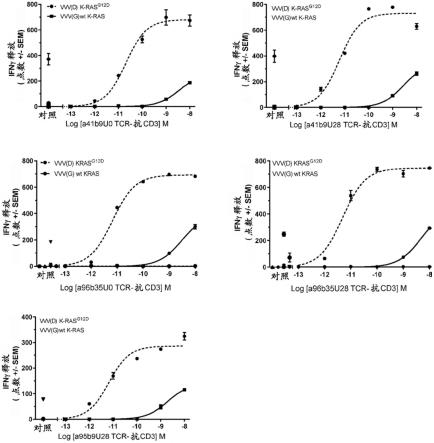
156.其中所述两条多肽链通过所述铰链结构域和/或fc结构域之间的共价和/或非共价键连接;和
157.其中所述双特异性多肽分子能够同时结合细胞表面分子和mhc相关肽表位,以及双特异性多肽分子,其中在两条多肽链中结合区的顺序选自vd1-vr1和vr2-vd2或vd1-vr2和vr1-vd2,或vd2-vr1和vr2-vd1或vd2-vr2和vr1-vd1,和其中所述结构域通过link1或link2连接,其中mhc相关肽表位是vvvgadgvgk复合物和mhc是hla-a*11。
158.特异性结合分子和抗cd3抗体的连接可以通过共价或非共价连接。共价连接可以是直接的,或通过接头序列间接的。接头序列通常是柔性的,因为它们主要由诸如不具有可能限制柔性的庞大侧链的甘氨酸、丙氨酸和丝氨酸的氨基酸组成。或,具有更大刚性的接头可能是期望的。可以容易地确定可用的接头序列或接头序列的最佳长度。通常,接头序列的长度将小于约12个氨基酸,如小于10或为2至10个氨基酸。可用于本发明的多结构域结合分子的适宜接头的实例包括但不限于:ggggs(seq id no:18)、gggsg(seq id no:19)、ggsgg(seq id no:20)、gsggg(seq id no:21)、gsgggp(seq id no:22)、ggeps(seq id no:23)、ggegggp(seq id no:24)和ggegggsegggs(seq id no:25)(如在wo2010/133828中所描述的)和gggsgggg(seq id no:26)。其他的接头可以包括具有以下序列基序中的一个或多个的序列:gggs(seq id no:27)、ggggs(seq id no:28)、tvlrt(seq id no:29)、tvssas(seq id no:30)和tvlssas(seq id no:31)。
159.本发明的抗cd3特异性结合分子融合构建体的具体实施方案包括那些α链和β链对,其中α链由包含seq id no:4-6的氨基酸序列的tcr可变结构域组成,和/或β链由包含seq id no:7-8的氨基酸序列的tcr可变结构域组成。所述α链和β链还可以包含恒定区,其包含非天然二硫键。α链的恒定结构域可以截短8个氨基酸。α链和β链的n末端或c末端可以通过接头融合至抗cd3 scfv抗体片段,所述接头选自seq id no:18-31。下表中提供了此类抗cd3特异性结合分子融合构建体的某些优选实施方案,并在图3中描述。
[0160][0161][0162]
连接至抗cd3的优选特异性结合分子包含seq id no:9和seq id no:10。
[0163]
在本发明的范围内还包括所述抗cd3-tcr融合构建体的功能性变体(也称为表型沉默变体)。所述功能性变体优选与参考序列具有至少90%的同一性,如90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%同一性,但在功能上是等效的。
[0164]
在一个进一步的方面中,本发明提供了编码本发明的特异性结合分子或特异性结合分子蛋白抗cd3融合物的核酸。在一些实施方案中,核酸是cdna。在一些实施方案中,核酸可以是mrna,例如,mrna编码的双特异性分子(stadler等,nat med.2017jul;23(7):815-817)。在一些实施方案中,本发明提供了包含编码本发明的tcr的α链可变结构域的序列的核酸。在一些实施方案中,本发明提供了包含编码本发明特异性结合分子的β链可变结构域的序列的核酸。核酸可以是非天然存在的和/或纯化的和/或工程化的。核酸序列可以根据所使用的表达系统进行密码子优化。如本领域技术人员所知,表达系统可以包括细菌细胞,如大肠杆菌、或酵母细胞、或哺乳动物细胞或昆虫细胞,或其可以是无细胞表达系统。在一些实施方案中,分子可以是编码双特异性抗体的mrna。
[0165]
在另一个方面中,本发明提供了包含本发明的核酸的载体。优选地,载体是tcr表达载体。适宜的tcr表达载体包括例如γ-逆转录病毒载体,或更优选地,慢病毒载体。更多详情可以参见zhang 2012及其参考文献(zhang等,adv drug deliv rev.2012jun 1;64(8):756
–
762)。
[0166]
本发明还提供了携带本发明的载体(优选tcr表达载体)的细胞。适宜的细胞包括哺乳动物细胞,优选免疫细胞,甚至更优选t细胞。载体可包含编码单个开放阅读框或两个不同的开放阅读框的本发明核酸,分别编码α链和β链。另一个方面提供了携带第一表达载体和第二表达载体的细胞,所述第一表达载体包含编码本发明的特异性结合分子的α链的核酸,所述第二表达载体包含编码本发明的特异性结合分子的β链的核酸。此类细胞在过继治疗中特别有用。本发明的细胞可以是分离的和/或重组的和/或非天然存在的和/或工程化的。
[0167]
由于本发明的特异性结合分子可用于过继性治疗,因此本发明包括非天然存在的和/或纯化的和/或工程化的细胞,特别是呈递本发明的特异性结合分子的t细胞。本发明还提供了呈递本发明的特异性结合分子的t细胞扩增群。存在许多适于用编码本发明的特异性结合分子的核酸(如dna、cdna或rna)转染t细胞的方法(参见例如robbins等,(2008)j immunol.180:6116-6131)。表达本发明的特异性结合分子的t细胞将适用于基于过继性治
疗的癌症治疗。如本领域技术人员将知晓的,有许多合适方法可以通过过继性治疗进行(参见例如rosenberg等,(2008)nat rev cancer 8(4))。如本领域所熟知的,包括包含本发明特异性结合分子的蛋白的体内生产可导致翻译后修饰。糖基化就是这样一种修饰,其包括寡糖部分与多肽链中限定的氨基酸的共价连接。例如,天冬酰胺残基或丝氨酸/苏氨酸残基是熟知的寡糖连接位置。特定蛋白质的糖基化状态取决于许多因素,包括蛋白质序列、蛋白质构象和某些酶的可用性。此外,糖基化状态(即,寡糖类型、共价键和附着总数)会影响蛋白功能。因此,当生产重组蛋白时,通常需要控制糖基化。受控糖基化已被用于改善基于抗体的治疗剂(jefferis等,(2009)nat rev drug discov mar;8(3):226-34.)。对于本发明的特异性结合分子,可以通过例如使用特定细胞系(包括但不限于哺乳动物细胞系,如中国仓鼠卵巢(cho)细胞或人胚肾(hek)细胞)或通过化学修饰来控制糖基化。这种修饰可能是期望的,因为糖基化可以改善药代动力学、降低免疫原性并且更接近地模拟天然人蛋白(sinclair和elliott,(2005)pharm sci.aug;94(8):1626-35)。在一些情况下,可以引入突变以控制和/或改善翻译后修饰。
[0168]
为了向患者施用,本发明的特异性结合分子(优选与可检测标记物或治疗剂相结合或在转染的t细胞上表达)、本发明的特异性结合分子抗cd3融合分子、核酸、表达载体或细胞可以作为无菌药物组合物的一部分与一种或多种药学上可接受的运载体或赋形剂一起提供。该药物组合物可以是任何合适的形式(取决于将其施用于患者的所需方法)。其可以以单位剂型提供,通常在密封容器中提供,并且可以作为试剂盒的一部分提供。这种试剂盒会通常(但并非必然)包括使用说明。它可以包括多个所述单位剂型。
[0169]
药物组合物可以适于通过任何适当途径的施用,例如肠胃外(包括皮下、肌内、囊内或静脉内)、肠内(包括口服或直肠)、吸入或鼻内途径。这种组合物可以通过药学领域已知的任何方法制备,例如通过在无菌条件下将活性成分与运载体或赋形剂混合来制备。
[0170]
本发明的物质的剂量可以在宽限度内变化,这取决于待治疗的疾病或病症、待治疗个体的年龄和状况等,特异性结合分子-抗cd3融合分子的合适剂量范围可以在25ng/kg至50μg/kg或1μg至1g的范围内。医师将最终确定所使用的适当剂量。在wo2017208018中提供了适宜的剂量方案的实例。
[0171]
本发明的特异性结合分子、特异性结合分子-抗cd3融合分子、药物组合物、载体、核酸和细胞可以基本纯的形式提供,例如纯度为至少80%、至少85%、至少90%、至少91%、至少92%、至少93%、至少94%、至少95%、至少96%、至少97%、至少98%、至少99%或100%。
[0172]
本发明还提供:
[0173]
·
本发明的特异性结合分子、特异性结合分子-抗cd3融合分子、核酸、药物组合物或细胞用于医学用途,优选用于治疗癌症的方法,包括但不限于胰腺、结直肠、肺(包括非小细胞肺癌)、卵巢(包括透明细胞、子宫内膜样、粘液)、胃肠道(包括胆管、胆囊、小肠、壶腹、盲肠、阑尾)和子宫内膜。特别优选的癌症适应症是胰腺和结直肠。
[0174]
·
本发明的特异性结合分子、特异性结合分子-抗cd3融合分子、核酸、药物组合物或细胞在制备用于治疗癌症的药物中的用途,包括但不限于胰腺、结直肠、肺(包括非小细胞肺癌)、卵巢(包括透明细胞、子宫内膜样、粘液)、胃肠道(包括胆管、胆囊、小肠、壶腹、盲肠、阑尾)和子宫内膜。特别优选的癌症适应症是胰腺和结直肠。
[0175]
·
治疗癌症的方法,包括向有需要的受试者施用治疗有效量的特异性结合分子-抗cd3融合分子,包括但不限于胰腺、结直肠、肺(包括非小细胞肺癌)、卵巢(包括透明细胞、子宫内膜样、粘液)、胃肠道(包括胆管、胆囊、小肠、壶腹、盲肠、阑尾)和子宫内膜。特别优选的癌症适应症是胰腺和结直肠。
[0176]
·
用于向人受试者施用的可注射制剂,其包含本发明的特异性结合分子、特异性结合分子-抗cd3融合分子、核酸、药物组合物或细胞。
[0177]
本发明的特异性结合分子、特异性结合分子-抗cd3融合分子、核酸、药物组合物或细胞可以通过注射施用,如静脉内、皮下或直接瘤内注射。人受试者可以是hla-a*02亚型。患者可在治疗前进行筛选以确定突变体kras蛋白的表达和/或突变肽的存在。另外第地或备选地,可以针对hla-a11对患者进行筛选。当考虑治疗肿瘤时,肿瘤可以是实体或液体肿瘤。
[0178]
治疗方法还可以包括单独、组合或顺序地施用一种或多种另外的抗肿瘤剂。
[0179]
术语“治疗(treatment/treat/treating)”指减缓、阻止或逆转癌症的进展。这些术语还包括缓解、改善、减轻、消除或减少一种或多种病症或病况的症状,即使癌症实际上没有被消除,即使癌症的进展本身没有被减缓、停止或逆转。
[0180]“治疗有效量”是指向受试者施用的化合物或其药学上可接受的盐的量,其将引起受试者的生物学或医学应答或期望的治疗效果。
[0181]
作为本领域技术人员,主治医师可以通过使用已知技术并通过观察类似情况下获得的结果来容易地确定治疗有效量。在确定受试者的有效量时,主治医师会考虑很多因素,包括但不限于:体型、年龄和一般健康状况;所涉及的特定疾病或病症;疾病或病症的程度或累积或严重程度;个体受试者的应答;所施用的特定化合物;施用模式;所施用制剂的生物利用度特征;所选择的剂量方案;伴随药物的使用;以及其他相关情况。
[0182]
本发明的每个方面的优选特征在细节上作必要修改后用于每个其他方面。本文提到的现有技术文件在法律允许的最大范围内并入本文。
附图说明
[0183]
图1提供了可溶性支架tcr的α和β可变和恒定结构域的氨基酸序列。cdr序列带有下划线。
[0184]
图2提供了突变的tcrα和β可变结构域的示例性氨基酸序列。cdr用下划线表示,与wt序列相关的突变用粗体表示。
[0185]
图3提供了引入突变的tcr可变结构域的tcr-抗cd3融合蛋白的示例性氨基酸序列。
[0186]
图4提供了示例性图形数据,表明tcr-抗cd3融合蛋白能够在用突变体kras肽(标记的vvv(d)k-ras
g12d
)冲击的细胞存在下,相对于用wt kras肽冲击的细胞(标记的vvv(g)wt k-ras)驱动有效的t细胞活化。将ifnγ释放作为t细胞活化的读数。
[0187]
图5提供了示例性图形数据,表明tcr-抗cd3融合蛋白能够在表达突变体kras的癌细胞系(panc-1xa11β2m和cl40)的存在下驱动有效的t细胞活化。细胞系nci-h2030和sk-mel-28表达wt kras。将ifnγ释放作为t细胞活化的读数。
[0188]
图6提供了示例性图形数据,表明tcr-抗cd3融合物介导表达突变体kras肽(cl40)
的癌细胞系相对于表达wt kras肽(sk-mel-28)的细胞系的有效杀伤。将在72h剩余的靶细胞百分比作为靶细胞死亡的标志物。
[0189]
图7提供了示例性图形数据,表明tcr-抗cd3融合蛋白在低于1nm的浓度下对源自正常组织(正常细胞)的细胞系产生很少或没有活性。分别将panc-1xa11β2m和sk-mel-28细胞作为阳性和阴性对照。将ifnγ释放作为t细胞活化的读数。
[0190]
以下非限制性实施例进一步描述了本发明。
实施例
[0191]
实施例1
–
wt tcr的分离和表征
[0192]
a)可溶性wt tcr的制备
[0193]
使用已知的t细胞克隆方法从供体pbmc中鉴定出识别vvvgadgvgk-hla-a*11复合物的tcr,随后通过race鉴定出tcr链。
[0194]
如此前所述,将wt tcr制备为可溶性αβ异二聚体(boulter等,protein eng.2003sep;16(9):707-11和wo03/020763)。
[0195]
简言之,使用标准方法将编码包含在seq id no 1和2中提供的氨基酸序列的可溶性tcr的α和β胞外区的dna序列分别克隆进入表达质粒,并且分别转化进入大肠杆菌菌株rosetta 2(de3)plyss中。为了进行表达,将细胞在补充了1%甘油(+100μg/ml氨苄西林和34μg/ml氯霉素)的自动诱导培养基中在37℃下生长2小时,然后将温度降至30℃并孵育过夜。用bugbuster蛋白提取试剂(merck millipore)裂解收获的细胞球团。通过离心回收内含体球团,在triton缓冲液中洗涤两次(50mm tris-hci ph 8.1,0.5% triton-x100,100mm nacl,10mm naedta),并且最终重悬在无去垢剂缓冲液(50mm tris-hcl ph 8.1,100mm nacl,10mm naedta)中。
[0196]
为了重折叠,首先将内含体混合并稀释到溶解/变性缓冲液(6m盐酸胍,50mm tris hcl ph 8.1,100mm nacl,10mm edta,20mm dtt)中,然后在37℃下孵育30min。然后通过进一步稀释到重折叠缓冲液(100mm tris ph 8.1,800或400mm l-精氨酸hcl,2mm edta,4m尿酸,6.5mm半胱胺盐酸盐和1.9mm胱胺盐酸盐)中开始重折叠。然后在5℃
±
3℃下,将重折叠混合物用10l h2o/l重折叠透析18-20小时。在此之后,用10mm tris ph 8.1(10l)两次替换透析缓冲液,并继续透析15小时。然后将透析混合物过滤通过0.45μm纤维素过滤器。然后将样品应用于50hq阴离子交换柱,并用0-500mm nacl在20mm tris ph 8.1中的梯度在6个柱体积上洗脱结合蛋白。通过sds page鉴定峰组分,随后混合和浓缩。然后将浓缩样品应用于在dulbecco pbs缓冲液中预平衡的200increase 10/300gl凝胶过滤柱(ge healthcare)。将峰组分混合和浓缩。
[0197]
b)可溶性wt tcr的生物物理特征
[0198]
使用表面等离子体共振(spr)评估可溶性tcr与vvvgadgvgk-hla-a*11复合物的结合。通过测量非突变kras肽vvvgagggvgk以及具有高序列同源性和/或具有与丙氨酸扫描方法鉴定的相同结合基序的其他肽的交叉识别来确定结合特异性。还评估了与另一个常见的不同长度的hla-a11肽库(称为cpmix)的交叉反应。
[0199]
首先,从大肠杆菌中制备截短的和生物素化的hla-a11重链和人β2-微球蛋白(β2m)作为内含体,并如前所述重新折叠和纯化(garboczi,hung,&wiley,1992;o’callaghan
8.1,然后浓缩并直接应用于凝胶过滤基质。
[0209]
b)可溶性tcr-抗cd3融合蛋白的生物物理表征
[0210]
使用与实施例1中所述类似的spr方法进行结合分析。除了高亲和力相互作用以外,通过单循环动力学分析确定结合参数。将五种不同浓度的可溶性tcr或融合蛋白以50-60μl min-1
的流速注射至用~50
–
200ru的肽-hla复合物涂覆的流动池。通常,以2-100nm之间的最高浓度注射60-200μl可溶性tcr或融合分子,其他四次注射使用连续2倍稀释。首先注射最低浓度。为测量解离相,注入缓冲液直至≥通常在1-3小时后发生10%的解离。使用生产厂商的软件计算动力学参数。将解离相拟合至单指数衰变方程,从而能够计算半衰期。根据k
off
/k
on
计算平衡常数kd。
[0211][0212]
这些数据表明,高亲和力变体保留了对vvvgadgvgk-hla-a*11复合物的结合特异性,并且能够区分突变和非突变kras肽。
[0213]
实施例3-可溶性tcr-抗cd3融合蛋白的细胞分析
[0214]
可溶性tcr-抗cd3融合蛋白介导有效和特异性t细胞活化
[0215]
a)肽冲击细胞
[0216]
测试tcr-抗cd3融合蛋白在用突变体g12d肽或wt肽冲击的靶细胞存在下介导t细胞活化的能力。
[0217]
使用ifnγ释放评估t细胞活化并且使用elispot测定试剂盒进行检测。将hla-a11+ve sup-b15细胞作为靶细胞并使用10μm肽冲击。将从供体血液获得的hla-a11+pbmc作为效应细胞。效应物与靶点的比率为1:1。使用人ifn-γelispot试剂盒(bd biosciences)根据生产厂商的说明书进行测定。简言之,在测定前使用ifn-γ抗体包被elispot板1-7天。在测定当天,使用100μl测定培养基(r10)封闭elispot板。去除封闭后,将靶细胞以50,000/孔在50μl中铺板。对融合蛋白进行滴定,以获得跨越预期生物活性范围的最终浓度(典型地,对数或半对数稀释的最高浓度为10nm),并以50μl的体积添加到孔中。将效应细胞从液氮中解冻,计数并以40-50,000个细胞/孔用50μl铺板(每个实验所用细胞的确切数量取决于供体,可进行调整以在适合的测定范围内产生应答)。用r10使每个孔的最终体积达到200μl。将板/细胞培养过夜并在第二天洗涤板,按照生产厂商的说明书进行测定,并在室温下干燥至少2小时,然后使用带有immunospot软件(cellular technology limited)的ctl分析仪对点计数。使用prism软件绘制剂量应答曲线。
[0218]
对照包括用i)单独用靶点和/或效应物,ii)效应物和10nm tcr-抗cd3融合物制备的样品。
[0219]
结果
[0220]
本发明的tcr-抗cd3融合蛋白在呈递突变体kras肽(vvvgadgvgk)hla-a*11复合物的细胞存在下导致有效且特异性的t细胞活化。在每种情况下,突变体和wt肽之间t细胞活化所需的浓度至少有100倍的差异,表明tcr-抗cd3融合蛋白可以充分区分突变体和wt肽。图4中提供了5种tcr-抗cd3融合蛋白的图形数据。
[0221]
b)细胞系
[0222]
使用抗原阳性或阴性的细胞系进一步测试tcr-抗cd3融合蛋白对t细胞的活化。
[0223]
在该实施例中,将以下人癌细胞系作为靶细胞:
[0224]
·
panc-1xa11β2m(胰腺)抗原阳性(kras g12d阳性;用hla-a11和β2m转导)
[0225]
·
cl40(结直肠)抗原阳性(kras g12d阳性)
[0226]
·
sk-mel-28(黑色素瘤)抗原阴性(wt kras阳性)
[0227]
·
nci-h2030(肺)抗原阴性(kras g12c阳性)
[0228]
用6点浓度范围的tcr-抗cd3融合蛋白处理细胞系,并与从供体血液中获得的hla-a11+pbmc以0.8:1的效应物与靶点的比率共培养。如上文所述,通过elispot测定测量ifnγ释放。
[0229]
结果
[0230]
本发明的tcr-抗cd3融合蛋白在天然存在突变体kras肽的细胞存在下介导有效的t细胞活化,ec
50
值在皮摩尔范围内(≤1000pm)。存在wt肽或替代突变体肽的细胞系在低于1nm的tcr-抗cd3融合物浓度下导致很少或没有t细胞活化。图5中提供了两种tcr-抗cd3融合蛋白的图形数据。
[0231]
c)可溶性tcr-抗cd3融合蛋白介导有效和特异性的癌细胞系杀伤
[0232]
测试tcr-抗cd3融合蛋白驱动t细胞介导杀伤抗原阳性或阴性癌细胞系的能力。
[0233]
在该实施例中,分别将cl40和sk-mel-28作为阳性和阴性靶细胞。用7点浓度范围的tcr-抗cd3融合蛋白处理靶细胞,并使用incucyte zoom平台在半胱天冬酶敏感的绿色荧光探针存在下与hla-a11+pbmc共培养72h。每2h采集一次图像,并使用incucyte zoom软件检测和分析红色荧光靶细胞的重定向t细胞杀伤作用。使用prism软件绘制剂量应答曲线并计算ic
50
值。
[0234]
结果
[0235]
在抗原阳性细胞存在下,每个tcr-抗cd3融合蛋白的ic50值如下表所示。四种tcr-抗cd3融合蛋白的图形数据如图6中所示。
[0236][0237][0238]
这些数据表明,本发明的tcr-抗cd3融合蛋白驱动自然呈递vvvgadgvgk-hla-a*11复合物的结直肠癌细胞系的有效t细胞介导的杀伤。ic50值在皮摩尔范围内(≤1000pm)。在
低于1nm的tcr-抗cd3融合物浓度下,观察到很少或没有t细胞介导的sk-mel-28细胞的杀伤。
[0239]
实施例4-tcr抗-cd3融合蛋白的进一步的特异性测试
[0240]
通过在来自正常健康组织的一组细胞系存在下评估t细胞活化,进一步测试tcr-抗cd3融合蛋白作为治疗剂的适用性。
[0241]
用6点浓度范围的tcr-抗cd3融合蛋白处理细胞系,并与从供体血液中获得的hla-a11+pbmc以1:1的效应物与靶点的比率共培养。如上文所述,通过elispot测定测量ifnγ释放。将panc-1xa11和sk-mel-28分别作为阳性对照和阴性对照。
[0242]
结果
[0243]
这些数据表明,本发明的tcr-抗cd3融合蛋白在≤1nm的浓度下针对各种正常组织产生最小的t细胞活性或无活性。图7中提供了两种tcr-抗cd3融合蛋白的图形数据。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1