用于抑制YTHDF1的组合物和方法
背景技术:
1、针对肿瘤新抗原的自发性t细胞致敏对于免疫疗法的临床疗效至关重要。但是,在许多患者中,新抗原识别不足以诱导完全肿瘤排斥所需的持续的t细胞应答。鉴定影响肿瘤新抗原免疫应答性的分子途径可为改善免疫疗法的应答提供靶点。例如,m6a是最丰富的内部mrna修饰,负责多种细胞类型mrna的转录后调控。此外,m6a可通过m6a结合蛋白包含yth结构域的家族蛋白1(ythdf1)影响mrna的翻译效率。以前的研究显示,在免疫系统(例如,抗原呈递细胞)的各种细胞中减弱ythdf1的活性可有助于诱导充分和持续的抗肿瘤免疫应答。但是,减弱ythdf1活性的有效组合物和方法仍然是迫切需要的。
技术实现思路
1、本技术提供用于减弱ythdf1活性的组合物和方法。本技术还提供经修饰的抗原呈递细胞(mapc),诸如经修饰的树突状细胞,具有增强的活性。本技术的组合物和mapc可用于以下的一种或多种目的:激活apc(诸如dc);产生具有增强的抗肿瘤活性的免疫细胞;防止和/或逆转免疫细胞(诸如t细胞)的耗竭;治疗与有需要的受试者中的抗原表达相关的疾病、病症或病况;在有需要的受试者中治疗癌症;在有需要的受试者中刺激t细胞介导的对癌细胞和/或肿瘤抗原的免疫应答;在有需要的受试者中提供抗肿瘤免疫;增加和/或改善肿瘤浸润性t细胞的增殖和/或活性;增加和/或改善肿瘤特异性t细胞的增殖和/或活性;增强t细胞的细胞因子的产生;12)增强肿瘤免疫疗法的抗肿瘤反应;13)抑制肿瘤生长,抑制肿瘤细胞的增殖,和/或杀死肿瘤细胞。本技术还提供用于增强免疫应答的方法和组合物,该组合物结合了本技术的ythdf1减弱剂和第二活性药剂,诸如免疫检查点抑制剂。
2、ythdf1是yth结构域家族的成员,是经m6a修饰的“阅读器”。例如,通过与翻译起始因子相互作用,ythdf1有助于提高mrna的翻译效率。此外,ythdf1的失调可打破原癌基因和肿瘤抑制因子之间的表达平衡,暗示ythdf1与肿瘤发生之间的联系。据报道,ythdf1的过表达与一些恶性肿瘤如结直肠癌(crc)和肝细胞癌(hcc)有关。此外,发现ythdf1缺陷(ythdf1-/-)小鼠表现出提高的抗肿瘤免疫应答,表明ythdf1是新的潜在治疗靶点。ythdf1也被发现与t细胞耗竭标记基因的表达有关。在t细胞中缺乏ythdf1的小鼠对淋巴瘤、实体瘤(诸如黑素瘤和结肠癌)和其他类型的癌症显示出更好的抗肿瘤免疫。ythdf1缺陷小鼠中的肿瘤浸润性t细胞功能增强。此外,拯救t细胞耗竭的分化以朝向记忆样或干细胞样cd8+t细胞的命运。
3、一方面,本技术提供一种yth n6-甲基腺苷rna结合蛋白1(ythdf1)减弱剂,该药剂包含一种化合物,当与ythdf1结合时,化合物结合至少一个残基,对应于选自seq id no:1的氨基酸残基372-392、479-494和526-535的残基。
4、在一些实施方案中,当与ythdf1结合时,包含ythdf1减弱剂的化合物结合至少一个残基,对应于以下残基:seq id no:1的n378、f382、w384、f480和h528。
5、在一些实施方案中,包含ythdf1减弱剂的化合物能够阻断ythdf1与m6a的结合。
6、在一些实施方案中,包含ythdf1减弱剂的化合物基本上不与m6a竞争结合ythdf1。
7、在一些实施方案中,ythdf1减弱剂包括式i化合物、式i化合物的前药、代谢物、衍生物或上述任一者的药学上可接受的盐、酯或酰胺:(式1),其中r1选自c1-50烃基、c1-50经取代烃基、c1-50杂烃基和c1-50经取代杂烃基。
8、在一些实施方案中,式i中的r1为(co)-r2,且r2为任选经取代的烯基。在一些实施方案中,r2为ch=ch-r3,且r3为任选经取代的芳基。在一些实施方案中,r3为式ii其中其中a为任选经取代的呋喃或r6为羟基,且r5为任选经取代的烯基。
9、在一些实施方案中,在式ii中,a为且r4为
10、在一些实施方案中,在式ii中,a为r6为羟基,r5为ch=ch-r7,且r7为
11、在一些实施方案中,包含本技术的ythdf1减弱剂的化合物包含至少两个二羟基苯基部分。
12、在一些实施方案中,包含本技术的ythdf1减弱剂的化合物包含至少三个二羟基苯基部分。
13、在一些实施方案中,ythdf1减弱剂包括式iii的化合物、式iii化合物的前药、代谢物、衍生物或上述任一者的药学上可接受的盐、酯或酰胺:
14、(式iii),其中a为任选经取代的呋喃或r6为羟基,且r5为任选经取代的烯基。
15、在一些实施方案中,在式iii中,a为且r4为
16、在一些实施方案中,在式iii中,a为r6为羟基,r5为ch=ch-r7,且r7为
17、在一些实施方案中,化合物包含下列任一种化合物、下列任一种化合物的前药、代谢物、衍生物或上述任一者的药学上可接受的盐、酯或酰胺:
18、
19、在一些实施方案中,化合物包含下列任一种化合物、下列任一种化合物的前药、代谢物、衍生物或上述任一者的药学上可接受的盐、酯或酰胺:
20、
21、在一些实施方案中,化合物包括下列任一种化合物、下列任一种化合物的前药、代谢物、衍生物或上述任一者的药学上可接受的盐、酯或酰胺:
22、
23、在一些实施方案中,包含ythdf1减弱剂的化合物是来源于植物的。
24、在一些实施方案中,在植物提取物中提供包含ythdf1减弱剂的化合物。在一些实施方案中,植物为鼠尾草属植物。在一些实施方案中,植物为丹参(danshen)。
25、一方面,本技术提供一种经修饰的抗原呈递细胞(mapc),其中mapc已用本技术的ythdf1减弱剂处理和/或包含本技术的ythdf1减弱剂。在一些实施方案中,mapc是经修饰的树突状细胞(mdc)。
26、一方面,本技术提供一种组合物,组合物包含本技术的ythdf1减弱剂和/或本技术的mapc。在一些实施方案中,本技术的组合物包含药学上可接受的载剂。在一些实施方案中,组合物是疫苗组合物。
27、在一些实施方案中,组合物进一步包含第二活性成分。在一些实施方案中,第二活性成分是抗癌剂。
28、在一些实施方案中,第二活性成分包含癌症免疫疗法。在一些实施方案中,第二活性成分包含免疫检查点抑制剂。在一些实施方案中,第二活性成分包括选自以下的药剂:抗pd-l1抗体或其抗原结合部分、抗pd-1抗体或其抗原结合部分、抗ctla-4抗体或其抗原结合部分以及ido抑制剂。
29、在一些实施方案中,第二活性成分包括帕博利珠单抗(pembrolizumab)、纳武利尤单抗(nivolumab)、西米普利单抗(cemiplimab)、阿替利珠单抗(atezolizumab)、阿维鲁单抗(avelumab)、度伐利尤单抗(durvalumab)、伊匹单抗(ipilimumab)和/或上述任一者的抗原结合片段或衍生物。
30、在一些实施方案中,第二活性成分能够在接受它的受试者中引起一种或多种肿瘤抗原的增加。
31、在一些实施方案中,肿瘤抗原选自cea、gp100、mage家族蛋白、dage、gage、rage、ny-eso 1、melan-a/mart 1、trp-1、trp-2、酪氨酸酶、her-2/neu、muc-1、p53、ksa、psa、psma及其片段和修饰形式。
32、在一些实施方案中,第二活性成分包含在单独的容器中,并且未与mapc或ythdf1减弱剂混合。
33、一方面,本技术提供一种减弱ythdf1活性的方法,包括施用有效量的本技术的ythdf1减弱剂。
34、在一些实施方案中,该方法是体内方法。在一些实施方案中,该方法是体外方法。在一些实施方案中,该方法是离体方法。
35、一方面,本技术提供一种确定候选药剂是否为ythdf1减弱剂的方法,包括:使候选药剂与ythdf1突变体接触,其中该ythdf1突变体在一个或多个残基处包括一个或多个氨基酸取代、缺失和/或添加,该残基对应于选自seq id no:1的残基372-392、479-494和526-535的残基。
36、在一些实施方案中,ythdf1突变体在一个或多个残基处包括一个或多个氨基酸取代、缺失和/或添加,该残基对应于选自seq id no:1的残基n378、f382、w384、f480和h528的残基。
37、在一些实施方案中,该方法进一步包括确定候选药剂是否与ythdf1突变体特异性结合。
38、一方面,本技术提供一种试剂盒,其包含本技术的ythdf1突变体。
39、一方面,本技术提供化合物在制备ythdf1减弱剂中的用途,其中,在与ythdf1结合时,该化合物与至少一个残基结合,该残基对应于选自seq id no:1的氨基酸残基372-392、479-494和526-535的残基。
40、在一些实施方案中,在与ythdf1结合时,该化合物与下列残基对应的至少一个残基结合:seq id no:1的n378、f382、w384、f480和h528。
41、在一些实施方案中,化合物能够阻断ythdf1与m6a的结合。
42、在一些实施方案中,化合物基本上不与m6a竞争结合ythdf1。
43、在一些实施方案中,化合物包含式i化合物、式i化合物的前药、代谢物、衍生物或上述任一者的药学上可接受的盐、酯或酰胺:
44、(式i),其中r1选自c1-50烃基、c1-50经取代烃基、c1-50杂烃基和c1-50经取代杂烃基。
45、在一些实施方案中,在式i化合物中,r1为(co)-r2,且r2为任选经取代的烯基。在一些实施方案中,r2为ch=ch-r3,且r3为任选经取代的芳基。
46、在一些实施方案中,r3为式ii其中a为任选经取代的呋喃或r6为羟基,且r5为任选经取代的烯基。
47、在一些实施方案中,在式ii中,a为且r4为
48、在一些实施方案中,在式ii中,a为r6为羟基,r5为ch=ch-r7,且r7为
49、在一些实施方案中,化合物包含至少两个二羟基苯基部分。
50、在一些实施方案中,化合物包含至少三个二羟基苯基部分。
51、在一些实施方案中,化合物包含式iii的化合物、式iii化合物的前药、代谢物、衍生物,或上述任一者的药学上可接受的盐、酯或酰胺:
52、(式iii),其中a为任选经取代的呋喃或r6为羟基,且r5为任选经取代的烯基。
53、在一些实施方案中,在式iii中,a为且r4为
54、在一些实施方案中,a为r6为羟基,r5为ch=ch-r7,且r7为
55、在一些实施方案中,化合物包含下列化合物中的任一种、下列任一种化合物的前药:
56、在一些实施方案中,化合物是来源于植物的。在一些实施方案中,在植物提取物中提供化合物。在一些实施方案中,植物为鼠尾草属植物。在一些实施方案中,植物为丹参(danshen)。
57、一方面,本技术提供激活apc的方法,该方法包括向该apc施用本技术的ythdf1减弱剂。
58、一方面,本技术提供激活dc的方法,该方法包括向该dc施用本技术的ythdf1减弱剂。
59、一方面,本技术提供治疗有需要的受试者中与抗原表达相关的疾病、病症或病况的方法,包括向该受试者施用:本技术的ythdf1减弱剂;本技术的mapc;和/或本技术的组合物。
60、在该方法的一些实施方案中,该抗原是肿瘤抗原。
61、在该方法的一些实施方案中,该抗原是选自以下的肿瘤抗原:cea、gp100、mage家族蛋白、dage、gage、rage、ny-eso 1、melan-a/mart 1、trp-1、trp-2、酪氨酸酶、her-2/neu、muc-1、p53、ksa、psa、psma及其片段和修饰形式。
62、在该方法的一些实施方案中,该疾病、病症或病况是癌症。
63、在一些实施方案中,该癌症选自血液肿瘤、淋巴瘤和实体肿瘤。
64、在一些实施方案中,该癌症选自黑素瘤、乳腺癌、肺癌、卵巢癌、脑癌、肝癌、宫颈癌、结肠癌、结直肠癌、肾癌、皮肤癌、头颈癌、骨癌、食管癌、膀胱癌、子宫癌、淋巴癌、胃癌、胰腺癌、睾丸癌、淋巴瘤和白血病。
65、一方面,本技术提供在有需要的受试者中治疗癌症的方法,包括向该受试者施用:本技术的ythdf1减弱剂;本技术的mapc;和/或本技术的组合物。在一些实施方案中,该癌症选自血液肿瘤、淋巴瘤和实体肿瘤。在一些实施方案中,该癌症选自黑素瘤、乳腺癌、肺癌、卵巢癌、脑癌、肝癌、宫颈癌、结肠癌、结直肠癌、肾癌、皮肤癌、头颈癌、骨癌、食管癌、膀胱癌、子宫癌、淋巴癌、胃癌、胰腺癌、睾丸癌、淋巴瘤和白血病。
66、一方面,本技术提供在有需要的受试者中刺激t细胞介导的对癌细胞和/或肿瘤抗原的免疫应答的方法,包括向该受试者施用:本技术的ythdf1减弱剂;本技术的mapc;和/或本技术的组合物。在一些实施方案中,该肿瘤抗原选自cea、gp100、mage家族蛋白、dage、gage、rage、ny-eso 1、melan-a/mart 1、trp-1、trp-2、酪氨酸酶、her-2/neu、muc-1、p53、ksa、psa、psma及其片段和修饰形式。
67、一方面,本技术提供在有需要的受试者中抗肿瘤免疫的方法,包括向该受试者施用:本技术的ythdf1减弱剂;本技术的mapc;和/或本技术的组合物。
68、一方面,本技术提供在有需要的受试者中预防和/或逆转t细胞耗竭的方法,包括向该受试者施用:本技术的ythdf1减弱剂;本技术的mapc;和/或本技术的组合物。
69、一方面,本技术提供在有需要的受试者中增强t细胞活性的方法,包括向该受试者施用:本技术的ythdf1减弱剂;本技术的mapc;和/或本技术的组合物。在一些实施方案中,该t细胞包括肿瘤浸润性t细胞。在一些实施方案中,该t细胞包括肿瘤特异性t细胞。
70、在本技术的该方法的一些实施方案中,该受试者是癌症患者。在一些实施方案中,该癌症选自血液肿瘤、淋巴瘤和实体肿瘤。在一些实施方案中,该癌症选自黑素瘤、乳腺癌、肺癌、卵巢癌、脑癌、肝癌、宫颈癌、结肠癌、结直肠癌、肾癌、皮肤癌、头颈癌、骨癌、食管癌、膀胱癌、子宫癌、淋巴癌、胃癌、胰腺癌、睾丸癌、淋巴瘤和白血病。
71、在一些实施方案中,该受试者已接受,正在接受和/或将接受抗癌治疗。在一些实施方案中,该抗癌治疗包括癌症免疫疗法。在一些实施方案中,该抗癌治疗包括免疫检查点抑制剂。在一些实施方案中,该抗癌治疗包括选自以下的药剂:抗pd-l1抗体或其抗原结合部分、抗pd-1抗体或其抗原结合部分、抗ctla-4抗体或其抗原结合部分以及ido抑制剂。在一些实施方案中,该抗癌治疗包括帕博利珠单抗、纳武利尤单抗、西米普利单抗、阿替利珠单抗、阿维鲁单抗、度伐利尤单抗、伊匹单抗和/或上述任一者的抗原结合片段或衍生物。在一些实施方案中,该抗癌治疗能够在该受试者中引起一种或多种肿瘤抗原的增加。在一些实施方案中,该肿瘤抗原选自cea、gp100、mage家族蛋白、dage、gage、rage、ny-eso 1、melan-a/mart 1、trp-1、trp-2、酪氨酸酶、her-2/neu、muc-1、p53、ksa、psa、psma及其片段和修饰形式。
72、在一些实施方案中,该方法进一步包括向受试者施用一种或多种额外的抗癌治疗。在一些实施方案中,额外的抗癌治疗包括癌症免疫疗法。在一些实施方案中,额外的抗癌治疗包括免疫检查点抑制剂。在一些实施方案中,额外的抗癌治疗包括选自以下的药剂:抗pd-l1抗体或其抗原结合部分、抗pd-1抗体或其抗原结合部分、抗ctla-4抗体或其抗原结合部分以及ido抑制剂。在一些实施方案中,额外的抗癌治疗包括帕博利珠单抗、纳武利尤单抗、西米普利单抗、阿替利珠单抗、阿维鲁单抗、度伐利尤单抗、伊匹单抗和/或上述任一者的抗原结合片段或衍生物。在一些实施方案中,额外的抗癌治疗能够在该受试者中引起一种或多种肿瘤抗原的增加。在一些实施方案中,肿瘤抗原选自cea、gp100、mage家族蛋白、dage、gage、rage、ny-eso 1、melan-a/mart 1、trp-1、trp-2、酪氨酸酶、her-2/neu、muc-1、p53、ksa、psa、psma及其片段和修饰形式。
73、一方面,本技术提供本技术的ythdf1减弱剂、本技术的mapc和/或本技术的组合物在制备用于以下一种或多种目的组合物和/或药物中的用途:1)激活apc;2)激活dc;3)产生具有增强的抗肿瘤活性的免疫细胞;4)预防和/或逆转免疫细胞(诸如t细胞)的耗竭;5)在有需要的受试者中治疗与抗原表达相关的疾病、病症或病况;6)在有需要的受试者中治疗癌症;7)在有需要的受试者中刺激t细胞介导的对癌细胞和/或肿瘤抗原的免疫应答;8)在有需要的受试者中提供抗肿瘤免疫;9)增加和/或改善肿瘤浸润性t细胞的增殖和/或活性;10)增加和/或改善肿瘤特异性t细胞的增殖和/或活性;11)增强t细胞的细胞因子产生;12)增强肿瘤免疫疗法的抗肿瘤反应;以及13)抑制肿瘤生长、抑制肿瘤细胞的增殖和/或杀死肿瘤细胞。
74、在一些实施方案中,癌症或肿瘤选自血液肿瘤、淋巴瘤和实体肿瘤。在一些实施方案中,癌症或肿瘤选自黑素瘤、乳腺癌、肺癌、卵巢癌、脑癌、肝癌、宫颈癌、结肠癌、结直肠癌、肾癌、皮肤癌、头颈癌、骨癌、食管癌、膀胱癌、子宫癌、淋巴癌、胃癌、胰腺癌、睾丸癌、淋巴瘤和白血病。
75、一方面,本技术提供本技术的ythdf1减弱剂、本技术的mapc和/或本技术的组合物结合额外的活性成分在制备用于以下一种或多种的药物中的用途:1)激活apc;2)激活dc;3)产生具有增强的抗肿瘤活性的免疫细胞;4)预防和/或逆转免疫细胞(诸如t细胞)的耗竭;5)在有需要的受试者中治疗与抗原表达相关的疾病、病症或病况;6)在有需要的受试者中治疗癌症;7)在有需要的受试者中刺激t细胞介导的对癌细胞和/或肿瘤抗原的免疫应答;8)在有需要的受试者中提供抗肿瘤免疫;9)增加和/或改善肿瘤浸润性t细胞的增殖和/或活性;10)增加和/或改善肿瘤特异性t细胞的增殖和/或活性;11)增强t细胞的细胞因子产生;12)增强肿瘤免疫疗法的抗肿瘤反应;以及13)抑制肿瘤生长、抑制肿瘤细胞的增殖和/或杀死肿瘤细胞。
76、在一些实施方案中,额外的活性成分包括癌症免疫疗法。在一些实施方案中,额外的活性成分包括免疫检查点抑制剂。在一些实施方案中,额外的活性成分包括选自以下的药剂:抗pd-l1抗体或其抗原结合部分、抗pd-1抗体或其抗原结合部分、抗ctla-4抗体或其抗原结合部分以及ido抑制剂。在一些实施方案中,额外的活性成分包括帕博利珠单抗、纳武利尤单抗、西米普利单抗、阿替利珠单抗、阿维鲁单抗、度伐利尤单抗、伊匹单抗和/或上述任一者的抗原结合片段或衍生物。在一些实施方案中,额外的活性成分能够在接受它的受试者中引起一种或多种肿瘤抗原的增加。在一些实施方案中,肿瘤抗原选自cea、gp100、mage家族蛋白、dage、gage、rage、ny-eso 1、melan-a/mart 1、trp-1、trp-2、酪氨酸酶、her-2/neu、muc-1、p53、ksa、psa、psma及其片段和修饰形式。
77、通过以下详细描述,本公开的其他方面和优点对于本领域技术人员将变得显而易见,其中仅显示和描述了本公开的说明性实施方案。将认识到,本公开能够其他和不同实施方案,并且其若干细节能够在各个明显方面修改而全部不会脱离本公开。因此,附图和描述被视为说明性的而非限制性的。
78、通过引用并入
79、本说明书中提及的所有公布、专利和专利申请均以引用的方式并入本文,其程度如同每个单独的公布、专利或专利申请被具体地且单独地指示以引用的方式并入一般。
80、附图简单说明
81、在随附的权利要求书中具体说明本技术的新颖特征。通过参考下文的详细描述和附图(本文中也称为“图”),将获得对本技术的特征和优势更好的理解,下文的详细描述阐述了采用本技术的原理的说明性实施方案,其中:
82、图1a-1b说明了saa的抑制活性。图1c说明了sac的抑制活性。图1d说明了saa与ythdf1的结合。
83、图2a-2c说明了saa与ythdf1结合的itc结合曲线。
84、图3a说明了saa和ythdf1之间的spr结合分析结果。图3b-3c说明了saa和ythdf1之间的mst结合分析结果。
85、图4a-4b说明了saa和含有m6a的mrna之间竞争性结合分析的结果。
86、图5a说明了hdx ms实验结果的残差图。图5b说明了hdx ms实验结果的蝴蝶图。
87、图6说明了hdx ms实验结果的热力图。
88、图7说明了ythdf1的局部氘吸收动力学。在右侧,纵轴表示氘吸收的百分比,且横轴指示hdx过程的持续时间。使用配对t检验比较氘吸收的变化,且p<0.05(*)被认为具有统计学意义。
89、图8a-8i说明了相关肽的局部交换动力学分析。纵轴表示氘吸收的百分比,且横轴指示hdx过程的持续时间。
90、图9说明了saa对ythdf1突变体和截短体的抑制活性。通过fp分析确定saa的ic50值。数据表示为平均值±s.e.m。
91、图10a-10j说明了通过fp分析测定的ythdf1突变体和c-末端截短体的ic50值。saa通过两倍梯度稀释从100m稀释。
92、图11a-11g说明了通过fp分析测定的ythdf1和其突变体或c-末端截短体的kd值。蛋白质通过两倍梯度稀释从200m稀释。
93、图12a-12b说明了在293t细胞中saa与ythdf1的结合。cetsa分析在293t细胞系中进行,温度范围如指示地为39.0℃至59.0℃。以gapdh为内参,通过免疫印迹法检测ythdf1的表达量。且根据免疫印迹法(图12a),相对表达量显示在图12b中。
94、图13a-13b说明了依赖t细胞和dc的saa的抗肿瘤作用。
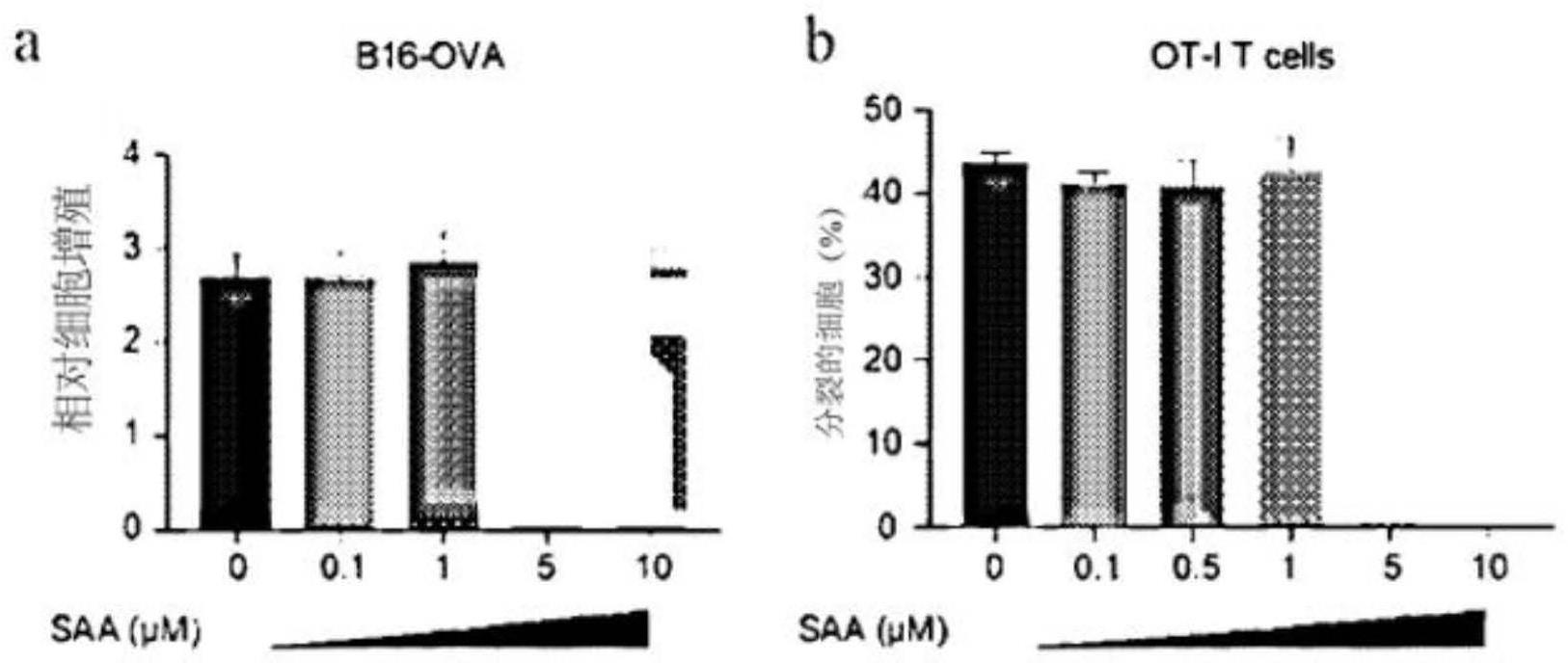
95、图14a-14b说明了在体外saa对肿瘤细胞生长的作用。
96、图15a说明了saa对rag1-/-小鼠的作用。图15b-15c说明了saa通过dc增强t细胞交叉致敏的能力。
97、图16a-16b说明了saa通过dc增强t细胞直接致敏的能力。
98、图17a说明了saa靶向dc以抑制肿瘤生长。图17b-17c说明了saa可增强肿瘤浸润性t细胞的活性。
99、图18a说明了经saa处理的组的pd-1low细胞群体比dmso组表达更多的cxcr5。图18b说明了经saa处理的小鼠的肿瘤浸润性终末期耗竭性t细胞(pd-1+tim-3+)的百分比下降。图18c说明了saa结合抗pd-l1抗体的抗肿瘤作用。
100、图19说明了saa和sac的抗肿瘤作用。
101、图20说明了saa连同pd-1阻断的抗肿瘤作用。
102、图21说明了过继转移经saa处理的flt3l dc表现出持续的抗肿瘤功能。
- 还没有人留言评论。精彩留言会获得点赞!