用于制备取代的吡唑的方法与流程
:本发明涉及一种改进的用于制备取代的吡唑衍生物的方法和新型卤代吡唑衍生物,这些卤代吡唑衍生物可用于制备作为杀昆虫剂而受关注的某些邻氨基苯甲酰胺化合物。
背景技术
0、
背景技术:
1、某些邻氨基苯甲酰胺化合物及使用不同吡唑前体制备这些化合物的方法是例如从wo 2001/70671、wo 2003/015518、wo 2003/015519、wo 2004/067528、wo 2004/011447中已知的。
2、在吡唑前体中,提及了取代的吡唑羧酸。披露了其不同的制备方法,然而,所有这些方法包括复杂的多步骤过程。例如在wo 2003/015519中,邻氨基苯甲酰胺的所述吡唑羧酸前体的制备涉及取代的吡唑与2,3-二卤代吡啶反应产生1-吡啶基吡唑以及进一步用二异丙基氨基锂使1-吡啶基吡唑金属化、随后用二氧化碳淬灭锂盐。
3、在wo 2003/016283中,邻氨基苯甲酰胺的吡唑羧酸前体是通过相应的取代的二氢-1h-吡唑的氧化制备的,其进而通过包括复杂的后处理和低工业适用性的多步骤方法制备。
4、用于制造具有式(i)的取代的吡唑的方法从wo 2008/126933中已知。然而,在wo2008/126933中在方案10披露的方法具有缺点,例如低产率和复杂的后处理;因此,需要用于制造具有式(i)的重要中间体的更有效的工业上适用的方法。
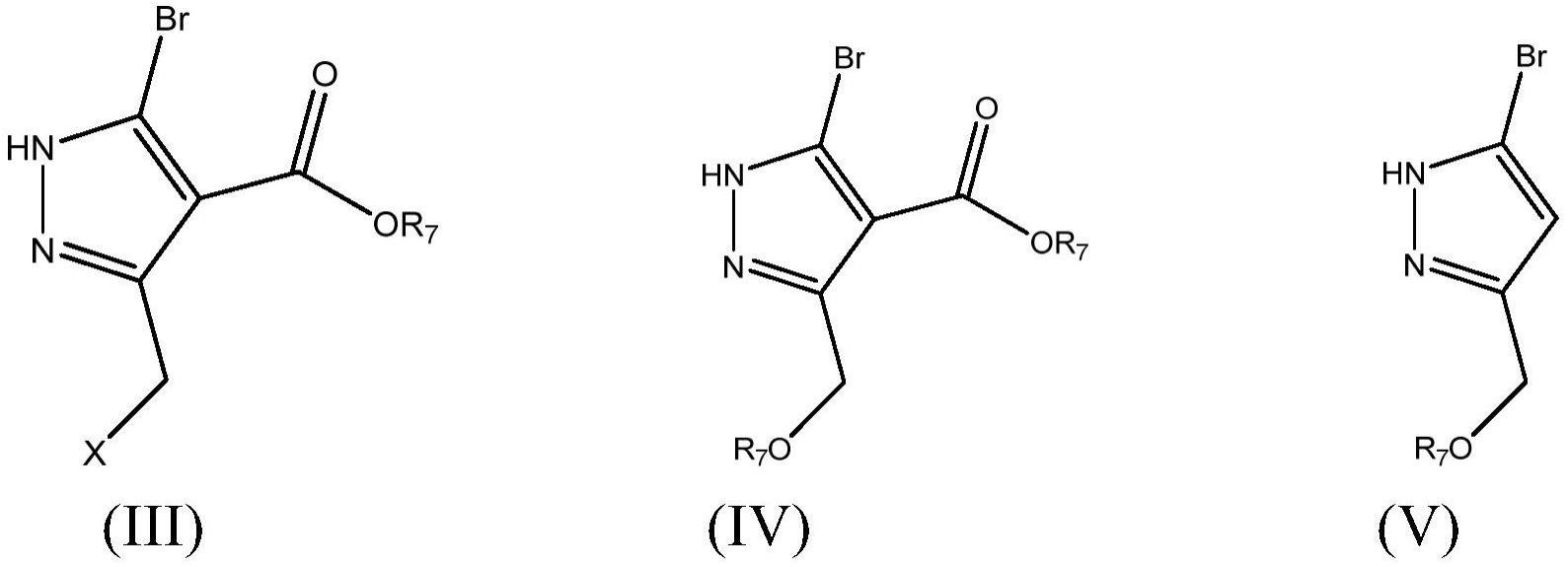
5、具有式(iii)、(iv)、(v)的新型取代的吡唑并未在文献中报告。所述取代的吡唑是有用的化学中间体,这些化学中间体是由可商购的原材料以高产率和好品质、以经济上有利且易于处理的方式制备的。
6、基于上文,非常希望提供一种改进的用于生产具有式(viii)的化合物的方法,该方法适合工业使用、高效、成本低、环境友好,并且提供高的产率并克服了已知方法的缺点。
7、说明书:
8、定义:
9、在详细阐述本主题之前,提供本文使用的某些术语的定义可能是有帮助的。除非另有定义,否则本文使用的所有技术和科学术语具有与本主题所涉及的领域技术人员通常所理解的相同的含义。
10、除非另外特别说明,否则如本文所使用的术语“一个/种(a或an)”包括单数和复数。因此,术语“一个/种(a/an)”或“至少一个/种(at least one)”在本技术中可互换使用。
11、在整个申请中,不同实施例的描述使用术语“包括(comprising)”;然而,本领域技术人员将理解,在一些特定情况下,可替代地使用“基本上由……组成”或“由……组成”的语言来描述实施例。
12、为了更好地理解本传授内容,并且绝不限制其范围,除非另有指示,否则将在说明书和权利要求书中使用的所有表示数量、百分比或比例的数字以及其他数值应理解为在所有情况下均以术语“约”修饰。因此,除非另外指示相反,否则在以下说明书和所附权利要求书中列出的数值参数是近似值,其可以根据所寻求获得的所希望的特性而变化。至少,每一个数值参数至少应该按照报告的有效数字的数量以及通过应用普通的舍入技术来解释。在这方面,本文的术语“约”的使用具体包括该范围内指定值的±10%。另外,本文中涉及相同组分或特性的所有范围的端点包括端点,是可独立组合的,并包括所有中间点和范围。
13、在本发明中,单独或在复合词如“烷硫基”或“卤代烷基”中使用的术语“烷基”包括直链或支链的烷基,如甲基,乙基,正丙基,异丙基,或不同的丁基、戊基或己基异构体。
14、本发明的某些化合物可以作为各种立体异构体存在,包括对映异构体、非对映异构体和几何异构体。在本领域中已知,当相对于一种或多种其他立体异构体富集或与一种或多种其他立体异构体分离时,一种立体异构体可以更具活性和/或可以展现出有益效果。此外,技术人员知晓如何分离、富集和/或选择性地制备所述立体异构体。因此,本发明的化合物可以作为立体异构体的混合物、单独的立体异构体、或作为光学活性形式存在。
15、本文提供了一种用于制备具有式i的化合物的方法,
16、
17、其中r5是h、f、cl或br;r6是h、f、cl或br,
18、r7是氢、c1-c4烷基;该方法包括:a)任选地在有机溶剂的存在下,使具有式(ii)的化合物与溴化剂反应
19、
20、以制备具有式(iii)的化合物
21、
22、在步骤(a)中,任选地在有机溶剂的存在下,用溴化剂处理具有式ii的化合物。可以使用极性和非极性有机溶剂,其中在极性溶剂中,c1-c6醇、乙腈、四氢呋喃、n,n-二甲基甲酰胺、二甲亚砜等是合适的。在非极性溶剂中,甲苯、氯苯、二氯甲烷、二氯乙烷、氯仿等是合适的。上述溶剂中的两种或更多种可以作为混合物使用,并且反应可以在单相体系或双相体系中进行。优选的溶剂是醇,如甲醇、乙醇、叔丁醇及其混合物。另外的合适的溶剂是乙腈、乙醇及其混合物。反应温度典型地在0℃与溶剂的沸点之间,并且反应时间典型地为从2至20小时。然后将反应物料用无机碱(如碳酸氢钠、氢氧化钠等)或有机碱(如乙酸钠)中和。所希望的产物、具有式iii的化合物可以通过本领域技术人员已知的方法分离,这些方法包括结晶、萃取和蒸馏。
23、具有式(ii)的化合物是可商购的或可以通过例如在de 3934924和wo 2012/025469中所述的已知的方法制备。作为实例,具有式(ii)的化合物可以类似于已知方法根据方案i由(e)-4-氯-2-((二甲基氨基)亚甲基)-3-氧代丁酸乙酯通过与肼的反应来制备:
24、
25、方案i:具有式(ii)的化合物的制备。
26、起始的(e)-4-氯-2-((二甲基氨基)亚甲基)-3-氧代丁酸乙酯可以通过如例如在方案ii所示的已知方法制备:
27、
28、方案ii:(e)-4-氯-2-((二甲基氨基)亚甲基)-3-氧代丁酸乙酯的制备。
29、在根据本发明的步骤b)中,将具有式(iii)的化合物与烷氧基化剂反应以制备具有式(iv)的化合物
30、
31、其中r7是如上文所定义的。
32、在根据上述方法的化合物(iv)的制备中,烷氧基化步骤在选自由以下组成的组的醇盐的存在下进行:c1-c4醇的碱金属氧化物,例如甲醇钠、甲醇钾、乙醇钠、乙醇钾、叔丁醇钠及其混合物。可替代地,烷氧基化步骤可以在c1-c4醇和碱金属碳酸盐、碳酸氢盐、氢氧化物及其混合物的存在下进行。
33、应使用与具有式iii的化合物相比大于1.0当量、优选在1与10当量之间的烷氧基化剂。反应温度典型地在-10℃至40℃之间。得到的具有式iv的化合物可以通过本领域技术人员已知的方法分离,这些方法包括结晶、萃取和蒸馏。
34、可替代地,具有式iv的化合物通过以下步骤制备:a)使具有式(ii)的化合物与碱在极性有机溶剂的存在下反应以制备具有式(iv-a)的化合物,以及将化合物(iv-a)的进一步溴化以制备具有式(iv)的化合物:
35、
36、在根据本发明的步骤c)中,具有式(v)的化合物是通过具有式(iv)的化合物的脱羧来制备的:
37、
38、根据本发明,脱羧反应通过将具有式iv的化合物与30%-60%vol的酸一起加热至优选地90℃至120℃的温度、更优选地100℃-105℃的温度来进行,该酸如盐酸、氢溴酸、四氟硼酸、六氟磷酸、三氟乙酸、硫酸、磺酸、亚磺酸、磷酸、膦酸及其混合物。
39、对于该反应,酸的催化量通常是充足的。总体上,酸以每摩尔具有式(iv)的化合物从0.1至1000摩尔的量、并且尤其是从1.0至10.0摩尔的量使用。
40、典型地,脱羧反应在有机溶剂或溶剂混合物的存在下进行。合适的有机溶剂是质子极性溶剂,例如具有优选从1至4个碳原子的脂肪族醇,如甲醇、乙醇、正丙醇、异丙醇、正丁醇、异丁醇或叔丁醇,或羧酸,如乙酸,或芳香族极性溶剂,如芳香族烃,如苯、甲苯、二甲苯、枯烯、氯苯、硝基苯或叔丁基苯;非质子极性溶剂,例如环状或非环状醚,如二乙醚、二异丙基醚、叔丁基甲基醚(mtbe)、叔丁基乙基醚、四氢呋喃(thf)或二噁烷,环状或非环状酰胺,如二甲基甲酰胺、二甲基乙酰胺、n-甲基吡咯烷酮或四甲基脲,或脂肪族腈,如乙腈或丙腈,及它们的混合物。
41、在根据本发明的步骤d)中,使具有式(vi)的吡啶与具有式(v)的化合物在碱的存在下反应。碱可以选自由以下组成的组:碱金属和碱土金属氢氧化物、氢化物、醇盐以及硫酸、磺酸、亚磺酸、磷酸、膦酸、甲酸、草酸、碳酸、乙酸、丙酸、苯甲酸和柠檬酸的盐。更优选地,合适的碱可以是碱金属碳酸盐和/或碱金属氢氧化物。
42、
43、其中r5是h、f、cl或br;并且
44、r6是h、f、cl或br。
45、相对于具有式(v)的起始化合物,所使用的碱的量选自在0.01与10.0摩尔当量范围内的值。
46、可替代地,在步骤a)中,具有式iv-a的化合物是通过具有式(ii)的化合物与碱在有机溶剂的存在下的烷氧基化产生的。在根据上述方法的化合物(iv-a)的制备中,烷氧基化步骤在选自由以下组成的组的醇盐的存在下进行:c1-c4醇的碱金属氧化物,例如甲醇钠、甲醇钾、乙醇钠、乙醇钾、叔丁醇钠及其混合物。可替代地,烷氧基化步骤可以在c1-c4醇和碱金属碳酸盐、碳酸氢盐、氢氧化物及其混合物的存在下进行。
47、有机溶剂的实例包括醚,如1,4-二噁烷、二乙醚、四氢呋喃、甲基叔丁基醚等;卤化的烃,如二氯甲烷、氯仿、四氯化碳、1,2-二氯乙烷、氯苯等;烃,如甲苯、苯、二甲苯等;腈,如乙腈等;非质子极性溶剂,如n,n-二甲基甲酰胺、n-甲基吡咯烷酮、1,3-二甲基-2-咪唑烷酮、二甲亚砜等;醇,如甲醇、乙醇、异丙醇等;及其混合物。在进一步的转化中,化合物(iv-a)的溴化得到具有式(iv)的化合物。
48、在步骤a)中使用的溴化剂选自由以下组成的组:nbs、br2、二溴二甲基乙内酰脲、三溴异氰尿酸、n-溴邻苯二甲酰亚胺、n-溴邻磺酰苯甲酰亚胺、溴代异氰尿酸单钠盐水合物、二溴异氰尿酸(=dbi)、溴代二甲基溴化锍、5,5-二溴麦氏酸cas rn:66131-14-4、双(2,4,6-三甲基吡啶)-溴鎓六氟磷酸盐、一氯化溴及其混合物。
49、在本发明的实践中,反应温度保持在从0℃至100℃的范围内,并且优选在15℃至30℃的范围内,持续几乎整个反应时间段,即至少直至所有的溴化剂和具有式(iv-a)的化合物混合在一起。由于溴化反应是放热的,所以优选地通过将溴化剂分批添加到具有式(iv-a)的化合物中来保持对温度的控制。
50、在实施例中,本发明提供了具有式(iii)、(iv)和(v)的化合物
51、其中x是卤素,并且r7是氢、c1-c4烷基;这些化合物可以如上文所述进行制备和分离:
52、
53、具有式(vii)的化合物以及其不同的制备方法先前披露于例如wo 2003/015519、wo 2003016283和wo 2003/015518中。
54、根据本发明的实施例,具有式(vii)的化合物(其中r5、r6如上文所定义)是通过具有式(i)的化合物与氧化剂反应制备的。
55、
56、上述氧化反应包括选自以下的溶剂:水、惰性c1-c6醇、羧酸及其酯、氯化烃、亚砜、砜、酰胺、醚、酮、吡啶、腈及其混合物。当选择溶剂时,要求具有式(i)的起始化合物部分或完全溶解。氧化剂可以是空气、氧气、过硫酸钾、过硫酸钠、过硫酸铵、单过硫酸钾(例如)、高锰酸钠、高锰酸钾及其混合物。优选地,氧化剂是高锰酸钾。为了获得完全转化,应使用相对于具有式(i)的化合物至少一当量的氧化剂,优选从约一至二当量。该氧化典型地在溶剂的存在下进行。溶剂可以选自水、惰性醇、羧酸及其酯、氯化烃、亚砜、砜、酰胺、醚、酮、吡啶及其混合物。在实施例中,氧化反应溶剂选自醚,如四氢呋喃、二噁烷等;有机酯,如乙酸乙酯、碳酸二甲酯等;c1-c6醇,如叔丁醇;或极性非质子有机溶剂,如n,n-二甲基甲酰胺、乙腈,及其混合物。上述溶剂中的两种或更多种可以作为混合物使用,并且反应可以在单相体系或双相体系中进行。该反应可以通过将具有式(i)的化合物在所希望的中混合来进行,该溶剂和氧化剂可以以方便的速率添加。反应温度典型地在从低至约20℃至最高达120℃变化,以获得合理的反应时间来完成反应。
57、根据实施例,氧化反应在催化剂的存在下进行。合适的催化剂选自由以下组成的组:n-羟基琥珀酰亚胺,n-羟基邻苯二甲酰亚胺,n-羟基苯并三唑,季铵盐如四乙基硫酸氢铵、三乙基苄基氯化铵,鏻盐如四苯基溴化鏻,peg,冠醚,亚硝酸钠,亚硝酸叔丁酯,乙酸钴(ii),乙酸锰(ii),及其混合物。
58、根据本发明,具有式i的化合物与氧化剂优选在升高的温度(即高于室温(20℃))下接触。优选的温度区间为从40℃至120℃,最优选的区间为从50℃至110℃。在不限制保护范围的情况下,升高的温度最有可能促进具有式i的化合物的溶解以进行更有效的氧化。
59、所希望的产物、具有式(vii)的化合物可以通过本领域技术人员已知的方法分离,这些方法包括结晶、萃取和蒸馏。
60、在本发明的另一方面中,通过本发明的方法制备的具有式(i)、(iii)、(iv)、(v)、(vii)的化合物可用作用于通过以下方法制备具有式(viii)的化合物的中间体
61、
62、其中
63、x是n;rl是ch3、cl、br或f;
64、r2是h、f、cl、br或cn;
65、r3是br;
66、r4a是h、c1-c4烷基、环丙基甲基或1-环丙基乙基;
67、r4b是h或ch3;r5是h、f、cl或br;并且
68、r6是h、f、cl或br,
69、这些方法例如从wo 2001/070671、wo 2006062978、wo 2003/015519和wo 2003/015518中已知。
70、示出以下实例以便说明本发明的某些实施例。然而,它们不应被解释为限制本发明的宽范围。在不脱离本发明的精神和范围的情况下,本领域技术人员可以容易地设计出本文披露的原理的许多变化和修改。
71、实验部分:
72、实例:
73、实例1:(e)-4-氯-2-((二甲基氨基)亚甲基)-3-氧代丁酸乙酯的制备
74、将41.8g(0.286mol)98%(z)-3-(二甲基氨基)丙烯酸乙酯和在50ml甲苯中的29g甲基吡啶(0.315mol)混合并冷却至0℃。然后在-5℃-0℃下在1h内向反应中逐滴添加在50ml甲苯中的36g 2-氯乙酰氯(0.315mol)。然后将混合物在25℃下再保持3h。添加100ml水以将反应淬灭,并且用甲苯萃取有机相。合并的甲苯溶液无需纯化使用。
75、实例2:3-(氯甲基)-1h-吡唑-4-甲酸乙酯的制备
76、在2h期间,将通过实例1制备的(e)-4-氯-2-((二甲基氨基)亚甲基)-3-氧代丁酸乙酯逐滴添加到70g的n2h4(20%,0.286mol)在50ml甲苯中的混合物并将反应温度保持在0℃下。添加完成后,将混合物再搅拌1h。将粗固体过滤并且然后用30ml甲苯和30ml h2o洗涤以获得37.7g呈黄色固体的3-(氯甲基)-1h-吡唑-4-甲酸乙酯。
77、实例3:5-溴-3-(氯甲基)-1h-吡唑-4-甲酸乙酯(iii)的制备
78、将13g(0.069mol)在实例2中制备的在50ml乙腈中的3-(氯甲基)-1h-吡唑-4-甲酸乙酯(ii)加热至80℃,并将3.2g的nbs添加到反应中并将混合物在80℃下搅拌12h。在减压下将乙腈除去并且在25℃下,将剩余的油状物在20ml甲基叔丁基醚/正庚烷(1:2)中进行搅拌。将滤饼干燥以获得14.8g的呈浅黄色固体的5-溴-3-(氯甲基)-1h-吡唑-4-甲酸乙酯。
79、实例4:5-溴-3-(甲氧基甲基)-1h-吡唑-4-甲酸乙酯的制备
80、在10℃下,将在60ml甲醇中的14.5g(0.054mol)通过实例3制备的5-溴-3-(氯甲基)-1h-吡唑-4-甲酸乙酯和在10ml h2o中的5.3gnahco3(1.168mol)混合,并将所得混合物搅拌4h。然后在减压下将甲醇除去,并且将粗产物过滤并干燥以获得10.7g呈白色固体的5-溴-3-(甲氧基甲基)-1h-吡唑-4-甲酸乙酯。
81、实例5:3-(甲氧基甲基)-1h-吡唑-4-甲酸乙酯的制备
82、在25℃下,将18g(0.095mol)通过实例2制备的3-(氯甲基)-1h-吡唑-4-甲酸乙酯溶解在20ml甲醇中并逐滴添加至在20ml甲醇和2ml水中的14g碳酸氢钠的混合物中。将所得混合物保持在25℃下3并且然后在减压下除去甲醇。将粗产物过滤并干燥以获得13.1g呈白色固体的3-(甲氧基甲基)-1h-吡唑-4-甲酸乙酯。
83、实例6:5-溴-3-(甲氧基甲基)-1h-吡唑-4-甲酸乙酯的制备
84、将在50ml乙腈中的10g(0.054mol)通过实例5制备的3-(甲氧基甲基)-1h-吡唑-4-甲酸乙酯加热至80℃,并且然后将11g nbs添加到反应混合物中并搅拌。然后在减压下将乙腈蒸馏出来并将剩余的油状物在25℃下在甲基叔丁基醚/正庚烷(1:2)混合物中进行搅拌。将粗产物过滤并干燥以获得9.9g呈白色固体的5-溴-3-(甲氧基甲基)-1h-吡唑-4-甲酸乙酯。
85、实例7:5-溴-3-(甲氧基甲基)-1h-吡唑的制备
86、将6.3g(0.024mol)通过实例4制备的5-溴-3-(甲氧基甲基)-1h-吡唑-4-甲酸乙酯与40ml的40% h2so4混合,并将反应混合物在100℃下搅拌30h。然后,用naoh水溶液将反应混合物的ph调节至ph 7并将产物用乙酸乙酯萃取、浓缩并通过二氧化硅胶柱纯化以获得2.5g呈白色固体的5-溴-3-(甲氧基甲基)-1h-吡唑。
87、实例8:2-(3-溴-5-(甲氧基甲基)-1h-吡唑-1-基)-3-氯吡啶的制备
88、将1g(5.24mmol)通过实例7制备的5-溴-3-(甲氧基甲基)-1h-吡唑、2g的2,3-二氯吡啶和1.8g碳酸钾粉末混合在10ml的n,n-二甲基乙酰胺中。将反应加热至160℃并搅拌5小时。然后将反应冷却至环境温度,过滤以除去未溶解的固体并且用5ml的n,n-二甲基乙酰胺洗涤。将所得棕色溶液在减压下蒸馏并将粗产物通过二氧化硅胶柱纯化以获得1.3g呈浅黄色固体的2-(3-溴-5-(甲氧基甲基)-1h-吡唑-1-基)-3-氯吡啶。
89、实例9:3-溴-1-(3-氯吡啶-2-基)-1h-吡唑-5-甲酸的制备
90、将0.6g(2.0mmol)在实例8中制备的2-(3-溴-5-(甲氧基甲基)-1h-吡唑-1-基)-3-氯吡啶和5ml叔丁基醇混合并将反应混合物加热至80℃。然后,将0.6g高锰酸钾溶解在60℃下的5g h2o中,并且然后逐滴添加至反应混合物并在80℃下再保持2h。随后,将混合物冷却至室温并过滤以除去mno2。将水层用乙酸乙酯萃取,并且然后用35%vol.hcl酸化。将粗产物过滤并干燥以获得0.3g呈白色固体的3-溴-1-(3-氯吡啶-2-基)-1h-吡唑-5-甲酸。
91、实例10:5-溴-3-(甲氧基甲基)-1h-吡唑-4-甲酸的制备
92、将在10ml h2o中的3.2g naoh和11g(42.8mmol)的5-溴-3-(甲氧基甲基)-1h-吡唑-4-甲酸乙酯悬浮、加热至100℃并保持2h。然后将反应混合物冷却至10℃并通过30%vol.hcl淬灭以将ph调节至1-2。将获得的混合物通过过滤分离。将滤饼用水洗涤并干燥以获得9.2g呈浅白色固体的5-溴-3-(甲氧基甲基)-1h-吡唑-4-甲酸。
93、实例11:5-溴-3-(甲氧基甲基)-1h-吡唑的制备
94、方法a:
95、将在20ml 40% h2so4中的9.2g(39.1mmol)5-溴-3-(甲氧基甲基)-1h-吡唑-4-甲酸保持在100℃下10h。将反应混合物冷却至室温并用6mol/l naoh水溶液中和至ph达到7至8。将混合物用40ml乙酸乙酯萃取并将溶剂除去以获得6.0g呈浅黄色油状物的5-溴-3-(甲氧基甲基)-1h-吡唑。
96、方法b:
97、将在20ml n,n-二甲基乙酰胺中的9.2g的5-溴-3-(甲氧基甲基)-1h-吡唑-4-甲酸(39.1mmol)保持在160℃下10h。将反应混合物冷却至室温,并将所得的6.8g呈浅黄色油状物的5-溴-3-(甲氧基甲基)-1h-吡唑从沉淀的粗产物中分离。
98、实例12:3-溴-1-(3-氯吡啶-2-基)-1h-吡唑-5-甲酸的制备
99、向配备有磁力搅拌器、温度计、冷凝器和氧气入口的250ml四颈烧瓶中装入10g的2-[3-溴-5-(甲氧基甲基)-1h-吡唑-1-基]-3-氯吡啶、co(oac)2(0.59g,10mol%)、nabr(0.07g,0.02当量)和80ml的乙酸。将混合物加热至120℃,同时鼓入氧气。将反应在120℃下保持2h。在反应完成后,将其冷却至室温并浓缩至干燥。将残余物溶解在2mol/l naoh水溶液中,用30ml乙酸乙酯洗涤。用32% hcl将水溶液ph调节至1-2。将获得的混合物通过过滤进行分离并将滤饼用20ml水洗涤并干燥以获得8.5g呈灰白色固体的3-溴-1-(3-氯吡啶-2-基)-1h-吡唑-5-甲酸(85%产率)。
100、实例13:3-溴-1-(3-氯吡啶-2-基)-1h-吡唑-5-甲酸的制备
101、向配备有磁力搅拌器、温度计、冷凝器和氧气入口的250ml四颈烧瓶中装入10g的2-[3-溴-5-(甲氧基甲基)-1h-吡唑-1-基]-3-氯吡啶、n-羟基琥珀酰亚胺(0.22g,0.04当量)和80ml乙酸。将混合物加热至120℃,同时鼓入氧气并逐滴添加hno3(2.5ml)。将反应在120℃下保持2h。在反应完成后,将其冷却至室温并浓缩至干燥物料。将干燥的残余物溶解在2mol/l naoh水溶液中,用30ml乙酸乙酯洗涤。用32% hcl将水溶液ph调节至1-2。将获得的混合物通过过滤进行分离并将滤饼用20ml水洗涤并干燥以获得8.1g呈灰白色固体的3-溴-1-(3-氯吡啶-2-基)-1h-吡唑-5-甲酸(81%产率)。
102、实例14:3-溴-1-(3-氯吡啶-2-基)-1h-吡唑-5-甲酸的制备
103、向10ml三颈烧瓶中装入0.6g的2-[3-溴-5-(甲氧基甲基)-1h-吡唑-1-基]-3-氯吡啶和5ml叔丁醇,并将混合物加热至80℃。然后,将0.6g kmno4(3当量)溶解在60℃下的5gh2o中并逐滴添加至反应混合物中。将反应再持续搅拌2h,然后冷却至室温,并通过硅藻土垫过滤以除去mno2。通过添加hcl(35%)将水相的ph调节至1-2。然后将产物通过过滤进行分离以获得0.54g的3-溴-1-(3-氯吡啶-2-基)-1h-吡唑-5-甲酸(90%产率)。
技术实现思路
0、
技术实现要素:
1、因此,本发明涉及一种用于制备具有式i的化合物的方法,
2、
3、其中r5是h、f、cl或br;并且
4、r6是h、f、cl或br;r7是c1-c4烷基,该方法包括:
5、a)任选地在有机溶剂的存在下,使具有式(ii)的化合物与溴化剂反应
6、
7、以制备具有式(iii)的化合物
8、
9、b)在碱的存在下使具有式(iii)的化合物烷氧基化,以制备具有式(iv)的化合物
10、
11、或者可替代地,a)使具有式(ii)的化合物与烷氧基化剂在有机溶剂的存在下反应
12、
13、以制备具有式(iv-a)的化合物,
14、
15、b)将化合物(iv-a)溴化以制备具有式(iv)的化合物,
16、c)将具有式(iv)的化合物脱羧,以制备具有式(v)的化合物:
17、
18、其中x是卤素,并且r7是氢、c1-c4烷基;d)使具有式(vi)的吡啶
19、
20、其中r5是h、f、cl或br;并且
21、r6是h、f、cl或br;r7是c1-c4烷基
22、与具有式(v)的化合物在碱的存在下反应。
23、根据上述方法的溴化剂选自由以下组成的组:nbs、br2、二溴二甲基乙内酰脲、三溴异氰尿酸、n-溴邻苯二甲酰亚胺、n-溴邻磺酰苯甲酰亚胺、溴代异氰尿酸单钠盐水合物、二溴异氰尿酸(=dbi)、溴代二甲基溴化锍、5,5-二溴麦氏酸(dibromomeldrum's acid)casrn:66131-14-4、双(2,4,6-三甲基吡啶)-溴鎓六氟磷酸盐、一氯化溴及其混合物。
24、根据上述方法的碱选自由以下组成的组:甲醇钠、甲醇钾、乙醇钠、乙醇钾、叔丁醇钾、叔丁醇锂、碳酸钾、碳酸氢钠、碳酸氢钾、碳酸钠、碳酸锂、氢氧化钠、氢氧化锂、氢氧化钾、乙酸钠、乙酸钾及其混合物。
25、在上述方法中,有机溶剂选自由以下组成的组:极性或非极性有机溶剂,如c1-c6醇、酮、酯、芳香族溶剂、杂芳香族溶剂、脂肪族溶剂、酰胺、砜、亚砜、卤化溶剂、腈、碳酸酯、脲及其混合物。合适的极性溶剂可以是例如但不限于醇(优选c1-c4醇)、丙酮、乙腈、四氢呋喃、二甲亚砜、n,n-二甲基甲酰胺、n,n-二甲基乙酰胺、n,n-二甲基乙醇胺或其混合物。在实施例中,合适的溶剂由以下组成:n,n-二甲基乙酰胺、n,n-二甲基甲酰胺、二甲亚砜、正丁醇、乙醇及其混合物。
26、在根据上述方法的化合物(iv-a)的制备中,烷氧基化步骤在选自由以下组成的组的醇盐的存在下进行:c1-c4醇的碱金属氧化物,例如甲醇钠、甲醇钾、乙醇钠、乙醇钾、叔丁醇钠及其混合物。可替代地,烷氧基化步骤可以在c1-c4醇和碱金属碳酸盐、碳酸氢盐、氢氧化物及其混合物的存在下进行。
27、此外,本发明涉及用于制备化合物(vii)的方法
28、
29、该方法包括使氧化剂与具有式(i)的化合物任选地在催化剂的存在下反应,其中该氧化剂选自由以下组成的组:氧气、空气、臭氧、过氧化氢、过氧化苯甲酰、叔丁基过氧化物、间氯过氧苯甲酸、过氧乙酸、过氧苯甲酸、单过氧邻苯二甲酸镁、过氧单硫酸钾、高锰酸钠、高锰酸钾及其混合物。
30、在上述氧化反应中任选地使用的催化剂可以选自由以下组成的组:n-羟基琥珀酰亚胺、n-羟基邻苯二甲酰亚胺、n-羟基苯并三唑、四乙基硫酸氢铵、三乙基苄基氯化铵、四苯基溴化鏻、peg、冠醚、亚硝酸钠、亚硝酸叔丁酯、乙酸钴(ii)、乙酸锰(ii)、亚硝酸钠、亚硝酸叔丁酯及其混合物。
31、任选地,用于制备化合物(vii)的方法在有机溶剂的存在下进行,该有机溶剂选自由以下组成的组:c1-c6醇、羧酸及其酯、氯化烃、亚砜、砜、酰胺、醚、酮、吡啶及其混合物。
32、本发明还涉及具有式(iii)、(iv)和(v)的化合物及其在改进的制备具有式i、vii、viii的化合物的方法中的用途。
33、
34、其中x和r7是如上文所定义的。
35、本发明还涉及一种制备具有式(viii)的邻氨基苯甲酰胺的方法
36、
37、其中
38、x是n;rl是ch3、cl、br或f;
39、r2是h、f、cl、br或cn;
40、r3是br;
41、r4a是h、c1-c4烷基、环丙基甲基或1-环丙基乙基;
42、r4b是h或ch3;r5是h、f、cl或br;并且
43、r6是h、f、cl或br,
44、其中该改进包括通过如上文指示的方法制备的具有式(i)、(iii)、(iv)、(v)的化合物。
45、此外,本发明涉及一种制备具有式(viii)的邻氨基苯甲酰胺的方法,其中x、r1、r2、r3、r4a、r4b、r5和r6如上文所指示,其中该改进包括由如上文指示的具有式(i)的化合物制备的具有式(vii)的化合物。
- 还没有人留言评论。精彩留言会获得点赞!