卡巴他赛制剂的制作方法
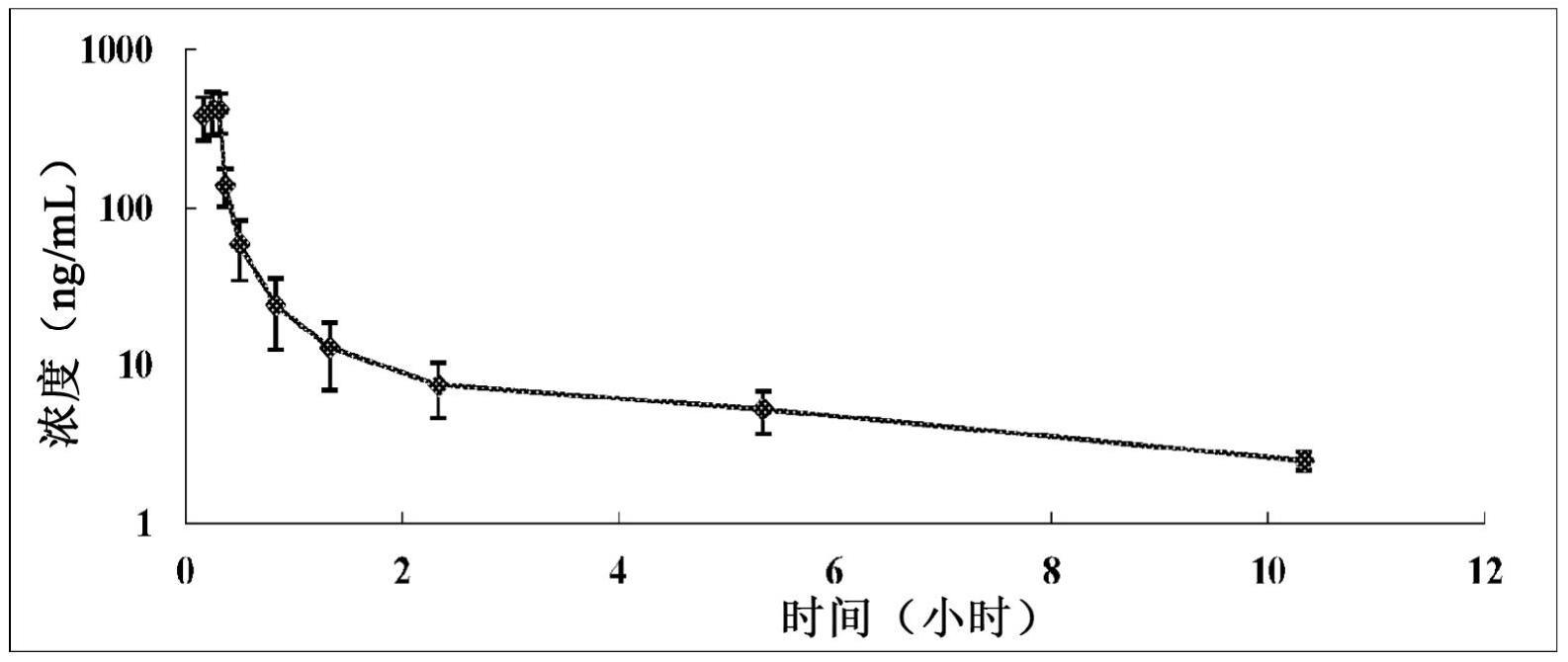
本技术文件涉及用于治疗增殖性疾病的制剂,更具体地,涉及包含卡巴他赛的制剂。
背景技术:
1、许多肠胃外使用的药物不溶于水,因此采用向患者施用时具有刺激性、过敏性或毒性的增溶剂、表面活性剂、溶剂和/或乳化剂配制。参见,例如briggs et al.,anesthesis37,1099(1982)和waugh et al.am.j.hosp.pharmacists,48,1520(1991))。此外,许多这些药物,尤其是那些静脉内给药的药物,会导致不良副作用,例如静脉刺激、静脉炎、注射时灼痛和疼痛、静脉血栓形成、外渗和其他给药相关副作用。此外,通常制剂中存在的游离药物在给药时会引起疼痛或刺激。
2、紫杉烷类药物在各种实体瘤的治疗中发挥着重要作用。卡巴他赛(cabazitaxel,商品名)是一种半合成紫杉烷衍生物。该药物由赛诺菲-安万特(sanofi-aventis)公司开发,美国食品及药物管理局(u.s.fda)于2010年6月17日批准其用于治疗激素难治性前列腺癌。继基于卡巴他赛的治疗后,卡巴他赛与泼尼松联用是激素难治性前列腺癌的又一种治疗方案。卡巴他赛(jevtana)以试剂盒形式供应,该试剂盒包括(a)卡巴他赛注射剂,其含有溶于1.5ml聚山梨醇酯80的60mg卡巴他赛;和(b)稀释剂,含有约5.7ml 13%(w/w)乙醇。在给药之前,jevtana注射剂必须首先与稀释剂混合,稀释剂将卡巴他赛稀释至10mg/ml,然后采用0.9%氯化钠溶液或5%葡萄糖溶液进一步稀释以供输注。参见卡巴他赛(jevtana)处方信息。
3、其他紫杉烷化合物包括多西紫杉醇,其商品名为经fda批准用于治疗乳腺癌、非小细胞肺癌、激素难治性前列腺癌、胃腺癌和头颈癌的鳞状细胞癌。市售多西紫杉醇的临床静脉给药采用每毫升含40mg多西紫杉醇和1040mg聚山梨醇酯80的高浓度溶液配制。参见泰索帝(taxotere)处方信息。
4、jevtana及taxotere中聚山梨醇酯80的存在可能会导致严重的副作用。此外,据报道,多西紫杉醇的施用与无法预测的(急性)超敏反应和累积液体潴留的发生有关。参见,例如trudeau me et a,j clin oncol 1996;14:422-8;piccart mj et al..j natl cancerinst 1995;87:676-81;bruno r et al.,j clin oncol 1998;16:187-96。这些副作用部分归因于聚山梨醇酯80的存在。
5、为了减少聚山梨醇酯80引起的副作用,患者可在每次施用jevtana之前使用地塞米松进行处理。地塞米松是一种抑制患者免疫反应的类固醇,对化疗中的癌症患者尤其有害,因为化疗对健康细胞的破坏可能已经损害了患者的免疫功能。因此,这些患者可能容易被细菌和真菌感染。此外,尽管在用药前施用了地塞米松,但患者仍可能发生紫杉烷化合物治疗引起的超敏副作用。由于这些副作用,患者可能会停止紫杉烷化合物治疗、跳过剂量或降低剂量继续进一步治疗。
6、已经报道了不含聚山梨醇酯80的卡巴他赛新制剂。wo2017/123760和wo2019/204738描述了包括卡巴他赛和人血清白蛋白的组合物和制剂。中国专利申请cn104490797a、cn104224750a、cn103393632a、cn106852911a和cn105727303a描述了卡巴他赛和白蛋白的纳米颗粒组合物。
7、为了消除这些副作用、用药前要求及与当前市售制剂相关的患者不依从性问题,需要新的卡巴他赛制剂,而且需要在临床上使用更方便。
技术实现思路
1、目前销售的卡巴他赛(jevtana)制剂包括双瓶制剂(注射剂和稀释剂)。双瓶制剂包含卡巴他赛的聚山梨醇酯80溶液及包含13%(w/w)乙醇水溶液的溶剂瓶。
2、双瓶制剂需要在向患者施用前进行两次稀释。在双瓶制剂中,药物瓶中的药物在使用前必须先用溶剂瓶中的溶剂重构,确保聚山梨醇酯80被适当重构而不会明显起泡。通过将适量的重构溶液注入到输液袋中进一步稀释。因此,对于双瓶制剂,存在起泡风险,使用不方便。此外,目前市售的制剂含有聚山梨醇酯80,这可能会在某些患者身上引发严重的超敏反应。jevtana产品标签上有一个关于聚山梨醇酯80超敏反应的黑框警告。非常需要开发出不含聚山梨醇酯80且又方便临床使用的替代卡巴他赛制剂。
3、在本发明中,申请人发明了一种新的制剂,其中已知浓度的药物产品以溶液形式装在单个小瓶中。使用前将药物产品溶液从小瓶中取出并注入到输液袋/输液瓶中。小瓶在使用前不需要重构和均质化。因此,这种新制剂不存在任何起泡风险,使用更方便。此外,新制剂不含聚山梨醇酯80。本技术人惊奇地发现,在将药物产品溶液注射到输液袋中之前,将人血清白蛋白溶液添加到含有肠胃外可接受载体(例如生理盐水、葡萄糖溶液等)的输液袋或输液瓶中,则在本发明的卡巴他赛制剂中无需使用聚山梨醇酯80。
4、在本发明中,提供了卡巴他赛药物制剂,其包含在向患者输注或给药之前混合的两种组合物,所述两种组合物包括:(a)第一液体组合物,其包含卡巴他赛和乙醇,其中卡巴他赛溶于溶剂(包括乙醇),和(b)第二水性组合物,其包含人血清白蛋白和肠胃外可接受载体,其中所述药物制剂不包含表面活性剂(例如聚山梨醇酯80)。在一些实施例中,这两种组合物在向患者输注或给药之前小于或等于约24小时内混合。在一些实施例中,这两种组合物在向患者输注或给药之前小于或等于约8小时内混合。在一些实施例中,这两种组合物在向患者输注或给药之前小于或等于约6小时内混合。在一些实施例中,这两种组合物在向患者输注或给药之前小于或等于约2小时内混合。在一些实施例中,这两种组合物在向患者输注或给药之前小于或等于约1小时内混合。在一些实施例中,混合在输液袋或输液瓶中进行。在一些实施例中,第二水性组合物包含在输液袋或输液瓶中。在一些实施例中,将第一液体组合物注入到包含第二水性组合物的输液袋或输液瓶中。
5、在一些实施例中,所述药物制剂不包含脂质(例如大豆油)。在一些实施例中,第一液体组合物不包含脂质(例如大豆油)。在一些实施例中,第二水性组合物不包含脂质(例如大豆油)。在一些实施例中,所述脂质是大豆油。
6、在一些实施例中,第一液体组合物不包含表面活性剂。在一些实施例中,第二水性组合物不包含表面活性剂。
7、在一些实施例中,第一液体组合物包含卡巴他赛、乙醇和其他有机溶剂(例如丙二醇、聚乙二醇(以下称为“peg”)等)。优选地,peg的分子量为约300(即peg 300)或约400(即peg 400)。如果需要,在替代实施例中可以包括普通技术人员熟知的其他分子量的peg。在一些实施例中,第一液体组合物包含卡巴他赛、乙醇和丙二醇。在一些实施例中,第一液体组合物包含卡巴他赛、乙醇和peg。在一些实施例中,第一液体组合物包含卡巴他赛、乙醇和peg 300。在一些实施例中,第一液体组合物包含卡巴他赛、乙醇和peg 400。在一些实施例中,第一液体组合物还包含酸。在一些实施例中,第一液体组合物包含卡巴他赛、乙醇和有机酸。本发明最优选使用的酸是柠檬酸。在一些实施例中,第一液体组合物包含卡巴他赛、乙醇和柠檬酸。在一些实施例中,第一液体组合物包含卡巴他赛、乙醇、丙二醇和柠檬酸。在一些实施例中,第一液体组合物包含卡巴他赛、乙醇和柠檬酸。在一些实施例中,第一液体组合物包含卡巴他赛、乙醇、peg(例如peg 300、peg 400)和柠檬酸。在一些实施例中,第一液体组合物中卡巴他赛与柠檬酸的重量比为约5000:1至约1:1。在一些实施例中,第一液体组合物中卡巴他赛与柠檬酸的重量比为约2000:1至约1:1。在一些实施例中,第一液体组合物中卡巴他赛与柠檬酸的重量比为约1000:1至约1:1。在一些实施例中,第一液体组合物中卡巴他赛与柠檬酸的重量比为约500:1至约1:1。在一些实施例中,第一液体组合物中卡巴他赛与柠檬酸的重量比为约5000:1至约10:1。在一些实施例中,第一液体组合物中卡巴他赛与柠檬酸的重量比为约2000:1至约10:1。在一些实施例中,第一液体组合物中卡巴他赛与柠檬酸的重量比为约1000:1至约10:1。在一些实施例中,第一液体组合物中卡巴他赛与柠檬酸的重量比为约1000:1至约100:1。在一些实施例中,第一液体组合物中卡巴他赛与柠檬酸的重量比为约600:1至约200:1。
8、在一些实施例中,第一液体组合物包含卡巴他赛和溶剂(包括乙醇),其中卡巴他赛溶解在溶剂中(例如,第一液体组合物是卡巴他赛在乙醇中的均匀溶液)。在一些实施例中,第一液体组合物包含卡巴他赛、酸以及溶剂(包括乙醇),其中卡巴他赛和酸溶解在溶剂中。在一些实施例中,第一液体组合物包含卡巴他赛、有机酸以及溶剂(包括乙醇),其中卡巴他赛和有机酸溶解在溶剂中。在一些实施例中,第一液体组合物包含卡巴他赛、柠檬酸以及溶剂(包括乙醇),其中卡巴他赛和柠檬酸溶解在溶剂中。在一些实施例中,第一液体组合物包含卡巴他赛和乙醇,其中卡巴他赛溶解在乙醇中。在一些实施例中,第一液体组合物包含卡巴他赛、柠檬酸和乙醇,其中卡巴他赛和柠檬酸溶解在乙醇中。在一些实施例中,第一液体组合物包含卡巴他赛和无水乙醇,其中卡巴他赛溶解在无水乙醇中。在一些实施例中,第一液体组合物包含卡巴他赛、柠檬酸和无水乙醇,其中卡巴他赛和柠檬酸溶解在无水乙醇中。
9、在一些实施例中,第一液体组合物通过将卡巴他赛溶解在溶剂(包括乙醇)中制备。在一些实施例中,第一液体组合物通过将卡巴他赛和柠檬酸溶解在溶剂(包括乙醇)中制备。在一些实施例中,第一液体组合物通过将卡巴他赛和柠檬酸溶解在溶剂(包括乙醇和丙二醇)中制备。在一些实施例中,第一液体组合物通过将卡巴他赛和柠檬酸溶解在溶剂(包括乙醇和peg,例如peg 300、peg 400)中制备。
10、在一些实施例中,第二水性组合物通过将人血清白蛋白溶液添加到肠胃外可接受载体中制备。在一些实施例中,第二水性组合物通过将人血清白蛋白溶液添加到包含肠胃外可接受载体的输液袋或输液瓶中制备。在一些实施例中,第二水性组合物通过将人血清白蛋白溶液添加到生理盐水或葡萄糖溶液中制备。在一些实施例中,第二水性组合物通过将人血清白蛋白溶液添加到包含生理盐水或葡萄糖溶液的输液袋或输液瓶中制备。在一些实施例中,第二水性组合物通过将人血清白蛋白输注溶液添加到生理盐水或葡萄糖溶液中制备。在一些实施例中,第二水性组合物通过将人血清白蛋白输注溶液添加到生理盐水或葡萄糖溶液中制备。在一些实施例中,第二水性组合物通过将20%(w/v)人血清白蛋白输注溶液添加到生理盐水或葡萄糖溶液中制备。在一些实施例中,第二水性组合物通过将25%(w/v)人血清白蛋白输注溶液添加到生理盐水或葡萄糖溶液中制备。在一些实施例中,第二水性组合物通过将5%(w/v)人血清白蛋白输注溶液添加到生理盐水或葡萄糖溶液中制备。在一些实施例中,第二水性组合物通过将人血清白蛋白输注溶液添加到包含生理盐水或葡萄糖溶液的输液袋或输液瓶中制备。在一些实施例中,第二水性组合物通过将人血清白蛋白输注溶液添加到包含生理盐水或葡萄糖溶液的输液袋或输液瓶中制备。在一些实施例中,第二水性组合物通过将20%(w/v)人血清白蛋白输注溶液添加到包含生理盐水或葡萄糖溶液的输液袋或输液瓶中制备。在一些实施例中,第二水性组合物通过将25%(w/v)人血清白蛋白输注溶液添加到包含生理盐水或葡萄糖溶液的输液袋或输液瓶中制备。在一些实施例中,第二水性组合物通过将5%(w/v)人血清白蛋白输注溶液添加到包含生理盐水或葡萄糖溶液的输液袋或输液瓶中制备。在一些实施例中,第二水性组合物是包含人血清白蛋白的水溶液。在一些实施例中,第二水性组合物中人血清白蛋白的浓度为约0.1%至约20%(w/v)。在一些实施例中,第二水性组合物中人血清白蛋白的浓度为约0.1%至约10%(w/v)。在一些实施例中,第二水性组合物中人血清白蛋白的浓度是0.1%至2%(w/v)。在一些实施例中,第二水性组合物中人血清白蛋白的浓度是0.2%至5%(w/v)。在一些实施例中,第二水性组合物中人血清白蛋白的浓度是0.3%至2%(w/v)。在一些实施例中,第二水性组合物中人血清白蛋白的浓度是0.3%至1.5%(w/v)。在一些实施例中,第二水性组合物包含约0.1g至约20g人血清白蛋白。在一些实施例中,第二水性组合物包含约0.5g至约10g人血清白蛋白。
11、此外,本文提供了一种透明无可见颗粒和沉淀的卡巴他赛肠胃外输注组合物,其包含人血清白蛋白和所述卡巴他赛,在肠胃外可接受载体中卡巴他赛的浓度为约0.01mg/ml至约0.5mg/ml,其中所述肠胃外输注溶液通过将包含卡巴他赛和乙醇的第一液体组合物注入到包含第二水性组合物的输液袋或输液瓶中得到,所述第二水性组合物包含在肠胃外可接受载体中的人血清白蛋白,其中在注入过程中不需要进行混合或搅拌。在一些实施例中,所述卡巴他赛输注溶液不含表面活性剂(例如聚山梨醇酯80)。在一些实施例中,肠胃外可接受载体是生理盐水或葡萄糖溶液。
12、此外,本文提供了一种透明无沉淀的卡巴他赛肠胃外输注组合物,其包含人血清白蛋白、所述卡巴他赛、和乙醇,其中所述输注组合物中卡巴他赛的浓度为约0.05mg/ml至约0.2mg/ml,所述输注组合物中乙醇的浓度为约0.2体积%至约4体积%,人血清白蛋白与卡巴他赛的重量比为约10:1至约300:1。所述肠胃外输注溶液可通过将包含卡巴他赛和乙醇的第一液体组合物注入到包含第二水性组合物的输液袋或输液瓶中获得,所述第二水性组合物包含在肠胃外可接受载体中的人血清白蛋白。在一些实施例中,在注入过程中不需要混合或搅拌。在一些实施例中,所述卡巴他赛输注溶液不含表面活性剂(例如聚山梨醇酯80)。
13、在一些实施例中,所述卡巴他赛肠胃外输注组合物不包含脂质(例如大豆油)。在一些实施例中,所述第一液体组合物不包含脂质(例如大豆油)。在一些实施例中,所述第二水性组合物不包含脂质(例如大豆油)。在一些实施例中,所述脂质是大豆油。
14、在一些实施例中,所述第一液体组合物不包含表面活性剂。在一些实施例中,所述第二水性组合物不包含表面活性剂。
15、在一些实施例中,所述卡巴他赛肠胃外输注组合物在向患者输注或施用前小于24小时内制备。在一些实施例中,所述卡巴他赛肠胃外输注组合物在向患者输注或施用前小于8小时内制备。在一些实施例中,所述卡巴他赛肠胃外输注组合物在向患者输注或施用前小于6小时内制备。在一些实施例中,所述卡巴他赛肠胃外输注组合物在向患者输注或施用前小于4小时内制备。在一些实施例中,所述卡巴他赛肠胃外输注组合物在向患者输注或施用前小于1小时内制备。
16、在一些实施例中,所述肠胃外输注组合物中卡巴他赛的浓度为约0.01mg/ml至约0.5mg/ml。在一些实施例中,所述肠胃外输注组合物中卡巴他赛的浓度为约0.02mg/ml至约0.25mg/ml。在一些实施例中,所述肠胃外输注组合物中卡巴他赛的浓度为约0.03mg/ml至约0.2mg/ml。在一些实施例中,所述肠胃外输注组合物中卡巴他赛的浓度为约0.03mg/ml至约0.15mg/ml。在一些实施例中,所述肠胃外输注组合物中卡巴他赛的浓度为约0.05mg/ml至约0.15mg/ml。在一些实施例中,人血清白蛋白与卡巴他赛的重量比为约10:1至约500:1。在一些实施例中,人血清白蛋白与卡巴他赛的重量比为约20:1至约200:1。在一些实施例中,人血清白蛋白与卡巴他赛的重量比为约50:1至约150:1。在一些实施例中,人血清白蛋白与卡巴他赛的重量比为约120:1、约100:1、约80:1、约60:1或约50:1。
17、在一些实施例中,第一液体组合物包含卡巴他赛、乙醇和其他有机溶剂(例如丙二醇、聚乙二醇(此处称为“peg”)等)。优选地,peg的分子量为约300(即peg 300)或约400(即peg 400)。如果需要,在替代实施例中可以包括普通技术人员熟知的其他分子量的peg。在一些实施例中,第一液体组合物包含卡巴他赛、乙醇和丙二醇。在一些实施例中,第一液体组合物包含卡巴他赛、乙醇和peg。在一些实施例中,第一液体组合物包含卡巴他赛、乙醇和peg 300。在一些实施例中,第一液体组合物包含卡巴他赛、乙醇和peg 400。在一些实施例中,第一液体组合物进一步包含酸。在一些实施例中,第一液体组合物包含卡巴他赛、乙醇和有机酸。本发明最优选使用的酸是柠檬酸。在一些实施例中,第一液体组合物包含卡巴他赛、乙醇和柠檬酸。在一些实施例中,第一液体组合物包含卡巴他赛、乙醇、丙二醇和柠檬酸。在一些实施例中,第一液体组合物包含卡巴他赛、乙醇和柠檬酸。在一些实施例中,第一液体组合物包含卡巴他赛、乙醇、peg(例如peg 300、peg 400)和柠檬酸。在一些实施例中,第一液体组合物中卡巴他赛与柠檬酸的重量比为约5000:1至约1:1。在一些实施例中,第一液体组合物中卡巴他赛与柠檬酸的重量比为约2000:1至约1:1。在一些实施例中,第一液体组合物中卡巴他赛与柠檬酸的重量比为约1000:1至约1:1。在一些实施例中,第一液体组合物中卡巴他赛与柠檬酸的重量比为约500:1至约1:1。在一些实施例中,第一液体组合物中卡巴他赛与柠檬酸的重量比为约5000:1至约10:1。在一些实施例中,第一液体组合物中卡巴他赛与柠檬酸的重量比为约2000:1至约10:1。在一些实施例中,第一液体组合物中卡巴他赛与柠檬酸的重量比为约1000:1至约10:1。在一些实施例中,第一液体组合物中卡巴他赛与柠檬酸的重量比为约500:1至约10:1。在一些实施例中,第一液体组合物中卡巴他赛与柠檬酸的重量比为约700:1至约200:1。
18、在一些实施例中,第一液体组合物通过将卡巴他赛溶解在溶剂(包括乙醇)中制备。在一些实施例中,第一液体组合物通过将卡巴他赛和柠檬酸溶解在溶剂(包括乙醇)中制备。在一些实施例中,第一液体组合物通过将卡巴他赛和柠檬酸溶解在溶剂(包括乙醇和丙二醇)中制备。在一些实施例中,第一液体组合物通过将卡巴他赛和柠檬酸溶解在溶剂(包括乙醇和peg,例如peg 300、peg 400)中制备。
19、在一些实施例中,第二水性组合物通过将人血清白蛋白溶液添加到肠胃外可接受载体中制备。在一些实施例中,第二水性组合物通过将人血清白蛋白溶液添加到包含肠胃外可接受载体的输液袋或输液瓶中制备。在一些实施例中,第二水性组合物通过将人血清白蛋白溶液添加到生理盐水或葡萄糖溶液中制备。在一些实施例中,第二水性组合物通过将人血清白蛋白溶液添加到包含生理盐水或葡萄糖溶液的输液袋或输液瓶中制备。在一些实施例中,第二水性组合物通过将人血清白蛋白输注溶液添加到生理盐水或葡萄糖溶液中制备。在一些实施例中,第二水性组合物通过将人血清白蛋白输注溶液添加到生理盐水或葡萄糖溶液中制备。在一些实施例中,第二水性组合物通过将20%(w/v)人血清白蛋白输注溶液添加到生理盐水或葡萄糖溶液中制备。在一些实施例中,第二水性组合物通过将25%(w/v)人血清白蛋白输注溶液添加到生理盐水或葡萄糖溶液中制备。在一些实施例中,第二水性组合物通过将5%(w/v)人血清白蛋白输注溶液添加到生理盐水或葡萄糖溶液中制备。在一些实施例中,第二水性组合物通过将人血清白蛋白输注溶液添加到包含生理盐水或葡萄糖溶液的输液袋或输液瓶中制备。在一些实施例中,第二水性组合物通过将人血清白蛋白输注溶液添加到包含生理盐水或葡萄糖溶液的输液袋或输液瓶中制备。在一些实施例中,第二水性组合物通过将20%(w/v)人血清白蛋白输注溶液添加到包含生理盐水或葡萄糖溶液的输液袋或输液瓶中制备。在一些实施例中,第二水性组合物通过将25%(w/v)人血清白蛋白输注溶液添加到包含生理盐水或葡萄糖溶液的输液袋或输液瓶中制备。在一些实施例中,第二水性组合物通过将5%(w/v)人血清白蛋白输注溶液添加到包含生理盐水或葡萄糖溶液的输液袋或输液瓶中制备。在一些实施例中,第二水性组合物是含有人血清白蛋白的水溶液。在一些实施例中,第二水性组合物中人血清白蛋白的浓度为约0.1%至约20%(w/v)。在一些实施例中,第二水性组合物中人血清白蛋白的浓度为约0.1%至约10%(w/v)。在一些实施例中,第二水性组合物中人血清白蛋白的浓度是0.2%至5%(w/v)。在一些实施例中,第二水性组合物中人血清白蛋白的浓度是0.3%至2%(w/v)。在一些实施例中,第二水性组合物中人血清白蛋白的浓度是0.3%至1.5%(w/v)。在一些实施例中,第二水性组合物包含约0.1g至约20g人血清白蛋白。在一些实施例中,第二水性组合物包含约0.5g至约10g人血清白蛋白。
20、将第一液体组合物快速注入到包含第二水性组合物的输液袋或输液瓶中。在一些实施例中,注射时间不超过60秒。在一些实施例中,注射时间不超过30秒。在一些实施例中,注射时间不超过15秒。在一些实施例中,注射时间不超过10秒。在一些实施例中,注射时间不超过5秒。
21、在将第一液体组合物注入到包含第二水性组合物的输液袋或输液瓶内的过程中,并不需要进行混合或搅拌。将第一液体组合物注入到输液袋或输液瓶中后,将第一液体组合物和第二水性组合物充分混合(例如用手轻轻上下颠倒装有组合物的袋子),得到透明无沉淀的输注溶液。在一些实施例中,包含第二水性组合物的输液袋或输液瓶在注射过程中保持静止。在一些实施例中,在注射过程中将第一液体组合物注入到第二水性组合物的液体表面下方。在一些实施例中,在注射完成后,将输液袋或输液瓶反复轻轻上下颠倒,充分混合第一液体组合物和第二水性组合物。在一些实施例中,注射完成后,将输液袋或输液瓶轻轻上下颠倒,直到得到透明无沉淀的溶液。在一些实施例中,注射完成后,将输液袋或输液瓶轻轻上下颠倒约5秒至约10分钟。在一些实施例中,注射完成后,将输液袋或输液瓶轻轻上下颠倒约10秒至约5分钟。在一些实施例中,注射完成后,将输液袋或输液瓶轻轻上下颠倒约0.5分钟至约3分钟。在一些实施例中,注射完成后,将第一液体组合物和第二水性组合物充分混合,直到得到透明无沉淀的输注溶液。
22、在将第一液体组合物和第二水性组合物充分混合之后,将第一液体组合物注入到包含第二水性组合物的输液袋或输液瓶中,得到包含人血清白蛋白、卡巴他赛和乙醇溶于肠胃外可接受载体的透明无沉淀输注溶液。在一些实施例中,透明输注溶液进一步包含柠檬酸。在一些实施例中,肠胃外可接受载体是生理盐水或葡萄糖溶液。在一些实施例中,透明输注溶液至少1小时内保持透明无沉淀。在一些实施例中,透明输注溶液至少2小时内保持透明无沉淀。在一些实施例中,透明输注溶液至少3小时内保持透明无沉淀。在一些实施例中,透明输注溶液至少4小时内保持透明无沉淀。在一些实施例中,透明输注溶液至少6小时内保持透明无沉淀。在一些实施例中,透明输注溶液至少8小时内保持透明无沉淀。在一些实施例中,当透明输注溶液保持在约20-25℃,透明输注溶液至少在1小时、2小时、3小时、4小时或6小时内保持透明无沉淀。在一些实施例中,当透明输注溶液保持在约2-8℃,透明输注溶液至少在2小时、4小时、6小时、8小时、12小时或24小时内保持透明无沉淀。
23、此外,本文提供了一种用于制备肠胃外输注溶液的试剂盒,包括:第一容器,其含有包含卡巴他赛的组合物;和第二容器,其含有包含人血清白蛋白的组合物。在一些实施例中,所述试剂盒包括第一容器,其含有包含卡巴他赛的液体组合物;和第二容器,其含有包含人血清白蛋白的液体组合物。
24、在一些实施例中,所述第一容器不包含脂质(例如大豆油)。在一些实施例中,所述第二容器不包含脂质(例如大豆油)。在一些实施例中,所述脂质是大豆油。在一些实施例中,所述第一容器不包含表面活性剂。在一些实施例中,所述第二容器不包含表面活性剂。
25、在一些实施例中,第一容器含有包含卡巴他赛和乙醇的液体组合物。在一些实施例中,第一容器含有包含卡巴他赛、酸和乙醇的液体组合物。在一些实施例中,第一容器含有包含卡巴他赛、有机酸和乙醇的液体组合物。在一些实施例中,第一容器含有包含卡巴他赛、乙醇和其他有机溶剂(例如醇,如丙二醇、聚乙二醇300等)的液体组合物。在一些实施例中,第一容器含有包含卡巴他赛、乙醇和丙二醇的液体组合物。在一些实施例中,第一容器含有包含卡巴他赛、乙醇和聚乙二醇300的液体组合物。在一些实施例中,第一容器含有包含卡巴他赛、乙醇和聚乙二醇400的液体组合物。在一些实施例中,第一容器含有包含卡巴他赛和柠檬酸的液体组合物。在一些实施例中,第一容器含有包含卡巴他赛、柠檬酸和乙醇的液体组合物。在一些实施例中,第一容器含有包含卡巴他赛、柠檬酸、乙醇和丙二醇的液体组合物。在一些实施例中,第一容器中卡巴他赛与柠檬酸的重量比为约5000:1至约1:1。在一些实施例中,第一容器中卡巴他赛与柠檬酸的重量比为约2000:1至约1:1。在一些实施例中,第一容器中卡巴他赛与柠檬酸的重量比为约1000:1至约1:1。在一些实施例中,第一容器中卡巴他赛与柠檬酸的重量比为约500:1至约1:1。在一些实施例中,第一容器中卡巴他赛与柠檬酸的重量比为约5000:1至约10:1。在一些实施例中,第一容器中卡巴他赛与柠檬酸的重量比为约2000:1至约10:1。在一些实施例中,第一容器中卡巴他赛与柠檬酸的重量比为约1000:1至约10:1。在一些实施例中,第一容器中卡巴他赛与柠檬酸的重量比为约500:1至约10:1。在一些实施例中,第一容器中卡巴他赛与柠檬酸的重量比为约700:1至约200:1。
26、在一些实施例中,第一容器中卡巴他赛的量为约5mg至约100mg卡巴他赛。在一些实施例中,第一容器中卡巴他赛的量为约5mg至约80mg卡巴他赛。在一些实施例中,第一容器中卡巴他赛的量为约10mg至约60mg卡巴他赛。在一些实施例中,第一容器中卡巴他赛的量为约10mg、约20mg、约30mg、约40mg、约50mg或约60mg卡巴他赛。在一些实施例中,第一容器中卡巴他赛的浓度为约1mg/ml至约50mg/ml。在一些实施例中,第一容器中卡巴他赛的浓度为约5mg/ml至约40mg/ml。在一些实施例中,第一容器中卡巴他赛的浓度为约5mg/ml至约20mg/ml。在一些实施例中,第一容器中卡巴他赛的浓度为约10mg/ml或5mg/ml。
27、在一些实施例中,第一容器含有包含卡巴他赛的固体组合物。在一些实施例中,第一容器含有包含卡巴他赛和有机酸的固体组合物。在一些实施例中,第一容器含有包含卡巴他赛和柠檬酸的固体组合物。
28、在一些实施例中,第二容器含有包含人血清白蛋白的液体组合物。在一些实施例中,第二容器含有包含人血清白蛋白的液体组合物,其中该组合物中人血清白蛋白的浓度为约1%至约25%(w/v)。在一些实施例中,第二容器包含人血清白蛋白溶液。在一些实施例中,第二容器包含人血清白蛋白溶液,其中溶液中人血清白蛋白的浓度为约1%至约25%(w/v)。在一些实施例中,第二容器包含人血清白蛋白溶液,其中溶液中人血清白蛋白的浓度为约5%至约25%(w/v)。在一些实施例中,第二容器包含人血清白蛋白输注溶液。在一些实施例中,第二容器包含20%(w/v)人血清白蛋白输注溶液。在一些实施例中,第二容器包含25%(w/v)人血清白蛋白输注溶液。在一些实施例中,第二容器包含5%(w/v)人血清白蛋白输注溶液。在一些实施例中,第二容器含有包含约1g至约50g人血清白蛋白的液体组合物。在一些实施例中,第二容器含有包含约1g至约20g人血清白蛋白的液体组合物。在一些实施例中,第二容器含有包含约1g至约10g人血清白蛋白的液体组合物。在一些实施例中,第二容器含有包含约10g人血清白蛋白的液体组合物。
29、在一些实施例中,所述试剂盒进一步包括说明书,其指示将包含卡巴他赛的组合物添加到包含人血清白蛋白的组合物中。
30、此外,本文提供了一种包含卡巴他赛和乙醇的液体组合物,其中所述组合物不含表面活性剂(例如聚山梨醇酯80),并且其中,在向患者输注或给药之前,将所述液体组合物与包含人血清白蛋白的第二水性组合物混合,以形成一个包含卡巴他赛的输注溶液。在一些实施例中,这两种组合物在向患者输注或给药之前小于或等于约24小时内混合。在一些实施例中,这两种组合物在向患者输注或给药之前小于或等于约8小时内混合。在一些实施例中,这两种组合物在向患者输注或给药之前小于或等于约6小时内混合。在一些实施例中,这两种组合物在向患者输注或给药之前小于或等于约2小时内混合。在一些实施例中,这两种组合物在向患者输注或给药之前小于或等于约1小时内混合。在一些实施例中,混合在输液袋或输液瓶中进行。在一些实施例中,所述第二水性组合物包含肠胃外可接受载体。在一些实施例中,所述第二水性组合物容纳在输液袋或输液瓶中。在一些实施例中,将所述液体组合物注入到含有包含人血清白蛋白和肠胃外可接受载体的第二水性组合物的输液袋或输液瓶中。在一些实施例中,所述液体组合物进一步包含柠檬酸。
- 还没有人留言评论。精彩留言会获得点赞!