生成凋亡单核细胞的方法和系统与流程
生成凋亡单核细胞的方法和系统
1.本发明涉及一种方法、一种辐照装置和一个系统,用于生成供体外周血组分包含的凋亡单核细胞,并使用这些细胞来治疗与免疫系统功能紊乱有关的病症。
2.发明适用于细胞治疗和免疫治疗领域,特别是体外光免疫治疗。
3.光子疗法,也被称为体外光化学疗法(ecp),是一种细胞治疗技术,20世纪80年代edelson首次治疗皮肤t细胞淋巴瘤(ctcl)后(edelson等,1987)相继投入使用。发明包括从患者身上抽血,通过离心分离患者血液中的单核细胞(mnc),在一种叫做8-甲氧基补骨脂素(8-mop)的光活化嵌入剂存在的情况下,用紫外线a(uva)照射处理这些细胞,然后将活化后的细胞重新注入患者体内。细胞在体外进行处理。
4.ecp在治疗与免疫系统功能障碍有关病症方面的价值已经过验证,无论在自体情况下(特定患者),例如肿瘤或自身免疫病症,还是在异体情况下(供体-受体关系),如实体器官或造血干细胞(hsc)移植,可能与移植物抗宿主病(graft versus host diseas,gvhd)等主要并发症有关。
5.这种治疗的安全性和有效性现在促使临床医生扩大ecp的使用范围,尤其是在治疗自身免疫性疾病方面(adamski等,2015)。
6.ecp的作用方式还没有完全阐明。然而,人们认为8-mop穿透细胞膜并嵌入两条dna链之间。经uva照射后,8-mop被激活,引发光添加过程(jeantet,2004)。这个过程阻止了dna复制和转录,导致细胞增殖停滞和凋亡。进行cep过程中处理的单核细胞中,t淋巴细胞群是受凋亡影响最大的细胞(heshmati,2014)。细胞凋亡是一种受机体高度调控的程序性细胞死亡,另一种类型的细胞死亡是坏死,是当环境受到干扰后发生的所谓“意外”死亡。
7.重新注射到患者体内后,经过ecp处理的t淋巴细胞会发生凋亡,并被抗原呈递细胞(apc)(也被称为树突状细胞)吞噬,激活免疫系统,造成免疫耐受反应(gvhd、移植排斥)或免疫活性反应(皮肤t淋巴瘤)。
8.更具体地说,cep刺激单核细胞分化为树突状细胞,然后吞噬t淋巴细胞的凋亡体。树突状细胞的作用是在其表面呈递被吞噬元素的肽,以发出异物存在的信号,或激活特化t细胞,并诱导与释放促炎症或耐受性细胞因子有关的免疫反应。
9.目前根据机构不同,存在两种类型的ecp程序。
10.由therakos公司提出的“封闭式”或“在线”技术是指在一个封闭系统(cellex系统)中,使用单一的系统进行收集、细胞分离、处理和再注射等过程。
11.另一种是maco pharma公司提出的“开放式”或“离线”技术,其中采样/分离和处理阶段在不同机器上进行,需要多次操作。
12.然而,这两种技术的实施仍然时长相对较长和复杂,而且一直需要简化cep。
13.文件wo 2020/139495提出了对小体积(小于500ml)进行ecp的各种系统和方法,特别是通过减少需要操作的设备数量。然而这些系统和方法仍然需要使用8-mop和uva辐照。
14.为了抵消使用uva照射激活的补骨脂素后可能出现的恶性皮肤肿瘤风险,文件wo 2015/162279提出使用原卟啉x的前体5-氨基乙酰丙酸(5-ala)代替8-mop。不过该技术所需的步骤与8-mop/uva的ecp相同。
15.wo 2017/005700公开了ecp方法的另一种替代方法,没有用于获得被刺激分化为apc的活化单核细胞的凋亡剂。该方法包括通过使血样在流室中循环,使包含单核细胞的患者血样受到剪切力。
16.wo 2016/170541号文件描述了包括富集和聚集凋亡单核细胞群的细胞制剂。来自不同供体的单核细胞通过与甲基强的松龙孵化来诱导其凋亡,然后进行伽马辐照以抑制不同供体细胞之间的交叉反应。紫外线照射被引述伽马射线照射的替代方法。这些细胞制剂可用于治疗免疫、抗炎或自身免疫性疾病,特别是用于治疗移植物抗宿主病。
17.由皮肤科医生tuchinda,chanisada等组成的团队发表了一篇论文。“宽带uvb、窄带uvb、宽带uva和uva1对人类外周血单核细胞的凋亡途径激活的比较。”(photodermatology,photoimmunology&photomedicine 23.1(2007):2-9),涉及uva或uvb辐射对外周血单核细胞凋亡的诱导,这些细胞已经过清洗,即没有血浆和红细胞。caspase激活根据细胞辐照的类型和剂量的函数而测得。结论是所有的紫外线辐射都会诱导细胞凋亡,并建议细胞凋亡可能在某些对紫外线有反应的炎症性皮肤病中起作用,如银屑病。
18.j.narbutt等在“重复暴露于低剂量紫外线辐射对外周血单核细胞凋亡的影响”。(archives of dermatology 145.2(2009):133-138)一文中,比较了志愿者全身或仅部分身体反复暴露于低剂量uvb(用一盏发出54%uvb和46%uva的灯)或模拟太阳辐射(用一盏发出4%uvb和96%uva的灯)对其外周血单核细胞的影响。在这项研究的基础上可以得出以下结论:uva,而不是uvb,通过光敏化的氧自由基诱导淋巴细胞凋亡。
19.最后一篇,buchele、vera和holger hackstein的“基于单次高-剂量紫外线a光照射的简化体外光疗程序显示出类似的体外疗效。”transfusion(2020)提出通过让血液单核细胞接受高剂量的uva照射(5j/cm2)来实现无8-mop的cep。
20.本发明提出了一个更简单、更快速的方法,旨在模仿cep在没有光活化剂的情况下对单核细胞的影响。
21.为此,根据第一方面,本发明提出一种生成包含在供体外周血组分中的凋亡单核细胞的方法,上述外周血组分的血浆含量在30-50%之间,上述过程包括使血液组分受到波长在200nm和320nm之间的紫外线照射的步骤,上述辐照预计在辐照48小时后,特别是辐照24小时后,诱导辐照细胞和非辐照细胞的凋亡率之差大于15%,从而获得能够调节患者免疫反应的凋亡单核细胞。
22.根据第二方面,本发明涉及一种用于实施基于第一方面方法的辐照装置,该装置包括一个发射辐射的紫外线光源,其波长在200至320nm之间、和一个控制单元,该控制单元被配置为使含有单核细胞的外周血组分受到预定剂量的紫外线照射,以诱导在照射后48小时内,受照射细胞的凋亡率与未受照射细胞的凋亡率之差大于15%。
23.根据另一个方面,本发明包括一个系统,用于根据第一方面方法生成的包含在供体外周血组分的凋亡单核细胞,所述系统包括
24.(a)一个用于接收含有单核细胞外周血组分的辐照容器,所述辐照容器可渗透波长在200和320nm之间的射线,以及
25.(b)根据本发明第二方面的辐照装置。
26.本发明的另一个方面涉及通过根据第一方面的方法获得的凋亡单核细胞,用于治疗与免疫系统功能障碍有关的病症。
27.其他目的和优点在下文中做更详细的描述。
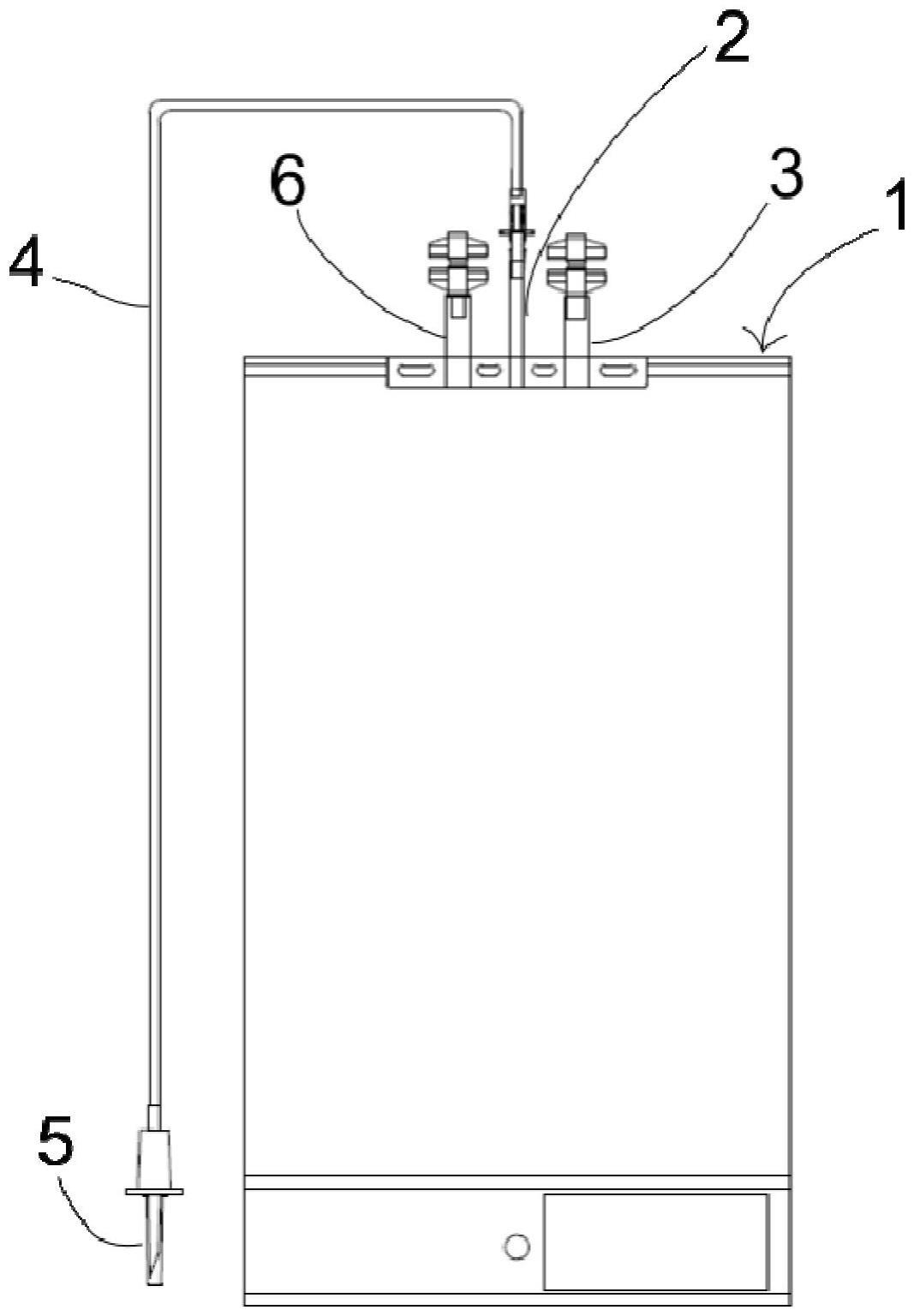
28.[图1]表示根据本发明系统的辐照袋的示意图。
[0029]
[图2]表示根据本发明系统的辐照装置的示意图。
[0030]
[图3]表示在8-mop存在的情况下,用不同剂量的uva(j/cm2)照射,jurkat细胞1天和2天后的细胞凋亡率差值(%)。
[0031]
[图4]表示在有8-mop的情况下,用不同剂量的uva(j/cm2)照射,jurkat细胞3天后的增殖抑制率(%)。
[0032]
[图5]表示用不同剂量的uvb(j/cm2)照射,jurkat细胞1天和2天后的细胞凋亡率差值(%)。
[0033]
[图6]表示用不同剂量的uva(j/cm2)照射,jurkat细胞3天后的增殖抑制率(%)。
[0034]
[图7]表示用不同剂量的uvc(j/cm2)照射,jurkat细胞1天和2天后的细胞凋亡率差值(%)。
[0035]
[图8]表示用不同剂量的uvc(j/cm2)照射,jurkat细胞3天后的增殖抑制率(%)。
[0036]
[图9]表示在8-mop存在的情况下,用不同剂量的uva(j/cm2)照射,jurkat细胞悬浮液在血浆中0天、1天和2天后的细胞凋亡率差值(%)。
[0037]
[图10]表示在8-mop存在的情况下,用不同剂量的uva(j/cm2)照射,jurkat细胞悬浮液在血浆中3天后的增殖抑制率(%)。
[0038]
[图11]表示用不同剂量的uvb(j/cm2)照射,jurkat细胞悬浮液在血浆中1天和2天后的细胞凋亡率差值(%)。
[0039]
[图12]表示用不同剂量的uvb(j/cm2)照射,jurkat细胞悬浮液在血浆中3天后的增殖抑制率(%)。
[0040]
[图13]表示在两个不同的系统中,在8-mop存在的情况下用uva或uvb照射,根据照射剂量的对数尺度,jurkat细胞悬浮液在血浆中1天和2天后的细胞凋亡率差值(%)。
[0041]
[图14]表示在有8-mop的情况下用uva照射,或用2种不同剂量(j/cm2)的uvb照射,或在有石杉碱(一种凋亡诱导剂)的情况下培养,1天后脾细胞的细胞凋亡率差值(%)。
[0042]
[图15]显示了用0.007j/cm2的uvb照射,1天和2天后脾细胞的细胞凋亡率差值(%)。
[0043]
[图16]显示了用2.5j/cm2的uvc照射,1天和2天后脾细胞的细胞凋亡率差值(%)。
[0044]
本发明提出一种旨在获得与传统ecp(8-mop/uva)获得的细胞反应相当的过程,该过程没有光活化剂如8-mop或卟啉衍生物,仅借助于光。
[0045]
根据第一方面,本发明涉及一种生成包含在供体外周血组分的凋亡单核细胞的方法。该过程包括一个紫外线照射步骤。
[0046]
外周血单核细胞(pbmc)是所有具有单一细胞核的外周血细胞。这些细胞由淋巴细胞(t细胞、b细胞、nk细胞)和单核细胞组成。红细胞和血小板没有细胞核,而粒细胞(中性粒细胞、嗜碱性粒细胞和嗜酸性粒细胞)有多裂的细胞核。
[0047]
在实施本发明的方法之前,通过白血球分离术获得供体外周血中含有单核细胞的组分,即使用血液成分分离装置,该装置抽取供体的血液,通过离心分离成血浆、红细胞和白细胞血小板层,将血浆和红细胞重新注入供体体内,并分离出含有所述单核细胞的白细胞富集组分。白血球分离术的产物包括含有单核细胞的外周血组分。这种富含白细胞的组
分体积在150至200ml之间。它包括90%以上悬浮在血浆中的单核细胞。
[0048]
另一种替代方法是,在实施工艺方法前,通过从全血样本中分离出白细胞血小板层,获得含有单核细胞的外周血部分。然后对全血样本进行离心分离,将血液分成血浆、红细胞和白细胞血小板层。分离出来的白细胞血小板层是外周血中含有悬浮在血浆中的单核细胞的组分。全血的起始体积一般在100到500ml之间。在全血样本为100至200ml的情况下,含有单核细胞的外周血组分的体积在6至10ml之间。在全血样本为450至500ml的情况下,含有单核细胞的外周血组分的体积在40至50ml之间。
[0049]
或者外周血组分在解冻进行紫外线照射之前会冷冻保存。例如将单核细胞储存在-80℃的低温保存液中,该保存液包括二甲基亚砜(dmso)、血清白蛋白和羟乙基淀粉。
[0050]
特别是外周血部分的血细胞比容在0-8%之间,基本上在1-4%,甚至更多是2%左右。红细胞的存在会影响单核细胞所吸附的紫外线量,形成对单核细胞的屏障。
[0051]
为了获得可接受的血细胞比容水平,我们会在辐照前稀释含有单核细胞的外周血组分。
[0052]
用血浆和/或生物相容性溶液(如生理盐水或缓冲溶液)进行稀释。最好只用生理盐水进行稀释。
[0053]
在一个实施方案中,外周血组分的体积在6至200ml之间,稀释后的体积在200至500ml之间,大概在300ml左右。
[0054]
含有单核细胞的外周血部分的血浆含量在30-50%之间。血浆中存在过多的脂质和/或胆红素会影响血浆透明度,从而限制单核细胞对紫外线的吸收。通过稀释和/或离心法降低外周血组分中血浆的比例,减少血浆过度吸收的风险。
[0055]
含有单核细胞并接受紫外线照射的外周血部分不含光敏剂或诱导细胞凋亡的药剂,如甲基强的松龙。由于无需加入这些药剂,该方法比传统的ecp更简单、更安全,因为获得要辐照的外周血组分之后,该过程即可完全在一个封闭系统中进行。
[0056]
根据一个实施方案,该过程是完全自体的,即含有单核细胞的外周血组分是从计划进行所述诱导的单核细胞治疗的患者那里获得。因此供体和受体是同一个人。
[0057]
从全血中分离出外周血组分之后,本发明的工艺过程在体外进行。外周血组分被放置在一个容器中,与供体分开并隔离。
[0058]
根据本发明第一方面的方法包括使所述血液成分接受波长在200nm和320nm之间的紫外线照射。
[0059]
紫外线照射的波长基本在200和280nm之间,具体来说是255nm。或者紫外线照射的波长在280和320nm之间,310nm左右。
[0060]
根据某实施方案,当外周血组分形成蛇形流道的管或袋中连续流动时,对外周血组分进行紫外线照射。
[0061]
在另一实施方案中,当外周血组分存在于容器中时,不连续地对外周血组分进行紫外线照射。
[0062]
为了使外周血组分中的单核细胞获得均匀辐照,在辐照过程不断搅动该外周血组分。
[0063]
根据本发明的方法,在辐照48小时后,尤其在辐照24小时后,预计紫外线辐照以诱导辐照细胞和非辐照细胞的凋亡率之差大于15%。
[0064]
辐照细胞的凋亡率与非辐照细胞的凋亡率之间的差异被称为凋亡率差值。通过计算受辐照细胞的凋亡率和非受辐照细胞的凋亡率之间的差异来确定凋亡率差值。
[0065]
尤其是凋亡率差值在辐照24小时后大于15%。
[0066]
通过这种波长在200至320nm之间,基本在280至320nm之间的紫外线照射,可获得能够调节患者免疫反应的凋亡单核细胞。
[0067]
细胞凋亡或程序性死亡的研究通常采用膜联蛋白-v与fitc荧光团和碘化丙啶(pi)的双重标记。使用流式细胞仪对被标记的细胞进行分析。
[0068]
膜联蛋白-v是一种对细胞膜蛋白磷脂酰丝氨酸具有高亲和力的蛋白质。当细胞存活时,膜上的磷脂酰丝氨酸位于细胞内侧,这使得膜联蛋白-v无法结合。一旦细胞进入凋亡,这些蛋白质就会外化,并在膜的两侧表达。因此可以用膜联蛋白-v标记凋亡细胞。
[0069]
结合使用pi(一种dna嵌入剂),可以将凋亡细胞与坏死细胞区分开来。事实上细胞坏死伴随着膜丧失完整性,而正在发生凋亡的细胞则没有这种情况。这使得pi能够穿透细胞并与dna插接。这种双重标记使得区分存活、坏死和凋亡细胞成为可能:存活细胞为pi阴性,膜联蛋白-v阴性;坏死细胞为pi阳性,膜联蛋白-v阴性;早期凋亡细胞为pi阴性,膜联蛋白-v阳性;后期凋亡细胞为pi阳性,膜联蛋白-v阳性。
[0070]
流式细胞仪是一种用于分析每个细胞物理和生物特征的技术,因此可以区分悬浮液中的细胞群(carmaux,2008)。形态学分析使细胞群可以根据两个参数进行区分:大小(前向散射fsc)和颗粒度(侧向散射ssc)。结果会得到一个散点图,每个点对应一个细胞。密集、同质的区域对应于一个细胞群,然后这些区域可以用软件(如accuri)划定。这样便能够被识别和分析所需细胞群。
[0071]
最好经过辐照的单核细胞在重新注射到患者体内时能够继续发生凋亡。此外,预计辐照后48小时诱导的凋亡率差值大于辐照后24小时的凋亡率差值。
[0072]
为了在患者身上获得免疫调节作用,单核细胞处于凋亡而不是坏死状态。因此,在本发明的过程中,辐照预计诱导坏死率低于5%,最好低于1%。
[0073]
ecp对细胞的另一个影响是抑制细胞增殖,特别是t淋巴细胞增殖。
[0074]
在根据第一方面的方法中,辐照预计在辐照三天后诱导细胞增殖抑制率大于70%。最好辐照后三天的细胞增殖抑制率大于90%。
[0075]
细胞增殖抑制率通过非辐照对照细胞的增殖率和辐照细胞的增殖率之差除以非辐照对照细胞的增殖率计算得出,通过最终细胞总数除以起始细胞总数确定细胞增殖率。在辐照3天后和细胞培养后,确定增殖抑制比率。
[0076]
单核细胞为了获得恰当的细胞凋亡率差值,所需要使用紫外线剂量取决于一些因素。这些因素包括内在因素,与外周血的组分有关,如血细胞比容、血浆量和血浆透明度,还有外在因素,与用于辐照的系统有关,如接收外周血的辐照容器形状和对紫外线透明度、紫外线光源的配置(单侧或两侧照射),照射容器的类型和搅拌速度以及照射容器中外周血的厚度。
[0077]
在某特定的实施方案中,为了确定对含有单核细胞的外周血组分施加适当剂量的紫外线,使用了由jurkat细胞组成的细胞模型。
[0078]
jurkat细胞是一种永生化人类cd4 t淋巴细胞系,于20世纪70年代末从一个患有白血病的14岁男孩的血液中建立。
[0079]
这个品系的优点是既可以使用,又是cep的目标,因为它由t细胞组成的。与单核细胞一样,jurkat细胞在接受8-mop和uva照射处理后显示出细胞死亡逐渐增加(cunderl
í
kov
á
,2014;lauhl
é
,2019)。
[0080]
为了确定应用于外周血组分的紫外线剂量,对jurkat细胞进行波长在200至320nm之间的紫外线照射,尤其在280至320nm之间,并在24小时后确定了光照剂量足以诱导30至40%的细胞凋亡率差值。更具体结果是在辐照48小时后,确定光照剂量足以诱导60-70%的细胞凋亡率差值。
[0081]
根据第一个实施方案,jurkat细胞悬浮在pbs类型的盐水溶液中。
[0082]
在另一实施方案中,jurkat细胞悬浮在含有血浆的2%血细胞溶液中,具体来说是30-40%的血浆。
[0083]
紫外线照射的波长在280至320nm之间,具体来说是310nm,或波长在200至280nm之间,255nm。
[0084]
我们确定了该辐照剂量足以在辐照三天后还能诱导对jurkat细胞增殖的抑制率大于70%。
[0085]
根据另一方面,本发明涉及一种用于实施上述过程的辐照装置。该辐照装置包括一个发射辐射的紫外线光源,其波长在200至320nm之间、和一个控制单元,该控制单元被配置为使含有单核细胞的外周血组分受到预定剂量的紫外线照射,以诱导在照射后48小时内,受照射细胞的凋亡率与未受照射细胞的凋亡率之差大于15%。
[0086]
辐照装置和用于接收含有单核细胞的外周血组分的辐照容器共同构成一个系统,上述辐照容器可透射波长在200至320nm之间的射线,用于根据本发明第一方面的方法,生成包含在供体外周血组分的凋亡单核细胞。
[0087]
辐照容器被设计用来接收含有待辐照的单核细胞的外周血组分。辐照容器特别适用于容纳和/或运输待辐照的液体。辐照容器有韧性且兼顾。
[0088]
在连续流动辐照的情况下,辐照容器可能采用管式、形成蛇形流道的小袋或流动盒。
[0089]
在不连续辐照的情况下,辐照容器最好采用辐照袋的形式。
[0090]
图1显示了此类辐照袋的范例。辐照袋1由可渗透紫外线的材料制成,如eva。在图1中,辐照袋1包括一个用于将外周血分量引入袋中的进气口2和一个出气口3。进气口2与一个以穿孔器5为终点的管道4相连。穿孔器5用于与含有单核细胞血液组分的源袋相连。辐照袋1还包括另一个接入口6,必要时用于引入稀释液。
[0091]
辐照装置7被配置成可以与所述辐照容器1相关联。
[0092]
根据图2,辐照装置7被配置成与辐照袋1相关联。辐照装置7包括,一个托盘8,辐照袋1放在该托盘上。托盘8的中央部分9对波长在200至320nm之间,尤其在280至320nm之间的紫外线具有较好的渗透性,因此辐照袋1可以从任何一面进行辐照。托盘8的中心部分9可以由石英制成。
[0093]
托盘8最好是一个摇床托盘。摇床托盘可以做回转式运动,以便对辐照袋1的内容物进行均匀辐照。
[0094]
由马达10为托盘8的旋转运动提供动力。
[0095]
辐照装置7还包括一个紫外线光源11,该光源发出的辐射波长在200至320nm之间,
尤其在280至320nm之间,更具体的说是在310nm的范围内。
[0096]
在图2中,光源11包括多个发射紫外线的灯,其辐射波长在200至320nm之间,尤其在280至320nm之间。
[0097]
在图2中,辐照装置7包括两组六个灯管,排列在托盘8的两侧,以便从上面和下面辐照辐照袋1。
[0098]
或者,光源11可以由一组或两组发光二极管组成。
[0099]
在图2中,设有反射器12,将光源11发出的光反射到辐照袋上。
[0100]
辐照装置7还包括一个控制单元,该控制单元被配置为使含有单核细胞的外周血组分受到具有200至320nm波长的紫外线辐照剂量,并预先确定在辐照48小时后,诱导受辐照细胞和未受辐照细胞的凋亡率之间的差异大于15%。
[0101]
特别是,辐照装置7向辐照容器提供波长在200至320nm之间的紫外线辐照剂量,预定在辐照24小时后诱导单核细胞的细胞凋亡率差异大于15%。
[0102]
具体来说紫外线辐照的波长在280至320nm之间。为了控制辐照装置7向辐照容器提供的辐照剂量,辐照装置7包括一个或多个安置在光源11的光学传感器。这些光学传感器检测由光源发出的辐照强度。
[0103]
控制单元的形式是电子和计算机系统,包括例如一个旨在执行命令程序的微处理器。执行该程序使控制单元能够控制紫外光源,尤其取决于例如由光学传感器收到的信号。例如控制单元确定达到目标剂量所需的辐照时间,作为由光学传感器确定的光强度的函数。
[0104]
在一个实施方案中,使用上述jurkat细胞模型预先确定辐照剂量。
[0105]
或者通过使用正方形数字模型对jurkat细胞在细胞凋亡率差值方面的反应进行建模以确定辐照剂量。即使没有辐照,细胞也会发生凋亡。当应用高剂量时,细胞凋亡率将达到饱和。在此之间,函数具有单调性:细胞凋亡率差值随着剂量的增加而增加。
[0106]
在此描述一种操作上述系统的方法,以生成包含在供体外周血组分的凋亡单核细胞。
[0107]
操作所述系统的方法包括以下步骤:
[0108]
(a)用含有单核细胞的供体外周血组分提供一个辐照容器,
[0109]
(b)将所述辐照容器置于辐照装置中,该装置包括一个发射波长在200至320nm之间的紫外线光源;
[0110]
(c)在所述辐照装置中用所述紫外线辐照所述辐照容器,在辐照48小时后,尤其在辐照24小时后,预计紫外线辐照诱导辐照细胞和非辐照细胞的凋亡率之差大于15%。
[0111]
具体来说紫外线光源波长在280至320nm之间,和/或预计在照射后24小时内诱导的细胞凋亡率差值大于15%。
[0112]
根据本发明的方法进行紫外线照射后,单核细胞能够调节患者的免疫反应。
[0113]
因此本发明涉及通过根据上述方法获得的凋亡单核细胞,用于治疗与免疫系统功能障碍有关的病症。此类病症有皮肤t细胞淋巴瘤(ctcl),包括塞扎里综合症、移植物抗宿主疾病(gvhd)、实体器官移植排斥反应、系统性硬皮病、特应性皮炎、银屑病、红斑狼疮和克罗恩病。
[0114]
在一个特定的实施方案中,凋亡的单核细胞在紫外线照射后被冷冻保存,以供日
后使用。
实施例
[0115]
为了证明传统的ecp技术与8-mop/uva在细胞反应和本发明的方法相比具有等同性,进行了几项实验。
[0116]
1.细胞模型
[0117]
由于很难获得患者的单核细胞,因此选择了从人类淋巴瘤中提取的t淋巴细胞系jurkat作为开展实验的细胞模型。
[0118]
2.接受标准
[0119]
用于验证传统ecp(200-333ng/ml的8-mop和2j/cm2的uva)体外疗效的标准是t淋巴细胞的凋亡和t淋巴细胞增殖抑制。
[0120]
对于患者的单核细胞,接受标准是:
[0121]-ecp三天后,细胞增殖抑制率大于70%,并且
[0122]-ecp后24小时内细胞凋亡率差值大于15%(taverna,2015)。
[0123]
在jurkat细胞模型中,接受标准是
[0124]-ecp 3天后,细胞增殖抑制率大于70%,并且
[0125]-ecp后24小时内细胞凋亡率差值大于30%(lauhl
é
,2019)。
[0126]
3.制备辐照用细胞
[0127]
为了获得所需数量的jurkat细胞,在补充有胎牛血清(10%v/v)、1%的l-谷氨酰胺(lonza)和1%青霉素-链霉素(lonza)的rpmi 1640培养基中培养。细胞在培养瓶中生长,放置在37℃和5%二氧化碳的培养箱中。jurkat的数量翻倍时间约为27小时。
[0128]
根据实验情况,每个辐照容器(培养皿或辐照袋)使用10x106或400x106个jurkat细胞。
[0129]
细胞悬浮在pbs(磷酸盐缓冲盐水)溶液或含有1/14抗凝剂acd-a的2%血细胞溶液中(nacl和血浆体积比50/50的混合物)。最终体积是使容器中细胞悬浮液的厚度约为3mm。
[0130]
在uva照射的情况下,细胞溶液还含有200ng/ml或333
°
ng/ml的8-mop。
[0131]
3.辐照设备
[0132]
使用了三种类型的辐照设备。
[0133]
第一个是macogenic g2辐照装置,由maco pharma(法国)制造,用于辐照一个袋。它包括六个提供uva辐射的灯管,排列在一个紫外线透明的石英托盘的两侧。托盘以60rpm的速度摇动辐照袋,以确保照射均匀性。
[0134]
第二个设备是maco pharma(法国)的macotronic紫外线辐照设备,用于辐照一个袋。它包括六个提供uvc(254nm)辐射的灯管,排列在一个紫外线透明的石英托盘的两侧。托盘以110rpm的速度摇动辐照袋,以确保照射均匀性。
[0135]
第三种辐照装置是来自opsytec dr 的bs02罩式辐照器,用于辐照培养皿。这种辐照器使用可拆卸的灯管提供规定剂量的辐照,灯管可以放在设备内部。使用的灯管是峰值为352nm的uva、峰值为311nm的uvb或峰值为257nm的uvc。剂量计根据设备内传感器测量的辐照剂量来控制辐照时间。为了确保细胞溶液均匀辐照,在设备的辐照室中放置了一个回转式摇床。摇动速度约为450rpm。
[0136]
4.细胞特征:细胞凋亡测试和细胞增殖的测量
[0137]
在辐照阶段结束时,清洗血细胞比容水平为2%的细胞溶液,以回收尽可能多的jurkat细胞用于培养,并减少红细胞污染。为此使用ficoll溶液(ge healthcare)通过密度梯度分离成分。
[0138]
在分离出jurkat后,清洗三次以去除ficoll溶液。前两次是在含有2mm edta(赛默飞世尔)的pbs溶液中进行,第三次是在pbs溶液中进行。然后将细胞重新悬浮在补充的rpmi培养基中,用vi-cell和abx计数,以估计已分离的jurkat的数量,并评估残余红细胞的数量。
[0139]
为了监测目标参数(细胞凋亡和对jurkat增殖的抑制),通过细胞计数培养细胞。为此,将5x106个处理过的和5x106个未处理的细胞播种在10ml的培养液中。
[0140]
4.1细胞凋亡测定
[0141]
细胞凋亡采用膜联蛋白-v与fitc荧光团和碘化丙啶(pi)的双重标记。
[0142]
值用以下公式确定细胞凋亡率差:
[0143]
[数学公式1]
[0144]
细胞凋亡率差值=(处理后的凋亡细胞率—未处理的凋亡细胞率)
[0145]
4.2.细胞增殖抑制
[0146]
jurkat的初始数量是每个培养瓶5x106个细胞。然后用vi-cell来计算每个培养瓶的细胞数量。
[0147]
为此,将装有细胞的培养液以1500rpm离心5分钟,将细胞颗粒重新悬浮在补充的rpmi培养液中。根据细胞密度,可在pbs中以1:10进行稀释。
[0148]
第n天的细胞增殖抑制百分比(dn)由以下公式计算得出:
[0149]
[数学公式2]
[0150]
%pi(第n天)=100-%p(第n天)
[0151]
其中%p(第n天)是第n天的细胞增殖率,由以下公式计算得出:
[0152]
[数学公式3]
[0153][0154]
实施例1:8-mop/uva、uvb和uvc处理对pbs中jurkat细胞的比较。
[0155]
本实验的目的是确定每种辐射的照射剂量,以使(i)jurkat细胞在照射后一天细胞凋亡率差值在30%和40%之间,在照射后两天细胞凋亡率差值在50%和60%之间,以及(ii)在照射后3天增殖抑制率大于70%。
[0156]
最初,这些实验在悬浮于pbs(不含血浆或血细胞)的细胞上进行,以确定所需的最小辐照剂量。
[0157]
将含有10x106个细胞的2ml细胞悬浮液放在培养皿中。仅在uva照射时,在细胞悬浮液中加入200ng/ml的8-mop。然后将培养皿放在bs02辐照装置中,用三种辐照方式之一进行辐照:uva、uvb或uvc。摇动速度设定为450rpm。
[0158]
a.ecp 8-mop/uva
[0159]
对于uva辐照,jurkat细胞悬浮液含有200ng/ml的8-mop。第一组测试了0.03和0.4j/cm2之间的几种uva辐照剂量。在第二组测试中,根据第一组测试的结果,使用了三钟
剂量(0.1j/cm2,0.13j/cm2和0.16j/cm2)。0.13j/cm2的uva剂量在细胞凋亡率差值和抑制增殖方面都符合接受标准(图3和图4)。
[0160]
对于所测试的所有剂量的uva辐射,细胞坏死率保持在1%以下。
[0161]
b.uvb辐照
[0162]
在测试了从0.5m j/cm2到1j/cm2的辐照剂量后,目标剂量被严格控制在1到11mj/cm2之间。7mj/cm2剂量在细胞凋亡率差值和抑制增殖方面被确定均符合接受标准(图5和图6)。
[0163]
辐照24小时后,对于7mj/cm2的辐照剂量,大约20%的细胞是晚期凋亡,40%是早期凋亡。
[0164]
对于0.5mj/cm2和1j/cm2之间的所有uvb辐照剂量,细胞坏死率低于1%。
[0165]
c.uvc辐照
[0166]
在测试了0.5到3.5mj/cm2的辐照剂量后,重新测试了1到5mj/cm2的相关剂量(图7和图8),最后测试了三个剂量(2mj/cm2、2.5mj/cm2和3mj/cm2)。2.5mj/cm2的uvc剂量在细胞凋亡率差值和抑制增殖方面被确定均符合接受标准。
[0167]
辐照24小时后,对于2mj/cm2的辐照剂量,大约40%的细胞是晚期凋亡,30%是早期凋亡。
[0168]
值得注意的是,与uva/8-mop和uvb照射不同,对于2mj/cm2剂量的紫外线照射,细胞凋亡率差值在第一天和第二天之间没有增加。
[0169]
对于所测试的所有剂量的uvc,细胞坏死率保持在1%以下。实施例2:比较8-mop/uva和uvb处理对悬浮在2%血细胞的血浆/盐水溶液中的jurkat细胞的影响。
[0170]
本实验的目的是确定每种辐射的照射剂量,使其达到以下接受标准:
[0171]-jurkat细胞的凋亡率差值在第1天为30%至40%,第2天为50%至60%,以及
[0172]-第3天时增殖抑制率大于70%。
[0173]
制备2ml溶液,其中含有10x106个jurkat细胞,血细胞比为2%,1/14acd-a,盐溶液和血浆体积比50/50的混合物。仅在uva照射时加入333ng/ml的8-mop。
[0174]
将含有10x106个细胞的2ml细胞悬浮液放在培养皿中,然后将培养皿放在bs02辐照装置中。这个装置同时用于uva和uvb照射。摇动速度设定为450rpm。
[0175]
a.8-mop/uva
[0176]
就细胞凋亡率差值和增殖抑制而言,达到细胞凋亡率差值接受标准的剂量为4j/cm2,达到增殖抑制率接受标准的剂量为3j/cm2(图9和图10)。
[0177]
b.uvb
[0178]
就细胞凋亡率差值而言,从0.1j/cm2剂量开始达到接受标准,而就增殖抑制而言,从0.025j/cm2开始达到接受标准(图11和图12)。
[0179]
辐照24小时后,对于0.1j/cm2的辐照剂量,大约40%的细胞是晚期凋亡,25%是早期凋亡。
[0180]
实施例3:紫外线处理悬浮在2%血细胞的盐水/血浆溶液中的jurkat细胞。
[0181]
在本实验中,将jurkat细胞悬浮在2%血细胞比容,1/14acd-a,盐溶液和血浆体积比50/50的混合物。将含有400x106个细胞且体积为330-400ml的细胞悬浮液置于一个紫外线渗透袋中。
[0182]
使用macopharma(法国)的macotronic紫外线设备进行辐照。研究了2 5mj/cm2和50mj/cm2两种剂量。
[0183]
结果显示,细胞凋亡率差值在辐照后的第一天和第二天保持不变,紫外线剂量25mj/cm2的比率约为50%,紫外线剂量50mj/cm2的比率约为70%。
[0184]
就辐照后三天对细胞增殖的抑制而言,剂量25mj/cm2的抑制率约为65%,剂量50mj/cm2的抑制率约为80%。
[0185]
实施例4:与maco pharma ecp技术的相关性
[0186]
使用与实施例2相同的基质,用maco pharma公司销售的ecp系统对jurkat细胞(330x106个细胞,300ml,333ng/ml的8-mop)进行辐照。
[0187]
maco pharma公司的ecp系统由一个uva渗透袋和macogenic g2辐照装置组成,根据待辐照袋中所含溶液的血细胞比容,设计出2至2.5j/cm2的辐照剂量。辐照周期大约持续12分钟。
[0188]
从2j/cm2的剂量开始,即达到细胞凋亡率差值和抑制增殖的接受标准,与系统的建议一致。
[0189]
为了模拟细胞在细胞凋亡率差值方面的反应,适用于sigmoidal数字模型。
[0190]
图13展示了使用对数刻度的辐照剂量所得到结果的图示。
[0191]
接受标准取决于辐照容器和设备的组合以及系统的光学配置。例如用macogenic g2提供的2.1j/cm2的uva剂量相当于用bs02辐照器提供的4j/cm2的uva剂量或用bs02辐照器提供的0.081j/cm2的uvb剂量。
[0192]
实施例4:小鼠脾细胞模型
[0193]
作为准备对小鼠gvh模型研究的一部分,进行了一项实验,以检查通过照射jurkat(示例1)得出的剂量能否诱导小鼠脾细胞凋亡。
[0194]
将含有5x106个细胞的脾细胞悬浮液(immune insight,法国)用bs02辐照器以下列剂量进行辐照:uva/8-mop为0.13j/cm2,uvb为7mj/cm2和70mj/cm2,uvc为2.5mj/cm2。
[0195]
在uva照射的情况下,细胞悬浮液含有200ng/ml的8-mop。
[0196]
测试的每个剂量都诱发了细胞凋亡。值得注意的是,照射2天后,细胞凋亡率差值下降,这是因为在对照组中测得的凋亡率很高(图14至图16)。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1