用于异基因造血干细胞移植的方法与流程
背景技术:
1、患有血液恶性肿瘤(如超过首次缓解的白血病和淋巴瘤)或患有难治性复发的患者很少用标准化疗治愈。清髓性异基因造血细胞移植(allohct)与这些患者的改善的生存期相关联,但与移植物抗宿主病(gvhd)相关联的发病率和死亡率是限制allohct的成功的主要因素。
技术实现思路
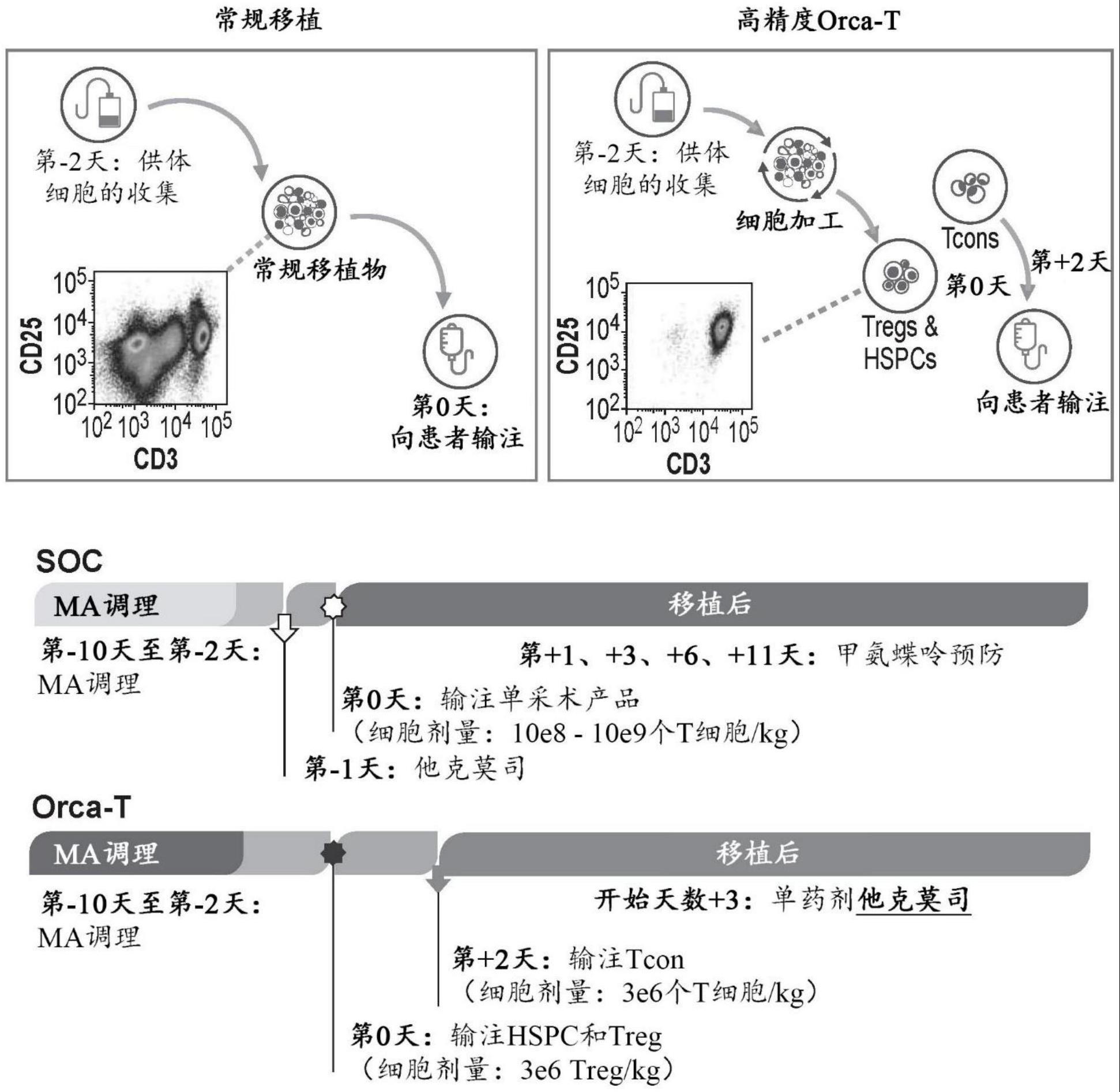
1、在第一方面,本发明的实施方案提供了一种多组分药物治疗(multi-componentpharmaceutical treatment),所述多组分药物治疗待施用于有需要的人类对象。根据一个实施方案,所述多组分治疗包括:(a)包含第一cd45+细胞群体的溶液,所述第一cd45+细胞群体包含造血干细胞和祖细胞(hspc)以及粒细胞,其中至多约10%的第一cd45+细胞群体包含粒细胞;(b)包含富含调节性t细胞(treg)的细胞群体的溶液;(c)包含第二cd45+细胞群体的溶液,其中第二cd45+细胞群体包含至少约20%的cd3+常规t细胞(tcon)、至少约10%的单核细胞和至少约10%的粒细胞;和(d)包含一个或多个剂量的移植物抗宿主病(gvhd)预防药剂的溶液。
2、在许多实施方案中,gvhd预防药剂包括他克莫司(tacrolimus)和/或其类似物和衍生物,其可以根据各种实施方案被配制成用于口服施用或静脉内施用于人类对象或制药领域中已知的其他施用或递送方法,包括例如肌内、经皮、鼻、颊和阴道施用。
3、在各种实施方案中,他克莫司可以在施用第二cd45+细胞群体之后以维持人类对象中至少约3ng/ml血液的目标血液水平的量施用至少约20天、在施用第二cd45+细胞群体之后以维持约4ng/ml或更高的目标血液水平的量施用至少约40天和/或在施用第二cd45+细胞群体之后以维持约4ng/ml或更高的目标血液水平的量施用至少约40天。在一些情况下,在施用第二cd45+细胞群体之后,以维持至多约10ng/ml的目标血液水平的量施用他克莫司持续至少30天。
4、在一些实施方案中,他克莫司在施用第二cd45+细胞群体之后施用至少约60天、在施用第二cd45+细胞群体之后施用至少约90天、在施用第二cd45+细胞群体之后施用至多约150天、在施用第二cd45+细胞群体之后施用至多约120天。
5、在一些实施方案中,第一cd45+细胞群体包含至少约0.5%的粒细胞、至少约1%的粒细胞、至多约5%的粒细胞、至多约3%的粒细胞、至多约3%的单核细胞、至多约2%的单核细胞、至多约0.5%的淋巴细胞、至多约2%的淋巴细胞、至少约15%的粒细胞、至少约20%的粒细胞、至多约35%的粒细胞、至多约30%的粒细胞、至多约25%的粒细胞、至少约15%的单核细胞、至少约20%的单核细胞、至多约35%的单核细胞、至多约30%的单核细胞、至多约25%的单核细胞、至少约0.5%的nk细胞、和/或至少约2%的nk细胞。
6、在一些实施方案中,第二cd45+细胞群体包含至少约0.1%的cd34+细胞或约0.2%至约20%的cd34+细胞和/或至少约0.1%的treg。
7、在各种实施方案中,所述多组分药物治疗还包括调理方案(conditioningregimen),其中调理方案在上文所列的组分(a)至(d)中的任一者之前施用,例如,调理方案在(a)至(d)中的任一者之前约两天至约十天施用。在一些实施方案中,调理方案是清髓性调理方案。在一些情况下,调理方案包括至少三种调理试剂,其中至少一种调理试剂为噻替派。在实施方案中,清髓性调理方案包括至少一个剂量的噻替派,例如,至少约5毫克噻替派/kg所述人类对象的实际或理想体重,或至少约10毫克噻替派/kg所述人类对象的实际或理想体重。在各种实施方案中,调理方案包括一个或多个剂量的白消安、氟达拉滨和噻替派。在一些实施方案中,一个或多个剂量分别包括约5至约12mg噻替派/kg所述人类对象的实际或理想体重、约7至约11mg白消安/kg所述人类对象的实际或理想体重以及约100至约200mg氟达拉滨/m2体表面积。
8、在一些实施方案中,第一cd45+细胞群体包含少于约5eu的内毒素/ml溶液、少于约1eu的内毒素/ml溶液和/或少于约0.5eu的内毒素/ml溶液。在一些情况下,富含treg的细胞群体包含少于约5eu的内毒素/ml溶液、少于约1eu的内毒素/ml溶液和/或少于约0.5eu的内毒素/ml溶液。在各种实施方案中,第二cd45+细胞群体包含少于约5eu的内毒素/ml溶液、少于约1eu的内毒素/ml溶液和/或少于约0.5eu的内毒素/ml溶液。
9、在一些实施方案中,hspc为cd34+。
10、在一些实施方案中,treg为cd4+cd25+cd127dim或cd4+foxp3+。在一些情况下,富含treg的细胞群体包含cd45+细胞,例如,超过约90%的cd45+细胞为treg。在各种实施方案中,富含treg的细胞群体包含约1×105至约1×107个treg/kg所述人类对象的实际或理想体重,或约5×105至约4×106个treg/kg所述人类对象的实际或理想体重。
11、在一些实施方案中,包含hspc的第一cd45+细胞群体包含约5×105至约2×107个hspc/kg所述人类对象的理想身体。在一些情况下,第二cd45+细胞群体包含约1×105至约1×107个tcon/kg所述人类对象的实际或理想体重,或者第二cd45+细胞群体包含约5×105至约5×106个tcon/kg所述人类对象的实际或理想体重。
12、在一些实施方案中,第一cd45+细胞群体和富含treg的细胞群体在第二cd45+细胞群体之前施用。
13、在各种实施方案中,一个或多个剂量的gvhd预防药剂的第一剂量在施用第二cd45+细胞群体之后施用。
14、另一方面提供了一种治疗被诊断患有血液恶性肿瘤的人类对象的方法。根据一个实施方案,该方法包括向人类对象施用包含第一cd45+细胞群体的溶液、包含富含调节性treg的细胞群体的溶液、包含第二cd45+细胞群体的溶液和包含一个或多个剂量的gvhd预防药剂的溶液。在该方面,包含第一cd45+细胞群体的溶液、包含富含调节性treg的细胞群体的溶液、包含第二cd45+细胞群体的溶液和包含一个或多个剂量的gvhd预防药剂的溶液如根据本文公开的任何多组分药物治疗所定义。
15、血液恶性肿瘤可以对应于急性淋巴细胞白血病、急性髓细胞性白血病、慢性髓细胞性白血病、多发性骨髓瘤、淋巴瘤、霍奇金淋巴瘤和非霍奇金淋巴瘤中的一种或多种。
16、在一些实施方案中,施用包括向人类对象输注所述第一cd45+细胞群体、所述富含treg的细胞群体和所述第二cd45+细胞群体。
17、在一些实施方案中,所述第二cd45+细胞群体可以在所述第一cd45+细胞群体之后至少约12小时施用,所述第二cd45+细胞群体在所述第一cd45+细胞群体之后约24至约96小时施用,所述第二cd45+细胞群体在所述第一cd45+细胞群体之后约36至约60小时施用,所述第二cd45+细胞群体在所述富含treg的细胞群体之后至少约12小时施用,所述第二cd45+细胞群体在所述富含treg的细胞群体之后约24至约96小时施用,和/或所述第二cd45+细胞群体在所述富含treg的细胞群体之后约36至约60小时施用。
18、在各种实施方案中,所述人类对象在所述施用所述第二cd45+细胞群体的约100天内未发展高于2期gvhd,所述人类对象在所述施用所述第二cd45+细胞群体的约180天内或约200天内未发展高于2期gvhd,所述人类对象在所述施用所述第二cd45+细胞群体的约1年内未发展高于2期gvhd。
19、在一些实施方案中,所述人类对象先前已经或正在同时针对血液恶性肿瘤进行治疗。
20、在一些实施方案中,gvhd预防药剂是他克莫司(和/或其类似物和衍生物),并最初以约0.03mg/kg人类对象的实际或理想体重/天施用于人类对象,或者在所述施用所述第二cd45+细胞群体之后约12小时至约24小时开始施用他克莫司。
21、在各种实施方案中,他克莫司的剂量可以在向人类对象施用第一剂量之后约90天开始逐渐减小,或者他克莫司的剂量在向人类对象施用第一剂量之后约45天开始逐渐减小。
22、在一些实施方案中,第一cd45+细胞群体、富含treg的细胞群体和第二cd45+细胞群体在一天或多天内从单一供体获得。
23、在一些实施方案中,从供体收集至少一次动员的外周血捐献,或从供体收集至多两次动员的外周血捐献。
24、在各种实施方案中,对动员的外周血捐献中的至少一次进行加工和分选,以富集cd34+细胞和treg。在一些实施方案中,动员的外周血捐献中的一次或多次的加工和分选时间少于约35小时,动员的外周血捐献中的一次或多次的加工和分选时间少于约30小时,动员的外周血捐献中的一次或多次的加工和分选时间少于约25小时,动员的外周血捐献中的一次或多次的加工和分选时间为至多约35小时,和/或动员的外周血捐献中的一次或多次的加工和分选时间为至多约25小时。
25、在各种实施方案中,使用一个或多个免疫分离颗粒(isp)来对动员的外周血捐献中的一次或多次进行加工和分选,例如,isp包括亲和试剂,如免疫磁性分离颗粒,其可以是各自与含铁颗粒缀合的抗体。在一些实施方案中,亲和试剂包括结合至hspc上的一个或多个cd34受体的多种cd34试剂(例如,抗cd34抗体)。在一些情况下,hspc细胞群体中每个hspc的isp的平均数量小于约20,000,hspc细胞群体中每个hspc的isp的平均数量等于或小于约10,000,和/或hspc细胞群体中每个hspc的isp的平均数量为约1500至约20,000。在实施方案中,亲和试剂包括结合至treg上的一个或多个cd25受体的多种cd25试剂(例如,抗cd25抗体)。在一些情况下,treg群体中每个t-reg细胞的isp的平均数量等于或小于约4000,或者treg群体中每个t-reg细胞的isp的平均数量为约1500至约2500。
26、在各种实施方案中,对动员的外周血捐献的细胞进行分选,使得第一cd45+细胞群体包含至多约10%的粒细胞。在一些情况下,对动员的外周血捐献的细胞进行分选,使得第一cd45+细胞群体包含至多约7%的粒细胞。
27、在一些实施方案中,对动员的供体外周血捐献的细胞进行分选,使得第一cd45+细胞群体包含至多约4%的单核细胞。在一些情况下,对动员的供体外周血捐献的细胞进行分选,使得第一cd45+细胞群体包含至少约0.1%的单核细胞。
28、在实施方案中,对动员的供体外周血捐献的细胞进行分选,使得富含treg的群体包含至多约10%的cd25细胞。
29、在各种实施方案中,第一cd45+细胞群体、所述富含treg的细胞群体和/或所述第二cd45+细胞群体相对于所述人类对象是异基因的。
30、在一些实施方案中,第一cd45+细胞群体、所述富含treg的细胞群体和/或所述第二cd45+细胞群体从相对于所述人类对象为hla匹配的供体获得。
31、在实施方案中,第一cd45+细胞群体、所述富含treg的细胞群体和/或所述第二cd45+细胞群体从相对于所述人类对象为hla不匹配的供体获得。
32、在各种实施方案中,第一cd45+细胞群体、所述富含treg的细胞群体和/或所述第二cd45+细胞群体从相对于所述人类对象为单倍体相合的供体获得。
33、在一些实施方案中,第二cd45+细胞群体包括恒定自然杀伤t细胞(inkt)群体,例如,为cd3+vα24jα18+的inkt。
34、在实施方案中,inkt群体包含超过约5×102个inkt/kg所述人类对象的理想身体实际或理想体重。
35、在各种实施方案中,inkt群体包含约5×102至约1×107个inkt/kg所述人类对象的理想身体实际或理想体重。
36、在一些实施方案中,第二cd45+细胞群体包括记忆t细胞(tmem)群体,例如,为cd3+cd45ra-cd45ro+的tmem。
37、在实施方案中,tmem群体包含超过约3×105个tmem/kg所述人类对象的理想身体实际或理想体重。
38、在各种实施方案中,tmem群体包含约3×105至约1×109个tmem/kg所述人类对象的理想身体实际或理想体重。
39、另一方面提供了一种多组分药物治疗,其中与其中人类对象接受tcon但未接受treg的类似药物治疗相比,与多组分药物治疗相关联的不良事件的风险和/或严重程度被降低,或者是本文公开的任何方法,其中与其中人类对象接受tcon但未接受treg的类似方法相比,与该方法相关联的不良事件的风险和/或严重程度被降低。
40、在一些实施方案中,不利事件为急性gvhd(agvhd),其可以包括二期或更高的agvhd。
41、在各种实施方案中,不良事件为慢性gvhd(cgvhd),其可以为中度至重度cgvhd。
42、在一些实施方案中,人类对象在施用细胞群体之后约一年没有cgvhd。
43、在各种实施方案中,不良事件为人类对象的恶性肿瘤的复发。
44、在一些实施方案中,人类对象在施用药物给药方案之后约一年没有其恶性肿瘤的复发。
45、在实施方案中,在施用任何细胞群体之前,人类对象已经经历清髓性调理方案,并且不良事件与清髓性调理相关联。
46、在各种实施方案中,所述方法还包括提供使用说明书(ifu),所述ifu包括用于向患者施用细胞群体的说明。在一些情况下,ifu还包括用于向患者施用一种或多种药物剂或组合物的说明。
47、另外的方面提供了一种移植常规t细胞(tcon)群体作为血液恶性肿瘤的治疗方案的一部分的方法,其中该方法降低了与治疗方案相关联的不良事件的风险和/或严重程度。该方法包括向患者施用调节性t细胞(treg)群体,所述调节性t细胞(treg)群体包含treg和悬浮treg的液体;向患者施用包含淋巴细胞、粒细胞、单核细胞和悬浮所述细胞的液体的异源细胞群体。在该方面,至少约30%的所述淋巴细胞包含tcon,并且在施用细胞群体之后,与接受tcon但未接受treg的血液恶性肿瘤患者相比,患者具有降低的不良事件的风险和/或严重程度。
48、另外的方面提供了一种将细胞群体移植到人类患者中作为血液恶性肿瘤的治疗方案的一部分的方法,其中该方法降低了与治疗方案相关联的不良事件的风险和/或严重程度。该方法包括提供待施用于患者的造血干细胞和祖细胞(hspc)群体,所述hspc群体包含hspc和悬浮hspc的液体;提供待施用于患者的调节性t细胞(treg)群体,所述treg群体包含treg和悬浮treg的液体;和提供待施用于患者的异源细胞群体,所述异源细胞群体包含淋巴细胞、粒细胞、单核细胞和悬浮所述细胞的液体。在该方面,至少约30%的所述淋巴细胞包含常规t细胞(tcon),并且在施用所述细胞群体之后,与接受tcon细胞群体但未接受t-reg细胞群体的血液恶性肿瘤患者相比,所述患者具有降低的不良事件的风险和/或严重程度。
49、在一些实施方案中,通过静脉内输注向患者施用细胞群体。
50、在实施方案中,相应的细胞群体作为单独的细胞群体提供,并且来源于单一人类血液供体。
51、在各种实施方案中,不良事件为急性移植物抗宿主病(agvhd),例如,二期或更高的agvhd。在一些情况下,患者在施用细胞群体之后约180天没有二期或更高的agvhd。
52、在一些实施方案中,不良事件为慢性移植物抗宿主病(cgvhd)。在一些情况下,患者在施用细胞群体之后约一年没有cgvhd。
53、在实施方案中,不良事件为中度至重度cgvhd。在一些情况下,患者在施用细胞群体之后约一年没有中度至重度cgvhd。
54、在各种实施方案中,不良事件为患者的恶性肿瘤的复发。在一些情况下,患者在施用细胞群体之后约一年没有其恶性肿瘤的复发。
55、在一些实施方案中,不良事件包括移植物抗宿主病(gvhd)和患者的恶性肿瘤的复发。在一些情况下,患者在施用细胞群体之后一年没有ghvd或其恶性肿瘤的复发。
56、在实施方案中,细胞群体中的至少一种包含少于约5eu的内毒素/ml相应的悬浮液体。
57、在各种实施方案中,在施用细胞群体之前,患者已经经历清髓性调理方案,并且不良事件与清髓性调理相关联。在一些情况下,不良事件包括患者的恶性肿瘤的复发或感染。
58、在一些实施方案中,异源细胞群体包含约0.2%至约2.0%的造血干细胞和祖细胞。
59、在实施方案中,血液恶性肿瘤为急性淋巴细胞白血病、急性髓细胞性白血病、慢性髓细胞性白血病、多发性骨髓瘤、淋巴瘤、霍奇金淋巴瘤和非霍奇金淋巴瘤。
60、在各种实施方案中,t-reg细胞的基因表达水平与在施用于患者前约60小时内从供体收获的细胞相关。
61、在一些实施方案中,t-reg群体中t-reg细胞的数量约等于异源细胞群体中t-con细胞的数量。在一些情况下,t-reg群体中的t-reg细胞将患者的健康组织对异源细胞群体中常规t细胞的激活抑制最高达约20%的量。
62、在实施方案中,与未施用细胞群体的健康人类对象相比,在施用细胞群体之后最长达约100天,患者的外周血显示出升高的treg与cd4+t细胞的比率。
63、在各种实施方案中,hspc细胞群体中至少约50%的细胞是集落形成单位。
64、在一些实施方案中,与未动员的血液相比,细胞群体中的至少一种具有升高量的粒细胞集落刺激因子。在一些情况下,至少一种细胞群体是异源细胞群体。
65、在实施方案中,细胞群体中的至少一种具有附着于细胞群体的细胞上的受体的多个免疫分离颗粒(isp)。在一些情况下,多个isp是免疫磁性分离颗粒。在各种实施方案中,多个isp包括与含铁颗粒缀合的抗体。
66、在一些实施方案中,tcon群体在hspc群体之后至少约12小时施用,例如,所述tcon群体在hspc群体之后约24至约96小时施用,或所述tcon群体在hspc群体之后约36至约60小时施用。
67、在一些实施方案中,tcon群体在包含treg的所述细胞群体之后至少约12小时施用,例如,tcon群体在包含treg的细胞群体之后约24至约96小时施用,或所述tcon群体在包含treg的细胞群体之后约36至约60小时施用。
68、在各种实施方案中,本文公开的方法还包括在最长达约180天的时间段内向患者施用包含他克莫司的单一移植物抗宿主病(gvhd)预防药剂(gvhdpa)(他克莫司ghvdpa);其中施用他克莫司ghvdpa以在所述时间段期间将患者的血液中的他克莫司的浓度维持在高于阈值水平;并且其中ghvd的风险和/或严重程度被显著降低。
69、在一些实施方案中,阈值水平为高于约4ng他克莫司/ml患者血液,或阈值水平为高于约5ng他克莫司/ml患者血液。
70、在实施方案中,施用他克莫司ghvdpa以在所述时间段期间将患者的血液中的他克莫司的浓度维持在低于上限阈值水平。在一些情况下,上限阈值水平为低于约10ng他克莫司/ml患者血液。
71、在各种实施方案中,患者具有恶性肿瘤复发、感染或肾衰竭中至少一种的降低的风险。
72、在一些实施方案中,患者在施用tcon的约30天内未发展gvhd,在施用tcon的约100天内未发展gvhd,在施用tcon的约180天内未发展gvhd,和/或在施用tcon的约一年内未发展gvhd。
73、在各种实施方案中,他克莫司移植物抗宿主病(gvhd)预防药剂(gvhdpa)可以静脉内施用或口服施用于患者。在各种实施方案中,他克莫司移植物抗宿主病(gvhd)预防药剂(gvhdpa)的施用在施用t-con之后约12至约24小时开始。在一些情况下,他克莫司ghvdpa被施用最长达约90天的时间段、被施用最长达约60天的时间段。在一些实施方案中,他克莫司ghvdpa最初以约0.03mg/kg患者的实际或理想体重/天施用于患者。在一些情况下,施用于患者的他克莫司gvhdpa的剂量在向患者施用第一剂量之后约90天开始逐渐减小,或者在向患者施用第一剂量之后约45天开始逐渐减小。
74、在一些实施方案中,该方法还包括在施用任何细胞群体之前,向患者施用清髓性调理方案,该调理方案包括向患者施用至少一种调理药剂。
75、在实施方案中,患者未接受作为清髓性调理方案的一部分的任何照射。
76、在各种实施方案中,在施用细胞群体中的任一种之前约两天至约十天施用至少一种调理药剂。在一些情况下,在施用细胞群体中的任一种之前约五天施用至少一种调理药剂。
77、在一些实施方案中,至少一种调理药剂包括噻替派。在一些情况下,施用于患者的噻替派的剂量在约5至约10mg/kg实际或理想体重的范围内。
78、在实施方案中,至少一种调理药剂包括白消安和氟达拉滨。在一些情况下,施用于患者的噻替派、白消安和氟达拉滨的剂量分别包括约10mg/kg患者的实际或理想体重、约9.6mg/kg患者的实际或理想体重和约150mg/m2体表面积。
79、在各种实施方案中,所述方法还包括提供使用说明书(ifu),所述ifu包括用于向患者施用细胞群体的说明。在一些情况下,ifu还包括用于向患者施用一种或多种药物剂或组合物的说明。
80、另一方面提供了一种将细胞群体移植到人类患者中作为血液恶性肿瘤的治疗方案的一部分的方法。该方法包括向患者施用造血干细胞和祖细胞(hspc)群体,所述hspc群体包含hspc和悬浮hspc的液体;向患者施用待施用于患者的调节性t细胞(treg)群体,所述treg群体包含treg和悬浮treg的液体;和向患者施用待施用于患者的异源细胞群体,所述异源细胞群体包含淋巴细胞、粒细胞、单核细胞和悬浮所述细胞的液体,其中至少约30%的所述淋巴细胞包含常规t细胞(tcon);以及在最长达约180天的时间段内向患者施用包含他克莫司的单一移植物抗宿主病(gvhd)预防药剂(gvhdpa)(他克莫司ghvdpa),其中施用他克莫司ghvdpa以在所述时间段期间将患者的血液中的他克莫司的浓度维持在高于阈值水平;并且其中与血液恶性肿瘤的治疗方案相关联的ghvd的风险和/或严重程度被显著降低。
81、另一方面提供了一种包含溶液的试剂盒,所述试剂盒包括:
82、包含第一cd45+细胞群体的第一容器,包含有包含第二cd45+细胞群体的溶液的第二容器,以及包含有包含富含调节性t细胞(treg)的细胞群体的溶液的第三容器。在该方面,包含第一cd45+细胞群体的溶液、包含第二cd45+细胞群体的溶液和包含富含treg的细胞群体的溶液如根据本文公开的任何多组分药物治疗或方法所定义。在一些实施方案中,试剂盒还包括包含gvhd预防药剂的第四容器。在一些情况下,还包括用于执行本文公开的任何方法的说明书。
83、另一方面提供了一种试剂盒,其包括:(a)一种或多种从动员的外周血组合物中分选cd34+细胞的试剂;(b)一种或多种从动员的外周血组合物中分选调节性t细胞(treg)的试剂;(c)一种或多种检测动员的外周血中cd3+常规t细胞的数量的试剂;和(d)包含一个或多个剂量的移植物抗宿主病(gvhd)预防药剂的溶液。在实施方案中,试剂盒还包括用于执行本文公开的任何方法的说明书。
84、一方面提供了一种将常规t细胞(tcon)群体移植到人类对象中而在移植后最长达约100天不引发2期或更高的移植物抗宿主病(gvhd)反应的方法。该方法包括(i)施用包含淋巴细胞、粒细胞和单核细胞的异源细胞群体,其中至少约30%的所述淋巴细胞包含常规t细胞(tcon);和(ii)施用调节性t细胞(treg)群体。在该方法中,异源细胞组分和/或treg群体包含少于约5eu/ml的内毒素。
85、另一方面提供了一种治疗人类对象的方法,所述方法包括施用多个细胞群体的步骤(a),其中所述多个细胞群体包括:(i)造血干细胞和祖细胞(hspc)群体;(ii)包含调节性t细胞(treg)的细胞群体;和(iii)常规t细胞(tcon)群体;和施用不超过一种移植物抗宿主病(gvhd)预防药剂持续少于约120天的步骤(b)。在该方法中,hspc群体包含少于约2%的cd3+细胞。
86、另外的方面提供了一种治疗有需要的人类对象的方法,所述方法包括向人类对象施用至少两种药物组合物,其中所述药物组合物选自(a)包含造血干细胞和祖细胞(hspc)群体的药物组合物;(b)包含调节性t细胞(treg)群体的药物组合物;和(c)包含常规t细胞(tcon)群体的药物组合物。在该方法中,药物组合物(a)、(b)和(c)各自包含少于约5eu/ml的内毒素;并且施用两种或更多种药物组合物的100名人类对象的组中少于15名人类对象在施用包含tcon群体的药物组合物之后约30天内发展2期或更高的移植物抗宿主病(gvhd)反应。
87、附加的方面提供了一种将常规t细胞(tcon)群体移植到人类对象中而在移植后最长达约100天不引发2期或更高的移植物抗宿主病(gvhd)反应的方法。该方法包括:(i)施用包含常规t细胞(tcon)群体的溶液;和(ii)施用包含调节性t细胞(treg)群体的溶液。在该方法中,tcon群体被冷冻保存至少约4小时;并且包含tcon群体的溶液和包含treg群体的溶液包含少于约5eu的内毒素/ml溶液。
88、一方面提供了一种在有需要的人类对象中治疗血液恶性肿瘤的方法,所述方法包括向人类对象施用:(a)造血干细胞和祖细胞(hspc)群体;(b)调节性t细胞(treg)群体;和(c)常规t细胞(tcon)群体。在该方法中,hspc群体和treg群体在tcon群体之前施用;并且与未施用三种细胞群体的健康人类对象相比,人类对象的外周血显示出升高的treg计数,直到施用三种细胞群体后约100天。
89、另外的方面提供了一种将常规t细胞(tcon)群体移植到人类对象中而在移植后最长达约100天不引发2期或更高的移植物抗宿主病(gvhd)反应的方法。该方法包括(i)施用常规t细胞(tcon)群体;和(ii)施用调节性t细胞(treg)群体。在该方法中,在施用treg群体后至少约12小时施用tcon群体;并且tcon群体和treg群体包含少于约5eu/ml的内毒素。
90、应当理解,本发明的不同方面和/或实施方案可以单独地、共同地或彼此组合使用。本文中关于特定组合物、多组分药物治疗、细胞群体、溶液、制剂、试剂盒和/或方法的任何描述适用于并且可以用于任何其他特定组合物、多组分药物治疗、细胞群体、溶液、制剂、试剂盒和/或方法。换句话说,本文描述的任何方面或实施方案可以与如本文公开的任何其他方面或实施方案组合。
91、援引并入
92、在本说明书中提及的所有出版物、专利和专利申请均通过引用并入本文,其程度如同每个单独的出版物、专利或专利申请被具体且单独地指明通过引用并入。
- 还没有人留言评论。精彩留言会获得点赞!